|
|
|
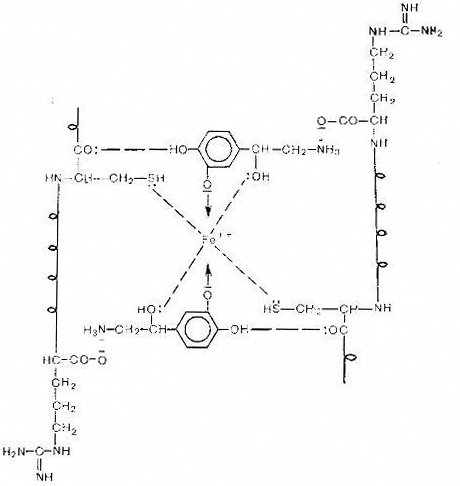
Рис.
6. Гипотетическая схема активного центра α1-адренорецептора
|
Катехоламины своей протежированной аминогруппой
электростатически взаимодействуют с карбоксилом аргинина, а за счет фенольного
и спиртового гидроксилов образуют хелатный комплекс с центральным ионом железа.
Активные центры α2-адренорецепторов
отличаются от таковых α1-адренорецепторов:
они лишены тиоловых участков, роль центрального иона может выполнить не только
Fе2+, но и Mn2+. Однако точные сведения о молекулярной структуре комплекса
катехоламипы-α-адренорецептор
можно получить, выделив рецепторы в чистом виде.
Такая попытка была сделана
R.M.Graham и соавт. (1982). Авторы для очистки предварительно солюбилизированного
дигитонином α-адренорецептора
мембран печени крыс с помощью аффинной хроматографии использовали
2-[4(-сукдионил) пиперазин-1-ил]-4-аминодиметоксиназолил, иммобилизованный
через амидную связь на агарозе [8]. Очищенный рецептор связывал
3Н-празозин и другие адренергические вещества с такими же стереоспецифичностью
и сродством, как и мембранно-связанные рецепторы. С помощью методов
гель-фильтрации и центрифугирования в градиенте плотности сахарозы было
выявлено, что рецептор-дигитониновый комплекс имеет радиус Стокса 4,9нм,
коэффициент седиментации 7,1S и молекулярную массу 147000. При электрофорезе
данного комплекса в полиакриламидном геле с додецилсульфатом натрия получена
одна белковая полоса с молекулярной массой 59000. Можно полагать, что белок с молекулярной
массой 59000 представляет собой субъединицу α-адрепореценторов мембран
гепатоцитов крыс, которая связывает катехоламипы, и что существование различных
типов α-адренорецепторов
обусловлено ассоциацией этих субъединиц.
.2.3 Функционирование α-адренорецепторов
Согласно общепринятым
представлениям, при связывании адреномиметика с α-адренорецептором
происходит конформационная перестройка последнего [10]. В результате
наступает изменение транспорта ионов через плазматическую мембрану клетки,
повышение содержания ионизированного кальция в цитоплазме - «мобилизация»
кальция и укорочение миофиламентов.
Известно, что содержание ионов
кальция во внутриклеточной среде чрезвычайно низко вследствие наличия мощных
связывающих систем, обладающих значительной предпочтительностью к двухвалентным
катионам по сравнению с одновалентными. Полагают, что в зависимости от органа и
вида животных повышение содержания кальция в цитоплазме под действием
адреномиметика осуществляется путем различных сочетаний четырех механизмов:
открытия потенциалзависимых кальциевых каналов после деполяризации клеточной
мембраны; открытия кальциевых каналов, связанных с адренорецепторами;
высвобождения кальция, связанного с поверхностью клеточной мембраны, и
высвобождения внутриклеточно резервированного кальция. Этим разнообразием
механизмов можно объяснить неодинаковое влияние блокаторов кальциевых каналов
на эффекты α-адреномиметиков
в опытах на различных сосудах, поскольку одна группа постсинаптических α-адренорецепторов,
вероятно, преимущественно регулирует поступление внеклеточного кальция, а
другая - процесс мобилизации внутриклеточного кальция.
Повышение содержания ионизированного
кальция в цитоплазме, независимо от того, каким оно обусловлено механизмом,
является главным (основным) внутриклеточным сигналом, вызванным агонистами при
действии на α-адренорецепторы.
Появлению этого сигнала может предшествовать повышение обмена мембранного
фосфатидилинозитола (активированная фосфолипаза С расщепляет фосфатидилинозитол
- кислый фосфолипид, выстилающий главным образом внутреннюю поверхность бислоя
плазматической мембраны), на 1,2-диацетилглицерол, а затем повышение
концентрации внутриклеточного циклического гуанозинмонофосфата. По всей
вероятности, кальций стимулирует высвобождение арахидоновой или другой
ненасыщенной жирной кислоты, что приводит к активации гуанилатциклазы и
образованию цГМФ.
Итак, по мнению большинства ученых,
основные этапы на пути между «распознаванием» адреномиметика и реакцией
клетки-мишени - это конформационное изменение α1-адренорецентора,
изменение проницаемости протоплазматической мембраны и повышение содержания
ионизированного кальция в цитоплазме. Согласно многочисленным экспериментальным
данным сужение сосудов, вызванное возбуждением постсинаптических α2-адренорецепторов,
также опосредуется притоком внеклеточных ионов кальция.
Рассмотрим процессы, протекающие в
пресинаптических α2-адрепорецепторах.
Их возбуждение вызывает угнетение высвобождения нейромедиатора. Согласно
имеющимся данным, здесь также ведущая роль принадлежит ионам кальция. Известно,
что электрическое раздражение симпатического нерва вызывает деполяризацию
нейропальной мембраны, вследствие чего раскрываются (активируются)
потенциал-зависимые кальциевые каналы, происходит приток ионов кальция в
цитоплазму, что в свою очередь приводит к высвобождению норадреналина. В
отличие от указанного эффекта электрического раздражения высвобождение
медиатора тирамином не зависит от наличия экстранейронального кальция и не
изменяется под влиянием активаторов и блокаторов α2-адренорецепторов.
Можно заключить, что пресипантические α2-адрепорецепторы принимают
участие в регуляции секреции медиатора на этапе, следующем за входом Са2+ [8].
Предположительно после проникновения
в клетку Са2+ связывается с внутриклеточным рецептором, например, кальмодулином
(повсеместно распространенный кальцийсвязывающий белок), который необходим для
стимуляции экзоцитоза. Известно, что в нейрональных клетках α2-агонисты
вызывают снижение уровня цАМФ и повышают уровень цГМФ, а дибутирил цГМФ
имитирует тормозящее действие оксиметазолина па высвобождение 3Н-норадреналина.
Следовательно, в качестве посредника влияния α-адренергической
стимуляции на кальцийсвязывающие внутриклеточные участки, ответственные за
секрецию нейромедиатора, может выступать цАМФ и/или цГМФ. Однако роль цАМФ и
цГМФ в этих процессах необходимо уточнить.
.3 β-адренорецепторы
.3.1 Подтипы β-адренорецепторов
Различают пресинаптические β-адренорецепторы
(участвующие в регуляции высвобождении нейроме-диатора) и два подтипа постсинаптических
β-адренорс-цепторов:
β1- и β2-. Е.J.
Ariens и А.М. Simonis считают более целесообразным характеризовать β-адренорецепторы
не искусственным разделением на β1- и β2-подгруппы,
а на основании их физиологических особенностей: β-адренорецепторы
для нсйромедиатора норадреналина, иначе их называют «иннервированными», или βт (Т - от
слона трансмиттер) рецепторами, и β-адренорецепторы для гормона
адреналина - «гормональные», βн (от слова hormone), или
«неиннервированные» рецепторы [10]. Нетрудно заметить, что термин βт совпадает
с термином β1, а βн- с β2. Β-адренорецепторы
обнаружены практически во всех тканях млекопитающих. С помощью радиолигандного
метода исследования установлено, что подтипы β-адренорецепторов
находятся не только в одном и том же органе, но и в клетках одного типа.
Считается, что β1-адренорецспторы
имеют примерно одинаковую чувствительность к адреналину и норадреналину; они
главным образом присутствуют в сердце, жировой ткани, сосудах и головном мозге.
В то же время β2-адрепорецепторы
имеют большее сродство к адреналину, чем к норадреналину; они обнаружены в
легких, печени, исчерченных мышцах и неисчерченных мышцах различных органов.
β-адренорецепторы тесно
сопряжены с ферментом аденилатцкклазой, катализирующей образование циклического
аденозин-3',6'-монофосфата. (цАМФ): их стимуляция приводит к повышению
активности аденилатциклазы и увеличению содержания цАМФ (который иногда
называют «вторым посредником, или «тканевым» передатчиком возбуждении) внутри
клетки.
Пресинаптические β-адренорецепторы
выявлены на окончаниях периферических и центральных норадренергических нервных
волокон. Возбуждение этих рецепторов приводит к увеличению количества
высвобождаемого медиатора по принципу положительной обратной связи. Вопрос о
том, к какому подтипу относятся пресинаптическне β-адренорецепторы,
окончательно еще не выяснен. По всей вероятности, они принадлежат к β2-подтипу,
поскольку: β1-активаторы
не влияют на высвобождение норадреналина в ответ на нервное раздражение; β2-активаторы
вызывают обратимое и доза-зависимое усиление высвобождения норадреналина, а β2-блокаторы
весьма эффективно конкурентно препятствуют активирующему влиянию изадрина на
высвобождение норадреналина
Постсинаптические β-адренорецепторы
делятся на два подтипа: β1- и β2-.
Постсинаптическне β1-адренорецепторы
обнаружены: в сердце (их активация приводит к учащению и усилению сокращении,
стимуляции гликогенолиза), в неиечерченных мышцах коронарных сосудов
(уменьшение тонуса) и кишечника (расслабление), в белой и бурой жировых тканях
(липолиз), и слюнных железах (повышение секреции слюны, содержащей амилазу).
Постсинаптические β2-адренорецепторы
расположены в сосудах (их активация приводит к расширению пространства артерий
и понижению системного артериального давления), в трахее и бронхах
(расширение), в исчерченных мышцах (усиление гликогенолиза), в матке и мочевом
пузыре (расслабление), в поджелудочной железе (увеличение высвобождения
инсулина).
4.3.2 Строение системы β-адренорецептор-аденилатциклаза
Путем применения различных методических
подходов установлено, что система β-адренорецептор -
аденилатциклаза (аденилатциклазный комплекс) состоит, по крайней мере, из трех
белковых компонентов: рецепторной части, которая расположена на внешней стороне
клеточной мембраны и обладает способностью «распознавать» агонистов и
антагонистов; термостабильного белка (он носит названия N-белок, G-белок и
G/F-белок), связывающего гуаниновый нуклеотид и выполняющего регуляторную роль
в сопряжении «агоннст-рецепторное взаимодействие - активация аденилатциклазы»,
и термолабильного каталитического белка - аденилатциклазы
Лигандсвязывающий фрагмент системы β-адренорецептор-аденилатциклаза
в отличие от аналогичного фрагмента α-адренорецептора не является
металлопротеидом, и тиоловые группы либо отсутствуют, либо не имеют значения в
рецепции. Было установлено, что лигандсвязывающий фрагмент β-адренорецепторов
представляет собой белок с молекулярной массой 60000-65 000 и что специфичность
β1- и β2-адренорецепторов,
по-видимому, обусловлена наличием остатков нескольких разных аминокислот в
области активного центра.
.3.3 Функционирование системы β-адренорецептор-аденилатциклаза
Взаимодействие лигандсвязывающего
фрагмента с регуляторным N-белком и каталитическим фрагментом аденилатциклазы
представляется в виде трех взаимосвязанных циклов. Первый - это β-адренорецепторный
(лигандсвязывающий) цикл. Здесь β-активатор (гормон, Г)
связывается с рецептором (Р) и образует комплекс Г-Р с низким сродством. Затем
этот двойной (бинарный) комплекс, уже во втором цикле соединяется с N-белком и
образует тройной комплекс Г-P-N. Образование комплекса Г-Р-N, очевидно,
стабилизирует связываниег с Р и, таким образом, повышает связывающее сродство
Р. Второй цикл заключается в связывании гуанозинтрифосфата (ГТФ) с одной из
субъединиц N-белка (имеющей молекулярную массу 45000) и высвобождении
гуанозиндифосфата (ГДФ). Практически функция β-адренорецептора
определяется тем, что он переводит комплекс N-ГТФ в комплекс N-ГДФ. Связывание
ГТФ с субъединицей N-белка приводит к конформациомному изменению N-белка и дает
начало двум событиям; во-первых, дестабилизирует тройной комплекс (Г-Р-М), в
результате чего рецептор переходит в состояние низкого сродства (т. е. ГТФ
вызывает понижение сродства Р к активатору), а во-вторых, дает начало третьему
циклу, а именно вновь образованный комплекс N-ГТФ соединяется с каталитическим
фрагментом (К) аденилатциклазы, при этом аденилатциклаза переходит в активную
форму. Последняя в цикле превращений вновь переходит в неактивную форму
благодаря присущему N-белкам свойству расщеплять ГТФ на ГДФ и РО43-, вследствие
чего происходит дестабилизация активированного N-K комплекса. Если активатор
(гормон) удалить или доставить блокатор, то циклы вышеотмеченпых событии не
возобновятся, так как нет стимула для образования решающего промежуточного
комплекса Г-P-N.
5. Методы получения субстанций
.1 Гуанабенз [11]
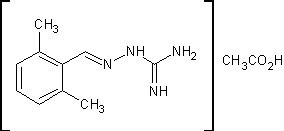
Ацетат
2,6-дихлорбензилиденаминогуанидина
адреномиметик синапс
медиатор препарат
C10H12Cl2N4O2 M.м. 291,13 Основание
С8Н8СlN4 М.м. 231,08
г дихлорбензальдегида , 78г
карбоната аминогуанидина, 50мл концентрированной соляной кислоты и 250мл
n-бутанола смешали и медленно нагрели до кипения (120ºС).
Выделяющуюся воду удаляют из реакционной массы с азеотропом на протяжении 4
часов. Затем реакционную смесь охлаждают, продукт выпадает в осадок.
Отфильтровывают, получают 105г гидрохлорида 2,6-дихлорбензилиденаминогуанидина
с температурой плавления 223-224ºС.

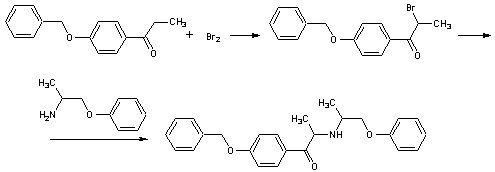
.2 Добутамин [12]
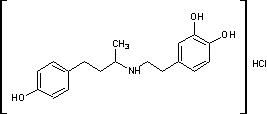
Гидрохлорид
N-[3-(пара-гидроксифенил)-1-метилпропил]-2-(3,4-дигидроксифенил)
этиламина.H24ClNO3 М. м. 337,85. Основание С18Н23NО3 М.м. 301,39
Стадия 1. Получение
3,4-дибензилокси-N-[3-(4-бензилокси-1-метил-n-пропил]-β-фенилэтиламина
гидрохлорида.
Суспензию
2-(3,4-дибензилоксифенил)этиламина (75г, 0,225моль) (VIIа),
4-(4-бензилоксифенил)-2-бутанона (68,65г, 0,27моль) (VIа), уксусной кислоты
(19,3мл) и 46% б/в раствора натрия триацетоксиборгидрида (247мл, 0,4моль) в ТГФ
(300мл) нагревают до 50-55ºС на протяжении 2 часов. Реакционную
массу охлаждают до 30-35 ºС и
прибавляют воду (225мл). рН доводят до 10-10,5 добавлением каустической соды
при температуре 10-15 ºС и продукт
экстрагируют изопропил ацетатом (225мл) при 30-35 ºС.
Органический слой концентрируют при 50-55 ºС при пониженном давлении и
затем упаривают в вакууме. Полученный продукт растворяют в метаноле (375мл),
охлаждают до 10-15
ºС
и смешивают с концентрированной соляной кислотой (12,5мл). Высаждают водой
(225мл), продукт отфильтровывают, промывают водой (150мл) и сушат при 50-55 ºС до
постоянного веса, равного 110г. Продукт растворяют в этилацетате (550мл) при
75-80 ºС, охлаждают
до 30-35 ºС. Выпавший
продукт отделяют на фильтре, промывают этилацетатом (220мл) и сушат до
постоянного веса. Получают 74г, чистота >97%
Стадия 2. Получение
4-[2-[[3-(4-гидроксифенил)-1-метилпропил] амино] этил]-1,2-бензендиола.
Суспензию
3,4-дибензилокси-N-[3-(4-бензилокси-1-метил-n-пропил]-β-фенилэтиламина
гидрохлорида (75г, 0,131моль), 5 Pd/C (7,5г) и соляной кислоты (7,5мл) в
метаноле (600мл) гидрируют при 45-50ºС и атмосферном давлении на
протяжении 3 часов. Катализатор отделяют на фильтре, фильтрат концентрируют при
50-55 ºС и
пониженном давлении. Добавляют 4N соляную кислоту (75мл) и отгоняют при 50-55 ºС, а затем
упаривают в вакууме до получения белого кристаллического продукта. К продукту
добавляют 4N соляную кислоту (2460мл), нагревают до 100-105 ºС до
получения прозрачного раствора, затем охлаждают до 30-35 ºС. Выпавший
продукт фильтруют, промывают 0,5N соляной кислотой (75мл) и сушат при 55-60 ºС до
постоянного веса, 36г, чистота 99,8%.
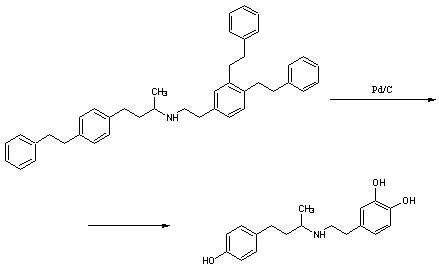
.3 Изоксуприн [13]
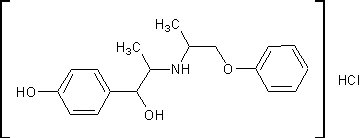
Гидрохлорид 1-(пара-гидроксифенил)-2-[
(1-метил-2-фен-оксиэтил)амино]-1-пропанолаH24ClNO3 M. м. 337,83 Основание
C18H23NO3 М. м. 301,37
К раствору 30,7г (0,203моль)
2-амино-1-феноксипропана в 150мл этанола приливают 31,9г (0,100моль)
1-(4-бензоксифенил)-2-бромо-пропанона-1, полученного бромированием
1-(4-бензоксифенил)-пропанона-1, смесь нагревают до кипения и кипятят с
обратным холодильником 3 часа. Этанол отгоняют в вакууме. Затем продукт
высаждают добавлением 150мл диэтилового эфира. Гидробромид 2-амино-1-феноксипропана
отфильтровывают и промывают диэтиловым эфиром. Обьединенные эфирные фильтраты
подкисляют 50мл 4N соляной кислотой и энергично взбалтывают. Выпавший
гидрохлорид 1-(4-бензоксифенил)-2-(1-метил-2-феноксиэтиламино)-пропанона-1
отфильтровывают, промывают водой, а затем диэтиловым эфиром. Сушат в вакууме.
Выход 37,7г, 89% от теоретически возможного, считая на
1-(4-бензоксифенил)-2-бромо-пропанон-1. Температура плавления 197-198ºС.
,89г соли, полученной на предыдущей
стадии, растворяют в 600мл 80% водного этанола. Добавляют палладиевый
катализатор и гидрируют водородом при комнатной температуре и давлении 1,1атм.
После поглощения 2моль водорода катализатор отфильтровывают, фильтрат упаривают
в вакууме до выпадения кристаллов. Кристаллы растворяют в как можно меньшем
количестве воды и охлаждают. Выпавшие кристаллы субстанции отфильтровывают,
промывают водой и сушат в вакууме. Получают 6,8г, 39% от т.в.
Перекристаллизованный из воды продукт имеет температуру плавления 203-204ºС.

.4 Ипрадол [14]
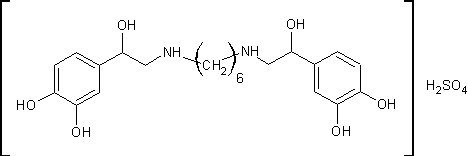
Сульфат
N,N’-биc[2-(3,4-дигидpoкcифeннл)-2-гидpoкcиэтил]гексаметилендиамина
H34N2O10S М.м. 518,58. Основание
C22H32N2O6 M. м. 420,51
г
N,N’-дибензил-N,N’-бис-2-(3,4-дигидроксифенил)-2-оксоэтил-тетраметилендиамина
дихлоргидрата (полученный взаимодействием ω-хлор-3,4-дигидроксиацетофенона
с N,N’-дибензилгексаметилендиамином) в 270мл метанола и 50мл воды гидрируют на
2г 10% палладиевого катализатора при 45ºС водородом при атмосферном
давлении. Исходное вещество полностью растворяется только в процессе
гидрирования. Теоретически рассчитанное количество водорода поглощается за 4
часа (4моля водорода на 1 моль исходного вещества) и процесс гидрирования
прекращают. Катализатор отфильтровывают, фильтрат выпаривают в вакууме и сухой
остаток кристаллизуют из абсолютного эфира. Получают 3,3г N,N’-
бис-2-(3,4-дигидроксифенил)-2-гидроксиэтил-тетраметилендиамина дихлоргидрата
(92% от теоретического значения). После его перекристаллизации из смеси
метанола с эфиром получили 2,8г продукта с температурой плавления 197,5-198ºС.

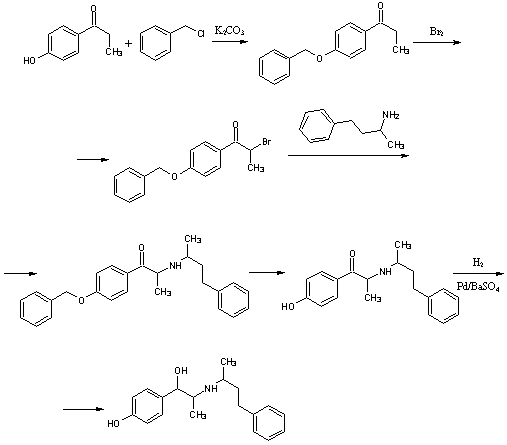
.5 Нилидрин [15]

Гидрохлорид
1-(пара-1-гидроксифенил)-2-(1-метил-3-фенилпропиламино)-1-пропанола
H26ClNO2 M. м. 335,85 Основание
C19H25NO2- M. м. 299,40
г 1-(р-гидроксифенил)-2-(α-метил-γ-фенил-пропиламино)-пропанона-1
гидробромида с температурой плавления 141ºС (получен из
4-гидроксипропиофенона и бензилхлорида, с последующим бромированием, сочетанием
с 1-метил-3-фенилпропиламином и снятием защитной группы) встряхивают в 150мл
метанола с 1,5г 10% палладиевого катализатора (носитель-сульфат бария) и
гидрируют. Гидрирование прекращают после поглощения 1моль водорода. Реакционную
массу фильтруют от катализатора и концентрируют, гидробромид
1-(р-гидроксифенил)-2-(α-метил-γ-фенил-пропиламино)-пропанола-1
высаждают добавлением диэтилового эфира. После перекристаллизации из спирта
получают продукт с температурой плавления 214-215ºС.
.6 Оксиметазолин [16]
Гидрохлорид 2-
(3-гидрокси-2,6-диметил-4-трет-бутилбензил)имидазолина
 H25C1N2О M. м. 296,83. Основание
C16H24N2О М.м. 260,37
H25C1N2О M. м. 296,83. Основание
C16H24N2О М.м. 260,37
г
2,6-диметил-3-гидрокси-6-трет-бутилбензилцианида (полученного
хлорметилированием 2,4-диметил-6-трет-бутилфенола и взаимодействием полученного
производного бензилхлорида с цианистым натрием), 9г 95% этилендиамина и 0,7мл
сероуглерода нагревали до 100 ºС на протяжении 48 часов, до
прекращения выделения аммиака. После охлаждения выпавщие кристаллы
отфильтровывают, растворяют в горячем бензоле и оставляют кристаллизоваться.
Получают 26г (76% от т.в.) продукта с температурой плавления 181-183 ºС
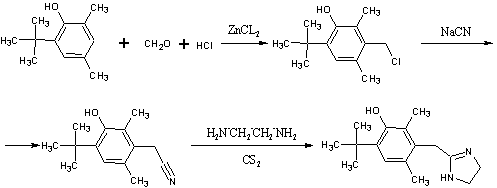
.7 Толонидин [17]
Нитрат
2-(4-метил-2-хлорфенил)аминоимидазолина
H13C1N4О3 М.м. 272,68 Основание
C10H12C1N3, M. м. 209,67
г N-(2-хлор-р-толуил)-тиомочевины
(температура плавления 124ºС) (полученной из 2-хлор-р-толуидина
и тиоцианата аммония) нагревают с 20мл метилйодида в 200мл метанола на
протяжении 2х часов с обратным холодильником. Затем растворитель отгоняют под
вакуумом, и выпавший гидройодид изотиомочевины (73,2г) нагревают с 20,4мл
этилендиамина при перемешивании на протяжении получаса при 150-160ºС до
прекращения выделения меркаптана.
Реакционную смесь смешивают с
горячей разбавленной уксусной кислотой и затем подщелачивают 2N раствором
каустической соды. Выпавший осадок свободного основания отделяют на фильтре,
промывают водой и сушат. Получают 10,2г продукта с температурой плавления 142-145ºС. Нитрат
2-N-(4-метил-2-хлорфенил)-аминоимидазолина плавится при 162-164ºС и
растворим в воде и метаноле.

.8 Трамазолин [18]

Гидрохлорид
2-N-(5,6,7,8-тетрагидро-1-нафтил)аминоимидазолина
H18ClN3 М.м. 251,75. Основание
C13H17N3 M. м. 215,30
,2г (0,1моль) гидрохлорида
N-(5,6,7,8-тетрагидронафтил-1)-S-метил-изотиомочевины (температура плавления
177ºС)
(полученного взаимодействием 5-аминотетралина с роданидом аммония с последующим
метилированием йодистым метилом) медленно нагревают под вакуумом с 6г (0,1моль)
безводного этилендиамина. Когда прекратиться выделение метилмеркаптана и
аммиака осадок гидройодида 2-N-(5,6,7,8-тетрагидронафтил-1)-аминоимидазолина
отделяют на фильтре. Свободное основание получают действием гидроксида натрия,
продукт фильтруют, промывают водой и перекристаллизовывают из изопропанола.
Температура плавления 142ºС.
Гидройодид продукта также можно
получить кипячением соли изотиомочевины с этилендиамином в растворе метанола на
протяжении не менее 20 часов.
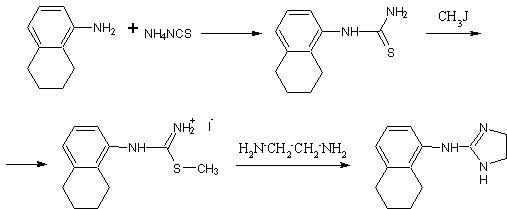
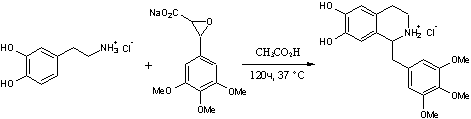
.9 Триметохинол [19]
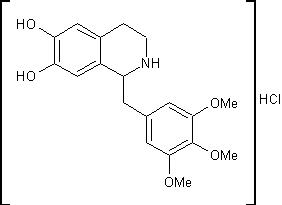
Гидрохлорид
1-(3,4,5-триметоксибензил)-6,7-дигидрокси-1,2,3,4-тетрагидроизохинолинаH24ClNO5
M. m. 381,84 Основание C19H23NO5; М. м. 345,38
.7г
3-(3,4,5-триметоксифенил)-глицидата натрия и 2,8г 3,4-дигидроксифенетиламина
гидрохлорида растворяют в 250мл воды. Добавляют 7мл 10% соляной кислоты и 7мл
уксусной кислоты и оставляют на 120 часов при 37ºС. После
фильтрации реакционной массы ее осветляют активированным углем и упаривают
воду. Выпавшие кристаллы отделяют на фильтре и дважды перекристаллизовывают из
этанола. Получают 0,25г 1-(3,4,5-триметоксибензил)-6,7-дигидрокси-1,2,3,4-тетрагидро-изохинолина
гидрохлорида (триметохинола) с температурой плавления 224,5-226 ºС.
6. Анализ препаратов
.1 Изопреналин [20]
Молекулярная формула. C11H17NO3·HCl.
Относительная молекулярная масса. 247,7. Структурная формула.

Химическое наименование. 4-[ 1
-окси-2-[ (1 -метил-этил) амино] этил]-1,2-беизолдиола гидрохлорид; per. №
CAS51-30-9.
Описание. Белый или почти белый
кристаллический порошок; без запаха.
Растворимость. Легко растворим в
воде; умеренно растворим в этаноле (~750 г/л) ИР; практически нерастворим в
хлороформе Р и эфире Р.
Категория. Бронходилататор.
Хранение. Изопреналина гидрохлорид
следует хранить в плотно укупоренной таре, предохраняющей от действия света.
Дополнительная информация.
Изопреналина гидрохлорид постепенно темнеет на воздухе и свету. Даже в
отсутствие света Изопреналина гидрохлорид постепенно разрушается во влажной
атмосфере, причем разрушение ускоряется при повышении температуры.
ТРЕБОВАНИЯ
Общее требование. Изопреиалина
гидрохлорид содержит не менее 97,5 и не более 101,0% C11H17NO3·HCl в пересчете
на высушенное вещество.
Подлинность. Спектр поглощения
раствора препарата с концентрацией 0,050 мг/мл в области от 240 до 350 нм имеет
максимум при 280 нм; поглощение этого раствора в кювете с толщиной слоя 1 см
при этой длине волны 0,50.
Б. Прибавляют по 1мл раствора
препарата с концентрацией 1,0 мг/мл в каждую из двух колб, одна из которых
содержит 10мл фталатного буферного раствора, рН 3,4, ИР, а другая - 10мл
фосфатного буферного раствора, рН 6,4, ИР; можно применять другие буферные
раствори с теми же значениями рН. Прибавляют по 1мл раствора йода (0,1
моль/л)ТР и оставляют стоять на 5 мин; затем прибавляют по 2мл раствора тиосульфата
натрия (0,1 моль/л) ТР. В растворе с рН 3,4 появляется интенсивное красное
окрашивание; в растворе с рН 6,4 появляется интенсивное красно-фиолетовое
окрашивание (отличие от левартеренола).. Раствор препарата с концентрацией
0,05г/мл дает характерную реакцию Б на хлориды, описанную в разделе «Общие
испытания на подлинность» (т. 1, с. 129).
Г. Температура плавления около 169ºС; при
плавлении вещество разлагается.
Прозрачность и окраска раствора.
Раствор 0,50г препарата в 10мл воды, свободной от углекислоты, Р прозрачный и
бесцветный.
Сульфатная зола. Не более 2,0мг/г.
Потеря при высушивании. Высушивают
при комнатной температуре и пониженном давлении (не превышающем 0,6кПа, или
около 5мм рт. ст.) над пятиокисью фосфора Р в течение 4ч; потеря составляет не более
10мг/г.
рН раствора. рН раствора препарата с
концентрацией 10 мг/мл 4,5-6,0.
Изопреналон. Поглощение раствора
препарата в серной кислоте (0,005 моль/л)ТР с концентрацией 1,0 мг/мл в кювете
с толщиной слоя 1 см при 310 нм не более 0,2 (для измерения предпочтительно
использовать кювету с толщиной слоя 2 см и сделать пересчет на поглощение в
кювете с толщиной слоя 1 см).
Количественное определение.
Растворяют около 0,5г препарата (точная навеска) в 30мл ледяной уксусной
кислоты Р1 с помощью минимального нагревания, прибавляют 10мл раствора ацетата
ртути в уксусной кислоте ИР и титруют хлорной кислотой (0,1моль/л)ТР, как
описано в разделе «Нсводное титрование», метод А (т. 1, с. 149). Каждый
миллилитр хлорной кислоты (0,1моль/л) ТР соответствует 24,77 мг C11H17NO3·HCl.
.2 Мезатон [21]Hydrochloridum
-(м-оксифенил)-2-метиламиноэтанола
гидрохлорид
Молекулярная масса 203,67.
Брутто-формула C9H13NO2 HCI. Структурная формула:

Описание. Белый или белый со слегка
желтоватым оттенком кристаллический порошок без запаха.
Растворимость. Легко растворим в
воде, 95% спирте и разведенных растворах щелочей и кислот, практически
нерастворим в эфире.
Подлинность. 0,01г препарата
растворяют в 1мл воды и прибавляют 2 капли раствора хлорида окисного железа;
появляется фиолетовое окрашивание.
,01г препарата растворяют в 1мл
воды, прибавляют 1 каплю раствора сульфата меди и 1мл раствора едкого натра;
появляется сине-фиолетовое окрашивание. Прибавляют 1мл эфира и встряхивают;
эфирный слой остается неокрашенным (отличие от эфедрина).
Препарат дает характерную реакцию на
хлориды (стр. 747).
Температура плавления 141-145°.
Прозрачность и цветность раствора.
Раствор 0,1г препарата в 10мл воды должен быть прозрачным и бесцветным.
Кислотность или щелочность. 0,1г
препарата растворяют в 5мл свежепрокипяченной и охлажденной воды и прибавляют 1
каплю раствора метилового красного. Окраска раствора должна измениться от прибавления
не более 0,1мл 0,05 н. раствора едкого натра или соляной кислоты.
Сульфаты. 0,65г препарата растворяют
в 10мл воды. Полученный раствор должен выдерживать испытание на сульфаты (не
более 0,015% в препарате).
Соли аммония. 0,2г препарата
помещают в пробирку, прибавляют 2мл воды, 1мл раствора едкого натра и кипятят.
Не должен выделяться аммиак, который обнаруживают по запаху или по посинению
влажной красной лакмусовой бумаги.
Потеря в весе при высушивании. Около
0,5г препарата (точная навеска) сушат при 100-105° до постоянного веса. Потеря
в весе не должна превышать 0,5%.
Сульфатная зола и тяжелые металлы.
Сульфатная зола из 0,5г препарата не должна превышать 0,1% и должна выдерживать
испытание на тяжелые металлы (не более 0,001% в препарате).
Мышьяк. 0,5г препарата должны
выдерживать испытание па мышьяк (не более 0,0001% в препарате).
Количественное определение. Около
0,1г препарата (точная навеска) помещают в склянку для бромирования и
растворяют в 20мл воды. Прибавляют 50мл 0,1н. раствора бромата калия, 0,7г
бромида калия и 5мл концентрированной соляной кислоты. Хорошо перемешивают и
выдерживают в течение 1 часа в темном месте при температуре около 20°. Затем
добавляют 10мл 20% раствора йодида калия, хорошо перемешивают и выделившийся
йод титруют ОД н. раствором тиосульфата натрия (индикатор - крахмал).
Параллельно проводят контрольный
опыт.
мл 0,1н. раствора бромата калия
соответствует 0,003395г C9H13NO2 HCI, которого в препарате должно быть не менее
98,5%.
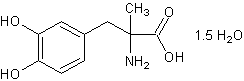
.3 Метилдопа [20]
Молекулярная формула. C10H13NO4
1,5Н2О. Относительная молекулярная масса. 238,2. Структурная формула.
Химическое наименование.
l-3-(3,4-диоксифенил)-2-метилаланин сесквигидрат; per. № CAS 41372-08-1.
Описание. Белый или желтовато-белый
мелкий порошок или кусочки; без запаха.
Растворимость. Мало растворима в
воде и этаноле (~750 г/л) ИР; практически нерастворима в эфире Р и хлороформе
Р.
Категория. Гипотензивное средство.
Хранение. Метилдопу следует хранить
в хорошо укупоренной таре, предохраняющей от действия света.
ТРЕБОВАНИЯ
Общее требование. Метилдопа содержит
не менее 98,0 и не более 101,0% C10H13NO4 в пересчете на безводное вещество.
Подлинность
Можно применять либо только
испытание А, либо испытания Б и В.
А. Проводят определение, как описано
в разделе «Спектрофото-метрия в инфракрасной области спектра» (т. 1, с. 45).
Инфракрасный спектр соответствует спектру, полученному со стандартным образцом
метилдопы СО, или спектру сравнения метилдопы.
Б. Проводят испытание, как описано в
разделе «Тонкослойная хроматография» (т. I, с. 92), используя в качестве
адсорбента целлюлозу Р2, а в качестве подвижной фазы смесь 50 объемов
1-бутаиола Р, 25 объемов ледяной уксусной кислоты Р и 25 объемов воды. Наносят
отдельно на пластинку по 5мкл каждого из двух растворов в соляной кислоте
(1моль/л)ТР, содержащих: (А) 10мг испытуемого вещества в 1мл и (Б) 10 мг
стандартного образца метилдопы СО в 1мл. Вынимают пластинку из
хроматографической камеры, высушивают ее в потоке теплого воздуха, опрыскивают
свежеприготовленным раствором, состоящим из 2 объемов раствора хлорида железа
(III) (25г/л)ИР и 1 объема раствора феррицианида калия (50г/л) ИР и оценивают
хроматограмму в дневном свете. Основное пятно, полученное с раствором А,
соответствует по положению, внешнему виду и интенсивности пятну, полученному с
раствором Б.
В. К 45 мг препарата прибавляют 1мл
воды, 1мл пиридина Р и 5мг 4-нитробензоилхлорида Р и нагревают до кипения. При
встряхивании прибавляют 0,1мл раствора карбоната натрия (200г/л)ИР; появляется
оранжевое или янтарное окрашивание.
Удельное оптическое вращение.
Используют раствор препарата в растворе хлорида алюминия ИР с концентрацией
44мг/мл и пересчитывают результат на безводное вещество; [α]D20 = -25
до -28°.
Тяжелые металлы. Используют 1,0г
препарата для приготовления испытуемого раствора, как описано в разделе
«Испытание на тяжелые металлы», методика 3 (т. 1, с. 136); определяют
содержание тяжелых металлов методом А (т. 1, с. 137); не более 10мкг/г.
Сульфатная зола. Не более 1,0 мг/г.
Вода. Определяют, как описано в
разделе «Определение воды методом Карла Фишера», метод А (т. 1, с. 154),
используя около 0,2г вещества; содержание воды не менее 100 и не более 130мг/г.
Кислотность. Растворяют 1,0г
препарата в 100мл воды, свободной от углекислоты, Р при нагревании и титруют
раствором гидроокиси натрия (0,1моль/л) ТР, используя в качестве индикатора
раствор метилового красного в этаноле ИР; для достижения средней точки перехода
окраски индикатора (оранжевая) требуется не более 0,5мл.
-О-Метилпроизводное. Проводят
испытание, как описано в разделе «Тонкослойная хроматография» (т 1, с. 92),
используя в качестве адсорбента целлюлозу Р2, а в качестве подвижной фазы смесь
65 объемов 1-бутанола Р, 15 объемов ледяной уксусной кислоты Р и 25 объемов
воды. Наносят отдельно на пластинку 10мкл раствора испытуемого вещества в смеси
4 объемов соляной кислоты (250г/л) ИР и 96 объемов метанола Р с концентрацией
10 мг/мл (раствор А), 10 мкл раствора стандартного образца
(-)-3-(4-окси-З-метоксифенил)-2-метилаланина СО с концентрацией 50мкг/мл
(раствор Б) и 20мкл смеси равных объемов растворов А и Б (раствор В). Вынимают
пластинку из хроматографической камеры, высушивают ее в токе теплого воздуха и
опрыскивают смесью 5 объемов раствора нитрата натрия Р с концентрацией 0,05г/мл
и 45 объемов раствора 4-нитроанилина Р с концентрацией 3 мг/мл, растворенного в
смеси 80 объемов соляной кислоты ( - 420г/л)ИР и 20 объемов воды. Высушивают в
токе теплого воздуха, опрыскивают раствором карбоната натрия (75г/л)ИР и
оценивают хроматограмму в дневном свете. Пятно, полученное с раствором Б,
должно быть более интенсивным, чем любое пятно, соответствующее по положению и
внешнему виду, полученное с раствором А. Испытание считают правильным только в
том случае, если на хроматограмме, полученной с раствором В, видны два четко
разделившихся пятна.
Количественное определение.
Растворяют около 0,20г препарата (точная навеска) в 20мл ледяной уксусной
кислоты P1, прибавляют 20мл диоксана Р и титруют хлорной кислотой (0,1моль/л)
ТР, как описано в разделе «Неводное титрование» метод А (т. 1, с. 149). Каждый
миллилитр хлорной кислоты (0,1моль/л) ТР соответствует 21,12мг C10H13NO4
6.4 Нафтизин [21]
Nitras
2-(α-нафтилметил)-имидазолина
нитрат
Молекулярная формула. C14H14O2·HNO3.
Относительная молекулярная масса. 273,29. Структурная формула.

Описание. Белый или белый с
желтоватым оттенком кристаллический порошок, без запаха.
Растворимость. Трудно растворим в
воде, растворим в 95% спирте, очень мало растворим в хлороформе, практически
нерастворим в эфире.
Подлинность. 0,1г препарата
растворяют в 10мл воды, помещают r делительную воронку, прибавляют 2мл раствора
едкого натра и извлекают основание нафтизина эфиром (2 раза по 5мл). Эфирные
извлечения промывают водой (2 раза по 5мл), сушат безводным сульфатом натрия в
течение 10-15 минут и фильтруют в выпарительную чашку, эфир отгоняют на водяной
бане досуха и остаток сушат при 80°. Температура плавления остатка 118-120,5°.
Препарат дает характерную реакцию А
на нитраты (стр. 745).
Температура плавления 167-170°.
Прозрачность и цветность раствора.
1% раствор должен быть прозрачным и бесцветным.
Кислотность или щелочность. 0,2г
препарата растворяют в 20мл свежепрокипяченной и охлажденной воды, прибавляют 2
капли раствора метилового красного. Окраска раствора должна измениться от
прибавления не более 0,1мл 0,05 н. раствора едкого натра или 0,05 н. раствора
соляной кислоты.
Хлориды. 1г препарата взбалтывают с
10мл воды в течение 2-3 минут и фильтрует. 1мл фильтрата, разведенный водой до 10
мл, должен выдерживать испытание на хлориды (не более 0,02% в препарате).
Сульфаты. 5мл того же фильтрата,
разведенные водой до 10 мл, должны выдерживать испытание на сульфаты (не более
0,02% в препарате).
Потеря в весе при высушивании. Около
0,5г препарата (точная навеска) сушат при 100-105° до постоянного веса. Потеря
в весе не должна превышать 0,5%.
Сульфатная зола и тяжелые металлы.
Сульфатная зола из 0,5г препарата не должна превышать 0,1% и должна выдерживать
испытание на тяжелые металлы (не более 0,001 % в препарате).
Количественное определение. Около
0,4г препарата (точная навеска) растворяют в 50мл безводной уксусной кислоты и
титруют 0,1 н. раствором хлорной кислоты до сине-зеленой окраски с выдержкой в
конце титрования 30 секунд (индикатор - кристаллический фиолетовый).
Параллельно проводят контрольный
опыт.
мл 0,1 н. раствора хлорной кислоты
соответствует 0,02733г C14H14O2·HNO3, которого в препарате должно быть не менее
98,5%.
Хранение. Список Б. В плотно
укупоренных банках оранжевого стекла.
.5 Салбутамол [22]
Молекулярная формула. C13H21NO3.
Относительная молекулярная масса. 239,3. Структурная формула
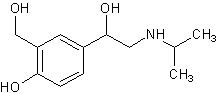
Химическое наименование, α'-[(трет-бутиламино)метил]-4-гидрокси-м-ксилен-αα'-диол; per.
№ CAS 18559-94-9.
Описание. Белый или почти белый
кристаллический порошок без запаха.
Растворимость. Растворим в 70 частях
воды; растворим в этаноле (-750г/л) ИР; мало растворим в эфире Р.
Категория. Противоастматическое
средство.
Хранение. Салбутамол следует хранить
в хорошо укупоренной таре, предохраняющей от действия света.
ТРЕБОВАНИЯ
Общее требование. Салбутамол
содержит не менее 98,0 и не более 101,0% C13H21NO3 в пересчете на высушенное
вещество.
Подлинность
Можно применять либо только
испытание А, либо испытания Б, В и Г.
А. Проводят испытание, как описано в
разделе «Спектрофото-метрия в инфракрасной области спектра» (т. 1, с. 45).
Инфракрасный спектр соответствует спектру, полученному со стандартным образцом
салбутамола СО, или спектру сравнения салбутамола.
Б. Спектр поглощения раствора
испытуемого вещества в соляной кислоте (0,1моль/л) ТР с концентрацией
0,080мг/мл при наблюдении между 230 и 350нм дает максимум только при длине
волны около 276нм; поглощение в кювете с толщиной слоя 1см при этой длине волны
около 0,56.
В. Растворяют 0,05г испытуемого
вещества в 5мл воды и добавляют 0,1мл раствора хлорида железа (III) (25г/л) ИР;
появляется красновато-фиолетовое окрашивание. Добавляют 0,05г гидроксида натрия
Р; образуется рыхлый осадок и выделяется газ. Добавляют несколько капель серной
кислотой (-1760г/л) ИР; раствор становится бесцветным.
Г. Температура плавления около 155°С
(плавится с разложением).
Сульфатная зола. Не более 1,0 мг/г.
Потеря при высушивании. Высушивают
до постоянной массы при 50°С и пониженном давлении (не выше 0,6 кПа или около
5мм рт. ст.); потеря не более 5,0мг/г.
Посторонние примеси. Проводят
испытание, как описано в разделе «Тонкослойная хроматография» (т. 1, с. 92),
используя в качестве сорбента силикагель Р1, а в качестве подвижной фазы -
смесь 4 объемов аммиака ( -260г/л) ИР, 16 объемов воды, 30 объемов 2-пропанола
Р и 50 объемов этилаиетата Р. Наносят на пластинку отдельно по 5 мкл каждого из
2 растворов в метаноле Р, содержащих (А) 20мг испытуемого вещества в 1мл и (Б)
0,10мг испытуемого вещества в 1мл. После извлечения пластинки из
хроматографической камеры дает ей высохнуть на воздухе до испарения
растворителей. Помещают пластинку на несколько минут в среду, насыщенную
диэтил-амином Р, опрыскивают ее диазотированной сульфаниловон кислотой ИР и
оценивают хроматограмму при дневном свете. «Любое пятно, которое даст раствор
А, кроме основного пятна, не должно быть более интенсивным, чем пятно, которое
дает раствор Б.
Количественное определение.
Растворяют около 0,4г испытуемого вещества (точная навеска) в 30мл ледяной
уксусной кислоты Р1 и титруют хлорной кислотой (0,1моль/л) ТР по методу А,
описанному в разделе «Неводное титрование» (т. 1, с. 151). Каждый миллилитр
хлорной кислоты (0,1моль/л) ТР соответствует 23,93мг C13H21NO3.
7. Сводная таблица препаратов
|
Структурная
формула
|
Синонимы
|
Систематическое
название
|
Методы
синтеза
|
Анализ
|
|
1.
|
 Адреналин,
эпинефрин, vasotonin(-)-(3,4-дигидрокси-фенил)-2-метиламиноэтанол[23][21] [20] Адреналин,
эпинефрин, vasotonin(-)-(3,4-дигидрокси-фенил)-2-метиламиноэтанол[23][21] [20]
|
|
|
|
|
|
2.
|
 Норадреналин,
норэпинефрин, arterenol, sympatin E(-)-(3,4-дигидрокси-фенил)-2-аминоэтанол[23][20] Норадреналин,
норэпинефрин, arterenol, sympatin E(-)-(3,4-дигидрокси-фенил)-2-аминоэтанол[23][20]
|
|
|
|
|
|
3.
|
 Гуанабенз,
Wy-86782,6-дихлорбензилиденаминогуанидин[23], [11] Гуанабенз,
Wy-86782,6-дихлорбензилиденаминогуанидин[23], [11]
|
|
|
|
|
|
4.
|
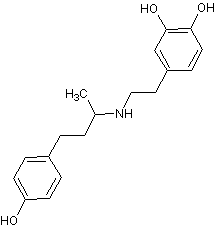 Добутамин,
dobutrex,
inotrexN-[3-(пара-гидроксифенил)-1-метилпропил]-2-(3,4-дигидрокси-фенил)-этиламин[23], [12] Добутамин,
dobutrex,
inotrexN-[3-(пара-гидроксифенил)-1-метилпропил]-2-(3,4-дигидрокси-фенил)-этиламин[23], [12]
|
|
|
|
|
|
5.
|
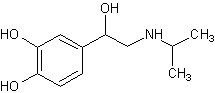 Изопреналин,
4-[1-окси-2-[(1-метилэтил) амино]этил]-1,2-беизолдиола[23][20] Изопреналин,
4-[1-окси-2-[(1-метилэтил) амино]этил]-1,2-беизолдиола[23][20]
|
|
|
|
|
6.  Изоксуприн,
cardilan, duvodilan, efanol, vasodilene1-(пара-гидроксифенил)-2-[
(1-метил-2-фен-оксиэтил)-амино]-1-пропанол
Изоксуприн,
cardilan, duvodilan, efanol, vasodilene1-(пара-гидроксифенил)-2-[
(1-метил-2-фен-оксиэтил)-амино]-1-пропанол
|
[23], [13]
|
|
|
|
|
|
|
7.
|
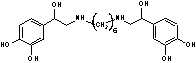 Ипрадол,
broncholysin,
hexoprenalineN,N’-биc[2-(3,4-дигидpoкcи-фeннл)-2-гидpoкcиэтил]-гексаметилен-диамин[23], [14] Ипрадол,
broncholysin,
hexoprenalineN,N’-биc[2-(3,4-дигидpoкcи-фeннл)-2-гидpoкcиэтил]-гексаметилен-диамин[23], [14]
|
|
|
|
|
|
8.
|
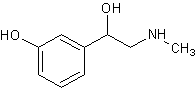 Мезатон,
фенилэфрин, metaoxedrin, visadon1-(м-оксифенил)-2-метиламино-этанол [23][21] Мезатон,
фенилэфрин, metaoxedrin, visadon1-(м-оксифенил)-2-метиламино-этанол [23][21]
|
|
|
|
|
|
9.
|
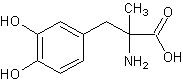 Метилдопаl-3-(3,4-диоксифенил)-2-метилаланин[23][20] Метилдопаl-3-(3,4-диоксифенил)-2-метилаланин[23][20]
|
|
|
|
|
|
10.
|
 Нафтизин,
санорин, naphazolin, privin2-(α-нафтилметил)-имидазолин[23][21] Нафтизин,
санорин, naphazolin, privin2-(α-нафтилметил)-имидазолин[23][21]
|
|
|
|
|
|
11.
|
 Нилидрин,
arlidin,
buphedrin1-(пара-1-гидроксифенил)-2-(1-метил-3-фенилпропил-амино)-1-пропанол[23], [15] Нилидрин,
arlidin,
buphedrin1-(пара-1-гидроксифенил)-2-(1-метил-3-фенилпропил-амино)-1-пропанол[23], [15]
|
|
|
|
|
|
12.
|
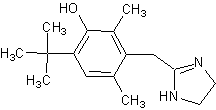 Оксиметазолин,
afrin, nasivin, sinerol2-
(3-гидрокси-2,6-диметил-4-трет-бутилбензил)-имидазолин[23], [16] Оксиметазолин,
afrin, nasivin, sinerol2-
(3-гидрокси-2,6-диметил-4-трет-бутилбензил)-имидазолин[23], [16]
|
|
|
|
|
|
13.
|
 Салбутамол,
albuterol, ventonin1-(4-гидрокси-3-гидрокси-метилфенил)-2-трет-бутиламино-этанол[23][22] Салбутамол,
albuterol, ventonin1-(4-гидрокси-3-гидрокси-метилфенил)-2-трет-бутиламино-этанол[23][22]
|
|
|
|
|
|
14.
|
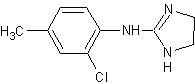 Толонидин,
St3752-(4-метил-2-хлорфенил)-аминоимидазолин[23], [17] Толонидин,
St3752-(4-метил-2-хлорфенил)-аминоимидазолин[23], [17]
|
|
|
|
|
|
15.
|
 Трамазолин,
rhinaspray, rhinol2-N-(5,6,7,8-тетрагидро-1-нафтил)аминоимидазолин[23], [18] Трамазолин,
rhinaspray, rhinol2-N-(5,6,7,8-тетрагидро-1-нафтил)аминоимидазолин[23], [18]
|
|
|
|
|
|
16.
|
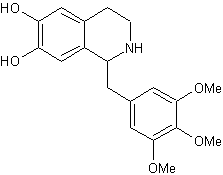 Тримето-хинол,
inolin1-(3,4,5-триметоксибензил)-6,7-дигидрокси-1,2,3,4-тетрагидроизохинолина[23], [19] Тримето-хинол,
inolin1-(3,4,5-триметоксибензил)-6,7-дигидрокси-1,2,3,4-тетрагидроизохинолина[23], [19]
|
|
|
|
|
Литература
Е.П.
Свищенко / Гипертоническая болезнь: реальность проблемы и перспективы ее
решения в XXI столетии // «Здоров’я України». - -2007.
<http://www.provisor.com.ua/archive.php?year=2000>№12/1
<http://www.provisor.com.ua/release.php?code=200023> - с.39-40.
И.
Луничкина / Внезапная смерть от бронхиальной астмы // «Медицинская газета». - -2007.
<http://www.provisor.com.ua/archive.php?year=2000>№41
<http://www.provisor.com.ua/release.php?code=200023> - с.7-8.
Корецкая
Ю.М., Мошетова Л.К. / Глаукома миопического глаза // «Русский медицинский
журнал». - -2003. <http://www.provisor.com.ua/archive.php?year=2000>№4/2
<http://www.provisor.com.ua/release.php?code=200023> - с.15-18.
И.
Чекман / Грипп и другие острые респираторные вирусные инфекции: лечение
комбинированными препаратами // «Аптека». - -2002.
<http://www.provisor.com.ua/archive.php?year=2000>№4 <http://www.provisor.com.ua/release.php?code=200023>
- с.28-29.
Р.П.Фенькина,
В.П.Дегтярев, В.А.Коротич / Учебное пособие по нормальной физиологии // <http://mmf.spb.ru/07_articles/Phys/Metod/01.htm>.В.
Воронова, Н.M. Климова, A.M. Менджерицкий / Анатомия центральной нервной
системы.// <http://culture.niv.ru/doc/psychology/nervous-system/004.htm>
Физиология
возбудимых тканей <http://edufns.nspu.ru/moodlefns/course/view.php?id=18>. Л. В.
Осадчук
<http://edufns.nspu.ru/moodlefns/user/view.php?id=173&course=1>. <http://fns.nspu.ru/resurs/files/HTML1/html/lection_4.htm>
Сергеев
П.В., Шимановский Н.Л., Петров В.Н. Рецепторы физиологически активных веществ:
Монография. - Волгоград; "Семь ветров", 1999. - 640 с.
Ю.М.
Мостовой, Т.В. Константинович, А.В. Демчук / Хронология становления терапии
бронхиальной астмы: фрагменты истории и современности // «Здоров’я України». -
2007 - №8, стр. 38
Авакян
О. М. Фармакологическая регуляция функции адрено-рецепторов. - М.: Медицина,
1988.-256 с: ил.
Pat. 1204631 GB, App. No. 48134/68.
Pharmakologikally active benzylideneamino guanidines and their use/ J.K.Kodama,
G.R.Haynes, J.L.Albert; 12.10.67; 10.10.68; - 7p.. WO 047382, App. No.
C07C213/02. A process of the preparation of
4-[2-[[3-(4-hydroxyphehyl]-1-methylpropy]amino]ethyl]-1.2-benzenediol/
M.M.Pillai, A.B.Mistry, V.M.Patel; 10.07.2006; 10.07.2007; - 30p.. 3056836 US.
Aralkylamines and methods of preparation therefore / H.D.Moed, V.Houtenlaan;
19.12.1960; 2.10.1962; - 7p.. 3329709 US.
N,N’-bis-[2-(3.4-dihydroxyphenyl)-2-hydroxyethyl]-hexamethylene-diamine and
salts thereof / O.Schmid, H.Stormann, M.Lerchenthal, G.Zolss, R.Gratz, and Karl
Wismayr; 5.06.1964; 4.07.1967; - 3p.. 2661373 US. Certain amino alcohols and
ketones / F.Kiilz, I.Kiilz A.Kiilz, W.Kiilz, F.Lehmann; 2.03.1953; 1.10.1953; -
8p.. 3147275 US. Imidazoline derivatives / W.Fruhstorfer, H.Мuller-Calgan;
21.09.1961; 1.09.1964; - 3p.. 1034938 GB, App. No. 1016514.
2-phenylamino-1.3-diazocyclopent-2-enes / J.K.Kodama, G.R.Haynes, J.L.Albert;
28.09.1964; 6.06.1966; - 15p.. 970957 GB, App. No. 29012/62.
2-(5.6.7.6-tetrahydronaphtyl-1)-amino-imidazoline / K.Thomae; 27.07.1962;
23.09.1964; - 6p.. 1114660 GB, Tetrahydro-isoquinolines / T.Seiyaku; 9.06.1966;
22.05.1968; - 4p.
Международная
фармакопея. Изд. 3-е.- Женева, Всемирная организация здравоохранения, 1983, -
Т.2: Спецификации для контроля качества. - 364с.
Государственная
фармакопея СССР. Изд. X. / Под ред. Машковского М.Д. - М.:Медицина., 1968, -
1079с.
Международная
фармакопея. Изд. 3-е.- Женева, Всемирная организация здравоохранения, 1983, -
Т.3: Спецификации для контроля качества. - 435с.
A. Klecmann, J. Engel.
Pharmazeutische wirkstoffe. Synthesen, patente, anwendungen. - New York: Georg
Thieme Verlag Stuttgart, 1982. - 1040p.
Машковский
М. Д. Лекарственные средства. В двух частях. Ч. 1. 12-е изд. перераб. и доп.
М.: Медицина, 1998. - 736 с.
Электронный
справочник Vidal. Лекарственные препараты России.
Словарь терминов
аденозинмонофосфат (АМФ; син.:
аденинмононуклеотид - устар., аденозинмонофосфорная кислота, аденозин фосфорная
кислота) - монофосфорный эфир аденозина, содержащий аденин, рибозу и один
остаток фосфорной кислоты; присоединение фосфатных групп к А. сопровождается
аккумуляцией энергии, необходимой для жизнедеятельности
аксон (axon, LNH; греч. axon ось; син.: нейрит,
осевой цилиндр, осевоцилиндрический отросток) - отросток нейрона, проводящий
нервные импульсы к другим нейронам или к эффекторам.
астма бронхиальная (asthma bronchiale) -
аллергическая болезнь, характеризующаяся повторными приступами экспираторной
одышки в связи с нарушением бронхиальной проходимости.
гипертензия артериальная - гипертензия
(hypertensio; гипер- + лат. tenslo напряжение; син. гипертония - нрк) -
повышенное гидростатическое давление крови в системе артерий большого круга
кровообращения.
глаукома (glaucoma; греч. glaukoma. от glaukos
голубовато-зеленый) - болезнь глаз, характеризующаяся повышенным внутриглазным
давлением с развитием трофических расстройств в сетчатке и диске зрительного
нерва, обусловливающих снижение зрительных функций
дендрит (dendritum, LNH; греч. dendron дерево)-
ветвящийся цитоплазматический отросток нервной клетки, проводящий нервные
импульсы к телу клетки
деполяризация (дe-+поляризация) - уменьшение
мембранного потенциала; лежит в основе возникновения и развития потенциала
действия
коллатераль (лат. collateralis боковой) -
анатомическое образование, соединяющее структуры в обход основного пути
миелин (myeimum) - смесь липоидных и белковых
веществ, входящая в состав внутреннего слоя оболочки нервного волокна и интенсивно
окрашивающаяся осмиевой кислотой в темно-коричневый цвет
миофиламент (myofilamentum, LNH; мио- + лат.
filamentum нить) - общее название протофибрилл, входящих в состав миофибрилл;
способен сокращаться, при этом смещается по межфибриллярным промежуткам
нейрон (neuronum, neurocytus, LNH; греч. neuron
жила, нерв; син.: клетка нервная, невроцит, нейроцит)- клетка, способная
воспринимать раздражение, приходить в состояние возбуждения, вырабатывать
нервные импульсы и передавать их другим клеткам: является структурной и
функциональной единицей нервной системы.
потенциал действия (син.: пиковый потенциал,
распространяющийся потенциал, спайк)- быстрое колебание мембранного потенциала,
лежащее в основе распространения возбуждения
потенциал концевой пластинки миниатюрный (МПКП;
син. миниатюрный потенциал)- потенциал концевой пластинки, возникающий при
спонтанном выделении ацетилхолина, содержащегося в одном пресинаптическом
пузырьке
потенциал покоя - мембранный потенциал,
регистрируемый до начала действия раздражителя
реполяризация (ре- + поляризация) - возвращение
разности потенциалов на мембране живой клетки к уровню, предшествовавшему ее
деполяризации
саливация (лат. salivatio слюноотделение) -
выделение слюны из слюнных желез в ротовую полость
синапс (synapsis, греч. «соприкосновение»,
«соединение») - специализированная структура, обеспечивающая передачу нервного
импульса с нервного волокна на какую-либо клетку или мышечное волокно, а также
с рецепторной клетки на нервное волокно
ткань (textus, LNH) - система клеток и
неклеточных структур, объединенных общей функцией, строением и (или)
происхождением