Состояние плутония (VI) в водных растворах
Озерский технологический институт
ГОСУДАРСТВЕННОГО ОБРАЗОВАТЕЛЬНОГО
УЧРЕЖДЕНИЯ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«Московский инженерно-физический
институт
(государственный университет)»
(ОТИ МИФИ)
Кафедра: Химии и ХТ
КУРСОВАЯ РАБОТА
по дисциплине: «Радиохимия»
Тема: «Состояние плутония (VI) в водных растворах»
Зав. Кафедрой
Медведев В.П.
Преподаватель
Медведев В.П.
Выполнил
студент
группы
ХТ-40Д
Смолянинова
Е.В.
Содержание
1.
Литературный обзор
.1
Плутоний. История открытия. Плутоний в окружающей среде.
.2
Методы определения плутония в объектах окружающей среды.
.3
Pu (VI) в реакциях комплексообразования и гидролиза
.
Расчетная часть
.1
Расчет доли и концентрации форм состояния гидролизующихся лигандов в растворе
во всем диапазоне рН.
.2
Рассчет доли всех возможных форм плутония (VI) в растворе данного состава
.3
Определение концентрации NaF и Na2C2O4
.4
Определение возможности образования истинных коллоидов гидроксида плутонила в
растворе во всем диапазоне рН
Заключение
Литература
1. Литературный
обзор
.1 Плутоний.
История открытия. Плутоний в окружающей среде
Плутоний - первый элемент, созданный в значительных количествах
синтетическим путем, т.е. в результате ядерных превращений других элементов
[1].
Первым в 1940 г. при бомбардировке урана дейтронами Сиборгом и
Мак-Миллоном Кеннеди и Уолом был открыт изотоп 238Pu (87,7 лет) [2]
U (d,2n) → 238Np → (β−) 238Pu
Название элемента было предложено в1948: Мак-Миллан назвал первый
трансурановый элемент нептунием в связи с тем, что планета Нептун- первая за
Ураном. По аналогии элемент 94 решили назвать плутонием, так как планета Плутон
является второй за Ураном [3].
В 1941 г. Сиборг и его сотрудники [4] при облучении урана нейтронами на
циклотроне идентифицировали 239Pu (2,41 · 104 лет) как продукт распада 239Np:
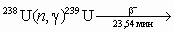 239Np
239Np 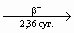 239Pu
239Pu
Pu-239 под
действием медленных нейтронов делится несколько лучше урана-235, помимо этого
нейтроны, полученные в процессе деления, пригодны для осуществления следующих
актов ядерного деления, то есть позволяют рассчитывать на осуществление цепной
ядерной реакции. По этой причине интерес к свойствам плутония и его соединений
возрос. Кроме того, с этого момента были начаты опыты по созданию плутониевой ядерной
бомбы и строительства реакторов для его наработки [3].
<#"823400.files/image003.gif"> 239Np  239Pu
239Pu
Его содержание составляет от 0,4 до 15 частей элемента на 1012 частей
урана [2].
Чрезвычайно малые количества 244Pu (самого долгоживущего изотопа
плутония, период полураспада 80 миллионов лет) были обнаружены в цериевой руде,
оставшиеся там со времен формирования Земли [3].Искусственно синтезированный
плутоний все-таки существует в природе, но его концентрация слишком мала. По
этой причине не только добыть - даже обнаружить «земной» плутоний необыкновенно
трудно. Сделать это удалось лишь после того, как были изучены физические и
химические свойства плутония, полученного в атомных реакторах. [3]
1.2 Методы
определения плутония в объектах окружающей среды
плутоний лиганд коллоид гидроксид
Для количественного определения плутония в окружающей среде и используют
следующие методы: кулонометрический, радиометрический, спектрометрический, а
также титрометрический и др. [7].
Кулонометрический метод анализа при заданном потенциале основан на известных
законах электролиза и характеризуется широким диапазоном определяемых количеств
плутония. Избирательность метода объясняется различием ОВ-потенциалов
элементов, регулируемым добавлением определенных комплексообразователей. При
использовании данного метода на электроде необходимо исключить возможность
протекания побочных реакций [5].
Радиометрический метод определения плутония получил большое
распространение. Это обусловлено тем, что главный изотоп плутония, 239Рu, имеет
очень высокую α-радиоактивность. Метод позволяет определять очень малые
количества плутония (порядка 0,1 мкг и менее). Высокая чувствительность,
сравнительно простая аппаратура и несложная техника работы позволяют широко
использовать радиометрический метод в технологическом контроле производства
плутония и в научных исследованиях [3].
Фотометрический и спектрометрический метод. Водные и органические
растворы соединений плутония во всех валентных состояниях обладают
специфической окраской. В зависимости от интенсивности окрашивания и состава
раствора все известные фотоколориметрические методы определения плутония можно
разделить на три группы:
). Методы, основанные на цветных реакциях ионов плутония с
неорганическими анионами и простейшими бесцветными и слабоокрашенными
органическими реагентами. Чувственность методов этой группы не высока, что
объясняет их применение только при определении миллиграммовых количеств
элемента.
). Методы, основанные на образовании внутрикомплексных соединений
плутония с интенсивно окрашенными реагентами. Методы этой группы наиболее
чувствительные и позволяют определять доли миллиграмма плутония в литре
раствора.
). Методы, основанные на цветных твердофазных реакциях плутония с
некоторыми органическими красителями. Достоинствами методов данной группы
являются очень высокая чувствительность и селективность. Недостатком - малая
воспроизводимость [5].
Титрометрический метод не широко используется в аналитической химии
плутония. Это объясняется существованием радиометрического метода, более просто
и избирательного. Титрометрический метод не зависит от изотопного состава
плутония, является его главным достоинством. Применение такие методы находят в
процессе контроля продуктов конечных стадий переработки ядерного горючего, а
также стандартизации растворов плутония, используемых в лаборатории [5].
1.3 Pu (VI) в реакциях комплексообразования и гидролиза
Гидролиз.
Общая картина гидролиза PuO2
представлена в виде ряда последовательных реакций:[8]
+ + H2O = PuO3(OH)+ + H+(OH)+ + H2O = PuO2(OH)2 + H+(OH)+ +
PuO2(OH)2 = (PuO2)2(OH)3+(OH)2 + H2O = PuO2(OH)- + H+(OH)2 + PuO2(OH)- =
(PuO2)2(OH)5-
Гидролиз имеет необратимый характер, а среди его продуктов находятся
полимеры [5].
При вычислении констант гидролиза не учитывались возможные реакции с
участием полимеров Pu (VI), поэтому величины констант,
полученые различными авторами, иногда значительно различаются [8,9].
О'Коннер [10] показал, что кривые титрования щелочных растворов Pu (VI)
кислотой отличаются от кривых, полученных при титровании кислых растворов Pu
(VI) щелочью. Хиндмен [9] установил, что РиО2+ не может рассматриваться как
простой двухвалентный катион, такой, как Ва2+, так как в этом случае константа
гидролиза Pu(VI) равнялась бы ~10~13. В действительности значение константы
гидролиза Pu (VI) соответствует значениям для четырехвалентных катионов
большого размера, таких, как Th4+.
Комплексообразование.
Известно несколько комплексов Pu(VI),и несмотря на то, что некоторые из
них изучены только качественно, получены неожиданные результаты. Так, в работе
[9] сообщалось, что Сl--ионы
проявляют большую тенденцию к комплексообразованию с Pu(VI), чем N03--ионы, в противоположность другим
валентным состояниям плутония. Эти отличия являются следствием
электростатического отталкивания между атомами кислорода нитратной группы и иона
Pu022+
В отношении комплексообразования Pu(VI) ведет себя в большей степени как
четырехзарядный катион большого размера, чем как двухвалентный ион [9].
Хлоридные комплексы Pu(VI) обнаружены методом переноса и
спектрофотометрически. Увеличение концентрации НСl или повышение температуры способствуют накоплению комплекса
в растворе. В 2М НСl Pu(VI) находится
в форме катиона; при концентрации НСl 6М в растворе преобладает анионный комплекс плутония, а при 10М НСl весь Pu(VI) находится в виде
анионного комплекса. Таким образом, по крайней мере три комплекса плутония (Рu02Сl+, Рu02Сl2 и Рu02Сl3-
или Рu02Сl42-) существуют в солянокислых средах. [11]
Нитратные комплексы. Нитрат-ионы проявляют очень слабую тенденцию к
образованию комплексов с Pu(VI) в разбавленных растворах и даже в 10М HN03
Pu(VI) находится в основном в катионной форме. В растворах с концентрацией HN03
около 11М и выше образуется тринитратный комплекс, Pu02(N03)3-, выход которого
увеличивается с дальнейшим ростом концентрации HN03 [11].
Спектрофотометрическим методом Хиндмен [9] обнаружил три rомплекса: Pu02N03+, Pu02(N03)2 и
Ри02(N03)3-
Динитратные и тринитратные комплексы обнаружены в растворах ацетона,
содержащих азотнокислый пиридин.
Сульфатные комплексы Pu(VI) обнаружены спектрофотометрически [9]. Уже в
0,1М H2SO4 преобладает анионный комплекс плутония, а в 1М растворах кислоты
свыше 90% Pu(VI) находится в виде анионных соединений с ионами S042- и HS04-.
Количественных данных об устойчивости сульфатных комплексов не представлено.
Карбонатные комплексы. На основании окрашивания в ярко-зеленый цвет
разбавленных растворов Pu(VI) в 45% К2СО3 предполагалось [9] образование
карбонатного комплекса Pu(VI). Подтверждением существования последнего является
повышенная растворимость гидроокиси Pu(VI) в водных растворах К2СО3 и спектры
поглощения этих растворов. Строение комплекса неизвестно, однако, исходя из
образования ярко-зеленого осадка (NH4)4Pu02(C03)3 при добавлении (NH4)2C03 в
азотнокислые растворы Pu(VI), можно предположить, что образуется зеленый Рu02(СО3)44-.
Получены моно- и дикарбонатные комплексы Рu(VI). В ~5%-ном растворе (NH4)2C03 образуется ярко-красный
нейтральный комплекс Рu02С03,
строение которого определено из состава осадка, получаемого при добавлении
спирта к раствору. Аналогичным образом выделен дикарбонатный комплекс. Из
данных по растворимости (NH4)4Pu02(C03)3 значение константы нестойкости
комплекса Рu02(СО3)22- в растворах с нулевой
ионной силой найдено равным 10-15 [11].
Оксалатные комплексы. Из зависимости растворимости оксалата Pu(VI) в
азотнокислой среде от концентрации (NH4)2C204 установлено, что в растворах
образуются в основном комплексы Рu02С204
и Pu02(C204)22- [11].
Ацетатные комплексы. На основании изучения растворимости NaРu02(СН3СОО)3 в зависимости от концентрации NaCH3COO и в
растворах НСl04 показано существование моно-, ди-
и триацетатных комплексов Pu(VI) [11]. Значения констант нестойкости этих
комплексов согласно реакциям
Рu02(СН3СОО)+ PuO22+ + СН3СОO-,
Рu02(СН3СОО)2 PuO22+ + 2СН3СОО-,
Рu02(СН3СОО)3- РuО2+ + ЗСН3СОО-
в растворах с ионной силой 2 найдены равными соответственно 5,4*10-4;
5,1*10-7 и 4,4*10-8.
Комплексы Pu(VI) с этилендиаминтетрауксусной кислотой (ЭДТА). Ионы Pu(VI)
образуют фиолетово-голубой хелат с ЭДТА согласно реакции
+ + Y4- Pu02Y2-
где Y4- - полностью ионизированная ЭДТА. Значения константа устойчивости
этого хелата в 0,1М растворе КCl,
определенная ионообменным методом при рН = 3,30 найдена равной 2,46*1016.
Другие комплексы Pu(VI) с ЭДТА не описаны[11].
2. Расчетная
часть
Исходные данные:
Состав раствора: «PuO2(NO3)2 - NaF - Na2C2O4 - H2O »
C(PuO2(NO3)2) = 10-6 моль/л
С(NaF) = 0,05 моль/л
С(Na2C2O4) = 0,001 моль/л
рН = 1-12
Kw =
10-14 - константа диссоциации воды
Основные реакции
1. PuO2(NO3)2 ↔ PuO22+ + 2 NO3-
2. NaF ↔ Na+ + F-
3. Na2C2O4 ↔ 2Na+ +
C2O42-
.1 Расчет
доли и концентрации форм состояния гидролизующихся лигандов в растворе во всем
диапазоне рН; построение распределительной диаграммы
плутоний лиганд коллоид гидроксид
Найдем α(H2C2O4) α(HC2O4ˉ) и α(C2O42ˉ)
H2C2O4 = H+ + HC2O4ˉ k1 = 6,5·10 -2
HC2O4 ˉ = H+ + C2O42ˉ k2 = 5,18·10 -5
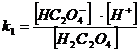
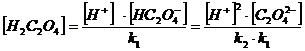
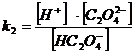
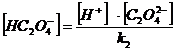 = [H2C2O4 ] + [HC2O4 ˉ] + [C2O4 2-]
= [H2C2O4 ] + [HC2O4 ˉ] + [C2O4 2-]
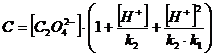
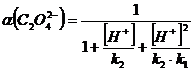


Запишем
полученные результаты и построим графики зависимостей:
α(H2C2O4 ) = f (pH), α(HC2O4 ˉ)
= f (pH), α(C2O4
2-) = f (pH).
Таблица
1.
Концентрация
и доли гидролизующихся ионов [C2O42-] при С(Na2C2O4) =
0,001 моль/л в интервале рН = 1-12.
|
рН
|
α(C2O4
2-)
|
с(C2O4 2-)
|
α(HC2O4
ˉ)
|
с(HC2O4 ˉ)
|
α(H2C2O4
)
|
с(H2C2O4 )
|
|
1
|
0,0001859
|
1,86E-07
|
0,359
|
0,000359
|
0,641
|
0,000641
|
|
2
|
0,004376
|
4,38E-06
|
0,845
|
0,000845
|
0,151
|
0,000151
|
|
3
|
0,048
|
0,000048
|
0,935
|
0,000935
|
0,017
|
0,000017
|
|
4
|
0,341
|
0,000341
|
0,658
|
0,000658
|
0,00175
|
1,75E-06
|
|
5
|
0,838
|
0,000838
|
0,162
|
0,000162
|
2,89E-05
|
2,889E-08
|
|
6
|
0,981
|
0,000981
|
0,019
|
0,000019
|
3,38E-07
|
3,382E-10
|
|
7
|
0,998
|
0,000998
|
0,001927
|
1,93E-06
|
3,44E-09
|
3,441E-12
|
|
8
|
0,9998
|
0,009998
|
0,000193
|
1,93E-07
|
3,45E-11
|
3,447E-14
|
|
9
|
0,99998
|
0,0099998
|
0,0000193
|
1,93E-08
|
3,45E-13
|
3,447E-16
|
|
10
|
0,999998
|
0,00999998
|
0,00000193
|
1,93E-09
|
3,45E-15
|
3,447E-18
|
|
11
|
0,9999998
|
0,009999998
|
1,93E-07
|
1,93E-10
|
3,45E-17
|
3,447E-20
|
|
12
|
0,99999998
|
0,0099999998
|
1,93E-08
|
1,93E-11
|
3,45E-19
|
3,447E-22
|
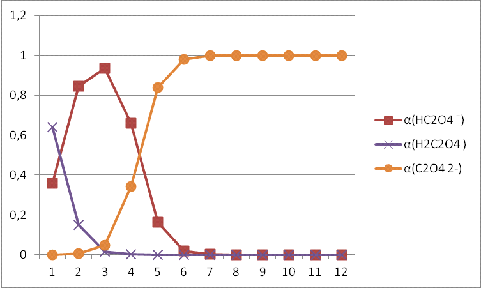
Рисунок
1. Зависимость доли гидролизующихся ионов [C2O42-] от pH
Найдем
α(HF) и α(Fˉ)
=
Fˉ + H+ k1 =
6.76·10-4
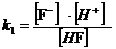
 = [HF ] + [Fˉ]
= [HF ] + [Fˉ]
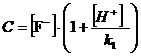
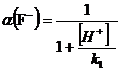

Запишем
полученные результаты и построим графики зависимостей:
α(HF ) = f (pH) и α(Fˉ)
= f (pH).
Таблица
2.
Концентрация
и доли гидролизующихся ионов [F-] при С(NaF) = 0, 1 моль/л в интервале рН
= 1-12.
|
рН
|
α1(F-)
|
c(F-)
|
α2(HF)
|
c(HF)
|
|
1
|
0,006754
|
0,000338
|
0,993
|
0,04965
|
|
2
|
0,064
|
0,0032
|
0,936
|
0,0468
|
|
3
|
0,405
|
0,02025
|
0,595
|
0,02975
|
|
4
|
0,872
|
0,0436
|
0,128
|
0,0064
|
|
5
|
0,986
|
0,0493
|
0,014
|
0,0007
|
|
6
|
0,999
|
0,04995
|
0,00168
|
0,000084
|
|
7
|
0,9998
|
0,04999
|
0,000147
|
7,35E-06
|
|
8
|
0,99998
|
0,049999
|
0,0000147
|
7,35E-07
|
|
9
|
0,999998
|
0,0499999
|
0,00000147
|
7,35E-08
|
|
10
|
0,9999998
|
0,04999999
|
0,000000147
|
7,35E-09
|
|
11
|
0,99999998
|
0,049999999
|
1,47E-08
|
7,35E-10
|
|
12
|
0,999999998
|
0,0499999999
|
1,47E-09
|
7,35E-11
|

Рисунок
2. Зависимость доли гидролизующихся ионов [F-] от pH
2.2 Рассчет
доли всех возможных форм плутония (VI) в растворе данного состава; построение
распределительной диаграммы
Реакции комплексообразования Pu(VI)
1. Гидроксокомплексы (OH-)
22+ + НОН ↔ PuO2(ОН)+
+ Н+ K’1= 2*10-6
PuO22+
+ 2НОН ↔ PuO2(ОН) 2 + 2Н+ K’1,2= 4*10-12
PuO22+
+ 3НОН ↔ PuO2(ОН) 32 + 3Н+ K’1,2,3 = 8*10-22

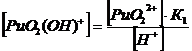
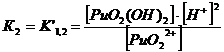
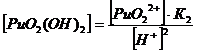

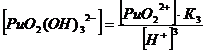
2. Оксалатные комплексы (C2O42-)
+ + C2O42-↔ PuO2 C2O4 lg K’’1 = 6,66 K’’1= 106,6+ +
2C2O42- ↔ PuO2 (C2O4) 22- lg K’’1,2 = 11,4 K’’1,2=1011,4
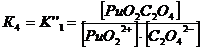
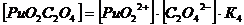

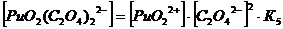
3. Фторидные комплексы (F-)
+ + НF ↔ PuO2F+ + Н+ lgK1 = 2,11 K1= 102,11+ + 2НF ↔ PuO2F2 + 2Н+ lg K1,2 = 4,15 K1,2= 104,15+ + 3НF ↔ PuO2F3- + 3Н+ lg K1,2,3 = 5,52 K1,2,3= 105,52+ +
4НF ↔ PuO2F42- + 4Н+ lg K1,2,3,4 = 6,68 K1,2,3,4= 106,68
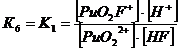
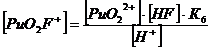
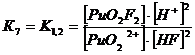
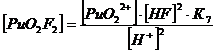
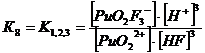
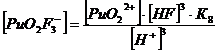

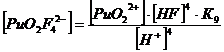
Уравнение материального баланса
С
(PuO22+) = [PuO22+] + [PuO2(ОН)+] + [PuO2(ОН) 2] + [PuO2(ОН)
32-] + [PuO2 C2O4] + [PuO2 (C2O4) 22-] + [PuO2F+] + [PuO2F2] +
[PuO2F3-] + [PuO2F42-]
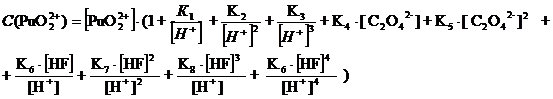
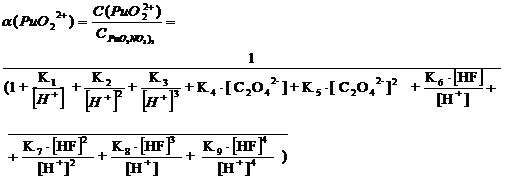
При
рН = 1:
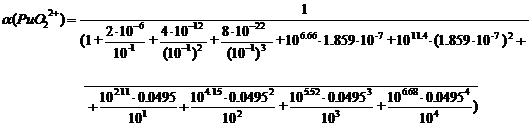

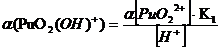
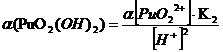
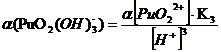


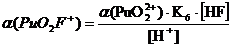
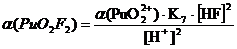
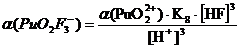

Таблица 3.
Доли всех возможных форм плутония(VI) в растворе заданного состава в интервале pH = 1-12.
|
рН
|
α(PuO22+)
|
α(PuO2(ОН)+)
|
α(PuO2(ОН) 2)
|
α(PuO2(ОН) 32-)
|
α
( PuO2 C2O4)
|
α( PuO2 (C2O4) 22-)
|
α(PuO2F+)
|
α(PuO2F2)
|
α(PuO2F3-)
|
α(PuO2F42-)
|
sum
|
|
1
|
2,98E-6
|
5,97E-11
|
1,19E-15
|
2,39E-24
|
2,54Е-6
|
2,59E-08
|
1,91Е-4
|
0,01
|
0,121
|
0,868
|
1
|
|
2
|
4,29E-10
|
8,57E-14
|
1,71E-17
|
3,43E-25
|
8,57E-09
|
2,06E-09
|
2,58E-07
|
1,33Е-4
|
0,015
|
0,984
|
1
|
|
3
|
2,56E-13
|
5,31E-16
|
1,06E-18
|
2,12E-25
|
5,88E-11
|
1,57E-10
|
1,02E-09
|
3,32E-06
|
2,3Е-3
|
0,998
|
1
|
|
4
|
1,24E-14
|
2,47E-16
|
4,94E-18
|
1,93E-11
|
3,60E-10
|
1,02E-10
|
7,17E-07
|
1,08Е-3
|
0,999
|
1
|
|
5
|
7,57E-15
|
1,51E-15
|
3,03E-16
|
6,06E-21
|
2,9E-11
|
1,34E-10
|
7,07E-11
|
5,62E-07
|
9,54Е-4
|
0,999
|
1
|
|
6
|
7,18E-15
|
1,44E-14
|
2,87E-14
|
5,75E-18
|
3,22E-11
|
1,74E-10
|
6,79E-11
|
5,47E-07
|
9, 41Е-4
|
0,999
|
1
|
|
7
|
7,15E-15
|
1,43E-13
|
2,9E-12
|
5,72E-15
|
3,26E-11
|
1,79E-10
|
6,77E-11
|
5,46E-07
|
9, 41Е-4
|
0,999
|
1
|
|
8
|
7,14E-15
|
1,43E-12
|
2,87E-10
|
5,71E-12
|
3,26E-11
|
1,79E-10
|
6,76E-11
|
5,45E-07
|
9, 41Е-4
|
0,999
|
1
|
|
9
|
7,14E-15
|
1,43E-11
|
2,86E-08
|
5,71E-09
|
3,26E-11
|
1,79E-10
|
6,76E-11
|
5,45E-07
|
9, 41Е-4
|
0,999
|
1
|
|
10
|
7,14E-15
|
1,43E-10
|
2,86Е-6
|
5,71Е-6
|
3,26E-11
|
1,79E-10
|
6,76E-11
|
5,45E-07
|
9, 41Е-4
|
0,999
|
1
|
|
11
|
7,14E-15
|
1,43E-09
|
2,84Е-4
|
5,68Е-3
|
3,25E-11
|
1,78E-10
|
6,76E-11
|
5,42E-07
|
9, 34Е-4
|
0,993
|
1
|
|
12
|
1,06E-15
|
2,12E-09
|
4,24У-3
|
0,85
|
4,84E-12
|
2,66E-10
|
1E-12
|
8,09E-08
|
1,39Е-4
|
0,149
|
1
|
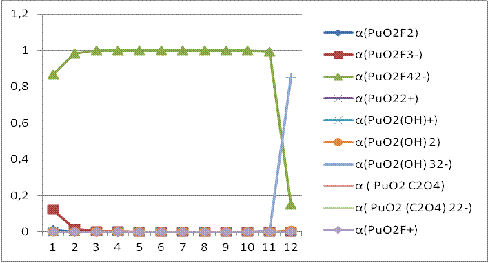
Рисунок
3. Зависимость доли всех возможных форм плутония(VI) ионов от pH.
.3
Определение концентрации NaF и Na2C2O4, при которых
преобладают
.3.1 Фторидные комплексы
Результат расчета долей всех возможных форм Pu(VI) показал, что в
растворе изначально заданного состава ( С(NaF) = 0.05 моль/л, С(Na2C2O4) = 0.001 моль/л) преобладают
фторидные комплексы Pu(VI).
.3.2 Оксалатные комплексы
Примем, что в растворе С(NaF) =
0.0005 моль/л, С(Na2C2O4) = 0. 1 моль/л, тогда доли всевозможных форм Pu(VI) примут следующие значения:
Таблица 4.
Доли всех возможных форм плутония(VI) в растворе заданного состава в интервале pH = 1-12.
|
рН
|
α(PuO22+)
|
α(PuO2(ОН)+)
|
α(PuO2(ОН) 2)
|
α(PuO2(ОН) 32-)
|
α
( PuO2 C2O4)
|
α( PuO2 (C2O4) 22-)
|
α(PuO2F+)
|
α(PuO2F2)
|
α(PuO2F3-)
|
α(PuO2F42-)
|
|
1
|
0,00575
|
1,15E-07
|
2,3E-12
|
4,6E-21
|
0,49
|
0,499
|
0,00368
|
0,0002
|
2,33Е-04
|
1,68E-05
|
|
2
|
1,99E-05
|
3,99E-09
|
7,97E-13
|
1,6E-20
|
0,04
|
0,958
|
0,00012
|
6,77Е-04
|
6,77Е-04
|
4,58Е-04
|
|
3
|
1,68E-07
|
3,36E-10
|
6,71E-13
|
1,3E-19
|
0,00371
|
0,988
|
6,43E-06
|
2,01Е-04
|
0,00147
|
0,0063
|
|
4
|
3,42E-09
|
6,83E-11
|
1,37E-12
|
2,7E-18
|
5,32Е-04
|
0,996
|
2,82E-07
|
1,98E-05
|
2,98Е-04
|
0,00276
|
|
5
|
5,66E-10
|
1,13E-10
|
2,26E-11
|
4,5E-16
|
2,17Е-04
|
0,999
|
5,29E-08
|
1,98E-05
|
7,13E-05
|
7,47Е-04
|
|
6
|
4,13E-11
|
8,27E-10
|
1,65E-09
|
3,3E-13
|
1,85Е-04
|
0,999
|
3,91E-08
|
4,2E-06
|
5,42E-05
|
5,75Е-04
|
|
7
|
3,99E-10
|
7,99E-09
|
1,6E-07
|
3,2E-10
|
1,82Е-04
|
0,999
|
3,78E-08
|
3,05E-06
|
5,25E-05
|
5,55Е-04
|
|
8
|
3,99E-10
|
7,99E-08
|
1,59E-05
|
3,2E-07
|
1,82Е-04
|
0,999
|
3,77E-08
|
3,04E-06
|
5,24E-05
|
5,57Е-04
|
|
9
|
3,97E-10
|
7,94E-07
|
0,00158
|
3,2Е-04
|
1,82Е-04
|
0,997
|
3,76E-08
|
3,03E-06
|
5,23E-05
|
5,56Е-04
|
|
10
|
2,69E-10
|
5,39E-06
|
0,108
|
0,215
|
1,23Е-04
|
0,676
|
2,55E-08
|
2,06E-06
|
3,54E-05
|
3,77Е-04
|
|
11
|
1,19E-12
|
2,37E-07
|
0,047
|
0,95
|
5,43E-07
|
0,003
|
1,12E-10
|
9,07E-09
|
1,56E-07
|
1,66E-06
|
|
12
|
1,24E-15
|
2,49E-09
|
0,00498
|
0,995
|
5,69E-10
|
3E-06
|
1,18E-13
|
9,5E-12
|
1,64E-10
|
1,74E-09
|
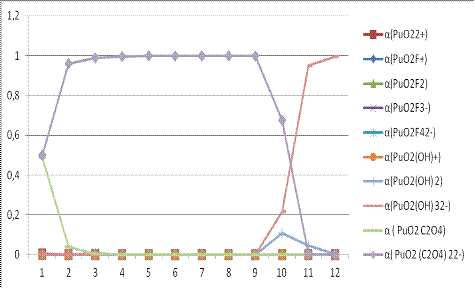
Рисунок
4. Зависимость доли всех возможных форм плутония(VI) ионов от pH.
Из
рисунка 4 видно, что в растворе данного состава преобладают оксалатные
комплексы.
.4
Определение возможности образования истинных коллоидов гидроксида плутонила в
растворе во всем диапазоне рН. Построение зависимости растворимости гидроксида
плутонила от рН
Необходимым условием образования истинных радиоколлоидов является
достижение произведения растворимости (ПР) труднорастворимого соединения,
образующего дисперсную фазу.
Протекает реакция:
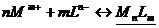 .
.
Основой
рассмотрения термодинамического равновесия в гетерогенной системе: «осадок
труднорастворимого соединения 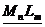 - водный
раствор» является произведение активностей (ПА), которое согласно Нернсту
определяется выражением:
- водный
раствор» является произведение активностей (ПА), которое согласно Нернсту
определяется выражением:
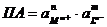 ,
,
где
а - термодинамическая активность. При данной температуре ПА - величина
постоянная. [9]
В условиях постоянства ионной силы раствора
коэффициенты активности можно считать постоянными и для характеристики
гетерогенного равновесия пользоваться выражением:
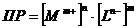 .
.
Учитывая,
что 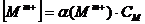 и
и 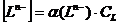 суммарные
равновесные концентрации в водном растворе всех форм катиона и аниона осадка
будут равны соответственно
суммарные
равновесные концентрации в водном растворе всех форм катиона и аниона осадка
будут равны соответственно 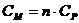 и
и 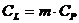 ,
,
где
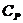 - растворимость данного осадка в его насыщенном
растворе, моль/л;
- растворимость данного осадка в его насыщенном
растворе, моль/л;
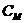 -
аналитическая концентрация катионов в насыщенном растворе данной соли
-
аналитическая концентрация катионов в насыщенном растворе данной соли 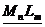 , моль/л;
, моль/л;
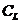 -
аналитическая концентрация анионов в насыщенном растворе данной соли
-
аналитическая концентрация анионов в насыщенном растворе данной соли 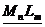 , моль/л. [14]
, моль/л. [14]
После
некоторых преобразований получаются уравнения растворимости:
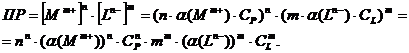
Далее:
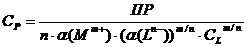 .
.
Если
рассчитанная по данному уравнению растворимость меньше общей аналитической
концентрации металла (Со), то раствор является пересыщенным и образование
истинных коллоидов радионуклидов термодинамически вероятно. При Ср> Со
раствор является ненасыщенным и образования истинных коллоидов ожидать не
следует.
Для
истинных коллоидов можно рассчитать по уравнению:
 .
.
Оцениваем
возможность образования истинных коллоидов для гидроксида плутонила:
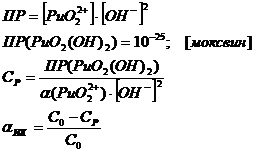
Таблица
5.
Растворимость
гидроксида плутонила в интервале рН = 1-12
|
рН
|
α(PuO22+)
|
Ср
|
α
|
|
1
|
2,98E-06
|
6,71E+06
|
0
|
|
2
|
4,29E-10
|
4,67E+08
|
0
|
|
3
|
2,56E-13
|
7,53E+09
|
0
|
|
4
|
1,24E-14
|
1,62E+09
|
0
|
|
5
|
7,57E-15
|
2,64E+07
|
0
|
|
6
|
7,18E-15
|
2,78E+05
|
0
|
|
7
|
7,15E-15
|
2,80E+03
|
0
|
|
8
|
7,14E-15
|
2,80E+01
|
0
|
|
9
|
7,14E-15
|
2,80E-01
|
0
|
|
10
|
7,14E-15
|
2,80E-03
|
0
|
|
11
|
7,14E-15
|
2,82E-05
|
0
|
|
12
|
1,06E-15
|
1,89E-06
|
0
|
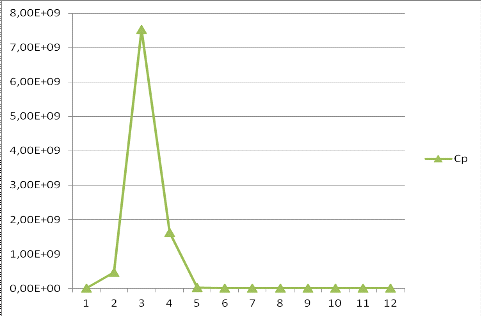
Рисунок
5. Зависимость растворимости гидроксида плутонила от pH.
Вывод:
В растворе заданного состава в диапазоне рН = 1 - 12 растворимость,
рассчитанная по данному уравнению больше исходной концентрации PuO2(NO3)2, таким образом, вероятность образования истинных
радиоколлоидов термодинамически маловероятна, раствор является ненасыщенным.
Заключение
Выполняя курсовую работу по теме «Состояние плутония VI в водных растворах», изучена
литература различного типа [1 - 12]. Были освещены в литературном обзоре такие
темы, как: история открытия плутония, плутоний в окружающей среде, методы
определения плутония в объектах окружающей среды, плутоний (VI) в реакциях гидролиза и
комплексообразования.
Произведен расчет долей всех возможных форм плутония VI в растворе с составом PuO2(NO3)2 - NaF - Na2C2O4 - H2O ». На основании произведенного расчета построена
распределительная диаграмма возможных форм плутония (VI) в данном растворе.
В курсовой работе была произведена оценка возможности образования
истинных коллоидов гидроксида плутонила в растворе в диапазоне рН = 1 - 12.
Также построен график зависимости растворимости гидроксида плутонила от рН.
После определенных вычислений был сделан вывод: Ср > C0 - гидроксид плутонила не будет
образовывать истинные коллоиды.
Литература
1. Вдовенко
В. М.. Современная радиохимия. - М.: Атомиздат, 1969 г.- 543 с.
. Трансурановые
элементы в окружающей среде / Под ред. У.С. Хэнсона. М., 1985.-344 с.
3. Бекман И. Н. Плутоний
<http://profbeckman.narod.ru/PlutonSS.htm>. Учебное пособие. - М.: МГУ
им. М. В. Ломоносова, 2009 г.
. Химия актиноидов /
Под ред. Дж. Каца, Г. Сиборга, Л. Морса. -пер. с англ. - М.: Мир, 1997.-Т.2.-
664 с.
5. Милюкова
М. С. Аналитическая химия плутония/ М. С. Милюкова, Н. И. Гусев, И. Г.
Сентюрин, И. С. Скляренко. - М.: Наука , 1965 г.
. Плутоний.
Фундаментальные проблемы / Под ред. Надыкто Б.А., Тимофеевой Л.Ф-пер. с англ.
Саров: РФЯЦ-ВНИИЭФ, 2003.-Т.1.-494 С.
. Филов
В.А. Врелные химические вещества. Радиоактивные вещества. Справочник. - Л, изд.
«Химия», 1990 г. -484 с.
. Москвин
А.И. Координационная химия актиноидов. - М.: Атомиздат, 1975 г.-288 c.
. Медведев
В. П. Пособие по радиохимии. Озёрск: ОТИ МИФИ, 2007 г.
. Xиндмен
И. В.. Актиниды. Под ред. Г. Сиборга и Дж. Каца. -пер. с англ. - М., Изд-во
иностр. лит., 1955 г.- 253 с.
12. Плутоний.
Справочник / Под ред. О. Вика. - М. Атомиздат. 1971.-Т.1.- 428 с.