Химия актиноидов
Министерство
образования и науки Российской Федерации
Федеральное
агентство по образованию
Государственное
учреждение высшего профессионального образования
"Поволжская
государственная социально-гуманитарная академия"
Кафедра
химии
Курсовая
работа
на
тему: "Химия актиноидов"
Выполнила Лутина М.
В.
студентка 3 курса
ЕГФ
отделения химии
Научный
руководитель
Акопьян В. А.
Самара
2011
Содержание
1. История открытия элементов
2. Нахождение в природе
. Получение элементов
. Физические свойства
. Химические свойства
. Применение
. Токсичность
Список литературы
1. История открытия элементов
Актиноиды (актиниды) - семейство, состоящее из
14 радиоактивных химических элементов III группы седьмого периода периодической
таблицы Д. И. Менделеева с атомными номерами 90 - 103: торий, протактиний,
уран, нептуний, плутоний, америций, берклий, калифорний, эйнштейний, кюрий,
фермий, менделевий, нобелий и лоуренсий
Термин "актиноиды" (подобные актинию)
был предложен в 1948 году профессором ЛГУ С. А. Щукаревым.
Первыми открытыми актиноидами были уран и торий.
Уран открыл М. Клапрот в 1789 году в урановой смоляной руде (название элемента
происходит от названия планеты Уран). М. Клапрот, восстанавливая углем жёлтый
оксид урана, добыл чёрное вещество, которое ошибочно принял за металл. Только
через 60 лет французский исследователь Э. Пелиго изучил его и понял, что это
вещество - диоксид урана. Тогда же была неправильно вычислена атомная масса -
120. Только Д. И. Менделеев в 1872 году на основании открытого им закона
уточнил атомную массу урана - 240. Экспериментально эту величину подтвердил в
1882 году К. Циммерман.
Торий открыл Ф. Вёлер в минерале, который был
найден в Норвегии (1827 год). Детально изучил этот элемент Й. Берцелиус; он же
назвал его в честь скандинавского бога грома и молнии - Тора (1828 год).
В 1917 году долгоживущий изотоп протактиния
открыли О. Ган и Л. Мейтнер. Название "протактиний" означает, что
атом этого элемента способен образовывать актиний. На данный момент известны 29
изотопов протактиния с массовыми числами 212-240 и 3 возбужденных изомерных
состояния некоторых его нуклидов. Наиболее стабилен нуклид 231Pa,
период полураспада которого равен 3,28×104
лет.
Первым предположил существование трансурановых
элементов Энрико Ферми, что явилось результатом ряда его экспериментов в 1934
году.
Синтез изотопа нептуния 239Np,
который провели в 1940 г. Э. Мак-Миллан и Ф. Абельсон, положил начало открытию
трансурановых элементов. В последующие года был произведен ядерный синтез
других изотопов нептуния.
Актиноиды на протяжении последних десятилетий
досконально изучались Г. Сиборгом и его школой. При участии Сиборга был
произведён синтез большинства трансурановых элементов [1].
Трансурановые элементы в природе практически не
встречаются. Для их получения используют ядерные реакции, которые проходят в
ядерных реакторах. Так, например, уран-238 в реакторе под действием нейтронов
частично преобразуется в плутоний-239. При этом происходят следующие реакции:
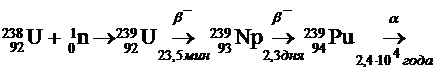
При дальнейшем поглощении нейтронов 239Pu
превращается в 241Pu, который вследствие β-распада
переходит в 241Am.
Таким способом Энрико Ферми с сотрудниками в
первом в мире реакторе "Чикагская поленница-1" впервые получил
значительные количества плутония-239, которые были использованы для создания
ядерного оружия.
Актиноиды с наибольшими порядковыми номерами
получены при бомбардировании ядер урана, плутония, кюрия или калифорния ионами
азота, кислорода, углерода, неона, бора на ускорителях тяжёлых ионов. Так, один
из первых методов синтеза нобелия - бомбардировка мишени из урана-238 ядрами
неона-22 в реакции
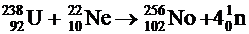
Первые изотопы ТПЭ - америций-241 и кюрий-242 -
были синтезированы в 1944 году Г. Сиборгом, Джеймсом и А. Гиорсо. Изотопы кюрия
были получены при бомбардировке ядер плутония-239 ионами гелия с энергией 32
МэВ:

Также изотопы америция-241 и кюрия-242 были
выделены из плутония, облучённого нейтронами в реакторе, где они образовались в
результате ядерных превращений.
При бомбардировании кюрия-242 α-частицами
образуется изотоп калифорния 245Cf. С помощью аналогичной реакции из
америция-241 был получен берклий-244.
В 1945 году Кеннингем впервые выделил твёрдое
соединение одного из ТПЭ - гидроксид америция. В течение последующих 3-4 лет
были накоплены миллиграммовые количества америция и микрограммовые количества
кюрия, что позволило, в результате облучения америция и кюрия, синтезировать
изотопы берклия (Томсон, 1949 год) и калифорния (Томсон, 1950 год). Весовые
количества данных элементов были выделены значительно позже, в 1958 году
(Кеннингем и Томсон), а первое соединение калифорния (CfOCl) получено лишь в
1960 году (Кеннингем и Уолмен).
Эйнштейний и фермий были выделены группой
американских учёных из Калифорнийского университета, Аргоннской национальной
лаборатории и Лос-Аламосской научной лаборатории в 1952-1953 годах из продуктов
термоядерного взрыва "Майк", произведённого 1 ноября 1952 года. В
результате мгновенного облучения урана-238 большим потоком нейтронов, возникшим
при термоядерном взрыве, образовались тяжёлые изотопы урана, в том числе
уран-253 и уран-255, при β-распаде
которых в конечном итоге образовались изотопы эйнштейния-253 и фермия-255.
Эйнштейний был найден группой американских учёных во главе с А. Гиорсо в 1952
году и назван в честь великого физика - А. Эйнштейна. Фермий впервые был
идентифицирован американским учёным А. Гиорсо в 1953 году в виде изотопа
фермия-255, указанного выше. Фермий назван в честь итальянского физика Э.
Ферми, внёсшего большой вклад в развитие современной теоретической и
экспериментальной физики. Первые весовые (субмикрограммовые) количества
эйнштейния выделены в 1961 году Кеннингемом и сотрудниками. Фермий и более ТПЭ
с большими порядковыми номерами до настоящего времени не получены в весовых
количествах.
Первый изотоп менделевия 256Md был
синтезирован в феврале 1955 года (Г. Сиборг и сотрудники) при облучении
эйнштейния-253 ионами гелия. Для синтеза следующих за менделевием элементов
пришлось использовать новый метод - облучение ядер урана и трансурановых
элементов тяжёлыми многозарядными ионами. Ввиду исключительно малого выхода и
коротких периодов полураспада изотопов трансменделевиевых элементов,
синтезируемых в этих реакциях, их идентификация оказалась очень сложной и не
всегда надёжной. Как правило, в первых работах по синтезу элементов с Z≥102
полученные изотопы идентифицировались чисто физическими методами, по характеру
излучения и дочерним продуктам распада.
Попытки получения изотопов нобелия велись с 1957
года, но первым надёжным результатом следует считать синтез изотопа нобелия 256No,
который был проведён Г. Флёровым в 1963 году. Для получения данного изотопа
использовался неон-22.
В 1961 году А. Гиорсо и сотрудниками был получен
первый изотоп лоуренсия путём облучения калифорния (в основном калифорния-252)
ионами бора-10 и бора-11; массовое число этого изотопа не было точно
установлено (возможно, 258 или 259) на тот момент. Более надёжно
идентифицирован изотоп лоуренсия 256Lr, синтезированный в 1965 году
Г. Флёровым с помощью нуклидов 243Am и 18O [6].
2. Нахождение в природе
Торий и уран имеют самую высокую
распространённость среди актиноидов; их атомные кларки равны 3×10−4
% и 2×10−5
% соответственно. В земной коре уран встречается в виде минеральной формы
уранинита - U3O8 (смоляная руда, урановая смолка), а
также карнотита - KUO2VO4·3H2O, отенита -
Ca(UO2)2(PO4)2·nH2O и
др. Два последних минерала имеют жёлтый цвет. Уран содержится также почти во
всех минеральных формах редкоземельных минералов (фергюсонит, самарскит,
эвксенит и др.).
Уран в природе встречается в виде изотопов 238U
(99,2739 %), 235U (0,7204 %) и 234U (0,0057 %). Из них 238U
имеет наибольший период полураспада (T½
= 4,51×109
лет) [4].
Уран принадлежит к числу редких и рассеяных
элементов. Содержание в земной коре урана составляет примерно 2×10−4
%. Общие запасы урана исчисляются миллионами тонн. Из минеральных форм урана
известно около 200 минералов, большинство из них относится к оксидам
переменного состава.
Наиболее богатыми минералами на торий являются
торианит (ThO2), торит (ThSiO4), монацит, шералит,
торогумит (Th(SiO4)1−x(OH)4x). Торий,
также как и уран, сопровождается с минеральными формами почти всех
редкоземельных элементов. Богатые месторождения монацитовых песков находятся в
Индии, Бразилии, Австралии, Африке, Канаде, США и на Цейлоне.
Более распространённым является протактиний,
атомный кларк которого 10−12 %. Протактиний был найден в
урановой руде в 1913 году К. Фаянсом и О. Герингом. Общее содержание
протактиния в земной коре (литосфере) в соответствии с содержанием урана
(изотопы протактиния образуются при распаде 235U) составляет 4,4×107
т. Содержание в горных породах вулканического происхождения составляет 0,8×10−6
г/т, а в железных метеоритах 0,02×10−6
г/т.
Период полураспада самого долгоживущего изотопа 237Np
ничтожно мал по сравнению с возрастом Земли, поэтому в природных минералах
нептуний практически не встречается. На Земле его нуклиды могут образоваться
практически лишь с помощью ядерных реакций. Нептуний находится в минералах как
промежуточный продукт распада других изотопов.
Наличие плутония в небольших количествах в
минеральных формах урана было впервые установлено в 1942 году. Верхний предел
распространённости на Земле 244Pu - самого долгоживущего из изотопов
плутония - составляет 3×10−22
г/г. Известно, что настуран и карнотит, найденные в Канаде и в штате Колорадо,
содержат небольшое количество α-излучающего
изотопа плутония 239Pu. Было определено содержание плутония в ряде
урановых руд, с последующим выделением плутония из отходов производства 239Pu.
Ни в одной из этих минеральных форм не было выделено другого изотопа плутония,
кроме плутония-239. В образцах лунного грунта плутоний не был обнаружен.
Однако даже использование богатейших на плутоний
урановых руд не сможет вытеснить искусственное получение данного элемента. На
это указывает тот факт, что для выделения микрограммовых количеств плутония
потребуется на каждый выделенный микрограмм плутония переработать 100 т рудного
концентрата плутония [6].
3. Получение элементов
В большинстве случаев для получения чистого
вещества элементов применяют разложение химического соединения этого элемента,
обычно путём реакции его оксида, фторида и т. д. с водородом. Однако этот метод
неприменим к актиноидам, поскольку они встречаются очень редко в природе, и
поэтому для их выделения применяются более сложные методы очистки соединений, а
затем и получения элементов данной группы.
Чаще всего для выделения чистых соединений
актиноидов используют фториды, поскольку они плохо растворяются в воде и могут
быть легче удалены путём обменной реакции. Фториды актиноидов восстанавливают
кальцием, магнием или барием, так как они сравнительно более активны по
сравнению с третьей и последующими подгруппами. Например, металлический америций
добывают действием на его трифторид парами бора:

Аналогично добывают и остальные. Плутоний
выделяют из его тетрафторида (PuF4), восстанавливая его:

Металлический уран также добывают из
тетрафторида (UF4), но в качестве восстановителя используют магний:
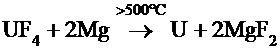 [1].
[1].
Среди актиноидов наиболее легко добываются торий
и уран. Торий добывают преимущественно из монацита. При этом дифосфат тория
(Th(PO4)2) с примесями редкоземельных элементов, которые
осаждаются при повышенном pH сульфатного раствора, обрабатывают азотной
кислотой, а нитрат тория экстрагируют трибутилфосфатом. Ещё лучше из кислых
растворов торий отделяется от РЗЭ в присутствии роданид-ионов.
При переработке монацита разложением 45%-ого
раствора гидроксида натрия (при 140°С) сначала добывают гидроксиды смешанных
металлов, которые затем отфильтровывают (при 80 °С), промывают водой и
растворяют в концентрированной хлорной кислоте. Далее кислый раствор
нейтрализуют гидроксидами до pH=5,8. При этом оседает гидроксид тория (Th(OH)4)
с примесями гидроксидов редкоземельных элементов (3 %), основная масса которых
остается в растворе.
Гидроксид тория растворяют в неорганической
кислоте и снова очищают от редкоземельных элементов. Более эффективным
считается метод растворения гидроксида тория в азотной кислоте, потому что
добытый раствор можно очистить посредством экстракции органическими
растворителями:
(OH)4 + 4HNO3 →
Th(NO3)4 + 4H2O
Но в нитратной кислоте ториевый концентрат не
полностью растворяется. В хлороводороде он растворяется лучше, образуя хлорид
тория и воду. Можно отделить торий от редкоземельных элементов (когда их
концентрация мала) осаждением оксалата тория из кислых растворов. Но самым перспективным
считается метод экстрагирования солей тория органическими растворителями,
которые не смешиваются с водой.
Металлический торий отделяют из безводного
оксида, хлорида или фторида с помощью кальция в инертной атмосфере:
2
+ 2Ca → 2CaO + Th - Q
Уран добывают из его руд разными способами.
Сначала руду поджигают, затем воздействуют на неё кислотами, чтобы уран перешёл
в растворённое состояние. При использовании серной кислоты, которая растворяет
лишь соединения шестивалентного урана, нужно добавлять ещё и оксиды (MnO2,
соли трёхвалентного железа и др.), чтобы перевести четырёхвалентный уран в
шестивалентный. На следующей стадии уран отделяют из примесей. Для этого
раствор отфильтровывают, а иногда непосредственно с пульпы экстрагируют соли
урана органическими растворителями (диэтиловый эфир, трибутилфосфат). Из
нитратного раствора лучше всего экстрагировать уран в керосиновом растворе ТБФ.
При этом в органическую фазу переходит комплекс - UO2(NCS)2·2ТБФ.
Когда раствор, который состоит из солей урана,
отфильтрован от нерастворимого осадка, уран можно выделить осаждением
гидроксидами (в виде (NH4)2U2O7)
или пероксидом водорода (в виде UO4·2H2O).
Если в урановой руде присутствует примесь таких
минералов, как доломит, магнезит и т. п., а они при действии кислоты на
урановую руду нейтрализуют большое количество кислоты, целесообразнее
использовать карбонатный способ разложения урановой руды. Основным реагентом
для этого является водный раствор соды, который переводит уран в растворимое
комплексное соединение - [UO2(CO3)3]4−.
Данное соединение является стабильным в водных растворах при невысоких
концентрациях гидроксид-ионов. Использование карбоната натрия имеет
преимущество, потому что при его использовании, кроме урана, практически все
другие металлы остаются в виде осадка. Преимущество карбонатного способа
разложения урановых руд относительно кислотного состоит в отсутствии
коррозийных характеристик рабочих растворов. Недостатком этого способа является
то, что в присутствии карбоната натрия соединения четырёхвалентного урана не растворяются.
Поэтому для полного очищения урана руду обрабатывают содой при нагревании и
единовременной подачи под давлением кислорода:

Из данного уравнения видно, что наилучшим
растворителем урана при карбонатной переработке является смесь карбоната с его
бикарбонатом. Когда берется средний карбонат, то из-за высокого pH раствора
часть урана может выпасть в осадок в виде диураната. Из карбонатных растворов
диуранат выделяют, восстанавливая его водородом в присутствии никеля. При этом
получается нерастворимый тетракарбонат урана [4].
Перспективным является также способ с
использованием высокополимерных смол в качестве полиэлектролитов. В смолах
происходит обмен ионов, в результате чего выделяется уран. С помощью данного
способа можно выделить уран как из кислых, так и из основных (карбонатных)
растворов. Поскольку, по сравнению с остальными трансурановыми металлами, уран
легче создает анионные комплексы, например [UO2(SO4)2]2−,
[UO2(CO3)3]4−, то при
выделении в реакции ионного обмена урана лучше пользоваться анионитами с
четвертинными аммонийными группами R4N+A−.
Из анионита уран вымывают раствором нитрата
аммония или азотной кислоты.
После разделения уран выделяют в виде нитрата
уранила - UO2(NO3)2·6H2O. Из него
при нагревании получится оксид урана(VI), который при восстановлении водородом
переходит в диоксид:
3
+ H2
→ UO2
+ H2O
При действии фтороводорода на диоксид урана
добывают тетрафторид урана, который потом можно восстановить магнием до
металлического урана:
4HF
+ UO2
→ UF4
+ 2H2O
Для выделения плутония из продуктов расщепления
радиоактивных материалов облученный нейтронами уран растворяют в азотной
кислоте. К полученному раствору добавляют восстановитель (FeSO4, или
H2O2), который переводит плутоний из степени окисления +6
в +4, а уран остается в виде нитрата уранила (UO2(NO3)2).
После обработки восстановителем раствор нейтрализуют карбонатом аммония до
pH=8. При этом Pu4+ переходит в осадок.
Можно воспользоваться и другим методом. После
восстановления нитратного раствора газообразной серой добавляют плавиковую
кислоту и осаждают ионы лантана, а вместе с этим осаждаются и фториды плутония
и нептуния (Э4+). После фильтрования и промывания осадок фторидов
обрабатывают броматом калия для окисления нептуния до  ,
который переходит в раствор.
,
который переходит в раствор.
Часто для разделения плутония и других
актиноидов, начиная с урана, пользуются экстракцией трибутилфосфатом. Сначала
экстрагируют нитраты Pu4+ и U6+, а потом экстрагент
приводят в контакт с гидразином и вымывают восстановленный плутоний [6].
4. Физические свойства
С физической точки зрения актиноиды - типичные
металлы. Все они мягкие, имеют серебристый цвет, достаточно высокую плотность и
пластичность. Некоторые из этих металлов можно разрезать ножом. Торий по
твёрдости подобен мягкой стали. Из нагретого чистого тория можно раскатывать
листы, вытягивать проволоку. Торий почти вдвое легче урана и плутония, но
твёрже их обоих. Все актиноиды в той или иной степени радиоактивны. Из них
только торий и уран встречаются в природе в заметных количествах [3].
|
Физические
свойства некоторых актиноидов [1]
|
|
Название
металла
|
Плотность,
г/см³, при 25
°C
|
Температура
плавления, °С
|
Цвет
|
Поперечное
сечение захвата нейтронов, барн
|
Радиус
атома, Å
|
|
Торий
|
11,78
|
1750
|
Серебристый
|
7,57
|
1,798
|
|
Протактиний
|
15,37
|
-
|
Серебристый
|
-
|
-
|
|
Уран
|
19,05
|
1132±1
|
Серебристо
- белый
|
7,68(природная
смесь)
|
1,762
|
|
Нептуний
|
20,25
|
640±1
|
Серебристый
|
-
|
-
|
|
Плутоний
|
19,84
|
637
|
Серебристо
- белый
|
-
|
1,58
|
|
Амерций
|
11,7
|
1100
|
Серебристый
|
-
|
1,82
|
|
Кюрий
|
7,0
|
1345±50
|
Серебристый
|
-
|
1,74
|
|
Берклий
|
14,78
|
1025
|
-
|
-
|
Для всех актиноидов, характерен полиморфизм.
Плутоний имеет семь полиморфных модификаций, а уран, нептуний и калифорний -
три. Кристаллические структуры протактиния, урана, нептуния и плутония по своей
сложности не имеют аналогов среди лантаноидов и более похожи на структуры 3d-переходных
металлов. Лёгкие актиноиды в точке плавления имеют объёмно-центрированную
решётку, а начиная с плутония - гранецентрированную.
Температура плавления актиноидов изменяется при
увеличении числа f-электронов нелинейно. С ростом числа данных
электронов температура плавления сначала (от протактиния к плутонию)
понижается, а затем (от америция к кюрию) повышается. Уникально низкую
температуру плавления у плутония объясняют гибридизацией 5f- и 6d-орбиталей
и образованием направленных связей в этих металлах. От кюрия до эйнштейния
температура плавления снова понижается, а затем возрастает до максимума у
фермия. Аналогичная кривая температур плавления повторяется от фермия до
лоуренсия.
Для актиноидов от америция до эйнштейния при
любых температурах ниже температуры плавления характерны гранецентрированная
кубическая и гексагональная плотнейшие упаковки. Для трансурановых элементов
сходство с металлическими лантаноидами усиливается - при комнатной температуре
кристаллические структуры актиноидов от америция до калифорния и лёгких
лантаноидов аналогичны [6].
5. Химические свойства
Все актиноиды являются химически активными
веществами.
f-элементы
обладают высокой химической активностью по отношению к кислороду, галогенам,
азоту, сере. Так, торий, уран и нептуний уже при комнатной температуре медленно
окисляются на воздухе. Чистый плутоний, оставленный на воздухе является
пирофорным.
Актиноиды склонны к гибридизации. Особенно это
характерно для тех элементов, атомы которых имеют малое количество 5f-электронов.
Объясняется это тем, что энергии 5f-, 7s- и 6d-подуровней
очень близки [3].
Торий.
Конфигурация внешних электронов атома 6d27s2. Торий
характеризуется высокой химической активностью. Хотя торий относится к
семейству актиноидов, однако по некоторым свойствам он близок также к элементам
второй подгруппы IV группы периодической системы Менделеева - Ti, Zr, Hf.
Для тория, как и для элементов четвёртой группы,
характерна степень окисления +4. Из-за отсутствия электронов на 6d- и 4f-орбиталях
соединения четырёхвалентного тория не имеют окраски. В растворах солей тория
при pH < 3 преобладают катионы [Th(H2O)8]4+.
Ион Th4+ имеет необычайно большой радиус; в зависимости от координационного
числа он может принимать значения от 0,95 до 1,14 Å.
Именно с данной характерной особенностью связана низкая способность солей тория
к гидролизу. Отличительной способностью солей тория считается их высокая
растворимость не только в воде, но и в полярных органических растворителях.
+ 4H2O(пар)
= Th(OH)4 + 2H2 [1].
На воздухе при комнатной температуре торий
окисляется незначительно, покрываясь защитной пленкой черного цвета; выше 400°С
быстро окисляется с образованием ThO2 - единственного оксида, который
плавится при 3200 °С и обладает высокой химические устойчивостью.
Th + O2
= ThO2.
С водородом при температурах выше 200°С торий
реагирует с образованием порошкообразных гидридов ThH2, ТhН3
и другого состава:
Th + nH2
= 2ThHn.
В вакууме при температуре 700-800°С из тория
можно удалить весь водород.
При нагревании в азоте выше 800°С образуются
нитрид Th3N4,
который разлагается водой с выделением аммиака:
3Th
+ 2N2
= Th3N4.
С углеродом образует два карбида - ThC и ThC2;
они разлагаются водой с выделением метана и ацетилена.
Сульфиды ThS, Th2S3, Th7S12,
ThS2 могут быть получены при нагревании металла с парами серы
(600-800°С):
+ nS
= ThSn [2].
Торий реагирует с фтором при комнатной
температуре, с остальными галогенами - при нагревании, с образованием
галогенидов типа ThHal4.
Наиболее важное промышленное значение из галогенидов имеют фторид ThF4
и хлорид ТhCl4. Фторид получают действием HF на ThO2 при
повышенных температурах; хлорид - хлорированием смеси ThO2 с углем
при повышенных температурах. Фторид малорастворим в воде и минеральных
кислотах; хлорид, бромид и иодид - гигроскопичны и хорошо растворимы в воде.
Для всех галогенидов известны кристаллогидраты, выделяемые кристаллизацией из
водных растворов [6].
Компактный торий при температурах до 100°С
медленно корродирует в воде, покрываясь защитной оксидной пленкой. Выше 200°С
активно реагирует с водой с образованием ThO2 и выделением водорода.
Металл пассивирует в азотной, серной и плавиковой кислотами, не реагирует со
щелочами, гидратом аммиака, легко растворяется в соляной кислоте и царской
водке.
Th + 4HCl (конц.,
гор.)
= ThCl4 + 2H2↑,
Th + 4HNO3 (конц.)
+ 12HCl (конц.)
=
3ThCl4
+ 4NO↑
+ 8H2O
[2].
Соли тория образуются в виде кристаллогидратов.
Растворимость солей в воде различна: хорошо растворимы нитраты Th(NO3)4·nH2O;
труднорастворимы сульфаты Th(SO4)2·nH2O,
основной карбонат ThOCO3·8Н2О, фосфаты Th3(PO4)4·4Н2О
и ThP2O7·2H2O; практически нерастворим в воде
оксалат Th(C2O4)2·6H2O. Растворы
щелочей слабо действуют на торий. Гидрооксид Th(OH)4 осаждается из
солей тория в интервале рН = 3,5-3,6 в виде аморфного осадка. Для ионов Th4+
в водных растворах характерна ярко выраженная способность к образованию
комплексных соединений и двойных солей [6].
Протактиний.
Конфигурация внешних электронов атома 5f26d17s2.
Протактиний имеет два валентных состояния - V
и IV. В отличие от
стабильного пятивалентного состояния четырёхвалентный протактиний в растворах
чрезвычайно легко окисляется до Pa5+ кислородом воздуха. В
зависимости от условий окисления могут быть получены оксиды РаО2, Pa6O14,
Ра2О5, а также три фазы переменного состава. Оксид Ра2O5
можно сплавить с кислым сульфатом калия (проявляет основные свойства) и с
оксидами щелочных и щелочноземельных элементов (кислотные свойства Ра2О5):
4Pa + 5O2 = 2Pa2O5
[1].
Пассивируется в воде, концентрированных соляной
и азотной кислотах. Не реагирует со щелочами, гидратом аммиака.
Протактиний является восстановителем; реагирует
с разбавленной соляной кислотой, неметаллами, аммиаком:
Pa + 4HCl
(разб.)
= PaCl4
+ 2H2↑,
2Pa + 3H2 = 2PaH3
(t = 250-300°С),+ 2NH3
= PaN2 + 3H2 (t = 800°С)
[2].
Четырёхвалентный протактиний по химическим
свойствам является близким аналогом UIV и тория. Известно, что PaVI
образует много кристаллических соединений, изоструктурных с соединениями UIV
и тория. Фториды, фосфаты, гипофосфаты, иодаты и фениларсонаты PaIV
нерастворимы в воде и в достаточно разбавленных кислотах [6].
2O5
+ 8HF + H2 = 2PaF4 ↓ + 5H2O
(t = 350-500°С) [2].
Протактиний образует растворимые карбонаты. По
гидролитическим свойствам пятивалентный протактиний близок к TaV и
NbV. Сложность химического поведения протактиния является следствием
появления у атомов данного элемента 5f-орбит [6].
Уран.
Конфигурация внешней электронной оболочки атома урана 7s26dl5f3.
Уран относится к реакционноспособным металлам, в соединениях проявляет степени
окисления +3, +4, + 5, +6, иногда +2; наиболее устойчивы соединения U (IV) и U
(VI). На воздухе медленно окисляется с образованием на поверхности пленки
оксида (IV), которая не предохраняет металл от дальнейшего окисления. В
порошкообразном состоянии уран пирофорен и горит ярким пламенем. С кислородом
образует оксид (IV) UO2, оксид (VI) UО3 и большое число
промежуточных оксидов, важнейший из которых U3O8. Эти
промежуточные оксиды по свойствам близки к UO2 и UO3 [1].
3U
+ 4O2
= ( )O8
[2].
)O8
[2].
При высоких температурах UO2 имеет
широкую область гомогенности от UO1, 60 до UO2,27. С
фтором при 500-600°С образует тетрафторид UF4 (зеленые игольчатые
кристаллы, малорастворимые в воде и кислотах) и гексафторид UF6
(белое кристаллическое вещество, возгоняющееся без плавления при 56,4 °С); с
серой - ряд соединений, из которых наибольшее значение имеет US (ядерное
горючее) [1].
+ 2F2 = UF4, US3, US2, U2S3, U3S5
(t = 500-800°С).
US3, US2, U2S3, U3S5
(t = 500-800°С).
При взаимодействии урана с водородом при 220 °С
получается гидрид UH3; с азотом при температуре от 450 до 700 °С и
атмосферном давлении - нитрид U4N7, при более высоком
давлении азота и той же температуре можно получить UN, U2N3
и UN2; с углеродом при 750-800 °С - монокарбид UC, дикарбид UC2,
а также U2С3; с металлами образует сплавы различных
типов, быстро реагирует с пероксидом водорода в щелочной среде:
U + 3H2 = 2UH3,
U + 7N2
= 2U4N7,
U + 2H2O2
(конц.) = U(OH)4↑.
Уран медленно реагирует с кипящей водой с
образованием UO2 и Н2, с водяным паром - в интервале
температур 150-250 °С; растворяется в соляной и азотной кислотах, слабо - в
концентрированной плавиковой кислоте:
+2H2O
 UO2↓
+ 2H2↑,
UO2↓
+ 2H2↑,
U + 4HCl
(конц.)
= UCl4
+ 2H2↑,
U + 14HNO3
(разб.) = 4UO2(NO3)2
+ 3N2O↑
+
7H2O
[2].
Для U (VI) характерно образование иона уранила
UO22+; соли уранила окрашены в желтый цвет и хорошо
растворимы в воде и минеральных кислотах; соли U (IV) окрашены в зеленый цвет и
менее растворимы; ион уранила чрезвычайно способен к комплексообразованию в
водных растворах как с неорганических, так и с органических веществами;
наиболее важны для технологии карбонатные, сульфатные, фторидные, фосфатные и
других комплексы. Известно большое число уранатов (солей не выделенной в чистом
виде урановой кислоты), состав которых меняется в зависимости от условий
получения; все уранаты имеют низкую растворимость в воде [6].
Нептуний.
Конфигурация трех внешних электронных оболочек атома Np 5s25p65d105f46s26d17s2;
при образовании его химических соединений участвуют 5f-, 6d- и 7s-электроны. По
химическим свойствам нептуний во многом сходен с ураном и плутонием. Во влажном
воздухе покрывается оксидной пленкой. Пассивируется в холодной воде,
концентрированных серной и азотной кислотах. Не реагирует со щелочами, гидратом
аммиака. В соединениях имеет степени окисления от +2 до +7. В растворах
нептуний образует ионы Np3+, Np4+, NpO2+,
NpO22+ и NpO53-. Наиболее
стабильными в растворах являются ионы NpV. В твёрдых соединениях
нептуний устойчив и проявляет валентность IV.
Ионы NpIII и NpIV, как и других актиноидов, существуют в
воде в качестве гидратированных катионов вышеуказанных ионов нептуния. NpIII
гидролизуется в слабощелочной среде. Металлический нептуний очень
реакционноспособен. Сильный восстановитель; реагирует с горячей водой, соляной
кислотой, разбавленными серной и азотной кислотами. Сильными окислителями
переводиться в оксокатионы. Катион Np3+ имеет темно-красную окраску,
катион Np4+ - желто-зеленую.
актиноид промышленный химический
физический
2Np + 6H2O(гор.)
= 2Np(OH)3↓(красн.)
+ 3H2↑,
Np + 2H2O(гор.)
+ O2
= Np(OH)4↓(серо-зел.),
Np + 6HCl
(разб.)
=
2NpCl3
+ H2↑,
Np + 4HCl
(разб.)
+ O2
= NpCl4
+ 2H2O,
2Np + 10HNO3 (разб.)
= 2Np(NO3)4 + N2O↑ + 5H2O,
Np + 4HNO3 (разб.)
+ 5O2 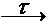 4(NpO2)NO3
+2H2O.
4(NpO2)NO3
+2H2O.
Ионы данного элемента отличаются высокой
склонностью к образованию координационных соединений и гидролизу [2].
Плутоний.
Конфигурация трех внешних электронных оболочек атома Pu 5s25p65d105f66s26p27s2.
Химические свойства плутония во многом сходны со свойствами его
предшественников в периодической системе - ураном и нептунием. Во влажном
воздухе покрывается оксидной пленкой. Пассивируется в холодной воде,
концентрированной серной кислоте, азотной кислоте. Не реагирует со щелочами,
гидратом аммиака [1].
В химическом отношении плутоний является весьма
активным элементом. Плутоний образует соединения со степенями окисления от +2
до +7. Сильный восстановитель; реагирует с горячей водой, соляной кислотой,
разбавленными серной и азотной кислотами. В соединениях с галогенами плутоний
обычно проявляет степень окисления +3, но известны также галогениды PuF4,
PuF6 и РuСl4. Сильными окислителями переводиться в оксокатионы.
Катион Pu3+
имеет сине-фиолетовую окраску, катион Pu4+
- жесто-коричневую.
Pu + 6H2O
(гор.)
= 2Pu(OH)3↓(голуб.)
+ 3H2↑,
Pu + 2H2O
(гор.)
+ O2
= Pu(OH)4
↓(зел.),
Pu + 6HCl
(разб.)
= 2PuCl3
+ 3H2↑,
Pu + 2Cl2 = PuCl4,
Pu + 3H2SO4 (разб.)
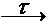 Pu2(SO4)3
+ 3H2↑,+ 4HNO3 (разб.,
гор.)
+ O2
Pu2(SO4)3
+ 3H2↑,+ 4HNO3 (разб.,
гор.)
+ O2 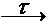 Pu(NO3)4
+ 2H2O,+ 2HNO3 (разб.)
+
O3
= PuO2(NO3)2
+ H2O.
Pu(NO3)4
+ 2H2O,+ 2HNO3 (разб.)
+
O3
= PuO2(NO3)2
+ H2O.
Плутоний заметно реагирует с водородом даже при
25-50 °C:
Pu + 3H2
= 2PuH3
(черн.) [2].
Данный элемент обладает сильным потенциалом к
образованию интерметаллических соединений. В растворах плутоний существует в
формах Pu3+, Pu4+, РuО2 (плутоноил-ион), PuO2+
(плутонил-ион) и PuO53- , отвечающих степеням окисления
от +3 до +7. Указанные ионы (кроме РuО3-5) могут
находиться в растворе одновременно в равновесии. Ионы плутония всех степеней
окисления склонны к гидролизу и комплексообразованию [1].
Америций.
Электронная конфигурация внешних электронных оболочек атома 5f76d07s2.
В соединения америций проявляет степени окисления от +2 до +6.
Двухвалентный америций получен только в сухих соединениях и в неводных
растворах (ацетонитриле). Состояния окисления +3, +5 и +6 характерны для водных
растворов америция, хотя известно большое количество соответствующих им твёрдых
соединений. В водной среде Аm4+ существует только как комплексный
фторидный ион, в других условиях быстро восстанавливается водой до Аm3+.
При окислении Аm3+ в слабощелочной среде можно получить 5-валентный
Америций в виде иона AmO2+. В сильнокислых растворах
желтый ион АmО2+ диспропорционирует, давая Аm3+
и желто-коричневый ион шестивалентного америция, АmО22+.
Последний образуется и при окислении кислых растворов АmО2+
или при действии на Аm3+ некоторых сильных окислителей. Как 241АmО2+,
так и 241АmО22+ в водных растворах энергично
восстанавливаются под действием собственного сильного α-излучения.
Наиболее устойчивой валентностью америция в водном растворе является +3, в
твёрдых соединения +3 и +4. Растворы Аm3+ окрашены в ярко-розовый
цвет. Для 4-валентного америция известны 3 твердых соединения (AmO2,
AmF4 и KAmF5) [1].
Реакционноспособный металл; реагирует с
кислородом, во влажном воздухе покрывается оксидной пленкой. Сильный
восстановитель; реагирует с горячей водой, разбавленными кислотами. Сильными
окислителями переводится в оксокатионы. Ион Am3+ в разбавленном
растворе имеет розовую окраску, заметно гидролизуется.
2Am +6H2O (гор.)
= 2Am(OH)3↓ + 3H2↑,
Am + 6HCl (разб.)
= 2AmCl3 + 3H2↑,
Am + nH2 = 2AmHn,+
O2 = AmO2 (черн.),
AmO2 + H2 = Am2O3
(желт.)
+ H2O,
Am + 3F2 = 2AmF3 (роз.),+
2F2 = AmF4 (оранж.)
[2].
Кюрий.
Электронная конфигурация внешних электронных оболочек 5f76d17s2.
Кюрий существует в четырёхвалентном состоянии в твёрдых соединениях (CmO2,
CmF4), а в водном растворе - только в виде неустойчивого фторидного
комплексного соединения. Наиболее типичная степень окисления кюрия +3; в
частности, синтезированы Cm2О3, CmCl3 и другие
[1].
Реакционноспособный металл; реагирует с кислородом,
во влажном воздухе покрывается оксидной пленкой. Сильный восстановитель;
реагирует с горячей водой, разбавленными кислотами. Ион Cm3+ в
растворе бесцветен, заметно гидролизуется.
Cm + 6H2O
(гор.)
= 2Cm(OH)3↓
+ 3H2↑,
Cm + 6HCl
(разб.)
= 2CmCl3
+ 3H2↑,
Cm + 4HNO3 (разб.)
= Cm(NO3)3 + NO↑ +2H2O,
Cm + (2+x)H2 = 2CmH2+x,
Cm + 3O2 = 2Cm2O3
(зел.),
Cm + 2O3 = 3CmO2 (черн.),+
HNO3 + 3HF = CmF3↓ + NO↑
+ 2H2O [2].
Берклий.
Электронная конфигурация внешних электронных оболочек 5f96d07s2.
Берклий, наряду с валентностью +3, также проявляет валентность +4, более
устойчивую чем у кюрия; ей отвечает ряд твёрдых соединений (фторид, диоксид
берклия) [1].
Реакционноспособный металл; реагирует с
кислородом, во влажном воздухе покрывается оксидной пленкой. Сильный
восстановитель; реагирует с горячей водой, разбавленными кислотами. Ион Bk3+
в разбавленном растворе имеет зеленую окраску, заметно гидролизуется.
Bk + 6H2O
(гор.)
= 2Bk(OH)3↓
+ 3H2↑,
Bk + 6HCl
(разб.)
= 2BkCl3
+ 3H2↑,
Bk + 4HNO3 (разб.)
= Bk(NO3)3 + NO↑ +2H2O,+ O2
= BkO2 (желт.),
BkO2 + H2 = Bk2O3
(зел.)
+ H2O,+ HNO3 + 3HF = BkF3↓ +
NO↑ + 2H2O [2].
Калифорний. Реакционноспособный
металл; реагирует с кислородом, во влажном воздухе покрывается оксидной
пленкой. Сильный восстановитель; реагирует с горячей водой, разбавленными
кислотами. Ион Cf3+
в растворе бесцветен, заметно гидролизуется.
2Cf
+ 6H2O
(гор.)
= 2Cf(OH)3↓
+ 3H2↑,
Cf + 6HCl
(разб.)
= 2CfCl3
+ 3H2↑,
Cf + 4HNO3 (разб.)
= Cf(NO3)3 + NO↑ +2H2O,
Cf + 3O2 = 2Cf2O3,+
O2 = CfO2,+ 4HBr (конц.)
+ Zn = CfBr2 (желт.)
+
ZnBr2
+ 2H2↑
[2].
У калифорния, эйнштейния и фермия единственной
достоверной валентностью является +3. Доказано наличие двухвалентного состояния
у менделевия и нобелия, причем у нобелия оно является более устойчивым, чем
трёхвалентное. Валентности двух последних трансплутониевых элементов -
лоуренсия и резерфордия - очень скудны; известно, что лоуренсий как в растворе,
так и в сухих соединениях проявляет только валентность +3; а резерфордий в виде
хлорида ведет себя подобно гафнию, то есть, по-видимому, четырёхвалентен [6].
6. Применение
Большинство актиноидов, до америция
включительно, нашли применение в различных областях науки и техники, например
приборостроении (датчики дыма), космических технологиях. Однако наиболее
массовым и значимым является применение актиноидов для создания ядерного оружия
и применение в качестве топлива в ядерных реакторах, в обоих случаях
используется свойство некоторых из актиноидов выделять колоссальную энергию при
ядерной реакции - делении ядра, которая при определённых условиях может быть
цепной, то есть самоподдерживающейся [6].
Для атомной энергетики очень важным является
уран, особенно его изотоп - уран-235, применяющийся в наиболее распространённых
реакторах на тепловых нейтронах, содержание которого в природном уране не
превышает 0,72 %. Этот изотоп имеет высокое поперечное сечение захвата тепловых
нейтронов, поглощая которые 235U делится с выделением большого
количества энергии. Превращающаяся в тепло энергия на один акт деления (200
МэВ), в перерасчёте на 1 г прореагировавшего 235U, даёт примерно 1
МВт•сут. Очень ценным является сопровождение деление урана-235 выделением
большего числа нейтронов, чем их затрачивается. При достижении критической
массы урана-235 - 0,8 кг - происходит самоподдерживающаяся цепная ядерная
реакция. Как правило, ядро урана делится на 2 осколка с высвобождением 2 - 3
нейтронов, например:
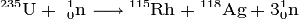
Также перспективным в ядерной энергетике
является использование ядерного цикла, основанного на применении тория-232 и
полезного продукта, образующегося при его делении - урана-233.
Выделение нейтронов при вынужденном делении
урана важно не только для поддержания цепной ядерной реакции и получения
большого количества энергии, но и для синтеза более тяжёлых актиноидов.
Уран-239 распадается посредством β-распада
и образует плутоний-239, который подобно урану-235 способен к спонтанному
делению. Первые в мире ядерные реакторы предназначались не для мирных нужд
энергетики, а для наработки плутония-239, с целью использования его для
создания ядерного оружия [1].
Торий применяется в качестве легирующего
компонента сплавов магния с цинком. Магниевые многокомпонентные сплавы с
примесью тория из-за лёгкости и прочности, высокой температуры плавления и
пластичности широко используются в авиационной промышленности и в производстве
снарядов. Металлический торий имеет хорошую способность в электронной эмиссии.
Лампы с ториевыми электродами имеют малый начальный потенциал и долго не
выходят из строя. Относительное содержание изотопов тория и урана часто
применяется для оценки возраста звёзд.
В перспективе изотоп плутоний-238
рассматривается исследователями в качестве автономного источника энергии,
поскольку его ядерные превращения сопровождаются выделением большого количества
тепла. В теории его применение может распространиться и на костюмы космонавтов
и водолазов. Но в виду его высокой цены (1 г изотопа стоит примерно 1000
долларов) его применение ограничено. Этот изотоп был использован на некоторых
спутниках Земли в термобатареях и для дистилляции воды на космических кораблях.
На американском космическом корабле "Аполлон-11" был размещён
маленький нагреватель, источником энергии которого являлся плутоний-238; он
включался при облетании затемнённой части Луны.
Для тех же целей, что и для плутония-238, можно
применять кюрий-242. Также некоторые изотопы калифорния имеют способность к
спонтанному делению. Поскольку критическая масса калифорния мала, то считается,
что в будущем из него можно будет изготовлять заряды для атомных пуль.
Отделение плутония от урана, которое происходит
с помощью химических реакций, намного проще, чем разделение изотопов урана, что
делает перспективным использование оружейного плутония из боеголовок,
отработавших свой срок, в качестве топлива в смешанном с торием и ураном виде,
так называемом MOX-топливе.
Америций-241 нашел применение в диагностике
нарушений щитовидной железы. Миниатюрные электрические генераторы, использующие
238Pu ,
разработаны для применения в кардиостимуляторах. Обычный ядерно-энергетический
кардиостимулятор содержит около 160 мг 238Pu,
заключенного в корпус из сплава тантала, иридия и плотины. В мире широко
используются несколько тысяч таких приборов.
Широкое применение актиноиды, такие как
плутоний, уран, нашли и в ядерном оружии. В 20-м веке было проведено большое
количество испытаний ядерных бомб. К концу 20-го века массовые испытания
ядерного оружия прекратились в связи с улучшением международной обстановки и
массовым сокращением количества ядерных вооружений в мире [6].
7. Токсичность
При попадании протактиния в организм он склонен
к накоплению в почках и костях. Было установлено, что максимальная безопасная
доза протактиния при попадании внутрь организма человека составляет 0,03 мкКи;
данная доза соответствует 0,5 мкг 231Pa. Данный изотоп, который
содержится в воздухе в виде аэрозолей, в 2,5×108
раз токсичнее синильной кислоты (при одинаковых концентрациях).
Плутоний является самым ядовитым из всех
актиноидов, так как при поступлении с воздухом, пищей или в кровь через рану он
оседает в лёгких, печени и костях. Лишь примерно 10 % попадает в другие органы.
Атомы плутония задерживаются в организме десятилетиями. Это объясняется тем,
что у изотопов плутония большие периоды полураспада, причём часть из них
испускает ионизирующее α-излучение,
которое повреждает окружающие клетки. Отчасти долгое выведение плутония из
организма объясняется плохой растворимостью в воде. Исследования на животных
показали, что летальной дозой плутония является несколько миллиграмм плутония
на килограмм ткани. ЛД50 в течение 30 дней для собак после
внутривенного введения плутония составляет примерно 0,32 миллиграмма на 1 кг
ткани. На основании этих исследований была получена примерная оценка летальной
дозы для человека весом 70 кг - 22 мг. При поступлении через органы дыхания
поглощение должно быть примерно в 4 раза больше. Однако Робертом Стоуном, были
сделаны наиболее точные расчёты безопасной дозы плутония в человеческом
организме. Плутоний в 50 раз менее токсичен, чем радий, и поэтому допустимое
содержание плутония в организме, по его расчётам, должно составлять 5 мкг, или
0,3 мкКи. Примечательно, что такое количество плутония трудно рассмотреть даже
в современном микроскопе. Вскоре, после испытаний таких доз на животных, данная
доза была уменьшена в 5 раз и стала составлять 1 мкг, или 0,06 мкКи. Однако и
эта доза была уменьшена, и стала составлять 0,65 мкг, или 0,04 мкКи [6].
Уран и его соединения высоко токсичны. Особенно
опасны аэрозоли урана и его соединений. Для аэрозолей растворимых в воде
соединений урана ПДК в воздухе 0,015 мг/м3, для нерастворимых форм
урана ПДК 0,075 мг/м3. При попадании в организм уран действует на
все органы, являясь общеклеточным ядом. Молекулярный механизм действия урана
связан с его способностью подавлять активность ферментов. В первую очередь
поражаются почки (появляются белок и сахар в моче, олигурия). При хронической
интоксикации возможны нарушения кроветворения и нервной системы
[1].
Список литературы
1. Неорганическая химия: в 3 т.
/ под ред. Ю. Д. Третьякова. Т. 3: Химия переходных элементов. Кн. 2: учебник
для вузов / [А. А. Дроздов, В. П. Зломанов, Г. Н. Мазо, Ф. М. Спиридонов]. -
М.: Издательский центр "Академия", 2007. - 400с.
2. Лидин Р. А., Молочко В. А.,
Андреева Л. Л. Химические свойства неорганических веществ / Под ред. Р. А.
Лидина. - 5-е изд., стер. - М.: КолосС, 2006. - 480с.
. Ахметов Н. С. Общая и
неорганическая химия. Учебник для вузов. - 4-е изд., исп. - М.: Высшая школа,
Издательский центр "Академия", 2001. - 743с.
. Карапетьянц М. Х., Дракин
С. И. Общая и неорганическая химия, учебное пособие для вузов. - М.: Химия,
1981. - 632с.
. Степин Б. Д., Цветков А. А.
Неорганическая химия: Учебник для хим. и химико-технол. спец. вузов. - М.:
Высшая школа, 1994. - 608с.
. http://ru.wikipedia.org/wiki/Актиноиды