|
Місцевий анестетик
|
Гіпотензія, брадікардія, %
|
Після пункційцний головний біль, %
|
Мозаїчний блок
|
М’язовий дріж
|
|
Лідокаїна гідрохлорид 2%
|
19
|
2,66
|
15
|
18
|
|
Бупівакаїна гідрохлорид 0,5%
|
10
|
3,33
|
12
|
23,33
|
|
Маркаін (бупивакаіна гідрохлорид
0,5%)
|
6
|
2
|
5,33
|
10,66
|
|
Бупивакаїн Агетан (бупівакаїна
гідрохлорид 0,5%)
|
10
|
5
|
5
|
15
|
|
Наропін 0,75% (ропівакаїна
гідрохлорид)
|
0
|
0
|
0
|
0
|
|
Наропін 1% (ропівакаїна
гідрохлорид)
|
0
|
0
|
0
|
0
|
1.4 Синтез субстанції
ропівакаїну
Є декілька патентів
синтезу ропівакаїна [10, 11], розглянемо один з них.
Стадія 1 [10]
В реакційну посудину
завантажують піпеколоксилідид гідрохлорид (1,0 кг), ацетон (3,75 л) і воду
(0,85 л). Додали NaOH (водний) до pH > 11. Фази, що утворювались при цьому
розділяють, і органічну фазу розбавляють водою (1,4 л). Додали L - (-) -
дибензоіл винну кислоту (0,67 кг), розчинену в ацетоні (3,75 л). В розчин
внесли затравку для кристалізації. Суспензію кристалів охолоджують до 2°C. Кристали
збирають шляхом центрифугуровання і промивають ацетоном і потім метил
ізобутилкетоном. Продукт не сушать. Вологий кристалічний продукт екстрагують
метилізобутилкетоном (3,60 л) і розбавленим NaOH (2,60 л) при pH > 11. Фази
розділяють, органічну фазу промивають водою (0,6 л) і використовують
безпосередньо на наступній стадії.
Вихід (розраховано по
сухій речовині): ~ 0,39 кг (S) - пипеколоксилідида (~ 90%).
Стадія 2
До органічної фази,
отриманої на попередній стадії, додають K2CO3 (0,32 кг),
NaI (каталітичну кількість) і I-бромпропан (0,28 кг), також близько 5% води.
Суміш нагрівали шляхом кип’ятіння з зворотнім холодильником до завершення
реакції. Надлишок бромпропана видаляють шляхом дистиляції. Реакційну суміш
екстрагували водою (1,70 л). До органічної фази додають ацетон (1,70 л) і HCl
(водний) до pH ~ 2. В розчин додають затравку. Суспензію кристалів охолоджують
до 9°C. Кристали збирають шляхом центрифугування і промивають ацетоном.
Отриманий продукт використовували безпосередньо на наступній стадії і не
сушили.
Вихід (розрахований по
сухій речовині): 0,47 кг ропівакаїна гідрохлориду (~90%).Стадія 3
Ропівакаїн гідрохлорид,
отриманий на попередній стадії, суспензують в ацетоні (1,0 л) при температурі
кипіння ацетону. Додають воду (0,60 л). Отриману суміш фільтрують і додають
ацетон (7,6 л) при температурі > 40°C. В розчин вносять затравку для
кристалізації. Суспензію кристалів охолоджують до 3°C. Кристали збирають шляхом
центрифугування і промивають ацетоном. Кристали сушать при 30-40°C в вакуумі (<
20 кПа).иxід: ~ 0,42 кг моногідрата ропівакаїна гідрохлорида (~ 80%).хема
отримання ропівакаїну з б-піколін - 2,6 - ксилідіда[12]. Алкілуванням
останнього бромистим пропілом отримують відповідну сіль пірідінію. Цю сіль
відновлюють воднем в піперидинове похідне, використовуючи в якості каталізатора
окис платини з отриманням ропівакаїну:


1.5 Відомості про
місцеву анестезію та її види
Історія медицини
пов'язує появу місцевого знеболення з відкриттям в 1879 г. кокаїну Анрепом В.,
який встановив дію його на чутливі нервові закінчення всіх тканин, а не тільки
на слизисті оболонки [13].
У 1890 р. був
синтезований анестезин, який застосовується до цього часу у складі мазей і
присипок.
Початок плідного етапу в
розвитку місцевої анестезії ознаменував в 1905 р. синтез новокаїну Ейнгорном.
З'являються наукові праці, узагальнюючи досвід застосування місцевої анестезії
новокаїном: у 1912 р. монографія Бердяєва «Місцева анестезія», у 1915 р.
монографія Войно-Ясенецкого» Регіонарна анестезія». У 1922 А.В. Вишневский
приступив до розробки нового методу місцевого знеболення - інфільтративна
анестезія. Таким чином, був розроблений метод інфільтраційної анестезії, що
забезпечує прямий контакт анестезуючої речовини з нервом, - метод тугої
інфільтрації тканин. Цей метод був названий» Вишневським методом повзучого
інфільтрату».
У 1932 р. виходить книга
з узагальненням досвіду Вишнєвського «Місцеве знеболення по методу повзучого
інфільтрату».
У 1956 р. синтезований тримекаїн,
що володіє в три рази більшою анестезуючою активністю, чим новокаїн.
Місцева анестезія - це
оборотня втрата больової чутливості тканин на обмежених ділянках тіла.
Досягається унаслідок припинення проведення імпульсів по чутливих нервових
волокнах. У основі місцевої анестезії лежить блокада натрієвих каналів,
утворених макромолекулами білка, вбудованими в рідку фазу мембрани. Блокада
каналів є результатом взаємодії місцевих анальгетиків з рецептором в гирлі
каналу, для того, щоб досягти рецептора, місцевий анальгетик повинен проникнути
в ліпідну фазу мембрани. Чим краще він розчиняється в ліпідах мембрани, тим
ефективніше анестезія.
Таким чином, феномен
місцевої анестезії є складним динамічним процесом, який виражається як
функціональними, так і структурними оборотними змінами нервового субстрату під
впливом фармакологічних препаратів, що пригнічують збудливість і провідність в
нервових рецепторах і провідниках. Вплив, що стабілізує їх, на клітинну
мембрану виявляється не тільки на нервових клітинах і волокнах, але і на інших
клітинах організму, здібних до збудження.
Місцева анестезія
підрозділяється на вісім видів:
- Термінальна
- вона досягається нанесенням розчину анестетика на слизисту оболонку.
Застосовується в офтальмології, стоматології, отоларингології.
- Інфільтраційна
анестезія. Використовується метод «повзучого інфільтрату» по Вишнєвському:
пошарова, поступова інфільтрація тканин розчином місцевого анастетика 0,25%
концентрації. Покази: видалення поверхневих пухлин, обробка ран, розтин абсцесів,
дренування гематом. Протипоказання: некрози, флегмони, інфекції.
- Реґіонарна
анестезія це введення розчинів анестетиків в ділянку крупних нервових
стовбурів, сплетень, корінців і спинного мозку, що дозволяє добитися зниження
больової чутливості у відповідній зоні іннервації нервового стовбура, що
блокується, або сплетення. При виконанні провідникової анестезії необхідно
керуватися наступними правилами:
) прагнути
вводити анестетик периневрально;
) систематично
здійснювати аспіраційную пробу, щоб виключити попадання розчину в судину;
) підводити
голку до стовбура нерва перпендикулярно, строго дотримувати концентрацію
розчину.
Розрізняють реґіонарну
анестезію: на голові, стволову, міжреберну, паравертебральну і сакральну
(різновид паравертебральної).
- Спинномозкова
(субарахноїдальна) анестезія досягається введенням розчину анестетика в
субарахноїдальний простір, після проколу твердої мозкової оболонки в каудальной
частині поперекового відділу хребта. Використовується спеціальна голка з
мандреном.
- Епідуральная
анестезія заснована на блокаді спинномозкових нервів і їх корінців
місцевоанестезуючим розчином, введеним в епідуральний простір.
- Внутрішньовенна
анестезія застосовується для операцій на диситальних ділянках кінцівок. Ця
анестезія заснована на локальній дії анестетика, введеного у вену кінцівки
нижче накладеного джгута. Місцевоанестезуюча речовина проникає в тканини
завдяки дифузії, діє на нервові закінчення і стовбури.
- Внутрішньокісткова
анестезія може використовуватися при операціях на кінцівках. Для цього
накладають джгут до зникнення пульсу, а кінцівки додають підвищене положення. У
місці введення голки в кістковий виступ проводять знеболення шкіри і підшкірної
клітковини. Для внутрішньокісткового введення використовують голки Кассирського,
укорочені для спинномозкової пункції з мандреном. Голку просувають обертальними
рухами крізь спорнгіозу в губчасту речовину.
- Анестезія
фасціальних футлярів. Цей вид анестезії застосовується для екстреного
знеболення, запобігання шоку при переломах. Основним принципом цього знеболення
є введення анестетика у фасціальні футляри кінцівки вище місця перелому.
Анестезія здійснюється з двох точок: у передню і задню групу м'язів. Цей метод
активно застосовувався в роки Великої Вітчизняної війни.
1.6 Вимоги до інгрідієнтів
препарату
Ропівакїну гідрохлорид
[5]
Хімічна назва: (S) - (-)
- 1-пропіл-піперідин-2-карбонової кислоти (2,6 - диметил-фенил) - амід
гідрохлорид моногідрат.
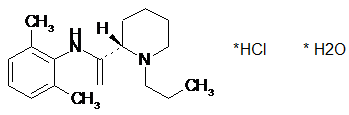
Формула (S) - (-)
- 1-пропіл-піперідин-2-карбонової кислоти (2,6 - диметил-фенил) - амід
гідрохлориду моногідрату
17H27ClN2O, H2O Mr=328,9.
Опис.
Білий або майже білий кристалічний порошок.
Розчинність:
розчиняється в воді і в етанолі (96%), мало розчинний в метиленхлориді.
Ідентифікація.
Перша ідентифікація
A, C, D. Друга ідентифікація A, B, C.
Інфрачервона
абсорбційна спектрометрія.
Порівняння:
ропівакаїна гідрохлорид моногідрат.. Питоме обертання (2.2.7): -64.0 до 74.0
(суха речовина).
Змішати 2 мл
200г/л розчину гідрооксиду натрію R і 30 мл води R і довести до 100.0 мл
етанолом (96%) R (розчин А). Розчиняють 0,500г субстанції перевіряють і
розбавляють до 50,0 мл розчином А.
С. Субстанція дає
реакцію на хлориди.. Енатіомерна чистота (див. тести).
Випробовування
Розчин S.
Розчиняють 0,50г в воді без вуглецю діоксиду R і доводять до 25,0 мл тим самим
розчином.
Зовнішній вигляд
розчину. Розчин має бути прозорим. (2.2.1)
рН (2.2.3): 4.5
до 6.0 для розчину S.
Поглинання
(2.2.25): максимум 0,030 при 405 нм і максимальне 0,025 при 436 нм, розчин S
готують перед використанням.
Супровідні
домішки. Рідинна хроматографія (2.2.29)
Випробовуваний
розчин. 55 мг цієї субстанції довести до 20 мл рухомою фазою.
Розчин порівняння
(a). 1,0 мл випробовуваного розчину розбавити до 100,0 мл рухомою фазою. 1,0 мл
утвореного розчину довести до 10,0 мл рухомою фазою.
Розчин порівняння
(b). Розчиняють 5 мг речовини для контролю і 5 мг бупівакаїна гідрохлориду CRS
(домішка А) в рухомій фазі і доводять до 5 мл рухомою фазою. 1 мл утвореного
розчину доводять до 100 мл рухомою фазою.
Колонка:
розмір: l=0,15 м,
Ø=3,9 мм;
стаціонарна фаза:
сферична кінцевими силікагель для хроматографії R (4 мкм)
Рухома фаза:
суміш 1,3 мл 138 г./л розчину натрію дигідрофосфату R і 32,5 мл 89 г./л розчину
із динатрійгідрофосфат R доводять до 1000 мл водою R; змішати однакові об’єми
цього розчину (pH 8,0) і ацетонітрила R.
Витрата: 1,0
мл/хв.
Ін’єкція: 2 мкл.
Виявлення:
спектрофотометр при 240 нм.
Час роботи: в 2,5
рази більше часу утримання ропівакаїна. Відносна затримка з еталоном
ропівакаїна (час утримання = близько 6 хв): домішка А= близько 1,6.
Система придатності:
розчин порівняння (b): роздільна здатність: мінімум 6,0 між піками у зв’язку з
ропівакаїном і домішкою А.
Межа:
- домішка
А: не більше двох площ основного піку в хроматограмі з розчином порівняння (а)
(0,2%);
- невизначених
домішок: для кожної домішки, не більше чим площа основного піку на хроматограмі
отримані з розчином порівняння(а) (0,10%);
- всього:
не більше чим в 5 разів площі основного піку в хроматограмі розчину порівняння
(а) (0,5%);
- не
враховувати: в 0,5 разів більше площі основного піку хроматограмі розчину
порівняння (а).
Домішки H. Рідинна
хроматографія (2.2.29) як описано в тесті на супровідні домішки з наступними
модифікаціями.
Випробовуваний розчин.
розчиняють 0,100г субстанції доводячи рухомою фазою до 10,0 мл.
Розчин порівняння.
Розчинити 13,0 мг 2,6 - диетиланіліна гідрохлориду R в рухомій фазі і доводять
до 100,0 мл рухомою фазою. Довести 1,0 мл розчину до 100,0 мл рухомою фазою.
Довести 1,0 мл розчину до 10,0 мл рухомою фазою. Час утримування: домішка Н =
близько 2-3 хв.
Межа: домішки Н не
більше чим площа основного піку в хроматограмі розчину порівняння (10 частин на
мільйон).
Енантіомерна чистота.
Капілярний електрофорез (2.2.47): використовувати нормалізацію процедури.
Випробовуваний розчин.
Розчинити 50 мг субстанції в воді R і довести тим самим розчинником до 25 мл.
Розчин порівняння (а).
1.0 мл випробовуваного розчину доводять до 200,0 мл водою R.
Розчин порівняння (b).
Розчинити 1,5 мг субстанції і 1,5 мг ропівакаїна домішки G CRS в воді R і
довести до 100 мл тим же самим розчинником.
Капіляр:
матеріал: плавлений
кварц;
розмір: ефективна
довжина = близько 72 см, загальна довжина = 80 см, Ø=50 мкм.
Температура: 30°С.буфер:
підготувати 13,3 г/л розчину диметил-в-циклодекситрина R в 11,5 г/л розчину
фосфорної кислоти R, попередньо доведеним до рН 3.0 триетаноламіном R. Готовий
буфер фільтрують через 0,45 мкм мембранний фільтр безпосередньо перед
використанням.
Визначення: спектрометр
при 206 нм.
Предумова капіляр: промити
капіляр при 100 кПа водою R протягом 1 хв, з 0,1 М натрію гідроксиду протягом
10 хв і R водою протягом 3 хв. Якщо капіляр новий або сухий, збільшити
полоскання натрієм гідрооксидом до 30 хв.
Між перспективна
промивка: промити капіляри при 100 кПа водою R протягом 1 хв, з 0,1 М
гідроксиду натрію протягом 4 хв, R водою протягом 1 хв і при CZE буфера
протягом 4 хв.
Ін'єкція: під тиском (5
кПа) протягом 5 с.
Міграція: застосовувати
напруженості поля 375 В/см з початковою рампою 500 В/с і позитивної полярності
відповідній струму 40-45 мА.
Час роботи: 30 хв.
Система придатності:
дозвіл: мінімальне 3,7
між піками через нечистоту G (1-й пік) і (S) - ропівакаін в електроферограмі
розчину порівняння (b);
При необхідності
збільшити диметил-в-циклодекстрин в концентрації CZE буфера або змінювати рН
між2.9 та 3.1 або знизити температуру;
Ставлення сигналу /
шуму: не менше 10 для основних піків в електроферограмі отримані з посиланням
розчину (а).
Ліміт:
Домішки G: не більше 0,5
відсотка.
Важкі метали (2.4.8) не
більше 10 частин на мільйон
Розчинити 2,0г в суміші
15 об’ємів води R і 85 об’ємів метанолу Р і доводять до 20 мл тією ж сумішшю.
12 мл розчину звіряють з тестом В.
Вода (2.5.12): від 5,0%
до 6,0%, визначається на 100,0 г.
Сульфатна зола (2.4.14):
не більше 0,1%, визначається на 1,0 г.
Аналіз
Розчиняють 0,250 г. в
суміші 10 мл води і 40 мл етанолу (96%) R. Додають 5,0 мл 0,01М соляної
кислоти. Провести потенціометричне титрування (2.2.20), використовуючи 0,1 М
гідрооксиду Натрія. Читати об’єм доданий між двома точками перегину.
мл 0,1 М розчину
гідрооксиду натрію еквівалентно 31,09 мг C17H27ClN2O.
Домішки
Вказані домішки: A, G,
H.
Інші домішки
визначаються: B, C, D, E, F.
A. R=[CH2]3-CH3:
(S) - бупівакаїн,. R=H: (-) - (2S) - N - (2,6 - диметилфеніл) -2-карбоксамид,.
R=CH3: (-) - (2S) - N - (2,6 - диметилфеніл) - 1-метилпіперидин -2 -
карбонової кислоти ((S) - мепівакаїн),. R=C2H5: (-) -
(2S) - N - (2,6 - диметилфеніл) - 1-етилпіперидин-2-карбонової кислоти,.
R=CH(CH3)2: (-) - (2S) - N - (2,6 - диметилфеніл) - 1 -
(1-метілетіл) піперидин -2 - карбонової кислоти,
. (8aS) - 2 -
(2,6 - диметилфеніл) - 3,3 - диметилгексагідроімідазо [1,5 - a] піридин-1 (5H)
- он (ацетон аддукт),
. (+) - (2R) - N
- (2,6 - диметилфеніл) - 1-пропілпіперидин-2-карбоксамід ((R) - ропівакаїн),
H. 2,6 -
диметилаланін.
Натрію хлорид
[14]
(Natrii
chloridum)
NaCI М.м.
58.44
Натрію хлорид містить не
менше 99.0% і не більше 100.5% NaCl, у перерахунку на суху речовину.
Властивості
Опис. Кристалічний
порошок білого кольору, безбарвні кристали або білі крупинки.
Розчинність. Легко
розчинний у воді Р, практично не розчинний в етанолі Р.
Ідентифікація
А. Субстанція дaє
реакції на хлориди (2.З.1).
В. Субстанція дaє
реакції на натрій (2.З.1).
Випробування на чистоту
Крупинки субстанції
перед використанням розтирають.
Розчин S. 20.0 г.
субстанції розчиняють у воді, вільній від вуглецю діоксиду, Р, приготованій із
води дистильованої Р, і доводять об’єм розчину тим самим розчинником до 100.0
мл.
Прозорість розчину
(2.2.1). Розчин S має бути прозорим.
Кольоровість розчину
(2.2.2, метод ІІ). Розчин S має бути безбарвним.
Кислотність або
лужність. До 20 мл розчину S додають 0.1 мл розчину бромтимолового синього Р1;
забарвлення розчину має змінитися при додаванні не більше 0.5 мл 0.01 М розчину
кислоти соляної або 0.01 М розчину натрію гідроксиду.
Броміди. Не більше 0.01%
(100 ррт). До 0.5 мл розчину S додають 4.0 мл води Р, 2.0 мл розчину Фенолового
червоного Р2, 1.0 мл розчину 0.1 г./л хлораміну Р і вiдpaзу перемішують. Точно
через 2 хв додають 0.15 мл 0.1 М розчину натрію тіосульфату, перемішують і
доводять об’єм розчину водою Р до 10.0 мл. Оптична густина (2.2.25) отриманого
розчину, виміряна за довжини хвилі 590 нм, не має перевищувати оптичну густину
еталона, приготованого паралельно із випробовуваним розчином із використанням
5.0 мл розчину 3.0 мг/л калію броміду Р. Як компенсаційний розчин
використовують воду Р.
Фероціаніди. 2.0 г.
субстанції розчиняють у 6 мл води Р, додають 0.5 мл суміші 5 мл розчину 10 г./л
заліза(ІІІ) амонію сульфату Ру розчині 2.5 г./л кислоти сірчаної Р і 95 мл
розчину 10 г./л заліза(ІІ) сульфату Р; блакитне забарвлення не має з'являтися
протягом 10 хв.
Йодиди. 5 г субстанції
зволожують, додаючи краплями свіжоприготовану суміш 0.15 мл розчину натрію нiтриту
Р, 2 мл 0.5 М розчину кислоти сірчаної, 25 мл розчину крохмалю, вільного від
йодидів, Р і 25 мл води Р. Через 5 хв одержаний розчин переглядають при дeнному
світлі; не має з'являтися синє забарвлення.
Нітрити. До 10 мл
розчину S додають 10 мл води Р. Оптична густина (2.2.25) одержаного розчину,
виміряна за довжини хвилі 354 нм, не має перевищувати 0.01.
Фосфати (2.4.11). Не
більше 0.0025% (25 ррт). 2 мл розчину S доводять водою Р до об’єму 100 мл.
Одержаний розчин Має витримувати випробування на фосфати.
Сульфати (2.4.1З). Не
більше 0.02% (200 ррт). 7.5 мл розчину S доводять водою дистильованою Р до
об’єму 30 мл. 15 мл одержаного розчину мають витримувати випробування на
сульфати.
Алюміній (2.4.17). Якщо
субстанція призначена для виробництва розчинів для перитонеальноrо діалізу,
гемодіалізу або гемофільтрації, вона має витримувати випробування на алюміній.
Не більше 0.00002% (0.2 ррт).
.0 г. субстанції
розчиняють у 100 мл води Р і додають 10 мл ацетатного буферного розчину рН 6.0
Р. Одержаний розчин має витримувати випробування на алюміній. Як еталон
використовують суміш 2 мл eтaлонного розчину алюмінію (2 ррт Аl) Р, 10 мл
aцeтaтного буферного розчину рН 6. 0 Р і 98 мл води Р. Як холостий розчин
використовують суміш 10 мл ацетатного буферного розчину рН 6.0 Р і 100 мл води
Р.
Арсен (2.4.2, метод А).
Не більше 0.0001% (1 ррт). 5 мл розчину S мають витримувати випробування на
арсен.
Барій. До 5 мл розчину S
додають 5 мл води дистильованої Р і 2 мл кислоти сірчаної розведеної Р. Через 2
год опалесценція одержаного розчину не має перевищувати опалесценцію суміші 5
мл розчину S і 7 мл води дистильованої Р.
Залізо (2.4.9). Не
більше 0.0002% (2 ррт). 10 мл розчину S мають витримувати випробування на
залізо.
Еталон готують із
використанням 4 мл еталонного розчину заліза (1 ррт Fe) Р і 6 мл води Р.
Магній і лужноземельні
метали (2.4.7). Не більше 0.01% (100 ррт), у перерахунку на Са. 10.0 г.
субстанції мають витримувати випробування на магній і лужноземельні метали
(використовують 150 мг індикаторної суміші протравного чорного 11 Р). Об’єм
витраченого 0.01 М розчину натрію едетату не має перевищувати 2.5 мл.
Калій. Якщо субстанція
призначена для виробництва лікарських засобів для парентерального застосування
або розчинів для перитонеального діалізу, гемодіалізу або гемофільтрації, вона
має витримувати випробування на калій. Не більше 0.05% (500 ррт). Визначення
проводять методом атомно-емісійної спектрометрії (2.2.22, метод І).
Випробовуваний розчин. 1.00 г. субстанції розчиняють у воді Р і доводять об’єм
розчину тим самим розчинником до 100.0 мл.
Розчини порівняння.
Готують відповідними розведеннями розчину, приготованого таким чином: 1.144 г.
калію хлориду Р, попередньо висушеного при температурі від 100°С до 105°С
протягом 3 год, розчиняють у воді Р і доводять об’єм розчину тим самим
розчинником до 1000.0 мл (600 мкг/мл К).
Інтенсивність емісії
вимірюють за довжини хвилі 766.5 нм.
Важкі метали (2.4.8,
метод А). Не більше 0.0005% (5 ррт). 12 мл розчину S мають витримувати
випробування на важкі метали. Еталон готують із використанням еталонного
розчину свинцю (1 ррт Рb) Р.
Втрата в масі при
висушуванні (2.2.З2). Не більше 0.5%. 1.000 г. субстанції сушать при
температурі від 100°С до 105°С протягом 2 год.
Бактеріальні ендотоксини
(2.6.14). Менше 5 MO/г, якщо субстанція призначена для виробництва лікарських
засобів для парентерального застосування без подальшої процедури видалення
бактеріальних eндотоксинів.
Кількісне визначення
.0 мг субстанції
розчиняють у воді Р, доводять об’єм розчину тим самим розчинником до 50 мл і
титрують 0.1 М розчином срібла нітрату потенціометр. (2.2.20). 1 мл 0.1 М
розчину срібла нітрату відповідає 5.844 мг NaCl.
Маркування
У необхідних випадках
зазначають:
- субстанція
придатна для виробництва лікарських засобів для парентерального застосування;
- субстанція
вільна від бактеріальних ендотоксинів;
- субстанція
придатна для виробництва розчинів для перитонеальноrо діалізу, гемодіалізу або
гeмoфільтрації.
Амонію солі (2.4.1,
метод А). Не більше 0.004% (40 ррт). 0.25 г. субстанції розчиняють у воді Р і
доводять об’єм розчину тим самим розчинником до 14 мл. Одержаний розчин має
витримувати випробування на амонію солі.
Замість наведеної вище
методики випробування «Кількісне визначення» можна застосовувати описану нижче
методику.
Кількісне визначення
.000 г. субстанції
розчиняють у воді Р і доводять об’єм розчину тим самим розчинником до 100 мл.
До 10.0 мл одержаного розчину додають 50 мл води Р, 5 мл кислоти азотної
розведеної Р, 25.0 мл 0.1 М розчину срібла нітрату і 2 мл дибутилфталату Р.
Одержаний розчин струшують і титрують 0.1 М розчином амонію тіоціанату,
використовуючи як індикатор 2 мл розчину заліза(ІІІ) амонію сульфату Р2,
інтенсивно перемішуючи до кінцевої точки титрування. 1 мл 0.1 М розчину срібла
нітрату відповідає 5.844 мг NaCl.
2. Розчини. Теоретична
частина
.1 Характеристика і
класифікація розчинів
Розчини - це рідкі
гомогенні системи, які складаються з розчинника і одного або декількох
компонентів, розміщених в ньому в вигляді іонів або молекул [15]. Медицинські
розчини вирізняються великим різноманіттям властивостей, складу шляхів
отримання і призначення.
Розчини мають ряд
переваг перед іншими лікувальними формами, так як значно скоріше всмоктуються в
шлунково-кишковому тракті. Недолік розчинів - їх великий об’єм, можливі
гідролітичні і мікробіологічні процеси, що викликають швидку руйнацію готового
продукту.
Розчини займають
проміжне положення між хімічними сполуками і механічними сумішами. Від хімічних
сполук розчини відрізняються не постійністю складу, а від механічних сумішей
однорідністю. Ось чому розчинами називають однофазні системи перемінного
складу, утворені не менше сим двома незалежними компонентами. Найважливіша
особливість процесу розчинення - його самовільність (спонтанність). Достатньо
простого дотику розчиненої речовини з розчинником, щоб через деяких час
утворилась однорідна система - розчин.
Розчини можуть бути
полярними і не полярними речовинами. До перших відносяться рідини поєднуючи
велику діелектричну постійну, великий дипольний момент з наявністю
функціональних груп, що забезпечують утворення координаційних зв’язків: вода,
кислоти, нижчі спирти і гліколі, аміни і т.к. Неполярні розчинники - рідини з
малим дипольним моментом, що не мають активні функціональні групи, наприклад
вуглеводи, галоідоалкіли і інші. При виборі розчинника користуються переважно
емпіричними правилами, оскільки запропоновані теорії розчинності не завжди
можуть пояснити важкі, як правило, співвідношення між складом і властивостями
розчинів.
Найчастіше за все
користуються старинним правилом: «Подібне розчиняється в подібному» («Similia
similibus solventur»). практично це означає, що для розчинення будь-якої
речовини найбільш підходять ті розчинники, які структурно схожі і володіють
близькими або аналогічними властивостями.
Розчинення рідин в рідинах
коливається в широких рамках. Відомі рідини, що без обмеження розчиняються одна
в одній. Існують рідини, які розчиняються одна в одній з обмеженням. Також є
рідини, що майже не розчиняються одна в одній.
Обмежена розчинність
спостерігається в сумішах ряду полярних і неполярних рідин, поляризуємість
молекул яких різко відрізняється. При відсутності хімічних взаємодій
розчинність максимальна в тих розчинниках, міжмолекулярне поле яких по
інтенсивності близьке до молекулярного поля розчиненої речовими. Для полярних
рідких речовин інтенсивність поля частинок пропорційна діелектричній постійній.
Будь-яка рідина володіє
обмеженою розчинною можливістю. Це означає, що дана кількість розчинника може
розчинити лікувальну речовину в кількостях, що не перевищують даної межі.
Розчинність речовини називається його можливість утворювати з іншими речовинами
розчини. Інформацію о розчинності лікувальних речовин приведені в фармакопейних
статтях. По ступеню розчинності розрізняють речовини:
- дуже
легко розчинні: для розчинення потрібно не більше 1 частини розчинника,
- легкорозчинні
- від 1 до 10 частин розчинника,
- розчинні
- від 10 до 20 частин розчинника,
- важкорозчинні
- від 30 до 100 частин розчинника,
- малорозчинні
- від 100 до 1000 частин розчинника,
- дуже
малорозчинні - від 1000 до 10000 частин розчинника,
- практично
нерозчинні - від 10000 частин розчинника.
Розчинність даної
лікувальної речовини в воді залежить від температури. Для більшості твердих
речовин розчинність зі збільшенням температури підвищується. Але бувають
виключення (наприклад, солі кальцію).
Деякі лікувальні
речовини можуть розчинятися повільно. З ціллю прискорення розчинення таких
речовин використовують нагрівання, попередньому подрібненню розчиненої
речовини, перемішування суміші.
Розчини, що використовуються
в фармації, в залежності від розчинника, який використовуємо можно підрозділити
на наступні групи:
- водні
(Solutiones aquosae seu Liquores)
- спиртові
(Solutiones spirituosae)
- гліцеринові
(Solutiones glicerinatae)
- масляні
(Solutiones oleosae seu olea medicata).
2.2 Теоретичні основи
розчинення
Розчинення - спонтанний,
мимовільний дифузійно-кінетичний процес, що протікає при зіткненні речовини, що
розчиняється, з розчинником.
В фармацевтичній
практиці розчини отримують з твердих, порошкоподібних, рідких і газоподібних
речовин. Як правило, отримання розчинів рідких речовин, що розчиняються одна в
одній або змішуються між собою, протікає без особливих труднощів як просте
змішування двох рідин. Розчинення твердих речовин, особливо повільно - або
важкорозчинних, являється важким і трудомістким процесом. При розчиненні
можливо виділити наступні етапи:
- поверхня
твердого тіла контактує з розчинником. Контакт супроводжується змочуванням,
адсорбцією і проникненням розчинника в мікропори частин твердого тіла.
- Молекули
розчинника взаємодіють з шарами речовини на поверхні розділу фаз. При цьому
відбувається сольватація молекул або іонів і відрив їх від поверхні розділу
фаз.
- Сольватовані
молекули або іони переходять в рідку фазу.
- Вирівнювання
концентрації у всіх шарах розчинника.
Довжина першої і
четвертої стадій залежить переважно від швидкості дифузійних процесів. Друга і
третя стадії часто протікають миттєво або достатньо швидко і мають кінетичний
характер. З цього випливає, що в основному швидкість розчинення залежить від
дифузійних процесів.
Більшість твердих
речовин являються кристалічними речовинами. Процес розчинення кристалічної
речовини складається з двох одночасно протікаючи процесів: сольватації (в
даному випадку гідратації) частинок і руйнування кристалічної ґратки. На
рисунку 2.1 показаний процес розчинення натрію хлориду в воді. Іони натрію
хлориду взаємодіють з дипольними молекулами води: до позитивного іону Na+
диполі звернені негативними полюсами, а до негативних іонів Cl- - позитивними.
Поступово диполі води проникають між іонами Na+і Cl- в
твердій фазі, відриваючи їх від кристалу.
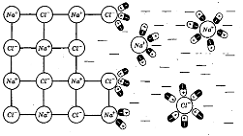
Рисунок 2.1 - Схема
процесу руйнування кристалічної решітки натрію хлориду в воді
Для ефективності
розчинення важливо, щоб сили зціплення між молекулами розчинника і частинками
розчиненої речовини були більше сил взаємного протягування цих частинок між
собою. Вода, в порівнянні з іншими розчинниками володіє великою полярністю.
Саме цією властивістю обумовлена висока іонізуюча здатність води і її руйнівну
дію на кристалічні ґратки багатьох полярних з’єднань.
При розчиненні речовин
спостерігається поглинання або виділення теплоти. Поглинання теплоти вказує на
витрату енергії. Поясняється це тим, що на перехід речовини з твердого стану в
рідкий, тобто на розчинення кристалічної ґратки, обов’язково використовується
енергія. Наприклад, іони натрію і хлору до розчинення натрію хлориду в воді
зафіксовані в вузлах кристалічної решітки, володіючи при цьому тільки обертальними
і коливальними рухами. Після розчинення іони отримують можливість відносно
вільно рухатись всередині розчину, для чого необхідно збільшення їх кінетичної
енергії. Збільшення відбувається за рахунок відібрання енергії у розчинника в
формі теплоти, в результаті чого відбувається охолодження розчину. Чим міцніша
кристалічна ґратка, тим суттєвіше охолодження розчину.
Виділення теплоти при
розчиненні речовини завжди вказує на активно протікаючи сольватацію, тобто
утворення з’єднань між розчиненою речовиною і розчинником.
Кінцевий тепловий ефект
розчинника (Q) потрібно розглядати як суму двох доданків - позитивного
теплового ефекту сольватації(q) і від’ємного теплового ефекту руйнування
кристалічної ґратки(-c):
=q+(-c)
Знак теплового ефекту
розчинення буде залежати від того, який доданок переважає. Якщо кристалічна
ґратка міцна, то доданок (-с) буде чисельно більше q; в цьому випадку
розчинення речовини буде відбуватися з поглинанням теплоти. Навпаки, у речовин
з неміцною кристалічною ґраткою і сильно сольватуємих переважає доданок q; при
цьому розчинення буде відбуватися з виділенням тепла. Часто додатній і
від’ємний теплові ефекти розчинення бувають однаковими чи дуже близькими; в
таких випадках при розчиненні ми не замічаємо охолодження або розігріву речовини.
3. Розчин ропівакаїну.
Технологічна частина
.1 Характеристика
кінцевого продукту
Найменування та номер
затверджуваної нормативно-діючої документаціїRopivacaine 0,2%. Розчин
ропівакаїну 0,2% для інфузій в ампулах по 10 мл виробництва ASTRAZENECA відповідає
вимогам ТФС 42У-8-557-97 і зм. №1 від 1.08. 99г.
Номер реєстраційного
посвідчення: UA/9384/01/01.
Фармакологічні
властивості
Ропівакаїн - довго
діючий місцевий анестетик амідного типу, що є чистим лівообертальним
енантіомером [4]. Має і анестезуючу і обезболюючу дію. Високі концентрації
ропівакаїну використовують при хірургічних втручаннях. В низьких концентраціях
визиває сенсорний блок з мінімальним і не прогресуючим моторним блоком.
Склад 0,2% розчину
ропівакаїну
На 1 мл [16]:
Ропівкаїну гідрохлориду 2,0
мг
Натрія хлорид 8,6
мг
,1 М розчину кислоти хлористоводневої до
рН від 4,0 до 6,0
Води для ін’єкцій до
1 мл.
Пакування
По 10 мл в ампули типу
ИП-10В, КИ-03 з скла марки УСП-1 по ТУ У 00480945-005-96 [17].
По 5 ампул разом з інструкцією
по застосуванню та ножем для розтинання ампул по ТУ 400-6-169-85 або
скарифікатором ампульним по ТУ 64-1-994-79 вкладають в коробку по ГОСТ
64-071-89 з картону для споживчої тари по ГОСТ 7933-89 з перегородками або
гофрованим вкладишем з паперу пачечного по ГОСТ 6290-74.
Коробку оклеюють
етикеткою-бандероллю з паперу етикеточного по ГОСТ 7625-86 або писчого по ГОСТ
18510-87 або текст етикетки завдають на пачку типографським засобом.
Групова та транспортна
тара у відповідності з ГОСТ 17768-90.
Маркування
На етикетці-бандеролі
вказують країну, завод, його товарний знак та адреса, назва препарату
латинською та українською або російською мовами, концентрацію, об’єм розчину в
мл, «Стерильно», «Для ін’єкцій», кількість ампул в упаковці, умови зберігання,
реєстраційний номер, номер серії, термін придатності.
Номер серії та термін
придатності препарату допускається завдавати на боковій стороні коробки або
пачки засобом тиснення.
На етикетці групової
тари додатково вказують кількість упаковок.
Транспортне маркування у
відповідності з ГОСТ 14192-96.
Транспортування
У відповідності з ГОСТ
17768-90.
Зберігання
Список Б. В захищеному
від світла місці.
Термін придатності
роки.
Основне призначення
Місцевоанестезуючий
засіб.
3.2 Характеристика
сировини, матеріалів і напівпродуктів
На виробництві
використовується різна сировина, матеріали і напівпродукти, дані про них
розміщені в таблиці 3.1
Таблиця 3.1 -
Характеристика сировини, матеріалів і напівпродуктів
|
Найменування
|
Категорія та номер НТД, згідно
якій перевіряються ці показники
|
Показники, обов'язкові для
перевірки
|
Примітка
|
|
1. Основна сировина
|
|
Вода для ін’єкцій Дільниця водо
підготовки
|
ФС 42-2620-89
|
Опис, рН, сухий залишок,
відновлюванні речовини, вугільний ангідрид, нітрати та нітрити, аміак,
хлориди, сульфати, кальцій, магній, важкі метали, механічні включення,
пірогенність, мікробіологічна чистота.
|
Розчинник для приготування 0,2%
розчину ропівакаїну
|
|
Ропівакаїна гідрохлорид
run-biotech Co., Ltd.
|
[5]
|
Опис, рН, супровідні домішки,
домішка Н, енантіомерна чистота, важкі метали, вода, сульфатна зола,
мікробіологічна чистота.
|
Активний фармацевтичний інгрідіент
|
|
Натрію хлорид SALINEN (Австрия)
|
[14]
|
Опис, кислотність або лужність,
броміди, фероціаніди, йодити, нітрити, фосфати, сульфати, алюміній, арсен,
барій, залізо, магній і лужноземельні метали, калій, важкі метали, втрата в
масі при висушуванні, бактеріальні ендотоксини, амонію солі.
|
Ізотонуюча речовина
|
|
Хлороводнева кислота ВАТ
«ЄВРОХІМТРАНС» або натрію гідрооксид ВАТ «Хімфармінвест»
|
[14] [14]
|
Опис, вільний хлор, сульфати,
важкі метали, сухий залишок, арсен, залізо, рН, Опис, карбонати, хлориди,
сульфати, залізо, важкі метали, рН.
|
Для доведення до рН 4-6
|
|
2. Допоміжна сировина
|
|
Вода очищена
|
ТФС 42У-8-1649-00
|
Опис, рН, сухий залишок,
відновлюванні речовини, вугільний ангідрид, нітрати та нітрити, аміак,
хлориди, сульфати, кальцій, магній, важкі метали, мікробіологічна чистота.
|
Для приготування дезрозчинів та
розчинів антисептиків, для санітарної підготовки виробництва, для миття
первинної упаковки.
|
|
Перекис водню
|
ГОСТ 177-88 конц.
|
% - вміст
|
Дезречовина для обробки обладнання
та інвентарю
|
|
Деззасіб «Стерилліум» виробництва
Германія
|
Рег. посвідчення. №П. 06.01/03227
від 14.06. 01
|
Маркування
|
Деззасіб для обробки рук
персоналу.
|
|
Дисперсія полівінілацетатна
|
ГОСТ 18992-80 Марки Д, 50 С, Д
50/3
|
Цілісність упаковки, зовнішній
вигляд.
|
Для склеювання коробок.
|
|
Кислота бензойна
|
ГОСТ 10521-78
|
Температура плавлення 120-122°С.
|
Тест при автоклавування
|
|
Фарба глибокої печатки для скляних
виробів
|
ТУ У 42.34. 011-97
|
Колір, час висихання.
|
Для маркування ампул.
|
|
Живильні середовища в т.ч.
тіогліколеве середовище, середа Сабуро
|
ГФ XI, вип. 2, с. 192 ГФ XI, вип.
2, с. 192
|
Зовнішній вигляд, стерильність,
ростові властивості середи.
|
Для контролю стерильності
препарату.
|
|
М’ясопептонний агар
|
ФС 42-257ВС-89
|
|
Для визначення мікробної
контамінації
|
|
Миючий засіб
|
ГОСТ 25644-96 «Лотос»
|
Цілісність упаковки.
|
Для приготування миючих та
дезрозчинів для обробки приміщень та обладнання.
|
|
Натрій двовуглекислий
|
ГОСТ 2156-76
|
Цілісність упаковки.
|
Для обробки обладнання.
|
|
Спирт етиловий
|
ГОСТ 5962-67
|
Вміст етилового спирту, зовнішній
вигляд.
|
Для приготування розчинів, які
використаються для обробки рук та обладнання, розчинник фарби при маркуванні
ампул.
|
|
3. Матеріали
|
|
Ампули скляні для лікарських
засобів: ИП-10В, КИ-03 «Полтавський з-д медичного скла» (м. Полтава, Україна)
|
Скло марки УСП-1 по ТУ У
00480945-005-96.
|
Зовнішній вигляд, розміри, форма,
чистота внутрішньої та зовнішньої поверхні, наявність напряжений,
термостійкість, хімостійкість, маркування, упаковка.
|
Первинна упаковка препарату
|
|
Папір пачечний
|
ГОСТ 6290-74
|
Максимальний діаметр бобіни,
ширина, маркування.
|
Для виготовлення гофрованого
вкладишу коробки
|
|
Папір підпергаментний
|
ГОСТ 1760-86 Щільністю 40-45 г./м2
|
Маркування, зовнішній вигляд.
|
Для загортання стерилізуючих
матеріалів перед стерилізацією
|
|
Папір обгортковий
|
ГОСТ 8273-75, Марка В
|
Маркування, зовнішній вигляд.
|
|
|
Вата медична
|
ГОСТ 5556-81, Гігроскопічна
|
Маркування, зовнішній вигляд.
|
Для виготовлення заглушок
|
|
Індикатори термогодинникові
Виробництво НПФ «Винар» м. Київ
|
ТУ 9443-004-11764404-96
|
Цілісність упаковки
|
Для оперативного візуального
контролю за дотриманням температурного та тимчасового режимів стерилізації.
|
|
Картон для споживчої тари
|
ГОСТ 7933-89, Марка А або хром
ерзац
|
Товщина, максимальний розмір
бобіни, маркування.
|
Для виготовлення коробок
|
|
Стрічка клейка «Скотч»
|
ГОСТ 18251-87
|
Маркування.
|
Для оклеювання стиків групової
тари
|
|
Марля медична
|
ГОСТ 9412-93
|
Маркування, зовнішній вигляд.
|
Для виготовлення серветок
|
|
Ножі ампульні
|
ТУ 400-6-169-85
|
Цілісність упаковки.
|
Для вкладання в коробку
|
|
Рукавички хірургічні
|
ГОСТ 3-88
|
Цілісність, зовнішній вигляд,
маркування.
|
|
|
Тканина фільтрувальна капронова
|
ОСТ 1746-82
|
Цілісність.
|
Для виготовлення серветок для
обробки обладнання
|
|
Трубки медичні гумові
|
ГОСТ 3399-76, тип. 3
|
Маркування, зовнішній вигляд.
|
Для трубопроводів
|
|
Трубки поліхлорвінілові
|
ГОСТ 19034-82 Тип ТВ-40, ТВ-40Т;
ТВ-40А
|
Міцність
|
Для трубопроводів
|
|
Фільтри поліпропіленові (тип ФТВП,
розмір пор 0,3 мкм), виробник «Укрфільтр» м. Чернігів, Україна
|
ТУ 020-70-890. 001-96
|
Цілісність упаковки.
|
Для стерилізуючої фільтрації
розчину
|
|
Шпагат з луб’яних волокон
|
ГОСТ 17308-88
|
Зовнішній вигляд, маркування.
|
Для упаковки матеріалів перед
стерилізацією
|
|
Етикетка-бандероль
|
Папір етикеточний ГОСТ 7625-86
Папір писчий ГОСТ 18510-87
|
Відповідність тексту, нанесеного
на етикетку, розділу «Маркування» ТФС на готову форму.
|
Для обклейки коробок
|
|
Шухляди з гофрованого картону
|
ГОСТ 9142-90 Виконання А
|
Лінійні розміри, якість склейки,
рівномірність нанесення лінії риллівки.
|
Групова тара для відвантаження
споживачу
|
|
4. Піддослідні тварини
|
|
Кролики ВТК
|
ДФ ХI, вип. 2 стор. 182
|
Здорові особливі масою 2-3,5 кг, з
вхідною температурою тіла 38,5-39,5 0С протягом 3 днів перед
іспитом
|
Для контролю на пірогенність
|
|
Миші білі
|
ДФ ХI, вип. 2 стор. 183
|
Здорові білі миші масою 19-21 г.,
за 24 години до і під час проведення іспиту повинні знаходиться в приміщенні
з постійною температурою.
|
Для контролю препарату на
токсичність
|
|
5. Напівпродукти
|
|
Розчин ропівакаїну не фільтрований
|
СРП ККХ №041-01-99
|
Кількісний вміст ропівакаїну, рН.
|
Проба розчину з реактора Р-1 (стадія
ТП. 2.1)
|
|
Розчин профільтрованого
ропівакаїну
|
СРП ККПХ №069-01-01
|
Відсутність механічних включений.
|
Розчин ропівакаїну в збірці С-2
(ТП. 2.2)
|
|
Розчин не стерилізованого
ропівакаїну в ампулах
|
СРП ККХП №068-01-01
|
Об’єм наповнення.
|
Ампули з розчином після машини
ГФ-5 (стадія ТП. 3.5)
|
|
Розчин стерилізованого ропівакаїну
в ампулах
|
СРП ККМБ 009-01-99 СРП ККБ
081-01-00 РД 42У-001-93
|
Стерильність, токсичність.
Механічні включення (Первинний, вибірковий вторинний контроль та вибірковий
контроль ВТК).
|
Ампули з розчином після автоклаву
ГФ-8 (стадія ТП. 4) Запаяні ампули з розчином (стадія ПМВ 5.1)
|
|
|
|
|
|
|
|
|
|
|
|
|
3.3 Технологічна схема
виробництва розчину ропівакаїну 0,2% для інфузій в ампулах по 10 мл
|
|
|
|
ДР 1.1
|
Підготовка вентиляційного повітря
|
|
Згідно СТП 64-01973118-02-01
«Система забезпечення якості. Організація виробництва ін’єкційних лікарських
засобів. Санітарна підготовка виробництва»
|
|
|
|
|
|
|
|
|
|
ДР 1
|
Санітарна підготовка виробництва
|
|
|
|
|
|
|
|
|
|
|
ДР 1.2
|
Приготування дезінфекційних
розчинів
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ДР 1.3
|
Підготовка комплектів одягу
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ДР 1.4
|
Підготовка технологічного
обладнання
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ДР 1.5
|
Підготовка виробничих приміщень
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ДР 1.6
|
Підготовка персоналу
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ТП 2
|
Приготування 0,2% розчину
ропівакаїну гідрохлориду
|
|
|
ТП 2.1 К 2.1.1 К 2.1.2 К 2.1.3 К
2.1.4 К 2.1.5 К 2.1.6
|
Розчинення вхідних компонентів:
Ропівакаїн Хлорид натрію Вода для ін’єкцій
|
|
Ваги В-1 Реактор Р-1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Втрати
|
|
|
ТП 2.2 К 2.2
|
Стерилізуюча фільтрація
|
|
Фільтр Ф-2 Балон З-2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ТП 3.1
|
Укладка ампул в касети
|
|
|
|
ТП 3
|
Ампулювання розчину
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ТП 3.2
|
Зовнішня мийка ампул
|
|
Ванна ГФ-2
|
|
|
|
|
|
|
|
|
|
Втрати
|
|
|
|
|
|
|
|
|
|
|
ТП 3.3 К 3.3.0 К 3.3.1 К 3.3.2 К
3.3.3
|
Внутрішня мийка ампул
|
|
Напівавтомат ГФ-3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ТП 3.4 К 3.4
|
Стерилізація ампул
|
|
Сухожарова піч ГФ-4, 5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ТП 3.5 К 3.5.1 К 3.5.2
|
Наповнення і запаювання ампул
|
|
Автомат ГФ-6, 7
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ТП 4.1
|
Стерилізація ампул з препаратом
|
|
|
|
ТП 4 К 4.1, К 4.2, К 4.3, К 4.4
|
Стерилізація препарату
|
|
|
|
|
|
Автоклав А-1
|
|
|
|
|
ТП 4.2
|
Перевірка на герметичність і
промивання ампул
|
|
Мірник М-2, Ванна ГФ-9
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Втрати
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПМВ 5
|
Маркування та пакування ампул
|
|
|
ПМВ 5.1 К 5.1.1 К 5.1.2 К 5.1.3
|
Контроль препарату на механічні
включення та інші види браку
|
|
Стіл ГФ-10
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Втрати
|
|
|
ПМВ 5.2 К 5.2.1 К 5.2.2
|
Маркування та пакування ампул,
контроль по фізико-хімічним показникам
|
|
Автоматична лінія ГФ-11-12
|
|
|
|
|
|
|
|
|
|
Готова продукція на склад
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПВ 6.1
|
Розкриття ампул з розчином
|
|
Обладнання ГФ-13
|
|
ПВ 6
|
Переробка відходів виробництва
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПВ 6.2
|
Відсмоктування розчину з ампул
|
|
Апарат ГФ-14
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПВ 6.3
|
Фільтрування і збір розчину
|
|
Фільтр Ф-3 Збірник З-3
|
|
|
|
|
|
|
|
|
3.4 Опис стадій
технологічного процесу
Розділ включає в себе
наступні стадії:
ДР. 1 Санітарна
підготовка виробництва.
ДР. 1.1. Підготовка
вентиляційного повітря.
ДР. 1.2. Приготування
дезінфекційних розчинів.
ДР. 1.3. Підготовка
комплектів одягу.
ДР. 1.4. Підготовка
технологічного обладнання.
ДР. 1.5. Підготовка
виробничих приміщень.
ДР. 1.6. Підготовка
персоналу.
ТП. 2 Приготування 0,2%
розчину ропівакаїну.
ТП. 2.1. Розчинення
вхідних компонентів.
ТП. 2.2. Стерилізуюча
фільтрація розчину.
ТП. 3 Ампулювання
розчину.
ТП. 3.1. Укладка ампул в
касети.
ТП. 3.2. Зовнішня мийка
ампул.
ТП. 3.3. Внутрішня мийка
ампул.
ТП. 3.4. Стерилізація
ампул.
ТП. 3.5. Наповнення і
запаювання ампул.
ТП. 4 Стерилізація
препарату.
ТП. 4.1. Стерилізація
ампул з препаратом.
ТП. 4.2. Перевірка на
герметичність і промивання ампул.
ПМВ. 5 Маркування і
упакування ампул.
ПМВ. 5.1. Контроль
препарату на механічні включення та інші види браку.
ПМВ. 5.2. Маркування та
упакування ампул, контроль по фізико-хімічним показникам.
ПВ. 6 Переробка відходів
виробництва.
ПВ.6.1. Розкриття ампул
з розчином препарату.
ПВ.6.2. Відсмоктування
розчину з ампул.
ПВ.6.3. Фільтрація
розчину.
Детальний опис стадій
технологічного процесу розміщений у вигляді таблиці 3.2.
Таблиця 3.2 - Опис
стадій технологічного процесу
|
Номер стадії
|
Опис процесу
|
Показники
|
|
ДР. 1
|
Санітарна підготовка виробництва
|
|
|
ДР. 1.1
|
Підготовка вентиляційного повітря
За 10-15 хвилин до початку роботи включити приливно-витяжну вентиляцію.
|
Підготовка повітря згідно СТП
64-01973118-02-01 «Система забезпечення якості. Організація виробництва
ін’єкційних лікарських засобів. Санітарна підготовка виробництва»
|
|
ДР. 1.2
|
Приготування дезінфікуючих
розчинів Приготувати відповідні дезрозчини для обробки обладнання, приміщень
і рук. На ємностях з дезрозчинами, приготованими для багаторазового вживання
прикріпити етикетку з вказівкою назви дезрозчина, дати виготовлення, терміну
придатності і прізвища особи, який приготував розчин.
|
Порядок приготування згідно СТП
64-01973118-02-01 «Система забезпечення якості. Організація виробництва
ін’єкційних лікарських засобів. Санітарна підготовка виробництва»
|
|
ДР. 1.3
|
Підготовка комплектів одягу
Підготувати комплекти одягу для працюючих в чистих приміщеннях.
|
Згідно СТП 64-01973118-02-01
«Система забезпечення якості. Організація виробництва ін’єкційних лікарських
засобів. Санітарна підготовка виробництва»
|
|
ДР. 1.4
|
Підготовка технологічного
обладнання Провести санітарну обробку обладнання. На обладнанні прикріпити
табличку: «Обладнання очищене і готово до роботи», з вказівкою дати, часу
обробки, прізвища і підпису особи, який проводив обробку.
|
Згідно СТП 64-01973118-02-01
«Система забезпечення якості. Організація виробництва ін’єкційних лікарських
засобів. Санітарна підготовка виробництва»
|
|
ДР. 1.5
|
Підготовка виробничих приміщень
Провести санітарну обробку приміщення у відповідності з класом чистоти
приміщення, яке обробляється. В приміщеннях В-С класів чистоти на стіні
прикріпити табличку з вказівкою: найменування приміщення, «Підготоване»,
«Чисто», дати, часу, прізвища і підпису особи, яка проводила обробку, там же
письмово підтвердити, що виробнича зона звільнена від матеріалів і продукції
попередніх серій (в приміщеннях класу чистоти В табличку прикріпити з зовнішньої
сторони боксу, в приміщеннях класу С - лист паперу запаяний в поліетиленовий
файл, оброблений дезрозчином, кріпиться в жерстяній кишені).
|
Згідно СТП 64-01973118-02-01
«Система забезпечення якості. Організація виробництва ін’єкційних лікарських
засобів. Санітарна підготовка виробництва»
|
|
ДР. 1.6
|
Підготовка персоналу до роботи
Перед початком роботи технологічному персоналу надіти комплект одягу,
відповідний класу чистоти приміщення, в якому буде проводиться технологічний
процес. В зв'язку з тим, що ропівакаїн відноситься до II класу небезпеки (у
відповідності з СТП 64-01973118-01-00 «Система забезпечення якості.
Технологічні процеси виробництва ін’єкційних лікарських засобів. Специфікація
безпеки сировини, проміжних продуктів, готового продукту і матеріалів»),
персоналу, який приймає участь в операції приготування розчину препарату
надіти засоби захисту рук, органів дихання і органів зору. Персонал,
підготований і одягнений в спеціальний технологічний одяг, виконуючи правила
техніки безпеки, приступає до виконання технологічного процесу.
|
Комплектність одягу згідно СТП
64-01973118-03-01 «Система забезпечення якості. Технологічні процеси
виробництва ін’єкційних лікарських засобів. Спеціальний одяг та інші засоби
індивідуального захисту»
|
|
|
|
|
ТП. 2
|
Приготування 0,2% розчину
ропівакаїну
|
|
|
ТП. 2.1.
|
Розчинення вхідних компонентів
|
|
|
На цьому етапі починається
формування досьє на серію препарату. Сировина. Вхідна сировина купляється у
виробника або через постачальників. На кожну партію сировини в день її
надходження матеріально-технічний склад оформлює повідомлення і повідомляє
групу вхідного контролю.
|
|
|
Контроль сировини. Представник
групи контролю перевіряє правильність оформлення супровідної документації,
підтверджуючий якість та комплектність сировини, проводить зовнішній огляд
сировини, перевіряє правильність і цілісність маркування та пакування,
реєструє в журналі вхідного контролю, аналізує відповідність між відомостями
зазначеними в накладної та на етикетках постачальника. Сировина зберігається
в складських приміщеннях підприємства, що забезпечує розподіл по серіям та
захист від мікробної контамінації. Представник групи контролю для оцінки
якості сировини проводить відбір проб у відповідності з нормативною
документацією. Упаковки з яких відбирається проба і контейнери з відібраними
зразками проб маркіруються з вказівкою вмісту, дати відбору і кріпиться
відповідна етикетка: «на контролі», «для контролю». Вхідному контролю
підлягає сировина: Ропівакаїн [5], Натрія хлорид [14], Гідрооксид натрію або
соляна кислота [14]; Зберігання сировини відбувається у відповідності з
умовами, вказаними в НТД сировини. Проконтрольована сировина супроводжується
аналітичними паспортами, які також вкладаються в досьє на серію препарату. На
упаковці з субстанцією кріпиться етикетка («дозволено до використання» або
«підлягає поверненню»), підписані начальником ВТК, з вказівкою найменування
сировини по НТД, номера партії, терміну придатності, номера аналітичного
листа та умов зберігання і дозвіл на використання у виробництво. Після отримання
дозволу на використання у виробництві, сировину беруть в роботу.
|
(К. 2.0. 1)
|
|
Щоденному вхідному контролю
підлягає вода для ін’єкцій згідно ФС 42-2620-89.
|
(К. 2.0. 2)
|
|
Зробити зовнішній огляд ректора
Р-1, мірника М-1, фільтру Ф-1 і збірників З-2, а також наявність на
обладнанні етикеток «чисто», «готово до роботи».
|
|
|
При розрахунку наважки врахувати
вміст основної речовини в сировині. Величина серії визначається об’ємом, який
готують в реакторі Р-1. Номінальний об’єм серії 279,5 літрів.
Серії присвоюють номер, і хімік цеху заповнює протокол приготування серії, що
вкладається в досьє на препарат. На стіні реакторної прикріпити табличку з
вказівкою назви і номера серії препарату, що готується.
|
|
|
Набрати в реактор Р-1 воду для
ін’єкцій
|
Біля 250,80 л (по мірному склу)
|
|
Подати пар в парову сорочку
реактора.
|
Тиск пара біля 0,02 МПА
|
|
Прокип’ятити воду для ін’єкції в
реакторі Р-1
|
Температура 100˚С (ТЕ 10-1),
тривалість 30 хв. (К 2.1. 1)
|
|
Охолодити воду в реакторі за
допомогою подачі в сорочку реактора Р-1 холодної питної води
|
До температури 30˚ С (ТЕ
10-1)
|
|
На вагах В-1 зважити субстанції: -
ропівакаїну - натрію хлорид
|
(К. 2.1. 2) 0,51 кг 2,18 кг
|
|
Завантажити через верхній люк
реактора Р-1 ропівакаїн, натрію хлорид і, включив мішалку, розчинити їх в
воді для ін’єкцій.
|
Тривалість перемішування - 10-15
хвилин, температура 30°С (ТЕ 10-1) (К. 2.1. 3)
|
|
Після цього додають регенерований
розчин ропівакаїну, відбракованого по механічним включенням.
|
13,31 л Тривалість перемішування
20-30 хвилин.
|
|
Відібрати пробу через верхній люк
реактора, охолодити її і передати її на аналіз в ВТК.
|
|
|
Вимірюють значення рН розчину
(потенціометрично) згідно СРП ККХ №041-01-99
|
рН від 4 до 6 (К. 2.1. 4)
|
|
Визначити кількісний вміст
ропівакаїну в пробі розчину (згідно СРП ККХ №041-01-99)
|
Вміст в 1 мл розчину: ропівакаїну
- від 0,00194 до 0,00206 г. (К. 2.1. 5)
|
|
При невідповідності кількісного
вмісту необхідному значенню, зробити необхідні розрахунки і укріпити або
розбавити розчин доданням відповідних кількостей ропівакаїну або води для
ін’єкцій.
|
|
|
ТП. 2.2
|
Стерилізуюча фільтрація розчину
|
|
|
Підготовка фільтру. Для фільтрації
використовуються фільтри (Ф-1) Фільтр патронний поліпропіленовий тип ФТВП -
затримуюча здібність - 0,3 мкм Попередньо зібраний фільтр приєднати до
мірника М-1. В мірник попередньо набрати 250 л води для ін’єкцій (яку
прокип’ятили протягом 30 хвилин) і охолодженої до 80-90С. Подаючи в мірник
стерильне стисле повітря, відкрити кран на впускному шлангу фільтру, промити
фільтр, злити промивні води в каналізацію. Фільтр від’єднати, обгорнути кінці
шлангів пергаментним папером, обв'язують суворою ниткою, кладуть в бікс і
стерилізують. Після стерилізації фільтр в тому же біксі перенести в бокс
фільтрації, де зберігати до вживання, але не більш 24 годин.
|
Температура 120 0С,
тиск 0,11 МПа, протягом 60 хв.
|
|
З’єднати шланг з сифоном на кінці
до верхнього патрубку мірника М-1. Опустити сифон в реактор Р-1. Створивши
розрядження в мірнику М-1 перекачати розчин з реактора.
|
Розрядження 0,05-0,06 МПа (РТ
14-1)
|
|
За допомогою трубопроводів фільтр
Ф-1 приєднують через верхній штуцер до збірника води, через нижній - до
скляного приймальника. При тиску в збірнику 0,060±0,01 МПа пропускають невелику кількість води на фільтр,
витісняючи повітря через воздушку на верхньому диску фільтротримача.
Відкривають вихід з фільтру і пропускають воду у бутиль настільки, щоб кінчик
довгої трубки виявився зануреним в рідину. Припиняють подачу води на фільтри
і з'єднують фільтротримач з балоном стисненого повітря. Повільно відкривають
вентиль подачі повітря, поступово створюючи тиск на фільтрі. Спостерігають за
показаннями манометра не менше 20 хв. Установка термічна, якщо тиск не
змінюється. Продовжують поступову подачу стерильного стислого повітря на
фільтр. Спостерігають за появою бульбашок повітря з кінця довгої трубки. Якщо
через шар рідини в балоні не з'являються Бульбашки повітря, - пластина не
пошкоджена і фільтраційна установка може бути пущена в роботу.
|
Тиск 0,150±0, 01 МПа Тиск 0,2650±0,005 МПа (К. 2.2. 0)
|
|
Над полум’ям спиртівки, що горить
з’єднати вхідний шланг підготованого фільтру Ф-1 з нижнім патрубком мірника
М-1, а вихідний шланг фільтру Ф-1 з балоном З-2.
|
|
|
Відкрити вентиль подачі стислого
повітря в мірник М-1 і розпочати фільтрацію.
|
Тиск стислого повітря 0,015 - 0,02
МПа (РТ 15-1)
|
|
Після заповнення збірки приблизно
на ½ його об’єму, використовуючи
лампу-рефлектор, проконтролювати візуально розчин препарату, який
відфільтрувався в балон З-2 на чорно-білому екрані на відсутність видимих
механічних включень згідно СРП ККПХ №069-01-01
|
Не повинно бути механічних
включень, які можна побачити неозброєним оком. (К. 2.2. 1)
|
|
Якщо у збірнику З-2 присутні
механічні включення, повернути розчин в мірник М-1, минаючи фільтр Ф-1. Для
цього на вхідному шлангу балону З-2 поставити затискач, вихідний шланг балону
з сифоном над полум’ям спиртівки з’єднати до верхнього патрубку мірника М-1 і
створити розрядження в мірнику.
|
Розрядження 0,02 - 0,03 МПа (РТ
14-1)
|
|
Заповнивши збірник З-2
профільтрованим розчином препарату, над полум’ям спиртівки від’єднати його
від фільтру, і під’єднати наступний балон.
|
|
|
Прикріпити на балон етикетку з
вказівкою назви препарату і номера серії, передати на ампулювання.
|
|
|
По закінченню процесу обробити
реактор Р-1, мірник М-1, а також фільтр Ф-1.
|
|
|
ТП. 3
|
Ампулювання розчину
|
|
|
Персонал підготований, одягнений у
відповідний технологічний одяг, забезпечений засобами індивідуального захисту
і виконує правила техніки безпеки.
|
|
|
ТП. 3.1
|
Укладка ампул в касети
|
|
|
Вимити касети над ванною ГФ-1
шляхом душування питною водою з двох боків.
|
У продовж 50± 5 секунд
|
|
Ампули з складу звільнити від
заводської упаковки.
|
|
|
Вручну вкласти ампули капілярами
вниз в касети.
|
Відбракувати ампули за зовнішнім
виглядом.
|
|
ТП. 3.2
|
Зовнішня мийка ампул
|
|
|
Помістити касети з набраними
ампулами в ванну ГФ-2 і продушувати їх водою очищеною.
|
Протягом 1 хв.
|
|
Залишити касети з ампулами у ванні
ГФ-2 для стоку залишків води.
|
|
|
ТП 3.3
|
Внутрішня мийка ампул
|
|
|
Перед початком мийки нагріти воду
очищену в збірці З-1 шляхом подачі пара в трубчатий теплообмінник збірки.
|
До температури 65± 5°С (К. 3.3. 1)
|
|
Поставити тест на чистоту ампул.
Для цього витягти декілька ампул з різних місць касети, за допомогою піпетки
або шприцу наповнити їх 0,1% розчином метиленового синього і помістити назад
в касету.
|
4 - 5 ампул в різних місцях
касети.
|
|
Встановити касету на опори
внутрішньої ємкості апарату ГФ-3 та запустити автомат до роботи.
|
|
|
Після підняття кришки автомату,
витягти касету з ємності та перевірити відсутність метиленового синього в
ампулах.
|
(К. 3.3. 2)
|
|
При наявності слідів метиленового
синього зробити регулювання параметрів мийки (глибина вакууму, рівень води в
ємкості) або ввести додатковий цикл мийки.
|
|
|
Дані по режиму та якості мийки
занести в журнал.
|
|
|
Періодично, не менш 1 разу за
тиждень перед початком процесу безпосередньо з внутрішньої ємкості
напівавтомата мийки ГФ-3 брати пробу води очищеної та контролювати її на
відсутність механічних включень, дані контролю занести в журнал.
|
(К. 3.3. 3)
|
|
Наявність в пробі механічних
включень служить підставою для заміни фільтру Ф-2.
|
|
|
ТП. 3.4
|
Стерилізація ампул
|
|
|
Підготований персонал, одягнений в
спеціальний технологічний одяг, забезпечений засобами індивідуального
захисту, виконуючи правила техніки безпеки, приступає до стерилізації.
|
|
|
Кожну касету з ампулами помістити
в контейнери, всередину контейнера помістити ампулу з запаяним в нього
термогодинниковим індикатором або з гідрохіноном та закрити контейнер
кришкою.
|
|
|
Контейнери розмістити на полицях
сухожарової печі ГФ - 4, -5 та замкнути двері.
|
|
|
Почати прогрів печі.
|
До температури 2000 С
|
|
При досягненні вищезазначеної
температури простерилізувати ампули.
|
Температура 2000 С, тривалість
- 1 година (К. 3.4)
|
|
Після охолодженні печі витягти
касети з ампулами
|
При температурі не більш 600
С
|
|
Передати контейнери з ампулами на
розлив.
|
|
|
ТП 3.5
|
Наповнення та запаювання ампул
|
|
|
Підготований персонал, одягнений в
спеціальний технологічний одяг, забезпечений засобами індивідуального
захисту, виконуючи правила техніки безпеки, приступає до наповнення та
запайки ампул.
|
|
|
Наповнення та запайка ампул
виробляється на автоматі наповнення та запайки ампул ГФ-6, ГФ-7.
|
|
|
Обробити автомат для наповнення та
запайки ампул.
|
|
|
На стіні боксу прикріпити етикетку
з вказівкою препарату, номера серії та дати розливу.
|
|
|
Протерти контейнери з
простерилізованими ампулами дезрозчином та занести їх в бокс.
|
Дезрозчин: 76% розчин спирту
етилового
|
|
Протерти зовнішню поверхню бутилів
з розчином препарату З-2 та занести їх в бокс.
|
Дезрозчин: 76% розчин спирту
етилового
|
|
Під захистом полум’я спиртівки
випускний шланг балону приєднати до вузла наповнення автомату ГФ-6.
|
|
|
З контейнера з ампулами зняти
кришку, витягти касету з ампулами, перевірити якість стерилізації ампул,
звіряючи забарвлення термогодинникового індикатора, поміщеного в тест-ампулу,
з еталоном. (При застосуванні гідрохінона перевірити чи розплавився вміст
тест-ампули.)
|
Інтенсивність забарвл. індикатора
не повинна бути менш насиченої, ніж забарвлення еталону. (У гідрохінона
забарвлення повинне змінитися з рожевого на темно-коричневе.) (К. 3.5. 1)
|
|
У випадку, якщо забарвлення
еталону більш інтенсивна або не розплавиться гідрохінон в тест-ампулі, касета
з ампулами вертається на повторну стерилізацію.
|
|
|
Накрити касету завантажувальним
лотком, перевернути касету на 180°, убрати касету, а
ампули, що опинилися в лотку оглянути візуально, видалити пінцетом пошкоджені
ампули.
|
|
|
Завантажувальний лоток разом з
ампулами помістити в завантажувальний бункер, убрати заслінку.
|
|
|
Переконатися в відсутності витіку
газу.
|
|
|
Включити автомат ГФ-6, 7 та
запустити його в роботу. Протягом всього процесу стежити за тиском газу та
кисню.
|
Тиск газу - не менш 0,04 МПа; тиск
кисню 0,4¸ 0,5 МПа
|
|
З початку процесу зробити вибірку
заповнених та запаяних ампул від кожного з 3 дозаторів автомату.
|
|
|
Каліброваним шприцем перевірити
об’єм наповнення ампул від кожного з дозаторів. Контроль наповнення
виробляють згідно СРП ККПХ №068-01-01.
|
Об’єм наповнення - 10,6 мл, що
відповідає об’єму розчину в шприці після витиснення повітря та заповнення
голки - 10,0 мл (К. 3.5. 2)
|
|
При невідповідності об’єму розчину
в шприці значенню 10,0, провести регулювання дозаторів та перевірити об’єм наповнення
ще раз.
|
|
|
Проводити такі перевірки ще 3-4
разу в зміну.
|
|
|
Руки персоналу через кожні дві
години роботи обробляти дезрозчином. Також руки обробляються після кожних
операцій по налагоджуванні та регулюванні автомату.
|
Дезрозчин: 76% розчин спирту
етилового або «Стериліум»
|
|
В стелажіГФ-8, в які поступають
запаяні ампули, на дно і зверху необхідно вкладати етикетки з вказівкою назви
препарату, номера серії та дати розливу.
|
|
|
Передати стелажіГФ-8 з запаяними
ампулами на стерилізацію.
|
|
|
ТП. 4
|
Стерилізація препарату
|
|
|
Персонал підготований, одягнений у
відповідний технологічний одяг, забезпечений засобами індивідуального
захисту, який виконує правила техніки безпеки.
|
|
|
ТП. 4.1.
|
Стерилізація ампул з препаратом
|
|
|
На автоклав А-1 прикріпити
етикетку з вказівкою назви препарату та номера серії.
|
|
|
Стелаж ГФ-8 з запаяними ампулами
розмістити в автоклаві А-1 та замкнути двері
|
|
|
Відкрити вентилі на лініях спуску
конденсату, воздушки, а після цього і подачі пара, прогріти автоклав.
|
Тиск пара 0,01 МПа тривалість 30
хвилин
|
|
Перекрити лінію воздушки,
збільшенням кількості подачі пара та частковим закручуванням вентиля спуску
конденсату підняти тиск в автоклаві до необхідного значення і провести
стерилізацію препарату. Контроль параметрів стерилізації ведеться безупинно,
візуально.
|
Температура-100°С Тривалість - 30 хв. (К. 4.1)
|
|
Якщо з бігом часу 8 хвилин після
початку стерилізації відбувалося падіння тиску та температури в автоклаві, то
стерилізацію вважати перерваною. Тоді по вказівці керівника цеху провести повторну
стерилізацію або продовжити режим стерилізації, про що зробити відповідну
відмітку в журналі.
|
|
|
ТП. 4.2.
|
Перевірка на герметичність та
промивка ампул
|
|
|
Після закінчення стерилізації
препарату закрити вентиль подачі пара, повністю відкрити вентиль спуску
конденсату. Відкрити вентиль на лінії воздушки для охолодження автоклаву.
|
Температура всередині автоклаву не
більш 60С°
|
|
Заповнити журнал стерилізації
препарату.
|
|
|
Закрити вентиль спуску конденсату.
Заповнити автоклав А-1 (при відкритої воздушки) 0,0005% розчином метиленового
синього.
|
|
|
Перекрити всю арматуру на
автоклаві, створити в ньому розрідження.
|
Розрідження 0,04 МПа тривалість:
біля 5 хв.
|
|
Відкрити воздушку на автоклаві А-1
для гасіння вакууму.
|
|
|
Відкрити вентиль спуску конденсата
та злити розчин метиленового синього. Відкрити автоклав і, використовуючи
візок, витягти стелажі з препаратом з камери автоклаву. Промити стелажі
холодною питною водою.
|
|
|
В кожен стелаж вкласти етикетку,
на якій написати дату та час стерилізації.
|
|
|
Контролю відібрати з кожного ящика
по декілька ампул (всього 80 ампул) для контролю ВТК на: Стерильність (відбір
зразків згідно СРП ККМБ №024-01-99, контроль згідно СРП ККМБ №009-01-99)
Токсичність (відбір зразків згідно СРП ККБ №80-01-00, контроль згідно СРП ККБ
№081-01-00)
|
(К. 4.2) (К. 4.3)
|
|
Продукція до пакування
зберігається в спеціально відведеному приміщенні згідно вимог, означених в
АНД на препарат.
|
|
|
ПМВ. 5
|
Пакування та маркування ампул з
препаратом
|
|
|
Персонал підготований, одягнений у
відповідний технологічний одяг, забезпечений засобами індивідуального
захисту, який виконує правила техніки безпеки.
|
|
|
ПМВ. 5.1
|
Контроль препарату на механічні
включення та інші види браку.
|
|
|
Контроль препарату проводиться
візуально за столом ГФ-10 згідно РД 42У-001-93 «Контроль лікарських засобів
для парентерального застосування на механічні включення»
|
|
|
Переконатися, що в приміщенні, в
якому буде вироблятися перегляд не знаходяться переглянути препарати в
аналогічних ампулах.
|
|
|
Занести стелажі з продукцією з
приміщення зберігання стерилізованої продукції.
|
|
|
Брати підряд в руки ампули за
капіляри.
|
Кількість водночас взятих ампул -
не більш 10 штук.
|
|
Внести ампули до зони контролю
перед екраном в положенні «дінцем вгору» та продивитись їх на чорному та
білому фонах. Плавним рухом перевернути ампули в положення «дінцем вниз» та
вдруге продивитись на чорному та білому фонах.
|
Час контролю водночас взятих
ампул - 15 сек.
|
|
Відбракувати не запаяні ампули,
ампули з видимими механічними включеннями, а також биті ампули, з пригаром та
з явно висловленим неповним об’ємом наповнення, «сині» ампули.
|
Суцільний первинний контроль всіх
ампул (К. 5.1. 1)
|
|
Розмістити якісні ампули капіляром
вверх в спеціальні касети з заслінкою, в касету вкласти етикетку з вказівкою
назви препарату, номера серії та прізвища особи, яка проводила контроль, дати
перегляду.
|
|
|
Відбраковані ампули помістити в
спеціальну ємність з вказівкою «Брак».
|
|
|
З проглянутих ампул зробити
вибірку ампул.
|
Об’єм вибірки - 250 штук з
різноманітних касет.
|
|
За столом ГФ-10 провести вторинний
перегляд ампул, аналогічний первинному перегляду
|
(К. 5.1. 2)
|
|
При виявленні у вибірці більш 2%
ампул з механічними включеннями серію повернути на первинний перегляд.
|
|
|
Провести контроль ВТК на відкриття
видимих механічних включень.
|
Об’єм середньої проби - 315 штук
(для серії об’ємом більш 10 тис. амп.) (К. 5.1. 3)
|
|
Якщо число ампул з виявленими
механічними включеннями менш 9, серію прийняти, якщо більш 14 - забракувати.
|
|
|
Якщо число ампул з виявленими
механічними включеннями від 9 до 14, необхідно відібрати додаткову середню
пробу та провести її контроль.
|
Додаткова середня проба - 315
штук.
|
|
Після отримання дозволу ВТК на
пакування препарату передати касети на пакування.
|
|
|
ПМВ. 5.2
|
Пакування та маркування ампул
|
|
|
Підготувати лінію ГФ-11, 12 до
роботи.
|
|
|
Переконатися у відсутності
продукції та матеріалів інших серій, про що зробити відповідну відмітку в
протоколі серії.
|
|
|
Зняти ролик кліше та встановити на
ньому потрібні цифри номера серії та терміну придатності, закріпити кліше.
|
|
|
Встановити спочатку виготовлений
формний циліндр, який містить дані, що згідно розділу «Маркування» ТФС
повинні завдаватися на ампулу.
|
|
|
Завантажити бункер
етикетками-бандеролями, які повинні обов'язково пройти контроль ВТК на
відповідність нанесеної на них інформації розділу «Маркування» ТФС.
|
|
|
Встановити касету з ампулами в
загрузочний бункер, зняти з касети заслінку.
|
|
|
Запустити лінію в роботу. В кожну
коробку перед її закриванням вкладати ніж для розкриття ампул.
|
|
|
Протягом всього процесу стежити за
чіткістю маркування на ампулах, чіткістю відтиску кліше на коробках та якістю
склейки коробок. З початку процесу пакування не менше 1 разу протягом процесу
контролеру ВТК необхідно перевірити якість та чіткість маркування на ампулах
та відтиску кліше на коробках, про що зробити відповідну відмітку в протоколі
серії.
|
(К. 5.2. 1)
|
|
Вкласти готові коробки в ящики з
гофрованого картону.
|
По 14 коробок в ящику.
|
|
Оклеїти стик ящику по колу
скотчем.
|
|
|
На місці перетину стрічки скотчу
приклеїти на ящику етикетку групової тари.
|
На етикетці вручну вказати номер
серії та термін придатності.
|
|
Заповнити протокол пакування
серії, який додають до досьє на серію препарату.
|
|
|
Передати продукцію всією серією на
карантинний склад. До отримання позитивного висновку ВТК про якість продукції
зберігання продукція виробляється у відповідності з вимогами, означеними в
ТФС на 0,2% розчин ропівакаїну для ін’єкцій.
|
|
|
Контролеру ВТК відібрати пробу
препарату для проведення фізико-хімічного контролю.
|
3 коробки
|
|
Зробити фізико-хімічний аналіз
препарату на відповідність показникам, означеним в ТФС 42У-8-557-97 на 0,2%
розчин ропівакаїну для ін’єкцій.
|
(К. 5.2. 2)
|
|
Після позитивного висновку ВТК про
якість препарату оформити паспорт, додати його до досьє на серію препарату,
здати продукцію всією серією на склад. До реалізації продукція зберігається
на складі у відповідності з вимогами, означеними в ТФС.
|
|
|
Зробити арбітражну вибірку
препарату та помістити її в архів.
|
10 коробок
|
|
ПВ.6
|
Переробка відходів виробництва
|
|
|
Персонал підготований, одягнений у
відповідний технологічний одяг, забезпечений засобами індивідуального
захисту, який виконує правила техніки безпеки.
|
|
|
ПВ. 6.1
|
Розкриття ампул з розчином
препарату
|
|
|
Розкриття ампул здійснюється на
обладнанні для розкриття ампул по схемі ГФ-13.
|
|
|
Ампули завантажують в бункер
обладнання, з бункера ампули подають на барабан, який обертається шляхом
зняття заслінки бункера. Ампули проходять в барабані повз ножа-диску, який
обертається, та розчиняє ампулу на рівні шейки. Розкриті ампули з барабана
вкладають в касети з допомогою відкривача.
|
|
|
ПВ. 6.2
|
Відсмоктування розчину з ампул
|
|
|
Відсмоктування розчину з ампул
здійснюється за допомогою апарату для відсмоктування розчину з ампул по схемі
ГФ-14 вакуумним засобом.
|
|
|
Касету з ампулами накривають
лотком з отвором діаметром в 1 мм, вручну перевертають на 1800С в
положення «вверх дінцем», встановлюють в робочу ємкість апарату та закривають
кришку, при досягненні розрідження відкривають воздушку. Після встановлення
стрілки вакуумметра на 0 відкривають кришку апарату, касету витягають з
ємкості, перевертають на 1800С. Касети визволяють від ампул та
віддають на мийку. Розчин зливають в бутиль та передають на фільтрацію.
|
Розрідження 0,075 МПа
|
|
ПВ. 6.3
|
Фільтрація розчину
|
|
|
Фільтрацію розчину після відсмоктування
проводять через фільтр Ф-3. Розчин після фільтрації збирають у збірник (по
схемі З-3). Отриманий розчин передають на хімічний аналіз для контролю вмісту
основної речовини, зовнішнього вигляду, рН. При задовільних результатах
аналізу розчин передають на стадію ТП. 2.
|
(К. 6.1.)
|
|
|
|
|
3.5 Матеріальні
розрахунки
Розрахунки матеріальних
балансів при проектуванні хіміко-технологічних схем виконуються для:
- визначення
витрати сировини;
- визначення
кількостей потоків відходів, що підлягають утилізації;
- визначення
навантаження на окремі апарати і матеріальні лінії, необхідні для розрахунку їх
геометричних розмірів;
- визначення
кількості і складів потоків, необхідних для теплових розрахунків окремих
апаратів.
Матеріальний баланс
виробництва
Для автоматизації
розрахунку матеріального балансу хіміко-технологічних схем використовують
методику формалізації технологічних операцій: їх заміну формальними операціями
із потоками - змішування двох потоків в один (І) або ділення потоку на два
(II), як показано на рисунку 3.1.

Рисунок 3.1 - Схематичне
зображення потоків
Технологічна схема
виробництва 0,2% розчину ропівакаїну в операторному вигляді зображена на
рисунку 3.2. Усі технологічні операції представлені формальними операціями із
потоками. На операторній схемі здійснена нумерація усіх матеріальних потоків.
Розрах. потужність однієї серії (таблиця 3.3). Використовуючи описання процесу,
підготовляють вихідні дані для розрахунку і складають таблицю вихідних даних
(таблиця 3.4). Вихідні дані беруть із даних діючого виробництва або літ-ри.
Потім виконують розрахунок балансу і представляють підсумкову таблицю
розрахунку матеріального балансу, після цього складають таблицю витрат сировини
та матеріалів.
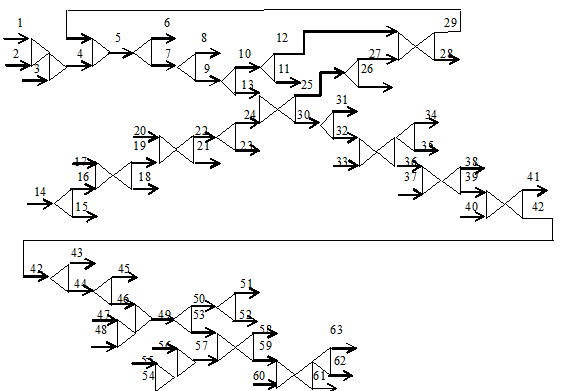
Рисунок 3.2 -
Графічна модель виробництва розчину ропівакаїну
Таблиця 3.3
Економічні розрахунки
|
Показник
|
|
|
Календарний фонд часу,
|
днів
|
365
|
|
- вихідні
|
днів
|
104
|
|
- святкові
|
днів
|
10
|
|
Кількість робочих днів
|
днів
|
251
|
|
Тривалість однієї зміни
|
год
|
8
|
|
Тривалість однієї серії
|
год
|
24
|
|
Кількість робочих змін
|
шт
|
3
|
|
Потужність за рік
|
пакувань
|
77700
|
|
ампул
|
5439000
|
|
кг
|
54390
|
|
Потужність за серію
|
пакувань
|
310
|
|
ампул
|
21700
|
|
кг
|
217
|
Таблиця 3.4 - Вихідні
дані для математичної моделі
|
Номер потока
|
Найменування потока
|
Од. виміру
|
Характеристика потока
|
|
1
|
Вода для ін'єкцій
|
кг
|
|
|
склад основної речовини
|
%
|
100,00%
|
|
густина
|
кг/л
|
1,00
|
|
2
|
Ропивакаина гидрохлорид
|
кг
|
|
|
осн. речовина
|
%
|
93,51%
|
|
вода
|
%
|
5,49%
|
|
домішки
|
%
|
1,00%
|
|
3
|
Натрія хлорид
|
кг
|
|
|
осн. речовина
|
%
|
99,90%
|
|
домішки
|
%
|
0,10%
|
|
4
|
Розчин п1+п2+п3
|
кг
|
|
|
Ропівакаїну гідрохлорид
|
%
|
0,20%
|
|
Натрія хлорид
|
%
|
0,86%
|
|
Домішки
|
%
|
0,01%
|
|
Води для ін'єкцій
|
%
|
98,93%
|
|
5
|
П4+п29
|
кг
|
|
|
6
|
Проба для аналізу
|
кг
|
0,20%
|
|
7
|
Розчин після аналізу
|
кг
|
|
|
8
|
Відходи
|
%
|
0,70%
|
|
9
|
Фільтрат
|
кг
|
|
|
10
|
Втрати на стер. фільтр.
|
%
|
5,00%
|
|
11
|
Відходи
|
%
|
0,30%
|
|
12
|
Р-н на регенерацію
|
%
|
5,00%
|
|
13
|
Стерильний розчин
|
|
|
|
14
|
Ампули зі склада
|
шт
|
|
|
15
|
Брак
|
%
|
1,10%
|
|
16
|
Ампули
|
шт
|
|
|
17
|
Питна вода
|
л/шт
|
0,05
|
|
18
|
Відпрацьована питна вода
|
л/шт
|
0,05
|
|
19
|
Ампули
|
шт
|
|
|
20
|
Вода очищена
|
л/шт
|
0,03
|
|
21
|
Відпрацьована очищена вода
|
л/шт
|
0,03
|
|
22
|
Ампули на сущіння і стериліз.
|
шт
|
|
|
23
|
Втрати амп.
|
%
|
0,05%
|
|
24
|
Ампули на наповнення
|
шт
|
|
|
25
|
Втрати при наповненні
|
%
|
2,00%
|
|
26
|
Бій скла
|
%
|
|
|
27
|
Р-н на регенерацію
|
%
|
|
|
28
|
Відходи
|
кг
|
|
|
29
|
Регенерований розчин від потоку 4
|
%
|
|
30
|
Наповнені ампули
|
|
|
|
розчину в ампулі
|
кг/шт
|
0,01
|
|
31
|
Втрати при стерилізації
|
%
|
0,30%
|
|
32
|
Стерильні ампули з розчином
|
|
|
|
33
|
Р-н метиленового синього
|
л
|
20,00
|
|
34
|
відпрацьований метиленовий синій
|
л
|
20,00
|
|
35
|
відбраковані амп.
|
%
|
1,00%
|
|
36
|
перевірені на герметичність
|
|
|
|
37
|
р-н НСl
|
л/шт
|
0,01
|
|
38
|
Відпрацьований розчин НСl
|
л/шт
|
0,01
|
|
39
|
Ампули на промивку
|
|
|
|
40
|
Питна вода
|
кг/шт
|
0,05
|
|
41
|
відпрацьована питна вода
|
кг/шт
|
0,05
|
|
42
|
ампули на механічні домішки
|
|
|
|
43
|
брак
|
%
|
1,20%
|
|
44
|
ампули на маркування
|
|
|
|
45
|
втрати
|
%
|
0,20%
|
|
46
|
ампули на первинну упаковку
|
|
|
|
ампул в пачці
|
шт
|
5,00
|
|
47
|
плівка
|
м2
|
0,05
|
|
48
|
фольга
|
м2
|
0,05
|
|
49
|
упаковка ампул
|
|
|
|
50
|
втрати
|
%
|
0,40%
|
|
51
|
фольга та плівка
|
%
|
0,400%
|
|
52
|
ампули на аналіз
|
%
|
0,400%
|
|
53
|
Ампули на вторинну упаковку
|
|
|
|
54
|
пачки
|
шт. на уп.
|
1,00
|
|
55
|
ножи
|
шт. на уп.
|
1,00
|
|
56
|
інструкції
|
шт. на уп.
|
1,00
|
|
57
|
п. 54 + п. 55+п. 56
|
|
|
|
58
|
втрати від п. 57
|
%
|
1,00%
|
|
59
|
пакувальння ампул
|
шт
|
|
|
60
|
коробки
|
шт
|
|
|
пачок в коробці
|
шт
|
14,00
|
|
61
|
втрати коробок
|
%
|
0,80%
|
|
62
|
ампули на зберігання
|
%
|
1,79%
|
|
63
|
готова продукція
|
пакування
|
|
Дані матеріального
балансу знаходяться в таблицях 3.5, 3.6, 3.7.
Таблиця 3.5 -
Матеріальний баланс стадії приготування 0,2% розчину ропівакаїну
|
Вміст основної речовини
|
Витрачено та одержано
|
|
Найменування
|
|
Маса, кг (г)
|
Об'єм
|
Кількість
|
|
|
загальна
|
основної речовини
|
кг-моль
|
л
|
шт.
|
|
Витрачено:
|
|
|
|
|
|
|
|
Вода для ін'єкцій
|
98,93%
|
|
250,80
|
|
|
|
|
Ропівакаїна гідрохлорид
|
0,20%
|
|
0,51
|
|
|
|
|
Натрію хлорид
|
0,86%
|
|
2,18
|
|
|
|
|
Домішки
|
0,01%
|
|
0,03
|
|
|
|
|
Регенерований розчин:
|
|
12,68
|
|
|
|
|
|
Вода для ін'єкцій
|
98,93%
|
|
12,54
|
|
|
|
|
Ропівакаїна гідрохлорид
|
0,20%
|
|
0,03
|
|
|
|
|
Натрію хлорид
|
0,86%
|
|
0,11
|
|
|
|
|
Домішки
|
0,01%
|
|
0,00
|
|
|
|
|
Разом
|
|
266,19
|
|
|
|
|
|
Одержано:
|
|
|
|
|
|
|
|
1. Розчину ропівакаїну
|
|
236,63
|
|
|
|
|
|
Вода для ін'єкцій
|
98,93%
|
|
234,10
|
|
|
|
|
Ропівакаїна гідрохлорид
|
0,20%
|
|
0,47
|
|
|
|
|
Натрію хлорид
|
0,86%
|
|
2,04
|
|
|
|
|
Домішки
|
0,01%
|
|
0,03
|
|
|
|
|
2. Втрати
|
|
29,56
|
|
|
|
|
|
Вода для ін'єкцій
|
98,93%
|
|
29,25
|
|
|
|
|
Ропівакаїна гідрохлорид
|
0,20%
|
|
0,06
|
|
|
|
|
Натрію хлорид
|
0,86%
|
|
0,25
|
|
|
|
|
Домішки
|
0,01%
|
|
0,00
|
|
|
|
|
Разом
|
|
266,19
|
|
|
|
|
Таблиця 3.6 -
Матеріальний баланс стадій ампулювання та контролю
|
Наймеування
|
Вміст основної речовини
|
Витрачено та одержано
|
|
|
Маса, кг (г)
|
Об'єм
|
Кількість
|
|
|
загальна
|
основної
|
кг-моль
|
л
|
шт.
|
|
|
|
речовини
|
|
|
|
|
Витрачено:
|
|
|
|
|
|
|
|
Розчину ропівакаїну
|
|
236,63
|
|
|
|
|
|
Вода для ін'єкцій
|
98,9%
|
|
234,10
|
|
|
|
|
Ропівакаїна гідрохлорид
|
0,2%
|
|
0,47
|
|
|
|
|
Натрію хлорид
|
0,9%
|
|
2,04
|
|
|
|
|
Домішки
|
0,01%
|
|
0,03
|
|
|
|
|
Ампули
|
|
|
|
|
|
23936
|
|
Разом
|
|
236,63
|
|
|
|
|
|
Одержано:
|
|
|
|
|
|
|
|
1. Ампули з розчином ропівакаїну
|
|
226,15
|
|
|
|
22615
|
|
Вода для ін'єкцій
|
98,93%
|
|
223,73
|
|
|
|
|
Ропівакаїна гідрохлорид
|
0,20%
|
|
0,45
|
|
|
|
|
Натрію хлорид
|
0,86%
|
|
1,94
|
|
|
|
|
Домішки
|
0,01%
|
|
0,02
|
|
|
|
|
2. Втрати ампул з розчином
|
|
10,48
|
|
|
|
1321
|
|
Вода для ін'єкцій
|
98,93%
|
|
10,37
|
|
|
|
|
Ропівакаїна гідрохлорид
|
0,20%
|
|
0,02
|
|
|
|
|
Натрію хлорид
|
0,86%
|
|
0,09
|
|
|
|
|
Домішки
|
0,01%
|
|
0,00
|
|
|
|
|
Разом
|
|
236,63
|
|
|
|
|
Таблиця 3.7 -
Матеріальний баланс стадії маркування і пакування
|
Найменування
|
Вміст основної речовини
|
Витрачено та одержано
|
|
|
Маса, кг (г)
|
Об’єм
|
Кількість
|
|
|
загальна
|
основної речовини
|
кг-моль
|
л
|
шт. (або м2)
|
|
Витрачено:
|
|
|
|
|
|
|
|
Ампули з розчином
|
|
226,15
|
|
|
|
22615
|
|
Вода для ін'єкцій
|
98,93%
|
|
223,73
|
|
|
|
|
Ропівакаїна гідрохлорид
|
0,20%
|
|
0,45
|
|
|
|
|
Натрію хлорид
|
0,86%
|
|
1,94
|
|
|
|
|
Домішки
|
0,01%
|
|
0,02
|
|
|
|
|
Плівка / фольга
|
|
|
|
|
|
226 / 226
|
|
Пачки
|
|
|
|
|
|
4514
|
|
Ножі
|
|
|
|
|
|
4495
|
|
Інструкції
|
|
|
|
|
|
4495
|
|
Паковання
|
|
|
|
|
|
317
|
|
Разом
|
|
226,15
|
|
|
|
|
|
Одержано:
|
|
|
|
|
|
|
|
Ампули з розчином
|
|
|
|
|
|
|
|
маркіров. і упакован.
|
|
|
|
|
|
21700
|
|
Вода для ін'єкцій
|
98,93%
|
|
214,68
|
|
|
|
|
Ропівакаїна гідрохлорид
|
0,20%
|
|
0,43
|
|
|
|
|
Натрію хлорид
|
0,86%
|
|
1,87
|
|
|
|
|
Домішки
|
0,01%
|
|
0,02
|
|
|
|
|
Плівка / фольга
|
|
|
|
|
|
217 / 217
|
|
Пачки
|
|
|
|
|
|
4340
|
|
Ножі
|
|
|
|
|
|
4340
|
|
Інструкції
|
|
|
|
|
|
4340
|
|
Паковання
|
|
|
|
|
|
310
|
|
Разом
|
|
217,00
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Втрати ампул з розчином
|
|
9,15
|
|
|
|
915
|
|
Вода для ін'єкцій
|
98,93%
|
|
9,05
|
|
|
|
|
Ропівакаїна гідрохлорид
|
0,20%
|
|
0,02
|
|
|
|
|
Натрію хлорид
|
0,86%
|
|
0,08
|
|
|
|
|
Домішки
|
0,01%
|
|
0,00
|
|
|
|
|
Плівка / фольга
|
|
|
|
|
|
9 / 9
|
|
Пачки
|
|
|
|
|
|
174
|
|
Ножі
|
|
|
|
|
|
155
|
|
Інструкції
|
|
Паковання
|
|
|
|
|
|
7
|
|
Разом
|
|
226,15
|
|
|
|
|
3.6 Вибір і розрахунки
основного технологічного устаткування
Вибір реактору
У результаті розрахунку
матеріального балансу об'єм реакційної суміші у реакторі Р-1 дорівнює за один
цикл 263,55 літрів. Враховуючи коефіцієнт заповнення 0,8 знаходять необхідний
об'єм (розрахунковий об’єм 349,44 л) реактора і обирають стандартний, об'єм
якого дорівнює 400 літрів типу РСЗЯ рн - 6/0,40 - нж, тобто реактор стальний,
закритий, із якірною мішалкою, із рубашкою, з нижнім випуском, із робочим
тиском у корпусі 0,6 МПа, із виконанням зі від'ємною кришкою та еліптичним
днищем, із нержавіючої сталі (таблиця 3.8) [18, 19].
Таблиця 3.8 - Розрахунок
реактора
|
Максимальне завантаження реактора
|
кг
|
266,19
|
|
Максимальний коефіциент
завантаження реактора
|
|
0,8
|
|
Об’єм розрахованого реактора
|
л
|
263,55
|
|
Об’єм найближчого стандартного
реактора
|
л
|
400
|
|
Коефіциент завантаження реактора
|
|
0,66
|
Основні розміри корпусу
за ДСТ 6533-78:
загальна висота (Н) 2192
мм,
діаметр апарату (Д) 800
мм,
діаметр мішалки (dм) 700
мм,
діаметр рубашки (Ді) 900
мм,
товщина стінки апарату 8
мм,
загальна вага апарату
353 кг.
Запас потужності апарату
розраховується за формулою:
Зпот = V ст. р. - V р.
с.
Де Зпот - запас
потужності, л,ст: Р. - об'єм стандартного реактору, лр. с. - об'єм реакційної
суміші, л.
пот.=400-263,55 =136,45 л.
Вибір фланців та
болтового з'єднання
Виходячи з того, що
робочий тиск складає 0,6МПа, приймаємо більше найближче значення стандартного
умовного тиску Ру = 0,7МПа.
Для даного типу апарата
внутрішній діаметр складає 800 мм, Dу = 800 мм.
За ОСТ 26-427-79 при Ру
= 0,6МПа и Dу = 800 мм прийняті фланці стандартні стальні приварні встик із
впадиною та виступом, який наплавлен з корозійностійкої сталі. У якості
матеріалу, із якого виготовлено фланцеве з'єднання, обираємо сталь марки 09Г2С
або 12Х18Н10Т.
Вибір стандартного
болтового з'єднання проведено за ГОСТ 7798-70. Приймняті болти із шестиграною
голівкою класу точності «В» із полем допуску 6д, класу точності 5,8 стальні,
сталь марки 40Х без покриття. Умовне позначення обранного болта: Болт
М-12-6д*100*58*40Х ГОСТ 7798-70.
Вибір прокладок
За ОСТ 26-430-79
обираємо стандартні прокладки, виготовлені із фторопласту - 4 виду 1 - 800 - 6.
Вибір стандартних днища
та кришки
За ГОСТ 6533 - 78 обрано
еліптичне відбортоване днище, виготовлене зісталі. Висота борту h = 50 мм.
Умовне позначення обраного днища із Dу=800 мм,= 8 мм: Днище 800 - 8 ГОСТ64533 -
78.
За ГОСТ 12623 - 78
вибираємоплоску, відбортовану стальну кришку із внутрішнім базовим діаметром D
= 800 мм, S = 6 мм. Умовне позначення обраної кришки: Кришка 800 - 6 ГОСТ 12623
- 78.
Вибір рубашки
За ОСТ 26-01 - 984 - 74
обрана нероз'ємна рубашка з еліптичним днищем та нижнім випуском продукту.
Рубашка апарату виготовлена із сталі марки 09Г2С за ГОСТ 10885 - 75. Умовне
позначення обраної рубашки (виконання 2) при D=800 мм, Н=480 мм, тиску Р =
0,6МПа із відбортовкою (0): Рубашка 2 -850-480-6-0 ГОСТ 2601 -984-74.
Вибір штуцерів
За ГОСТ 26-1407-76
обираємо штуцера із фланцами стальними приварними встик із з'єднуючим виступом
та тонкостінним патрубком.
Штуцер для введення пари
та виведення конденсату виготовляються із сталі марки 02Г2С, а усі інші штуцери
- із сталі марки 12Х18Н10Т за ГОСТ 10-885-75.
Вибір перемішувачу
За МН 5874-66 вибраний
перемішувач якірного типу для прискорення розчинення. Перемішувач виготовлено
із корозійностійкої сталі марки 12Х18Н10Т за ГОСТ 10-885-75. Умовне позначення
обраного перемішувачу шифру 31 нормального виконання (конструктивне виконання D
= 700 мм із корозійностійеої сталі (виконання 2)):
Перемішувач 31.1.700.2
МН 5874-66. Вибір приводу
За МН 5855-66 вибраний
вертикальний привід перемішувачу типу 1. Привід забезпечує потужність N =
0,4кВт та швидкість обертів перемішувачу n = 75 об/хв, має типорозмір мотору -
редуктору 11. Вал виготовлений із корозійностійкої сталі марки 12Х18Н10Т за
ГОСТ 10885-75. Умовне позначення обраного приводу 2 із N = 0,4кВт та w= 7,85
рад/сек:
Привід 2-1,1-7,85 МН
5855-66
Вибір опор
Маса апарату складає 353
кг. За ОСТ 26-665-79 обрано опори типу 1 (лапи), виготовлені із сталі марки
09Г2С за ГОСТ 10885-75. Умовне позначення обраноїопори типу 1 із припустимим
навантаженням Q = 1,6кН:
Опора 1-1600 ГОСТ
26665-79.3.6.2 Вибір іншого технологічного обладнання
Все технологічне
обладнання, що використовується для виготовлення розчину ропівакаїну в ампулах
розміщено в таблиці 3.9. Електрообладнання, встановлене в вибухонебезпечних і
пожежонебезпечних зонах, має ступінь захисту оболонки IP.
Таблиця 3.9 -
Специфікація обладнання [18, 19]
|
Позиція
|
Позначка
|
Найменування
|
Кіль - кість
|
Маса
|
Примітка
|
|
З-1
|
|
Збірник води очищеної Прямокутної
форми з водомірним склом, з кришкою. Об’єм, л: 400. Габаритні розміри, мм:
720´ 700´ 800. Надходження води згори самопливом, вивантаження знизу
самопливом Виробник: ВАТ «Дніпрофарм»
|
1
|
|
Р. 3. - сталь 12Х18Н10Т
|
|
В-1
|
Тип: ВНЦ-2 ДГСТ 7327-55 Тип:
РН-10-13У ТУ 25.06. 575-77
|
Ваги технічні Межа зважув., кг:
від 0.2г до 2 Ціна ділення: 2 г Габаритні розміри, мм: 500´ 300´ 630 Виробник:
Запорізький досвідчений завод дефектоскопії Або: Ваги настольні циферблатні
Межа зважув., від 100г до 10 кг Ціна ділення: 5 г Виробник: Кіровоградський
завод дозуючих автоматів
|
1 1
|
22 кг
|
|
|
Р-1
|
|
Реактор для приг. розчину.
Циліндричної форми, обладн. мішалкою, тепловою сорочкою і водомірним склом,
плоскою кришкою. Місткість, л: 400. Електродвигун зі ступенем захисту
оболонки IP 54. Частота обертання мішалки, с 1: 1.25 - 1.33. Потужність, що
споживається, кВт: не більш 1,1. Живлення: 380 В, 50 Гц Тиск в корпусі
сорочки, МПА: не більш 0.7. Площа теплообміну, м2: 2,2
|
1
|
353 кг
|
Р. 3. - сталь 10Х17Н13М3Т
|
|
|
Надходження продукту згори,
вивантаження знизу шляхом створення вакууму в мірнику М-1 Габаритні розміри
реактора, мм: діаметр - 900, висота - 2192 Виробник: завод «Емальпосуд», м.
Чернівці
|
|
|
|
|
Ф-1
|
Тип: УСФ-293
|
Фільтр. Площа фільтрації, м2:
0,055 Продуктивність при перепаді тиску 0,02 МПа, л/годину: не менше 100
Виробник: ОКПБ, м. Киріши
|
1
|
|
Р.3.-сталь 12Х18Н10Т, гума
силікону. Фільтруючий матеріал: 1 шар капрону і 1 шар фільтрувального паперу
|
|
М-1
|
|
Мірник розчину Грушовидної форми з
еліптичним днищем і плоскою кришкою. Об’єм, л: 630 Габаритні розміри, мм:
діаметр-800, висота-1670. Робочий тиск, МПА: до 0.02 Надходження розчину
згори шляхом створення в збірці вакууму, вивантаження знизу під впливом
стислого повітря Виробник: фірма «Кавалиер», Чехословакія
|
2
|
12.5
|
Р.З. - скло «Симакс»
|
|
Ф-2
|
Тип: ФТВП 11 SKL 7001 або
SKL 7002 «Pall»
|
Фільтр патронний Максимальний
перепад тиску, МПА: 0.6 Габаритні розміри, мм: діаметр-72, висота-250 Площа
поверхні, що фільтрує, м2: 0.2 Що затримує спроможність, мкм: 0.3 Виробник:
«Укрфільтр», м. Чернігів Або Фільтр патронний Максимальний перепад тиску,
МПа: не більш 10 Площа поверхні, що фільтрує, м2: 0.15 Габаритні розміри, мм:
діаметр 60, висота 250 мм Що затримує спроможність, мкм: 0.2 Виробник: Pall,
GmbH, Германія
|
1 1
|
|
Фільтрує матеріал -
волокноутворюючий поліпропілен ТУ-6-05-1105-78, каркас - поліетилен ДГСТ
16338-77 Корпус сталь 316 L (аналог стали 20Х25Н20С2)
|
|
З-2
|
|
Балон Циліндричної форми з
герметично притертою пробкою з сифонами і заглушкою. Об’єм, л: 15 Надходження
розчину згори під тиском, вивантаження через сифон шляхом вакууму Виробник:
Скляний завод, м. Житомир
|
13
|
|
Р.З. - скло
|
|
ГФ-1
|
|
Вана для мийки касет Прямокутної
форми, об’єм - 800 л Габаритні розміри, мм: 1500´ 750´ 750 Надходження води
згори самопливом, спуск знизу в каналізацію Виробник: ВАТ «Дніпрофарм»
|
1
|
|
Р. 3. - сталь 12Х18Н10Т
|
|
ГФ-2
|
|
Ванна для зовнішньої мийки ампул
Прямокутної форми, об’єм - 800 л Габаритні розміри, мм: 1500´ 750´ 750 Надходження води
згори самопливом, спуск знизу в каналізацію Виробник: ВАТ «Дніпрофарм»
|
1
|
|
Р. 3. - сталь 12Х18Н10Т
|
|
ГФ-3
|
Тип: АП-30М
|
Напівавтомат для вакуумн. внутр.
мийки ампул. Продуктивність, амп/година: 4500. Температура води 700С.
Розрідження вакууму, МПА: не менше 0.08 Живлення пневмосистеми апарату
стислим повітрям тиском, МПА: не менше 0.03 Видаток води, що містить на 1
касету, м3: не більш 0.027 Напруга змінного струму живильної мережі, В: 220
Що споживається потужність, кВт: не більш 0.3 Габаритні розміри, мм: 1115´ 720´ 1575 Виробник: завод
технологічного обладнання, м. Маріуполь
|
5
|
480 кг
|
Р. 3. - сталь 12Х18Н10Т
|
|
ГФ-4, ГФ-5
|
|
Сухожарова піч полочного типу.
Місткість: 30 контейнерів Потужн. спіралі, що нагріває, кВт: 18 Живлення:
змінний струм 380 В, 50Гц Виробник: ВАТ «Дніпрофарм»
|
3
|
|
Р. 3. - муфельный цегла
|
|
ГФ-6, 7
|
|
Автомат для наповнення і запайки
ампул Продуктивність, амп/година: 2500 - 3600 Що споживається потужність,
кВт: не більш 0.2 Живлення: змінний струм 380 В, 50 Гц Тиск природного газу,
МПА: 0.04 - 0.05 Тиск кисню, МПА: 0.4 - 0.5 Тиск стислого повітря, МПА: 0.1 -
1.15 Габаритні розміри, мм: 1155´ 705´ 1400 Виробник: НПО «Прогрес», м. Ленінград Маркіровка по
вибухозахисту обладнання 2Е №11АТ2
|
1
|
500
|
|
|
ГФ-8
|
|
Стелаж Перфорирований прямокутної
форми Габаритні розміри, мм: 600´ 400´ 220 Виробник ВАТ «Дніпрофарм» Або: Перфорований
прямокутної форми Габаритні розміри, мм: 800× 500 ×
300 Виробник: завод пластмас, м. Дніпропетровськ
|
80 50
|
|
Р.З. - оцинкована листова сталь.
Поліпропілен
|
|
А-1
|
Тип АВТ-5
|
Автоклав Робочий об’єм камери, дм3:
610 Температура стерилізації, ЕС: від 102 до 132 Максимальний робочий тиск,
кгс/см2 (МПА): 2.0 (0.2) Габаритні розміри, мм: 1100× 1250 ×2900
|
3
|
|
Р. З - сталь 3
|
|
М-2
|
|
Мірник метиленового синього для
перевірки ампул на герметичність Грушовидної форми з еліптичним днищем і
плоскою кришкою. Об’єм, л:100 Габаритні розміри, мм: діаметр-560, висота-850
Виробник: фірма «Кавалієр», Чехія
|
1
|
12,5
|
Р.3.-скло «Симакс»
|
|
|
|
|
|
|
|
|
3.7 Контроль виробництва
Вхідний контроль
сировини, допоміжних матеріалів здійснює відділ технічного контролю у
відповідності з РД 64У-2-95 «Вхідний контроль якості сировини та матеріалів на
підприємствах медичної та мікробіологічної промисловості по показникам якості,
передбачених ТФС, а також «Переліком сировини та матеріалів», затверджуваним
головним інженером підприємства.
Контроль готової
продукції здійснює відділ технічного контролю по поданню продукції виробничими
цехами та цехом пакування готових лікарських засобів у відповідності з РД
64-062-88 «Положення про правила приймання готової продукції на підприємствах
медичної та мікробіологічної промисловості по всім показникам якості, передбаченими
ТФС на кожний вигляд продукції.
Готова продукція
передається на склад для відвантаження її споживачу тільки при повній
відповідності ТФС та наявності паспорту, підтверджуючого її якість. Крім того,
кожна серія ГЛЗ, який випускається підприємством, представляється в
контрольно-аналітичну лабораторію Держінспекції по контролю якості лікарських
засобів для підтвердження її якості та реалізується споживачам з додатковим
сертифікатом.
Технологічний
операційний контроль здійснюється: постійно - майстрами та хіміками дільниць та
начальниками цехів; вибірково - фахівцями ВТК, представниками технологічної та
метрологічної служб підприємства. При цьому перевіряються виконання вимог
промислових технологічних регламентів, дотримання правив виробництва та ведення
технологічної документації.
Контроль за правильною
роботою контрольно-вимірювальних приладів здійснюють робітники КИП і А
підприємства.
Всі відхилення від
регламенту фіксуються в протоколах, журналах, з відміткою про усунення
виявлених порушень.
Контроль якості
напівпродукту в процесі приготування здійснюється згідно стандартним робочим
процедурам:
СРП ККХ №041-01-99
«Порядок проведення іспиту напівпродукту розчину «Ропівакаїн» для ін'єкцій по
показнику «рН». (К. 2.1. 4; К.6.1).
СРП ККХ №041-01-99 «Порядок
проведення іспиту напівпродукту розчину «Ропівакаїн» для ін'єкцій по показнику
«Кількісне визначення ропівакаїну». (К. 2.1. 5; К.6.1).
СРП ККПХ №0068-01-01
«Порядок проведення іспитів проміжної продукції на стадії наповнення при
виготовленні ін'єкційних ЛЗ в ампулах по показнику «Номінальний об’єм» (К.
2.5).
СРП ККПХ №069-01-01
«Порядок проведення іспитів проміжної продукції на стадії фільтрації при
виготовленні ін'єкційних ЛЗ по показнику «Механічні включення» (К. 3.5. 2).
СРП ККМБ №024-01-99
«Відбір зразків готових лікарських засобів для іспиту на стерильність» (К.
4.2).
СРП ККМБ №009-01-99
«Проведення іспиту на стерильність ГЛЗ» (К. 4.2).
СРП ККБ №080-01-00
«Порядок відбору та підготовки зразків ГЛЗ для проведення іспиту на
пірогенність та токсичність» (К. 4.3).
СРП ККБ №081-01-00
«Проведення іспиту на токсичність» (К. 4.3).
СРП ККХ №050-01-99
«Порядок відбору зразків ГЛЗ для проведення іспитів та вимірів у
хіміко-аналітичній лабораторії». (К. 5.2. 2)
В Таблиці 3.10 наведені
найважливіші контрольні параметри, дотримання яких забезпечує правильність
ведення технологічного процесу виробництва 0,2% розчину ропівакаїну та
отримання продукту, відповідного його специфікаціям.
Таблиця 3.10 -
Контрольні точки виробництва і засоби їх контролю
|
№ контроль-ної точки (назва
стадії)
|
Об’єкт контролю і показник, який
визначається
|
Засіб контролю
|
Періодичн. перевірки та порядок
відбору проб
|
Нормативна характер - ристика
показника, який визначається
|
|
ДР. 1. Санітарна підготов-ка
виробн.
|
Повітря виробничих приміщень Вміст
механічних часток Мікробна контамінація Поверхні виробничих приміщень
Мікробна контамінація Внутрішні та зовнішні поверхні обладнання Мікробна
контамінація Технологічний одяг Режим прання Режим стерилізації Ступінь
виділення часток тканиною технологічного одягу Руки персоналу Мікробна
контамінація
|
|
Згідно стандартам підприємства СТП
64-01973118-02-01 «Система забезпечення якості. Організація виробництва
ін’єкційних лікарських засобів. Санітарна підготовка виробництва», СТП
64-01973118-03-01 «Система забезпечення якості. Технологічні процеси
виробництва ін’єкційних лікарських засобів. Спеціальний одяг та інші засоби
індивідуального захисту».
|
|
К. 2.0. 1 Вхідний контроль
ропівакаїну [5]
|
|
|
Порядок відбору проб у відповідн.
з
|
|
|
Зовнішній вигляд - розчинність
|
Візуально
|
СРП ККХ №025-01-99 «Відбір зразків
сировини та матеріалів для проведення вхідного контролю якості по
фізико-хімічним показникам»
|
Білий або майже білий кристалічний
порошок. Добре розчинний у воді, розчинний в етанолі (96%), мало розчинний в
метилен - хлориді.
|
|
|
|
|
|
|
3.8 Техніко-економічні
розрахунки
Метою цього розділу є
техніко-економічне обґрунтування доцільності запропонованих під час виконання
дипломного проекту техніко-технологічних рішень. Для цього розрахуємо перелік
показників, які характеризують ефективність використання виробничих
потужностей: коефіцієнт екстенсивного використання обладнання, коефіцієнт
інтенсивного використання обладнання, інтегральний коефіцієнт, резерв
потужності, фондовіддачу, фондоємність та фондоозброєність [22, 23, 24, 25,
26].
Визначення вартості
річного обсягу товарної продукції
Вихідні дані для
розрахунку:
. Річний випуск
продукції в натуральному виразі - 57109,5 літрів на рік.
. Оптова ціна за одну
натуральну одиницю продукції - 1400,0 грн./л (згідно оптової ціни діючого
виробництва)
. Вартість річного
обсягу товарної продукції, грн.
Визначається за формулою
(3.1):
ТП=Ар·Ц, (3.1)
де ТП - вартість річного
обсягу товарної продукції, грн.;
Ар - випуск
продукції в натуральному вираженні, л/рік;
Ц - ціна одиниці продукції
- 1 л, грн.
Тоді вартість річного
обсягу товарної продукції:
ТП=57109,5·1400,0 =
79953300,0 грн.
Результати заносимо до
таблиці 3.11.
Таблиця 3.11 - Виробнича
потужність цеху з випуску товарної продукції
|
Найменування продукції
|
Натуральна одиниця виміру
|
Річний випуск продукції в
натуральному виразі
|
Оптова ціна за одну нату-ральну
одини-цю продукції, грн.
|
Вартість річного обсягу товарної
продукції, грн.
|
|
0,2% розчин ропівакаїну в ампулах
по 10 мл
|
л
|
57109,5
|
1400,0
|
79953300,0
|
Розрахунок суми
капітальних вкладень та амортизаційних відрахувань
Потреба в капітальних
вкладеннях визначає вартість основних фондів, необхідних для виробництва
продукції, передбаченої виробничою програмою цеху: будинків, споруджень,
передавальних пристроїв, робочих машин і устаткування, підйомно-транспортних
засобів, КВП та інше. В таблиці 3.8 приведена вартість ОВФ і сума
амортизаційних відрахувань.
По 1 групі основних
виробничих фондів (ОВФ) норма амортизації становить 8%, по 2 групі ОВФ - 40%,
по 3 групі ОВФ - 24%, по 4 групі ОВФ - 60%) (таблиця 3.12).
Таблиця 3.12 - Сума
капітальних вкладень та амортизаційних відрахувань
|
Найменування
|
Балансова вартість, грн.
|
Амортизаційні відрахування
|
|
|
Норма амортизації, %
|
Сума, грн.
|
|
1. Будинки, спорудження і
передавальні пристрої
|
19140000,00
|
8
|
1531200,00
|
|
2. Автотранспорт, прилади,
інструменти
|
12952000,00
|
40
|
5180800,00
|
|
3. Силове та робоче обладнання
|
12987400,00
|
24
|
3116976,00
|
|
4. ЕОМ та інші машини автоматичної
обробки інформації
|
16603900,00
|
60
|
9962340,00
|
|
Всього
|
61683300,00
|
|
19791316,00
|
Основні фонди
підприємства
Враховуючи специфіку
технології виробництва розчину ропівакаїну гідрохлориду і особливості
експлуатації обраного реактору приймаємо режим роботи цеху з п'ятиденним
робочим тижнем, в одну зміни по 8 робочих годин.
Виходячи з прийнятого
для цеху режиму роботи, розраховуємо річний ефективний фонд часу роботи
основного технологічного обладнання.
Ефективний фонд часу
обладнання визначається за формулою (3.2):
Теф=(Тк-Твих-Тсв-Тппр)·tзм·n, (3.2)
де Тк -
календарний фонд часу (365 діб або 2920 годин);
Твих і Тсв
- відповідно сумарна тривалість вихідних і святкових днів протягом року, Твих=104
дні, Тсв=10 днів;- кількість змін;
ТППР -
тривалість планово-попереджувальних ремонтних робіт, ТППР=1 день;зм
- тривалість зміни.
Теф=(365-104-10
- 1)·8·1 = 2000 годин=250 днів
Ефективність
використання виробничої потужності
Ефективність
використання виробничої потужності визначається переліком показників.
Коефіцієнт екстенсивного
використання обладнання - Кекс - характеризує використання
обладнання за період часу і визначається за формулою (3.3):
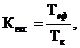 (3.3)
(3.3)
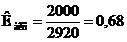
Коефіцієнт
інтенсивного використання обладнання (Кінт) - характеризує
використання обладнання по продуктивності і визначається за формулою (3.4):
 (3.4)
(3.4)
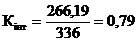
де Пф -
фактична продуктивність реактору,
Ппасп -
паспортна продуктивність реактора за один цикл.
Інтегральний коефіцієнт
(Kiнтегр) дає уявлення про резерв потужності, (3.5):
 (3.5)
(3.5)
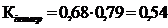
Резерв потужності
визначається за формулою (3.6):
 (3.6)
(3.6)
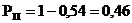
Фондовіддачу
розраховують за формулою (3.7):

де ТП - вартість
основної продукції, грн.;- вартість основних фондів, грн.;
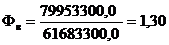 грн./грн.
грн./грн.
Фондоємність
розраховується за формулою (3.8):
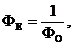 (3.8)
(3.8)
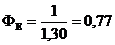 грн./грн.
грн./грн.
Розраховуємо за формулою
фондоозброєність (3.9):
 , (3.9)
, (3.9)
 грн./чол.
грн./чол.
де F - вартість
основних фондів, грн.;
 -
чисельність промислово-виробничого персоналу, чол.;
-
чисельність промислово-виробничого персоналу, чол.;
Річна сума амортизації
дорівнює сумі амортизації всіх груп основних виробничих фондів.
 грн.
грн.
Розраховані вище
показники ефективності використання основних фондів підприємства заносимо до
таблиці 3.13.
Таблиця 3.13 -
Показники ефективності використання основних фондів підприємства
|
Показники
|
од. вим.
|
значення
|
|
1. Коефіцієнт екстенсивної роботи
обладнання
|
-
|
0,68
|
|
2. Коефіцієнт інтенсивної роботи
обладнання
|
-
|
0,79
|
|
3. Коефіцієнт інтегральної роботи
обладнання
|
-
|
0,54
|
|
4. Резерв потужності
|
-
|
0,46
|
|
5. Фондовіддача
|
грн./грн.
|
1,3
|
|
6. Фондоємність
|
грн./грн.
|
0,77
|
|
7. Фондоозброєність
|
грн./чол.
|
|
|
9. Річна сума амортизації
|
грн.
|
19791316,0
|
Отже, виробництво 0,2%
розчину ропівакаїну гідрохлориду є вигідним та економічно доцільним, що
підтверджують розраховані вищі техніко-економічні показники, а саме
фондовіддача, фондоємність та фондоозброєність. Продукт, що випускається, буде
користуватися попитом на ринку збуту та є ефективним з точки зору економічної
прибутковості.
Висновки
- Розроблений
проект цеху з виробництва 0,2% розчину ропівакаїну для інфузії в апмулах.
- Розрахований
матеріальний баланс однієї серії.
- Спроектовано
планування цеху із урахуванням основних вимог, які пред’являються до
хіміко-технологічних процесів та санітарних норм і правил, до вибухо-,
пожежобезпеки, розміщено в ньому обладнання, згідно з правильною організацією
направлення потоку повітря, його швидкістю, доцільне розміщення зон із різними
класами чистоти.
- Розроблений
проект автоматизації стадії приготування розчину ропівакаїну. Вибрана структура
управління об’єктом автоматизації.
- Підрахована
кількість промислових викидів, рідких відходів та стічних вод; розроблені
методи їх очищення та утилізації. Розроблена система заходів для виконання
вимог екологічної безпеки. Розроблено методи очищення та рекуперації
промислових викидів у навколишнє середовище.
- Розраховано
економічну ефективність цеху. Визначено за результатами розрахунків, що дане
підприємство є економічно доцільним.
Список літератури
1. Кесарево
сечение: общая информация/ Азбука для родителей [Электронный ресурс] // Режим
доступа: http://www.roditeli.ua/rody/all_about_childbirth/cesarean_birth -
Заголовок с экрана.
. Наропин
(ропивакаин) в лечении боли: идеальный выбор?/ Подробно о лекарствах
[Электронный ресурс] // Режим доступа: http://medi.ru/doc/8100304.htm - Заголовок
с экрана.
. Харкевич, Д.А.
Фармакология [Текст]: учебник. Издание девятое / Д.А. Харкевич. - М.:
ГЭОТАР-Медиа, 2006. - 736 с.
. Інструкція для
прийому лікувального препарату для медичного використання Наропін / Офіційний
сайт ASTRAZENECA [Електронний ресурс] // Режим доступу:
http://www.astrazeneca.ru/_mshost7275093/content/resources/images/9061482/9072103/naropin_5mgml
- Заголовок с екрану.
. European
pharmacopoeia. Six edition. Volume 2. Consil of Europe. Strasbourg.
. Фармакологические
аспекты / Школа регионарной анестезии [Электронный ресурс] // Режим доступа:
http://www.critical.ru/RegionarSchool/content/view/lessons/121/0010.html -
Заголовок с экрана.
. Энантиомеры /
Википедия [Электронный ресурс] // Режим доступа:
ru.wikipedia.org/wiki/Энантиомеры - Заголовок с экрана.
. Основные понятия
стереохимии/ Eesti Keemiaolümpiaddid [Электронный ресурс] //
http://eko.olunet.org/pdf/sessioon/Stereochemistry.rus - Заголовок с экрана.
. Сравнительная
характеристика местных анестетиков для эпидуральной анестезии в плановой
хирургической практике / Острые и неотложные состояния в практике врача
[Электронный ресурс] // http://urgent.com.ua/article/326.html - Заголовок с
экрана.
. Пат. WO 96/36606
Sweden, C07D 211/60, С07B 57/00. New processed for the preparation of
ropisvacaine hydrochloride monohydrate [Текст] / P. Jaksch. (Швеція) -
№PCT/SE96/00563; заявл. 30.04.96; опубл. 21.11.96, - 13 с.
. Пат. US
2009/0187024 А1 USA, C07D 211/32 211/32. Ropivacaine hydrochloride anhydrate
and the preparation thereof [Текст] / R. Vyas (Великобританія), S.V. Nidadavolu
(Індія), D.H. Shah (Індія) - №PCT/NL2007/050180; заявл. 25.04.07; опубл.
23.07.09, - 5 с.
. Вартанян, Р.С.
Синтез основных лекарственных средств [Текст] / Р.С. Вартанян. - М.: МИА, 2004.
- 845 с.
. Місцеві анестетики/
Тернопільський державний медичний університет [Електронний ресурс] Режим
доступу: http://intranet.tdmu.edu.ua - Заголовок з екрану.
. Держава фармкопея
України [Текст] / Державне підприємство «Науково - експертний фармакопейний
центр». - 1-е вид. - Доповнення 1. - Х.: РІРЕГ, 2001. - Доповнення 1. - 2004. -
520 с.
. Чуешов, В.И.
Промышленная технология лекарств [Текст]: учебник. Том второй / В.И. Чуешов [и
др.] - Х.: Изд-во НФаУ, 2002. - 716 с.
. Энциклопедия
лекарств и товаров аптечного ассортимента / Наропин® (Naropin®): инструкция по
применению, противопоказания и состав [Електронный ресурс] Режим доступу:
http://www.rlsnet.ru/tn_index_id_12221.htm - Заголовок з екрану.
. Ампулы стеклянные
предназначены для фасования, транспортирования и хранения лекарственных средств
и других веществ / ОАО «Полтавский завод медицинского стекла» [Електронный
ресурс] Режим доступ: http://www.medicalglass.com.ua/product-2.html#ampula3 -
Заголовок с экрана.
. Лащинский, А.А.
Основы конструирования и расчета химической аппаратуры [Текст] / А.А. Лащинский
[и др.] - Ленинград: Машиностоение, 1970. - 752 с. 19. Чуешов, В.И. Каталог
технического оборудования химико-фармацевтической промышленности [Текст]:
учебное пособие / Чуешов В.И. [и др.] - Х.: НФаУ, 2005. - 307 с.
. Дмитрієвський, Д.
І. Технологія лікарських препаратів промислового виробництва [Текст]: навч.
Посібник. Видання друге / Д. І. Дмитрієвський [та ін.] - Вінниця: Нова книга,
2008. - 280 с.
. Основы технологии
готовых лекарственных средств / Cайт факультета Промышленной Технологии
Лекарств (ФПТЛ) Санкт-Петербургской Государственной Химико-Фармацевтической
Академии (СПХФА) [Электронный ресурс] // Режим доступа:
http://www.fptl.ru/Y4eba_osnovi-gls.html - Заголовок с экрана.
. Авдеенко В.Н.,
Котлов ВА. Производственный потенциал промышленного предприятия. - М.:
Экономика, 1989. Ш. Бизнес-план / Под ред. В.М. Попова. - М.: Финансы и
статистика, 1994.
. Войчик І.М, Харів
П.С, Хопчак М.І. Економіка підприємств. - Л.: Спо-лом, 1998.
. Вихрущ В.П.
Основи бізнесу: Підручник. - Т.: Збруч, 1998. - Том 1.
. Вихрущ В.П.,
Тирпак І.В. Економіка нових форм господарювання. - Бучач: ТАНГ, 1994. - 158 с.
. Волков О.
Экономика предприятия. - М.: ИНФРА, 1997. - 216 с.
. ГОСТ 12.0.003-74
Опасные и вредные производственные факторы. [Текст] - Введ. с 1976-01-01. - М.:
Изд-во стандартов, 1976. - 2 с.
.
Пожаровзрывоопасность веществ и материалов и средства их тушения [Текст]:
справочник / под ред. А.Н. Баратова. - М.: Химия, 1990. - 384 с.
. СНиП 2.01.02-85*.
Противопожарные нормы / ЦНИИСК им. Кучеренко Госстроя СССР. М.: 1985.
. ГОСТ 12.1.004-91.
Пожарная безопасность. Общие требования. М., 1992. - 78 с.
. ГОСТ 12.1.003-83.
Шум. Общие требования безопасности. - М.: Изд-во стандартов, 1983. - 11 с.
. Вредные вещества
в промышленности. [Текст]: справочник в 3-х томах / Под ред. Лазарева Н.В. -
М.: Химия, 1991. - 271 с.
. Белов, С.В.
Охрана окружающей среды [Текст] / Белов С.В. [и др.] - М.: Высшая школа, 1991.
- 319 с.
. Сметанин, В.И.
Защита окружающей среды от отходов производства и потребления [Текст] / В.И.
Сметанин - М.: Колос, 2000. - 230 с.
. Кисельов, В.В.
Методичні рекомендації до структури та змісту дипломного проекту
освітньо-кваліфікаційного рівня «Бакалавр» для студентів IV-V курсів усіх форм
навчання за кредитно-модульною системою напряму підготовки 6.120201 «фармація»
[Текст]: метод. вказівки / В.В. Кисельов [та ін.] - Дніпропетровськ: УДХТУ,
2011. - 42 с.