Химия полимеров
Содержание
1. Классификация ВМС по
происхождению
2. Кинетика процесса
поликонденсации
. Концепция
аморфно-кристаллической структуры полимеров
. Полимерные кислоты, их
получение, свойства и применение
Литература
1.
Классификация ВМС по происхождению
По происхождению полимеры делятся на
синтетические и природные, последние, в свою очередь, делятся на неорганические
и органические, называемые также биополимерами. Существуют еще искусственные.
Органические полимеры содержат атомы углерода,
водорода, азота, кислорода, галогенов. Примером карбоцепных органических
полимеров являются полиолефины и полимеры виниловых мономеров общей формулы [СН2-СНХ(Н)-]n,
где X - арил, галоген, эфирная, нитрильная или другая функциональная группа.
Неорганические полимеры не содержат связей С-Н.
К гомоцепным неорганическим полимерам относятся линейные модификации серы и
селена, к гетероцепным - полифосфонитрилхлорид [-PCl2=N-]n.
Элементорганические полимеры содержат как
органические, так и неорганические группы. Примером гетероцепного
элементорганического полимера является полидиметилсилоксан [-Si(CH3)2О-]n.
К элементорганическим полимерам можно также отнести полиорганофосфазены [-PR2=N-]„,
которые получаются при замене атомов хлора в полифосфонитрилхлориде на
органические группы [4, c.
20].
Природные, или натуральные, представляют собой
большую группу полимеров: белки и их разновидности, целлюлоза, крахмал,
натуральный каучук и др.
Синтетические получаются синтезом из
низкомолекулярных веществ - мономеров, например:
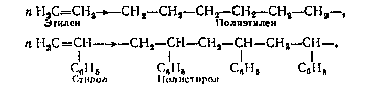
Искусственные получаются из природных полимеров
путем их химической модификации. Например, азотно-кислый эфир целлюлозы
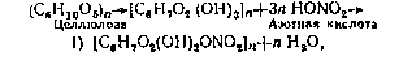
азотнокислые эфиры целлюлозы (нитроцеллюлоза)
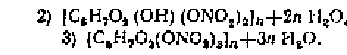
2. Кинетика процесса поликонденсации
Если предположить, что реакционная способность
функциональных групп не зависит от молекулярной массы, то кинетика
поликонденсации становится довольно простой. В качестве примера рассмотрим
процесс образования полиамида из аминокислоты в присутствии катализатора.
Скорость реакции определяют скоростью исчезновения функциональных групп,
например, карбоксильных, а не молекул как это делается обычно. Так как в данном
случае концентрации карбоксильных и аминогрупп равны между собой (обозначим их
С), то скорость прямой реакции любого элементарного акта
H-(HN-R-СО)n-ОН
+ H-(HN-R- CO)m-OH
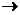 H-(HN-R-CO)n+m-ОН
H-(HN-R-CO)n+m-ОН
можно записать так:
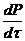 = k1[K]C2
(2.1)
= k1[K]C2
(2.1)
где [К] - концентрация катализатора в системе; 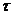 -
время.
-
время.
В это уравнение удобно ввести параметр Р,
называемый степенью завершенности процесса, являющийся долей прореагировавших
функциональных групп, т. е.:
Р = 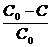 (2.2)
(2.2)
где С0-начальная концентрация
функциональных групп. Формула (2.1) в этом случае принимает вид:
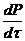 = k1[K]
(1 - P)2C0
(2.3)
= k1[K]
(1 - P)2C0
(2.3)
а после интегрирования:
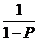 = k1
[К] С0
= k1
[К] С0 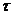 + const (2.4)
+ const (2.4)
Если степень полимеризации равна n,
то количество звеньев в ней и количество карбоксильных групп в исходном
мономере также равно n.
Следовательно, степень завершенности равна:
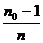 = 1 -
= 1 -  =
P,
=
P,
ткуда:
n = 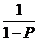 (2.5)
(2.5)
В реакциях поликонденсации средняя степень
полимеризации определяется отношением исходного числа молекул мономера к
полному числу различных молекул на соответствующей стадии реакции [1, c.
190].
Таким образом, степень полимеризации в этом
случае должна быть линейной функцией времени. При очень больших значениях Р
необходимо учитывать также и скорость обратной реакции. Очевидно, скорость
обратной реакции пропорциональна концентрации низкомолекулярного вещества,
выделяющегося в процессе конденсации и концентрации звеньев в системе.
Если реакция протекает в отсутствии катализатора
или катализируется молекулой мономера, то формулы (2.3) и (2.4) приобретают
вид:
высокомолекулярный полимер синтетический кислота
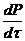 = k1C02
(1 - P)3 (2.6)
= k1C02
(1 - P)3 (2.6)
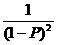 = 2k1C02
= 2k1C02
 +const
(2.7)
+const
(2.7)
Все полученные соотношения справедливы для
обратимых процессов поликонденсации, протекающих в кинетической области и
неосложненных побочными реакциями. Между тем во многих случаях поликонденсация
протекает в диффузионной области. Возможны также побочные процессы, например
реакции циклизации. Так, оксикислоты могут наряду с полиэфиром давать лактоны,
аминокислоты, лактаны и др.
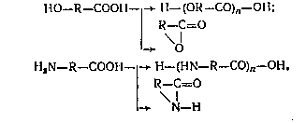
Главным фактором, определяющим направление
реакции (образование колец или цепей), является размер кольца, которое может
быть образовано. Если кольцо содержит менее 5 или более 7 членов, то обычным
продуктом реакции является преимущественно линейный полимер. При образовании
колец с 5-7 членами наряду с полимером будут образовываться также циклические
соединения. Это объясняется напряжением связей при образовании циклов [6, c.
58 - 60].
При анализе кинетики поликонденсации используют
принцип Флори, предполагая, что активность реагирующих групп одинакова и не
зависит от длины цепи полимера. В случае поликонденсации мономеров, взятых в
эквимольных количествах, кинетическое уравнение изменения концентрации
функциональных групп выглядит следующим образом:
[A0]
= 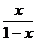 (2.8)
(2.8)
где k - константа скорости реакции; [А0]
- начальная концентрация функциональных групп; х - глубина превращения (доля
прореагировавших к данному моменту функциональных групп).
Это уравнение справедливо для необратимых
процессов и для начальных стадий обратимых в случае, если обратной реакцией
можно пренебречь.
Для обратимой гомополиконденсации уравнение
зависимости средней степени поликонденсации 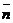 от
константы поликонденсационного равновесия К' и содержания выделяющегося
низкомолекулярного продукта Д имеет вид:
от
константы поликонденсационного равновесия К' и содержания выделяющегося
низкомолекулярного продукта Д имеет вид:
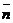 =
= 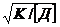 (2.9)
(2.9)
Следовательно, для подавления обратных реакций
необходимо непрерывно удалять из реакционной среды низкомолекулярные продукты.
В случаях, когда поликонденсация протекает без выделения
низкомолекулярных продуктов, это уравнение с некоторым упрощением (если не
учитывать процессы дезактивации реагирующих групп) можно представить в виде 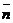 =
=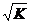 ,
т. е. средняя степень полимеризации (следовательно, и молекулярная масса)
пропорциональна корню квадратному из константы равновесия [5, c.
149 - 150].
,
т. е. средняя степень полимеризации (следовательно, и молекулярная масса)
пропорциональна корню квадратному из константы равновесия [5, c.
149 - 150].
Процессы поликонденсации представляют собой ряд
последовательных реакций между, по крайней мере, бифункциональными
компонентами. При этом выделяются побочные продукты, такие, как вода или спирт.
Кинетическая обработка процесса поликонденсации значительно упрощается, если
предположить, что все функциональные группы реагируют идентично и с одинаковой
скоростью независимо от молекулярной массы макромолекул, в состав которых они
входят. Принцип равной реакционной способности применим как к процессам
поликонденсации, так и к ступенчатой полимеризации. Это означает, что нет
различия между реакционной способностью концевых групп мономера, димера,
тримера и т. д., так что в течение всего времени скорость реакции не зависит от
степени полимеризации.
Особый интерес представляют следующие вопросы в
кинетике поликонденсации:
) зависимость средней молекулярной массы от
конверсии;
) зависимость средней молекулярной массы от
мольного соотношения функциональных групп;
) зависимость конверсии и средней молекулярной
массы от равновесного состояния процесса конденсации;
) обменные реакции, такие, как переэтерификация
и переамидирование [1, c.
189 - 190].
3.
Концепция аморфно - кристаллической структуры полимеров
Для полимеров характерно два фазовых состояния:
кристаллическое и аморфное. Кристаллическое состояние полимеров характеризуется
наличием областей с дальним трехмерным порядком в расположении атомов и
молекул. Размеры этих областей (кристаллитов) в десятки и сотни раз превышают
размеры звена цепи и в то же время меньше контурной длины макромолекулы: одна и
та же цепь может проходить через несколько кристаллических областей.
Кристаллическая фаза в полимерах никогда не распространяется на весь объем и
степень кристалличности для реальных полимеров составляет в среднем 20-80%. В
кристаллических областях упаковка звеньев макромолекул определена параметрами
кристаллической решетки и тепловое движение ограничено колебаниями атомов и
молекул относительно положений равновесия.
Аморфное состояние характеризуется наличием
областей с ближним порядком в расположении отдельных звеньев, размеры которых
гораздо меньше контурной длины цепи и в которых совершенство молекулярной
упаковки по мере удаления от произвольно выбранной точки резко уменьшается [2, c.
144].
Аморфное состояние полимеров характеризуется
жидкоподобной структурой разной степени замороженности. Никакого специального
порядка в аморфных полимерах нет. Но
отсутствие порядка вовсе не означает однородность, в определенной мере
существующую, скажем, в оптических стеклах. Аморфные полимеры - это
структурно-неоднородные системы [7, c.
89].
Наиболее надежным методом идентификации
кристаллической структуры полимеров является рентгеноструктурный анализ.
Степень кристалличности полимеров часто определяется дилатометрическим методом,
поскольку кристаллические и аморфные области имеют разную плотность. В
некоторых случаях, как, например, для поливинилхлорида, степень кристалличности
определяется методом инфракрасной спектроскопии.
Основным элементом кристаллической структуры
полимера является монокристалл.
Монокристаллы образуются из разбавленных
растворов и имеют форму пластины. Так, при температуре 70-80°С из 0,01%-ного
раствора полиэтилена в ксилоле выделяются плоские ромбовидные кристаллы с
длиной грани в несколько микрон и толщиной около 10 нм. Рентгенографическими
исследованиями установлено, что оси макромолекул расположены перпендикулярно
плоскости пластины кристалла. Поскольку контурная длина макромолекулы на 1-2
порядка превышает толщину пластины, это означает, что макромолекулы в
монокристаллах находятся в складчатой конформации.
Положение о складывании полимерной цепи является
фундаментом современной морфологии полимерных кристаллов; оно многократно
доказано как прямыми, так и косвенными экспериментальными методами.

Рис. 3.1. Складывание макромолекул в кристалле
Складывание макромолекул в кристалле может быть
регулярным и нерегулярным. В первом случае (рис. 3.1, а) макромолекула после
выхода из монокристалла сразу возвращается обратно. Петля, состоящая из 5-6
атомов основной цепи, локализована на грани кристалла, здесь же преимущественно
располагаются начало и конец цепи. Во втором случае по выходе из монокристалла
полимерная цепь изгибается далеко от грани и описывает петлю гораздо большего
размера. Вследствие этого она возвращается в монокристалл далеко от места
выхода (рис. 3.1, б) или вообще не возвращается (рис. 3.1, в). В последнем
случае полимерная цепь может участвовать в построении другого монокристалла.
Такие полимерные цепи называются проходными. Так, в изотактическом
кристаллическом полипропилене с молекулярной массой 1,54*106
макромолекула складывается в одном монокристалле в среднем двадцать пять раз и
участвует в построении восемнадцати монокристаллов [3, c.
114 - 115].
Таким образом, высшей формой упорядоченности для
глобулярных полимеров является монокристалл, но при условии, что размеры глобул
строго одинаковы. В узлах решетки такого кристалла располагаются глобулы,
поэтому размеры ячейки в таком кристалле необычно велики. Поскольку сама
глобула - малоупорядоченное образование (звенья свернувшейся макромолекулы
расположены неупорядоченно), то обычные (рентгенография, электронография)
структурные методы исследования укажут, что строение таких кристаллов аморфно,
хотя внешне и по термодинамическим свойствам они типичные кристаллы [6, c.
157].
4. Полимерные кислоты, их получение, свойства и
применение
Полиакриловая кислота
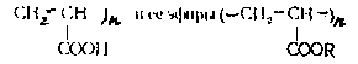
получаются методом свободнорадикалыюй
полимеризации. Инициаторами служат пероксиды, персульфаты, азо- и
диазосоединения. Полимеризация протекает с большой скоростью даже при низких
(20-25 °С) температурах. Удобнее всего проводить полимеризацию в растворе.
Растворителем может быть вода, ксилол, бензол. Полиакриловая кислота представляет
собой твердое, матово-белое хрупкое вещество, напоминающее фарфор, она
растворима в воде, формамиде, с трудом в спирте, нерастворима в мономере. При
230-2400 С начинает разлагаться. Полиакриловая кислота, полученная
при низких температурах, имеет высокую молекулярную массу, в воде не
растворяется, а только набухает.
Макромолекулы полимера имеют преимущественно
линейное строение. Некоторые звенья макромолекул полиакриловой кислоты
соединены по схеме "голова к голове", но преобладающее большинство - "голова
к хвосту":
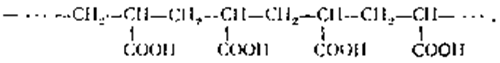
Полиметакриловую кислоту
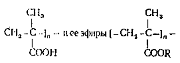
получают путем свободнорадикалыюй полимеризации
в присутствии инициаторов, резко увеличивающих скорость полимеризации. Введение
в молекулу акриловой кислоты метильной группы в  -положение
несколько замедляет процесс полимеризации и облегчает его регулирование.
Внешний вид полиметакриловой кислоты не отличается от полиакриловой. Она тоже
имеет матово-белый цвет и обладает почти такой же твердостью.
-положение
несколько замедляет процесс полимеризации и облегчает его регулирование.
Внешний вид полиметакриловой кислоты не отличается от полиакриловой. Она тоже
имеет матово-белый цвет и обладает почти такой же твердостью.
Полиметакриловая кислота растворима в воде и
нерастворима в неполярных растворителях. С повышением молекулярной массы
полиметакрилата его растворимость в воде падает. Химические свойства
полиакриловой и полиметакриловой кислот сходны со свойствами многоосновных
насыщенных органических кислот.
Они широко применяются для получения кожевенных
и обувных аппретур, а также в качестве эмульгаторов. Соли полиакриловой и
полиметакриловой кислот применяются как загустители, поскольку их растворы
имеют очень высокую вязкость.
Большое значение имеют сополимеры акриловой и
метакриловой кислот с другими виниловыми и дивиниловыми мономерами. При
сополимеризации с диенами акриловая кислота образует каучуки.
Такие каучуки можно вулканизовать
многовалентными металлами:
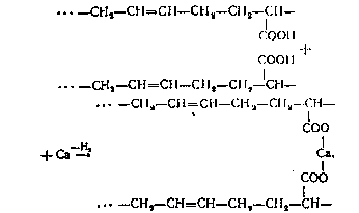
Такие каучуки очень термостойки. Некоторые
сополимеры метакриловой кислоты используются в качестве ионообменных смол.
Полиметилметакрилат 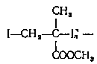 получается
свободнорадикальной полимеризацией метилметакрилата. Полимеризацию чаще всего
проводят блочным методом, поскольку при этом получается органическое стекло с
наилучшими оптическими свойствами. Присутствие инициаторов, ультрафиолетовое
облучение ускоряют процесс полимеризации. С повышением температуры скорость
реакции возрастает, но уменьшается молекулярная масса. Молекулярная масса
полимера колеблется в пределах 50000-200000, плотность 1,18 г/см3,
температура стеклования около 98 °С. При 260-270 °С полимер разрушается.
Полиметилметакрилат хорошо растворяется в ацетоне, дихлорэтане и в некоторых
сложных эфирах. Применяют его в основном для получения органического стекла.
получается
свободнорадикальной полимеризацией метилметакрилата. Полимеризацию чаще всего
проводят блочным методом, поскольку при этом получается органическое стекло с
наилучшими оптическими свойствами. Присутствие инициаторов, ультрафиолетовое
облучение ускоряют процесс полимеризации. С повышением температуры скорость
реакции возрастает, но уменьшается молекулярная масса. Молекулярная масса
полимера колеблется в пределах 50000-200000, плотность 1,18 г/см3,
температура стеклования около 98 °С. При 260-270 °С полимер разрушается.
Полиметилметакрилат хорошо растворяется в ацетоне, дихлорэтане и в некоторых
сложных эфирах. Применяют его в основном для получения органического стекла.
Другие эфиры метакриловой кислоты применяются
для производства лаков, пленок, гибких шлангов и т. д.
Кроме эфиров акриловой и метакриловой кислот
большое практическое значение имеет нитрил акриловой кислоты.
Полиакрилонитрил 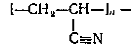 получается
эмульсионной радикальной полимеризацией акрилонитрила. Инициаторами процесса
чаще всего являются пероксид водорода, персульфаты или пербораты, дисперсионной
средой обычно служит вода. По мере полимеризации полимер выпадает в виде мелких
легко фильтрующихся частичек.
получается
эмульсионной радикальной полимеризацией акрилонитрила. Инициаторами процесса
чаще всего являются пероксид водорода, персульфаты или пербораты, дисперсионной
средой обычно служит вода. По мере полимеризации полимер выпадает в виде мелких
легко фильтрующихся частичек.
Полиакрилонитрил не растворяется в
растворителях, пригодных для растворения других акриловых смол. Группы -C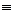 N,
содержащиеся в макромолекулах, обусловливают сильное межмолекулярное
взаимодействие.
N,
содержащиеся в макромолекулах, обусловливают сильное межмолекулярное
взаимодействие.
Полиакрилонитрил растворяется только в
сильнополярных растворителях: диметилформамиде, диметилцианамиде, в
концентрированных водных растворах некоторых солей (KCNS, ZnCl2,
ZnBr2). Его растворимость понижается после обработки водным
раствором формальдегида.
В зависимости от условий полимеризации
молекулярная масса полиакрилонитрила колеблется от 20000 до 350000, плотность
составляет около 1,17 г/см3; температура стеклования 80°С,
разлагается он при 220°С. Полиакрилонитрил при нагревании изменяет свой цвет,
причем процесс нагревания всегда сопровождается потерей растворимости.
Полиакрилонитрил обладает достаточно высокими
физико-механическими показателями. По светостойкости он превосходит почти все
известные полимеры.
Большое количество полиакрилонитрила идет на
получение синтетических волокон и пластических масс. По своим свойствам полиакрилонитрильное
волокно напоминает шерсть и хорошо окрашивается.
Большое промышленное значение имеют сополимеры
акрилонитрила с винилхлоридом, винилацетатом, стиролом, эфирами акриловой и
метакриловой кислот, изобутиленом, бутадиеном и др. Сополимеры бутадиена с
акрилонитрилом используют для получения маслостойких резин. По сравнению с
полистиролом сополимеры стирола и акрилонитрила обладают повышенной
теплостойкостью [6, с. 312 - 315].
Литература
. Браун Д., Шердрон Г. Практическое
руководство по синтезу и исследованию свойств полимеров. - М.: Химия, 1976. -
256 с.
. Практикум по химии и физике
полимеров / Аввакумова Н. И. - М.: Химия, 1990. - 304 с.
. Семчиков Ю. Д. Введение в химию
полимеров. - М.: Высшая школа, 1988. - 151 с.
. Семчиков Ю. Д. Высокомолекулярные
соединения. - М.: Академия, 2005. - 368 с.
. Тугов И. И., Кострыкина Г. И,
Химия и физика полимеров. - М.: Химия, 1989. - 432 с.
. Химия и физикохимия полимеров /
Анохин В. В. - К.: Вища школа, 1987. - 399 с.
. Физика полимеров / Бартенев Г. М.
- Л.: Химия, 1990. - 432 с.