Термодинамические расчеты соединений
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
. Исходные данные
. Расчет изобарно-изотермического потенциала
.1 Расчет ΔGтº по уравнению Гиббса (первый метод)
.2 Расчет ΔGтº по уравнению Гиббса-Гельмгольца
(второй метод)
. Расчет ΔGтº химической реакции образования
соединения CuFeO2
.1 Расчет ΔG400º
.1.1 Расчет ΔG400º реакции по уравнению Гиббса (первый
метод)
.1.2 Расчет DG0400
по уравнению Гиббса-Гельмгольца(второй метод)
.2 Расчет ΔG500º
.2.1 Расчет ΔG500º реакции по уравнению Гиббса (первый
метод)
.2.2 Расчет DG0500
по уравнению Гиббса-Гельмгольца(второй метод)
.3 Расчет ΔG600º
.3.1 Расчет ΔG600º реакции по уравнению Гиббса (первый
метод)
.3.2 Расчет DG0600
по уравнению Гиббса-Гельмгольца(второй метод).
.4 Расчет ΔG700º
.4.1 Расчет ΔG700º реакции по уравнению Гиббса (первый
метод)
.4.2 Расчет DG0700
по уравнению Гиббса-Гельмгольца(второй метод)
.5 Заключение
. Расчет ΔGтº химической реакции образования
соединения CuFe2O4
.1 Расчет ΔG400º
.1.1 Расчет ΔG400º реакции по уравнению Гиббса (первый
метод)
.1.2 Расчет DG0400
по уравнению Гиббса-Гельмгольца(второй метод)
.2 Расчет ΔG500º
.2.1 Расчет ΔG500º реакции по уравнению Гиббса (первый
метод)
.2.2 Расчет DG0500
по уравнению Гиббса-Гельмгольца(второй метод)
.3 Расчет ΔG600º
.3.1 Расчет ΔG600º реакции по уравнению Гиббса (первый
метод)
.3.2 Расчет DG0600
по уравнению Гиббса-Гельмгольца(второй метод)
.4 Расчет ΔG700º
.4.1 Расчет ΔG700º реакции по уравнению Гиббса (первый
метод)
.4.2 Расчет DG0700
по уравнению Гиббса-Гельмгольца(второй метод)
.5 Заключение
ВЫВОД
Список литературы
ВВЕДЕНИЕ
В курсовой работе следует рассчитать основные
термодинамические функции:
энтальпии, энтропии, изобарно-изотермические потенциалы химических
реакций образования 2-х соединений: CuFeO2; CuFe2O4 в интервале температур от 298 до 700 К. Термодинамические
расчеты позволяют оценить возможность (вероятность) протекания химических
реакций в заданных условиях, определить их направление и предпочтительность
(очередность) протекания одной реакции перед другой.
Цель курсовой работы: освоение термодинамического метода исследования
системы «CuO ˗˗ FeO» и системы «CuO ˗˗
2FeO», а также протекающих в них
химических реакций образования соединений CuFeO2 и CuFe2O4.
термодинамический реакция химический изотермический
1.
ИСХОДНЫЕ ДАННЫЕ ДЛЯ КУРСОВОЙ РАБОТЫ
) Формулы соединений: CuFeO2
и CuFe2O4.
) Интервал температур: 298…700 К.
) Термодинамические величины компонентов систем «CuO ˗˗ FeO» и
системы «CuO ˗˗ 2FeO» приведены в таблице 1.
Таблица 1 ˗˗ Термодинамические величины соединений
|
Формула простых веществ и
соединений
|
Теплота образования из
элементов, -DH0 298, кДж·моль-1
|
Энтропия S0 298, Дж·моль-1·К-1
|
Теплоемкость Cp, Дж·моль-1·К-1
|
|
|
|
Коэффициенты уравнения Cp =
а + вТ - С¢Т -2
|
|
|
|
а
|
b·103
|
c´·10-5
|
|
1
|
2
|
3
|
4
|
5
|
6
|
|
CuO
|
157,03
|
42,63
|
43,83
|
16,76
|
5,88
|
|
FeO
|
266,65
|
59,44
|
51,82
|
-6,78
|
|
CuFeO2
|
592,6
|
88,7
|
95,6
|
10,63
|
16,65
|
|
CuFe2O4
|
959,0
|
141,0
|
138,62
|
119,41
|
22,76
|
) Реакции образования соединений в смесях с соотношением исходных
элементов компонентов 1:1 следующие:
+ FeO = CuFeO2,+ 2FeO = CuFe2O4.
) Определяем 5 значений температур для проведения термодинамических
расчетов: 298, 400, 500, 600, 700 К.
2. РАСЧЕТ ИЗОБАРНО-ИЗОТЕРМИЧЕСКОГО ПОТЕНЦИАЛА
2.1 Расчет ΔGтº по уравнению Гиббса (первый метод)
Исходные данные: ΔНº298, ΔSº298, Cp = а + вТ + С¢Т -2 веществ, участвующих в
химической реакции.
1)Определяем энтальпию реакции при стандартной температуре 298 К.
 (1)
(1)
) Находим изменение коэффициентов: Δа, Δв, Δс΄,определяющих зависимость Ср
= ƒ(Т).
Δа = Σа(продуктов) - Σа(исходных веществ)
Δв = Σв (продуктов) - Σв(исходных веществ)
Δс´= Σс(продуктов) - Σс(исходных веществ) (2)
3) Находим энтропию химической реакции при 298 К.
 (3)
(3)
4) Определяем теоретическое значение изменения
изобарно-изотермического потенциала реакции при температуре Т по уравнению
Гиббса:
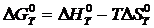 (4)
(4)
Для
этого находим энтальпию реакции по уравнению
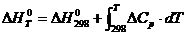 (5)
(5)
и
энтропию реакции по уравнению
 (6)
(6)
Подставляя
выражения (6) и (5) в (4), получим уравнение, по которому будем вычислять
изобарно-изотермический потенциал реакции при температуре Т:
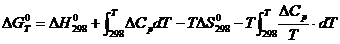 . (7)
. (7)
Рассчитываем
значение величины интеграла 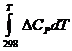 .
.
 (8)
(8)
) Рассчитываем
значения величины интеграла  .
.

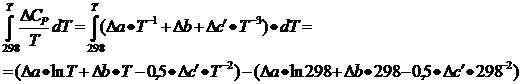 (9)
(9)
2.2 Расчет DG0T по уравнению
Гиббса-Гельмгольца (второй метод)
Исходные
данные: DH0298, DS0298, Dа, Db, Dс для химической реакции уже
вычислены при расчете DG0T по уравнению Гиббса.
)
Вычисляем изобарно-изотермический потенциал при стандартной температуре 298К.
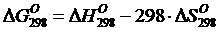 .
(10)
.
(10)
)
Определяем теоретическое значение 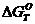 по
уравнению Гиббса - Гельмгольца
по
уравнению Гиббса - Гельмгольца
 (11)
(11)
Для этого преобразуем это уравнение, умножая его на величину Т-2.
Получаем
 или
или 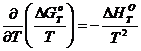 .
.
Интегрируя
выражение  получаем значение -
получаем значение - . Умножая
это значение на Т получаем
. Умножая
это значение на Т получаем 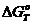 .
.

По уравнению (12) будем рассчитывать DG0T реакции для всех значений
температуры.
3)Определяем
первую константу интегрирования 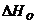 .
.
 (13)
(13)
1) Определяем вторую константу интегрирования у.
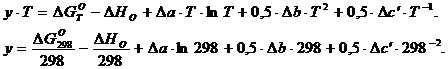 (14,15)
(14,15)
3. РАСЧЕТ ΔGТº ХИМИЧЕСКОЙ РЕАКЦИИ ОБРАЗОВАНИЯ
СОЕДИНЕНИЯ CuFeO2
3.1 РАСЧЕТ ΔG400º
.1.1 Расчет ΔG400º реакции по уравнению Гиббса (первый
метод)
1) Определяем энтальпию реакции при 298 К.
DH0298
= DH0298(CuFeO2) - DH0298(CuO) - DH0298(FeO) =
-592,6 +157,03 + +266,65= -168,92 кДж•моль-1.
2) Вычисляем изменение коэффициентов
зависимости теплоемкости от температуры: Da, Db, Dc´.
Da =
95,6 - 43,83 - 51,82 = -0,05.
D b = (10,63 - 16,76 +6,78)•10-3 =
0,65•10-3.
Dc´= (16,65 - 5,88 + 1,59)•105 = 12,36•105.
) Рассчитываем энтропию реакции при 298 К.
DS0298 = S0298 (CuFeO2) - S0298 (CuO) - S0298(FeO) = 88,7 -
42,63 - 59,44= = -13,37 Дж•моль-1•К-1
4) Находим значения величин интеграла.
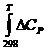 dT = ((-0,05)•400 + 0,5•0,65•10-3•4002 -
12,36•105•400-1) -
dT = ((-0,05)•400 + 0,5•0,65•10-3•4002 -
12,36•105•400-1) -
((-0,05)•298
+ 0,5•0,65•10-3•2982 - 12,36•105•298-1) = 1075,7 Дж•моль-1•К-1
)
Находим значения величины интеграла.
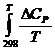 dT = ((-0,05)•ln400 + 0,65•10-3•400 -
0,5•12,36•105•400-2) -
dT = ((-0,05)•ln400 + 0,65•10-3•400 -
0,5•12,36•105•400-2) -
((-0,05)•ln298
+ 0,65•10-3•298 - 0,5•12,36•105•298-2) = 3,15 Дж•моль-1•К-1
DG0400
= -168920 + 1075,7 + 400•13,37 - 400•3,15 = -163756 Дж•моль-1•К-1= -163,7
кДж•моль-1•К-1
3.1.2 Расчет DG0400 по
уравнению Гиббса-Гельмгольца (второй метод)
1) Определяем изобарно-изотермический
потенциал реакции при 298 К.
DG 0298
= -168920 + 298•13,37 = -164936 Дж•моль-1•К-1
) Вычисляем постоянную интегрирования DH0.
DH0 =
-168920 + 0,05•298 - 0,5•0,65•10-3•2982 + 12,36•105•298-1 =
= -164786 Дж•моль-1.
) Находим постоянную интегрирования у.
у•298 = -164936 + 164786 - 0,05•298•ln298 + 0,5•0,65•10-3•2982 + +0,5•12,36•105•298-1 =1867,8;
у = 6,27.
) Рассчитываем значение изобарно-изотермического потенциала реакции при
400 К.
DG0400
= -164786 + 0,05•400•ln400
- 0,5•0,65•10-3•4002 - 0,5•12,36•105•400-1 + + 6,27•400 = -163755 Дж•моль-1=
-163,7 кДж•моль-1.
Полученное значение величины изобарно-изотермического потенциала, DG0400 = -163,7 кДж•моль-1, позволяет
сделать заключение о термодинамической вероятности, то есть возможности
протекания реакций образования соединения CuFeO2 при температуре 400 К.
.2 РАСЧЕТ ΔG500º
3.2.1 Расчет ΔG500º реакции по уравнению Гиббса (первый
метод)
1) Определяем энтальпию реакции при 298
К.
DH0298
= DH0298(CuFeO2) - DH0298(CuO) - DH0298(FeO) =
-592,6 +157,03 + +266,65= -168,92 кДж•моль-1.
2) Вычисляем изменение коэффициентов
зависимости теплоемкости от температуры: Da, Db, Dc´.
Da = 95,6 - 43,83 - 51,82
= -0,05.
D b = (10,63 -
16,76 +6,78)•10-3
= 0,65•10-3.
Dc´= (16,65 - 5,88 + 1,59)•105 = 12,36•105.
3) Рассчитываем энтропию реакции при 298
К.
DS0298 = S0298 (CuFeO2) - S0298 (CuO) - S0298(FeO) = 88,7 -
42,63 - 59,44= = -13,37 Дж•моль-1•К-1.
4) Находим значения величин интеграла.
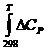 dT = ((-0,05)•500 + 0,5•0,65•10-3•5002 -
12,36•105•500-1) -
dT = ((-0,05)•500 + 0,5•0,65•10-3•5002 -
12,36•105•500-1) -
((-0,05)•298
+ 0,5•0,65•10-3•2982 - 12,36•105•298-1) = 1717,9 Дж•моль-1•К-1
)
Находим значения величины интеграла.
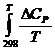 dT = ((-0,05)•ln500 + 0,65•10-3•500 -
0,5•12,36•105•500-2) -
dT = ((-0,05)•ln500 + 0,65•10-3•500 -
0,5•12,36•105•500-2) -
((-0,05)•ln298
+ 0,65•10-3•298 - 0,5•12,36•105•298-2) = 4,6 Дж•моль-1•К-1
6) Рассчитываем значение величины изобарно-изотермического потенциала
реакции при температуре 500 К.
DG0500
= -168920 + 1717,9 + 500•13,37 - 500•4,6 = -162817 Дж•моль-1•К-1 = -162,8
кДж•моль-1•К-1.
3.2.2 Расчет DG0500 по
уравнению Гиббса-Гельмгольца (второй метод)
1) Определяем изобарно-изотермический
потенциал реакции при 298 К.
DG 0298
= -168920 + 298•13,37 = -164936 Дж•моль-1•К-1
) Вычисляем постоянную интегрирования DH0.
DH0 =
-168920 + 0,05•298 - 0,5•0,65•10-3•2982 + 12,36•105•298-1 =
= -164786 Дж•моль-1.
) Находим постоянную интегрирования у.
у•298 = -164936 + 164786 - 0,05•298•ln298 + 0,5•0,65•10-3•2982 + +0,5•12,36•105•298-1 =1867,8;
у = 6,27.
) Рассчитываем значение изобарно-изотермического потенциала реакции при
500 К.
DG0500
= -164786 + 0,05•500•ln500
- 0,5•0,65•10-3•5002 - 0,5•12,36•105•500-1 + + 6,27•500 = -162813 Дж/моль =
-162,8 кДж•моль-1.
Полученное значение величины изобарно-изотермического потенциала, DG0500 = -162,8 кДж•моль-1, позволяет
сделать заключение о термодинамической вероятности, то есть возможности
протекания реакций образования соединения CuFeO2 при температуре 500 К.
3.3 РАСЧЕТ ΔG600º
.3.1 Расчет ΔG600º реакции по уравнению Гиббса (первый
метод)
1) Определяем энтальпию реакции при 298
К.
DH0298
= DH0298(CuFeO2) - DH0298(CuO) - DH0298(FeO) =
-592,6 +157,03 + +266,65= -168,92 кДж•моль-1.
2) Вычисляем изменение коэффициентов
зависимости теплоемкости от температуры: Da, Db, Dc´.
Da = 95,6 - 43,83 - 51,82
= -0,05.
D b = (10,63 -
16,76 +6,78)•10-3
= 0,65•10-3.
Dc´= (16,65 - 5,88 + 1,59)•105 = 12,36•105.
3) Рассчитываем энтропию реакции при 298
К.
DS0298 = S0298 (CuFeO2) - S0298 (CuO) - S0298(FeO) = 88,7 -
42,63 - 59,44= = -13,37 Дж•моль-1•К-1
4) Находим значения величин интеграла.
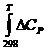 dT = ((-0,05)•600 + 0,5•0,65•10-3•6002 -
12,36•105•600-1) -
dT = ((-0,05)•600 + 0,5•0,65•10-3•6002 -
12,36•105•600-1) -
((-0,05)•298
+ 0,5•0,65•10-3•2982 - 12,36•105•298-1) = 2160,7 Дж•моль-1•К-1.
)
Находим значения величины интеграла.
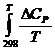 dT = ((-0,05)•ln600 + 0,65•10-3•600 -
0,5•12,36•105•600-2) -
dT = ((-0,05)•ln600 + 0,65•10-3•600 -
0,5•12,36•105•600-2) -
((-0,05)•ln298
+ 0,65•10-3•298 - 0,5•12,36•105•298-2) = 5,4 Дж•моль-1•К-1
6) Рассчитываем значение величины изобарно-изотермического потенциала
реакции при температуре 600 К.
DG0600
= -168920 + 2160,7 + 600•13,37 - 600•5,4 = -161977 Дж•моль-1•К-1= -161,9
кДж•моль-1•К-1
3.3.2 Расчет DG0600 по
уравнению Гиббса-Гельмгольца (второй метод)
1) Определяем изобарно-изотермический
потенциал реакции при 298 К.
DG 0298
= -168920 + 298•13,37 = -164936 Дж•моль-1•К-1
) Вычисляем постоянную интегрирования DH0.
DH0 =
-168920 + 0,05•298 - 0,5•0,65•10-3•2982 + 12,36•105•298-1 =
= -164786 Дж•моль-1.
) Находим постоянную интегрирования у.
у•298 = -164936 + 164786 - 0,05•298•ln298 + 0,5•0,65•10-3•2982 + +0,5•12,36•105•298-1 =1867,8;
у = 6,27.
DG0600
= -164786 + 0,05•600•ln600
- 0,5•0,65•10-3•6002 - 0,5•12,36•105•600-1 + + 6,27•600 = -161979 Дж/моль =
-161,9 кДж•моль-1.
Полученное значение величины изобарно-изотермического потенциала, DG0600 = -161,9 кДж•моль-1, позволяет
сделать заключение о термодинамической вероятности, то есть возможности
протекания реакций образования соединения CuFeO2 при температуре 600 К.
.4 РАСЧЕТ ΔG700º
3.4.1 Расчет ΔG700º реакции по уравнению Гиббса (первый
метод)
1) Определяем энтальпию реакции при 298
К.
DH0298
= DH0298(CuFeO2) - DH0298(CuO) - DH0298(FeO) =
-592,6 +157,03 + +266,65= -168,92 кДж•моль-1.
2) Вычисляем изменение коэффициентов
зависимости теплоемкости от температуры: Da, Db, Dc´.
Da = 95,6 - 43,83 - 51,82
= -0,05.
D b = (10,63 -
16,76 +6,78)•10-3
= 0,65•10-3.
Dc´= (16,65 - 5,88 + 1,59)•105 = 12,36•105.
3) Рассчитываем энтропию реакции при 298
К.
DS0298 = S0298 (CuFeO2) - S0298 (CuO) - S0298(FeO) = 88,7 -
42,63 - 59,44= = -13,37 Дж•моль-1•К-1.
4) Находим значения величин интеграла.
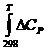 dT = ((-0,05)•700 + 0,5•0,65•10-3•7002 -
12,36•105•700-1) -
dT = ((-0,05)•700 + 0,5•0,65•10-3•7002 -
12,36•105•700-1) -
((-0,05)•298
+ 0,5•0,65•10-3•2982 - 12,36•105•298-1) = 2492,2 Дж•моль-1•К-1
)
Находим значения величины интеграла.
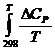 dT = ((-0,05)•ln700 + 0,65•10-3•700 -
0,5•12,36•105•700-2) -
dT = ((-0,05)•ln700 + 0,65•10-3•700 -
0,5•12,36•105•700-2) -
((-0,05)•ln298
+ 0,65•10-3•298 - 0,5•12,36•105•298-2) = 5,9 Дж•моль-1•К-1.
6) Рассчитываем значение величины изобарно-изотермического потенциала
реакции при температуре 700 К.
DG0700
= -168920 + 2492,2 + 700•13,37 - 700•5,9 = -161199 Дж•моль-1•К-1 = -161,2
кДж•моль-1•К-1
3.4.2 Расчет DG0700 по
уравнению Гиббса-Гельмгольца (второй метод)
1) Определяем изобарно-изотермический
потенциал реакции при 298 К.
DG 0298
= -168920 + 298•13,37 = -164936 Дж•моль-1•К-1
) Вычисляем постоянную интегрирования DH0.
DH0 =
-168920 + 0,05•298 - 0,5•0,65•10-3•2982 + 12,36•105•298-1 =
= -164786 Дж•моль-1.
) Находим постоянную интегрирования у.
у•298 = -164936 + 164786 - 0,05•298•ln298 + 0,5•0,65•10-3•2982 + +0,5•12,36•105•298-1 =1867,8;
у = 6,27.
) Рассчитываем значение изобарно-изотермического потенциала реакции при
700 К.
DG0700
= -164786 + 0,05•700•ln700
- 0,5•0,65•10-3•7002 - 0,5•12,36•105•700-1 + + 6,27•700 = -161210 Дж/моль =
-161,2 кДж•моль-1.
Полученное значение величины изобарно-изотермического потенциала, DG0700 = -161,2 кДж•моль-1, позволяет
сделать заключение о термодинамической вероятности, то есть возможности
протекания реакций образования соединения CuFeO2 при температуре 700 К.
.5 ЗАКЛЮЧНИЕ
Результаты расчетов изменения изобарно-изотермического потенциала DG0т, полученные по уравнению Гиббса и
уравнению Гиббса-Гельмгольца для реакции образования CuFeO2, приведены в таблице 2. Графическая зависимость DG0т=f(T) показана на
рисунке 1.
Таблица 2 - Значения величины DG0т реакции образования CuFeO2
|
Т, К
|
298
|
400
|
500
|
600
|
700
|
|
DG0т,
кДж•моль-1
|
-164,9
|
-163,7
|
-162,8
|
-161,9
|
-161,2
|

Рисунок 1 ˗ Зависимость изобарно-изотермического потенциала от
температуры
Как показывают полученные результаты, реакция образования CuFeO2 протекает в интервале температур от
298 до 700 К при стандартном давлении, с увеличением температуры её вероятность
убывает.
4. РАСЧЕТ ΔGтº ХИМИЧЕСКОЙ РЕАКЦИИ ОБРАЗОВАНИЯ
СОЕДИНЕНИЯ CuFe2O4
.1 РАСЧЕТ ΔG400º
4.1.1 Расчет ΔG400º реакции по уравнению Гиббса (первый
метод)
1) Определяем энтальпию реакции при 298
К.
DH0298
= DH0298(CuFe2O4) - DH0298(CuO) -2•DH0298(FeO) = -959 + 157,03 + +2•266,65=
-268,67 кДж•моль-1.
2) Вычисляем изменение коэффициентов
зависимости теплоемкости от температуры: Da, Db, Dc´.
Da = 138,62 - 43,83 - 51,82
= 42,97.
D b = (119,41 -
16,76 +6,78)•10-3
= 109,43•10-3.
Dc´= (22,76 - 5,88 + 1,59)•105 = 18,47•105.
3) Рассчитываем энтропию реакции при 298
К.
DS0298 = S0298 (CuFe2O4) - S0298 (CuO) - 2•S0298(FeO) = 141 -
42,63 - 2•59,44 = -20,51 Дж•моль-1•К-1
4) Находим значения величин интеграла.
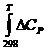 dT = (42,97•400 + 0,5•109,43•10-3•4002 -
18,47•105•400-1) -
dT = (42,97•400 + 0,5•109,43•10-3•4002 -
18,47•105•400-1) -
(42,97•298
+ 0,5•109,43•10-3•2982 - 18,47•105•298-1) = 9858,9 Дж•моль-1•К-1.
)
Находим значения величины интеграла.
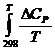 dT = (42,97•ln400 + 109,43•10-3•400 -
0,5•18,47•105•400-2) -
dT = (42,97•ln400 + 109,43•10-3•400 -
0,5•18,47•105•400-2) -
(42,97•ln298
+ 109,43•10-3•298 - 0,5•18,47•105•298-2) = 28,4 Дж•моль-1•К-1
6) Рассчитываем значение величины изобарно-изотермического потенциала
реакции при температуре 600 К.
DG0400
= -268670 + 9858,9 + 400•20,51 - 400•28,4 = -261967 Дж•моль-1•К-1 =
= -261,9 кДж•моль-1•К-1
1) Определяем изобарно-изотермический потенциал реакции при 298 К.
DG 0298
= -268670 + 298•20,51 = -262558 Дж•моль-1•К-1.
) Вычисляем постоянную интегрирования DH0.
DH0 =
-268670 - 42,97•298 - 0,5•109,43•10-3•2982 + 18,47•105•298-1 = - 280136
Дж•моль-1.
) Находим постоянную интегрирования у.
у•298 = -262558 + 280136+ 42,97•298•ln298 + 0,5•109,43•10-3•2982 + 0,5•18,47•105•298-1 = 98487,53;
у = 330,5.
) Рассчитываем значение изобарно-изотермического потенциала реакции при
400 К.
DG0400
= - 280136 - 42,97•400•ln400
- 0,5•109,43•10-3•4002 - 0,5•18,47•105•400-1 + 330,5•400 = -261980 Дж/моль =
-261,9 кДж•моль-1.
Полученное значение величины изобарно-изотермического потенциала, DG0400 = -261,9 кДж•моль-1, позволяет
сделать заключение о термодинамической вероятности, то есть возможности
протекания реакций образования соединения CuFe2O4 при
температуре 400 К.
4.2 РАСЧЕТ ΔG500º
4.2.1 Расчет ΔG500º реакции по уравнению Гиббса (первый
метод)
1) Определяем энтальпию реакции при 298
К.
DH0298
= DH0298(CuFe2O4) - DH0298(CuO) -2•DH0298(FeO) = -959 + 157,03 + +2•266,65=
-268,67 кДж•моль-1.
2) Вычисляем изменение коэффициентов
зависимости теплоемкости от температуры: Da, Db, Dc´.
Da = 138,62 - 43,83 - 51,82
= 42,97.
D b = (119,41 -
16,76 +6,78)•10-3
= 109,43•10-3.
Dc´= (22,76 - 5,88 + 1,59)•105 = 18,47•105.
3) Рассчитываем энтропию реакции при 298
К.
DS0298 = S0298 (CuFe2O4) - S0298 (CuO) - 2•S0298(FeO) = 141 -
42,63 - 2•59,44 = -20,51 Дж•моль-1•К-1
4) Находим значения величин интеграла.
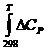 dT = (42,97•500 + 0,5•109,43•10-3•5002 -
18,47•105•500-1) -
dT = (42,97•500 + 0,5•109,43•10-3•5002 -
18,47•105•500-1) -
(42,97•298
+ 0,5•109,43•10-3•2982 - 18,47•105•298-1) = 20003,8 Дж•моль-1•К-1
)
Находим значения величины интеграла.
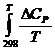 dT = (42,97•ln500 + 109,43•10-3•500 -
0,5•18,47•105•500-2) -
dT = (42,97•ln500 + 109,43•10-3•500 -
0,5•18,47•105•500-2) -
(42,97•ln298
+ 109,43•10-3•298 - 0,5•18,47•105•298-2) = 51 Дж•моль-1•К-1
6) Рассчитываем значение величины изобарно-изотермического потенциала
реакции при температуре 500 К.
DG0500
= -268670 + 20003,8 + 500•20,51 - 500•51 = -263911 Дж•моль-1•К-1 =
= -263,9 кДж•моль-1•К-1
4.2.2 Расчет DG0500 по
уравнению Гиббса-Гельмгольца (второй метод)
1) Определяем изобарно-изотермический потенциал реакции при 298 К.
DG 0298
= -268670 + 298•20,51 = -262558 Дж•моль-1•К-1.
) Вычисляем постоянную интегрирования DH0.
DH0 =
-268670 - 42,97•298 - 0,5•109,43•10-3•2982 + 18,47•105•298-1 =
= - 280136 Дж•моль-1.
) Находим постоянную интегрирования у.
у•298 = -262558 + 280136+ 42,97•298•ln298 + 0,5•109,43•10-3•2982 + 0,5•18,47•105•298-1 = 98487,53;
у = 330,5.
) Рассчитываем значение изобарно-изотермического потенциала реакции при 500
К.
DG0500
= - 280136 - 42,97•500•ln500
- 0,5•109,43•10-3•5002 - 0,5•18,47•105•500-1 + 330,5•500 = -263933 Дж•моль-1=
-263,9 кДж•моль-1.
Полученное значение величины изобарно-изотермического потенциала, DG0500 = -263,9 кДж•моль-1, позволяет
сделать заключение о термодинамической вероятности, то есть возможности
протекания реакций образования соединения CuFe2O4 при
температуре 500 К.
.3 РАСЧЕТ ΔG600º
4.3.1 Расчет ΔG600º реакции по уравнению Гиббса (первый
метод)
1) Определяем энтальпию реакции при 298
К.
DH0298
= DH0298(CuFe2O4) - DH0298(CuO) -2•DH0298(FeO) = -959 + 157,03 + +2•266,65=
-268,67 кДж•моль-1.
2) Вычисляем изменение коэффициентов
зависимости теплоемкости от температуры: Da, Db, Dc´.
Da = 138,62 - 43,83 - 51,82
= 42,97.
D b = (119,41 -
16,76 +6,78)•10-3
= 109,43•10-3.
Dc´= (22,76 - 5,88 + 1,59)•105 = 18,47•105.
3) Рассчитываем энтропию реакции при 298
К.
DS0298 = S0298 (CuFe2O4) - S0298 (CuO) - 2•S0298(FeO) = 141 -
42,63 - 2•59,44 = -20,51 Дж•моль-1•К-1
) Находим значения величин интеграла.
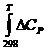 dT = (42,97•600 + 0,5•109,43•10-3•6002 -
18,47•105•600-1) -
dT = (42,97•600 + 0,5•109,43•10-3•6002 -
18,47•105•600-1) -
(42,97•298
+ 0,5•109,43•10-3•2982 - 18,47•105•298-1) = 30935,1 Дж•моль-1•К-1.
)
Находим значения величины интеграла.
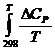 dT = (42,97•ln600 + 109,43•10-3•600 -
0,5•18,47•105•600-2) -
dT = (42,97•ln600 + 109,43•10-3•600 -
0,5•18,47•105•600-2) -
(42,97•ln298
+ 109,43•10-3•298 - 0,5•18,47•105•298-2) = 70,95 Дж•моль-1•К-1.
6) Рассчитываем значение величины изобарно-изотермического потенциала
реакции при температуре 600 К.
DG0600
= -268670 + 30935,1 + 600•20,51 - 600•70,95 = -267999 Дж•моль-1•К-1= -267,9
кДж•моль-1•К-1.
4.3.2 Расчет DG0600 по
уравнению Гиббса-Гельмгольца (второй метод)
1) Определяем изобарно-изотермический потенциал реакции при 298 К.
DG 0298
= -268670 + 298•20,51 = -262558 Дж•моль-1•К-1
) Вычисляем постоянную интегрирования DH0.
DH0 =
-268670 - 42,97•298 - 0,5•109,43•10-3•2982 + 18,47•105•298-1 = - 280136
Дж•моль-1.
) Находим постоянную интегрирования у.
у•298 = -262558 + 280136+ 42,97•298•ln298 + 0,5•109,43•10-3•2982 + 0,5•18,47•105•298-1 = 98487,53;
у = 330,5.
) Рассчитываем значение изобарно-изотермического потенциала реакции при
600 К.
DG0600
= - 280136 - 42,97•600•ln600
- 0,5•109,43•10-3•6002 - 0,5•18,47•105•600-1 + 330,5•600 = -267998 Дж•моль-1=
-267,9 кДж•моль-1.
Полученное значение величины изобарно-изотермического потенциала, DG0600 = -267,9 кДж•моль-1, позволяет
сделать заключение о термодинамической вероятности, то есть возможности
протекания реакций образования соединения CuFe2O4 при
температуре 600 К.
4.4.1 Расчет ΔG700º реакции по уравнению Гиббса (первый
метод)
1) Определяем энтальпию реакции при 298
К.
DH0298
= DH0298(CuFe2O4) - DH0298(CuO) -2•DH0298(FeO) = -959 + 157,03 + +2•266,65=
-268,67 кДж•моль-1.
2) Вычисляем изменение коэффициентов
зависимости теплоемкости от температуры: Da, Db, Dc´.
Da = 138,62 - 43,83 - 51,82
= 42,97.
D b = (119,41 -
16,76 +6,78)•10-3
= 109,43•10-3.
Dc´= (22,76 - 5,88 + 1,59)•105 = 18,47•105.
3) Рассчитываем энтропию реакции при 298
К.
DS0298 = S0298 (CuFe2O4) - S0298 (CuO) - 2•S0298(FeO) = 141 -
42,63 - 2•59,44 = -20,51 Дж•моль-1•К-1
4) Находим значения величин интеграла.
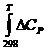 dT = (42,97•700 + 0,5•109,43•10-3•7002 -
18,47•105•700-1) -
dT = (42,97•700 + 0,5•109,43•10-3•7002 -
18,47•105•700-1) -
(42,97•298
+ 0,5•109,43•10-3•2982 - 18,47•105•298-1) = 42784,8 Дж•моль-1•К-1.
)
Находим значения величины интеграла.
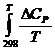 dT = (42,97•ln700 + 109,43•10-3•700 -
0,5•18,47•105•700-2) -
dT = (42,97•ln700 + 109,43•10-3•700 -
0,5•18,47•105•700-2) -
(42,97•ln298
+ 109,43•10-3•298 - 0,5•18,47•105•298-2) = 89,2 Дж•моль-1•К-1.
6) Рассчитываем значение величины изобарно-изотермического потенциала
реакции при температуре 700 К.
DG0700
= -268670 + 42784,8 + 700•20,51 - 700•89,2 = -273968 Дж•моль-1•К-1= -273,9
кДж•моль-1•К-1
4.4.2 Расчет DG0700 по
уравнению Гиббса-Гельмгольца (второй метод)
1) Определяем изобарно-изотермический потенциал реакции при 298 К.
DG 0298
= -268670 + 298•20,51 = -262558 Дж•моль-1•К-1
) Вычисляем постоянную интегрирования DH0.
DH0 =
-268670 - 42,97•298 - 0,5•109,43•10-3•2982 + 18,47•105•298-1 = - 280136
Дж•моль-1.
) Находим постоянную интегрирования у.
у•298 = -262558 + 280136+ 42,97•298•ln298 + 0,5•109,43•10-3•2982 + 0,5•18,47•105•298-1 = 98487,53;
у = 330,5.
) Рассчитываем значение изобарно-изотермического потенциала реакции при
700 К.
DG0700
= - 280136 - 42,97•700•ln700
- 0,5•109,43•10-3•7002 - 0,5•18,47•105•700-1 + 330,5•700 = -273966 Дж•моль-1=
-273,9 кДж•моль-1.
Полученное значение величины изобарно-изотермического потенциала, DG0700 = -273,9 кДж•моль-1, позволяет
сделать заключение о термодинамической вероятности, то есть возможности
протекания реакций образования соединения CuFe2O4 при
температуре 700 К.
.5 ЗАКЛЮЧЕНИЕ
Результаты расчетов изменения изобарно-изотермического потенциала DG0т, полученные по уравнению Гиббса и
уравнению Гиббса-Гельмгольца для реакции образования CuFe2O4,
приведены в таблице 3. Графическая зависимость DG0т=f(T) показана на рисунке 2.
Таблица 3 - Значения величины DG0т реакции образования CuFe2O4
|
Т, К
|
298
|
400
|
500
|
600
|
700
|
|
DG0т,
кДж•моль-1
|
-262,5
|
-261,9
|
-263,9
|
-267,9
|
-273,9
|
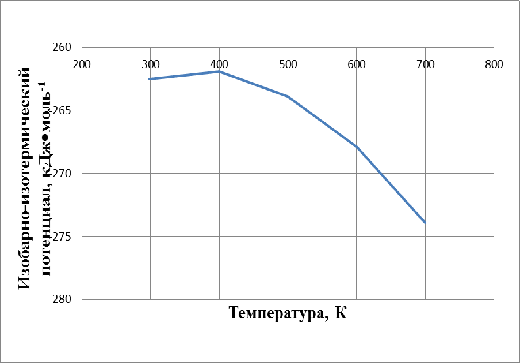
Рисунок 2 ˗ Зависимость изобарно-изотермического потенциала от
температуры
Как показывают полученные результаты, реакция образования CuFe2O4 протекает в интервале температур от 298 до 700 К при
стандартном давлении, с увеличением температуры её вероятность убывает в
интервале температур от 298 до 400 К и возрастает в интервале температур от 400
до 700 К.
ВЫВОД
Термодинамический анализ системы «CuO ˗˗ FeO» и
системы «CuO ˗˗ 2FeO» в интервале температур 298…700 К
показывает, что энергетически наиболее вероятно протекание реакции образования CuFe2O4 (DG0т= ˗262,5…˗273,9
кДж•моль-1). Реакция образования CuFeO2
будет протекать во вторую очередь (DG0т= ˗164,9…˗161,2 кДж•моль-1).
Список литературы
1. Хомич В.А.
Термодинамические расчеты: метод. указания к курсовой работе по физической
химии для студентов специальности 330200 « Инженерная защита окружающей среды».
- Омск: Изд-во СибАДИ, 2005. - 14 с.
. Бобкова
Н.М., Силич Л.М., Терещенко И.М. Сборник задач по физической химии силикатов и
тугоплавких соединений: учеб. пособие для вузов. - Минск: «Университетское»,
1990. - 175 с.
. Кругляков
П.М. Физическая и коллоидная химия: учебное пособие / П.М. Кругляков, Т.Н.
Хаскова. 2-ое изд., испр. ˗ М.: Высшая школа, 2007. ˗ 319 с.
. Краткий
справочник физико-химических величин: учебное пособие / Ред. А.А. Равдель, А.М.
Пономарева. ˗ 11˗е изд., испр. и доп. ˗ М.: As˗book, 2009. ˗ 240 с.