Оценка качества твердых дозированных лекарственных форм
Министерство
здравоохранения Республики Беларусь
УО
«Витебский государственный ордена Дружбы народов
медицинский
университет»
Кафедра
промышленной технологии с курсом ФПК и ПК
Курсовая
работа на тему
Оценка
качества твердых дозированных лекарственных форм
Выполнил:
студентка 4 группы 5 курса
заочного
отделения
фармацевтического
факультета
Милькевич
Е.В.
Витебск,
2013г.
ВВЕДЕНИЕ
Стандартизация лекарственных форм имеет одно из
первостепенных значений в определении качества лекарственного средства.
Цель данной курсовой работы - изучить
требования, предъявляемые к твердым дозированным лекарственным формам, таким
как таблетки, капсулы, суппозитории. Оценка качества определяется с помощью
тестов, которые могут быть общего характера, например:
· описание
· идентификация действующих веществ
· количественное содержание
действующих веществ
· микробиологическая чистота
а могут быть и специфическими, например:
· содержание талька и аэросила (при их
использовании при производстве таблеток)
· излишнее количество органических
растворителей при их использовании
1. Описание, внешний
вид, количественное содержание действующих веществ
Внешний вид определяется по ФС производителя.
Таблетки, например должны иметь правильную форму, цельные края без выщербленных
мест, поверхность должна быть ровной и гладкой, без пятен и вкраплений. Внешний
вид таблетки имеет не только эстетическое значение, но и технологический смысл.
Форма таблетки может влиять на акт глотания. Окраска и гравировка служат для
идентификации и дифференцирования. Блеск поверхности указывает на отсутствие
истирания и т.д.
Идентификация действующих веществ и определение
их количественного содержания проводят с помощью специфических реакций, исходя
из химического строения данных соединений.
Для определения количественного содержания
действующих веществ берут 20 таблеток без оболочки, если таблетки имеют
оболочку, то количество таблеток устанавливается разработчиком (но не менее 5).
Допустимые отклонения:
· если содержание действующего вещества менее 1 мг
- ±17,5
· если от 1 мг до 10 мг - ±10
· если от 10 до 100 мг - ±7,5
· если более 100 мг - ±5
2. Однородность массы
для единицы дозированного лекарственного средства (ГФ РБ т 1. 2.9.5.)
единиц дозированного лекарственного средства
отбирают по статистически обоснованной схеме, взвешивают каждую в отдельности и
рассчитывают среднюю массу. Лекарственное средство считают выдержавшим
испытание, если не более двух индивидуальных масс отклоняются от средней массы
на величину, указанную в таблице 1. При этом ни одна индивидуальная масса не
должна отклоняться от средней массы на величину в два раза превышающую значение,
указанное в таблице 1.
Таблица 1
|
Лекарственная
форма
|
Средняя
масса
|
Допустимое
отклонение,
|
|
Таблетки
(без оболочки и покрытые пленочной оболочкой)
|
80
мг и менее
|
10
|
|
Более
80 мг, но менее 250мг
|
7,5
|
|
250
мг и более
|
5
|
|
капсулы
|
Менее
300 мг
|
10
|
|
300
мг и более
|
7,5
|
|
суппозитории
|
Для
всех случаев
|
5
|
Данное испытание не проводится для
поливитаминных лекарственных средств и для лекарственных средств, содержащих
микроэлементы, если нет других указаний в частной статье.
Капсулы
Взвешивают невскрытую капсулу. Затем вскрывают
капсулу таким образом, чтобы не была потеряна какая-либо часть оболочки, и
удаляют как можно полнее ее содержимое. В случае капсул с мягкой оболочкой
промывают оболочку растворителем. Затем взвешивают оболочку. По разности
взвешиваний рассчитывают массу содержимого капсулы. Повторяют процедуру с другими
19 капсулами.
3. Прочность таблеток
без оболочки на истирание (ГФ РБ т 1. 2.9.7.)
Испытание позволяет определить истираемость
таблеток без оболочки при определенных условиях, т.е. повреждения поверхности
таблеток под воздействие механического удара или истирания.
Методика
При массе одной таблетки менее 0,65 г для
испытания берут 20 таблеток; при массе одной таблетки более 0,65 г - 10
таблеток. Таблетки помещают на сито №1000 и тщательно удаляют пыль посредством
сжатого воздуха или мягкой кисточки. Таблетки взвешивают (точная навеска) и
помещают в барабан. После 100 оборотов барабана таблетки извлекают и снова
тщательно удаляют пыль. Если ни на одной из таблеток нет сколов и трещин,
таблетки взвешивают с точностью до 0,001 г.
Обычно испытание проводят один раз. Если
полученные результаты вызывают сомнение или потеря в массе превышает 1%,
испытание повторяют еще дважды и вычисляют среднее из трех измерений. Если нет
других указаний в частной статье, потеря в массе должна быть не более 1% от
суммарной массы испытуемых таблеток.
При испытании таблеток с диаметром 13 мм и более
для получения воспроизводимых результатов может возникнуть необходимость
отрегулировать барабан таким образом, чтобы лежащие рядом таблетки не упирались
друг в друга и имели возможность падать свободно. Обычно достаточно установить
ось под углом 10 к основанию. Схема
прибора представлена на рисунке 1.
к основанию. Схема
прибора представлена на рисунке 1.

Рисунок 1. - Прибор для определения прочности
таблеток на истирание
Представление результатов
Прочность таблеток на истирание выражается
потерей в массе, вычисленной в процентах от исходной массы испытуемых таблеток.
Необходимо указывать число таблеток, взятых для
испытания.
Допускается использование и другого прибора (см.
Рисунок 2)
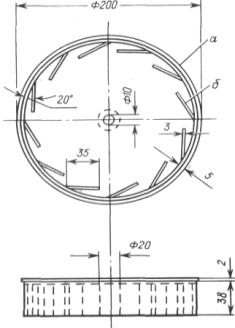
Рисунок 2. - Прибор для определения прочности
таблеток на истирание
Методика
таблеток, обеспыленных и взвешенных с точностью
до 0,001 г, помещают в барабан, привинчивают крышку и включают устройство на 5
мин, что соответствует 100 об/мин. По истечении установленного времени таблетки
обеспыливают и определяют их массу с точностью до 0,001 г.
Представление результатов
 ,
,
где: Рнач - масса таблеток до истирания, в
граммах;
Ркон - масса таблеток после истирания, в
граммах.
Форма таблеток не должна изменяться в процессе
испытания. Если хотя бы из 10 испытуемых таблеток обнаруживаются трещины или
сколы, испытание проводят дополнительно на 20 таблетках.
4. Прочность таблеток
на сжатие (ГФ РБ т 1. 2.9.8.)
Испытание позволяет определить прочность
таблеток на сжатие при определенных условиях путем измерения силы, необходимой
для разрушения таблеток.
Прибор
Прибор представляет собой два расположенные друг
против друга зажима, один из которых может перемещаться по направлению к
другому. Плоскости поверхностей зажимов перпендикулярны направлению движения.
Сдавливающие поверхности зажимов должны быть плоскими и превосходить по размеру
зону контакта с таблеткой. Прибор калибруют с использованием системы,
обеспечивающей точность 1 Н.
Методика
Таблетку помещают между зажимами, принимая во
внимание ее форму, а также разделительную линию и надпись. Если они есть. Для
всех измерений таблетка должна быть ориентирована одинаково по отношению к
направлению прилагаемой силе. Измерения проводят для 10 таблеток. Перед каждым
измерением тщательно удаляют все фрагменты предыдущей таблетки.
Эта процедура не применима при использовании
полностью автоматизированного прибора.
Представление результатов
Необходимо указывать среднее, минимальное и
максимальное значения измеренной силы в Н.
Также указывают тип использованного прибора и,
если необходимо, ориентацию таблеток.
Таблетки должны иметь прочность на сжатие не
ниже значений, указанных в таблице 2, если нет других указаний в частной
статье.
Таблица 2
|
Диаметр,
мм
|
Прочность
на сжатие, Н
|
|
6
|
10
|
|
7
|
20
|
|
8
|
25
|
|
9
|
30
|
|
10
|
30
|
|
11
|
40
|
|
12
|
50
|
|
13
|
50
|
Для таблеток, предназначенных для измельчения
или разжевывания, в частной статье указывают верхний предел прочности на
сжатие.
5. Распадаемость
таблеток и капсул (ГФ РБ т 1. 2.9.1.)
Испытание на распадаемость позволяет определить,
распадаются ли таблетки или капсулы в пределах установленного времени, если они
помещены в жидкую среду в экспериментальных условиях, указанных ниже.
Считают, что образцы распались, если:) нет
остатка;) есть остаток, но он состоит из мягкой массы, не содержащей
ощутимого ядра, которое не смачивается;) есть только фрагменты покрытия
(таблетки) или только фрагменты оболочки на сетке, или, если были использованы
диски, фрагменты оболочки, которые прилипли к нижней поверхности дисков
(капсулы).
В случае, если длина таблеток не превышает 18
мм, используют прибор А, для таблеток и капсул большего размера используют
прибор В.
Тест А - таблетки и капсулы нормального размера
Методика.
В каждую из 6 трубок помещают одну таблетку или
капсулу и, если указано, диск; погружают корзинку в сосуд с жидкостью,
указанной в общей и частных статьях. Включают прибор (Рисунок 3), по истечении
указанного времени отключают, вынимают корзинку и исследуют состояние таблеток
или капсул. Лекарственное средство выдерживает испытание, если все таблетки или
капсулы распались.
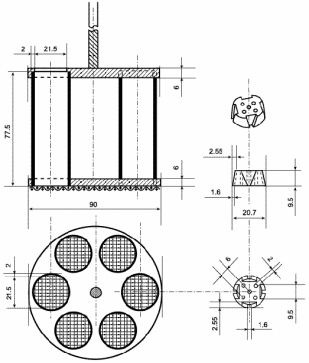
Рисунок 3. - Прибор А
Тест В - таблетки и капсулы больших размеров
Методика
Испытывают 6 таблеток или капсул, используя либо
две корзинки параллельно, либо выполняя испытание дважды. В каждую из 3 трубок
помещают одну таблетку или капсулу и, если указано, диск; погружают корзину в
сосуд с жидкостью, указанную в общих или частных статьях. Включают прибор
(рисунок), по истечении указанного времени отключают, вынимают корзинку и
исследуют состояние таблеток или капсул. Лекарственное средство выдерживает
испытание, если 6 таблеток или капсул распались.

Рисунок 4. - прибор В
6. Распадаемость
суппозиториев (ГФ РБ т 1. 2.9.2.)
Испытание позволяет определить, размягчаются или
распадаются суппозитории в пределах установленного времени, если они помещены в
жидкую среду в экспериментальных условиях, указанных ниже.
Считают, что образцы распались, если:) наблюдается
полное растворение;) компоненты суппозитория разделились;) размягчение
образца сопровождается заметным изменением формы, без полного разделения
компонентов; размягчением также считается отсутствие твердого ядра,
оказывающего сопротивление давлению стеклянной палочки;
Методика
Испытывают три суппозитория. Каждый образец
помещают на нижний диск устройства (Рисунок 5), устанавливают устройство в
цилиндр прибора и закрепляют его. Помещают прибор в сосуд с водой и начинают
испытание. Приборы переворачивают каждые 10 мин. По истечении времени,
указанного в частной статье, исследуют образцы. Лекарственное средство
выдерживает испытания, если все образцы распались.
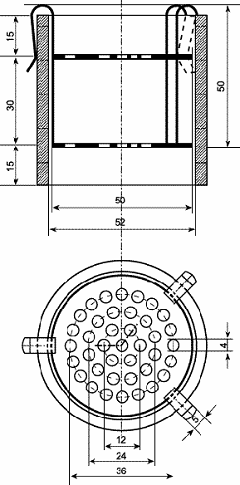
Рисунок 5. - Прибор для определения
распадаемости суппозиториев
7. Тест «Растворение»
для твердых дозированных форм (ГФ РБ т 1. 2.9.3.)
Под степенью растворения понимают количество
действующего вещества, в процентах, от содержания, указанного в разделе
«Состав», которое в условиях, описанных в частной статье, должно перейти в
раствор.
Данное испытание используют для определения
степени растворения действующих веществ твердых дозированных форм.
Для проведения испытания может использоваться
прибор с лопастью-мешалкой, корзинкой или, в специальных случаях, с проточной
кюветой, если нет других указаний в частной статье. Проточный прибор обычно
целесообразно применять в том случае, когда действующее вещество испытуемого
лекарственного средства плохо растворимо в воде и водных средах растворения. В
каждом конкретном случае применение теста «Растворение» должно быть указано
следующее:
· используемый прибор; в тех случаях, когда
применяется прибор с проточной кюветой, должен быть указан тип проточной кюветы
(Рисунок);
· состав, объем и температура среды
растворения;
· скорость вращения или скорость
протекания среды растворения;
· время, методика и объем отбираемого
испытуемого раствора или условия для непрерывного контроля;
· методика анализа;
· количество или количества
действующих веществ, которые должны раствориться за указанное время.
Среда растворения. В качестве среды растворения
могут использоваться вода Р, 0,1 М раствор кислоты хлористоводородной,
фосфатные буферные растворы с рН от 6,8 до 7,6 и другие водные растворители.
Неводные растворители в средах растворения используют в исключительных случаях,
и их применение требует дополнительного обоснования.
Выбор используемого прибора (Рисунок 6,7,8)
зависит от физико-химических характеристик дозированной формы.

Рисунок 6. - Прибор с лопастью-мешалкой
Рисунок 7. - Прибор с корзинкой
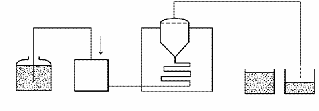
Рисунок 8. - Проточный прибор
Если средой растворения является буферный
раствор, его рН устанавливается с точностью до ±0,05 от указанного значения.
Перед проведением испытания из среды растворения
удаляются растворенные газы, поскольку они могут вызвать образование пузырьков,
которые существенно влияют на результаты испытаний.
Обычный объем среды растворения - 900-1000 мл,
температура среды растворения - 37,0±0,5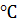 .
.
Методика
Прибор с лопастью-мешалкой и корзинкой (Рисунок
6)
Помещают указанный в частной статье объем среды
растворения в сосуд, собирают прибор, нагревают среду растворения до 37±0,5 и
удаляют термометр.
и
удаляют термометр.
Помещают одну единицу испытуемого лекарственного
средства и прибор.
Возможно помещение нескольких единиц испытуемого
лекарственного средства одновременно.
Для прибора с лопастью-мешалкой: перед началом
вращения лопасти лекарственное средство помещают на дно сосуда; твердые
дозированные формы, которые при этом могут всплывать, помещают на дно сосуда
горизонтально с помощью соответствующего устройства, например, проволоки или
стеклянной спирали.
Для прибора с корзинкой: лекарственное средство
помещают в сухую корзинку, которую опускают в соответствующее положение перед
началом вращения.
Следует принять меры, обеспечивающие отсутствие
пузырьков воздух на поверхности лекарственного средства.
Вращение лопасти-мешалки или корзины с указанной
скоростью (±4 ) начинают
немедленно.
) начинают
немедленно.
Скорость вращения обычно составляет 50 об/мин
для лопасти в случае использования прибора с лопастью-мешалкой и 100 об/мин -
для корзинки.
Рисунок 8 - Проточная кювета

Рисунок 9 Кюветы
Чтобы предохранять вход в камеру,
предназначенный для жидкости, на дно конуса помещают один шарик диаметром 5±0,5
мм, затем - стеклянные шарики подходящего размера, предпочтительнее диаметром
1±0,1 мм. Посредством специального держателя помещают одну единицу испытуемого
лекарственного средства в кювету на/или внутрь полученного слоя стеклянных
шариков. Собирают фильтрующую головку.
Нагревают среду растворения до температуры
37±0,5 .
Используя насос, пропускают с указанной скоростью (±5
.
Используя насос, пропускают с указанной скоростью (±5 среду
растворения через дно кюветы для получения подходящего непрерывного потока в
открытом или закрытом цикле.
среду
растворения через дно кюветы для получения подходящего непрерывного потока в
открытом или закрытом цикле.
Помещают одну единицу испытуемого лекарственного
средства в камеру А. Закрывают кювету подготовленным фильтрующим устройством. В
начале испытания в камере А удаляют воздух через маленькое отверстие,
соединенное с фильтрующим устройством. Нагревают среду растворения до соответствующей
температуры, учитывая температуру плавления лекарственного средства. Используя
подходящий насос, пропускают с указанной скоростью (±5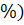 нагретую среду растворения через дно кюветы, получая непрерывный поток в
открытом или закрытом цикле. Камера В заполняется средой растворения, когда
среда растворения начнет переливаться через край. Воздух начнет выходить через
капилляр. Лекарственное средство распределяется в среде растворения в
соответствии со своими физико-химическими свойствами. В обоснованных и
разрешенных случаях испытанию могут подвергаться представительные части
суппозиториев большого размера.
нагретую среду растворения через дно кюветы, получая непрерывный поток в
открытом или закрытом цикле. Камера В заполняется средой растворения, когда
среда растворения начнет переливаться через край. Воздух начнет выходить через
капилляр. Лекарственное средство распределяется в среде растворения в
соответствии со своими физико-химическими свойствами. В обоснованных и
разрешенных случаях испытанию могут подвергаться представительные части
суппозиториев большого размера.
Отбор проб и оценка результатов
При использовании прибора с лопастью-мешалкой
или корзинкой отбор проб указанного объема проводят в указанное время или через
указанные интервалы, или непрерывно из участка посередине между поверхностью
среды растворения и верхней частью корзинки или лопасти-мешалки на расстоянии
не менее 1 см от стенки сосуда.
При использовании прибора с проточной кюветой
отбор проб всегда проводят у выходного отверстия кюветы, независимо от того,
открыта цепь или закрыта.
Рисунок 10. - Проточная кювета
Необходимо компенсировать отобранный объем
жидкости прибавлением равного объема среды растворения или соответствующими
изменениями в расчетах, исключая те случаи, когда используются непрерывные
измерения при проведении испытаний с лопастью-мешалкой или корзинкой
(отобранная жидкость при этом возвращается обратно в сосуд), или когда
отбирается только одна порция жидкости.
Отобранную жидкость фильтруют, используя
инертный фильтр с соответствующим размером пор, который не вызывает
значительной адсорбции действующего вещества из раствора и не содержит таких
веществ, которые экстрагируются средой растворения и не влияют на результаты
указанного аналитического метода. Анализ фильтрата проводят методом, указанным
в частной статье.
Количество действующего вещества,
растворившегося в течение указанного времени, выражается в процентах от
содержания, указанного в разделе «Состав».
Если нет других указаний в частных статьях, для
каждой единицы испытуемого лекарственного средства за 45 мин в раствор должно
перейти не менее 75 не более 115
не более 115 действующего вещества от его содержания, указанного в разделе «Состав». Если
одна из единиц испытуемого лекарственного средства не соответствует этому
требованию, проводят испытание еще шести единиц испытуемого лекарственного
средства.
действующего вещества от его содержания, указанного в разделе «Состав». Если
одна из единиц испытуемого лекарственного средства не соответствует этому
требованию, проводят испытание еще шести единиц испытуемого лекарственного
средства.
В случае использования в тесте «Растворение»
совокупности единиц испытуемого лекарственного средства, которая рассматривается
как одна единица испытуемого лекарственного средства, проводят параллельно
испытание для шести таких единиц. Полученные результаты пересчитывают на одну
единицу дозированного лекарственного средства. Если нет других указаний в
частных статьях, для каждой единицы испытуемого лекарственного средства за 45
мин в раствор должно перейти не менее 75 и не более 115
и не более 115 действующего
вещества от его содержания, указанного в разделе «Состав». Дополнительные
испытания в данном случае не проводят.
действующего
вещества от его содержания, указанного в разделе «Состав». Дополнительные
испытания в данном случае не проводят.
8. Определение времени
деформации липофильных суппозиториев (ГФ РБ т 3. 2.9.22.)
Данное испытание позволяет определить, при
заданных условиях, время необходимое для деформации суппозиториев с момента помещения
суппозитория в воду до момента, когда лекарственное средство не оказывает
сопротивление определенному приложенному весу.
Методика
Помещают стеклянную трубку, которая содержит 10
мл воды, на водяную баню с температурой 36,5±0,5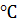 .
Стеклянную трубку устанавливают вертикально и погружают ее на глубину не менее
7 см ниже поверхности, но так, чтобы она не касалась дна водяной бани. В трубку
заостренным концом вниз помещают суппозиторий, затем вводят стержень со
свободно скользящей крышкой до тех пор, пока металлическая игла не коснется
плоского конца суппозитория. Трубку закрывают крышкой. Отсчет времени начинают
с этого момента. Регистрируют время, необходимое для достижения стержнем дна
стеклянной трубки и время подъема маркировочного кольца до верхнего края
пластмассовой крышки (Рисунок 11)
.
Стеклянную трубку устанавливают вертикально и погружают ее на глубину не менее
7 см ниже поверхности, но так, чтобы она не касалась дна водяной бани. В трубку
заостренным концом вниз помещают суппозиторий, затем вводят стержень со
свободно скользящей крышкой до тех пор, пока металлическая игла не коснется
плоского конца суппозитория. Трубку закрывают крышкой. Отсчет времени начинают
с этого момента. Регистрируют время, необходимое для достижения стержнем дна
стеклянной трубки и время подъема маркировочного кольца до верхнего края
пластмассовой крышки (Рисунок 11)
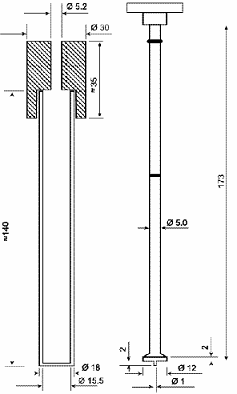
Рисунок 11. - Прибор А для измерения времени
деформации липофильных суппозиториев.
Государственная Фармакопея предлагает и прибор В
(Рисунок 12).
Методика
Во внутреннюю трубку (А) отмеривают 5 мл воды с
температурой 36,5±0,5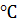 , помещают
суппозиторий заостренным концом вниз и вводят вставку (С1 или С2). Отсчет
времени начинают с этого момента. Полное размягчение или растворение
суппозитория считается законченным, когда нижний край стеклянного стержня с
ободком (С1) или стального стержня (С2) достигнет суженной части внутренней
стеклянной трубки.
, помещают
суппозиторий заостренным концом вниз и вводят вставку (С1 или С2). Отсчет
времени начинают с этого момента. Полное размягчение или растворение
суппозитория считается законченным, когда нижний край стеклянного стержня с
ободком (С1) или стального стержня (С2) достигнет суженной части внутренней
стеклянной трубки.

Рисунок 12. - Прибор В для измерения времени
деформации липофильных суппозиториев.
9. Устойчивость
суппозиториев к разрушению (ГФ РБ т 1. 2.9.24)
Данное испытание предназначено для определения
устойчивости к разрушению, при заданных условиях, суппозиториев, путем
измерения массы, необходимой для их разрушения раздавливанием.
Данное испытание проводится для суппозиториев,
изготовленных на липофильной основе.
Методика
Устанавливают прибор (Рисунок 13) в вертикальное
положение. Термостатическую камеру нагревают до температуры 25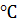 .
Испытуемое лекарственное средство выдерживают при нужной для проведения
испытания температуре в течение не менее 24 ч. Суппозиторий помещают
вертикально, заостренным концом вверх, между тисками держателей (Рисунок 14).
.
Испытуемое лекарственное средство выдерживают при нужной для проведения
испытания температуре в течение не менее 24 ч. Суппозиторий помещают
вертикально, заостренным концом вверх, между тисками держателей (Рисунок 14).
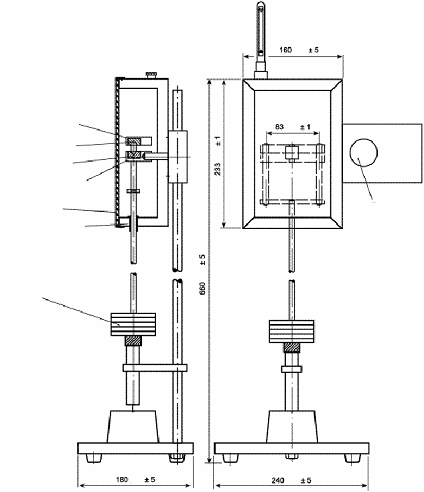
Рисунок 13. - Прибор для определения
устойчивости к разрушению суппозиториев
Надежно закрепляют верхний прижимной блок,
соединенный с подвесным устройством, и закрывают камеру стеклянным окном. Для
каждого определения закрепляют суппозиторий одинаково с учетом направления силы
сжатия.
Спустя одну минуту нанизывают первый диск массой
200 г. Спустя еще минуту добавляют следующий диск. Процедура повторяется до
полного разрушения суппозитория.
Необходимую для разрушения суппозитория массу
рассчитывают путем суммирования массы, воздействующей на суппозиторий в момент
его разрушения (с учетом первоначальной массы подвески прибора), и оценивают
следующим образом:
· если суппозиторий разрушается в течение 20 с с
момента нанизывания последнего диска, массу диска не учитывают;
· если суппозиторий разрушается в
течение 20-40 с с момента нанизывания последнего диска, учитывают только
половину массы диска, то есть 100 г;
· если суппозиторий остается не
разрушенным в течение более 40 с с момента нанизывания последнего диска,
учитывают массу всех дисков.
Испытания проводят на 10 суппозиториях,
убедившись в отсутствии остатков суппозиториев в приборе перед каждым
последующим испытанием.
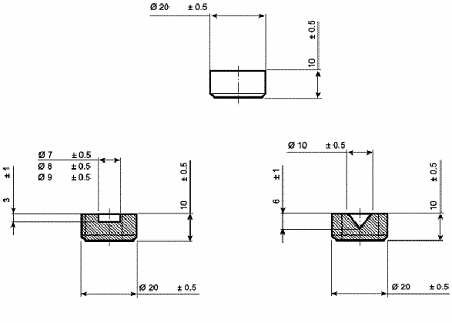
Рисунок 14.- Нижние и верхние тиски
10. Однородность
содержания действующего вещества в единице дозированного лекарственного
средства (ГФ РБ т 1. 2.9.6.)
Испытание на однородность содержания
действующего вещества в единице дозированного лекарственного средства
основывается на количественном определении содержания в индивидуальных
однодозовых единицах лекарственного средства с целью выяснения, находится ли
это содержание внутри пределов, установленных по отношению к среднему
содержанию в испытуемом образце.
Метод. Используя аналитическую методику,
указанную в частной статье, определяют содержание действующего вещества в
каждой из 10 дозированных единиц лекарственного средства, отобранных по
статистически обоснованной схеме.
Применяют критерии тестов А, В или С как указано
в статье для испытуемой дозированной формы.
Тест А используется в случае таблеток.
Лекарственное средство выдерживает испытание, если содержание в каждой его
однодозовой единице находится в пределах 85-115 от среднего содержания. Лекарственное средство не выдерживает испытание, если
содержание более чем в одной единице выходит за вышеуказанные пределы или если
содержание хотя бы в одной единице выходит за пределы 75-125
от среднего содержания. Лекарственное средство не выдерживает испытание, если
содержание более чем в одной единице выходит за вышеуказанные пределы или если
содержание хотя бы в одной единице выходит за пределы 75-125 от среднего содержания.
от среднего содержания.
Если содержание в одной единице лекарственного
средства выходит за пределы 85-115 ,
но находится в пределах 75-125
,
но находится в пределах 75-125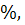 определяют
содержание в каждой из 20 дополнительных однодозовых единиц лекарственного
средства, отобранных по статистически обоснованной схеме. Лекарственное
средство выдерживает испытание, если содержание не более чем в одной из
проанализированных 30 единиц выходит за пределы 85-115
определяют
содержание в каждой из 20 дополнительных однодозовых единиц лекарственного
средства, отобранных по статистически обоснованной схеме. Лекарственное
средство выдерживает испытание, если содержание не более чем в одной из
проанализированных 30 единиц выходит за пределы 85-115 и ни в одной единице не выходит за пределы 75-125
и ни в одной единице не выходит за пределы 75-125 от среднего содержания.
от среднего содержания.
Тест В. Используется для капсул и суппозиториев.
Лекарственное средство выдерживает испытание,
если содержание не более чем в одной единице выходит за пределы 85-115 и ни в одной единице не выходит за пределы 75-125
и ни в одной единице не выходит за пределы 75-125 от среднего содержания в лекарственном средстве. Лекарственное средство не
выдерживает испытание, если содержание более чем в трех единицах выходит за
пределы 85-115
от среднего содержания в лекарственном средстве. Лекарственное средство не
выдерживает испытание, если содержание более чем в трех единицах выходит за
пределы 85-115 от среднего
содржания или если хотя бы в дной единице выходит за пределы 75-125
от среднего
содржания или если хотя бы в дной единице выходит за пределы 75-125 от среднего содержания. Если содержания в двух или трех единицах лекарственного
средства выходит за пределы 85-115
от среднего содержания. Если содержания в двух или трех единицах лекарственного
средства выходит за пределы 85-115 ,
но находиться в пределах 75-125
,
но находиться в пределах 75-125 , определяют
содержание в каждой из 20 дополнительных однодозовых единиц лекарственного
средства, отобранных по статистически обоснованной схеме. Лекарственное
средство выдерживает испытание, если содержание не более чем в трех из
проанализированных 30 единиц выходит за пределы 85-115
, определяют
содержание в каждой из 20 дополнительных однодозовых единиц лекарственного
средства, отобранных по статистически обоснованной схеме. Лекарственное
средство выдерживает испытание, если содержание не более чем в трех из
проанализированных 30 единиц выходит за пределы 85-115 и ни в одной единице не выходит за пределы 75-125
и ни в одной единице не выходит за пределы 75-125 от среднего содержания.
от среднего содержания.
11. Однородность
дозированных единиц (ГФ РБ т 2. 2.9.40.)
Однородность дозированных единиц определяется
как степень определяется как степень однородности распределения активного
вещества в дозированных единицах лекарственного средства с целью выяснения,
находится ли это содержание внутри установленных пределов. Метод прямого
определения может применяться во всех случаях.
Метод прямого определения
Отбирают не менее 30 единиц лекарственного
средства и проводят определение, как указано для данной дозированной формы.
Если используются разные методики для количественного определения и испытания
однородности содержимого, вводят корректирующий коэффициент, который применяют
к конечным результатам.
Для твердых дозированных форм в каждой из 10
отобранных единиц определяют количественное содержание активного вещества,
используя подходящий аналитический метод. Рассчитывают приемлемое значение.
Расчетно-весовой метод
Количественное определение активного вещества
проводят на репрезентативном образце серии, используя подходящей аналитический
метод. Получают значение А, выраженное в процентах от номинального содержания.
Допускают, что концентрация (масса активного вещества на массу дозированной
единицы) одинаковая для всех дозированных единиц. Отбирают не менее 30
дозированных единиц и проводят определение, как указано для каждой дозированной
формы.
Таблетки без оболочки или таблетки, покрытые
пленочной оболочкой. Точно взвешивают каждую из 10 отобранных таблеток.
Рассчитывают содержание активного вещества в каждой таблетке в процентах от
номинального содержания исходя из номинальной массы таблетки и результата
количественного определения. Рассчитывают приемлемое значение.
Твердые капсулы. Точно взвешивают каждую из 10
отобранных капсул, тщательно следя за их целостностью. Извлекают подходящим
способом содержимое каждой капсулы. Точно взвешивают каждую пустую капсулу и
рассчитывают для каждой капсулы чистую массу содержимого путем вычитания массы
оболочки из общей массы соответствующей капсулы. Рассчитывают содержание
активного вещества в каждой капсуле, исходя из извлеченной из капсулы
индивидуальной массы и результата количественного определения. Рассчитывают
приемлемое значение.
Другие твердые лекарственные формы, кроме
таблеток и капсул. Определение проводят так же, как и для твердых капсул,
обрабатывая каждую единицу, как указано в данном разделе. Рассчитывают
приемлемое значение.
Приемлемое значение (AV)
рассчитывают по формуле

Для расчетно-весового метода индивидуальное
содержание заменяют на рассчитанное содержание, полученное следующим способом:
 ,
,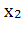 ,….,
,….,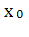 -
отдельные значения содержания в испытанных дозированных единицах, где
-
отдельные значения содержания в испытанных дозированных единицах, где
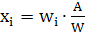
 - отдельные массы
испытанных дозированных единиц,
- отдельные массы
испытанных дозированных единиц,
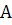 - содержание
активного вещества (процент от указанного на этикетке), полученное с
использованием подходящего аналитического метода,
- содержание
активного вещества (процент от указанного на этикетке), полученное с
использованием подходящего аналитического метода,
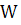 - среднее значение
отдельных масс.
- среднее значение
отдельных масс.
Критерии
Требования для однородности дозирования
удовлетворяются, если приемлемое значение первых 10 дозированных единиц
является меньшим или равным L1.
Если приемлемое значение выше, то исследуют следующие 20 единиц и вычисляют
приемлемое значение. Требования удовлетворяются, если конечное приемлемое
значение 30 дозированных единиц является меньшим или равным L1.
Причем индивидуальное содержание дозированной единицы должно быть не менее, чем
(1- L2 М
и не более, чем (1+ L2
М
и не более, чем (1+ L2 М
при расчете приемлемого значения по методу прямого определения или по
расчетно-весовому методу. Если не других указаний в частных статьях, то L1
равно 15,0, а L2 равно 25,0.
М
при расчете приемлемого значения по методу прямого определения или по
расчетно-весовому методу. Если не других указаний в частных статьях, то L1
равно 15,0, а L2 равно 25,0.
12. Микробиологическая
чистота
Испытание проводится согласно общему методу
«Испытание микробиологической чистоты» или «Испытание стерильности».
Для испытания таблеток нужно взять
соответствующее количество порошкованных таблеток в асептических условиях.
Таблетки в зависимости от назначения должны соответствовать требованиям
«Испытание микробиологической чистоты для различных групп лекарственных
средств».
таблетка оболочка капсула дозированный
ЗАКЛЮЧЕНИЕ
Тесты, проводимые для стандартизации различных
твердых дозированных лекарственных форм, существуют как общие, так и
специфические, но при этом и те и другие должны неукоснительно выполняться.
Оценка качества таблеток предусматривает
следующие тесты:
) описание (внешний вид, цвет, запах)
) идентификация действующих веществ
) количественное содержание действующих
веществ
) средняя масса, однородность массы
единичных таблеток
) истираемость
) стойкость к раздавливанию
) распадаемость и растворение
) однородность содержания действующих
веществ в единице дозированного лекарственного средства
) содержание талька и аэросила
(количественно, если входят в состав)
) потеря в массе при высушивании
) сопутствующие добавки
) излишнее количество органических
растворителей при их использовании
) микробиологическая чистота.
Оценка качества капсул предусматривает следующие
тесты:
) описание (внешний вид, внешний вид
содержимого)
) подлинность действующих веществ
) распадаемость
) однородность содержания действующих
веществ в единице дозированного лекарственного средства
) количественное содержание действующих
веществ
) микробиологическая чистота
) уменьшение летучести испаряющихся
лекарственных веществ (нитроглицерин).
Оценка качества суппозиториев предусматривает
следующие тесты:
) распадаемость суппозиториев
) определение времени деформации
липофильных суппозиториев
) устойчивость суппозиториевк разрушению.
СПИСОК ЛИТЕРАТУРЫ
1. Государственная
Фармакопея Республики Беларусь. В 3 т. Т. 1. Общие методы контроля качества
лекарственных средств / Центр экспертиз и испытаний в здравоохранении; под общ.
ред. Г. В. Годовальникова. - Минск: Минский государственный ПТК полиграфии,
2006.
2. Государственная
Фармакопея Республики Беларусь. В 3 т. Т.2. Контроль качества лекарственных
веществ и лекарственного растительного сырья / Центр экспертиз и испытаний в
здравоохранении; под общ. ред. А. А Шерякова. - Молодечно: «Типография
«Победа», 2008.
. Государственная
Фармакопея Республики Беларусь. В 3 т. Т.3. Контроль качества фармацевтических
субстанций / Центр экспертиз и испытаний в здравоохранении; под общ. ред. А. А
Шерякова. - Молодечно: «Типография «Победа», 2009.
. Ищенко,
В. И. Промышленная технология лекарственных средств: Учебное пособие В. И.
Ищенко. - Витебск, издательство ВГМУ, 2003. - 567 с
. Хишова,
О. М. Практическое руководство по фармацевтической технологии аптечного
изготовления лекарственных средств для студентов 5-го курса заочного отделения
/ О. М. Хишова. - 2-е издание - Витебск: ВГМУ, 2012. - 181 с.