Фармакотехнологическое изучение надземной части черноголовки разрезной
ПЯТИГОРСКИЙ МЕДИКО-ФАРМАЦЕВТИЧЕСКИЙ
ИНСТИТУТ -
ФИЛИАЛ ГОСУДАРСТВЕННОГО БЮДЖЕТНОГО
ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
"ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ
МЕДИЦИНСКИЙ УНИВЕРСИТЕТ"
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
Выпускная квалификационная работа
Фармакотехнологическое изучение
надземной части черноголовки разрезной
по специальности 060108
"Фармация"
Студентка V курса 26 группы
Аталикова Альбина Сергеевна
Пятигорск 2013
Оглавление
Введение
Глава 1. Перспективы получения фитопрепаратов из черноголовки
разрезной
1.1 Систематическое положение рода Prunella (Черноголовка)
1.2 Ботаническая характеристика черноголовки разрезной (Prunella
laciniata)
1.3 Химический состав черноголовки разрезной
1.4 Использование черноголовки разрезной в народной медицине
1.5 Теоретические аспекты фитоэкстракционных препаратов и их
лекарственных форм
1.5.1 Закономерности процесса экстрагирования растительного сырья
1.5.2 Капсулы как лекарственная форма
Выводы по обзору литературы
Глава 2. Фармакогностический анализ надземной части черноголовки
разрезной
2.1 Морфолого-анатомическое изучение надземной части черноголовки
разрезной
2.1.1 Изучение анатомического строения надземной части черноголовки
разрезной
2.2 Определение числовых показателей надземной части черноголовки
разрезной
2.3 Фитохимический анализ надземной части черноголовки разрезной
2.3.1 Анализ качественного состава фенольных соединений
2.3.2 Кислота аскорбиновая
2.3.3 Макро - и микроэлементы
2.4 Количественное определение биологически активных веществ
надземной части черноголовки разрезной
2.4.1 Дубильные вещества
2.4.2 Кислота аскорбиновая
2.4.3 Флавоноиды
Выводы по главе
Глава 3. Разработка состава и технологии капсул на основе сухого
экстракта из черноголовки разрезной
3.1 Разработка технологии фитоэкстракта из надземной части
черноголовки разрезной
3.2 Выбор вспомогательных веществ
3.3 Получение лекарственной формы - капсул
3.3.1 Получение гранул из сухого экстракта надземной части
черноголовки разрезной
3.3.2 Технологические характеристики сыпучих капсулируемых
материалов
3.3.3 Технологическая схема производства капсул
3.3.4 Оценка качества капсул
Выводы по главе
Общие выводы
Литература
Введение
Растительный мир - неисчерпаемая кладовая природного
лекарственного сырья. На протяжении тысячелетий, с глубокой древности растения
были единственными лечебными средствами. И сегодня лекарственные растения, и
препараты из них служат незаменимым сырьем для получения целого ряда
лекарственных средств.
Общее количество видов лекарственных растений, произрастающих
в мире, очень велико и достигает нескольких сот тысяч. Многие из них еще не
изучены, другие изучаются во многих странах мира.
Народная медицина использует огромное количество
лекарственных растений, значительная часть которых при надлежащем уровне их
химической и фармакологической изученности могут применяться официально. К
числу подобных растений относится черноголовка разрезная.
В связи с этим целью данной работы явилось фармакотехнологическое
изучение надземной части черноголовки разрезной и получение на ее основе
фитопрепарата и современной лекарственной формы - капсул. Капсула -
дозированная лекарственная форма, состоящая из твердой или мягкой желатиновой
<#"780983.files/image001.gif">
где K - коэффициент массопередачи;
S - количество вещества, переходящего из одной фазы в
другую, кг;
F - поверхность
соприкосновения фаз, 
 ;
;
τ - время, сек;
C - с - разность
концентрации вещества, переходящего из одной фазы в другую, кг/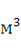
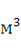 .
.
Суммарный коэффициент массопередачи при экстрагировании
растительного сырья имеет вид (формула 2):

где K - коэффициент массопередачи;
Dc - коэффициент
молекулярной диффузии;
Dв - коэффициент
массопроводности (внутренней диффузии);
В - коэффициент
конвективной диффузии;
1 - размер
частиц;
S - толщина
пограничного слоя.
Коэффициент массопроводности складывается из величины
молекулярного переноса вещества сырья в пограничном слое, а также из величины
конвективного переноса в потоке экстрагента. Поэтому количественная оценка
процесса массопередачи зависит от многих факторов, влияющих на полноту и
скорость извлечения. Эффективность процесса экстракции является
равнодействующей многих факторов, влияние которых нужно умело регулировать,
разрабатывая оптимальную технологию препаратов из растительного сырья [16].
В фармацевтической практике производства фитопрепаратов применяют
динамические и статические способы экстрагирования. Из числа статических
способов наибольшее распространение получили периодические равновесные способы
экстрагирования:
Ø одноступенчатый -
мацерация,
Ø многоступенчатый
прямоточный - ремацерация,
Ø многоступенчатый
противоточный с завершенным циклом - реперколяция с завершенным циклом,
Ø многоступенчатый
противоточный - реперколяция с незавершенным циклом.
Мацерация как способ экстрагирования широко использовалась
для получения ряда препаратов природных соединений. Схемы мацерации отличаются
временем настаивания и соотношением сырья и экстрагента. Чаще всего мацерация
при получении настоек протекает 7 дней, а соотношение сырья и экстрагента
используется в зависимости от характера лекарственного сырья, содержащего те
или иные группы действующих веществ.
Ремацерация и неоднократное настаивание лекарственного сырья
широко применяется в фармацевтической практике. В настоящее время в России
широко применяется модификация ремацерации НИИФ (ЦАНИИ), по которой проводят
получение настоек [16].
Реперколяция имеет много разновидностей, наиболее часто
применяемая в производстве суммарных препаратов - модификация ЦАНИИ и методика,
предложенная Н.Д. Чулковым. При реперколяции экстрагент и сырье движутся
(условно) относительно друг друга по принципу противотока. Экстрагент по мере
насыщения веществами из сырья поступает на другие порции сырья с все
увеличивающимся содержанием веществ и насыщается веществами в еще большей
степени. На каждой ступени происходит настаивание сырья в течение определенного
времени, затем полученный экстрагент передается на следующую ступень, где снова
настаивается со следующей порцией сырья.
При перколяции экстрагент движется через слой растительного
материала и происходит непрерывное удаление проэкстрагированных веществ от
поверхности растительного сырья и перенос в следующие слои материала. При
перколировании слой сырья неподвижен и поток экстрагента производит
передвижение проэкстрагированных веществ, одновременно насыщаясь ими.
Динамические способы предусматривают движение экстрагента
относительно сырья, при котором происходит удаление проэкстрагированных веществ
из зоны экстракции или их перенос в следующие слои материала.
В условиях крупномасштабных производств получают развитие
способы непрерывного противоточного экстрагирования. При этом способе сырье и
экстрагент поступают в аппарат и продвигаются в нем навстречу друг другу.
Регулируя скорость поступления экстрагента и сырья в аппарат, можно менять в
широких пределах концентрацию вытяжек, степень истощения сырья и др. [26].
В настоящее время разрабатываются и применяются новые, более
интенсивные способы обработки сырья с применением частотных колебаний широкого
диапазона, электрического и магнитного полей, экстракция сырья сжиженными
газами и др. [12]
Важнейшим экономическим показателем любого способа
экстрагирования является степень истощения сырья "S", обычно называемая
эффективностью экстракции. Выражают ее в процентах от исходного содержания
веществ в сырье [13].
Эффективность способа экстракции является весьма важным экономическим
показателем и дает возможность судить о степени совершенства производства.
Теоретически вычисленная эффективность экстракции дает представление о
предельной возможности степени истощения сырья. В реальных производственных
условиях фактическая эффективность экстракции по разным причинам всегда
несколько ниже теоретической.
Так, например, расчет эффективности экстракции методом
ремацерации проводят по формуле 3:

где K - коэффициент образования внутреннего сока,
 /г;
/г;

 - число
ступеней экстракции;
- число
ступеней экстракции;
y - коэффициент
съема готовой продукции.
Фактическая эффективность "Sф"
промышленных способов экстрагирования устанавливается в производственных
условиях по формуле 4:

где 
 - объем извлечения,
- объем извлечения, 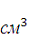
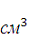 ;
;

 - концентрация нормируемых веществ в извлечении;
- концентрация нормируемых веществ в извлечении;
Q - масса сырья, г;
х - содержание экстрактивных веществ в сырье, %.
Оценить количественно фактическую эффективность экстрагирования
можно путем сравнения ее с теоретической, для чего введено понятие
относительной эффективности экстрагирования "Sо".
Рассчитывается по формуле 5:

 (5)
(5)
Она характеризует степень совершенства производства. Оправданными
могут быть такие условия экстрагирования, при которых Sо≥0,9.
Более низкие значения So
означают, что условия экстракции подобраны неправильно и нуждаются в улучшении
[16].
Динамика и выход процесса экстрагирования растительного сырья
зависит от технологических свойств экстрагируемого сырья, технологической методики
проведения процесса и применяемой аппаратуры. Свойства исходного растительного
сырья оказывают решающее влияние на качество получаемой продукции. Особенно
большое значение имеют содержание экстрактивных и действующих веществ,
влажность и размер частиц. Для проведения процесса экстрагирования и его
расчета необходимо также знать технологические свойства лекарственного сырья:
доброкачественность сырья, поглощаемость сырьем экстрагента, плотность,
объемная и насыпная масса, пористость, порозность и т.д. [17].
При экстрагировании растительного сырья некоторая часть
экстрагента поглощается сырьем. Мерой объема экстрагента, поглощенного единицей
массы сырья является коэффициент поглощения.
Равновесные способы экстрагирования предполагают равенство
концентраций веществ во всех точках системы, поэтому расчеты их эффективности
основаны на количественном учете жидкой фазы, так как экстрагируемые вещества
распределяются на ступени экстракции пропорционально объемам жидкости, слитой
после настаивания и оставшейся с сырьем. После настаивания и слива извлечения с
сырьем всегда остается жидкость, содержащаяся в порах частиц, на их поверхности
и между ними. Мерой ее объема является коэффициент образования внутреннего
сока.
Коэффициент образования внутреннего сока служит мерой объема
внутреннего сока, образовавшегося в единице массы сырья при растворении в
поглощенном экстрагенте влаги и экстрактивных веществ.
Кроме того, для расчетов при прогнозировании и нормировании
качества жидких экстрактов и настоек необходимо иметь информацию о
"коэффициенте увеличения объема при растворении экстрактивных
веществ", который служит мерой увеличения объема экстрагента при
растворении в нем единицы массы экстрактивных веществ.
Содержание в сырье действующих и экстрактивных веществ позволяет
выяснить количество получаемого экстракта и оценить степень экстрагируемости
сырья.
Поглощаемость сырьем экстрагента выявляет количество экстрагента,
поглощенного сырьем в период набухания и после него. Плотность, объемная масса
и насыпная масса сырья, пористость позволяют определить объем, занимаемый
сухим, набухшим сырьем, внешним соком, что выявляет необходимые соотношения
сырья и экстрагента, изменение объема внутреннего и внешнего сока при изменении
их объемов, измельченность сырья характеризует размер частиц и поверхность
экстрагирования, необходимую при установлении констант массопередачи. Кроме
факторов, определяемых технологическими свойствами, на процесс экстрагирования
влияют факторы, имеющие значение при процессе массопередачи внутри частиц сырья
и в свободном экстрагенте: гидродинамические условия процесса, тип экстрагента,
температура, присутствие воздуха на поверхности и внутри сырья и т.д. [17].
Важнейшим параметром является степень гидрофильности веществ,
извлекаемых из растений. Их можно разделить на растворимые в полярных
растворителях - гидрофильные вещества, растворимые в малополярных растворителях
- вещества смешанной природы и растворимые в неполярных растворителях -
гидрофобные [27].
Таким образом, каждый вид сырья требует особых условий проведения
процесса, необходимости планомерной работы по изучению технологических свойств
лекарственного сырья и разработке оптимальных условий его экстрагирования.
1.5.2 Капсулы
как лекарственная форма
Капсулы как лекарственная форма в последнее время получили
широкое распространение в фармакотерапии различных заболеваний благодаря своим
биофармацевтическим характеристикам
Капсулы представляют собой дозированную лекарственную форму,
состоящую из лекарственного средства, заключенного в оболочку. Капсулы
предназначены для приема внутрь, а также для ректального и вагинального
способов введения [39]. Оболочка желатиновая, твердая или мягкая, содержащая
одно или несколько действующих веществ, с добавлением или без вспомогательных
веществ.
Виды капсул:
Ø твердые;
Ø мягкие;
Ø микрокапсулы;
Ø желудочно-резистентные
капсулы (кишечнорастворимые);
Ø спансулы - капсулы,
содержащие пеллеты
Мягкие - цельные капсулы
различной формы (шарообразной, яйцевидной, продолговатой и др.) с жидкими или
пастообразными веществами.
Твердые - капсулы
цилиндрической формы с полусферическими концами, состоящие из двух частей,
которые входят одна в другую, не образуя зазоров [39].
Капсулы могут быть наполнены:
Ø порошками
<#"780983.files/image013.gif">
Рисунок 1 - Внешний вид черноголовки разрезной (Prunella laciniata)
2.1.1
Изучение анатомического строения надземной части черноголовки разрезной
Описание анатомо-гистологического строения стебля
Стебель на поперечном сечении имеет четырехгранную форму: от
резко выраженных граней в верхней части до сглажено-квадратной (почти округлой)
формы (рисунок 2,3).
Структурный состав включает:
покровная ткань;
кора;
центральный цилиндр.
Покровная ткань представлена эпидермой в надземной части
стебля. Однослойная эпидерма стебля состоит из округлых цилиндрических клеток,
несущие кроющие многоклеточные трихомы.
Кора. Уголковая колленхима залегает под эпидермой и
локализована в гранях стебля. Целлюлозные утолщения образуются в тангентальных
стенках пятиугольных клеток. Ниже залегает хлоренхима - ткань, состоящая из
тонкостенных, овальных клеток, периферия цитоплазмы которых заполнена
хлоропластами. Клетки запасающей паренхимы изодиаметричные, тонкостенные,
свободно лежащие друг относительно друга, с образованием межклетников.
Эндодерма заканчивает блок коры одним четко выраженным рядом живых,
тонкостенных клеток прямоугольной формы.
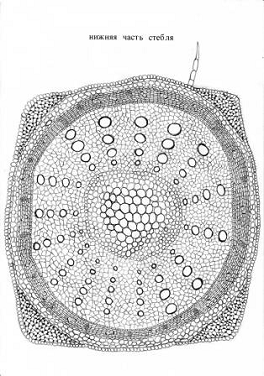

Рисунок 2 - Схема анатомо-гистологического строения нижней и
средней части стебля черноголовки разрезной
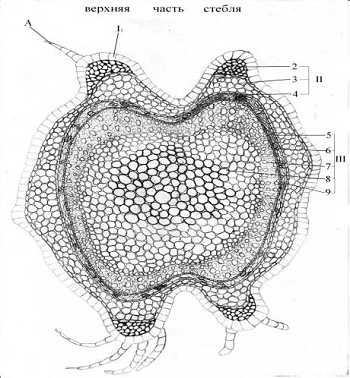
А - многоклеточный волосок; I - покровная ткань; II - кора, 2 - колленхима,
3-запасающая паренхима, 4 - эндодерма; III - центральный цилиндр, 5
- перицикли-ческая паренхима, 6 - флоэма, 7 - ксилема, 8 - сердцевинный луч,9 -
камбий.
Рисунок 3 - Схема анатомо-гистологического строения верхней
части стебля черноголовки разрезной
Центральный цилиндр. Перицикл представлен перициклической
паренхимой. Проводящая система непучкого типа представлена сифоностелью. Ее
мощность увеличивается в направлении от верхней к нижней за счет разрастания
ксилемной части. Она состоит из сосудов и лубяной паренхимы. Ксилема стебля
сильно лигнифицирована, на что указывает ее почти сплошное окрашивание в яркий
малиновый цвет, прерывающийся цепочкой однорядных узких сердцевинных лучей.
Флоэма, доли которой значительно уступают ксилеме, состоят из ситовидных трубок
с клетками-спутницами, лубяной паренхимы и лубяных волокон. Камбий составлен
одним рядом живых, тонкостенных клеток с крупным ядром, залегающим сплошным
цилиндром между проводящими тканями. Центральная часть стебля по всей длине
полностью состоит из клеток сердцевины, размеры которой центробежно
уменьшаются. В центре крупные клетки, а по направлению к стеле клетки
сердцевины становятся меньше.
Описание анатомо-гистологического строения листа
Цитологический состав эпидермы включает: основные клетки,
побочные клетки, замыкающие клетки устьиц, кроющие волоски.
Основные клетки верхней эпидермы больше клеток нижней, их
антиклинальные стенки менее извилистые, чем стенки клеток нижней эпидермы.
Верхняя эпидерма опушена слабо по сравнению с нижней (рисунок 4). Опушение
локализовано в области главной жилки с нижней стороны эпидермы листа.

- основные клетки листа, 2 - побочные клетки, 3 - замыкающие
клетки устьиц, 4 - устьичная щель, 5 - многоклеточный волосок.
Рисунок 4 - Схема анатомо-гистологического строения верхней
эпидермы листа черноголовки разрезной
Кроющие трихомы состоят из 4-7 клеток, и их больше
располагается на нижней эпидерме листа. Устьичный аппарат диацитного типа: две
побочные клетки примыкают к замыкающим клеткам устьиц, и их общая стенка
перпендикулярна устьичной щели. Устьиц на нижней стороне листа больше, чем на
верхней (рисунок 5).

- основные клетки листа, 2 - побочные клетки, 3 - замыкающие
клетки устьиц, 4 - устьичная щель, 5 - многоклеточный волосок, 6 - главная
жилка.
Рисунок 5 - Схема анатомо-гистологического строения нижней
эпидермы листа черноголовки разрезной
Поперечный срез листа
Дорзовентральный тип листа. На поперечном сечении имеет
округло-крылатую форму (рисунок 6).
Мы выделяем четыре блока тканей:
покровная ткань;
мезофилл;
арматурная система;
проводящая система.
Покровная ткань представлена однослойной эпидермой,
дифференцированной на верхней и нижней стороне листа. Клетки эпидермы живые,
тонкостенные. Клетки верхней эпидермы составлены более крупными основными клетками
и замыкающими клетками устьиц, довольно редко расположенными. Клетки нижней
эпидермы имеют меньшие размеры, и больше содержат замыкающих клеток устьиц.
Устьица образуют подустьичные полости. Нижняя эпидерма также имеет выросты -
кроющие трихомы. Волоски многоклеточные и состоят из клеток с разрушенными
протопластами и мощными стенками, что обеспечивает лучшую ксероморфную защиту
растений. По характеру расположения устьиц - лист амфистоматический, т.е.
устьица располагаются с обеих сторон.
Мезофилл дорзовентрального типа: под верхней эпидермой
размещается столбчатая (палисадная) паренхима, а под нижней - рыхлая (губчатая)
хлоренхима. Клетки столбчатой паренхимы представлены 3-4 рядами клеток,
более-менее плотно сомкнутых, по периферии цитоплазмы располагается ¾ всех имеющихся хлоропластов, что обеспечивает основной
фотосинтез. Рыхлая (губчатая) хлоренхима представлена 4-8 рядами округлых
клеток, более-менее рыхло расположенных друг относительно друга с образованием
систем межклетников, что позволяет выполнять основную их функцию - газообмен и
транспирацию, потому что фотосинтез здесь незначителен из-за малого количества
хлоропластов. Кроме того, губчатая хлоренхима обеспечивает отток первичных
ассимилянтов (крахмал), образовавшихся в столбчатой хлоренхиме - во флоэму.
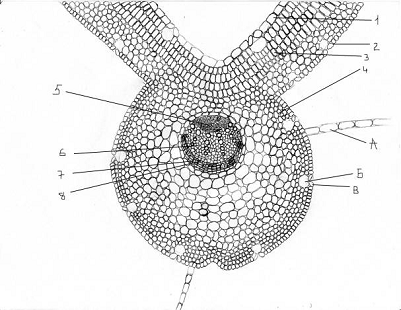
I - покровная ткань,1 - клетки нижней эпидермы, 2 - клетки
верхней эпидермы; II - мезофилл, 3 - столбчатая паренхима, 4 - губчатая паренхима; III - проводящая система, 5
- флоэма, 6 - камбий, 7 - ксилема; IV - арматурная система, 8 - склеренхима, А -
многоклеточный волосок, Б - подустьичная полость, В - замыкающие клетки устьиц.
Рисунок 6 - Схема анатомо-гистологического строения
поперечного среза листа черноголовки разрезной
Проводящая система представлена коллатеральными пучками, в
области жилки располагается самый крупный пучок, который мы и исследовали. В
пучке ксилема ориентирована к верхней эпидерме, а флоэма - к нижней. Ксилема
представлена объемом большим, чем флоэма. Пучок открытого типа, так как камбий
не полностью дифференцирован и представлен одним рядом живых тонкостенных
клеток с большим ядром. Ксилема состоит из сосудов и древесной паренхимы.
Сосуды сгруппированы в 6 расходящихся рядов, между ними располагаются клетки
древесной паренхимы. Сосуды на поперечном сечении округлой формы с мощной
вторичной стенкой, дающий реакцию на лигнин - малиновое окрашивание, клетки
полностью мертвые. Клетки древесной паренхимы мелкие, тонкостенные.
Флоэма состоит из ситовидных трубок с клетками-спутницами,
лубяной паренхимы. Лубяные волокна отсутствуют. Ситовидные трубки гранистые с
четко видимыми перфорациями - ситовидными полями, в группе по две-три
ситовидной трубки. Клетки лубяной паренхимы тонкостенные, живые.
Арматурная система представлена механической тканью -
склеренхимой. Склеренхима небольшим объемом - 5 рядов клеток, укрепляет со
стороны ксилемы. Клетки многогранные с мощной вторичной стенкой и полостью
внутри. Качественная реакция на лигнин - положительна (малиновое окрашивание),
клетки мертвые.
Описание анатомо-гистологического строения
черешка
Форма черешка на поперечном срезе - округло-крыловидная
(рисунок 7). Покровная ткань представлена однослойной эпидермой, состоящей из
основных клеток.
На поперечном сечении клетки прямоугольной формы, живые, тонкостенные.
За эпидермой расположена двухслойная хлоренхима, затем выполняющая паренхима -
основная ткань. Ее клетки живые, тонкостенные, округлые, многогранные,
центростремительно уменьшающиеся.
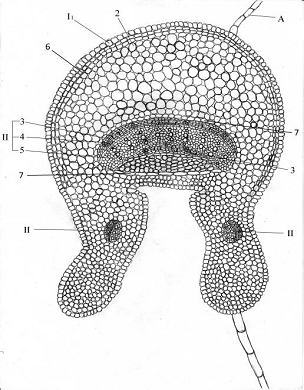
- покровная ткань (эпидерма); 2 - запасающая паренхима; II - биколлатеральный
проводящий пучок, 3 - флоэма, 4 - камбий, 5 - ксилема; 6 - хлоренхима; 7 -
клетки-обкладки пучка; А - многоклеточный волосок.
Рисунок 7 - Схема анатомо-гистологического строения черешка
черноголовки разрезной
В центре черешка располагается проводящий пучок -
биколлатерального типа, потому что с обеих сторон ксилемы располагается флоэма.
Объем ксилемы больше. Она состоит из древесной паренхимы и
сосудов.
Флоэма представлена ситовидными трубками с клетками-спутницами,
лубяной паренхимой и лубяными волокнами.
Камбий располагается со стороны внутренней флоэмы.
Имеется по одному пучку в крыльях черешка размером меньшим,
чем центральный пучок. Пучки коллатеральные. Пучки обрамляют клетки-обкладки.
Трихомы незначительные многоклеточные.
Описание анатомо-гистологического строения
чашечки
Цитологический состав включает: основные клетки, побочные
клетки, замыкающие клетки устьиц и кроющие волоски (рисунок 8). Волоски
представлены двумя видами: кроющие многоклеточные и простые одноклеточные.
Устьица диацитного типа. Клетки с извилистыми антиклинальными стенками.
Опушение чашечки сильное, за счет наличия большого количества волосков.

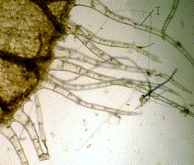
I - многоклеточный волосок; II - простой волосок; III - эпидерма.
Рисунок 8 - Схема анатомо-гистологического строения чашечки
черноголовки разрезной
2.2
Определение числовых показателей надземной части черноголовки разрезной
Определение влажности
Определение влажности исследуемых образцов сырья проводили по
методике ГФ XI [5].
Результаты определения влажности сырья черноголовки разрезной
представлены в таблице 1.
Таблица 1 - Результаты определения влажности надземной части
черноголовки разрезной
|
№
|
Навеска, г (до
высушивания)
|
Навеска, г
(после высушивания)
|
Найдено, %
|
Метрологические
характеристики
|
1 2,0728 1,9175 7,50 
 = 7,43
= 7,43

 = 0,0611
= 0,0611

 = 0,0250
= 0,0250
Δхср= 0,0641
|
e= 0,86
|
|
|
2
|
2,0448
|
1,8950
|
7,33
|
|
|
3
|
2,0148
|
1,8648
|
7,45
|
|
|
4
|
2,0545
|
1,2384
|
7,43
|
|
|
5
|
2,0101
|
1,8597
|
7,48
|
|
|
6
|
2,0281
|
1,8781
|
7,40
|
|
Из данных, представленных в таблице, видно, что влажность
сырья составила 7,43±0,0641% (e=0,86).
Определение общей золы
Определение золы проводили по методике ГФ XI [5].
Результаты статистической обработки определения общей золы
надземной части черноголовки разрезной приведены в таблице 2.
Таблица 2 - Результаты определения общей золы надземной части
черноголовки разрезной
|
№
|
Навеска, г
|
Навеска, г
(зола)
|
Найдено, %
|
Метрологические
характеристики
|
1 3,0082 0,1886 6,77 
 = 6,79
= 6,79

 = 0,1356
= 0,1356

 = 0,0553
= 0,0553
Δхср= 0,1422
e=2,10
|
|
|
2
|
3,0032
|
0,1822
|
6,55
|
|
|
3
|
3,0042
|
0, 1924
|
6,92
|
|
|
4
|
3,0040
|
0, 1912
|
6,88
|
|
|
5
|
3,0039
|
0, 1909
|
6,87
|
|
|
6
|
3,0025
|
0,1872
|
6,74
|
|
Из данных, приведенных в таблице, следует, что общая зола
сырья черноголовки разрезной составляет 6,79±0,1422% (e=2,10).
Определение золы, нерастворимой в 10%
хлористоводородной кислоте
Определение проводили по методике ГФ XI [5].
Результаты определения золы, нерастворимой в 10%
хлористоводородной кислоте, приведены в таблице 3.
Таблица 3 - Результаты определения золы, нерастворимой в 10%
хлористоводородной кислоте, надземной части черноголовки разрезной
|
№
|
Навеска, г
|
Навеска, г
(золы)
|
Результат, %
|
Метрологические
характеристики
|
1 3,0042 0,0043 0,145 
 = 0,14
= 0,14

 = 0,0052
= 0,0052

 = 0,0021
= 0,0021
Δхср=0,0050
|
e= 3,84
|
|
|
2
|
3,0032
|
0,0035
|
0,139
|
|
|
3
|
3,0082
|
0,0040
|
0,142
|
|
|
4
|
3,0040
|
0,0042
|
0,151
|
|
|
5
|
3,0025
|
0,0038
|
0,136
|
|
|
6
|
3,0039
|
0,0039
|
0,141
|
|
Таким образом, зола, нерастворимая в 10 % хлористоводородной
кислоте, сырья черноголовки разрезной составляет 0,14±0,0050% (e=3,84).
Определение экстрактивных веществ
Экстрактивные вещества в сырье черноголовки разрезной
определяли по ГФ XI [5]. Результаты определения экстрактивных веществ в сырье
черноголовки разрезной приведены в таблице 4.
Таблица 4 - Результаты определения экстрактивных веществ
надземной части черноголовки разрезной
|
№
|
Экстрагент
|
Навеска, г
|
Найдено, %
|
Метрологические
характеристики
|
1 вода очищенная 1,0077 28,3 
 = 28,42
= 28,42

 = 0,3764
= 0,3764

 = 0,1537
= 0,1537
Δхср= 0,3949
|
e= 1,39
|
|
|
2
|
|
1,0081
|
28,5
|
|
|
3
|
|
1,0096
|
29,1
|
|
|
4
|
|
1,0079
|
28,4
|
|
|
5
|
|
1,0064
|
28,2
|
|
|
6
|
|
1,0051
|
28,0
|
|
1 спирт этиловый 40% 1,0926 28,7 
 = 28,99
= 28,99

 = 0,3711
= 0,3711

 = 0,1515
= 0,1515
Δхср= 0,3894
|
e= 1,34
|
|
|
2
|
|
1,0954
|
29,5
|
|
|
3
|
|
1,0934
|
28,9
|
|
|
4
|
|
1,0891
|
29,3
|
|
|
5
|
|
1,105
|
29,01
|
|
|
6
|
|
1,0914
|
28,5
|
|
1 спирт этиловый 70% 1,0130 26,5 
 = 26,62
= 26,62

 = 0,3189
= 0,3189

 = 0,1302
= 0,1302
Δхср= 0,3345
|
e= 1,26
|
|
|
2
|
|
1,0115
|
26,3
|
|
|
3
|
|
1,0146
|
26,6
|
|
|
4
|
|
1,0139
|
26,4
|
|
|
5
|
|
1,0151
|
26,7
|
|
|
6
|
|
1,0192
|
27,2
|
|
1 спирт этиловый 95% 1,0499 7,98 
 = 7,81
= 7,81

 = 0, 2012
= 0, 2012

 = 0,0821
= 0,0821
Δхср= 0,2111
|
e= 2,7
|
|
1,0506
|
8,01
|
|
|
3
|
|
1,0464
|
7,54
|
|
|
4
|
|
1,0472
|
7,62
|
|
|
5
|
|
1,0482
|
7,74
|
|
|
6
|
|
1,0492
|
7,95
|
|
Из данных, приведенных в таблице, видно, что наибольший выход
экстрактивных веществ в образцах надземной части черноголовки разрезной
наблюдается при использовании спирта этилового 40% (28,99±0,3894%) (e=1,34).
2.3
Фитохимический анализ надземной части черноголовки разрезной
2.3.1 Анализ
качественного состава фенольных соединений
Флавоноиды
Качественный состав флавоноидов в траве черноголовки
разрезной мы исследовали, используя спиртовое извлечение (спирт этиловый 70%).
Присутствие флавоноидов определяли по качественным реакциям [28]:
цианидиновая проба (по Chinodi) - при прибавлении к
извлечению кислоты хлористоводородной в присутствии металлического магния
наблюдали оранжевое окрашивание;
реакция с раствором свинца ацетата: при прибавлении к
извлечению раствора свинца ацетата 2% выделяется жёлтый осадок;
реакция с раствором сурьмы хлорида: при прибавлении к
извлечению раствора сурьмы хлорида наблюдали жёлтое окрашивание;
реакция с раствором аммиака: при прибавлении к извлечению
раствора аммиака наблюдали жёлтое окрашивание, при нагревании переходящее в
оранжевое.
В результате анализа нами подтверждено наличие в извлечении
флавоноидов.
Хроматографический анализ фенольных соединений
Для обнаружения фенольных соединений использовали извлечение,
полученное путем экстракции спиртом этиловым 70%, которое подвергали
хроматографическому анализу с использование бумажной хроматограммы марки Merck в системе БУВ 4: 1: 2 (в
этой системе наблюдалось наилучшее разделение). Хроматограмму просматривали в
УФ свете до, и после обработки парами аммония гидроксида. Обнаружено 5 веществ
в виде пятен желтой окраски и 2 вещества голубой и зеленой флуоресценцией в УФ
свете. Результаты определения представлены в таблице 5 и в виде рисунка 9.

И - спиртовое извлечение травы черноголовки разрезной;
Р - стандартный образец рутина;
К - стандартный образец кверцетина;
КК - стандартный образец кофейной кислоты.
Рисунок 9 - Хроматограмма фенольных соединений травы
черноголовки разрезной (система БУВ 4: 1: 2)
В результате хроматографического анализа в траве черноголовки
разрезной были идентифицированы следующие соединения: рутин, кверцетин и
кофейная кислота.
Таблица 5 - Результаты качественной бумажной хроматографии
фенольных соединений, идентифицированных в траве черноголовки разрезной
|
№
|
Значение   Видимый светОкраска NH3Флюоресценция в УФ-светеИдентифицированное соединения Видимый светОкраска NH3Флюоресценция в УФ-светеИдентифицированное соединения
|
|
|
|
|
|
|
|
|
без обработки
|
обработка +NH3
|
|
|
1
|
0,35
|
светло-бурое
|
ярко-желтое
|
светло-синее
|
сине-зеленое
|
Не идентифицировано
|
|
2
|
0,46
|
желто-зеленое
|
желтое
|
ярко-зеленое
свечение
|
зеленое
свечение
|
Не
идентифицировано
|
|
3
|
0,55
|
светло-желтое
|
светло-желтое
|
ярко-желтое
|
желто-зеленое
|
Рутин
|
|
4
|
0,61
|
светло-желтое
|
светло-желтое
|
желтое
|
желтое
|
Не
идентифицировано
|
|
5
|
0,70
|
желто-зеленое
|
ярко-желтое
|
серо-зеленое
|
желто-зеленое
|
Не
идентифицировано
|
|
6
|
0,77
|
светло-желтое
|
светло-желтое
|
желтое
|
желтое
|
Кверцетин
|
|
7
|
0,88
|
светло-желтое
|
желтое
|
голубое
свечение
|
светло-голубое
свечение
|
Кофейная
кислота
|
Дубильные вещества
Как известно, к растительным полифенольным соединениям
относят также дубильные вещества. По данным литературы известно, что для
проведения качественных реакций на дубильные вещества необходимо получение
водного извлечения из сырья [21].
Для идентификации дубильных веществ из растительного
сырья готовили водное извлечение. Для этого 1,0 г измельченного растительного
сырья заливали 100 мл воды. Нагревали на водяной бане 20-30 мин, полученное
извлечение фильтровали и использовали для проведения качественных реакций:
к 2-3 мл извлечения добавляли по каплям
раствор желатина 1%. Наблюдалось появление мути, исчезающей при добавлении
избытка желатина;
к 2-3 мл извлечения прибавляли несколько
капель раствора хинина дихлорида 1%. Появлялся аморфный осадок;
при добавлении к 2-3 мл извлечения 4-5
капель раствора железоаммониевых квасцов появлялось черно-зеленое окрашивание,
что свидетельствовало о наличии конденсированных природе веществ;
к 10 мл извлечения прибавляли 5 мл смеси
(2 мл кислоты хлористоводородной, разведенной в соотношении 1: 1, и 3 мл
раствора формальдегида 40%). Полученную смесь кипятили 30 мин в колбе с
обратным холодильником. При этом выпадал осадок, конденсированных дубильных
веществ. Осадок отфильтровывали. К 2 мл фильтрата добавляли 10 капель раствора
железоаммониевых квасцов 1% и около 0,2 г кристаллического свинца ацетата.
Отсутствие в нейтральной среде синего или фиолетового окрашивания,
свидетельствовало об отсутствии гидролизуемых дубильных веществ;
к 2-3 мл извлечения прибавляли по каплям
бромную воду (5 г брома в 1 л воды) до тех пор, пока от одной капли бромной
воды раствор не приобретет желтую окраску. Образовавшийся осадок,
свидетельствовал о наличии конденсированных дубильных веществ;
к 1 мл извлечения добавляли 2 мл кислоты
уксусной 10% и 1 мл раствора свинца ацетата 10%. При прибавлении 5 капель
раствора железоаммониевых квасцов 1% и 0,1 г свинца ацетата фильтрат
окрашивался в черно-зеленый цвет, что свидетельствовало о наличии
конденсированных дубильных веществ.
Таким образом, в траве черноголовки
разрезной были идентифицированы дубильные вещества конденсированной группы.
2.3.2 Кислота
аскорбиновая
Для определения кислоты аскорбиновой в траве черноголовки
разрезной использовали БХ. Навеску сырья (0,5 г) заливали 20 мл воды очищенной
и оставляли на 24 часа. Полученное извлечение фильтровали и хроматографировали
на бумаге в системе растворителей спирт н-бутиловый - кислота уксусная - вода
(4: 1: 2). Детектирование пятен веществ на хроматограмме осуществляли раствором
2,6-дихлорфенолиндофенолята натрия 0,04% в воде. Кислота аскорбиновая
обнаруживалась в виде белого пятна на розовом фоне (Rf= 0,37) и
сравнивалась с показателем Rf значения образца свидетеля (рисунок 10).

Условные обозначения:
Водное извлечение (1: 40) из травы;
"свидетель" кислоты аскорбиновой.
Рисунок 10 - Бумажная хроматограмма водного извлечения из
травы черноголовки разрезной
Таким образом, в траве черноголовки разрезной обнаружена
кислота аскорбиновая.
2.3.3 Макро -
и микроэлементы
Содержание макро - и микроэлементного состава травы
черноголовки разрезной определяли спектральным методом на базе испытательной
лаборатории при ФГУП "Кавказгеолсъемка" по методике предприятия МП 4С
- полуколичественный метод анализа минерального сырья из кратера угольного
электрода (50 элементов). Для анализа использовали спектрограф ДФС-8-1.
Полученные данные представлены в таблице 6, откуда следует, что в состав травы
черноголовки разрезной входят макроэлементы: калий, натрий, кальций, магний,
железо, кремний, фосфор. Микроэлементы: стронций, марганец, титан, молибден,
цинк, медь [31].
Элементы, входящие в состав травы черноголовки разрезной,
можно условно разделить на следующие группы:
. Эссенциальные - К, Fe, Ca, Mg, Si, Mn, Zn, Na, P, Cu, Mo, Zr, Co;
. Условно эссенциальные - Ti, Ba, Ni, V;
. Токсичные - Al, Sr, Pb, Be;
. Потенциально-токсичные - Ag, Ti, Ga.
Таблица 6 - Макро- и микроэлементный состав травы
черноголовки разрезной.
|
№
|
Название
элемента
|
Содержание, %
|
№
|
Название
элемента
|
Содержание, %
|
|
1
|
Калий
|
2,037
|
14
|
Цирконий
|
0,000068
|
|
2
|
Кальций
|
1,358
|
15
|
Бериллий
|
0,0000034
|
|
3
|
Кремний
|
0, 2037
|
16
|
Цинк
|
0,001
|
|
4
|
Магний
|
0, 2037
|
17
|
Медь
|
0,0005
|
|
5
|
Фосфор
|
0,136
|
18
|
Ванадий
|
0,000041
|
|
6
|
Железо
|
0,02
|
19
|
Хром
|
0,000068
|
|
7
|
Алюминий
|
0,068
|
20
|
Бор
|
0,001
|
|
8
|
Натрий
|
0,068
|
21
|
Литий
|
0,000068
|
|
9
|
Титан
|
0,002
|
22
|
Стронций
|
0,0041
|
|
10
|
Барий
|
0,0136
|
23
|
Галлий
|
0,0000136
|
|
11
|
Марганец
|
0,0034
|
24
|
Серебро
|
0,00000068
|
|
12
|
Кобальт
|
0,00002
|
25
|
Свинец
|
0,000068
|
|
13
|
Молибден
|
0,0002
|
26
|
Никель
|
0,000068
|
Таким образом, в траве черноголовки разрезной установлено
наличие 26 элементов, основными по содержанию из которых являются калий,
кальций, кремний, магний, фосфор и железо.
2.4
Количественное определение биологически активных веществ надземной части
черноголовки разрезной
2.4.1
Дубильные вещества
Количественное определение проводили по
методике ГФ XI [5].
Около 2,0 г (точная навеска) измельченного
сырья, просеянного сквозь сито с диаметром отверстий 3 мм, помещали в
коническую колбу вместимостью 500 мл, заливали 250 мл нагретой до кипения воды
и кипятили с обратным холодильником на электрической плитке с закрытой спиралью
в течение 30 мин при периодическом перемешивании. Жидкость охлаждали до
комнатной температуры и процеживали около 100 мл в коническую колбу
вместимостью 200-250 мл через вату так, чтобы частицы сырья не попали в колбу.
Затем отбирали пипеткой 25 мл полученного извлечения в другую коническую колбу
вместимостью 750 мл, прибавляли 500 мл воды, 25 мл раствора индигосульфокислоты
и титровали при постоянном перемешивании раствором калия перманганата (0,02 М)
до золотисто-желтого окрашивания.
Параллельно проводили контрольный опыт.
мл раствора калия перманганата (0,02 М)
соответствует 0,004157 г дубильных веществ в пересчете на танин.
Содержание дубильных веществ (Х) в
процентах в пересчете на абсолютно сухое сырье вычисляли по формуле 6:
 , (6)
, (6)
где V - объем раствора калия
перманганата (0,02 М), израсходованного на титрование извлечения, в
миллилитрах;
V1 - объем раствора калия
перманганата (0,02 М), израсходованного на титрование в контрольном опыте, в
миллилитрах;
,004157 - количество дубильных веществ,
соответствующее 1 мл раствора калия перманганата (0,02 М) в пересчете на танин,
в граммах;
m - масса сырья, в
граммах;
W - потеря в массе при
высушивании сырья, в процентах;
- общий объем извлечения, в миллилитрах;
- объем извлечения, взятого для
титрования, в миллилитрах.
Полученные результаты
приведены в таблице 7.
Таблица 7 - Количественное содержание дубильных веществ в
траве черноголовки разрезной
|
№
|
Навеска, г
|
Найдено, %
|
Метрологические
характеристики
|
1 2,0660 8,72 
 =8,71
=8,71

 = 0,1009
= 0,1009

 =0,0412
=0,0412
Δхср=0,1059
|
e=1,22
|
|
|
2
|
2,0125
|
8,70
|
|
|
3
|
1,9820
|
8,83
|
|
|
4
|
2,0540
|
8,53
|
|
|
5
|
2,0134
|
8,69
|
|
|
6
|
1,9967
|
8,77
|
|
Результаты анализа показывают, что содержание дубильных
веществ в траве черноголовки разрезной в пересчёте на танин составляет
8,71±0,1059% (e=1,22).
2.4.2 Кислота
аскорбиновая
При определении количественного содержания
кислоты аскорбиновой использовали методику, описанную в ГФ ХI [5].
Результаты количественного определения аскорбиновой кислоты в
траве черноголовки разрезной представлены в таблице 8.
Таблица 8 - Результаты количественного определения
аскорбиновой кислоты в траве черноголовки разрезной
|
№
|
Навеска, г
|
Найдено, %
|
Метрологические
характеристики
|
1 20,0024 0,0656 
 =0,06
=0,06

 = 0,0022
= 0,0022

 =0,0009
=0,0009
Δхср=0,0023
|
e=3,68
|
|
|
2
|
20,0124
|
0,0624
|
|
|
3
|
19,984
|
0,0648
|
|
|
4
|
19,952
|
0,0594
|
|
|
5
|
20,0143
|
0,0638
|
|
|
6
|
20,0064
|
0,0643
|
|
Таким образом, количество кислоты аскорбиновой в траве
черноголовки разрезной составляет 0,06±0,0023% (e=3,68).
2.4.3
Флавоноиды
При разработке методики количественного определения
флавоноидов в траве черноголовки разрезной мы опирались на тот факт, что в
последние годы в анализе растительного сырья, содержащего флавоноиды,
наибольшее распространение получили спектрофотометрические методики, основанные
на определении продуктов реакции комплексообразования с алюминия хлоридом [30].
Методики позволяют значительно повысить избирательность определения, проводить
анализ растительного сырья без дополнительных трудоемких стадий очистки, а
также в присутствии продуктов деструкции. С этой целью нами была изучена
возможность использования метода дифференциальной спектрофотометрии для
определения флавоноидов в траве черноголовки разрезной.
Изучение УФ спектров извлечений из надземной части
черноголовки разрезной показало, что максимумы светопоглошения флавоноидов не
проявляются вследствие наложения более интенсивных полос поглощения
сопутствующих веществ (λmax=325 нм). Следовательно,
использование для количественного определения флавоноидов в надземной части
черноголовки разрезной прямой спектрофотометрии оказалось нецелесообразным.
Изучение данных литературы показало, что при использовании дифференциальной
спектрофотометрии, основанной на реакции комплексообразования с алюминия
хлоридом, происходит батохромный сдвиг полосы поглощения флавоноидов от 325 -
350 до 390 - 410 нм [30].
Применение в качестве контроля качества испытуемого раствора
без реактива позволяет исключить влияние окрашенных сопутствующих веществ,
выделить полосу поглощения комплексов флавоноидов с алюминия хлоридом,
значительно повысить избирательность определения.
Дифференциальные спектры различных извлечений из надземной
части черноголовки разрезной оказались аналогичными по положению максимума
дифференциальному спектру рутина (рисунок 11,12). Поэтому сумму флавоноидов мы
посчитали возможным определять в пересчете на РСО рутина (λmax=407±2 нм). Таким образом, проведенные предварительные
исследования показали возможность использования дифференциальной
спектрофотометрии для количественного определения флавоноидов в траве
черноголовки разрезной.
Методика определения флавоноидов в траве. Аналитическую пробу
сырья измельчали до размера частиц, проходящих сквозь сито с отверстиями
диаметром 1мм. Около 1 г (точная навеска) измельченного сырья помещали в колбу
со шлифом вместимостью 150 мл, прибавляли 50 мл спирта этилового 70 %. Колбу
присоединяли к обратному холодильнику и нагревали на кипящей водяной бане в
течение 1,5 часов, периодически встряхивая для смывания частиц сырья со стенок
колбы. Горячее извлечение фильтровали через бумажный фильтр в мерную колбу
вместимостью 50 мл так, чтобы частицы сырья, не попадали на фильтр.
После охлаждения объем извлечения доводили спиртом этиловым
70 % до метки и перемешивали (раствор А).
В мерную колбу вместимостью 25 мл помещали 5 мл раствора А,
0,5 мл кислоты уксусной 33%, 2 мл раствора алюминия хлорида 2% и доводили объем
раствора спиртом этиловым 70 % до метки (раствор Б). Через 45 минут измеряли
оптическую плотность раствора Б на спектрофотометре при длине волны 410±2 нм в
кювете с толщиной рабочего слоя 10 мм.
Содержание суммы флавоноидов в пересчете на рутин и абсолютно
сухое сырье в процентах (Х) вычисляют по формуле 7:
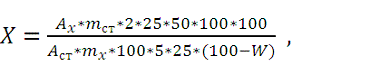
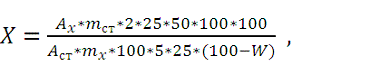 (7)
(7)
где Ах - оптическая плотность испытуемого раствора;
Асm -
оптическая плотность раствора стандартного образца;
mсm - масса
стандартного образца рутина, г;
m - масса навески сырья, г;
W - потеря в массе при высушивании сырья, %.
В качестве раствора сравнения использовали раствор, состоящий из 5
мл раствора А, 0,5 мл раствора кислоты уксусной 33% и доведенный спиртом
этиловым 70 % до метки в мерной колбе вместимостью 25 мл. Параллельно измеряли
оптическую плотность раствора РСО рутина (рисунок 11).
Приготовление раствора РСО рутина.
Около 0,05 г (точная навеска) (ФС 42-2508-96), высушенного при
температуре 132-135°С в течение 2-х часов, помещали в мерную колбу вместимостью
100 мл и растворяли в 70 мл спирта этилового 95%, доводили до метки этим же
растворителем (раствор РСО рутина).
мл раствора РСО рутина помещали в мерную колбу вместимостью 25 мл,
прибавляли 10 мл спирта этилового 70 %, 0,5 мл раствора кислоты уксусной 33% и
2 мл раствора алюминия хлорида 2% и доводили объем раствора спиртом этиловым 70
% до метки, перемешивали. Через 45 минут измеряли оптическую плотность
полученного раствора относительно раствора сравнения, приготовленного по
методике: 2 мл раствора РСО рутина помещали в мерную колбу вместимостью 25 мл,
прибавляли 10 мл спирта этилового 70 %, 0,5 мл раствора кислоты уксусной 33%,
доводили объем раствора спиртом этиловым 70 % до метки и перемешивали.
Раствор устойчив в течение 30 дней при хранении в темном месте в
хорошо укупоренной склянке.
Приготовление спиртового раствора алюминия хлорида 2%.
2,0 г алюминия хлорида безводного или 3,6 г алюминия хлорида
6-водного (ГОСТ 3759-75, "ч. д. а. "), растворяют при нагревании на
водяной бане в 80,0 мл спирта этилового 95% в мерной колбе вместимостью 100 мл,
охлаждают, доводят объем раствора спиртом этиловым 95% до метки и фильтруют.
Раствор годен в течение 3-х месяцев [31].

Рисунок 11 - Дифференциальный спектр поглощения РСО рутина

Рисунок 12 - Дифференциальный спектр поглощения суммы флавоноидов
спиртового извлечения травы черноголовки разрезной
Статистически обработанные результаты определения суммы
флавоноидов в шести сериях травы черноголовки разрезной представлены в таблице
9.
Таблица 9 - Содержание флавоноидов в траве черноголовки
разрезной
|
№
|
Навеска, г
|
Найдено, %
|
Метрологические
характеристики
|
1 1,0046 0,72 
 = 0,73
= 0,73

 = 0,0251
= 0,0251

 = 0,0102
= 0,0102
Δхср= 0,0263
|
e= 3,63
|
|
|
2
|
1,0054
|
0,75
|
|
|
3
|
0,9994
|
0,70
|
|
|
4
|
1,0086
|
0,76
|
|
|
5
|
0,9992
|
0,70
|
|
|
6
|
1,0035
|
0,72
|
|
Результаты анализа показывают, что содержание флавоноидов в
траве черноголовки разрезной в пересчёте на рутин составляет 0,73±0,0263% (e=3,63).
Выводы по
главе
1. Проведено фармакогностическое исследование травы
черноголовки разрезной, позволившее установить основные морфолого-анатомические
(диагностические) признаки сырья.
2. Определены общие числовые показатели сырья травы
черноголовки разрезной: влажность (7,43±0,0641%), общая зола (6,79±0,1422%),
зола, нерастворимая в 10% HCI (0,14±0,0050%), экстрактивные вещества - вода
очищенная (28,42±0,3949%), спирт этиловый 40% (28,99±0,3894%), спирт этиловый
70% (26,62±0,3345%), спирт этиловый 95% (7,81±0,2111%).
. С помощью БХ в траве черноголовки разрезной
идентифицированы рутин, кверцетин и кофейная кислота.
. Методом дифференциальной спектофотометрии в траве
черноголовки разрезной определен количественный состав флавоноидов
(0,73±0,0263%).
. С помощью характерных качественных реакций
установлено наличие в траве черноголовки разрезной дубильных веществ
конденсированной природы. Определено суммарное количественное содержание
дубильных веществ в пересчете на танин, составившее 8,71±0,1059%.
. В траве черноголовки разрезной установлено
содержание аскорбиновой кислоты - 0,06±0,0023%.
. Определен минеральный состав в траве черноголовки
разрезной и установлено наличие 26 элементов, основными по содержанию из
которых являются калий, кальций, кремний, магний, фосфор и железо.
Глава 3.
Разработка состава и технологии капсул на основе сухого экстракта из
черноголовки разрезной
3.1
Разработка технологии фитоэкстракта из надземной части черноголовки разрезной
Для получения продукта, содержащего комплекс биологически активных
веществ, нами была предложена технология получения фитоэкстракта. Экстракцию
проводили методом бисмацерации. В качестве экстрагента использовали спирт
этиловый 70%. Соотношение сырья и экстрагента 1: 5, при 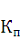
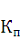 , определенным нами и равным 3,5. Процесс экстрагирования
проводили в два этапа. Первый этап - 3 дня, заливали измельченное сырье спиртом
этиловым 70% до зеркала, по окончании времени экстракции, полученное извлечение
1 сливали в приемник 1. Второй этап - 2 дня, оставшееся сырье заливали спиртом
этиловым 70%, после окончания экстракции сливали извлечение 2 в приемник 2 и
объединили с извлечением 1. Извлечение выпаривали, сушили в сушильном шкафу при
температуре 40°С до содержания влаги не более 5%. При разработке технологии
сухого экстракта установлено, что из 100 г сухого сырья получается 19,5 г
сухого экстракта, что составляет выход 73,3%.
, определенным нами и равным 3,5. Процесс экстрагирования
проводили в два этапа. Первый этап - 3 дня, заливали измельченное сырье спиртом
этиловым 70% до зеркала, по окончании времени экстракции, полученное извлечение
1 сливали в приемник 1. Второй этап - 2 дня, оставшееся сырье заливали спиртом
этиловым 70%, после окончания экстракции сливали извлечение 2 в приемник 2 и
объединили с извлечением 1. Извлечение выпаривали, сушили в сушильном шкафу при
температуре 40°С до содержания влаги не более 5%. При разработке технологии
сухого экстракта установлено, что из 100 г сухого сырья получается 19,5 г
сухого экстракта, что составляет выход 73,3%.
3.2 Выбор
вспомогательных веществ
При разработке лекарственной формы на основе сухого
экстракта, содержащие флавоноиды, идентифицированных нами в надземной части
черноголовки разрезной, мы ориентировались на физико-химические свойства
веществ, а также на удобство в применении.
В качестве вспомогательных веществ нами были выбраны:
лактоза, аэросил, сахароза и крахмал.
Для увлажнения гранулируемой массы использовали спирт
этиловый 40%.
Композиции вспомогательных веществ подбирали исходя из
пластичности гранулируемой массы, времени высушивания. Были получены гранулы
следующих составов (таблица 10).
Таблица 10 - Состав гранул с сухим экстрактом надземной части
черноголовки разрезной
|
Состав 1
|
Состав 2
|
Состав 3
|
|
сухой экстракт
|
0,1
|
сухой экстракт
|
0,1
|
сухой экстракт
|
0,1
|
|
Лактоза
|
0,1
|
крахмал
|
0,2
|
крахмал
|
0,1
|
|
аэросил
|
0,05
|
аэросил
|
0,05
|
сахароза
|
0,2
|
|
средняя масса
|
0,25
|
0,35
|
средняя масса
|
0,4
|
В результате нами был выбран для получения гранул состав 2.
Состав 1 и состав 3 в процессе хранения спекался и портился.
3.3 Получение
лекарственной формы - капсул
.3.1
Получение гранул из сухого экстракта надземной части черноголовки разрезной
Гранулы готовили следующим образом: отвешенные количества
порошков измельчали в ступке, смешивали порошки с учетом их физико-химических
свойств, увлажняя спиртом этиловым 40% до получения пластичной массы.
Полученную массу протирали через гранулятор с диаметром отверстий 2 мм.
Первичные гранулы подсушивали на воздухе в течение 20 минут.
Затем высушивали в сушильном шкафу при температуре не выше 40°С в течение 30
минут.
3.3.2
Технологические характеристики сыпучих капсулируемых материалов
В технологическом процессе производства капсул имеют значение
такие технологические характеристики сыпучих капсулируемых материалов, как
насыпная плотность, сыпучесть, фракционный состав, поэтому проведены
исследования по определению этих показателей для капсулируемой смеси со
вспомогательными веществами [26, 27].
Из всего многообразия капсул, используемых при производстве
готовых лекарственных средств, для исследуемой капсулируемой смеси нами выбраны
твёрдые желатиновые капсулы с крышечками, которые можно использовать как для
аптечного, так и для заводского производства лекарственных средств [15].
Фракционный состав капсулируемого материала
Фракционный (гранулометрический) состав капсулируемого
материала имеет большое значение, как с биофармацевтической точки зрения, так и
при выборе способов заполнения твёрдых желатиновых капсул с крышечками.
Фракционный состав представляет собой распределение частиц данного материала по
крупности.
Этот показатель, наряду с сыпучестью дозируемого материала учитывается
при выборе автоматов со шнековыми, тарелочными, роторными, поршневыми,
вакуумными или вибрационными дозаторами, поскольку фасовка в данном случае
осуществляется по объёму.
Для проведения работы по определению фракционного состава,
подготовленного для капсулирования порошка надземной части черноголовки
разрезной использовали ситовой анализ. Для этого 50 г исследуемого порошка
просеивали через набор из 4 последовательно собранных сит с диаметром отверстий
0,472; 0,25; 0,15 и 0,12 мм. Навеску материала помещали на самое крупное
(верхнее) сито и весь комплект встряхивали вручную в течение 5 минут,
контролируя время по секундомеру. Затем сита снимали по очереди одно за другим,
и каждое сито встряхивали отдельно над листом чистой бумаги.
Просеивание считали законченным, если количество материала,
проходящего сквозь сито при дополнительном встряхивании в
течение одной минуты, составляли по массе менее 1% материала, оставшегося на
сите. Отсев добавляли на верхнее сито оставшегося комплекта сит. Остаток
материала на сите взвешивали [27].
Результаты ситового анализа приведены в таблице 11.
В таблице знаком " + " обозначена фракция,
оставшаяся на данном сите, а знаком " - " - прошедшая через сито.
Таблица 11 - Фракционный состав капсулированного порошка
|
№
|
Фракционный
состав
|
|
1
|
2
|
3
|
4
|
5
|
|
+0,5
|
-0,5 +0,25
|
-0,25 +0,15
|
-0,15 +0,12
|
-0,12
|
|
г
|
%
|
г
|
%
|
г
|
%
|
г
|
%
|
г
|
%
|
|
1
|
0,10
|
0, 20
|
0,78
|
1,56
|
0,90
|
1,80
|
47,05
|
95,10
|
0,67
|
1,33
|
|
2
|
0,13
|
0,26
|
0,65
|
1,30
|
0,95
|
1,90
|
47,07
|
95,14
|
0,69
|
1,36
|
|
3
|
0,17
|
0,34
|
0,60
|
1, 20
|
0,92
|
1,84
|
47,5
|
95,0
|
0,84
|
1,67
|
|
среднее
|
0,27
|
|
1,35
|
|
1,85
|
|
95,08
|
|
1,47
|
Из данных таблицы следует, что фракция
порошков от (+0,12) до (-0,15) составляет 95,08% капсулируемого материала, что
обеспечивает высокую степень однородности в отношении гранулометрического
состава.
Пылевидная фракция (-0,12) составляет
1,45% в общем объёме капсулируемого материала, что, по нашему мнению, не окажет
существенного влияния на реализацию технологического процесса капсулирования.
Насыпная плотность
капсулируемого материала
Насыпная плотность зависит от фракционного
состава, влажности порошка, других показателей и не является постоянной даже
при хранении лекарственных веществ в условиях, определённых соответствующей НД.
Это объясняется тем, что под влиянием вибрации тары и упаковок, фундамента зданий
и т.п. происходит изменение насыпной плотности [26].
Насыпная плотность определяется как масса
единицы объёма свободно насыпаемого порошка. Насыпная плотность зависит от
формы, размера, плотности частиц порошка, их влажности. По значению насыпной
плотности можно прогнозировать размер (объём) твёрдых капсул с крышечкой, то
есть их номер, необходимый для заполнения лечебной дозой лекарственного
вещества.
Перед измерением насыпной плотности
определяли влажность капсулируемой смеси по методике ГФ XI [5].
При этом установлено, что влажность
исследуемого материала составляет 3,2%.
Максимальную насыпную плотность порошка
измеряли на приборе 545Р-АК - 3.
Для этого 5 г исследуемого порошка в смеси
с лактозой, обеспечивающей оптимальную влажность капсулированного материала,
взвешенных с точностью до 0,001 г, во избежание уплотнения осторожно небольшими
порциями засыпали в измерительный прибор цилиндра. Регулировочным винтом
устанавливали амплитуду колебаний цилиндра, равную 35 мм.
После включения прибора следили за
отметкой уровня порошка в цилиндре. Когда уровень порошка становится постоянным
(через 7 минут), прибор выключали.
Насыпную плотность рассчитывали по формуле
8:

 , (8)
, (8)
где рн - насыпная плотность, кг/м3;- объём
порошка в цилиндре после утряски, м3;- масса сыпучего материала, кг.
Для определения насыпной плотности проводили 6 определений, данные
которых приведены в таблице 12.
Таблица 12 - Результаты определения насыпной плотности
|
№ фракции
|
масса порошка,
г
|
объем порошка,   насыпная плотность, г/см3 насыпная плотность, г/см3
|
|
|
1
|
5
|
4, 20
|
1, 19
|
|
2
|
5
|
4,30
|
1,16
|
|
3
|
5
|
4,25
|
1,18
|
|
4
|
5
|
4,35
|
1,14
|
|
5
|
5
|
4,40
|
1,12
|
|
6
|
5
|
4,45
|
1,12
|
|
Среднее
|
1,15
|
Из данных таблицы следует, что
капсулируемая смесь относится к легким сыпучим материалам, плотность которых
рн<600 кг/м3и равна 1,15*10~2 кг/м3.
Учитывая полученные результаты можно
рассчитать прогнозируемый номер используемых твердых желатиновых капсул с
крышечками. Принимая в расчет плотность капсулируемого материала, равную
1,15-10~2 кг/м3, массу порошкообразной смеси, рассчитанную на одну
разовую дозу, равную 0,35 г, а также таблицу номеров капсул, приведенную в ГФ
XI, находим, что оптимальным номером в нашем случае является фармакопейный №1,
средняя вместимость которого равна 0,5 мл.
Таким образом, для заполнения смеси нами
использовались твердые желатиновые капсулы с крышечкой №1.
Сыпучесть капсулируемого
материала
Сыпучесть является важной характеристикой,
отражающей способность сыпучего материала образовывать дискретно - непрерывный
устойчивый поток. Её учитывают при выборе всех приборов, устройств и агрегатов,
связанных с переработкой, хранением и транспортированием сыпучих материалов.
Сыпучесть ещё иногда называют текучестью, отдавая дань аналогии между
некоторыми свойствами жидкости и сыпучего материала [27].
Сыпучесть зависит от многочисленных
факторов, характеризующих сыпучий материал: гранулометрического состава,
насыпной плотности, внутреннего (взаимного) и внешнего трения частиц, удельной
поверхности, формы, удельного веса частиц, влажности, температуры и давления,
количества пылевидных фракций в общем объёме сыпучего материала.
Оценку сыпучести проводят по следующим
показателям: углу естественного откоса, скорости течения порошка, коэффициента
сыпучести, коэффициента неоднородности и др.
Углом естественного откоса называют угол
между образующей конуса из сыпучего материала и горизонтальной плоскостью. Он
изменяется в широких пределах - от 25 до 35° для хорошо сыпучих материалов, до
60 - 70° для связных материалов. Отсюда, чем меньше угол естественного откоса,
тем выше сыпучесть.
Сыпучесть материала определяют на приборе
ВП-12А. В приборе предусмотрена вибрация конусной воронки.
Определение сыпучести проводят по
следующей методике: 50 г порошка, взвешенного с точностью до 0,01 г, засыпают в
воронку, включают устройство тумблера при закрытой заслонке и одновременно
включают электромагнит и секундомер. После 20 секунд утряски открывают заслонку
и наблюдают за истечением сыпучего материала из воронки в приёмный стакан.
Точность отсчёта времени истечения до 0,2 секунд.
Сыпучесть рассчитывают по формуле 9:

где 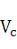
 - сыпучесть, кг/с;- масса навески, кг;полное время опыта, сек;
- сыпучесть, кг/с;- масса навески, кг;полное время опыта, сек;
- время утряски, сек.
С помощью прибора ВП - 12А определяется также угол естественного
откоса. Для определения этого показателя предварительно устанавливают объём
порошка, который должен заполнить кольцо с образованием горки. Затем полученный
объём порошка засыпают в воронку, включают устройство и открывают заслонку. К
образовавшейся горке подводят угломер, определяя по шкале угол естественного
откоса.
Кроме того, по полученным данным рассчитывают коэффициент
сыпучести, используя следующую формулу 10:

 , (10)
, (10)
где 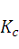
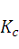 - коэффициент сыпучести;
- коэффициент сыпучести;
г - радиус отверстия воронки, мм;
m - масса сыпучего материала.
Данные по расчету коэффициента сыпучести и угла естественного
откоса приведены в таблице 13.
При расчетах учитывали, что радиус воронки равен 7 мм, масса
сыпучего материала равна 30г.
Таблица 13 - Результаты определения сыпучести порошка
|
№
|
сыпучесть, г/с
|
угол
естественного откоса, град
|
коэффициент
сыпучести
|
|
|
эксперим.
|
расчетн.
|
|
|
1
|
10,2
|
30
|
34,8
|
15,2
|
|
2
|
10,0
|
30
|
35,0
|
14,5
|
|
3
|
11,0
|
31
|
33,2
|
13,8
|
|
4
|
10,8
|
31
|
33,0
|
13,9
|
|
5
|
11,2
|
32
|
31,6
|
13,3
|
Из данных таблицы 13 следует, что
сыпучесть капсулируемой смеси можно охарактеризовать как очень хорошую.
Кроме того, полученные экспериментальные
данные близки к рассчитанным по уравнению, предлагаемому для определения угла
естественного откоса (формула 11):
у0 = 55,23 - 2VC, (11)
где Vо - угол естественного откоса, град;-
сыпучесть, г/сек.
Исходя из полученных данных, можно
рекомендовать проводить заполнение капсул предлагаемой смесью с помощью роторных,
шнековых, а также вибрационных устройств для заполнения калсул сыпучим
материалом.
Для заполнения капсул подготовленной
смесью фитоэкстрактом надземной части черноголовки разрезной нами использовался
ручной способ. При этом гранулы насыпали в донышки капсул, которые затем
закрывали крышечками. После заполнения капсулы во избежание соскакивания
крышечки герметически закупоривали, заклеивая их 2% раствором поливинилового
спирта. Для этого использовали выпускаемую через иглу инъекционного шприца
струю раствора поливинилового спирта.
Описанные капсулы затем сушили при
комнатной температуре в течение 4 часов.
3.3.3
Технологическая схема производства капсул
Производство лекарственных средств в
капсулированной форме состоит из следующих основных стадий [27].:
· приготовление желатиновой
массы;
· получение (формирование)
капсул;
· наполнение капсул,
закрывание;
· сушка и обработка капсул;
· бракераж и оценка
качества готовой продукции.
Для производства капсулированного
фитоэкстракта нами использовались готовые твёрдые желатиновые капсулы с
крышечками №1.
Порошок по составу композиции №2 готовили
по правилам изготовления сложных порошков. Для этого отвешивали 5,0 г сухого
экстракта (в расчёте на 50 капсул) и смешивали с предварительно отвешенными и
измельчёнными количествами аэросила (2,5 г), крахмала (10,0 г) в ступке №4 в
течение 3,5 мин. Для получения однородного порошка, периодически соскабливая
его со стенок ступки и с пестика специальным скребком так, чтобы порошок
находился в центре ступки.
После смешивания порошковую массу
проверяли на однородность смешивания. Для этого весь порошок собирали на дно
ступки и, легко надавив пестиком на вершину конуса порошка, определяли
невооружённым глазом с расстояния 25см отсутствие отдельных частичек.
Далее из полученной смеси готовили гранулы
и заполняли капсулы. Для этого капсулируемую смесь развешивали на разовые дозы
и заполняли капсулы ручным способом. Заполненные капсулы заклеивали 2%
раствором поливинилового спирта и высушивали при комнатной температуре в
течение 4 часов.
Поверхность заполненных капсул очищали от
остатков налипшего порошка, промывая их в изоамиловом спирте. Затем капсулы
повторно высушивали при комнатной температуре (под тягой) в течение 30 мин.
Заполненные капсулы с гранулами подвергали
бракеражу, отбраковывая треснувшие, неровные и расклеившиеся капсулы.
Готовые капсулы с гранулами анализировали
в соответствии с требованиями ГФ XI издания по следующим показателям:
определение средней массы и отклонения от неё, распадаемости капсул,
растворения, механической прочности [5]. Общая технологическая схема получения
капсул из фитоэкстракта черноголовки разрезной представлена на рисунке 13.

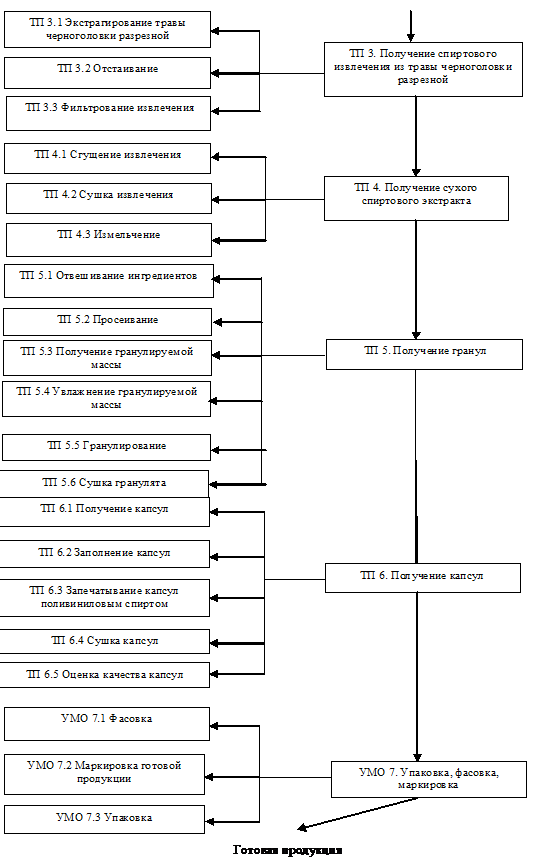
Рисунок 13 - Технологическая схема производства капсул из
фитоэкстракта черноголовки разрезной
3.3.4 Оценка
качества капсул
Определение средней массы
капсул
Для определения средней массы взвешивали
20 невскрытых капсул и определяли среднюю массу капсул, разделив массу 20
капсул на 20. Затем взвешивали каждую капсулу отдельно и сравнивали со средней
массой капсулы [5].
Результаты определения приведены в таблице
14.
Таблица 14 - Определение средней массы капсул с гранулами и
отклонения от нее
|
№
|
отклонение
|
№
|
отклонение
|
|
г
|
±%
|
|
г
|
±%
|
|
1
|
0,0027
|
0,8
|
11
|
0,0099
|
2,97
|
|
2
|
0,0105
|
3,14
|
12
|
0,0003
|
0,09
|
|
3
|
0,0046
|
1,38
|
13
|
0,0096
|
2,87
|
|
4
|
0,110
|
1,59
|
14
|
0,0031
|
0,93
|
|
5
|
0,0039
|
1,17
|
15
|
0,0044
|
1,32
|
|
6
|
0,008
|
2,40
|
16
|
0,006
|
1,80
|
|
7
|
0,0026
|
0,78
|
17
|
0,0053
|
1,59
|
|
8
|
0,008
|
2,40
|
18
|
0,0087
|
2,60
|
|
9
|
0,0075
|
2,25
|
19
|
0,0086
|
2,57
|
|
10
|
0,0044
|
1,32
|
20
|
0,012
|
3,60
|
|
средняя масса
|
0,3341
|
Из данных таблицы следует, что отклонение
в массе капсул от средней массы не превышает ±3,60%, что соответствует
требованиям ГФ XI.
Определение средней массы
содержимого капсул
Определение средней массы содержимого
капсул проводили по методике ГФ XI издания [5]. Для этого осторожно вскрывали
те же 20 капсул, удаляли содержимое капсул и взвешивали каждую оболочку.
Определяли среднюю массу содержимого, разделив разницу между массой полных
капсул и пустых оболочек на 20.
Результаты определения приведены в таблице
15.
Таблица 15 - Определение средней массы содержимого капсул
|
№
|
масса, г
|
№
|
масса, г
|
|
заполненные
капсулы
|
оболочки
|
содержимое
|
|
заполненные
капсулы
|
оболочки
|
содержимое
|
|
|
|
г
|
±% откл.
|
|
|
|
г
|
±% откл.
|
|
1
|
0,3314
|
0,0766
|
0,2545
|
0,93
|
11
|
0,3242
|
0,0751
|
0,2491
|
3,03
|
|
2
|
0,3236
|
0,0772
|
0,2458
|
4,3
|
12
|
0,3338
|
0,0779
|
0,2559
|
0,39
|
|
3
|
0,3387
|
0,0773
|
0,2614
|
1,8
|
13
|
0,3437
|
0,0781
|
0,2656
|
3,39
|
|
4
|
0,3288
|
0,0759
|
0,2552
|
0,66
|
14
|
0,3372
|
0,0782
|
0,2590
|
0,82
|
|
5
|
0,3302
|
0,0762
|
0,2543
|
1,01
|
15
|
0,3297
|
0,0773
|
0,2524
|
1,75
|
|
6
|
0,3421
|
0,0794
|
0,2627
|
2,26
|
16
|
0,3281
|
0,2514
|
2,14
|
|
7
|
0,3315
|
0,0768
|
0,2547
|
0,86
|
17
|
0,3394
|
0,0786
|
0,2608
|
1,52
|
|
8
|
0,3261
|
0,0742
|
0,2519
|
1,95
|
18
|
0,3254
|
0,0768
|
0,2486
|
3,23
|
|
9
|
0,3416
|
0,0796
|
0,2620
|
1,99
|
19
|
0,3427
|
0,0787
|
0,2640
|
2,76
|
|
10
|
0,3385
|
0,0789
|
0,2596
|
1,05
|
20
|
0,3461
|
0,0781
|
0,2680
|
4,32
|
|
среднее
значение содержимого капсул
|
0,2569
|
|
Из данных таблицы следует, что капсулы с
гранулами отвечают требованиям ГФ XI по определению средней массы содержимого капсул,
поскольку отклонение составляет не более ±4,32%.
Определение распадаемости
капсул
Распадаемость капсул с гранулами
фитоэкстракта из надземной части черноголовки разрезной определяли по методике
ГФ XI [5] на приборе "качающаяся корзинка" при температуре воды
очищенной 37±2°С. Для проведения испытаний использовали 6 готовых капсул.
Установлено, что капсулы распадаются полностью за время от 12 до 15 минут.
На основании полученных данных можно
сделать вывод о том, что капсулы с гранулами отвечают требованиям ГФ по распадаемости.
Определение растворимости
капсул
Растворимость капсул с гранулами
определяли в соответствии с ГФ XI [5] на "вращающейся корзинке" по
методике, описанной выше. Данные определения свидетельствуют о том, что 94,84%
капсул растворяется за 45 минут.
Следовательно, по растворимости капсулы с
гранулами отвечают требованиям ГФ по данному показателю.
Определение механической
плотности капсул
Определение механической прочности капсул
проводили путём испытания прочности на нагрузку. Для этого на капсулы помещали
груз массой 2 кг и засекали время, в течение которого они оставались целыми.
Установлено, что при воздействии груза
массой 2 кг капсулы оставались целыми в течение 5 - 7 секунд, что отвечает
требованиям, предъявляемым к твёрдым желатиновым капсулам с крышечками [5].
Количественное
определение флавоноидов в капсулах
Методика определения флавоноидов в капсулах. Случайным образом на
анализ нами отбиралось пять капсул. Взвешивали массу сухого экстракта. Навеску
вносили в мерную колбу на 25 мл и добавляли порциями спирт этиловый 70%.
Полученный раствор (раствор А) отфильтровывали.
В мерную колбу вместимостью 25 мл помещали 2 мл полученного
раствора, 0,5 мл кислоты уксусной 33%, 2 мл раствора алюминия хлорида 2% и
доводили объем раствора спиртом этиловым 70 % до метки (раствор Б). Через 45
минут измеряли оптическую плотность раствора Б на спектрофотометре при длине
волны 410±2 нм в кювете с толщиной рабочего слоя 10 мм.
Содержание суммы флавоноидов в пересчете на рутин и абсолютно
сухое сырье в процентах (Х) вычисляют по формуле 12:

 (12)
(12)
где Ах - оптическая плотность испытуемого раствора;
Асm -
оптическая плотность раствора стандартного образца;
mсm - масса
стандартного образца рутина, г;
m - масса навески сухого экстракта, г;
W - влажность, %.
В качестве раствора сравнения использовали раствор, состоящий из 2
мл раствора А, 0,5 мл раствора кислоты уксусной 33% и доведенный спиртом
этиловым 70 % до метки в мерной колбе вместимостью 25 мл. Параллельно измеряли
оптическую плотность раствора РСО рутина.
Таблица 16 - Содержание флавоноидов в капсулах
|
№
|
Навеска, г
|
Найдено, %
|
Метрологические
характеристики
|
1 0,1000 0,56 
 = 0,56
= 0,56

 = 0,0187
= 0,0187

 = 0,0076
= 0,0076
Δхср= 0,0197
e= 3,55
|
|
|
2
|
0,0995
|
0,54
|
|
|
3
|
0,0991
|
0,53
|
|
|
4
|
0,1005
|
0,58
|
|
|
5
|
0,1015
|
0,57
|
|
|
6
|
0,0997
|
0,55
|
|
Результаты анализа показывают, что содержание флавоноидов в
капсулах в пересчёте на рутин составляет 0,56±0,0197% (e=3,55).
Выводы по
главе
1. На основании технологических показателей разработана
технология фитоэкстракта из надземной части черноголовки разрезной.
2. Для экстрагирования использовали метод бисмацерации,
в соотношении фаз 1: 5.
. Установлено, что оптимальным экстрагентом является
спирт этиловый 70%.
. Эффективность предлагаемого метода экстрагирования
травы черноголовки разрезной составляет 73,3%.
. Установлены технологические характеристики
фитоэкстракта из надземной части черноголовки разрезной: фракционный состав,
насыпная плотность, сыпучесть и другие, необходимые для заполнения капсул, при
получении лекарственной формы.
. Был установлен наиболее оптимальный состав капсул.
7. Разработана технологическая схема
производства гранул и капсул, основой которой послужили изученные
технологические характеристики.
8. Проведена оценка качества капсул:
средняя масса капсул 0,3341г; средняя масса содержимого капсул 0,2569 г;
капсулы распадаются полностью за время от 12 до 15 минут; 94,84% капсул
растворяется за 45 минут; при воздействии груза массой 2 кг капсулы оставались
целыми в течение 5 - 7 секунд; содержание флавоноидов в капсулах составляет
0,56±0,0197% (e=3,55).
Общие выводы
1. На основании проведенных комплексных исследований
выявлена возможность использования отечественного сырья - травы черноголовки
разрезной.
2. Определены характерные морфолого-анатомические
признаки травы черноголовки разрезной, позволяющие установить подлинность
сырья.
. Определены общие числовые показатели сырья травы
черноголовки разрезной: влажность (7,43±0,0641%), общая зола (6,79±0,1422%),
зола, нерастворимая в 10% HCI (0,14±0,0050%), экстрактивные вещества - вода
очищенная (28,42±0,3949%), спирт этиловый 40% (28,99±0,3894%), спирт этиловый
70% (26,62±0,3345%), спирт этиловый 95% (7,81±0,2111%).
. Изучен химический состав черноголовки разрезной.
Установлено содержание: аскорбиновой кислоты (0,06±0,0023%), дубильных веществ
(8,71±0,1059%). Минеральный состав травы черноголовки разрезной был представлен
26 элементами, основными по содержанию из которых являются: калий, кальций,
кремний, магний, фосфор и железо.
. Методом БХ, в траве черноголовки разрезной идентифицированы
следующие соединения: рутин, кверцетин и кофейная кислоты.
. Модифицирована методика определения суммы
флавоноидов в траве черноголовки разрезной. Методом дифференциальной
спектофотометрии в траве черноголовки разрезной определена сумма флавоноидов,
что составило 0,73±0,0263%.
. Разработана технология получения капсул с гранулами
из фитоэкстракта черноголовки разрезной.
. Установлены технологические характеристики
фитоэкстракта из надземной части черноголовки разрезной: фракционный состав,
насыпная плотность, сыпучесть и другие, необходимые для заполнения капсул, при
получении лекарственной формы.
. Определены показатели качества капсул: средняя масса
капсул (0,3341г); средняя масса содержимого капсул (0,2569г); распадаемость;
растворимость; прочность; содержание флавоноидов в капсулах (0,56±0,0197%).
Литература
1. Белоусов,
Ю.Б. Клиническая фармакология и фармакотерапия / Ю.Б. Белоусов, В.С. Моисеев,
В.К. Лепахин. - М.: Универсум,
1993. - 400 с.
2. Бондаренко,
О.М. Фенольные соединения черноголовки / О.М. Бондаренко, В.И. Литвиненко, П.П.
Баланда // Современные проблемы фармацевтической науки и практики. - Киев,
1972. - С.730-731.
. Вергейчик,
Т.Х. Токсикологическая химия/ Т.Х. Вергейчик. Под ред. проф.Е.Н. Вергейчика. -
М.: МЕДпресс-информ, 2009. - 400 с.
. Государственная
фармакопея СССР X изд. - М.: Медицина, 1968. - 1079 с.
. Государственная
фармакопея СССР XI изд. - вып.1,2.
- М.: Медицина, 1987. - 336с., 398с.
. Девяткина,
И.А. Изучение влияния фармацевтических факторов на высвобождение лекарственных
веществ из лекарственных форм. Учебно-методическая разработка. / И.А.
Девяткина, Н.К. Бабанова, Т.В. Лебеденко. - М.: Изд. ММА, 1992, №6. - 42 с.
. Дикорастущие
полезные растения России / Под. ред.А.Л. Буданцева, Е.Е. Лесиовской. - СПб.:
Издательство СПХФА, 2001. - 663 с.
. Дмитрук,
С.И. Противовоспалительные свойства, антибактериальная и антифунгальная
активности экстракта из надземной части Prunella vulgaris L. / C.И.
Дмитрук // Растит. ресурсы. - 2001. - вып.4. - С.92-96.
. Мичник,
О.В., Ушаков, В.Б., Осман, М. Исследования по разработке технологии сухого
экстракта из травы верблюжьей колючки, произрастающей в Афганистане // В сб.:
Изыскание и изучение новых фармакологических средств. - Пермь, 1989. - С.13.
. Молчанов,
Г.И. Интенсивная обработка сырья/ Г.И. Молчанов. - М.: Медицина, 1981. - 20 с.
. Молчанов,
Г.И. Ультразвук в фармации/ Г.И. Молчанов. - М.: Медицина, 1980. - 116 с.
. Муравьев,
И.А. Технология лекарств.3-е изд. / И.А. Муравьев. - М.: Медицина, 1980. Т1. -
391с. Т2. - 703 с.
. Муравьев,
И.А., Пшуков, Ю.Г. Способ расчета основных параметров непрерывного
противоточного экстрагирования в батарее диффузоров // Фармация. - 1980. - №1.
С.28-29.
. Муравьев,
И.А., Пшуков, Ю.Г. Теоретические основы производства жидких экстрактов методом
реперколяции с законченным циклом. Методические рекомендации/ И.А. Муравьев,
Ю.Г. Пшуков. - Пятигорск, 1985. - 48с.
. Погорелов,
В.И., Мичник Л.А., Мичник О.В. Производство лекарственных препаратов в условиях
крупных и малых фармацевтических предприятий (8семестр) / В.И. Погорелов [и
др.]. - Пятигорск: Пятигорская ГФА, 2012. - 428 с.
. Погорелов,
В.И., Мичник Л.А., Мичник О.В. Фитоэкстракционные препараты. Растворы: учебное
пособие по фармацевтической технологии (7 семестр) / В.И. Погорелов [и др.]. -
Пятигорск: Пятигорская ГФА, 2012. - 372 с.
. Пономарев,
В.Д. Экстрагирование растительного лекарственного сырья/ В.Д. Пономарев. - М.:
Медицина, 1976. - 240 с.
. Попа,
Д.П. Высшие терпеноиды растений сем. губоцветных / Д.П. Попа. - Кишинев, 1976.
- 148 с.
. Попова,
Н.В. Лекарственные растения мировой флоры / Попова Н.В., Литвиненко В.И. -
Харьков: СПДФЛ, 2008. - 510 с.
. Разработка
и стандартизация лекарственных фитокомплексов с содержанием различных групп
действующих веществ / Э.Ф. Степанова, О.В. Мичник, Ю. Бекеле и др. // В сб.:
Материалы респуб. науч. конф. по фармации и фармакологии "Проблемы
фармации, подготовки и использования провизорских кадров". - Пятигорск,
1993. - С.121-122
. Растительные
дубильные вещества / С.М. Мавлюнов [и др.] / Химия природ. соединений. - 2001.
- № 1. - С.3 - 22.
. Растительные
ресурсы России: Дикорастущие цветковые растения, их компонентный состав и
биологическая активность; Семейство Caprifoliaceae - Lobeliaceae. - СПб.; М.: Товарищество научных изданий КМК, 2011. - Т.4. - 630 с.
. Справочник
ВИДАЛЬ Лекарственные препараты в России. - М.: Астра Фарм Сервис. - 1995. -
1168 с.
. Тахтаджян,
А.Л. Система магнолиофитов / А.Л. Тахтаджян - Л.: Наука, 1987. - 439 с.
. Тенцова,
А.И., Ажгихин, И.С. Лекарственная форма и терапевтическая эффективность
лекарств / А.И. Тенцова, И.С. Ажгихин. - М.: Медицина, 1974. - 336 с.
. Технология
лекарственных форм: в 2 т. / Под ред. проф. Т.С. Кондратьевой и Л.А. Ивановой.
- М.: Медицина, 1991. Т 1. - 495 с. Т.2. - 544 с.
. Фармацевтическая
технология / Под. ред. проф.В.И. Погорелова. - Ростов-на-Дону: Феникс, 2002. - 543 с.
. Хакимова,
Д.Р. Унификация метода стандартизации флавоноидов: Автореф. дис… канд. фармац.
наук / Д.Р. Хакимова. - М., 1994. - 23 с.
. Цагарейшвили,
Г.В. Технологические аспекты повышения биологической доступности действующих
веществ из лекарственных средств/ Г.В. Цагарейшвили. - Тбилиси: Мецниереба, 1968. - 168 с.
. Челомбитько,
В.А. Количественное определение флавоноидов в надземной части волжанки
обыкновенной (Aruncus vulgaris Rafin) / Челомбитько В.А., Айрапетова А.Ю.,
Шамилов А.А. // VI съезд Фитофарм 2002: Актуальные проблемы создания новых
лекарственных препаратов природного происхождения: Материалы… - СПб., 2002. -
С.324 - 326.
. Шамилов,
А.А. Макро - и микроэлементный состав волжанки обыкновенной (Aruncus vulgaris
Rafin.), произрастающей во флоре Северного Кавказа / Шамилов А.А., Челомбитько
В.А. // Разработка, исследование и маркетинг новой фармацевтической продукции:
Материалы 59 Межрегион. конф. по фармации и фармагологии - Пятигорск, 2004. -
С.63.
32. Capsugel
AG, Basel: The Naw Capsule Colours-Appearanceand Effect, BAS-88, 1988.
33. Du, D
<http://www.ncbi.nlm.nih.gov/pubmed?term=Du%20D%5BAuthor%5D&cauthor=true&cauthor_uid=22574453>.
A. A new unusual delta11 (12) - oleane triterpene and anti-complementary
triterpenes from Prunella vulgaris spikes / Du D. A., Cheng Z., Chen D. // Nat Prod Commun.
<http://www.ncbi.nlm.nih.gov/pubmed/22574453> - 2012 Apr. - Vol.7,
№ 4. - P.501-505.
. Factors
of Compositions Preparing and Treatment That Influence Solid Capsules’ Ability
for Disintegration/Naicloo N. // Drug Dev. and Ind. Pharm. - 1989. - 15. - № 9. - P.1329-1339.
35. Gelatinen
kapselnmiteinem Wassereinsaugenstoff und hydrophilendem Anfueller und
ihreHerstellungsverfahren/Shere R. P., Patent 4804542, BRD, anmeld.09.04.87, №
36311, publ.14.02.89, IPK A61K9/64.
. Markovб, H
<http://www.ncbi.nlm.nih.gov/pubmed?term=Markov%C3%A1%20H%5BAuthor%5D&cauthor=true&cauthor_uid=9244565>.
Prunella vulgaris L. - a rediscovered medicinal plant / Marková H., Sousek
<http://www.ncbi.nlm.nih.gov/pubmed?term=Sousek%20J%5BAuthor%5D&cauthor=true&cauthor_uid=9244565>J.,
Ulrichovб
<http://www.ncbi.nlm.nih.gov/pubmed?term=Ulrichov%C3%A1%20J%5BAuthor%5D&cauthor=true&cauthor_uid=9244565>J.
// Ceska Slov Farm. - 1997 Apr. Vol.46, № 2. - P.58-63.
. Mixtures
of Gelatins and Fibrous Materials for Capsule Shells/Jones B., Lilli Ind.,
patent 311255, UK, appl.11.09.87, № 37/21455, publ.12.04.89, IPC А61К9/48.
. Quickly
Disintegrating Solid Gelatin Capsules/Nippon Eranco Со.,
patent 61-15831, Japan, appl.29.06.84, № 59-135846, publ.23.01.86, IPC А61К9/48.
39. Информационный ресурс:
http://ru. wikipedia.org
<http://ru.wikipedia.org/>
. Информационный
ресурс: <http://www.lisyz.ru/>