Технологічні процеси охорони довкілля при виробництві каустичної соди
АНОТАЦІЯ
Темою даної роботи є
виробництво каустичної соди. Сода каустична є пожежо- та вибухобезпечна. Їдка,
корозійно активна речовина. За ступенем впливу на організм відноситься до
речовин 2-го класу небезпеки. Як тверда речовина, так і концентровані її
розчини викликають дуже сильні опіки
<#"700984.files/image001.gif"> (1.1)
Розчинності СaCO і Са (ОН )
різною мірою залежать від температури, тому, строго кажучи, константа рівноваги
залежить від температури. Проте практично ця залежність не враховується.
Важливою характеристикою процесу каустіфікації є рівноважна ступінь
каустифікації, виражений відношенням 1.2:
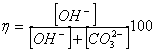 (1.2)
(1.2)
Висловлюючи концентрацію
іонів [ОН ] через константу рівноваги К і концентрацію іонів [ CO ], отримують
1.3:
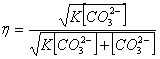 (1.3)
(1.3)
З виразу випливає, що
рівноважна ступінь каустифікації (ступінь переходу соди в їдкий натр ) за інших
рівних умов знижується при збільшенні вмісту соди в вихідному розчині . При
вмісті соди в розчині ¬ не більше 23,2 % в даній фазі з'являється Пірсон,
сприяючий зростанню втрат соди. Навпаки, при зниженні концентрації соди у
вихідному розчині ступінь каустифікації підвищується.
Однак разом з цим зростає
також питомий вміст води (на 1 кг твердого NaОН ) у каустифікованому содовому
розчині. Підвищення питомої вмісту води призводить до збільшення витрати
гріючої пари на випарки слабких щолоків, тобто до зростання вартості
продукційної каустичної соди.
Вельми малий тепловий ефект
реакції показує, що температура мало впливає на рівноважну ступінь
каустифікації. Швидкість досягнення рівноваги залежить від температури. Тому
хоча температура і не впливає на рівноважний вихід NaОН, процес каустифікації
ведуть при температурі 98 - 100 ° С, що забезпечує досить високу швидкість
протікання процесу. Крім того, збільшення температури сприяє появі
крупнокристалічного осаду СaCO, що покращує відділення шламу від лужних
розчинів при подальшій її декантування і підвищує швидкість осадження СaCO за
рахунок зниження в'язкості розчину.
По осі абсцис відкладена
концентрація соди, але осі ординат-концентрація NаОН [в моль/л і % ( мас.)] в
межах, прийнятих у виробничих умовах.
Слабкий луг необхідно
відокремити від шламу і освітлити. Швидкість і повнота відділення шламу від
слабкого лугу залежать від якості випалювального вапняку, умов його випалу,
надлишку вапна та інших факторів. При підвищенні температури випалу і
збільшенні часу перебування матеріалу в зоні випалу швидкість освітлення лугу
зростає. Умови гасіння вапна також помітно позначаються на швидкості освітлення
лугу.
Великі кристали СаСО3 не
тільки швидше осідають, але і краще відмиваються від NаОН і залишків соди меншою
кількістю промивної води. Останнє надзвичайно важливо, оскільки промивна вода,
що містить NаОН і Nа2СО3, не виводиться з циклу, а змішується з вихідним
концентрованим содовим розчином. Тому, чим менше витрата промивної води, тим
концентрированнее содовий розчин, що подається на каустифікації, і
концентрированнее каустіфіцірованний розчин, і, тим, отже, менше витрата тепла
на подальше концентрування цього розчину для отримання товарного NаОН. Зниження
пересичення каустіфіціруемого розчину по СаСО3 призводить до утворення більш
великих кристалів СаСО3 і тим самим покращує процес освітлення слабкого лугу.
Зниженню пересичення, окрім підвищення температури каустифікації, сприяє також
додавання до вихідного содовому розчині так званих «міцних » промивок, що містять
крім соди, їдкий натр, підвищуючий розчинність СаСО3. «Міцні» промивки
отримують при розчиненні соди, яка випадає із слабкого лугу при його
концентрировании. У результаті додавання до вихідного содовому розчині «слабких
» і «міцних» промивок отримують «нормальний» содовий розчин.
У виробництві каустичної соди
необхідно досягти по можливості високого ступеня декарбонізації содового
розчину, так як присутній в содовому розчині гідрокарбонат натрію взаємодіє в
промивних водах з їдким натром по реакції:
аНСО3 + NаОН ↔ Nа2СО3 +
Н2О (1.4)аНСО3 + Са ( ОН) 2 ↔ СаСО3 + NаОН + Н2О (1.5)
У результаті цієї реакції
витратний коефіцієнт вапна на 1 т NаОН зростає.
У технологічних схемах
виробництва NаОН часто передбачається повторна каустифікації шламу свіжим
содовим розчином, що призводить до збільшення концентрації слабкого лугу і
підвищенню коефіцієнта використання СаО. При проведенні двох процесів
каустифікації з наступним промиванням шламу швидкість осадження твердих
частинок при інших рівних умов вище швидкості осадження частинок, отриманих при
одноразовій каустифікації. Це можна пояснити збільшенням ступеня використання
СаО в шламі і зростанні часу формування шламу при дворазовою каустифікації. У
виробництві їдкого натру витрата промивної води на 1 т NаОН при 70 - 800С
становить 4.5 - 5.0м3. Висока температура промивної води сприяє розчиненню в
ній домішок і підвищує швидкість осадження твердих частинок.
У відділення випарки з
відділення каустифікації надходять слабкі лугу, що містять близько 130г / л
NаОН, 30г / л Nа2СО3 та 11.3 г / л Nа2SО4. При концентрировании слабких щолоків
в тверду фазу виділяється Nа2СО3 і Nа2SО4, розчинність яких у розчинах їдкого
натру дуже близькі. При великих концентраціях NаОН в розчині спостерігається
високе пересичення по Nа2СО3 іNа2SО4, яке дуже повільно знижується в результаті
старіння розчину. Однак навіть через 48 годин розчин не досягає рівноважного
стану.
У процесі випарювання важливо
не тільки максимально виділити домішки в тверду фазу, а й отримати великі
швидко осідають кристали Nа2СО3 і Nа2SО4. Повнота виділення солей
забезпечується високою концентрацією їдкого натру і тривалістю витримування
розчину NаОН, що забезпечує зняття пересичення по Nа2СО3 і Nа2SО4. Розмір
осаждающихся кристалів в значній мірі визначається вмістом Nа2SО4 в розчині. Бо
частину сульфату натрію залишається в готовому продукті і не повертається назад
в цикл, необхідно заповнювати його втрати.
Максимальна концентрація
їдкого натру, що досягається в випарних установках, складає 70%. Більш
концентровані розчини їдкого натру володіють великою в'язкістю і мають високу
температурну депресію, що робить неекономічним подальше зневоднення NаОН
ввипарних установках.
Для цього в промисловості
застосовують плавильні котли ( горщики ), виготовлені з лугостійкою сірого
чавуну.
Температура кипіння NаОН при
атмосферному тиску становить 13880С, тому повне зневоднення NаОН можливо лише
при цій температурі. Досягнення такої високої температури пов'язано з
технічними труднощами. Натомість присутність в їдкому натре навіть малої
кількості води різко знижує температуру кипіння плаву. Для нагрівання плаву до
таких температур використовують димові гази, що утворюються при спалюванні
вугілля або природного газу.
Зневоднення їдкого натру може
протікати в одному плавильному горщику ( періодичний процес ) або в батареї з
6-9 плавильних горщиків послідовно. У цьому випадку плавка їдкого натру
ведеться безперервно, так як зневоднення продукту здійснюється в міру руху його
через плавильні горщики.
При охолодженні плаву в
останньому плавильному горщику утворюється три шари : верхній шар- біла
каустична сода в кількості 95 % маси всього плаву-являє собою готовий продукт;
середній шар- сіра каустична сода ( 3% ) повертається зазвичай в сусідній
плавильний котел і нижній шар - червоного кольору продукт (2%) є відходом
виробництва.
Електролітичний спосіб
виробництва їдкого натру
Сировиною для
електролітичного виробництва лугу і хлору є водні розчини NаСl. Вапняне молоко,
використовуване содових заводах, на хлорних заводах замінюють розчином каустичної
соди ( католіт ), тому метод очищення носить назву содово - каустичний.
Кожен їх зазначених способів
відрізняється реакціями, що протікають на католітом. У диафрагменном способі на
твердому катоді відбувається розряд іоновводорода з освітою в електроліті лугу,
що містить залишкові кількості NаСl. У анодне простір подається гаряче очищений
розсіл і відводиться утворюється хлоргаза. Рух розсолу з анодного простору в
катодне відбувається за рахунок різниць рівнів аноліта і католіта.
Катодний процес . При
електролізі водного розчину хлориду натрію на твердому, наприклад, залізному
катоді, виділяється водень і в католіті утворюється луг.
Н2О +2 е → Н2 +2 ОН
(1.6)
Різні іони розряджаються при
різних значеннях потенціалу. Це властивість іонів і дозволяє використовувати
електроліз для розділення сумішей речовин. Мінімальний потенціал електорода,
необхідний для розряду даного іона при концентрації його в розчині, що дорівнює
1екв / л, називають нормальним електродним потенціалом і позначають через Е0.
Для багатьох іонів значення Е0 відомі і наводяться у довідковій літературі.
У практичних умовах розряд
іонів на електродах відбувається при більш високих значеннях потенціалу, ніж
теоретичне. Різниця між значеннями дійсного та оборотного електродного
потенціалу називається поляризацією, яка зростає із збільшенням щільності
струму.
Лімітуючою стадією процесу
електролізу може бути стадія розряду іонів - гальмування процесу за рахунок
електрохімічної стадії ( виникає при протіканні струму), що призводить до появи
перенапруги - поляризації. На поляризацію в цьому випадку впливає зміна умов
ведення електролізу. Так, наприклад, для зменшення поляризації виділення водню
залізний катод покривають нікелем або кобальтом ( каталізатором ), що знижує
потенціал виділення водню.
Розряд іонів натрію на
сталевому катоді не відбувається внаслідок високого від'ємного значення
стандартного потенціалу реакції.
а + е → Nа, рівного -
2.714В (1.7).
Крім основного процесу, що
протікає на аноді 2Сl → Сl2, в анодному просторі електролізера протікає
ряд побічних реакцій, що зменшують вихід по струму, наприклад, розряд гідроксил
- іонів із кисню 4ОН - - 4е → О2 + Н2О
Хлор, що виділяється на
аноді, частково розчиняється в електроліті, взаємодіючи з водою відповідно до
реакціями
Сl2 + Н2О ↔ НСlО + НСl,
Сl2 + ОН- ↔ НСlО + Сl - (1.8)
Освіта вільної хлорнуватисту
кислоти в концентрованих водних розчинах NаСl практично не змінює іонного
складу розчину поблизу анода внаслідок слабкої дисоціації цієї кислоти, а,
отже, не впливає і на процес електролізу.
На окислення іонів СlО - на
аноді до СlО3 - витрачається значна частка струму, отже, зазначені процеси є
небажаними. Таким чином, вихід за струмом продукту, що позначається зазвичай А,
залежатиме від ретельності поділу катодних і анодних продуктів. Крім того,
вихід за струмом залежить від концентрації їдкого натру в Католіт, від
розчинності хлору в аноліте, а остання пов'язана з концентрацією NаСl: чим вище
концентрація NаСl в аноліте, тим нижче розчинність хлору. Розчинність хлору у
водних розчинах концентрацією NаСl знижується також з підвищенням температури.
Цим і пояснюється прагнення направити на електроліз практично насичений водний
розчин концентрацією NаСl і вести процес при температурі 85- 900С . Вихід хлору
і луги по струму в цих умовах складає 92-96 %.
РОЗДІЛ 2. ТЕХНОЛОГІЯ
ВИРОБНИЦТВА КАУСТИЧНОЇ СОДИ
2.1
Функціональна схема виробництва каустичної соди
Функціональна схема
виробництва каустичної соди виглядає наступним чином (рис. 2.1.)

Рис. 2.1. Функціональна схема
виробництва каустичної солі.
Технічну кальциновану соду марки : А
упаковують в м'які спеціалізовані контейнери типів МКР -1, 0 С по ТУ 6-19-74,
МКР -1, ОМ за ТУ 6-19-264 МКО -1, 0 С по ТУ 6-19 - 229 або в пятишарові
паперові мішки марок ПМ, БМ за ГОСТ 2226. [10,
с 131]
Технічну кальциновану соду марки : Б
упаковують в чотирьох - пятишарові паперові мішки марок НМ, БМ, ПМ по ГОСТ
2226, в м'які спеціалізовані контейнери типів МКР -1, 0 С по ТУ 6-19-74 ; МКР
-1, 0 М по ТУ 6-19-264 ; МК-1, 5 Л по ОСТ 6-19-80 .
Технічну кальциновану соду,
призначену для тривалого зберігання, упаковують в м'які спеціалізовані
контейнери типів МКР -1, 0 С по ТУ 6-19-74, МКР -1, 0 М по ТУ 6-19-264 .
При поставках на експорт технічну
кальциновану соду упаковують в чотирьохшарові паперові мішки марок: НМ, БМ за
ГОСТ 2226, вкладені в льно- джуто - кенафні мішки за ГОСТ 30090, або в два
чотиришарових паперових мішка марок НМ, БМ за ГОСТ 2226, вкладені один в інший,
або в спеціалізовані м'які контейнери типів МКР -1, 0 М, МКР -1, 0 С.
При упаковці соди в чотирьохшарові
паперові мішки допускається маса не більше 50 кг. Транспортне маркування - за
ГОСТ 14192, з нанесенням маніпуляційного знаку "Боїться вогкості » і
зазначенням класифікаційного шифру 923 за ГОСТ 19433[10,
с 131]
2.2 Класична схема
виробництва каустичної соди
.2.1 Опис та
технологічна схема виробництва каустичної соди
У 1882 р. був розроблений і
здійснений в промисловості феритний спосіб отримання соди каустичної NаОН,
заснований на застосуванні кальцинованої соди. В даний час феритний спосіб
практично не застосовується через технологічної складності і великих затрат
ручної праці .
Одночасно в кінці XIX ст . стали
швидко розвиватися електрохімічні методи отримання соди каустичної NаОН
електролізом водних розчинів NaCl. При електрохімічному способі одночасно з
содою каустичної NаОН отримують хлор, який знаходить широке застосування в
промисловості важкого органічного синтезу та в інших галузях промисловості, що
і пояснює швидкий розвиток електрохімічного виробництва каустику NаОH . Частка
їдкого натру, що випускається методом електролізу, у світовому виробництві соди
каустичної NаОН в 1980 р. склала 96,8 %, а їдкого натру, одержуваного хімічними
методами, -3,2 %. У 1970 р. в Радянському Союзі на частку електрохімічної каустичної
соди припадає вже 88,8 % всієї вироблення ( 11,2 % № ОН було вироблено хімічним
способом). Перший патент па електрохімічний метод виробництва їдкого натру (
соди каустичної ) і хлору був отриманий російськими винахідниками -Н . Глуховим
і Ф. Ващуком в 1879 р., а вже в 1880 р. стало можливим промислове впровадження
цього способу . [11,
с 469]
Цех вапняної каустичної соди,
випусковий твердий їдкий натр, має три відділення : каустифікації, випарки
слабких щолоків і плавки.
Основною особливістю схеми
каустифікації є одночасне проведення реакцій кипіння навести і каустифікації
содового розчину в одному апараті - гасителів - каустифікаторах, в якому
ступінь каустифікації досягає 75-80 %. На гасіння вапна в гаситель подають не
воду, як зазвичай, а содовий розчин. Для зменшення втрат вапна в технологічній
схемі передбачається додаткова каустифікації утворився в гасителів -
каустифікаторах шламу, що містить непрореагіровавшій СаО .Випарювання щолоків
при виробництві соди каустичної, проводять за допомогою водяної пари з різними
параметрами. Підігрівач і перший по ходу розчину випарної апарат обігрівають
насиченою водяною парою тиском 980 кПа ( 10 кгс / см). Концентрація їдкого
натру ( каустику ) в апараті зростає від 130 до 200 г / л. Такий розчин
переходить у другий корпус, а з другого в третій, що працює під вакуумом
близько 80 кПа ( 600 мм. Рт. Ст. ) . Обігрів другого і третього корпусів
здійснюється вториннимпором попереднього корпусу. Концентрація каустичної соди
NаОН на виході з третього корпусу складає 610-660 г / л.
[12, с 232]
Виділяються при концентрировании
розчину каустику NaОН карбонат і сульфат натрію відокремлюють від розчину у
відстійнику середніх щолоків . Освітлений розчин направляють у збірник середніх
щолоків, а шлам - на вакуум - фільтри. Фільтрат повертається у відстійник
середніх щолоків, а осад з фільтру надходить в розчинник солей випарки і далі
на каустифікації .
За іншою технологічною схемою осад
після вакуум -фільтра репульпують, знову фільтрують, але на центрифузі, а потім
подають в розчинник солен випарки .Освітлений розчин у збірнику середніх
щолоків являє собою товарний продукт . При випуску твердого NаОН рідка
каустична сода надходить на другу стадію випарки, де її концентрація зростає до
1000-1200 г / л NаОН . На другій стадії випарки є один вакуум- випарний апарат,
обігрівається зазвичай вторинним пором першого корпусу першої стадії випарки . [13,
с 654]
В цьому корпусі підтримується вакуум
близько 80 кПа ( 600 мм рт. ст.) У міру підвищення концентрації NаОН з розчину
виділяються додаткові кількості соди. Тому розчин після четвертого випарного
апарату надходить у відстійник «міцних » щолоків . Подальший рух «міцних »
щолоків і шламу аналогічно наведеному вище для середніх щолоків .На деяких
заводах випарювання лугу ведуть парою під тиском 200-300 кПа (2-3 кгс/см2) при
відповідній зміні руху пари і лугу .Для випуску твердого плавленого і
чешуірованная їдкого натру «міцний луг », що містить 1000-1200 г / л NаОН,
піддається подальшому зневоднення ( плавці ) .
Плавка їдкого натру може
здійснюватися в одиночних котлах ( періодичний процес ) ; в даний час цей
процес практично не застосовується. Значно ефективнішим способом зневоднення є
безперервна плавка каустику NаОН в батареї плавильних котлів.
Коли концентрований розчин хлориду
натрію піддається електролізу, утворюються хлор і гідроксид натрію, але вони
реагують один з одним з утворенням гіпохлориту натрію - отбеливающего речовини.
Цей продукт, у свою чергу, особливо в кислих розчинах при підвищених
температурах, окислюється в електролізної камері до перхлорату натрію. Щоб
уникнути цих небажаних реакцій, електролізний хлор повинен бути просторово
відділений від гідроксиду натрію. [14,
с 64]
У більшості промислових установок,
використовуваних для отримання електролізної каустичної соди, це здійснюється
за допомогою діафрагми, вміщеній поблизу анода, на якому утворюється хлор.
Існують установки двох типів : з зануреної або незануреному діафрагмою. Камера
установки з зануреної діафрагмою цілком заповнюється електролітом. Соляний
розчин втікає в анодне відділення, де з нього виділяється хлор, а розчин
каустичної соди заповнює катодне відділення . В установці з незануреному
діафрагмою розчин каустичної соди відводиться з катодного відділення в міру
утворення, так що камера виявляється порожньою . У деяких установках з
незануреному діафрагмою в порожнє катодне відділення напускається водяна пара,
щоб полегшити видалення каустичної соди і підняти температуру.
У діафрагменних установках при
виробництві соди каустичної виходить розчин, що містить як каустичну соду, так
і сіль. Більша частина солі викристалізовується, коли концентрація каустичної
соди в розчині доводиться до стандартного значення 50%. Такий « стандартний»
електролізний розчин містить 1% хлориду натрію. Продукт електролізу придатний для
багатьох застосування в різних секторах промисловості, наприклад для
виробництва мила і чистячих препаратів. Однак для виробництва штучного волокна
і плівки потрібно каустична сода високого ступеня очищення, що містить менше 1%
хлориду натрію (солі) . «Стандартний» рідкий каустик можна належним чином
очистити методами кристалізації та осадження . [15,
с 258]
Безперервне поділ хлору і каустику
можна також здійснити в установці з ртутним катодом. Металевий натрій утворює з
ртуттю амальгаму, яка відводиться в другу камеру, де натрій виділяється і
реагує з водою, утворюючи каустик і водень. Хоча концентрація і чистота
соляного розчину для установки з ртутним катодом більш важливі, ніж для
установки з діафрагмою, в першій виходить каустична сода, придатна для
виробництва штучного волокна. Її концентрація в розчині становить 50-70 %.
Більш високі витрати на установку з ртутним катодом виправдовуються одержуваної
вигодою.
[16, с 158]
Класична технологічна схема наведена
на рис. 2.2.
Рис. 2.2. Класична схема виробництва
каустичної соди.
2.2.2 Технологічно
проблемні стадії виробництва каустичної соди
Однією з проблем виробництва каустичної соди є
використання ртутного методу виробництва. Проблематика данного методу повязана
з виділенням ртутних відходів при виробництві.
Ртутний метод отримання каустичної
соди передбачає утворення 4 видів відходів: [17,
с 359]
) ртуть містять шлами;
) стічні води промивання ємностей і
комунікацій;
) вентиляційні викиди електролізних
ванн;
Технологічні втрати ртуті за п. 1-3
становлять у середньому 150г/тн.Cl2, або, враховуючи світове виробництво хлору
(близько 4 млн. т / рік), 600 т / рік. У США ухвалено індекс ПДКHg = 1 мкг/м3,
що відповідає допустимому викиду підприємства середньої потужності не більше 2
- 3 кгHg / добу.
В останні роки порядковий номер
ртуті в списку найбільш отруйних речовин істотно зменшився через виявлену
здатності пригнічувати активність ферментів. При цьому помітно зросла і її
дефіцитність. Це активізувало розробку методів її знешкодження та утилізації.
Розглянемо ці методи в застосуванні до трьох перерахованих вище видів
ртутьвмісних відходів. [17,
с 359]
2.2.3 Аналіз стадій
утворення відходів від виробництва каустичної соди
З аналізу стадій виробництва соди
слід, що поряд з цільовим продуктом в ньому утворюються тверді та рідкі
відходи. До твердих належать опади регенерації аміаку і очищення розсолу, а
також перевитрата й інші відходи випалу вапняку. Рідкі відходи становить так
звана дістіллерной рідина ( ДЖ ) - залишковий розчин, точніше суспензія, стадії
регенерації аміаку, що містить СаС12 і NaCl в зразковому співвідношенні 2:1.
Вихід твердих відходів содового виробництва ( ТОС ) дорівнює 200-250 кг, а
дістіллерной рідини 9-10 м / т соди. Їх загальний світовий обсяг перевищує 300
млн м / м. Утилізація відходів незначна, і вони відправляються в обширні
шламонакопичувачі, що отримали образну назву «білих морів» . У Росії накопичено
більше 40 млн т ТОС, їх кількість щороку збільшується на 1 млн т. Зокрема, на
підприємстві « Сода » (м. Стерлітамак, Башкортостан), основному виробнику
каустичної соди, шламонакопичувачі займають 500 га землі в заплаві р. . Біла і
акумулюють більше 20 млн т відходів. На ньому ж щорічно утворюється близько 17
млн м ДЖ. Тверді і рідкі відходи містять карбонат кальцію,
гідроксид магнію, хлориди кальцію, натрію і магнію. [18, с 539]
Хімічний склад ТОС,%: 1,8 SiO2 ; 1,9
Al2O3 + Fe2O3 ; 45,5 СаО, в тому числі 1,6 Сао; 4,2 MgO . Середня вологість ТОС
становить 44 %. У висушеному стані він являє собою светлосерий порошок, 80 %
якого складають частинки розміром 0,1-0,6 мм.
При в цілому незначною мірою
використання ТОС і ДЖ у світі, відзначимо основні напрямки їх утилізації,
реалізовані на підприємстві « Сода ».
Найбільш перспективним для ТОС в
даний час виявилося їх застосування для отримання в'яжучих і будівельних
матеріалів.
На початку 80- х рр. був побудований
комплекс річною потужністю 120 тис. т з виробництва в'яжучого вапняно -
белітового типу. Його склад,%: 18,8 SiO2 ; 4,0 А12О3 ; 1,34 Fe2O3 ; 60,0 CaO;
4,6 MgO ; 3,1 SO3 ; 8,5 CO2 ; 5,4 Cl ..
Технологія отримання в'яжучого
заснована на термообробці ТОС при 900-1100 ° С під обертової печі Е, сушінні
другого компонента ( кварцового піску), змішуванні його і відходу в заданому
співвідношенні в мішалці М, подрібненні суміші до питомої поверхні 4000-5000 см
/ г з додаванням гіпсу в дробарці Д, інтенсифікатора помелу і води для
часткової гідратації оксиду кальцію. [19,
с 268]
Силікатна суміш включає близько 25%
мас в'яжучого, отриманого з частин продукту випалу ТОС і меленого піску.
Автоклавірванние вироби упрочняют за базовим заводському режиму ( тиск пари 8
атм, тривалість ізотермічної витримки 8 год). Марка цегли становить не менше
125, його морозостійкість не нижче 25 циклів . [19,
с 268]
На основі в'яжучого налагоджений
також випуск 60 тис м / рік авто- клавірованних стінових блоків з пористого
бетону. Побудовані з їх використанням для кладки зовнішніх стін 1- 4х- кімнатні
житлові будинки, тваринницькі та допоміжні приміщення через 15 років
перебувають у задовільному стані.Із застосуванням ТОС освоєно виготовлення
асфальто -мінеральних і бітумно -мінеральних сумішей. У них ТОС, з додаванням
інших мінеральних компонентів ( кварц, вапно, зола ТЕЦ тощо), служить
заповнювачем. Виявлено довговічність цих асфальтобетонів : термін їх служби
збільшується в середньому на 4 роки.ТОС утилізують і при виробництві
тампонажних матеріалів. Останні і розчини на їх основі включають переважно порт
- ландцемент (70-90% мас) і обпалений відхід (10-30 % мас), а також близько 0,1
% мас пластифікатора і 4-5 % мас соди ( електроліту ) . Розроблені склади
використовують на ряді нафтових і газових родовищ Росії, на яких температурний
інтервал цементування свердловин охоплює діапазон від -2 до 150 ° С.З
зарубіжної практики відомо застосування ТОС для виготовлення меліорантів і
нейтралізації звалищ сміття.Переходячи до розгляду утилізації дістіллерной
рідини, відзначимо, що в цьому плані відомі два традиційні способи, що
передбачають одержання хлоридів кальцію та амонію . Однак потреба в цих солях
порівняно невелика і проблема реалізації ДЖ такий спосіб не вирішується .У
конкретних умовах підприємства «Сода », розташованого поблизу нафтових родовищ,
ДЖ з 1975 р. використовується для їх заводнення . Спочатку застосовували
стандартну дістіллерной рідина з рН, рівним 11, а потім з рН порядку 7,2-8,5 .
Останнє досягнуто карбонізацією ДЖ. Її використання дозволило збільшити
видобуток нафти при стабілізації обводнення . У той же час на видобувних
свердловинах з нагнітанням прісної води вона продовжувала знижуватися. Всього
за рахунок нової технології обводнення в 1975-1981 рр. . було додатково
отримано 235 тис. т нафти.Інша область утилізації рідких відходів - виробництво
азбестоцементних виробів . Відхід подають на азбоцементний шар при його
вакуумуванні на сукні лістоформовочной машини. Застосування ДЖ істотно
прискорює твердіння вироби, особливо в перші 2-3 год, при вмісті хлориду
кальцію в ньому на рівні 2,5-3,5% мас . [20,
с 125]
Дістіллерной рідина утилізують також
у виробництві « білої сажі ». У цьому випадку карбонизовані ДЖ підігрівають до
50 ° С, розбавляють водою в 3-4 рази, потім з додаванням рідкого скла
направляють на осадження .
Утворений осад гідросилікату кальцію
надходить на соляно - кислотну обробку, провідну до утворення білої сажі -
SiO2. При отриманні 1 т цього продукту утилізується 22-25 м дістіллерной
рідини.Створено також технологія виробництва з ДЖ порошкової композиції. Вона
передбачає термообробку топковим газами з температурою 450-650 ° С дістіллерной
рідини, яку попередньо нагрівають до 75-85 ° С протягом 1,5-3,0 год при рН
6,5-7,0 . Далі рідина направляють в розпилювальну сушарку . Тут випаровується
надмірна волога, а утворений твердий залишок має вологість 1,5-2,0 % мас . Він
містить 45-65 % мас СаС12 і 30-36 % мас NaCl + KCl, близько 97 % його
представлено частками розміром 40-100 мкм.Виготовлена за даною технологією
сольова композиція була застосована в якості реагенту для первинного та
вторинного розкриття нафтових пластів, регулювання термінів тверднення тампонаж
-них розчинів та приготування рідини глушіння в нафтогазовидобувних і бурових
організаціях Башкирії і Західного Сибіру ( Шатов ) . [21,
с 265]
2.3 Новітня схема
виробництва каустичної соди
.3.1 Опис та
технологічна схема виробництва каустичної соди
Існує декілька новітніх способів
виробництва каустичної соди.
Вапняний метод
Вапняний метод отримання каустичної
соди полягає у взаємодії розчину соди з вапняним молоком при температурі
близько 80 °С. Цей процес називається каустифікацією, він проходить за
реакцією:
Na2CО3
+
Са(ОН)2 =
2NaOH
+ CaCО3
(2.1)
У результаті реакції виходить розчин
гідроксиду натрію і осад карбонату кальцію. Карбонат кальцію
відділяється від розчину, який випарюється до отримання розплавленого продукту,
що містить близько 92% мас. каустичної соди. Потім NaOH плавлять розливають в
залізні барабани, де він остиває. [22, с 358]
Феритний метод
Феритний метод отримання каустичної соди
складається з двох етапів:
CО3 + Fe2О3 = Na2О ? Fe2О3 + CО2 (2.2)
Na2О Fe2О3-f H2О = 2NaOH + Fe2O3 (2.3)
Перша реакція - це процес спікання кальцинованої
соди з оксидом заліза при температурі 1100-1200 °С. При цьому утворюється ферит
натрію і виділяється двоокис вуглецю. Далі ферит обробляють (витравлюють) водою
за другою реакцією. Утворюється розчин гідроксиду натрію і осад Fe2O3, який
після відділення його від розчину повертається в процес. Одержаний розчин
каустичної соди містить близько 400 г/л NaOH. Його випарюють до отримання
продукту, що містить близько 92% мас. NaOH, а потім отримують твердий продукт у
вигляді гранул або пластівців. [23,
с 418]
Діафрагмовий метод
Найбільш поширеними є електрохімічні методи
отримання каустичної соди, а найбільш простим, з електрохімічних методів, в
плані організації процесу і конструкційних матеріалів для електролізера, є
діафрагмовий метод отримання гідроксиду натрію.Розчин кухонної солі в
діафрагмовий електролізер безперервно подається в анодний простір і протікає
через, як правило, сталеву катодну сітку на азбестовій діафрагмі, в яку, інколи,
додають невелику кількість полімерних волокон. [24,
с 257]
У багатьох конструкціях електролізерів катод
повністю занурений під шар аноліту (електроліту з анодного простору), а водень,
що виділяється на катодній сітці, відводиться з під катода за допомогою
газовідвідних труб, не проникаючи через діафрагму в анодний простір завдяки
протитечії.
Протитечія - дуже важлива особливість будови
діафрагмового електролізера. Саме завдяки протилежному потоку направленому з
анодного простору в катодний через пористу діафрагму стає можливим роздільне
одержання лугів і хлору. Протиточний потік розраховується так, щоб протидіяти
дифузії і міграції OH- іонів в анодний простір.
Анод: 2Cl-- 2е- Cl2 - основний процесс (2.4)
H2O - 2e- O2 + 4H+ (2.5)
СlО-+ 3Н2О - 6Е-? 2СlО3-+ 4Сl-+ 1,5O2 ? + 6Н+ (2.6)
Катод: 2H2O + 2e H2 + 2OH-- основний процес
(2.7)
СlО-+ Н2О + 2е-? Сl-+ 2ОН-
(2.8)
СlО3-+ 3Н2O + 6е Сl-+ 6OН,
(2.9)
Як анод в діафрагмових електролізерах може
використовуватися графітовий або вугільний електроди. На сьогодні їх в
основному замінили титанові аноди з окисно-рутенієвим-титановим покриттям або
інші маловитратні аноди. [25,
с 319]
На наступній стадії електролітичний луг упарюють
і доводять вміст у ньому каустичної соди до товарної концентрації 42-50% мас.
відповідно до стандарту.Кухонна сіль, сульфат натрію та інші домішки при
підвищенні їх концентрації в розчині вище їх межі розчинності випадають в осад.
Розчин їдкого лугу декантують від осаду і передають в якості готового продукту
на склад або продовжують стадію упарювання до отримання твердого продукту, з
наступним плавленням або грануляцією.Зворотну кухонну сіль повертають назад в
процес, готуючи з неї так званий зворотний розсіл. Від неї, щоб уникнути
накопичення домішок в розчинах, перед приготуванням зворотного розсолу
відокремлюють домішки.Витрату аноліту заповнюють додаванням свіжого розсолу.
Свіжий розсіл перед змішуванням його зі зворотним розсолом очищають від
механічних суспензій і значної частини іонів кальцію і магнію. [26,
с 65]
Мембранний метод
Мембранний метод виробництва каустичної соди
найбільш енергоефективний, однак складний в організації та експлуатації.
З точки зору електрохімічних процесів мембранний
метод подібний до діафрагмового, але анодний і катодний простори повністю
розділені непроникною для аніонів катіонообмінною мембраною. Завдяки цій
властивості можливо отримувати більш чисті, ніж у випадку з діафрагмовим
методом, луги. Тому в мембранному електролізері, на відміну від діафрагмового,
не один потік, а два.У анодний простір надходить, як і в діафрагмовому методі,
потік розчину солі. А в катодний - католіт (32%-ий розчин каустичної соди). З
катодного простору випливає потік збідненого аноліту, що містить так само
домішки гіпохлорит- і хлорат-іони та хлор, а з анодного - луг і водень, які практично
не містять домішок і близькі до товарної концентрації, що зменшує витрати
енергії на їх випарювання і очищення.Каустична сода, що отримується за
допомогою мембранного електролізу, практично не поступається за якістю соді,
яка отримується за допомогою методу з використанням ртутного катоду і поступово
замінює луг, отримуваний ртутним методом. [27,
с 257]
Ртутний метод з рідким катодом
У ряду електрохімічних методів одержання лугів
найефективнішим способом є електроліз з ртутним катодом. Луги, отримані при
електролізі з рідким ртутним катодом, значно чистіші від отриманих діафрагмовим
способом (для деяких виробництв це критично, наприклад, у виробництві штучних
волокон можна застосовувати тільки високочистий каустик), а в порівнянні з
мембранним методом організація процесу при отриманні лугу ртутним методом
набагато простіша.Установка для ртутного електролізу складається з
електролізера, розкладача амальгами і ртутного насоса, об'єднаних між собою
ртутнопроводними комунікаціями.
Катодом електролізера служить потік ртуті, який
прокачується насосом. Аноди - графітові, вугільні або маловитратні. Разом з
ртуттю через електролізер безперервно тече потік живлячої кухонної солі.На
аноді відбувається окислення іонів хлору з електроліту, і виділяється хлор:
Cl-- 2е-- Cl20 - основний процес (2.10)-
H2O - 2e- O2 +4H+6СlО-+ 3Н2О - 6Е- 2СlО3-+ 4Сl-+
1,5O2 + 6Н+ (2.11)-
Хлор і аноліт відводяться з електролізера.
Аноліт, що виходить з електролізера, донасичують свіжим галітом, виділяють з
нього домішки, а також вимивають із анодів і конструкційних матеріалів, і
повертають на електроліз. Перед донасичуванням з аноліту видаляють розчинений у
ньому хлор. [28,
с 128]
На катоді відновлюються іони натрію, які
утворюють слабкий розчин натрію в ртуті (амальгаму натрію):
+ + е
= Na0 (2.12)-
nNa+ + nHg- = Na + Hg
(2.13)-
Амальгама безупинно перетікає з електролізера в
розкладач амальгами. У розкладач також безперервно подається високо очищена
вода. У ньому амальгама натрію в результаті самовільного хімічного процесу
майже повністю розкладається водою з утворенням ртуті, розчину каустику і
водню:
каустичний сода якість очищення
Na + Hg + Н2O = NaOH + 1/2Н2 + Hg (2.14)-
Отриманий таким чином розчин каустику, що є
товарним продуктом, практично не містить домішок. Ртуть повністю звільняється
від натрію і повертається в електролізер. Водень відводиться на очистку. [28,
с.128]
2.3.2 Проблемні стадії
виробництва каустичної соди
При діаграфмовому методі можуть
виникати певні технологічні проблеми зумовлені особливістю
будови діафрагмового електролізера. Якщо
величина протитоку недостатня, тоді в анодному просторі у великих кількостях
починає утворюватися гіпохлорит-іон (ClO-), який, потім, може окислюватися на
аноді до хлорат-іона ClO3-. Утворення хлорат-іона серйозно знижує вихід по струму
хлору і є основним побічним процесом в цьому методі отримання каустичної соди.
Так само шкодить і виділення кисню, яке до того ж, веде до руйнування анодів і,
якщо вони з вуглецевих матеріалів, попаданню в хлор домішок фосгену.При
мембранному методі необхідна складніша система очистки кінцевого продукту.
Однак вихідний розчин солі (як свіжий так і оборотний) і вода попередньо
максимально очищуються від будь-яких домішок. Таке ретельне очищення
визначається високою вартістю полімерних катіонообмінних мембран та їх
вразливістю до домішок в живильному розчині. [29,
с.357]
Крім того, обмежена геометрична форма а так само
низька механічна міцність і термічна стійкість іонообмінних мембран багато в
чому визначають порівняно складні конструкції установок мембранного
електролізу. З тієї ж причини мембранні установки вимагають найбільш складних
систем автоматичного контролю та управління
При ртутному методі з рідким катодом можуть
виникати проблеми з повним очищенням розчину лугу, який відділити від залишків
ртуті практично неможливе, тому цей метод поєднаний з витоками металевої ртуті
та її парів. [29,
с.357]
Сааме тому існують зростаючі вимоги до
екологічної безпеки виробництв, а дорожнеча металевої ртуті ведуть до
поступового витіснення ртутного методу методами отримання каустичної соди з
твердим катодом, особливо мембранним методом. [29,
с.357]
2.4 Порівняльна
характеристика технологічних схем виробництва каустичної соди
При проведенні порівняльної характеристики
технологічних схем виробництва каустичної солі видно, що основа для технологій
виробництва є практично однакова. Відмінності в методах виклакані розбіжностями
в технічних можливостях минулого та сьогодення. [30,
с.345]
Сьогодні є можливим не лише виробництво
каустичної солі та утилізація його відходів, а і використання відходів у інших
виробництвах.
Наприклад у діафрагмовому методі виробництва
каустичної солі утворюється хлор. Отриманий хлор відділяється від парів води,
компримується і подається або на виробництво хлорвмісних продуктів, або на
зріджування.
Також діафрагмовий метод є відносно дешевим,
завдяки відносній простоті. Саме тому він широко використовується у
промисловогості.
Також Україна може пишатися наявністю
мембранного електролізу в місті Калуш. Це виробництво введене в експлуатацію в
2010 році і поки є лідером за якістю отриманої каустичної соди. Хлор, який
неодмінно отримується як супутній продукт, в Калуші використовується для
хлорування етилену, за допомогою чого отримують вінілхлорид, який потім
полімеризують і отримують високоякісну полівінілхлоридну смолу. Так у наших
домівках з’являються надійні та довговічні металопластикові вікна та двері. [31,
с.257]
РОЗДІЛ 3. ТЕХНОЛОГІЧНІ ПРОЦЕСИ
ОХОРОНИ ДОВКІЛЛЯ ПРИ ВИРОБНИЦТВІ КАУСТИЧНОЇ СОДИ
3.1 Аналіз потоків
відходів від виробництва каустичної соди
.1.1 Газові відходи
В сучасному світі більше всього газових відходів
виникає внаслідок виробництва каустичної соди ртутним методм. Основна кількість
ртуті (до 5 г / т Cl2 ) захоплюється потоком водню. Очищення ведуть в 2 стадії
. Перша, фізична, передбачає охолодження газу від 125 до 50 С. При цьому
концентрація ртуті знижується до 15 мг/м3. Друга, фізико - хімічна стадія
включає:1) абсорбцію в тарілчастих і насадок колонах наступними абсорбентами :
Розчинами NaCl ( 250 г / л) і Cl2 (1 г / л) при
рН = 2 - 4;
Розчинами NaCl і NaOCl при рН = 6 - 7;
Розчинами лугу і діетилдитіокарбамату, рН = 11 .
) адсорбцію на активованих вугіллі і цеолітах,
просочених мінеральними кислотами, сіркою, йодом, сульфідами, Тіоціанати, тіо
семікарбазідамі ; залишкова концентрація ртуті в газах не більше 10 мкг/м3 .
До теперішнього часу серйозною проблемою було
скорочення (виключення ) викидів в атмосферу токсичних газів: оксиду вуглецю і
діоксиду сірки, які утворюються в кількості 27 кг СО і 5,6 кг SO2 на 1 т соди.
Для цієї мети розроблено апарат регенеративного типу для допалювання токсичних
газів, що складається з двох реакційних камер, сполучених між собою через
камеру згоряння. У камері згоряння відбувається інтенсивна турбулізація потоку
технологічного газу, що містить токсичні горючі компоненти і незначна кількість
(1-2 %) кисню. Інтенсивна турбулізація забезпечує попереднє дожиганяя домішок
(зокрема, смолистих з'єднань) на розвиненою нагрітої поверхні перед подачею
газової суміші на каталізатор. В якості каталізатора застосовують боксит, на
поверхні якого відбувається безполуменеве спалювання оксиду вуглецю, сірководню
та інших токсичних горючих домішок при температурі 750-800 ° С. Процес
проводять у нестаціонарному режимі при періодичних змінах напрямку подачі в
реакційні камери знешкоджує газу з низькою температурою. Найкращим є режим, при
якому не витрачається природний газ, а необхідні температури в зонах
підтримують за рахунок тепла, що виділяється при допалювання газів.
Апарат випробуваний у процесі знешкодження
оксиду вуглецю в відходять газах вапняно -випалювальних печей. При вмісті в
технологічному газі 1,5-2,3 % СО апарат працює в автотермічний режимі.
Відходять гази являють собою вторинні енергетичні ресурси. [30,
с.129]
3.1.2 Рідкі відходи
Для фільтровою рідини пропонується отримання
хлористого амонію.
При виробництві хлориду амонію частину або весь
потік фільтровою рідини після барабанних вакуум- фільтрів спрямовується на
дегазацію (вузол XII ), яка здійснюється парою ( розділ 3 рис. 3.2).
Десорбувати з рідини в парогазовий потік аміак і діоксиду вуглецю надходять на
абсорбцію II .
На абсорбцію у відділення II додатково подається
газоподібний аміак від аміачно - випарної установки для заповнення убутку
аміаку, який виводиться з циклу хлоридом амонію, розчиненим у дегазованої
фільтровою рідини. Дегазована фільтрувальна рідина направляється на випарки
(відділення XIII ), після якої утворюється соляна пульпа проходить стадію
відстоювання і центрифугування ( XIV), сушіння і прокалки кухонної солі (XV ) .
. [31, с.275]
Соляний матковий розчин подається на вакуум -
кристалізацію ( XVI) ; пульпа хлориду амонію надходить далі на відстоювання і
центрифугування (XVII); хлорид амонію проходить сушку, грануляція (XVIII ) і
направляється на склад готової продукції .
Існує і пропонується кілька способів утилізації
дістіллерной рідини : перше - переробка освітленої дістіллерной рідини, яка
полягає в отриманні хлориду кальцію, друге - після відповідної підготовки
закачування дістіллерной рідини в нафтові свердловини, третє - отримання з
дістіллерной рідини хімічно осадженого карбонату кальцію . [31,
с.357]
При виробництві СаСl2 весь потік дістіллерной
суспензії ( рис. 3.2 ) або його частина піддається попередній карбонізації і
далі надходить на відстоювання від зважених часток ( XIX) . Шлам з відстійника
направляється для подальшої переробки (стадія XXIV), а освітлений розчин
зливається в ємність (XX), в яку подають затравки з активного сульфат кальцію
для запобігання інкрустування випарної трехкорпусние прямоточною батареї.
Дістіллерной рідина упарюється до досягнення концентрації хлориду кальцію 18%
мас . У другій трехкорпусние прямоточною батареї (стадія XXI) дістіллерной
рідина упарюється до концентрації хлориду кальцію 38% мас, з виділенням
основної маси кухонної солі. Освітлений 38 %-ий розчин розчин хлориду кальцію
подається на вакуум - кристалізатор (стадія XXII), в якому відбувається
утворення 40%- го розчину хлориду кальцію і виділення хлориду натрію. Далі
розчин подається в апарат XXIII, де упарюється з утворенням плаву, що містить
72 % хлориду кальцію. Після чого плав чешуіруется, гартується, сушиться,
охолоджується і направляється на склад готової продукції. [31,
с.357
Спосіб підготовки дистильованої рідини,
використовуваної для закачування в нафтові свердловини, включає наступні
стадії:
Відстій суспензії в накопичувачі - " біле
море " ;
Розбавлення відгалужень дістіллерной рідини
водою з метою зняття пересичення по гіпсу ;
Карбонізація розведеної дістіллерной рідини
газом вапняних печей у присутності ретурного шламу ;
Відстоювання і транспортування
прокарбонізарованной дістіллерной рідини.
Описаний спосіб підготовки дозволяє отримувати
для заводнення нафтових пластів дістіллерной рідина наступного якості:
Відсутність OH - іонів, які з Fe2 + і Mg2 +
разом з утворюють нерозчинні опади, здатні кальматіровать пласти ;
Відсутність зважених і емханіческіх домішок у
кількостях, що перевищують гранично допустиму концентрацію ;
Відсутність пересичення по гіпсу .
Дістіллерна рідина (вміст твердої фази 22,75
г/дм3) з виробництва кальцинованої соди надходить у відстійник при температурі
363-368 К. Згущена тверда фаза ( шлам) із співвідношенням Т: Ж = 1:2
відкачується в шламонакопичувач, а освітлена частина надходить у відповідний
збірник.
Надмірна матковий розчин виробництва очищеного
карбонату натрію з температурою 333-348 До подається до відповідного збірник.
Відгалуження частина дістіллерной рідини і надмірна матковий розчин змішуються
в реакторі - осаджувачами протягом 3 хвилин при їх одночасному змішуванні при
температурі 353-358 К.
Отримана суспензія CaCO3 подається на
фільтрування, а діоксид вуглецю, отриманий після розкладання кислої солі
кальцію виводиться з реактора у виробництво соди. Отриманий осад CaCO3
відмивається від іонів хлору і фільтрується на камерних фільтрпрессах . Після
чого отриманий фільтрат і промивні води відкачуються на розсоломпромисел .
Промитий осад CaCO3 висушується в стрічкової
сушарці за допомогою топкових газів, а потім прямує на подрібнення в
дезінтегратор, звідки на розсів . Затарювання готового продукту здійснюється в
шнекової розфасовочной машині . Отриманий продукт CaCO3 відповідає вимогам ГОСТ
8253-79 . [31, с.357]
Є в літературі дані з переробки дістіллерной
рідини в пероксид кальцію CaO2, який маю широку область застосування.В області
охорони навколишнього середовища його можна використовувати при очищенні води
від катіонів заліза, миш'яку, марганцю, цинку, хрому і міді . [32,
с.103]
Також пероксид кальцію можна використовувати в
каталізаторі для очищення промислових і побутових стічних вод від
нафтопродуктів і для очищення стічних вод містять органічні барвники. Очищення
шкідливих газових викидів хімічної промисловості від діоксиду сірки та оксидів
азоту може бути забезпечена суспензією містить суміш пероксиду і гідроксиду
кальцію в співвідношенні 1:1. Також можна здійснити і очищення газової суміші
від формальдегіду. Пероксид кальцію застосовують у знешкодженні радіоактивних
відходів змінного складу. Його використовують і для знезараження мулу побутових
міських стоків [32, c. 13]
В органічному синтезі пероксид кальцію
використовується як каталізатор для окислення изопропилбензола до α
- кумулгідроперекісі
і для отримання полісульфідів етилену, пропілену, бутилена . Він також
використовується в якості промотору оксиду срібла, уживаного в якості
каталізатора в процесі окиснення етану до оксиду етилену, діоксиду вуглецю і
води. Також запропоновано використовувати пероксид кальцію для стабілізації
вулканізованих сополімерів ізобутілену і поряд з пероксидом стронцію в процесі
вулканізації бутилкаучуку .
Пероксид кальцію використовують як джерело кисню
в алюмотермического та інших металургійних процесах . Його також використовують
при рафинировании металів шлаки, що містять сульфіди і для дефосфорізаціі
сталі. [32, c. 13]
3.1.3 Тверді відходи
До твердим відходів содового виробництва
відносяться: . [33, c. 152]
Шлам рассолоочісткі;
Шлам дистиляції;
Відходи гасіння вапна і вапняного пилу
виробництва вапна та гідратованої вапна.
Розглянемо коротко по порядку запропоновані
технології
Технологія утилізації шламів рассолоочісткі
Для зменшення кількості шламу пропонується
рассолоочістку проводити з поетапним осадженням з розчину Mg (OH) 2, CaCO3,
5CaSO4 · Na2SO4 · H2O. Відзначається, що зазначені продукти виділяються в досить
чистому вигляді і можуть бути перероблені в цільові продукти.
При класичній рассолоочістке тожу можна виділити
з шламу компоненти. При цьому процес переробки шламу можна розділити на кілька
стадій:
Часткова нейтралізація шламу;
Карбонізація частково нейтралізованого шламу;
Фільтрування карбонізованого суспензії і
промивання осаду крейди;
Отримання основного карбонату магнію.
В результаті цієї технологія на ї тонну соди
можна отримувати 2,2 · 10-3 т основного карбонату магнію, 0,6 м3 очищеного
розсолу NaCl, 1,3 · 10-3 т хімічно осадженої крейди. [33, c.
152]
3.2 Впровадження
природоохоронних технологій у виробництві каустичної соди
.2.1 Огляд та аналіз
існуючих технологій очищення каустичної соди
З дистильованої рідини можна
витягати CaCl2 і NaCl. При цьому кухонну сіль можна використовувати як харчову
або повернути назад на виробництво . Організація збуту хлориду кальцію
складніша проблема, так як відсутній великий споживач цього продукту.
.
Останнім часом була показана, що при додаванні CaCl2 в цементну шихту можна
знизити температуру випалу на 350-500 ОС. Це дозволяє на 30 % зменшити витрату
палива і збільшити продуктивність випалювальних печей. Цементний клінкер, що
утворюється при більш низькій температурі, легше подрібнюється, а на його
основі можна отримати бетони більш високих марок. [33, c.
152]
З метою переробки дистильованої
рідини в товарні CaCl2 і NaСl її освітлюють і очищають від сульфат - іонів,
після чого піддають випаровуванню . У результаті цього в осад спочатку випадає
хлорид натрію, його відділяють, промивають і віджимають на центрифугах . Що
залишився paствоp 32-38 %-ного СаCl2 в цистернах направляють споживачеві . Якщо
необхідний твердий продукт, то розчин упарюють так кінця, при цьому з нього
додатково випадають кристали NaCl, які виділяють . Отримується в результаті
упарювання плав охолоджують і чешуіруют . Продукт являє дигідрат хлориду
кальцію в якому міститься 76-80 % CaСI2 . Чешуірованіе здійснюється на
металевому барабані, що обертається, охолоджуваному зсередини водою.Слід мати
на увазі, що збут CaCl2 відносно невеликий.
Аміачний спосіб отримання
кальцинованої соди можна істотно спростити і перетворити практично в
безвідхідний, якщо відмовитися від стадії регенерації маткової ( фільтровою )
рідини . Відомо, що в ці рідини на кожну тонну Na2CO3 припадає 1 т NH4Cl .
Виділити хлорид амонію з фільтровою рідини в тверду фазу можна упариванием, або
висолюванням за допомогою NaCI . Метод упаривания більш простий і не пов'язаний
з витратою твердого NaCl для висолювання . [33, c.
164]
Метод запарювання фільтрувальної
рідини з метою отримання крім Nа2СО3 хлориду амонію і NaC1 називають
модернізованим аміачним методом ( « дуал »). Цим методом, в Японії виробляють
да 900 тис. т / ' гад NH4CI . У відповідності з цим методом з фільтровою рідини
спочатку відганяють СО2 і NН3 ( шляхом розкладання NН4НСО3 ), після чого її
піддають випаровуванню . Так як розчинності NH4Cl і NaCl при різних
температурах різні, то зазначені солі можна розділити в процесі упарювання .
Спочатку з розчину кристалізується NaCl який відокремлюють і або повертають у
процес, або видають в якості готової продукції . У зв'язку з цим в
модернізованому аммиачном методі ступінь використання NaCl становить майже
100%. Залишився розчин піддають кристалізації у вакуумі ; випав NH4Cl
відокремлюють на центрифузі, сушать і пресують з подальшим помелом і розсівом
готового продукту. [33, c.
164]
3.2.2 Вибір та
обґрунтування технологій очищення каустичної соди
Недоліком переробка дистильованими
речовинами є те, що в її процесі виділяється хлорид кальцію. А організація
збуту хлориду кальцію є досить складніша проблема, так як відсутній великий
споживач цього продукту, не зважаючи на те, що хлорид кальцію маже бути
використаний в хімічній промисловості як осушувача газів і рідин для знепилювання
грунтових і щебеневих доріг, у практиці вуглезбагачення для меліорації
солонцюватих грунтів, як добавка до бетонів. Крім того, на випарювання води з
дістіллерной рідини необхідно затратити багато енергії.
Позитивним
аспектом використання аміачного способу виготовлення каустичної соди є те, що
великі кількості, одержуваного при цьому хлориду амонію, мають велиликий попит
оскільки ; він може бути використаний як азотного добрива під рис і кукурудзу.
[34, c. 198]
Метод запарювання фільтрувальної
рідини викликає цікавість у споживачів, проте повний перехід на таку технологію
виробництва каустичної соди є неможливим, оскільки кількості одержуваного при
цьому NH4Cl значно перевищує рівень потенційного попиту.
Виходячи з усього вище описаного,
можна зробити висновок, що найкращим методом очищення каустичної соди на
сьогоднішній день є аміачний. Оскільки аміачний метод можна модернізувати, якщо
замість хлориду натрію в якості сировини застосувати сильвініт . Для цього
фільтрову рідина насичують аміаком да змісту 65 г / л NНз і діоксидом вуглецю
да змісту 70 г / л СО2. Отриманою рідиною обробляють сильвинит при температурі
мінус 10 ° С. При цьому з маткової рідини виділяється NH4Cl і в ній
розчиняється міститься в сильвините хлорид натрію. Хлорид калію сильвініту залишається
в осаді і разом з випали кристалами NH4Cl утворює продукт, званий потазотом, в
якому міститься 30 % KCl і 70 % NH4Cl . Після відділення потазота залишився
розсіл направляють на подальші операції для отримання кальцинованої соди. За
цією технологією на 1т Nа2СОз отримують 1,4 т потазота, який може бути
використаний в якості мінерального добрива, що містить одночасно азот і
калій.Оскільки хлорид амонію як азотне добриво відрізняється невисокою якістю,
ведуться дослідження по регенерації з нього аміаку з одночасним отриманням
товарного хлору або соляної кислоти. Для отримання газоподібного хлору твердий
NH4Cl обпалюють з оксидом магнію при температурі близько 350 ° С:
[34, c. 198]
NH4Cl + MgO = MgCl + 2 NН3 + H2O
(3.1)
Аміак повертається у виробництво, а
MgCl2 окислюють при 650 ° С для отримання газоподібного хлору :
MgCl2 + О2 = 2 MgO + 2 Cl2 (3.2)
Оксид магнію повертається в процес,
а хлор є товарним продуктом.
Розроблено видозмінений варіант
аміачного методу отримання кальцинованої соди шляхом використання як сировини
не вапняку, а доломіту - CaCO3 * MgCO3 . При його випалюванні отримують суміш
MgO і CaO . При обробці фільтровою рідини такої суміші NH4Cl вступає у
взаємодію з CaO, тому на стадії дистиляції отримують дістіллерной рідину, що містить
NaCl і CaCl2, а гідратований MgO залишається в осаді. Цю суспензію піддають
карбонізації : [34, c.
198]
+ MgO + СО2 = MgCl2 + CaCO3 (3.3)
Після видалення карбонату кальцію з
утворюється суспензії розчин складається в основному з MgCl2 і NaCl. Цей розчин
упарюють, причому спочатку в осасдок випадає кухонна сіль, яка може бути
повернута у виробництво, а потім кристалізується MgCl2 * 6 H2O . Цей продукт є
хорошим сировиною для отримання металевого магнію. Одним із шляхів утилізації
дістіллерной рідини є організація комбінованого виробництва шляхом регенерації
аміаку оксидом магнію з подальшим використанням виділяється HCl . У цьому
процесі оксид магнію не використовується, а рециркулює, виробничі втрати
компенсуються введенням його свіжих порцій. Процес може бути здійснений за
трьома напрямками . [34, c.
198]
. Отримання кухонної солі і
концентрованого HCl . Хімізм процесу :
( OH ) 2 + 2 NH4Cl > MgCl2 +2 NH4
OH (3.4)+ H2O > MgO + 2 HCl (3.5)OH > NН3 + H2O (3.6)
Упариванv
розчину MgCl2 і NaCl, т.е дістіллерной рідини, отримують NaCl, який після
промивання і сушіння є товарним продуктом.
. Отримання хлориду кальцію та
харчової кухонної солі. У доповненні до розглянутого вище вапняну дрібниця
обробляють газоподібним HCl :
+ 2 HCl > CaCl2 + СО2 + HO (3.8)
Зміст CaCl2 становить 94 %; СОз
повертають на карбонізацію .
. Використання соляної кислоти для
розкладання фосфатів з метою отримання преципітату і хлориду кальцію :
( PO4 ) 3 + 10 HCl > 3H3PO4 +5
CaCl2 + HF (3.9)+2 HCl > CaCl2 + СО3 + H2O (3.10)PO4 + CaCO3 + H2O >
CaHPO4 * 2H2O + СО2 (3.11)
Отримання Na2CO3 за цими схемами
дозволяє знизити собівартість соди в l, 6 рази . Наприклад розрахунковий річний
: економічний 'ефект виробництві 675 тис. т Na2CO3 ; 330 тис. т повареної солі
і 675 тис. т. хлориду кальцію (100% ) складе 45,6 млн. руб. на рік у порівнянні
з роздільним отриманням цих продуктів ; ця ж величина при тому ж обсязі
виробництва соди і 337 тис. т, 656 тис.т. кормового преципітату, 923 тис. т.
хлориду кальцію становить 53,5 млн. руб / рік .
Були проведені роботи по заміні
аміаку в методі Сольве деякими амінами, знижувальними розчинність NаНСО3 . У
зв'язку з цим ступінь використання хлориду натрію в такому процесі збільшується
з 70-75 до 92-95 % і зменшується кількість NaCI, скидного з дістіллерной рідиною.
Проте використання амінів не знайшло
практичного застосування через високу їх вартість .
[34, c. 198]
SO4 +2 NН3 + 2H2O + СО3 - 2 NaHCO3 +
( NH4 ) 2SO4 (3.12)
Відходом, одержуваних за цією
технологією є не CaCl2, який не має широкого збуту, а сульфат амонію, широко
застосовується в сільському господарстві азотне добриво. Однак цей процес
виявився більш складним і дорогим.
Деякий інтерес представляє процес, в
якому в якості вихідної сировини застосовують не NaCl, а нітрат натрію. Процес
протікає па рівнянням: [34, c.
198]
+ NН3 + H2O + СО3 = NH4NO3 + NaHCO3
(3.13)
Як видно, крім кальцинованої садки в
цьому випадку можна в якості побічного продукту отримувати аміачну селітру, яка
є хорошим азотним добривом. Однак застосування цього, по суті безвідходного
методу стримується обмеженими запасами нітрату натрію.
Ступінь використання дістіллерной
рідини в промисловому масштабі досить незначна, і тому вона зазвичай
направляється в шламонакопичувачі, або так звані «білі моря».
Шламонакопичувачі - спеціально
підготовлені площі на поверхні землі, обнесені дамбами висотою 20 м. Зазвичай
вони займають значні земельні площі, крім того є джерелами інтенсивного
забруднення підземних і поверхневих вод хлоридами натрію і кальцію. Утворені у
великих кількостях відходи содового виробництва обмежують подальший розвиток
діючих содових заводів. [34, c.
198]
РОЗДІЛ 4. РОЗРАХУНКОВА ЧАСТИНА
4.1 Розрахунок
матеріальної бази балансу процессу
Процес виробництва каустичної соди
можна відобразити у вигляді сумарних реакцій :
+ NH3+CO2+H2O NaHCO3+NH4CL (4.1)
NaHCO3 Na2CO3+CO2+H2O (4.2)
Вихідні дані:
M(NaCl)=23+35,5=58,5
кг/кмоль;
M(NaHCO3)=23+1+12+16·3=84
кг/кмоль;
M(NH3)=14
+1·3=17 кг/кмоль;
M(CO2)=12
+16·2=44 кг/кмоль;
M(H2O)=16
+1·2=18 кг/кмоль,
M(NH4Cl)=14
+1·4+35,5=53,5 кг/кмоль.
Розрахунок можна вести за пропорції,
де зліва - реагент, праворуч - продукт.
NaCL NaHCO3 (4.3)NaHCO3
(4.4)NaHCO3 (4.5)
H2O
NaHCO3 (4.6)
Отже, масса NaCl, необхідна для
реакції:
NaCL=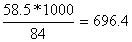 кг/моль
кг/моль
Масса NH3
необхідна для реакції:
NH3=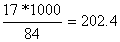 кг/моль
кг/моль
Масса CO2
необхідна для реакції:
CO2=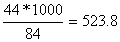 кг/моль
кг/моль
Масса H2O
необхідна для реакції:
H2O= кг/моль
кг/моль
Тоді маса хлориду амонію, що утворився
дорівнює:
NaHCO3 =
696.4+202.4+523.8+214.3 -1000 = 636.9 кг/моль.
Тепер розрахуємо матеріальний
баланс при а1=95%
NaHCO3= Na2CO3+CO2+H2O
(4.7)
Знайдемо число моль NaHCO3,
яке відповідає 1000 кг:
NaHCO3 = 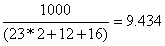 кг/моль
кг/моль
З рівняння реакції (2) число
моль кожного продуктів дорівнює числу молей Na2CO3 і одно 9,434 кмоль при a2 =
100%, але у нас 95%
Тоді маси продуктів і
продуктів за рівнянням (2) рівні:
CO2=9.434
* 44 = 415.1 кг/моль
H2O =
9.434 * 18 = 169.8 кг/моль
NaHCO3 =  кг/моль
кг/моль
Маса непрореагованого NaHCO3
(відходів) загалом складає:
NaHCO
непрореаговане = 1668,4*(1-0,95) = 83,4 кг/моль
Отже відповідно до
розрахунків бачимо, що при а1 = 100%, маса NaHCO3
становить 636,9 кг/моль, непрореагованої частини речовини немає.
При а1=а2=95%, маса NaHCO3
становить 1668,3 кг/моль, Частина непрореагованої величини складає 83,4 кг/моль
(тобто 5% від загальної маси)
4.2
Розрахунок (оцінка) кількості відходів
Відповідно до попередніх
розрахунків вираховуємо частини проредагованих реагентів.
Маси реагентів дорівнюють:
NaCL= кг/моль
кг/моль
NH3=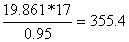 кг/моль
кг/моль
CO2=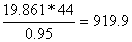 кг/моль
кг/моль
H2O=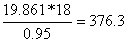 кг/моль
кг/моль
NaHCO3 =
19,861*53,5=1062,6 кг/моль.
Відповідно маса
непрореагованих речовин становить:
NaCLнепрореаговане=122,3*0,05
= 61,15
кг/моль
NH3непрореаговане=
355,4*0,05 = 17,77 кг/моль
CO2непрореаговане=
919*,9*0,05 = 46
кг/моль
H2Oнепрореаговане=
376,3*0,05 = 18,8
кг/моль
Отже, кількість
непрореаговних речовин у складі каустичної соди дорівнює: NaCL -
61,15 кг/моль, NH3 - 17,77 кг/моль, CO2 -
46 кг/моль, H2O -
18,8 кг/моль. Величина загальної речовини, що не прореагувала становить 83,4
кг/моль.
ВИСНОВКИ
Сьогодні виробництво
каустичної соди досить поширено у промисловості України, оскільки вона має
широкий спектр використання. застосовується в безлічі галузей промисловості і
для побутових потреб:
)Каустична сода застосовується у
целюлозно-паперовій промисловості для делігніфікації (сульфатний процес)
целюлози, у виробництві паперу, картону, штучних волокон, деревно-волоконних
плит;
)Для омилення жирів при виробництві
мила, шампуню та інших миючих засобів. У давнину під час прання у воду додавали
золу, і, мабуть, господині звернули увагу, що якщо зола містить жир, що
потрапив у вогнище під час приготування їжі, то посуд добре миється. Про
професію миловара (сапонаріуса) вперше згадує приблизно в 385 р. н. е. Теодор
Прісціанус. Араби варили мило з олій та соди з VII століття, сьогодні мила
виробляються тим же способом, що і 10 століть тому. В даний час продукти на
основі гідроксиду натрію (з додаванням гідроксиду калію, нагріті до 50-60
градусів Цельсія, застосовуються у сфері промислової мийки для очищення виробів
з нержавіючої сталі від жиру та інших масляних речовин, а також залишків
механічної обробки.
) У хімічних галузях промисловості -
для нейтралізації кислот і кислотних оксидів, як реагент або каталізатор в
хімічних реакціях, в хімічному аналізі для титрування, для травлення алюмінію і
у виробництві чистих металів, в нафтопереробці - для виробництва олій.
) Для виготовлення біодизельного
палива, яке одержують з рослинних масел і використовують для заміни звичайного
дизельного палива. Для одержання біодизеля до дев'яти масових одиниць рослинної
олії додається одна масова одиниця спирту (тобто дотримується співвідношення
9:1), а також лужний каталізатор (NaOH). Отриманий ефір (головним чином
лінолевої кислоти) відрізняється гарною займистістю, забезпечується високим
цетановим числом. Цетанове число умовна кількісна характеристика самозаймання
дизельних палив в циліндрі двигуна (аналог октанового числа для бензинів). Якщо
для мінерального дизпалива характерний показник у 50-52%, то метиловий ефір вже
спочатку відповідає 56-58% цетану. Сировиною для виробництва біодизеля можуть
бути різні рослинні олії: рапсова, соєва та інші, крім тих, у складі яких
високий вміст пальмітинової кислоти (пальмова олія). При його виробництві в
процесі етерифікації також утворюється гліцерин який використовується в
харчовій, косметичній та паперовій промисловості, або переробляється в
епіхлоргідрин за методом Solvay.
) В якості агента для розчинення
засмічень каналізаційних труб, у вигляді сухих гранул або в складі гелів.
Гідроксид натрію дезагрегує засмічення і сприяє легкому просуванню його далі по
трубі.
) У цивільній обороні для дегазації
і нейтралізації отруйних речовин, у тому числі зарину, в ребрізерах (ізолюючих
дихальних апаратах (ІДА), для очищення повітря, що видихається від вуглекислого
газу.
) Каустична сода також
використовується в поєднанні з цинком для фокусу. Мідну монету кип'ятять у
розчині гідроксиду натрію в присутності гранул металевого цинку, через 45
секунд, колір копійки стане сріблястим. Після цього копійку виймають з розчину
і нагрівають у полум'ї пальника, де вона, практично моментально стає «золотою».
Причини цих змін полягають в наступному: іони цинку вступають в реакцію з
гідроксидом натрію (в нестачі) з утворенням Zn(OH)42- - який при нагріванні
розкладається до металевого цинку і осідає на поверхні монети. А при нагріванні
цинк і мідь утворюють золотистий сплав - латунь.
) Каустична сода також використовується
для мийки прес-форм автопокришок.
) Каустична сода також
використовується для нелегального виробництва метамфетамінів та інших
наркотичних засобів.
) Деякі страви готуються із
застосуванням каустику: лютефіск - скандинавське блюдо з риби - сушена тріска
вимочується 5-6 днів в їдкому лузі і набуває м'якої, желеподібної консистенції;
брецели - німецькі рогалики - перед випічкою їх обробляють у розчині каустичної
соди, яка сприяє утворенню унікальної хрусткої скоринки.
) У косметології для видалення
ороговілих ділянок шкіри: бородавок, папілом.
Отже, як бачимо розвиток технологій
щодо виробництва каустичної соди є необхідним в умовах сучасного її
використання.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
1. Бикбулатов
И.Х., Насыров Р.Р., Даминев Р.Р., Бакиев А.Ю. Способ утилизации основного
отхода производства кальцинированной соды // Нефтегазовае дело, 2007. - С. 1-9.
2. Гончаров
А.П., Середа І.П. Хімічна технологія: Підручник для студентів вищих навчальних
закладів. - К.: Вища школа, 1979.
. ГОСТ
5100-85 Сода кальцинированная техническая. Технические условия. Дата введения
01.01.86.
4. ГОСТ
8253-79 Мел химически осажденный. Технические условия.
5. Загальна
хімічна технологія: Підручник/ В.Т. Яворський, Т.В. Перекупко, З.О. Знак, Л.В.
Савчук. - Львів: Видавництво Національного університету «Львівська
політехніка», 2005. - 552 с.
. Зайцев
И.Д., Ткач Г.А., Стоев
Н.Д. Производство соды. - М.: Химия, 1986. - 312 с.
7. Інвестиційна
пропозиція ПДП «Хімпром» стосовно виробництва каустичної соди. - Електронний
ресурс. - Режим доступу:
investatlas.kharkov.ua/data/file/.../Rekonstr_hlory_i_kaystuky_ukr.doc
8. Крашенинников С.А. Технология соды.
- М.: Химия, 1988.
9. Мельников
Е.Я., Салтанова В.П., Наумова А.М., Блинова Ж.С. Технология неорганических веществ
и минеральных удобрений: Учебник для техникумов. - М.: Химия, 1983. - 432 с.
10. Михайлова
Є.О. Одержання хімічно осадженого карбонату кальцію з відходів алмазного
виробництва: Автореф. дис. на здобуття наукового ступеня кандидата технічних
наук . - Харків. - 2006. - 20 с.
11. Мухленов И.П. «Основы химической
технологии». - М.: «Высшая школа», 1991.
12. Наркевич И.П. «Утилизация и ликвидация
отходов в технологии неорганических веществ». - М.: Химия, 1984.
. «Общая химическая технология и основы
промышленной экологии». Под ред. Ксензенко. - М.: «КолосС», 2003.
14. Основы
химической технологии./Под ред. И.П. Мухленова. - М.: Высшая школа, 1991. -463
с.
. Панасенко
В.А. Физико-химические основы получения кальцинированной соды с использованием
диэтиламина: Дис. … канд. техн. наук: 05.17.01 - Харьков, 1992. - 203 с.
16. Позин М.Е., Зинюк Р.Ю.
«Физико-химические основы неорганической технологии». - Л.: Химия, 1985.
17. Практикум
по общей химической технологии /Под ред. Мухленова И.П. М.: Высшая школа, 1973.
- 424 с.
. Производство
соды по малоотходной технологии: Монография/Ткач Г.А., Шапорев В.П., Титов В.М.
- Х.: ХГПУ, 1998. - 429 с.
. Расчеты
химико-технологических процессов /Под ред. И.П.Мухленова. М.: Химия. 1982 -248
с.
20. Родионов
А.Н., Клушин Н.С., Торочешников Н.С. Техника зашити окружающей среди. - М.:
Химия, 1989. - 512 с.
21. Сасс-Тисовский Б.А.«Производство
соды». - Л.: «Ленхимсектор», 1932.
22. Тимонин
А.С. Инженерно-экологический справочник: Учебное пособие : В 3 томах / А. С.
Тимонин .- Калуга : Изд-во Н. Бочкаревой, 2003.
23. Торочешников Н.С.,Родионов А.И,
Кельцев Н.В., Клушин В.Н. «Техника защиты окружающей среды». - М.: Химия, 1981.
24. Федотьев
П.П. Сборник Исследовательских работ. - Л.: 1936.
. Царева
З.М., Орлова Е.И. Теоретические основи химической технологии. Киев: Вища школа,
1986.-260 с.
26. Шарипов
Т. В. Утилизация отхода производства каустической соды с получением
фторосиликата натрия [Текст] / Т. В. Шарипов, А. И. Дельмухаметова, Г. С.
Кинзябулатова // Молодой ученый. - 2013. - №1. - С. 58-61.
27. Шокин
И.Н. и.н. и др. Технология соды. - М.: Химия, 1975, - с.288.
ДОДАТКИ
Додаток А.
Технологічна схема відділення двохступеневої каустифікації
