Химический анализ соды
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Государственное
образовательное учреждение высшего профессионального образования
«НАЦИОНАЛЬНЫЙ
ИССЛЕДОВАТЕЛЬСКИЙ
ТОМСКИЙ
ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Направление
- Химическая технология
Кафедра
- ОХТ
Отчёт
по лабораторной работе:
Химический
анализ соды
Студент гр.5А96
Рыбалко И.В.
Руководитель
Фролова И.В.
доцент каф.ОХТ
Томск
- 2012
Цель работы: освоение методов
химического анализа соды
Теоретическая часть
Наряду с минеральными кислотами и удобрениями
содопродукты - кальцинированная сода, каустическая сода и бикарбонат натрия
относятся к важнейшим видам продукции основной химической промышленности,
стекольной, металлургической, нефтеперерабатывающей, легкой и пищевой.
В древности источниками получения соды были
содовые озера и зола щелочесодержащих растений, произраставших в районе
Средиземного моря. В дальнейшем такие растения начали специально
культивировать, и в средние века они стали основным сырьем для получения так
называемой соды барилла, содержащей до 30% Na2CO3. К концу XVIII века выработка
соды основывалась в равной степени на использовании озерной соды в Египте и
получении соды из золы растений, распространенных преимущественно в Испании.
С развитием промышленности, главным образом
стеклоделия и мыловарения, а также в связи с трудностью доставки соды из Египта
и Испании в период наполеоновских войн возникла необходимость в организации
производства соды на базе минеральных ресурсов - солей натрия. К этому времени
был установлен химический состав соединений натрия и определены различия между
углекислым натрием и едким натром, а также содой и поташем. В 1775 году
Лебланом был предложен способ получения соды из поваренной соли, однако
стоимость получаемого продукта была велика, а качество невысокое. Развитие
химической науки в XIX веке дало возможность разработать новый процесс
получения соды, основанный на взаимодействии раствора хлорида натрия с
бикарбонатом аммония.
В настоящее время в мире производство соды
базируется на четырех способах ее получения: аммиачный, из нефелинов,
карбонизация гидроксидов натрия и из природной соды.
Кроме того, кальцинированная сода способна
образовывать термически неустойчивые кристаллогидраты различной степени
водности:
сода химический хлористый натрий
Na2CO3*H2O; Na2CO3*1,5H2O;
Na2CO3*4H2O; Na2CO3*7H2O; Na2CO3*10H2O
Согласно ГОСТ 5100 - 64, кальцинированная сода,
получаемая аммиачным методом, должна отвечать следующим требованиям к
химическому составу:
содержание Na2CO3 в прокаленном продукте, не
менее 99,0%
(что соответствует содержанию Na2CO3 в чистом
виде) 96,8%
потери при прокаливании,% не более 2,2%
содержание хлоридов в пересчете на NaCl
в прокаленном продукте, % не более 0,8%
содержание железа не более 0,02%
содержание сульфата натрия, Na2SO4, % не более
0,1%
Приборы, химическая посуда, химические реактивы:
муфельная печь, сушильный шкаф, песчаная баня,
весы аналитические;
эксикатор, бюксы, мерные колбы, пипетка,
фарфоровый тигель, платиновый тигель;
сода, дист. вода, индикатор фенолфталеин,
метилоранжевый индикатор, лакмусовая бумага, фильтр с белой лентой, фильтр с
синей лентой, Н2SO4 конц., НNO3 конц., аммиак, 0,5N раствор НСl, 0,5N раствор
AgNO3, железоаммонийные квасцы, 30 %-й раствор Н2О2, 5%-й раствор ВаСl2, КNO3
кристал., 1N раствор NH4Cl, 20%-й раствор сульфолициловой кислоты, 10%-й раствор
NH4ОН.
Порядок выполнения работы и расчет параметров
Определение потерь при высушивании
Навеску соды массой 2 г высушивают при
температуре
- 300°С до постоянного веса. Потери при
высушивании подсчитывают по формуле (3.1):
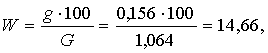 (3.1)
(3.1)
Определение общей щелочности
Навеску соды массой 5 г растворить в
50 мл дистиллированной воды и кипятить 15 мин. до полного растворения.
Полученный раствор количественно
перенести в колбу на 500 мл (через фильтр). Остаток на фильтре промыть горячей
дистиллированной водой до прекращения реакции на ион ОН - (проба с
фенолфталеином).
Фильтрат и промывные воды в колбе на
500 мл довести дистиллированной водой до метки.
Из колбы на 500 мл взять 50 мл в
коническую колбу, добавить 2-3 капли метилового оранжевого индикатора и
титровать 0,5N НСl до окраски изменения окраски индикатора из желтой в розовую.
Общую щелочность рассчитывают по
формуле (3.2):
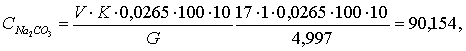 (3.2)
(3.2)
гдеV - количество 0,5N титрованного
раствора HCl, затраченного на титрование, мл;
К - коэффициент нормальности
рабочего 0,5N раствора HCl;- исходная навеска соды, г;
,0265 - титр точно 0,5N раствора,
выраженный в граммах Na2O.
Определение хлористого натрия
Из колбы на 500 мл отобрать в две
колбы по 50 мл. В одну из колб добавить 2-3 капли метилового оранжевого
индикатора и нейтрализовать концентрированной азотной кислотой по каплям. Заметить
число капель, при котором произойдет смена цвета.
Во вторую колбу без индикатора
добавить HNO3 конц. на одну каплю меньше.
Полученный раствор титровать 0,1N
AgNO3 в присутствии индикаторв К2СrО4 до появления красно-бурой окраски.
Процентное содержание (%) в соде
NaCl подсчитывают по формуле (3.3):
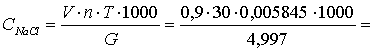 (3.3)
(3.3)
гдеV - количество рабочего 0,1N
титрованного раствора AgNO3 в мл, взятого для осаждения хлор-иона;-
аликвотность;- титр 0,1N раствора, выраженный в (г) NaCl (0,005845);- исходная
навеска соды в, г;
Выводы: освоили методы химического
анализа соды, провели высушивание, определение общей щелочности и хлористого
натрия.
1.