|
№
|
Азосоставляющая
(R)
|
выход,
%
|
Тпл,
°С
|
Rf
|
λ,
нм
|
lgε
|
M
|
|
1
|
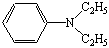 N,N-диэтиланилин N,N-диэтиланилин
|
75,61
|
272-273
|
0,87
|
552
|
3,89
|
445
|
|
2
|
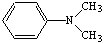 N,N-диметиланилин N,N-диметиланилин
|
80,65
|
275-276
|
0,77
|
538
|
3,87
|
417
|
|
3
|
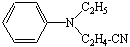 N-этил,N-цианэтиланилин N-этил,N-цианэтиланилин
|
71,56
|
268-269
|
0,82
|
525
|
4,25
|
470
|
|
4
|
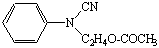 N-циан,N-ацетоксиэтиланилин N-циан,N-ацетоксиэтиланилин
|
50,33
|
171-172
|
0,69
|
510
|
4,37
|
500
|
|
5
|
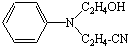 N-оксиэтил,N-цианэтиланилин N-оксиэтил,N-цианэтиланилин
|
69,06
|
255-256
|
0,70
|
520
|
3,59
|
486
|
|
6
|
 N-этил,N-оксиэтиланилин N-этил,N-оксиэтиланилин
|
72,73
|
234-235
|
0,75
|
545
|
3,72
|
461
|
|
7
|
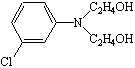 N,N-диоксиэтил-м-хлоранилин N,N-диоксиэтил-м-хлоранилин
|
65,57
|
269-270
|
0,64
|
537,5
|
3,93
|
511,5
|
Следующим этапом работы была попытка проведение
реакции роданирования 3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она:
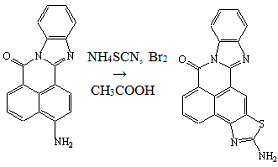
Реакцию проводили в течение 24 часов при
температуре не выше 30°С по общей методике [22]. В течение всего времени не
было отмечено появления новых пятен, которые свидетельствовали бы о прохождении
реакции. Из реакционной массы был выделен исходный
3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-он,
что было доказано хроматографически Rf=0,22
(элюент - хлороформ:ацетон 2:1), при помощи Тпл: при 290°С не
плавится (лит. [8] амин при 300°С еще не плавится) и смешанной пробы
выделенного продукта с исходным 3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-оном,
которая депрессии в температуре плавления не дала.
Целью проведения следующих реакций являлось
также получение сублимирующихся красителей.
Были изучены реакции взаимодействия
4-нитронафталевого ангидрида с алкиламинами, а именно, с трет-бутиламином и
октиламином:
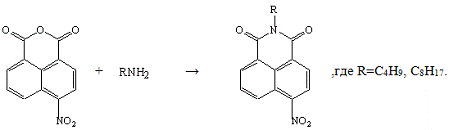
Реакция с трет-бутиламином не прошла, возможно,
из-за пространственных трудностей, связанных с разветвленной структурой
молекулы трет-бутиламина.
Реакция с октиламином прошла успешно. Для её
проведения, как и для реакции с трет-бутиламином, необходимо было в колбу
загрузить 4-нитронафталевый ангидрид, октиламин и уксусную кислоту при
перемешивании. Реакционную массу нагревают на кипящей водяной бане 4 часа и
оставляют на 3 суток. После чего выпадает непрореагировавшее исходное
соединение, что доказано с помощью ТСХ (Rf=0,22
(элюент - хлороформ)), Тпл =225-229°С (лит. [5] Тпл
=228-229°С) и смешанной пробы выделенного продукта с исходным 4-нитронафталевым
ангидридом, которая депрессии в температуре плавления не дала. Его
отфильтровывают, а фильтрат разбавляют по каплям водой до выпадения осадка.
Продукт отфильтровывают и сушат. Выход полученного 4-нитро-N-октил-нафталимида
составил 51,37%; Тпл =102-106°С; λmax(lgε)=350
нм (3,38); ИК-спектр:1560,1340(NO2).
Заключающим этапом были реакции взаимодействия
полученного 4-нитро-N-октил-нафталимида
с морфолином, гексаметиленимином и пиперидином в среде ДМСО:
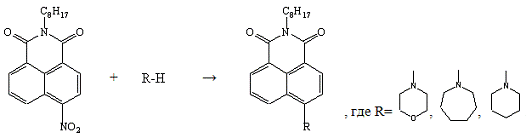
Ход проведения реакции одинаковый во всех трёх
случаях: смесь нагревали на кипящей водяной бане, в случае с морфолином и
пиперидином - 2часа, с гексаметиленимином - 5,5 часов. В результате были
синтезированы красители: 4-(N’-морфолино)-N-октил-нафталимид
с λmax(lgε),
нм: 398(4,03);
-(N’-гексаметиленимино)-N-октил-нафталимид
с λmax(lgε),
нм: 441(4,13);
-(N’-пиперидино)-N-октил-нафталимид
с λmax(lgε),
нм: 414(4,04).
Растворы 4-(N’-морфолино)-N-октил-нафталимида
и 4-(N’-пиперидино)-N-октил-нафталимида
люминесцируют.
Полученные красители предполагается испытать на
возможность использования их в качестве сублимирующихся красителей для
термопечати.
. Экспериментальная
часть
Опыт №1. Получение
о-фенилендиамина
В водяную баню помещают колбу ёмкостью 500 мл, с
обратным холодильником, мешалкой и термометром. Загружают 34,5 г (0,25 моль)
о-нитроанилина, 20 мл воды, 4,9 г NaOH
и 100 мл этанола. Реакционную смесь при размешивании нагревают до кипения (t=78°С),
перемешивают еще 20-30 минут и небольшими порциями прибавляют 65,0 г (1,00
моль) цинковой пыли. При загрузке цинковой пыли реакционная масса должна
равномерно кипеть, но не бурно. Затем еще кипятят 1 час, при этом раствор из
темно-красного становится почти бесцветным. Горячую массу фильтруют. Цинковый
шлам переносят в ту же колбу, добавляют 75 мл этанола, кипятят 15 минут, осадок
отфильтровывают, а фильтрат присоединяют к маточному раствору. Эту операцию
повторяют еще раз. Далее проводят перегонку, при этом отгоняют растворитель до
объема 60-75 мл. Остаток в колбе охлаждают в бане со смесью льда с поваренной
солью 30 минут и выпавшие коричневые кристаллы отфильтровывают, промывают 15мл
ледяной воды и сушат.
Получено: 20,0 г (74%) продукта; Тпл =96-98°С
(лит.[4] Тпл =97-100°С).
Для очистки полученный продукт помещают в
стакан, ёмкостью 250 мл, добавляют 80-85 мл горячей воды, 1,0 г Na2S2O4.
Раствор перемешивают при нагревании на водяной бане 10 минут, добавляют 3,0 г
активированного угля, кипятят 5 минут и профильтровывают горячий раствор через
складчатый фильтр. Фильтрат охлаждают, выпавшие светло-коричневые кристаллы
отфильтровывают, промывают 10 мл ледяной воды и сушат.
Получено: 18,2 г (68%) о-фенилендиамина; Тпл=100-101°С
(лит. [4] Тпл=101-102°С); Rf=0,10
(элюент - хлороформ); хорошо растворяется в горячей воде, этаноле, хлороформе.
Опыт №2. Получение
4-нитронафталевого ангидрида
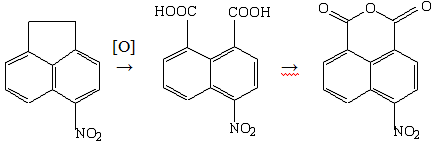
В трёхгорлую колбу ёмкостью 500 мл, снабжённую
мешалкой, термометром и обратным холодильником, загружают 20,0 г (0,10 моль)
4-нитроаценафтена, 100,0 г (0,34 моль) бихромата калия и 340 мл 18%-ной соляной
кислоты. Нагревают на кипящей водяной бане 5 часов. Охлаждают, осадок
отфильтровывают, отмывают водой и обрабатывают на кипящей водяной бане 5%-ным
раствором соды в течение 1 часа (до pH=9-10).
Раствор отфильтровывают от нерастворимого осадка, и фильтрат подкисляют 36%-ной
соляной кислотой (до pH=3-4).
Выпавшую в осадок 4-нитронафталевую кислоту отфильтровывают, промывают водой и сушат
до постоянного веса.
Получено: 11,0 г (42%) 4-нитронафталевой
кислоты.
Нагреванием 4-нитронафталевой кислоты в
"ледяной" уксусной кислоте получают 4-нитронафталевый ангидрид.
Получено: 8,0 г (33%) 4-нитронафталевого
ангидрида; Тпл=226-228°С (лит. [5] Тпл=228-229°С); Rf=0,22
(элюент - хлороформ); хорошо растворяется в хлороформе.
Опыт №3. Взаимодействие
4-нитронафталевого ангидрида с о-фенилендиамином
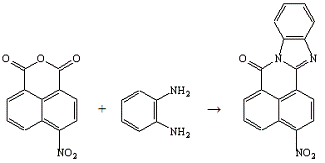
В трёхгорлую колбу ёмкостью 250 мл, снабжённую
мешалкой, термометром и обратным холодильником, загружают 5,0 г (0,02 моль)
4-нитронафталевого ангидрида, 2,2 г (0,02 моль) о-фенилендиамина, 250 мл
"ледяной" уксусной кислоты при перемешивании. Нагревают на кипящей
водяной бане 30 минут. Выпавший осадок, в виде хлопьев жёлтого цвета,
отфильтровывают, отжимают и сушат. Нагреванием в уксусной кислоте получают
чистый продукт.
Получено: 4,0 г (64%)
3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она,
после нагревания в уксусной кислоте 3,9 г (62%); Тпл=255-258°С (лит.
[7] Тпл=259-260°С); Rf=0,23
(элюент - хлороформ); хорошо растворяется в хлороформе. И
4-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-он
с Rf=0,51.
ИК-спектр, см-1 (вазелиновое масло):
1536;1340(-NO2);
1696(-OC-N=);
1520(C=N).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм: 406(4,09).
Опыт №4. Взаимодействие
3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
с
морфолином
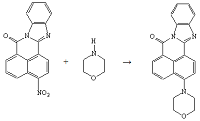
В круглодонную колбу ёмкостью 100 мл загружают
1,0 г (0,003 моль) 3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она,
2,9 мл морфолина, 23,5 мл ДМСО. Реакционную массу нагревают на песчаной бане (tбани=170°С)
10 часов до исчезновения 3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она.
За реакцией следят хроматографически. По окончании реакции массу охлаждают до
комнатной температуры, выпавший осадок отфильтровывают и сушат.
Получено: 0,8 г (75%) 3-(N-морфолино)-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она;
порошок жёлтого цвета; Тпл=251-252°С; Rf=0,07
(элюент - хлороформ); хорошо растворяется в хлороформе, ацетоне.
ИК-спектр, см-1 (вазелиновое масло):
1112(-C-O-C-);
1628(C-N-C).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм:
431(4,25).
Опыт №5. Взаимодействие
3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
с
пиперидином
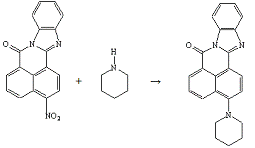
В круглодонную колбу ёмкостью 100 мл загружают 1,0
г (0,003 моль) 3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она,
2,9 мл пиперидина, 8,7 мл ДМСО. Реакционную массу нагревают на кипящей водяной
бане 2 часа до исчезновения исходного вещества. За ходом реакции следят
хроматографически. По окончании реакции, массу охлаждают до комнатной
температуры, выпавший осадок отфильтровывают и сушат.
Получено: 0,6 г (57%) 3-(N-пиперидино)-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она;
порошок оранжевого цвета; Тпл=228-229°С; Rf=0,11
(элюент - хлороформ); хорошо растворяется в хлороформе, ацетоне.
ИК-спектр, см-1 (вазелиновое масло):
1624(С-N-C).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм:
447(4,24).
Опыт №6. Взаимодействие
3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
с
гексаметиленимином
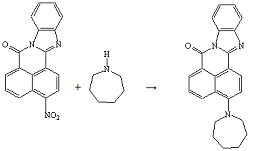
В круглодонную колбу ёмкостью 100 мл загружают
1,0 г (0,003 моль) 3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она,
2,9 мл, перегнанного при 138°С, гексаметиленимина, 8,7мл ДМСО. Реакционную
массу нагревают на кипящей водяной бане 2 часа. Продукт отфильтровывают и
сушат. Так как в полученном веществе есть исходное соединение, что было
выявлено хроматографически, то продолжают реакцию, добавив 2 мл
гексаметиленимина и 4 мл ДМСО. Нагревают на кипящей водяной бане ещё 3 часа. По
окончании реакции продукт отфильтровывают, сушат, промывают изопропиловым
спиртом, сушат.
Получено: 0,15 г (14%) 3-(N-гексаметиленимино)-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она,
в виде смолы, из которой после затирания с петролейным эфиром получили 0,1 г
(9%) порошка тёмно-коричневого цвета; Тпл=101-102°С; Rf=0,24
(элюент - хлороформ); хорошо растворяется в ацетоне.
ИК-спектр, см-1 (вазелиновое масло):
1648(С-N-C).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм:
471(4,01).
Опыт №7. Восстановление
3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
хлоридом
олова(II) в среде
соляной кислоты
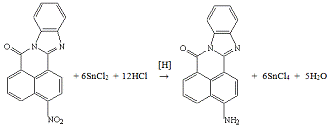
В трёхгорлую колбу ёмкостью 50 мл, снабжённую
мешалкой, термометром и обратным холодильником, загружают 1,0 г (0,003 моль)
3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она,
3,6 г (0,019 моль) хлорида олова(II),
8 мл 36%-ной соляной кислоты (большой избыток). Нагревают на кипящей водяной
бане 10 часов. За реакцией следят хроматографически. Через 10 часов в
реакционной массе почти нет исходного вещества. Красный осадок отфильтровывают.
Желтый фильтрат нейтрализуют аммиаком до pH=11-12,
выпавший белый осадок - неорганические соединения (не плавятся, не горят).
Красный осадок сушат, растворяют в 10%-ном NaOH,
отфильтровывают, сушат. Хроматограмма показала наличие продукта (Rf=0,23
(элюент - хлороформ:ацетон 3:1)) и небольшого количества примеси (Rf=0,38
(элюент - хлороформ:ацетон 3:1)). Многократная перекристаллизация из ДМФА к
успеху не привела.
Получено: 0,4 г (44%) продукта; порошок
тёмно-красного цвета; при 290°С не плавится (в лит. [8] амин при 300°С еще не
плавится); хорошо растворяется в ацетоне, спирте, ДМФА при нагревании.
ИК-спектр, см-1 (вазелиновое масло):
3340;3090(-NH2);
1680(-OC-N=);
1588(C=N
в цикле).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм:
470(3,87).
Опыт №8. Восстановление
3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
гидросульфитом
натрия
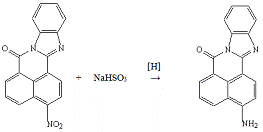
В трёхгорлую колбу ёмкостью 50 мл, снабжённую
мешалкой, термометром и обратным холодильником, загружают к суспензии 1,3 г
(0,004 моль) 3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
в 60 мл спирта и 20 мл воды при 75°С и перемешивании 2,4 г (0,023 моль) NaHSO3.
Нагревают 1 час, фильтруют, и фильтрат разбавляют 30 мл воды. Спирт отгоняют и
отфильтровывают 3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-он.
Получено:
0,1 г (8,5%) 3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она;
порошок тёмно-красного цвета; при 290°С не плавится (при 300°С еще не
плавится); Rf=0,20
(элюент - хлороформ); хорошо растворяется в ацетоне, спирте, ДМФА при
нагревании.
Опыт №9. Каталитическое
восстановление водородом 3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
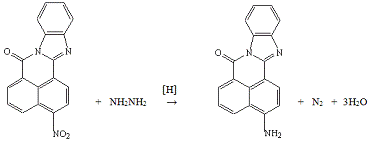
В трёхгорлую колбу ёмкость 500 мл, снабжённую
мешалкой, термометром и обратным холодильником, загружают 5,0 г (0,016 моль),
100 мл этанола, 10,0 г катализатора Ni-Re.
Нагревают на кипящей водяной бане 20 минут, после чего добавляют 5 мл гидразина
по 1 мл с интервалом в 15-20 минут. Затем добавляют 5г активированного угля и
кипятят еще 30 минут. Профильтровывают через складчатый фильтр горячий красный
раствор, осадок загружают обратно в колбу, наливают 100 мл спирта и снова
кипятят. Профильтровывают через складчатый фильтр горячий красный раствор и так
еще 2 раза. Все растворы объединяют и отгоняют спирт.
Получено: 2,5 г (55%)
3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она;
порошок тёмно-красного цвета; при 290°С не плавится (в лит. [8] при 300°Сеще не
плавится); Rf=0,24
(элюент - хлороформ:ацетон 3:1); хорошо растворяется в ацетоне, спирте, ДМФА
при нагревании.
ИК-спектр, см-1 (вазелиновое масло):
3324;3080(-NH2);
1664(-OC-N=);
1628(C=N
в цикле).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм:470(4,03).
Опыт №10.
Получение
3-(N,N-диэтилфенилазо)-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
а) Диазотирование:
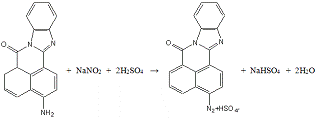
Фарфоровый стакан ёмкостью 100 мл с мешалкой,
термометром и капельной воронкой помещают в баню со льдом. Загружают в него
0,17 г (0,0006 моль) 3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она,
10 мл (0,237 моль) 93%-серной кислоты. К полученному раствору при -2-3°С
добавляют сначала 5 мл воды, а затем по каплям раствор 0,15 г нитрита натрия в
2 мл воды при интенсивном перемешивании.
Диазотируют 1-1,5 часа при t=
- 1 - 0°С. Образование диазосоединения определяется качественно по появлению
окрашивания при взаимодействии полученного раствора диазосоединения на
фильтровальной бумаге с раствором Аш-кислоты. Контроль за реакцией проводят по
йодкрахмальной бумаге. Окончание реакции определяют по исчезновению исходного
3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
в реакционной смеси с помощью ТСХ на пластинах Silufol.
б) Азосочетание:
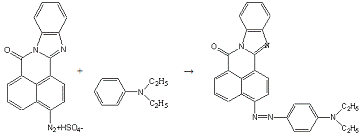
К полученному диазораствору при перемешивании и
температуре не выше 10°С добавляют по каплям раствор 0,2 мл (0,0012 моль) N,N-диэтиланилина
в 5 мл спирта. Смесь размешивают при температуре 10-15°С в течение 30 минут.
После реакционную массу при перемешивании и охлаждении до 10°С постепенно
нейтрализуют до pH=6-7
концентрированным раствором ацетата натрия. Окончание реакции определяют по
исчезновению окрашивания при взаимодействии полученного раствора с раствором
Аш-кислоты на фильтровальной бумаге. Краситель отфильтровывают, промывают на
фильтре водой, отжимают и сушат.
Получено: 0,21 г (75,61%) вещества; Тпл=272-273°С;
Rf=0,87 (элюент -
хлороформ:ацетон 3:1).
ИК-спектр, см-1 (вазелиновое масло):
1692(-CO-N=); 1632(C=N в цикле);
1244(-Ar-N-R).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм:552(3,89).
Опыт №11.
Получение
3-(N,N-диметилфенилазо)-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
а) Диазотирование:
Диазотируют 0,17 г (0,0006 моль)
3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
по методике 10а.
б) Азосочетание:
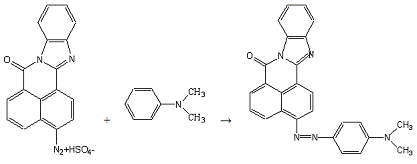
Сочетают по методике 10б с 0,15 мл (0,0012 моль)
N,N-диметиланилина
в 5 мл спирта.
Получено: 0,20 г (80,65%) вещества; Тпл=275-276°С;
Rf=0,77 (элюент -
хлороформ:ацетон 3:1).
ИК-спектр, см-1 (вазелиновое масло):
1696(-CO-N=); 1652(C=N в цикле);
1248(Ar-N-R).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм:538(3,87).
Опыт №12.
Получение
3-(N-этил,N-цианэтилфенилазо)-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
а) Диазотирование:
Диазотируют 0,17 г (0,0006 моль)
3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
по методике 10а.
б) Азосочетание:
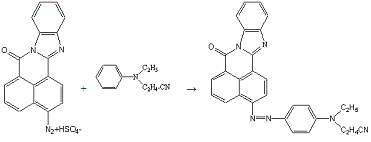
Сочетают по методике 10б с 0,2 мл (0,0012 моль) N-этил,N-цианэтиланилина
в 5 мл спирта.
Получено: 0,19 г (71,56%) вещества; Тпл=268-269°С;
Rf=0,82 (элюент -
хлороформ:ацетон 3:1).
ИК-спктр, см-1 (вазелиновое масло):
1688(-CO-N=); 1624(C=N в цикле);
1196(Ar-N-R); 1752(R-C=N).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм:525(4,25).
Опыт №13.
Получение
3-(N-циан,N-ацетоксиэтилфенилазо)-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
а) Диазотирование:
Диазотируют 0,17 г (0,0006 моль)
3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
по методике 10а.
б) Азосочетание:
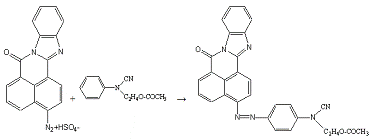
Сочетают по методике 10б с 0,3 мл (0,0012 моль) N-циан,N-ацетоксиэтиланилина
в 5 мл спирта.
Получено: 0,15 г (50,33%) вещества; Тпл=171-172°С;
Rf=0,69 (элюент -
хлороформ:ацетон 3:1).
ИК-спектр,см-1 (вазелиновое масло):
1692(-CO-N=); 1632(C=N в цикле);
1232(Ar-N-R); 1369(-СO-CH3).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм:510(4,37).
Опыт №14.
Получение
3-(N-оксиэтил,N-цианэтилфенилазо)-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
а) Диазотирование:
Диазотируют 0,17 г (0,0006 моль)
3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
по методике 10а.
б) Азосочетание:

Сочетают по методике 10б с 0,3 мл (0,0012 моль) N-оксиэтил,N-цианэтиланилина
в 5 мл спирта.
Получено: 0,20 г (69,06%) вещества; Тпл=255-256°С;
Rf=0,70 (элюент -
хлороформ:ацетон 3:1).
ИК-спектр, см-1 (вазелиновое масло):
1688(-CO-N=); 1624(C=N в цикле);
1232(Ar-N-R); 1752(R-C=N).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм:520(3,59).
Опыт №15.
Получение
3-(N-этил,N-оксиэтилфенилазо)-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
а) Диазотирование:
Диазотируют 0,17 г (0,0006 моль)
3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
по методике 10а.
б) Азосочетание:
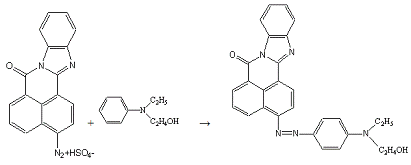
Сочетают по методике 10б с 0,2 г (0,0012 моль) N-этил,N-оксиэтиланилина
в 5 мл спирта.
Получено: 0,20 г (72,73%) вещества; Тпл=234-235°С;
Rf=0,75 (элюент -
хлороформ:ацетон 3:1).
ИК-спектр, см-1 (вазелиновое масло):
1696(-CO-N=); 1616(C=N в цикле);
1184(Ar-N-R).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм:545(3,72).
Опыт №16.
Получение
3-(N,N-диоксиэтил-м-хлорфенилазо)-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
а) Диазотирование:
Диазотируют 0,17 г (0,0006 моль)
3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
по методике 10а.
б) Азосочетание:
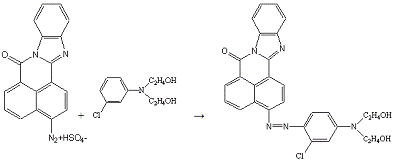
Сочетают по методике 10б с 0,3 г (0,0012 моль) N,N-диоксиэтил-м-хлоранилина
в 5 мл спирта.
Получено: 0,20 г (65,57%) вещества; Тпл=269-270°С;
Rf=0,64 (элюент -
хлороформ:ацетон 3:1).
ИК-спектр, см-1 (вазелиновое масло):
1688(-CO-N=); 1624(C=N в цикле);
1276(Ar-N-R).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм:537,5(3,93).
Опыт №17.
Роданирование
3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
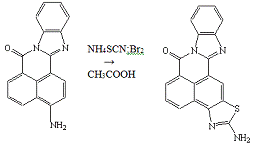
В четырёхгорлую колбу ёмкостью 250 мл,
снабжённую мешалкой, термометром, обратным холодильником и капельной воронкой,
загружают в течение 30 минут 0,27 мл (0,005 моль) раствора брома в 1 мл
уксусной кислоты в смесь 1,43 г (0,005 моль)
3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
и 1,52 г (0,02 моль) тиоционата аммония в 10 мл уксусной кислоты. Температуру
поддерживают в интервале 25-35°С. Затем суспензию перемешивают 24 часа при
комнатной температуре.
Контроль за ходом реакции проводили с помощью
ТСХ (silufol
UV-254, элюент -
хлороформ:ацетон 2:1). Выделенный продукт является исходным
3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-оном,
что было доказано с помощью ТСХ (Rf=0,24
(элюент - хлороформ:ацетон 2:1)), Тпл: при 290°С не плавится (в лит.
[8] при 300°Сеще не плавится) и смешанной пробы выделенного продукта с исходным
3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-оном,
которая депрессии в температуре плавления не дала.
Опыт №18.
Взаимодействие
4-нитронафталевого
ангидрида с трет-бутиламином
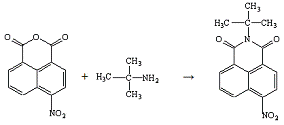
В трёхгорлую колбу ёмкостью 250 мл, снабжённую
мешалкой, термометром и обратным холодильником, загружают 5,0 г (0,02 моль)
4-нитронафталевого ангидрида, 2,2 мл (0,02 моль) трет-бутиламина, 125 мл
уксусной кислоты при перемешивании. Нагревают на кипящей водяной бане
(температура реакционной массы равна 85°С) 3 часа, затем на песчаной бане
(температура реакционной массы равна 114°С) 3 часа.
Контроль за ходом реакции проводили с помощью
ТСХ (silufol
UV-254, элюент -
хлороформ:ацетон 2:1). Выделенный продукт является исходным 4-нитронафталевым
ангидридом, что было доказано с помощью ТСХ (Rf=0,22
(элюент - хлороформ)), Тпл=223-226°С ( лит. [5] Тпл=228-229°С)
и смешанной пробы выделенного продукта с исходным 4-нитронафталевым ангидридом,
которая депрессии в температуре плавления не дала.
Опыт №19.
Взаимодействие
4-нитронафталевого
ангидрида с октиламином
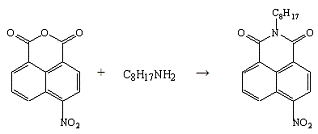
В трёхгорлую колбу ёмкостью 50 мл, снабжённую
мешалкой, термометром и обратным холодильником, загружают 1 г (0,004 моль)
4-нитронафталевого ангидрида, 0,7 мл (0,004 моль) октиламина, 25 мл уксусной
кислоты при перемешивании. Нагревают на кипящей водяной бане 4 часа и оставляют
на 3 суток. После чего выпадает непрореагировавшее исходное соединение, что
доказано с помощью ТСХ (Rf=0,22
(элюент - хлороформ)), Тпл=225-229°С ( лит. [5] Тпл=228-229°С)
и смешанной пробы выделенного продукта с исходным 4-нитронафталевым ангидридом,
которая депрессии в температуре плавления не дала. Исходное соединение
отфильтровывают, а фильтрат разбавляют по каплям водой до выпадения осадка.
Осадок отфильтровывают, сушат.
Получено: 0,75 г (51,37%) 4-нитро-N-октил-нафталимида;
порошок почти белого цвета; Тпл=102-106°С; Rf=0,79
(элюент - хлороформ:ацетон 3:1); хорошо растворяется в ацетоне.
ИК-спектр, см-1 (вазелиновое масло):
1560,
1340(NO2);
1688(-CO-N=).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм: 350(3,38).
Опыт №20.
Взаимодействие
4-нитро-N-октил-нафталимида
с морфолином
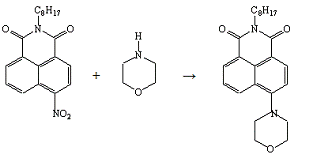
В коническую колбу ёмкостью 50 мл, снабжённую
обратным холодильником, загружают 0,5 г (0,001моль) 4-нитро-N-октил-фталимида,
1,5 мл морфолина, 4 мл ДМСО. Реакционную массу нагревают на кипящей водяной
бане 2 часа до исчезновения исходного соединения. За реакцией следят
хроматографически. По окончании реакции массу охлаждают до комнатной
температуры, выпавший осадок отфильтровывают, промывают водой и сушат.
Получено: 0,40 г (71,43%) порошка ярко-жёлтого
цвета, который сильно люминесцирует в растворе; Тпл=100-101°С; Rf=0,67
(элюент - хлороформ); хорошо растворяется в ацетоне, хлороформе.
ИК-спектр, см-1 (вазелиновое масло):
1684(-CO-N=).
Электронный спектр поглощения:
λmax(lgε),
нм: 398(4,03).
Опыт №21.
Взаимодействие
4-нитро-N-октил-нафталимида
с гексаметиленимином
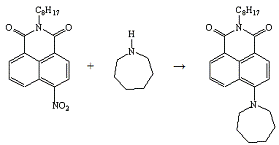
В коническую колбу ёмкостью 50 мл, снабжённую
обратным холодильником, загружают 0,5 г (0,001 моль) 4-нитро-N-октил-фталимида,
1,5 мл гексаметиленимина, 4 мл ДМСО. Реакционную массу нагревают на кипящей
водяной бане 5-6 часов до исчезновения исходного соединения. За реакцией следят
хроматографически. По окончании реакции массу охлаждают до комнатной
температуры, выпавший осадок отфильтровывают, промывают водой и сушат.
Получено: 0,35 г (61,40%) порошка жёлтого цвета;
Тпл=75-77°С; Rf=0,63
(элюент - хлороформ); хорошо растворяется в ацетоне, хлороформе.
ИК-спектр, см-1 (вазелиновое масло):
1688(-CO-N=).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм: 441(4,13).
Опыт №22.
Взаимодействие
4-нитро-N-октил-нафталимида
с пиперидином
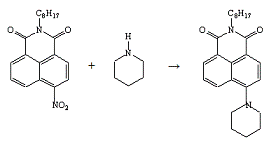
В коническую колбу ёмкостью 50 мл, снабжённую
обратным холодильником, загружают 0,5 г (0,001 моль) 4-нитро-N-октил-фталимида,
1,5 мл пиперидина, 4 мл ДМСО. Реакционную массу нагревают на кипящей водяной
бане 2 часа до исчезновения исходного соединения. За реакцией следят
хроматографически. По окончании реакции массу охлаждают до комнатной
температуры, выпавший осадок отфильтровывают, промывают водой и сушат.
Получено: 0,37 г (67,27%) порошка
золотисто-жёлтого цвета, который люминесцирует в растворе; Тпл=97-98°С;
Rf=0,55 (элюент -
хлороформ); хорошо растворяется в ацетоне, хлороформе.
ИК-спектр, см-1 (вазелиновое масло):
1684(-CO-N=).
Электронный спектр поглощения (этанол):
λmax(lgε),
нм: 414(4,04).
. В работе было изучено взаимодействие
4-нитронафталевого ангидрида с о-фенилендиамином, в результате которого
образуется 3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-он.
. Восстановлением
3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
различными способами был получен 3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-он.
. На основе
3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
и 3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
были синтезированы 10 красителей.
.По данным исследований НИОПИКа было показано,
что краситель 3-(N-морфолино)-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-он
и 3-(N-пиперидино)-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-он
обладают хорошей сублимационной способностью. Они дают на полиэфирной ткани
жёлтое окрашивание с красноватым оттенком, с хорошей степенью флуоресценции по
сравнению с аналогом по применению и могут представлять интерес для дальнейших
разработок.
. В работе был осуществлён синтез красителей на
основе 4-нитро-N-октил-нафталимида
путём замещения нитрогруппы на морфолин, гексаметиленимин и пиперидин.
. Все промежуточные продукты и красители
охарактеризованы температурой плавления, данными ТСХ, ИК- и электронных
спектров поглощения.
4. Технологическая
часть
В данной части дипломной работы представлены
расчет и технологическое оформление процесса получения красителя, который
образуется в результате сочетания с N,N-диметиланилином
диазотированного 3-амино-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она.
Характеристика производимой продукции
1.Название:
-(N,N-диметилфенилазо)-7H-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-он.
.Структурная формула:
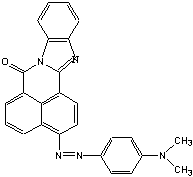
3.Эмпирическая формула:
С26Н19ОN5
.Молекулярная масса:
417г/моль
.Схема основной реакции:
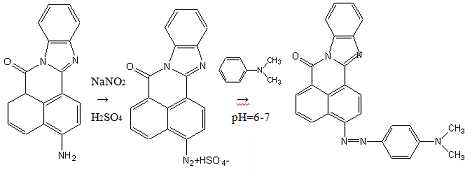
Химизм процесса
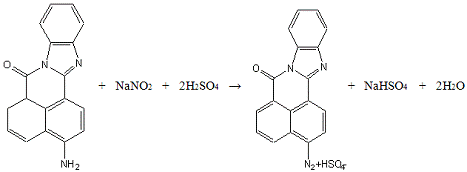
1.Диазотирование:
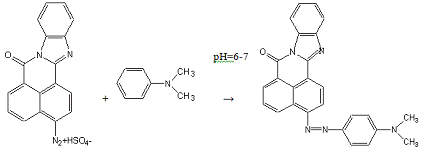
2.Азосочетание с N,N-диметиланилином:
Стадии процесса
.Приготовление раствора нитрита натрия.
.Диазотирование.
.Приготовление раствора азосоставляющей.
.Азосочетание.
.Фильтрация.
.Кипячение в спирте.
.Фильтрация чистого красителя.
Описание технологической схемы
.Приготовление раствора нитрита натрия.
В чистый аппарат№3 загружают по объему воду,
включают мешалку и через люк аппарата№3 загружают по массе нитрит натрия. Массу
в аппарате№3 размешивают в течение 20-30 минут до полного растворения нитрита
натрия.
Затем после полного растворения нитрита натрия в
воде раствор охлаждают пуском рассола в рубашку аппарата№3 до температуры 3°С.
.Диазотирование.
При размешивании по массе загружают через люк
аппарата№1 амин. Массу размешивают и охлаждают пуском рассола в рубашку
аппарата№1 до температуры
-3°С. При этой температуре в аппарат№1 загружают
порциями по объему и, затем, самотеком раствор нитрита натрия, который из
аппарата№3 при помощи сжатого воздуха подается в расходную емкость№4.
По окончании загрузки раствора нитрита натрия
массу в аппарате№1 размешивают при температуре 0-3°С в течение 1-1,5 часов.
В чистый аппарат№2 массу из аппарата№1 передают
при помощи сжатого азота по трубопроводу для сочетания с предварительно
подготовленным раствором N,N-диметиланилина.
Аппарат№1 после освобождения от реакционной
массы необходимо осмотреть и убедиться, что вся масса передана в аппарат№2.
Затем в аппарат№1 загружают воду и размешивают в течение 10-20 минут для
промывки аппарата от диазосоединения. Воду из аппарата№1 передают в
промышленную канализацию.
.Приготовление раствора азосоставляющей.
В чистый аппарат№7 по объему загружают этанол,
поступающий по трубопроводу из хранилища при помощи погружного насоса. При
размешивании в аппарат№7 по объему загружают N,N-диметиланилин,
поступающий по трубопроводу из хранилища при помощи погружного насоса.
.Азосочетание.
В аппарат№2 при перемешивании и температуре не
выше 10°С к диазораствору прибавляют по объему раствор N,N-диметиланилина
в спирте из аппарата№7 при помощи сжатого азота.
Затем реакционную массу в аппарате№2 при
перемешивании и температуре не выше 10-15°С нейтрализуют до рН=6-7
концентрированным (25%) раствором ацетата натрия, который подается из
аппарата№6 самотеком в аппарат№2.
После нейтрализации реакционная масса передается
при помощи сжатого воздуха на фильтр-пресс№8, предварительно оборудованный
бельтингом, и фильтруют. Осадок на фильтре промывают водой. Промывные воды и
фильтрат поступают в приемник№9, из которого их передают в промышленную
канализацию.
Пасту на фильтр-прессе хорошо отжимают,
выгружают в промежуточную тару и направляют на кипячение в спирте.
Фильтровальную ткань направляют на сжигание
после 10 фильтраций. В аппарат№2 загружают по объему воду для промывки
фильтр-пресса№8 и включают мешалку. Воду в аппарате№2 нагревают пуском пара в
рубашку аппарата до температуры 80-90°С. При этой же температуре воду передают
при помощи сжатого воздуха на фильтр-пресс№8, промывают его, а, затем,
пропаривают паром. Промывную воду принимают в приемник№9, откуда направляют в
промышленную канализацию.
.Кипячение в спирте.
В чистый аппарат№10 самотеком из аппарата№11 по
объему загружают этанол, который поступает в аппарат№11 из хранилища при помощи
погружного насоса. Затем через люк аппарата№10 загружают по массе пасту
красителя при перемешивании. Массу в аппарате№10 нагревают до 60-70°С пуском
пара в рубашку аппарата№10. И при этой температуре перемешивают 1,5-2 часа.
После этого масса подается при помощи сжатого
воздуха на фильтр-пресс№12, предварительно оборудованный бельтингом, и
фильтруют. Осадок на фильтре промывают водой. Промывные воды и фильтрат
поступают в приемник№13, из которого их передают в промышленную канализацию.
Пасту на фильтр-прессе хорошо отжимают, выгружают в тару и направляют на сушку
в полочную сушилку.
5. Расчетная
часть
Материальный баланс
для
стадии диазотирования
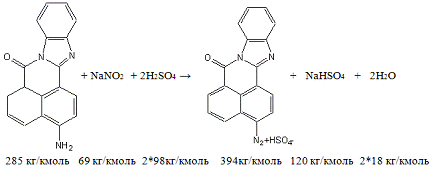
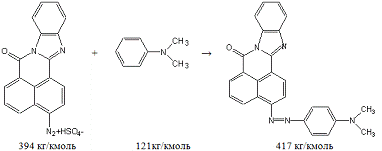
В результате одной реакции в одном аппарате
объемом 1,6м3 получается 25кг диазосоединения со 100% выходом.
Для этого необходимо взять (по реакции):
(исходного
амина)=25кг*285кг/кмоль/394кг/кмоль=18,08кг;
m(100%-ной H2SO4)=18,08кг*2*98кг/кмоль/285кг/кмоль=12,43кг,
мы берем по условиям опыта избыток кислоты в 127
раз, следовательно,
(100%-ной H2SO4)=1578,61кг,
поэтому
m(65%р-ра H2SO4)=2428,63кг,
m(H2O)=850,02кг;
m(NaNO2)=18,08кг*69кг/кмоль/285кг/кмоль=4,38кг,
так как мы берем 13%-ный раствор нитрита натрия,
то
(13%р-ра NaNO2)=33,69кг,
m(H2O)=29,31кг.
В результате реакции получили:
(непрореагировавшей 100%-ной H2SO4)=1578,61кг
- 12,43кг=1566,18кг,
m(65%р-ра
H2SO4)=2409,51кг,(H2O)=843,33кг;(NaHSO4)=18,08кг*120кг/кмоль/285кг/кмоль=7,61кг;(H2O)=18,08кг*2*18кг/кмоль/285кг/кмоль
+ 29,31кг
+ 6,69кг=38,28кг.
Тепловой баланс для
стадии диазотирования
Температурный график:
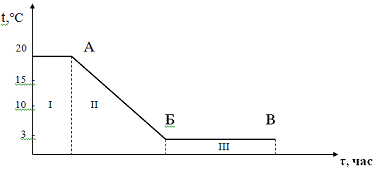 - загрузка кислоты
и исходного амина;
- загрузка кислоты
и исходного амина;
II -
охлаждение до 3°С;
III - загрузка
воды и нитрита натрия.
Уравнение теплового баланса в общем виде [1]:
1
+ Q2
+ Q3
= Q4
+ Q5
+ Q6
, где
1
- тепло, вносимое в аппарат с исходными веществами (для непрерывного процесса),
или энтальпия (теплосодержание) веществ в аппарате в начале стадии (зоны)
теплообмена (для периодического процесса);
Q2
- тепло, отдаваемое теплоносителем перерабатываемым веществам и аппарату или
отнимаемое от них хладагентом;
Q3
- тепловой эффект процесса;
Q4
- тепло, уносимое из аппарата конечными продуктами (для непрерывного процесса),
или энтальпия веществ в аппарате в конце стадии (зоны) теплообмена (для
периодического процесса);
Q5
- тепло, расходуемое на нагревание отдельных деталей аппарата или отнимаемое от
них хладагентом;
Q6
- тепло, теряемое аппаратом в окружающую среду или получаемое им из нее.
Участок АБ:
Q1=∑
Giн
Сp
н
Тн , где
Giн
- расход исходного вещества или компонента реакционной массы для непрерывного
процесса, кг/ч; масса вещества в начале зоны теплообмена или масса вещества,
загружаемого а аппарат в начале этой зоны, для периодического процесса, кг;
Ср
н - теплоемкости соответствующих веществ или компонентов при Тн
, кДж/(кг*К); Тн -
температура исходного вещества или компонента реакционной массы на входе в
аппарат - для непрерывного процесса или же начальная температура стадии
теплообмена либо температура вещества, загружаемого в аппарат на этой стадии, -
для периодического процесса, К.
Q1АБ=
(GамСам
+ GкислотыСкислоты)*Tн;
Cам=∑
Cа*n/М
[2], где
Cа
- атомные теплоемкости, n
- число одноименных атомов в молекуле,
М - молекулярная масса амина;
|
Элементы
|
Са(тв)
|
Са(ж)
|
|
Углерод
|
1,8
|
2,8
|
|
Водород
|
2,3
|
4,3
|
|
Кислород
|
4,0
|
6,0
|
|
Сера
|
5,4
|
7,4
|
|
Азот
|
6,3
|
8,0
|
Cам=
(1,8*18+2,3*11+4,0*1+6,3*3)/285=0,283ккал/(кг*К)=1,186кДж/(кг*К);
Cкислоты=1,417*0,65+4,19*0,35=2,388кДж/(кг*К)
, так как раствор серной кислоты 65%, [3];
Q1АБ=
(18,08*1,186+2428,63*2,388)*293,15=1706429,468кДж.
Q4=
∑ Giк
Ср к Тк , где
Giк
- расход продукта или компонента реакционной массы на выходе из аппарата - для
непрерывного процесса, кг/ч; масса вещества или компонента реакционной массы в
конце стадии теплообмена - для периодического процесса, кг;
Тк - температура продукта или
компонента реакционной массы на выходе из аппарата - для непрерывного процесса
или же температура реакционной массы в конце зоны теплообмена - для
периодического процесса, К;
Ср к - теплоемкость вещества при Тк
, кДж/(кг*К).
Q4АБ=
(Gам Сам
+ Gкислоты
Скислоты )*Tк;
Сам=
(2,8*18+4,3*11+6,0*1+8*3)/285=0,448ккал/(кг*К)=1,877кДж/(кг*К);
Q4АБ=
(18,08*1,877+2428,63*2,388)*276,15=1610922,295кДж.
Q3=0;
Q6=0.
Q5=Gап
Ср ап (Тапк - Тапн), где
Gап
- масса отдельных частей аппарата, кг;
Cр ап
- теплоемкости отдельных частей аппарата, кДж/(кг*К);
Тапк и Тапн
- средняя температура отдельных частей аппарата в конце и в начале нагревания,
К.
Q5=Sповерх
Sстенки
ρстали Сстали
(Тк - Тн);
Q5=5,5м2*0,016м*7500кг/м3*0,5*(3
- 20)= -5610кДж.
Следовательно,
Q2=Q4+Q5
- Q1,
Q2=1610922,295-
5610 - 1706429,468= - 101117,173кДж.
Для периодических процессов используют уравнение
теплопередачи:
SТ=Q2/(КТ*∆Тср*τi),
где
SТ
- теплообменная поверхность аппарата, м2;
КТ - коэффициент теплопередачи, Вт/(м2*К);
для рубашки он равен 230-290Вт/(м2*К);
∆Тср - средняя полезная
разность температур между хладагентом и реакционной массой в аппарате;
τi
- продолжительность стадии теплообмена, с.
Находим ∆Тср:
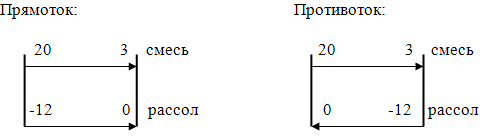
∆Тср (для прямотока)=(32 - 3)/ln(32/3)=12,25;
∆Тср (для противотока)=(20 -
15)/ln(20/15)=17,38;
∆Тср=(12,25 + 17,38)/2=14,82;
τАБ=1час
30мин=5400с;
SТ=101117,173*1000/(290*14,82*5400)=4,36м2
< 5,5м2 [4].
Участок БВ:
Q1БВ=(Gам
Сам + Gкислоты
Скислоты + GNaNO2
CNaNO2
+ GH2O
CH2O)*Тн;
СNaNO2=
1,31кДж/(кг*К), [3];
СH2O=4,19кДж/(кг*К),
[3];
Q1БВ=(18,08*1,877+2428,63*2,388+4,38*1,31+29,31*4,19)*276,15=1646420,467кДж.
Q4БВ=(Gдиазо
Сдиазо + Gкислоты
Скислоты
+ GNaHSO4
CNaHSO4
+
GH2O
CH2O)*Тк;
Сдиазо=
(2,8*18+4,3*10+6,3*4+8*4+6*5+7,4*1)/394=0,477ккал/кг*К=1,999кДж/(кг*К);
СNaHSO4=1,07кДж/(кг*К);
Q4=(25*1,999+2409,51*2,388+7,61*1,07+38,28*4,19)*276,15=1649283,998кДж.
Q5=0,
так как Тн =Тк.
Q6=0.
Q3=Gдиазо*qр*1000/М,
где
qр
- удельная теплота реакции при прямом порядке диазотирования, рассчитывается по
формуле [2]:
qp=qд
+ qн.д
- qн.а
+ 3,45,где
qд
- тепло реакции диазотирования, ккал/г-мол;
qн.д
- тепло нейтрализации диазогидрата, ккал/г-мол;
qн.а
- тепло нейтрализации амина, ккал/г-мол.
Данные приведены для α-нафтиламина,
так как справочных данных для необходимого красителя нет.
qр=18,39+12,86
- 6,44+3,45=28,26ккал/г-мол=118,409кДж/моль.
Q3=25*118,409*1000/394=7513,287кДж.
Следовательно,
Q2=Q4
- Q1
- Q3,
Q2=1649283,998
- 1646420,467 - 7513,287= - 4649,756кДж.
Для реакции диазотирования ∆Тср
прямотока и противотока равны:
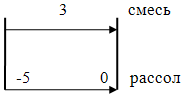
∆Тср=(8 - 3)/ln(8/3)=5,09;
τ=1час 30мин=5400с;
SТ=4649,756*1000/(230*5,09*5400)=0,74м2
< 5,5м2 [4].
. Охрана труда.
Краткая
характеристика выполняемой работы
Охрана труда - система законодательных актов и
соответствующих или социально-экономических, технических, гигиенических и
организационных мероприятий, обеспечивающих безопасность, сохранение здоровья и
работоспособность человека в процессе труда.
Методологическая основа охраны труда - научный
анализ условий труда, технологического процесса, аппаратурного оформления,
применяемых и получаемых продуктов, с точки зрения возможности возникновения в
процессе эксплуатации производства опасностей при воздействии вредных веществ.
На основе этого анализа определяют опасные участки производства, выявляют
возможные опасные ситуации и разрабатывают меры по их предупреждению и
ликвидации [2].
На предприятиях химической промышленности роль
техники безопасности особенно важна, так как приходится непосредственно
соприкасаться с различными видами сырья, полуфабрикатов и готовой продукции,
обладающими токсическими свойствами, а также в связи с использованием
температур и давления при проведении технологического процесса.
В данной работе рассматривается техника
безопасности в условиях студенческой лаборатории при выполнении исследований,
аналогичных исследованиям, проводимым на производстве.
Данная работа посвящена синтезу красителей на
основе бензимидазола. На основной стадии дипломной работы применялись вредные,
пожаровзрывоопасные вещества. Также для проведения работы необходимо было
использовать электроприборы: плитки, электромоторы, трансформаторы.
Исследования проводились при строгом соблюдении
технологического регламента и при использовании минимального количества
вредных, пожаровзрывоопасных веществ. Контроль за ходом реакции осуществлялся
методом тонкослойной хроматографии (ТСХ), где в качестве элюентов используются
смеси органических растворителей в очень малых количествах. Поэтому
возникновение аварийных ситуаций сведено до минимума.
Все расчеты в данном разделе проводились по
методическим указаниям [1].
Режим личной безопасности
Лица, приступающие к работе в лаборатории, проходят
личный инструктаж по технике безопасности в отделе охраны труда и техники
безопасности. На рабочем месте каждый работающий в лаборатории проходит
первичный инструктаж. В дальнейшем каждый работающий в лаборатории проходит
повторный инструктаж не реже одного раза в год. Все лабораторные работы
проводятся в халатах, по мере необходимости используются резиновые перчатки,
защитные очки, маска, респиратор.
Инструктаж проводится по инструкциям [9]:
. Инструкция по обслуживанию газовых
лабораторных горелок. Утверждена ректором МХТИ им. Д.И.Менделеева Ягодиным
Г.А., 1984г.
. Инструкция №10-ТБ по технике пожарной
безопасности в МХТИ им. Д.И.Менделеева. Утверждена ректором МХТИ им.
Д.И.Менделеева Ягодиным Г.А., 1984г.
. Инструкция №11-ТБ по технике безопасности при
работе с едкими веществами (кислотами, щелочами, щелочными металлами).
Утверждена ректором МХТИ им. Д.И.Менделеева Ягодиным Г.А., 1984г.
. Инструкция №14-ТБ по технике безопасности при
работе с горючими и легковоспламеняющимися веществами. Утверждена ректором МХТИ
им. Д.И.Менделеева Ягодиным Г.А., 1985г.
. Инструкция №15-ТБ по электробезопасности для
сотрудников и студентов МХТИ им. Д.И.Менделеева. Утверждена ректором МХТИ им.
Д.И.Менделеева Саркисовым П.Д., 1987г.
. Инструкция №162-ТБ по технике безопасности при
работе с ароматическими аминами. Утверждена ректором МХТИ им. Д.И.Менделеева
Саркисовым П.Д., 1987г.
Все работы, связанные с различным применением
ЛВЖ проводятся при отсутствии открытого огня. Для извещении о несчастном случае
в лаборатории установлен телефон. Имеется аптечка, в которой находятся
медикаменты для оказания первой медицинской помощи. Также в каждой лаборатории
имеются средства пожаротушения.
Инструктаж провела: Манаева Т.В.
Производственная санитария
Установка соответствия размеров площади и объема
помещения на одного работающего требованиям санитарных норм:
Согласно санитарным нормам объем
производственного помещения должен составлять не менее 15м3, площадь
не менее 4,5м3 на одного работающего [6]. В данной лаборатории
объемом 480м3 и площадью 96м2 работает 6 человек [7].
Следовательно, фактический объем на одного работающего составляет 80м3,
а фактическая площадь 16м2, что удовлетворяет санитарным нормам.
Организация работы с вредными веществами
Все работы с вредными веществами должны
проводится в вытяжном шкафу. Перед началом работы необходимо проверить работу
вытяжной вентиляции и удостовериться в наличии и исправности средств
индивидуальной защиты. Особую осторожность необходимо соблюдать при работе с
канцерогенными веществами. После соприкосновения с ними необходимо тщательно
вымыть руки. Все химические вещества должны храниться в емкостях с плотно
закрывающимися крышками и имеющих этикетки с указанием названий веществ.
При химических ожогах пораженное место промывают
струей воды из под крана в течение длительного времени - не менее 15 минут.
Далее при ожогах кислотами и кислотоподобными прижигающими веществами
накладывают примочки 2%-го раствора бикарбоната натрия, а при ожогах щелочами -
2%-м раствором уксусной, лимонной или виннокаменной кислот. Для предупреждения
ожогов необходимо при работе с концентрированными кислотами применять резиновые
перчатки. При переливании олеума необходимо применять маску для защиты лица.
При отравлении растворителями наркотического
действия необходимо принять 0,03г фениламина, 0,1г коразина, 0,5г бромистой
камфары. После этого выпить крепкий чай. Прежде всего, необходим свежий воздух,
а для тяжелых случаев искусственное дыхание, кислород [2].
Метеорологические условия
В лаборатории имеется центральное отопление,
которое обеспечивает нормальные метеорологические условия в зимнее время.
Лаборатория относится к помещениям, характеризующимся небольшим избытком тепла
(20ккал/(ч*м3)).
Категория работ - легкие физические работы. Для
таких рабочих помещений оптимальными являются следующие условия [8]:
а) в холодный период с температурой наружного
воздуха ниже +10°С:
температура в лаборатории +21-23°С;
относительная влажность воздуха 40-60%;
скорость движения воздуха 0,1м/с;
б) в теплый период с температурой наружного
воздуха выше +10°С:
температура в лаборатории +22-25°С;
относительная влажность воздуха 40-60%;
скорость движения воздуха >0,2м/с.
Вентиляция
Для поддержания чистоты воздуха на рабочих
местах, для обеспечения нормальных условий работы и поддержания теплового
равновесия между теплом человека и окружающей средой необходима правильная
организация системы вентиляции. Работа вентиляционных систем должна создавать
на постоянных рабочих местах, в рабочей и обслуживаемой зонах помещений
метеорологические условия и чистоту воздушной среды, соответствующие санитарным
условиям [6].
В лаборатории организована смешанная система
вентиляции. По способу воздухообмена естественная вентиляция является
общеобменной и осуществляется через форточки, окна и двери. Искусственная
вентиляция является местной и предназначена для отсоса вредных выделений (газы,
пары, пыль, избыточное тепло) в местах их образования и удаления их из
помещения.
Скорость подсоса в вытяжном шкафу 0,75-1,0 м/с.
Производительность вентиляционной установки
4500м3/час [7].
Производительность (L)
с учетом потерь (10%), которые возникают из-за сопротивления движению потока
воздуха в воздуховодах, будет равна:
L=4500-4500*10/100=4050м3/час.
Кратность обмена воздуха равна:
Кшк=L/(Vшк*n),
где
Vшк
- объем шкафа, м3;
n - число вытяжных
шкафов, равное 6.
Vшк=1,1*1,32*1,4=2,03м3;
Кшк=4050/(2,03*6)=332,5час-1;
U=4050/(3600*0,3*1,1*6)=0,57м/с.
В лаборатории:
Клаб=L/Vлаб=4050/480=8,4час-1.
Кратность обмена воздуха в лаборатории
соответствует санитарным нормам. И скорость подсоса воздуха допускает работу с
веществами класса опасности 2.
Освещение
Для создания нормальных, благоприятных условий
работы необходимо рациональное освещение помещений и рабочих мест. В
лаборатории используют естественное освещение и свет от источников
искусственного освещения.
Естественное освещение является более
гигиеничным и предусматривается для помещений, в которых постоянно работают
люди. Если по условиям зрительной работы оно оказывается недостаточным, то
используют совместное освещение.
Основной величиной для расчета и нормирования
естественного освещения внутри помещений принят коэффициент естественной
освещенности (КЕО).
Работа в химической лаборатории относится к 4
разряду зрительных работ - работа средней точности, при которой наименьший
размер объекта различения 0,5-1,0 мм.
Расчет естественного освещения заключается в
определении площади световых проемов (S0)
при боковом освещении, м2:
S0=еn*η0*Sn*Kз*Kзд/(τ0*r1*100),
где
S0
- площадь окон, м2;
еn
- нормированные значения КЕО при боковом освещении;
η0
- световая характеристика окна;
Sn
- площадь пола, м2;
Kзд
- коэффициент, учитывающий затенение окон противостоящими зданиями;
Kз
- коэффициент запаса;
r1
- коэффициент, учитывающий повышение КЕО при боковом освещении благодаря свету,
отраженному от поверхностей помещения и подстилающего слоя, прилегающего к
зданию;
τ0
- общий коэффициент светопропускания светового потока, определяется по формуле:
τ0=τ1*τ2*τ3*τ4*τ5,
где
τ1
- коэффициент, учитывающий светопропускание материала;
τ2
- коэффициент, учитывающий потери света в слое загрязнений стекла;
τ3
- коэффициент, учитывающий потери света в переплетах светопроема;
τ4
- коэффициент, учитывающий потери света в несущих конструкциях;
τ5
- коэффициент, учитывающий потери света в защитной сетке, устанавливаемой под
фонарями, принимаемый равным 0,9 (отсутствует в нашем случае).
еn=1,5%
[10, табл.1, стр5].
По отношению L/B
и B/h1
находим η0
[10, табл.26, стр.34], где
L - длина помещения;
B - глубина
помещения;
h1
- уровень условной рабочей поверхности.
/B=12/8=1,5;
B/h1=8/1,5=5,33;
η0=19.
Коэффициент запаса равен Кз=1,2 [10,
табл.3, стр.16];
r1=2,25
[10, табл.30, стр.36];
Кзд=1 [10, табл.27, стр.34].
Находим τ1=0,8;
τ2=0,6; τ3=0,8;
τ4=1 [10, табл.28,29,
стр.34-35]. Следовательно,
τ0=0,8*0,6*0,8*1=0,384;
S0=1,5*19*96*1*1,2/(0,394*2,25*100)=37м2.
Фактическая площадь световых проемов 36м2,
следовательно, немного меньше нормы. Искусственное освещение предусматривается
в помещениях, в которых недостаточно естественного света, и для освещения
помещения в часы суток, когда естественная освещенность отсутствует.
В лаборатории используется комбинированное
освещение - к общему добавляется местное освещение рабочих мест светильниками.
Источниками искусственного освещения в лаборатории являются люминесцентные
лампы дневного света типа ЛД-30.
Для искусственного освещения нормируемый
параметр - освещенность. СНиП устанавливают минимальные уровни освещенности
рабочих поверхностей в зависимости от точности зрительных работ, контраста
объекта, фона системы освещения и типа используемых ламп.
Расчет количества ламп проводится по методу
светового потока:
n=E*K*S*Z/(F*η*m), где
- число светильников;
E - нормированная
освещенность, лк;
K - коэффициент
запаса, учитывающий снижение освещенности при эксплуатации;
S - площадь
помещения;
Z - поправочный
коэффициент светильника (для стандартных светильников 1,1-1,2);
F - световой поток
одной лампы, лм;
η -
коэффициент использования, зависящий от тапа светильника, показателя типа
помещения, отраженности и т.д.;
m - число
люминесцентных ламп в светильнике.
E=300лк [10, табл.2,
стр.4];
K=1,5 [10, табл.3,
стр.16];
S=96м2;
Z=1,1;
F=1800лм(для
люминесцентных ламп мощностью 30Вт);
η=0,55(для ламп дневного
света данного типа);
m=2;
Следовательно, n=300*1,5*96*1,1/(1800*0,55*2)=24шт.
Фактически 24 лампы. Поэтому применение других
источников освещения необязательно.
Водоснабжение. Канализация. Отопление
Система водоснабжения в лаборатории по
назначению является хозяйственно-питьевой. Она обеспечивает подачу
доброкачественной воды для хозяйственно-бытовых потреблений.
Все сточные воды с небольшим количеством вредных
веществ сливаются в канализацию. Каждая сливная точка в канализацию снабжена
гидравлическим запором. Для сброса горючих отходов, едких веществ, осадков и
смол имеются специальные керамические бочки с крышками. Все отходы затем
нейтрализуются, растворители регенерируются.
В лаборатории имеется центральное отопление,
которое обеспечивает нормальные метеорологические условия в зимнее время [13].
Техника безопасности
Электробезопасность
Электробезопасность представляет собой систему
организационных и технических мероприятий и средств, обеспечивающих защиту от
вредного воздействия и опасного воздействия электрического тока. В лаборатории,
где проводится дипломная работа, используется переменный ток с напряжением 220
и 380В и частотой 50Гц. Для защиты людей от поражения применяется защитное
заземление (R=40м). Все подходы
для отключения тока легкодоступны. Помещение лаборатории - помещение с повышенной
опасностью поражения людей электрическим током (класс электробезопасности - II).
Существует возможность одновременного прикосновения человека с соединенной с
землей металлической конструкцией здания, технологическим аппаратом, механизмом
с одной стороны и металлическим корпусом - с другой [14].
В соответствии с ПУЭ электрооборудование
выбирают с учетом класса взрывоопасной зоны и свойств взрывоопасной смеси. Для
зоны класса В-1б используются установки без взрывозащиты.
В пожароопасных зонах любого класса могут
использоваться электронагревательные приборы, нагреваемые части которых должны
быть защищены от соприкосновения с горючими веществами, а сами приборы следует
устанавливать на поверхности из негорючих материалов [14,15].
Пожарная профилактика
Категорирование производственных помещений
по
пожаровзрывоопасности
Дипломная работа проводится в лаборатории,
которая по степени безопасности относится к категории В - помещения, в которых
образуются взрывоопасные смеси [16].
По ПУЭ лаборатории относится к помещениям класса
В-1б, в которых при нормальной эксплуатации взрывоопасные смеси паров ЛВЖ и
горючих газов с воздухом не образуются, а возможны только аварии и
неисправности. Они имеют следующие особенности:
горючие газы и ЛВЖ находятся в небольших
количествах только для однодневного применения, их недостаточно для образования
взрывоопасной смеси в объеме, превышающем 5% от общего объема помещения. Работы
с ними ведутся без применения открытого огня [14].
Число этажей для зданий данной категории не
более 8. Площадь этажа между противопожарными стенами не ограничена. Расстояние
от дальнего рабочего места до выхода не более 40м, фактически - 10м [17].
Организация работы с горючими веществами
К работе с горючими веществами допускаются лица,
прошедшие инструктаж по безопасным методам работы и по мерам оказания первой
доврачебной помощи при отравлениях и ожогах.
Все работы с горючими веществами должны
проводиться в вытяжном шкафу при отсутствии открытого пламени. Нагревать и
перегонять растворители следует в круглодонных колбах, в банях, заполненных
соответствующими теплоносителями.
На рабочем месте разрешается держать горючие
вещества в том количестве, которое необходимо в данный момент. Количество
растворителей, находящихся в лаборатории, не должно превышать дневной нормы
потребности лаборатории. Дневная норма горючих веществ должна храниться в
толстостенной таре в закрытых металлических ящиках со слоем песка на дне.
Металлический натрий необходимо хранить в плотнозакрытом сосуде, под слоем
керосина, вынимать щипцами, а обрезки гасить спиртом.
Средства пожаротушения
Для ликвидации пожаров в лаборатории имеются:
огнетушитель углекислотный ОУ-2, кошма и ящик с песком. Нужно следить за тем,
чтобы все средства были исправны и доступны. В лаборатории составлен список
пожарного расчета, план эвакуации людей и ценного оборудования. Для оповещения
о пожаре может быть использован телефон.
сублимационный ткань
химический краситель
7. Охрана
окружающей среды
Охрана окружающей среды - это комплекс
мероприятий по охране, рациональному использованию и восстановлению живой и
неживой природы.
Промышленностью используется и выпускается
большое количество химических соединений. Многие из них не разлагаются на более
простые безвредные соединения, а накапливаются в атмосфере, воде или почве и
преобразуются в еще более токсичные продукты, некоторые из которых оказывают
концерагенное, мутагенное, аллергенное действие на организм человека,
проявляющееся иногда через несколько лет и в следующих поколениях.
Загрязняющие атмосферу вещества, преобразуясь в
стабильные соединения, выпадают вместе с осадками на почву, проникают в
грунтовые воды, входят в состав растительных, а затем мясных и молочных
продуктов.
Все это представляет угрозу для здоровья
человека - повышенную заболеваемость, преждевременную смерть, возникновение
возможных необратимых изменений в будущих поколениях.
В целях защиты окружающей среды работа
промышленных предприятий должна быть организована таким образом, чтобы
образующиеся отходы превращались в новые продукты. Поэтому необходимо создавать
такие схемы и режимы производства, при которых:
максимально используются все ингредиенты сырья и
обеспечивается соблюдение ПДК вредных веществ в отходящих потоках;
обеспечивается полный кругооборот воды,
позволяющий резко сократить потребность предприятия в свежей воде;
реализуется утилизация тепла реакций, в
результате чего некоторые производства превращаются из энергопотребляющих в
энергопроизводящие;
обеспечивается выпуск продукции высокого
качества, которую можно использовать более эффективно и более длительный срок.
Данная работа связана с производством
красителей, в процессе синтеза которых используют и получают ряд токсичных,
горючих и взрывоопасных веществ. К числу токсичных веществ относятся, прежде
всего, ароматические амины, а также нитрит натрия и оксиды азота, образующиеся
при неправильном ведении процесса получения диазосоединения.
При соблюдении техники безопасности и норм
технологического режима вредное воздействие этих веществ на человека и природу
практически исключается. Производство
красителей связано с использованием огромного количества воды, которая не
должна сбрасываться в загрязненном состоянии. Идеальным
способом избавится от загрязненных стоков является организация безотходных
производств, при которых все продукты находят полезное применение. Это очень
непростая задача. Поэтому основной проблемой является очистка сточных вод до
такого состояния, когда они могут быть возвращены в производственный цикл или
доведены до такой степени чистоты, когда сброс их в естественные водоемы не
нанесет ущерба природе.
Предполагаемая технологическая схема
Экологическая характеристика темы работы
Целью настоящей дипломной работы является
изучение реакционной способности 3-нитро-7Н-бенз-(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-она
и получение на его основе красителей, обладающих определенными свойствами.
Данная
работа носит научно-исследовательский характер, поэтому можно сказать лишь о
возможном количестве и ассортименте отходов в масштабе дипломной работы.
В процессе получения красителей на стадии
реакции диазотирования возможно образование газообразных отходов в результате
несоблюдения норм технологического режима, таких как: повышение температуры;
слишком быстрое прибавление нитрита натрия. Для предотвращения попадания оксида
азота в атмосферу используют барботажный абсорбер колокольного типа:
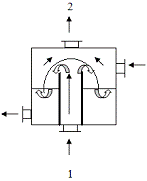
1 - отходящие газы, оксиды азота;
- отходящие газы;
- 1%-раствор едкого натра.
На стадии фильтрования готового продукта
остается на фильтре продукт, а в приемник стекает фильтрат, содержащий
следующие вещества: серная кислота, гидросульфат натрия, этанол, вода. Серная
кислота в незначительных количествах может нейтрализоваться щелочью.
Предприятие по производству данных красителей
целесообразно построить в месте, доступном для привоза сырья, обеспеченном
необходимым количеством воды, электроэнергии, рабочими. Предполагаемое место
внедрения результатов работы: центр европейской части России (р. Волга).
Токсикологическая характеристика сырья,
реагентов и промежуточных продуктов приведена в разделе "Охрана
труда".
Токсикологическая характеристика сырья,
реагентов, промежуточных и конечных продуктов
. Хлороформ.
а) Физико-химические свойства:
Бесцветная жидкость. Молекулярная масса 119,37;
плотность 1,498 г/см3; температура кипения 58-61,5°С. Нерастворим в
воде.
б) Токсические свойства:
Наркотик, действующий токсически на обмен
веществ и внутренние органы, особенно на печень. Порог восприятия запаха 0,0003
мг/л. Наркотическая концентрация паров 70-80 мг/л. ПДК в воздухе рабочей зоны
5,0 мг/м куб. Класс опасности 3.
в) Пожаровзрывоопасные свойства:
Не воспламеняется.
. Ацетон (2-пропанон, диметилкетон).
а) Физико-химические свойства:
Бесцветная жидкость с резким запахом. Молекулярная
масса 58,08; плотность 0,791г/см3; температура кипения 56,24°С;
температура плавления -95,35°С. Неограниченно растворим в воде.
б) Токсические свойства:
Наркотик, поражающий все отделы ЦНС.
Накапливается в организме, может всасываться через поврежденную кожу. ПДК в
воздухе рабочей зоны производственных помещений 200 мг/м куб. Класс опасности
4.
в) Пожаровзрывоопасные свойства:
Легковоспламеняющаяся жидкость. Относится к
классу В1.
НКПВ 2,7%об. ВКПВ 13%об. НТПВ -20°С. ВТПВ 6°С.
Температура самовоспламенения 535°С; температура воспламенения -5°С;
температура вспышки -18°С (з.т.); -9°С (о.т.). Водные растворы ацетона
пожароопасны. Ацетон отличается способностью при горении на открытой
поверхности прогреваться в глубину, образуя все возрастающий гомотермический
слой.
Средства тушения:
при крупных проливах - распыленная вода, пена,
порошок ПСБ;
в помещениях - объемное тушение;
малые очаги: СО2, вода.
. Нитрит натрия.
а) Физико-химические свойства:
Белые или желтоватые кристаллы. Молекулярная
масса 69; плотность 2,168 г/см3; температура плавления 71°С; при
температуре выше 320°С разлагается, не доходя до кипения. Растворим в воде.
б) Токсические свойства:
Высокоопасное вещество. Является кровяным ядом.
При попадании внутрь, даже при небольших количествах, вызывает сильное
отравление. Сильно расширяет сосуды. Уменьшает кровяное давление, вызывает
паралич сосудов двигательного центра. Переводит гемоглобин в метгемоглобин. ПДК
0,05 мг/м куб. Класс опасности 2.
в) Пожаровзрывоопасные свойства:
Пожаровзрывоопасен. При взаимодействии с
кислородом воздуха и водой не взрывается и не горит.
. Серная кислота.
а) Физико-химические свойства:
Маслянистая, прозрачная, бесцветная жидкость.
Молекулярная масса 98; плотность 1,834 г/см3; температура плавления
10,35°С; температура кипения 330°С. Смешивается с водой, выделяя большое
количество тепла. Начиная с 200°С и выше выделяется оксид серы(V1),
который с водяным паром образует белый туман.
б) Токсические свойства:
Раздражает и прижигает слизистые верхних
дыхательных путей, поражает легкие. При попадании на кожу вызывает тяжелые
ожоги. Аэрозоль серной кислоты обладает выраженным токсическим действием. ПДК
1мг/м куб. Разбавленная серная кислота растворяет металлы с выделением
водорода. Класс опасности 2.
в) Пожаровзрывоопасные свойства:
Негорючая пожароопасная жидкость. Разбавленные
растворы реагируют с металлами, выделяя водород. Концентрированная серная
кислота вызывает самовоспламенение некоторых горючих веществ.
. Этиловый спирт (винный спирт, этанол, метил
карбинол).
а) Физико-химические свойства:
Бесцветная жидкость. Молекулярная масса 46,07;
плотность 0,785 г/см3; температура кипения 78,5°С. В воде растворим
неограниченно.
б) Токсические свойства:
Наркотик. Вызывает сначала возбуждение, а затем
паралич ЦНС. При длительном воздействии больших количеств может вызвать тяжелые
заболевания нервной системы, печени, сердечно-сосудистой системы. ПДК в воздухе
рабочей зоны 1000 мг/м куб. ПДК в атмосфере населенных пунктов 5 мг/м куб.
Класс опасности 4.
в) Пожаровзрывоопасные свойства:
Легковоспламеняющаяся жидкость. Температура
вспышки 13°С (з.т.); 16°С (о.т.); температура воспламенения 18°с; минимальная
температура самовоспламенения 365°С; стандартная температура самовоспламенения
404°С. НКПВ 3,6%об. ВКПВ 17,7%об. НТПВ 11°С. ВТПВ 41°С.
Средства тушения:
при крупных проливах - пена, порошок, ПСБ-3;
в помещениях - объемное тушение;
небольшие очаги: ПСБ, СО2.
. Соляная кислота.
а) Физико-химические свойства:
Бесцветная жидкость. Молекулярная масса 36,46;
плотность 1,639 г/см3; температура плавления 17°С. Кипит с
разложением. Растворима в воде.
б) Токсические свойства:
Вызывает раздражение слизистых носа, глаз,
чувство удушья, кашель. ПДК в воздухе рабочей зоны 5 мг/м куб. ПДК в атмосфере
воздуха населенного пункта 0,2 мг/м куб.Класс опасности 2.
в) Пожаровзрывоопасные свойства:
Негорючая жидкость. Сильные окислители вызывают
выделение газообразного хлора, а смеси азотной и соляной кислот - выделение
хлора и гемиоксида азота.
. Уксусная кислота (этановая).
а) Физико-химические свойства:
Прозрачная жидкость, с резким запахом уксуса.
Молекулярная масса 60,05; плотность 1,049 г/см3; температура кипения
118°С; температура плавления 16,7°С. Хорошо растворяется в воде, этаноле,
эфире.
б) Токсические свойства:
Обладает сильным раздражающим действием на
слизистую оболочку глаз и верхних дыхательных путей. Вызывает риниты,
фарингиты, на коже - ожоги. Концентрация выше 2-3 мг/л является
труднопереносимой. Растворы с концентрацией выше 2% вызывают ожоги глаз. Порог
ощущения запаха 0,0006 мг/л. ПДК в воздухе рабочей зоны 5 мг/м куб. ПДК в
атмосферном воздухе населенных пунктов максимальная разовая 0,2 мг/м куб. и
среднесуточная 0,06 мг/м куб.Класс опасности 3.
в) Пожаровзрывоопасные свойства:
Легковоспламеняющаяся жидкость. Температура
самовоспламенения 465°С; температура воспламенения 61°С; температура вспышки
40°С (з.т.); 54°С (о.т.). НКПВ 4,0%об. ВКПВ 19,9%об. НТПВ 35°С. ВТПВ 76°С. При
концентрациях 55% и менее растворы практически негорючие. Средства тушения те
же, что и у ацетона.
. 3-амино-7Н-бенз(4,5)-имидазо-(2,1-а)-бенз-(d,e)-изохинолин-7-он.
Твердое вещество желтого цвета, без запаха.
Молекулярная масса 285. Температура плавления 260°С. Растворим в ацетоне,
хлороформе. В воде не растворяется.
б) Токсические свойства:
Действует на нервную систему, печень, почки.
Обладает кумулятивными свойствами. Раздражает кожу и слизистые оболочки глаз.
Класс опасности 3.
в) Пожаровзрывоопасные свойства:
Не воспламеняется.
. N,N-диметиланилин.
а) Физико-химические свойства:
Жидкость желтого цвета с неприятным запахом.
Молекулярная масса 121,18; плотность 0,955 г/см3; температура
кипения 194,15°С; температура плавления 2,45°С. Растворим в спирте, уксусной
кислоте. В воде плохо растворим.
б) Токсические свойства:
ПДК рабочей зоны 0,2 мг/м куб. Класс опасности
3.
в) Пожаровзрывоопасные свойства:
Горючая жидкость. Температура вспышки 63°С
(з.т.); 77°С (о.т.); температура самовоспламенения 370°С. НКПВ 1,2%об. ВКПВ
7%об. НТПВ 37°С. ВТПВ 90°С. Средства тушения те же, что и у этанола.
. Краситель, полученный при взаимодействии
исходного амина с N,N-диметиланилином.
а) Физико-химические свойства:
Твердое вещество темно-фиолетового цвета, без
запаха. Молекулярная масса 417. Температура плавления 270°С. Растворим в ДМСО и
ДМФА. В воде, спирте, хлороформе, ацетоне не растворяется.
б) Токсические свойства:
Не обладает повреждающим действием на кожу и
канцерогенной опасностью. Класс опасности 4.
в) Пожаровзрывоопасные свойства:
Не воспламеняется.
.Оксид азота(IV)
и оксид азота(II).
а) Физико-химические свойства:
Газообразные вещества, желтого цвета, с
неприятным запахом. Молекулярная масса 46 и 30, соответственно.
б) Токсичность:
Окислы азота обладают выраженным раздражающим
действием на дыхательные пути, вплоть до отека легких. Признаки отравления
могут возникнуть через 2-12 часов.
Вопросы газоочистки
На стадии получения диазосоединения при
несоблюдении норм технологического режима могут выделяться оксиды азота,
образующиеся в результате реакции разложения азотистой кислоты:
2HNO2
→ N2O3
+ H2O
Для исключения попадания оксидов азота в
атмосферу на крышках аппаратов для диазотирования устанавливают на линии
воздух-вода барботажный абсорбер колокольного типа, заполненный 1%-ым раствором
едкого натра. Нейтрализация окислов азота проходит по реакции:
2NaOH
+
N2O3
→ 2NaNO2 + H2O
Нитрит натрия может быть использован в
дальнейшем. Степень очистки отходящих газов составляют 95-97%.
Переработка и обезвреживание жидких отходов
На последней стадии фильтрования готового
красителя и его промывки остается фильтрат, соединенный с промывными водами,
содержащий смесь неорганических и органических веществ. Жидких отходов после
стадий диазотирования и сочетания при мощности производства 0,72т/год:
m(C2H5OH) = 33,50т;(NaHSO4)
= 0,27т;(H2SO4)
= 86,40т;
m(H2O)
= 1,38т.
Так как жидкие отходы содержат большое
количество кислоты и этанола, то очистка сточных вод от этих веществ имеет
смысл. Этанол можно отогнать при его температуре кипения. Кислоту необходимо
нейтрализовать до рН=6,5 - 8,5 добавлением в сточные воды гидроксида кальция с
содержанием активной извести 5 - 10%. Оставшиеся жидкие отходы отправляются в
промышленную канализацию. Степень очистки 70%.
Переработка и обезвреживание твердых отходов
В данном процессе твердых отходов не образуется.
. Экономическая
оценка природоохранных мероприятий
1. Оценка экономического ущерба от загрязнения
атмосферы.
Величина ущерба от загрязнения атмосферы
определяется по формуле:
фактатм=
Yутвоздσзазвозд
f
M, где
утвозд
- удельный ущерб от выброса в атмосферу одной условной тонны загрязняющих
веществ; он равен 2,4 руб./усл.т (по ценам 1987г.);
σзазвозд
- показатель относительной опасности загрязнения для различных реципиентов;
f - поправка на
характер рассеивания примесей в атмосфере;
M - приведенная
масса годового выброса вредных компонентов ( в условных тоннах).
Приведенная масса вычисляется по формуле:
= ∑ Aiвозд
mi, где
- масса примесей i-го
вида, поступающих в атмосферу, т;
Аiвозд
- показатель относительной агрессивности, характеризующий количество оксида
углерода, эквивалентное по воздействию на окружающую среду одной тонне этого
вещества ( усл.т/т).
Для определения показателей относительной
агрессивности пользуются формулой:
Аiвозд=
аi * αi
* δi * λi
* βi , где
аi
- характеризует относительную опасность присутствия примеси в воздухе,
вдыхаемом человеком;
αi
- поправка, учитывающая вероятность накопления исходной примеси или вторичных
загрязняющих веществ в компонентах окружающей среды и цепях питания, а также
поступления примеси в организм человека неингаляционным путем(αi=1);
δi
- поправка, характеризующая вредное воздействие примеси на остальных
реципиентов (кроме человека)(δi=1,5);
λi
- поправка, на вероятность вторичного заброса примесей в атмосферу после их
оседания на поверхность (для пыли)(λi=1);
βi
- поправка на вероятность образования из исходных примесей, выброшенных в
атмосферу, других (вторичных) загрязняющих веществ, более опасных, чем исходные
(для легких углеводородов)(βi=1).
аi=(ПДКсс
со ПДКрз со/(ПДКссiПДКрзi))0,5=(60/ПДКссiПДКрзi)0,5,
где
ПДКсс - среднесуточные ПДК;
ПДКрз - разовые ПДК.
аi=(60/0,085мг/м
куб. * 5мг/м куб.)0,5=11,88, так как
ПДКссNO2=0,085мг/м
куб.;
ПДКрзNO2=5мг/м
куб.
Аiвозд=11,88
* 1 * 1,5 * 1 * 1=17,82.
Предполагаем, что выброс окислов азота в
атмосферу составит 0,36кг/год при мощности производства 0,72т/год.
М=17,82 * 0,36 * 10-3=6,40*10-3 т/год.
Величина поправки на характер рассеивания
примесей равна:
=(100/(100+φh))
* (4/(1+U))
при рассеивании газообразных частиц, где
φ - поправка для учета
подъема факела;
h - геометрическая
высота устья источника по отношению к среднему уровню ЗАЗ (зоны активного
загрязнения)(неорганизованный источник) м;
U - среднегодовое
значение модуля скорости ветра на уровне флюгера, м/с.
φ=1+∆t/75°С,
где
∆t
- разность температур в устье источника и в окружающей среде, принимаем равной
10°С.
φ=1+10/75=1,13;
h=15м(труба,
отходящая от аппарата);
U=3м/с;
f=(100/(100+1,13 *
15)) * (4/(1+3))=0,855.
σзазвозд=4(для
территории промышленных предприятий и промузлов из таблицы1[3]).
Yфактатм=2,4руб./усл.т
* 4 * 0,855 * 6,40*10-3т/год=0,05руб./год.
Степень очистки отходящих газов от окислов азота
97%. Количество окислов азота, попадающих в атмосферу после прохождения через
очистные сооружения:
m=0,36кг/год *
(1-0,97)=0,01кг/год;
М=17,82 * 0,01 *10-3=1,78*10-3т/год.
Yвозможатм=2,4руб./усл.т
* 4 * 0,855 * 1,78*10-3т/год=0,01руб./год.
Предотвращенный ущерб от загрязнения атмосферы
окислами азота:
предотватм=0,05
- 0,01=0,04руб./год.
.Оценка экономического ущерба от загрязнения
водных объектов.
Величина ущерба от загрязнения водной среды
определяется в соответствии с выражением:
фактвод=Yутвод
*
σквод
* М, где
утвод
- удельный ущерб, причиняемый народному хозяйству сбросом в водоемы одной
условной тонны загрязняющих веществ; он равен 400руб./усл.т (по ценам 1987г.);
σквод
- показатель относительной опасности загрязнения водоемов; он равен 2,6(из
таблицы 5[3]);
М - приведенная масса сбрасываемых в водоемы
веществ (усл.т).
Приведенная масса загрязняющих веществ в годовом
объеме сточных вод может быть определена в условных тоннах, как:
М=∑Аiвод
mi, где
- масса примесей i-го
вида, поступающих в водные объекты, т;
Аiвод
-
показатель относительной агрессивности вод (усл.т/т);
Аiвод=1/ПДКвi,
где
ПДКвi
- ПДК вещества в воде, мг/л.
|
Формула
вещества
|
ПДКвi, мг/л
|
Ai,усл.т/т
|
mi, т
|
|
C2H5OH
|
6,76
|
0,15
|
33,50
|
|
SO4-
|
100
|
0,01
|
86,40
|
|
NaHSO4 Na+ HSO4-
|
-
120
100
|
- 0,008 0,01
|
0,27 0,05 0,22
|
Предполагаемая мощность производства 0,72т/год
готового красителя:
М=0,72 * (0,15 * 33,50+0,01 *
86,40+0,008*0,05+0,01*0,22)=4,24усл.т/год.
Yфактвод=400руб./усл.т
* 2,6 * 4,24усл.т/год=4409,60руб./год.
Так как степень очистки водоема 70%:
возможвод=4409,60руб./год
* (1-0,7)=1322,88руб./год.
Предотвращенный ущерб:
предотввод=4409,60
- 1322,88=3086,72руб./год.
Заключение
В разделе "Охрана окружающей среды от
промышленных загрязнений" с точки зрения экологии были рассмотрены вопросы
получения одного из красителей на основе бензимидазола.
В процессе синтеза на стадии реакции
диазотирования могут при несоблюдении технологического режима образовываться
оксиды азота, которые в данной технологической схеме улавливаются с помощью
барботажного абсорбера колокольного типа (степень очистки отходящих газов 97%).
Сточные воды после фильтрования готового
продукта через коллектор сточных вод могут быть направлены в канализацию после
очистки от этанола и нейтрализации.
Суммарный экономический эффект от
природоохранных мероприятий составляет 3086,76руб./год.
Литература
1. Родионов А.И., Клушин В.Н.,
Торочешников Н.С. Техника защиты окружающей среды. М.:Химия, 1989.512с.
. Беспамятнов Г.П., Кротов Ю.А.
Предельно допустимые концентрации химических веществ в окружающей среде.
Л.:Химия, 1985. 528с.
. Тарасова Н.П., Малков А.В., Гусева
Т.В. Выполнение раздела дипломной работы (проекта) "Охрана окружающей
среды от промышленных загрязнений": Учебное пособие/РХТУ
им.Д.И.Менделеева. М.,1997.68с.