Исследование уравнений реакций
1. Рассчитайте молярную
массу эквивалентов воды при реакции
а) с металлическим натрием;
б) с оксидом натрия.
Решение:
а) 2Na + 2H2O = 2NaOH + H2h
Из закона эквивалентов:
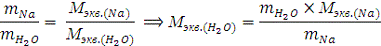
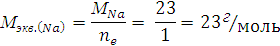
где ne - число отданных Na электронов.
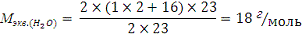
б) Na2O + H2O = 2NaOH
Из закона эквивалентов:
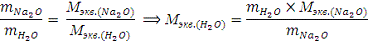

где n - число катионов соответствующих
оксиду основания Na2O.
|c.o| - абсолютное значение степени
окисления катиона Na
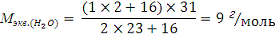
2. Назовите элементы,
внешний энергетический уровень атомов который выражается электронной
конфигурацией np4. Напишите полную
электронную конфигурацию атома одного из этих элементов и укажите электронное
семейство
Решение
Элементы, внешний энергетический
уровень атомов которых выражается электронной конфигурацией np4 являются:
Кислород 8 O 2s22p4 1s22s22p4
Сера 16 S 3s23p4 1s22s22p63s23p4
Селен 34 Se 4s24p4 1s22s22p63s23p64s23d104p4
Теллур 52 Te 5s25p4 1s22s22p63s23p64s23d104p65s24d105p4
Полоний 84 Po 6s26p4 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p4
Все вышеперечисленные элементы
принадлежат к p - электронному семейству.
3. Исходя из положения
металла в Периодической системе, дайте мотивированный ответ на вопрос: какой из
двух гидроксидов является более сильным основанием: а) Mg(OH)2 или Ba(OH)2; б) Ca(OH)2 или Co(OH)2; в) Ca(OH)2 или Zn(OH)2? Напишите
уравнения реакций, доказывающих амфотерность гидроксида цинка
Внутри подгруппы с увеличением
заряда ядра возрастают металлические свойства и ослабевают неметаллические,
следовательно, усиливаются основные свойства их соединений и ослабевают
кислотные свойства.
а) В главной подгруппе сверху вниз
периодической системы усиливается основной характер гидроксидов: из пары Mg(OH)2 и Ba(OH)2 более
сильным основанием будет являться Ba(OH)2;
В периоде с лева на право основной
характер гидроксидов постепенно ослабляется, сменяясь амфотерностью к кислотным
свойствам внутри периода, т.к. анионам легче присоединять электроны чем
отдавать;
б) В паре Ca(OH)2 и Co(OH)2 более
сильным будет Ca(OH)2 т. к. элемент кобальт является d-элементом (не заполненный d-подуровень), и будет склонен к
комплексообразованию, также они находятся в разных подгруппах;
в) В паре Ca(OH)2 и Zn(OH)2 более
сильным основанием будет Ca(OH)2 т.к. находятся в разных подгруппах и цинк будет
склонен к комплексообразованию (d-элемент, наличие свободных f-орбиталей)
ZnCl2 +NaOH = Zn(OH)2 +NaCl - cоли цинка взаимодействуют со
щелочами образуя гидроксид
Zn(OH)2+HCl=ZnCl2+H2O - гидроксид цинка при
взаимодействии с кислотами растворяется образуя соль
Zn+ H2O+2KOH=K2[Zn(OH)4]+H2h - при переизбытке щелочи Zn образует комплексные
соединения
Zn +2NaOH = Na2ZnO2 + H2h
Zn+2HCl=ZnCl2+H2h
4. При растворении 16 г.
CaC2 в воде выделяется
31,27 кДж теплоты. Определить стандартную энтальпию образования Ca(OH)2
CaC2 кр+ 2H2Oжид = Ca(OH)2кр+ C2H2газh-rHp
1) Рассчитаем сколько количество
молей CaC2 прореагировало:
М (CaC2)=64 г/моль
M(CaC2)=16 г
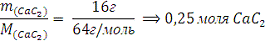
) т.е. при взаимодействии 0,25 моля
СаС2 выделяется - 31,27 кДж теплоты, а т.к. стандартная
энтальпия рассчитывается на 1 моль вещества, то рассчитываем сколько тепла
выделится при взаимодействии 1 моля СаС2
0,25 моля выделится - 31,27 кДж
теплоты
,0 моля выделится - х кДж теплоты

) исходя из таблицы «стандарт
энтальпии образований» находим стандартные энтальпии веществ:
rH(СаС2кр)=-62,7 кДж
rH(H2Oж)=-285,8 кДж
rH(C2H2газ)= 226,8 кДж
) Исходя из уравнения rHp рассчитывается как:
rHp=∑rH(продуктов) - ∑rH (исходных веществ);
rHp=(rH (Ca(OH)2кр)+ rH(C2H2г)) - (rH(CaC2кр)+2rH(H2Oж)) =>
rHp=rH (Ca(OH)2кр+ rH(C2H2г) - rH(CaC2кр) - 2rH(H2Oж), находим rH (Ca(OH)2кр:
rH (Ca(OH)2кр=rHp - rH(C2H2г) + rH(CaC2кр) + 2rH(H2Oж) подставим значения стандартных
энтальпий в уравнение:
rH (Ca(OH)2кр=-125,08
- (226,8)+(-62,7)+2*(-285,8)=-125,08-226,8-62,7-2*285,8= = - 986,18кДж/моль
Ответ: -986,2 кДж/моль
5. При состоянии
равновесия системы N2 +3H2 ↔ 2NH3 концентрации
веществ были (моль/л): [N2] = 0,3; [H2] = 0,9; [NH3] = 0,4.
Рассчитайте, как изменятся скорости прямой и обратной реакции, если давление
увеличить в 4 раза. В каком направлении сместится равновесие?
Для решения воспользуемся законом
действия масс.
. Записываем математическое
выражение для начальной скорости прямой и обратной реакции
ϑн(п) = k ∗ CN2 ∗ (CH2)3
ϑн(о) = k ∗ (СNH3)2
2. Записываем математическое
выражение для конечной скорости прямой обратной реакции (после увеличения
давления в 4 раза)
ϑк(п) = k ∗ 4 ∗ CN ∗ (4∗CH2)3 = k ∗ 256 ∗ CN ∗ (CH2)3
ϑк(о) = k ∗ (4∗СNH3)2 = k ∗ 16 ∗ (СNH3)2
. Найдём отношение скоростей
прямой и обратной реакции
ϑк(п) k ∗ 256 ∗ CN ∗ (CH2)3
ϑн(п) k ∗ CN2 ∗ (CH2)3
6. Составьте
молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах
между: а) BaCO3 и HNO3; б) Fe2(SO4)3 и KOH; в) HCl и K2S; г) CH3COOK и HCl
а) BaCO3 â+ 2HNO3 = Ba(NO3)2 + H2CO3h
BaCO3â+2Н2++2NO3- = Ba2+ +2NO3
- +2H+ + CO32-
BaCO3â= Ba2+ + CO32-
б) Fe2(SO4)3+6KOH=2Fe(OH)3â+3K2SO4
2Fe3+ +3SO42
- +6K+ +6OH - =2Fe(OH)3â+6K+ +3SO42-
2Fe3+ +6OH
- =2Fe(OH)3â
в) 2HCl+K2S=H2S+2KCl
H++2Cl -
+2K+ +S2 - =2H+ +S2 - +2K+
+2Cl-
В реакции прореагировали все
вещества, но ионная реакция сопровождается образованием газа (сероводорода),
тогда:
2HCl+K2S=H2Sh+2KCl
H++2Cl -
+2K+ + S2- = H2Sh +2K+
+2Cl -
H+ +S2- =
H2Sh
г) CH3COOK+HCl=CH3COOH+KCl3COO -
+ K++H++Cl - =CH3COO - +
H++ K+ +Cl -
CH3COO -
+ K++H++Cl - =CH3COОН + K+
+Cl -, слабый элетролит CH3COОН3COO - + H+ =CH3COОН
7. Чему равна величина
ЭДС гальванического элемента, составленного из стандартных цинкового и
серебряного электродов, погруженных в растворы их солей? Приведите схему
гальванического элемента и реакции, и реакции протекающие на электродах при его
работе
Схема гальванического элемента:
(-) Zn | Zn2+ || Ag+ | Ag (+)
На аноде протекают реакции: Zn0-2e=Zn2+
На катоде протекают реакции: Ag++e=Ag0
Т.к. потенциал Е0(Ag)> Е0(Zn)
Е0(Ag+ |Ag)= +0,80В
Е0(Zn2+ | Zn)= -0,763В
то на серебряном электроде будет
протекать восстановление (будет являться катодом), а на цинковом электроде
будет протекать окисление (он будет анодом);
Потенциал гальванического элемента:
Е = Е0катода -
Е0анода =0,80 - (-0,763)=1,562В
Ответ: 1,562 В.
8. Изделие из алюминия
склёпано медью. Какой из металлов будет подвергаться коррозии с водородной
деполяризацией, если эти металлы попадут в кислую среду (HCl)? Составьте уравнения
проходящих при этом процессов, приведите схему образующегося гальванического
элемента. Определите продукты коррозии
В реакциях с кислотами атомы
алюминия окисляются ионами водорода в ионы алюминия, которые переходят в
раствор:
Al+6H+→2Al3+ +3H2h
Медь в электрохимическом ряду
напряжения металлов находится за водородом, (т.е. её стандартный потенциал
положительный) и с разбавленными кислотами не реагирует (положительно
заряженные ионы меди не переходят в раствор).
В кристаллической решетке меди (в
отличие от алюминия) свободные электроны не накапливаются. При соприкосновении
этих двух металлов свободные электроны алюминия переходят к меди и
восстанавливают на её поверхность ионы водорода:
H+ +2e→H2h
Продуктами коррозии будет являться
результат взаимодействия алюминия с соляной кислотой:
Al+6HCl→2AlCl3+3H2h
Образуется гальванический элемент:
(-) Al |AlCl3|Cu(+)
Анод катод.
9. При электролизе
водных растворов каких из приведённых ниже веществ на катоде выделяется только
металл: хлорид бария, хлорид меди (II), иодид калия, нитрат
серебра, сульфид натрия? Приведите соответствующие уравнения электродных
процессов
При электролизе водных растворов
катионов металлов, у которых стандартный электродный потенциал больше чем
водорода (Е0>>-0,41В) на катоде восстанавливаются только
катионы металлов. В данном случае это хлорид меди (II) и нитрат серебра:
(-) Катод
Суммарный процесс электролиза:

Суммарный процесс электролиза:
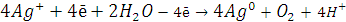
Суммарное молекулярное уравнение
электролиза:
 .
.
Библиографический список
1. Будякк Е.В. Химия: учеб. пособие Иркутск: Изд-во ИрГТУ,
2008. - 160 с.
. Коровин Н.В. Общая химия. М. Высш. шк., 2002. 558 с.
. Кузнецова А.А. Химия: метод. указания по освоению
дисциплины для студентов заочной формы обучения. Иркутск: Изд-во ИрГТУ, 2010.
44 с.
. Химия: метод. указания, программа, решение типовых задач
и контрольные задания для студентов заочного обучения технических направлений и
специальностей / сост.: В.И. Дударев, В.П. Зуева, О.В. Лебедева, Ю.Н. Пожидаев,
З.Н. Топшиноева, А.Н. Шибанова. Иркутск: Изд-во ИрГТУ, 2007. 92 с.