Смешанные растворители и их свойства
СМЕШАННЫЕ
РАСТВОРИТЕЛИ И ИХ СВОЙСТВА
СОДЕРЖАНИЕ
1 КЛАССИФИКАЦИЯ РАСТВОРИТЕЛЕЙ
ФИЗИЧЕСКИЕ СВОЙСТВА
СМЕШАННЫХ РАСТВОРИТЕЛЕЙ, ОБРАЗОВАННЫХ ХИМИЧЕСКИ НЕ ВЗАИМОДЕЙСТВУЮЩИМИ
КОМПОНЕНТАМИ
.1 Диэлектрическая
проницаемость
.2 Вязкость
.3 Плотность, молярный объем
.4 Электрическая проводимость
ФИЗИЧЕСКИЕ СВОЙСТВА
СМЕШАННЫХ РАСТВОРИТЕЛЕЙ, ОБРАЗОВАННЫХ ХИМИЧЕСКИ ВЗАИМОДЕЙСТВУЮЩИМИ КОМПОНЕНТАМИ
.1 Диэлектрическая
проницаемость
.2 Вязкость
.3 Плотность, молярный объем
.4 Электрическая проводимость
ХИМИЧЕСКИЕ СВОЙСТВА
СМЕШАННЫХ РАСТВОРИТЕЛЕЙ
.1 Константы автопротолиза
.2 Сольватирующая способность
.3 Донорно-акцепторные
свойства
ВЫВОДЫ
СПИСОК ИСПОЛЬЗОВАННОЙ
ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
Энергии специфической и универсальной
сольватации являются основными факторами, определяющими характеристики
протекающих в растворах процессов. Направленно изменять оба эти фактора,
ограничиваясь индивидуальными растворителями, весьма трудно, а нередко и вовсе
невозможно. Действительно, переход от одного растворителя к другому с целью
изменить в необходимом направлении энергию специфической сольватации, может
привести к изменению (в нежелательном направлении) диэлектрической
проницаемости (ДП) и, следовательно, энергии электростатаческих взаимодействий
в системе. Аналогично, стремление изменить ДП в нужном направлении может быть
сопряжено с нежелательным для экспериментатора изменением энергии специфической
сольватации.
Вот почему в химии растворов за последние
десятилетия чрезвычайно большое, нередко доминирующее распространение получили
смешанные, чаще всего двойные растворители, позволяющие направленно изменять и
подбирать физико-химические свойства среды.
1.
КЛАССИФИКАЦИЯ РАСТВОРИТЕЛЕЙ
смешанный
растворитель
Существуют несколько подходов к классификации
растворителей. Для этого обычно выбирают какой-то один (реже несколько)
характерный признак растворителей, оставляя в стороне другие. Таким образом,
заранее нельзя ожидать безупречной классификации, так как любая из них будет
условной. Поскольку вода является уникальным растворителем, то ее часто не
включают ни в одну из классификаций, а оставляют как эталон для сравнения.
Некоторые системы классификации основаны на физических свойствах растворителей.
В их основу положены такие параметры, как диэлектрическая проницаемость,
вязкость, температура кипения растворителей, а также дипольные моменты молекул
растворителей.
Растворы бывают:
· ненасыщенные,
· насыщенные
· пересыщенные.
Ненасыщенным называется раствор, у которого
граница растворимости не достигнута.
Насыщенный раствор - это раствор, содержащий
максимально возможное при определенных условиях количество вещества.
Пересыщенный -- это раствор, в котором
содержится растворенного вещества больше того количества, что соответствует его
нормальной растворимости при данных условиях .
В аптечных условиях чаще готовят ненасыщенные
растворы, реже -- насыщенные и пересыщенные, так как они являются нестойкими
системами. Кроме растворов твердых и жидких лекарственных средств, применяются
еще некоторые растворы газов в воде, например, аммиака(10--25 %), хлористого
водорода (25 %), формальдегида (36,5--37,5 %) и т. д. В аптеках эти
концентрированные растворы в меру необходимости разводятся водой или другим
растворителем до указанной в рецепте концентрации.
Однако наиболее распространенные классификации
основаны на химических свойствах растворителей. Перечислим некоторые из них.
Классификация на неорганические и органические
растворители. К числу неорганических растворителей относятся: вода - самый
распространённый растворитель в природе, жидкий аммиак -- хороший растворитель
для щелочных металлов, производные фосфора, серы, солей, аминов. Большое
значение имеют многочисленные органические растворители. Это, прежде всего,
углеводороды и их галогенопроизводные, спирты, простые и сложные эфиры, кетоны,
нитросоединения.
Классификация на основе кислотно-основных
свойств. Здесь особую роль отводят кислотно-основным представлениям
Бренстеда-Лоури. Растворители делят на протонные и апротонные. К протонным
относят растворители, которые проявляют протон-донорную или протон-акцепторную
функцию по отношению к растворенному веществу. В зависимости от этого протонные
растворители, в свою очередь, делят на протогенные (способные поставлять
протоны), протофильные (способные принимать протоны) и амфипротонные (способные
как поставлять, так и принимать протоны).
Классификация по способности растворителей к
образованию водородных связей, поскольку при взаимодействии ионов с молекулами
растворителей важную роль играют именно эти связи. По этой классификации
растворители разделены на пять групп.
· К первой относятся жидкие растворители,
способные к образованию объемной трехмерной сетки водородных связей (муравьиная
кислота, гликоли и т.п.).
· Ко второй относятся растворители, в которых
образуется двумерная сетка водородных связей. Они, как правило, содержат одну
группу ОН (фенолы, одноатомные спирты, одноосновные низшие карбоновые кислоты,
за исключением муравьиной).
· К третьей группе относятся растворители,
которые имеют в своем составе электроотрицательные атомы азота, кислорода,
серы, фтора, способные участвовать в образовании водородных связей (эфиры,
тиоэфиры, амины, кетоны, альдегиды и др.).
· К четвертой группе относятся растворители,
молекулы которых имеют атом водорода, способный к образованию водородных
связей, но не имеют атомов, которые могли бы быть акцепторами протонов
(хлороформ, дихлорэтан и т.п.).
· К пятой группе относятся растворители,
молекулы которых при обычных условиях не способны к образованию водородных
связей ни в качестве доноров, ни в качестве акцепторов протонов (углеводороды,
четыреххлористый углерод и т.п.).
В зависимости от природы растворителя выделяют
водные и неводные растворы
В медицинской практике широкое применение
находят растворы на неводных растворителях (неводные растворы) в качестве примочек,
полосканий, смазываний, обмываний, интраназальных капель, ингаляций.
Для получения растворов из веществ,
нерастворимых в воде или трудно растворимых, для пролонгирования действия,
повышения стабильности, устранения гидролиза применяют неводные растворители.
Наиболее часто на практике встречаются:
· масла жирные растительного
происхождения (миндальное и персиковое);
· эфиры простые и сложные (этилолеат);
· спирты одноатомные и многоатомные
(этанол 2--30%-ный, поливинол, сорбит, маннит);
· амиды (диметиламид,
бета-оксиэтиллактамид);
· сульфоксиды и сульфон
(диметилсульфоксид, сульфолан).
Неводные растворы представляют собой гомогенные
дисперсные системы, структурными единицами в которых являются ионы и молекулы..
Неводные растворы не содержать механических включений, быть стабильными при
хранении.
Кроме общих требований, к неводным растворителям
предъявляются дополнительные, такие как:
§ прозрачность;
§ термостойкость (температура кипения более 100
°С, а замерзания не выше +5 °С);
§ биологическая совместимость (по величине рН и
осмотического давления);
§ химическая чистота;
§ стабильность;
§ вязкость и текучесть растворителей не должны
нарушать всасывание, затруднять фильтрование и наполнение ампул для готовых
растворов.
С технологической точки зрения неводные
растворители делят на три группы:
· летучие растворители (спирт этиловый,
хлороформ, эфир, бензин, скипидар, и др.)
· нелетучие растворители (жирные масла, жидкий
парафин, глицерин, димексид, полиэтиленоксиды, эсилоны и др.).
· комбинированные растворители (этанол с
глицерином, глицерин с димексидом, водой и др.).
Преимуществами их являются возможность сочетания
в одной форме нескольких действующих веществ с различной растворимостью,
использование неводных растворителей одновременно. Неводные растворы просты в
изготовлении, разнообразны по способам назначения, более стабильны при
хранении, чем водные. Качество неводных растворов и выбор технологических
приемов их изготовления зависят главным образом от физико-химических свойств
растворителей. Неводные растворители отличаются друг от друга химической
структурой, наличием и количеством функциональных групп, диэлектрической
проницаемостью, различной растворяющей способностью по отношению другим
веществам и, как следствие, различной стабильностью, степенью химической
индифферентности.
Летучие растворители:
Эфир медицинский, хлороформ, этиловый спирт
являются прекрасными растворителями для большой группы веществ - эфирных масел,
органических кислот, смол, йода и т. д. и легко смешивается с другими
растворителями - водой, глицерином, диэтиловым эфиром, хлороформом и т.
Нелетучие растворители:
Масло вазелиновое, жидкий парафин, глицерин,
масла жирные
В маслах хорошо растворяются различные препараты
- ментол, камфора, фенол, ртути йодид, фенилсалицилат, алкалоиды - основания,
эфирные масла и т. д.
Водные растворители
Вода фармакологически индифферентна, доступна и
хорошо растворяет многие вещества, но в то же время в ней довольно быстро
гидролизуются некоторые вещества и размножаются микроорганизмы. Это самый дешевый
растворитель использующийся в 68% случаев изготовления растворов (исключая
настойки и отвары).
Деминерализованная вода получается путем
обессоливания водопроводной воды с помощью специальных ионообменных смол.
Деминерализованная вода может использоваться для мытья аптечной посуды и
различных упаковок. Вода деминерализованная не должна использоваться для
парентерального применения, но может применяться для приготовления всех жидких
лекарственных форм, растворов, реактивов
В последнее время уделяют внимание использованию
воды деминерализованной вместо дистиллированной. Это связано с тем, что
электрические дистилляторы часто выходят из строя. Высокое содержание солей в
исходной воде приводит к образованию накипи на стенках испарителя, что ухудшает
условие дистилляции и снижает качество воды.
· Дистиллированная вода
Дистиллированная вода. Как известно, питьевая
вода всегда содержит примеси растворенных в ней различных химических соединений
и поэтому не всегда пригодна для приготовления растворов.
Дистиллированная, вода должна быть бесцветной,
прозрачной, не иметь запаха и вкуса: рН дистиллированной воды должен быть в
пределах 5,0-6,8. Дистиллированная вода не должна содержать хлоридов,
сульфатов, нитратов, нитритов, солей кальция и тяжелых металлов. [1]
Комбинированные растворители
Приготовление растворов на комбинированных
растворителях.
Другие растворители
· Спирт метиловый или древесный.
Получается синтетически. По запаху напоминает этиловый. Сильный яд: доза 15 -
20 мл смертельна. Смешивают с водой.
· Изопропиловый спирт. Ядовит.
Образующая смесь с водой, содержит 12,3% воды.
· Ацетон . Смешивается с водой и
органическими растворами.
· Уксусная кислота .Используется б/в и
водные растворы. Б/в при температуре <16,6?C застывает в кристаллы, похожие
на лед. Смешивается с водой, спиртом, эфиром и другими растворителями.
· Этиловый эфир. Растворяется в 12
частях воды. Смешивается со спиртом, хлороформом, петролейным эфиром и др.
· Бензины (смесь углеводородов).
Важное свойство - быстро улетучиваются, очень огнеопасны.
· Хлороформ. Смешивается со спиртом,
эфиром, бензином. Трудно растворяется в воде (1:200). Дихлорэтан. Смешивается
со спиртом, эфиром. При вдыхании паров - отравление. Малоогнеопасен.
· Четыреххлористый углерод
.Неогнеопасен.
В качестве растворителей используются смеси
различных индивидуальных веществ, например бензины, петролейный эфир, смеси
спиртов и эфиров.
Стабилизация растворов
Под стабильностью понимают неизменяемость
состава и концентрации находящихся в растворе веществ в течении установленных
сроков хранения. Стабильность зависит от качества и колличества исходных
растворителей.. Стабильность достигается соблюдением оптимальных условий
стерилизации, использованием допустимых консервантов, которые позволяют
достигать необходимый эффект стерилизации при более низкой температуре.
Стабильность достигается применением стабилизаторов, соответствующих природе
веществ.
При хранении некоторые вещества теряют
первоначальную структуру, изменяют свои свойства при тепловой стерилизации, в
растворах могут протекать нежелательные химические реакции (гидролиз,
изомеризация, фотохимические и окислительно-восстановительные реакции).
Стабилизировать растворы можно физическими и химическими способами.
Физические способы:
· подбор ампул из химически стойкого
материала (например, замена стекла на полимер);
· раздельное ампулирование вещества и
растворителя;
· соблюдение принципа газовой защиты.
Химические способы:
§ добавление антиоксидантов;
§ добавление стабилизаторов.[2]
2.
ФИЗИЧЕСКИЕ СВОЙСТВА СМЕШАННЫХ РАСТВОРИТЕЛЕЙ, ОБРАЗОВАННЫХ ХИМИЧЕСКИ НЕ
ВЗАИМОДЕЙСТВУЮЩИМИ КОМПОНЕНТАМИ
.1
Диэлектрическая
проницаемость
В жидких системах с химически
невзаимодействующими компонентами молярная поляризация Рм, по определению,
аддитивна при выражении состава в молярных долях:
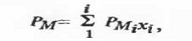
Где xi-
молярная доля соответствующего компонента смеси.
В случае двойной жидкой системы
(двойного смешанного растворителя)

Где х-молярная доля первого
компонента; здесь и далее обозначения без цифрових индексов относятся к
аддитивным значениям свойств смесей.
Поскольку
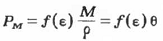
То
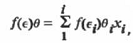
или для двойного смешанного растворителя
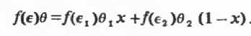
Здесь М- аддитивная молекулярная масса
смеси, р - ее плотность, Ө - молярный объем, f(є)
- одна из функций.
В соответствии с правилами перевода аддитивных
свойств от одного способа выражения состава к другому следует, что
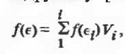
а для двойной системы
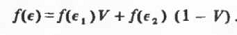
Здесь V - объемная доля.
Подставляя в (2.1.1)
любую из функций, приходим к выводу об объемно-долевой аддитивности ДП:
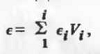
или для двойного смешанного растворителя

Обширный экспериментальный материал по ДП
двойных жидких систем [11,408] показывает, что уравнение
(2.1.2) соблюдается с
удовлетворительной точностью в системах образованных
неассоциированны-ми в индивидуальном состоянии компонентами. В системах с
ассоциированными (одним или несколькими) компонентами следует принимать во
внимание флуктуации ДП, которые в свою очередь обусловлены флуктуациями концентрации,
плотности, ориентации и т.п.. Учет флуктуации ДП показывает, что для расчета є
смеси двух химически невзаимодействующих жидкостей из значения є,
определяемого по уравнению (2.1.2а),
следует вычесть Δє,
находимое как
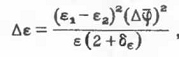
где Δφ-
флуктуации плотности, а 
Значение Δє
может быть рассчитано по упрощенному уравнению. Так, для равнообъемных смесей (V=0,5)
двух растворителей
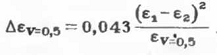
Таким образом, ДП равнообъемной смеси двух
химически не взаимодействующих растворителей может быть рассчитана по уравнению
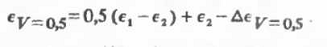
Располагая данными по ДП обоих исходных
компонентов и одной из смесей, нетрудно интерполировать эти значения на смесь
любого состава.
Для систем, образованных двумя ассоциированными
жидкостями, сколько-нибудь надежных теоретических методов расчета изотерм ДП не
существует. Предложен эмпирический подход [3], основанный на том, что каждый из
ассоциированных компонентов, будучи смешан с другим ассоциированным
компонентом, химически не взаимодействующим с ним, вносит строго определенный
вклад в отклонение ДП от объемно-долевой аддитивности..
Диэлектрическую проницаемость смесей при
различных температурах с достаточно высокой точностью можно рассчитать, исходя
из абсолютных температурных коэффициентов этого свойства, значения которых для
смесей рассчитывают по уравнениям, идентичным по форме (2.1.2)-(2.1.3). Так,
например, расчет ає
равнообъемной
смеси двух химически не взаимодействующих ассоциированных растворителей
осуществляется по уравнению, идентичному по форме уравнению (2.1.3) [3]:
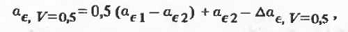
где
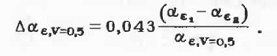
2.2.
Вязкость
В литературе приводится очень большое число
уравнений, предназначенных описывать вязкость смесей химически не
взаимодействующих жидких компонентов. Все эти уравнения независимо от того,
были они выведены теоретическим путем или установлены эмпирически,
подразделяются на две основные группы. К первой относятся уравнения,
связывающие вязкость смеси ŋ с вязкостью исходных компонентов ŋi
и
их содержанием в смеси с (с - в данном случае произвольный способ выражения
концентрации):
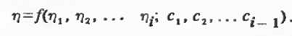
Уравнения второй группы помимо параметров,
содержащихся в уравнениях типа (2.2.1), включают также различные находимые из
эксперимента либо рассчитываемые теоретически постоянные к1 к2…
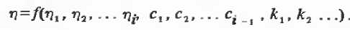
Поскольку точность расчета вязкости смесей
растворителей по уравнениям типа (2.1.2) не выше, чем по уравнениям типа
(2.2.1), ограничимся рассмотрением последних.
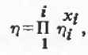
или для двойного смешанного растворителя:
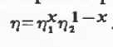
Из (2.1.3) вытекает, что относительный
температурный коэффициент вязкости  смесей
химически не взаимодействующих жидкостей описывается уравнением:
смесей
химически не взаимодействующих жидкостей описывается уравнением:
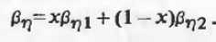
2.3
Плотность, молярный объем
По определению, плотность р для систем
рассматриваемого типа есть объемно-аддитивная функция состава:
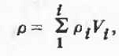
или для двойных систем:
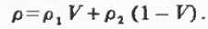
Из (2.3.1) вытекает, что молярный объем
идеальных систем является мольно-аддитивной функцией состава:
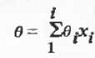
Молекулярная масса смеси, по определению, также
является мольно- аддитивной функцией:
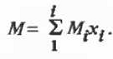
Для двойных смешанных растворителей эти
соотношения представляются в вариантах:

Неидеальность систем приводит к относительным
отклонениям плотности и молярного объема, как и иных волюмометрических свойств,
порядка 1% [4]. При этом примерно равновероятно сжатие и расширение растворов.
В системах, находящихся при условиях, близких к расслаиванию, может наблюдаться
значительное сжатие. Впрочем, двойные смеси, образованные большинством из
распространенных в практике неводных растворителей, при обычных температурах
представляют собою растворы, далекие от расслаивания.
Учитывая линейную зависимость плотности от
температуры, по уравнениям (2.3.1) и (2.3.2) можно рассчитать значения
плотности и молярного объема при необходимой температуре.
2.4
Электрическая проводимость
Сколь-нибудь существенная электропроводимость в
смешанных растворителях, образованных химически не взаимодействующими
компонентами, может проявиться лишь в том случае, если хотя бы один из
компонентов относится к проводящим ток в индивидуальном состоянии. Описано
немало систем типа электролитный компонент - индифферентный растворитель. К
таким системам относятся растворы минеральных кислот (азотной, ортофосфорной),
карбоновых кислот (трифторуксусной, муравьиной), ацидокомплексов аминов и
хлорного олова , а также некоторых тетраалкиламмонийных солей в индифферентных
по отношению к этим объектам растворителях.
Закономерности зависимости электропроводимости
от состава двойного смешанного растворителя типа электролитный компонент -
индифферентный растворитель определяются влиянием двух основных факто- ров: в
первую очередь, вязкости, а затем ДП системы. Влияние этих факторов
количественно учитывается как полуэмпирическим уравнением

где обозначения без индекса относятся к
свойствам смеси, индекс „l”
относится к электролитному компоненту; 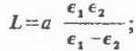 а
- коэффициент
пропорциональности,так и неэмпирическим
а
- коэффициент
пропорциональности,так и неэмпирическим

где с - концентрация, моль- л-1; const
рассчитывают по уравнениям, исходя из кристаллографических радиусов ионов,
дипольных моментов молекул компонентов смешанного растворителя и ДП компонентов
системы.
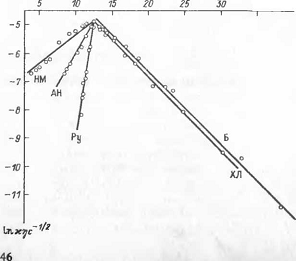

Из уравнений (2.4.1) и (2.4.2) вытекает, что
изотермы логарифма электропроводимости, исправленной на вязкость и на
концентрацию lnæŋc-½,
должны_быть линейной функцией от обратной ДО. Справедливость этого вывода
подтверждается рис1.
При необходимости получить смешанный
растворитель с заданными значениями двух или более физических
Рис 1 Зависимости lnæŋc-½
от
1/є при 393,15 К для
систем, образованных тетрабутиламмонийбромидом с апротонным
растворителем.Второй компонент системы обозначен на прямых
свойств в общем случае необходимо
манипулировать, соответственно, с трех- и более многокомпонентными смесями.
Управление свойствами многокомпонентных смешанных растворителей достигается
приемами оптимизации на основании аналитических зависимостей каждого из свойств
от состава:
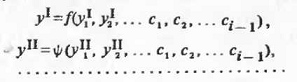
Описанные здесь концентрационные зависимости ДП,
вязкости, плотности (молярного объема) и электропроводимости позволяют с полной
определенностью выбрать состав смешанного растворителя, характеризующийся любым
значением каждого из этих свойств, которые находятся между значениями величин
этих свойств для исходных компонентов.
3.
ФИЗИЧЕСКИЕ
СВОЙСТВА СМЕШАННЫХ РАСТВОРИТЕЛЕЙ, ОБРАЗОВАННЫХ ХИМИЧЕСКИ ВЗАИМОДЕЙСТВУЮЩИМИ
КОМПОНЕНТАМИ
Поскольку в подавляющем большинстве случаев
смешанные растворители, применяемые в исследовательской и технологической
практике, составляются из двух компонентов, концентрационные изменения свойств
смешанных растворителей, вступающих в химическое взаимодействие, рассмотрим на
примере двойных жидких систем.
Теоретический расчет свойства смеси
определенного состава химически взаимодействующих растворителей может быть
осуществлен методами количественного физико-химического анализа [5] лишь в том
случае, если с достаточной определенностью известно число всех химических форм,
образующихся при таком взаимодействии, их стехиометрия, константа равновесия
процесса их образования и значения величин свойств этих химических форм.
Наличие столь внушительной совокупности сведений о жидкой системе, по-видимому,
еще долго будет оставаться большой редкостью. Поэтому данные о ДП, вязкости и
других свойствах смешанных растворителей с взаимодействующими компонентами
находят экспериментально. Вот почему можно говорить лишь об общих
закономерностях, которым подчиняются концентрационные зависимости свойств
смешанных растворителей с химически взаимодействующими компонентами. Прогноз же
относительно характера этих зависимостей может быть сделан при оценке константы
равновесия (энергии взаимодействия) между растворителями.
3.1
Диэлектрическая проницаемость
Диэлектрическая проницаемость, пожалуй,
единственное из свойств жидких систем, которое изучено для систем с
взаимодействующими компонентами в меньшей степени, чем для систем без
химического взаимодействия. Когда взаимодействие протекает по всем стадиям
общей схемы, нередко образуются достаточно хорошо проводящие ток растворы,
измерение ДП которых является непростой, а подчас и неразрешимой задачей. Хотя
более или менее успешные попытки разработать достаточно прецизионные методы
определения ДП сред с высокой электропроводимостью не прекращаются, указанная
диспропорция сохраняется, хотя и уменьшается с каждым годом.
Классификация изотерм ДП - состав двойных жидких
систем [5] основывается на положении экспериментальной изотермы относительно
изотермы, отвечающей системе с химически не взаимодействующими компонентами и
рассчитываемой по уравнениям (2.1.2) и (2.1.3) - см. рис.2.
Тип I отвечает случаю совпадения
экспериментальной изотермы ДП с изотермами (III-4)
либо (III-6) для
двойных жидких систем, компоненты которых вступают во взаимодействие; эта
ситуация реализуется в тех случаях, когда возрастание ДП за счет аддитационного
взаимодействия компенсируется
падением этого свойства за счет протекания процессов гомомолекулярной
ассоциации. Примером, иллюстрирующим этот тип изотерм ДП, может служить система
диэтиловый эфир - м-крезол.
Тип II, характеризующийся отрицательными
отклонениями от изотермы (III-6),
отвечает системам со сравнительно неглубоким гетеромолекулярным
взаимодействием, причем один из компонентов системы значительно ассоциирован в
индивидуальном состоянии. Примером систем, характеризующихся изотермами ДП
такого типа, может служить система муравьиная кислота - анизол. Кроме того,
этот тип изотерм ДП может быть свойствен системам, образованным
неассоциированными или слабоассоциированными в исходном состоянии компонентами,
взаимодействие между которыми сопряжено с такой взаимной ориентацией диполей в
гетеромолекулярном ассоциате, что дипольный момент последнего определяет
падение ДП по сравнению с аддитивным значением. К системам такого рода
относится двойной смешанный растворитель 1,2-дихлорэтан - бутилбромид [6].
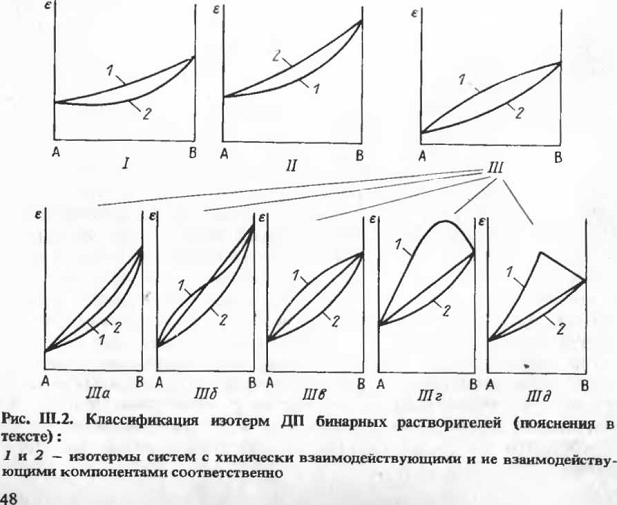
Тип III объединяет изотермы ДП, лежащие выше
рассчитанных по уравнению (2.1.3). Изотермы этого типа являются бесспорным
свидетельством взаимодействия между компонентами смешанного растворителя.
Разнообразие таких систем обуславливает существование пяти подтипов изотерм ДП
рассматриваемого типа,
Подтип IIIа
составляют изотермы, лежащие между кривой (III-6)
и аддитивной прямой. Этот подтип реализуется в системах с малой константой
равновесия процесса гетеро молекулярной ассоциации. Примером могут служить
зависимости ДП - состав системы масляная кислота - вода.
Подтип IIIб
включает S-образные изотермы
ДП, геометрия которых обусловлена влиянием одновременно протекающих процессов
гомо-и гетеромолекулярной ассоциации. Примером этого подтипа могут служить
изотермы ДП в системе вода - пиридин.
Подтип IIIв
включает наиболее распространенный тип изотерм ДП -
кривые, монотонно выпуклые от оси состава  Примером
здесь может служить система пиридин - вода.
Примером
здесь может служить система пиридин - вода.
Подтип IIIг
- изотермы ДП с максимумом. Как правило, такие изотермы свойственны системам, в
которых константа равновесия процесса гетеромолекулярной ассоциации достаточно
велика, а само взаимодействие приводит к существенному увеличению дипольного
момента по сравнению с дипольными моментами исходных компонентов. Изотермами
такого типа характеризуются системы карбоновые кислоты - амины.
Наконец, подтип IIIд
- это весьма редкие изотермы ДП с сингулярным максимумом, свидетельствующие о
высокой константе равновесия процесса гетеромолекулярной ассоциации. Примером
здесь может служить система хлорное олово - этилацетат.
3.2
Вязкость
Геометрия изотерм вязкость - состав двойной
жидкой системы достаточно разнообразна, поэтому возникла необходимость введения
классификации изотерм вязкости, основанной на их геометрических особенностях
[7]. Основные геометрические типы изотерм вязкости систем с взаимодействующими
компонентами приведены на рис. З.
Тип I - изотермы, монотонно выпуклые к оси
состава  \
\
 . Влияние
химического взаимодействия на геометрию изотерм
. Влияние
химического взаимодействия на геометрию изотерм
вязкости этого типа сказывается в том, что они
располагаются выше изотермы, рассчитанной в предположении отсутствия
взаимодействия, т.е. по уравнению (2.1.4).

Примером могут служить изотермы вязкости в
системе пиперидин - анилин.
Тип II составляют S-образные
кривые 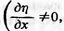 в
точке перегиба
в
точке перегиба
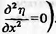 . Изотермы этого
типа свойственны системам, компоненты которых существенно разнятся по вязкости,
а выход продукта взаимодействия (гетеромолекулярного ассоциата) недостаточно
велик для того, чтобы повышение вязкости вследствие взаимодействия привело к
появлению максимума. Примером могут служить изотермы вязкости систем серная
кислота - пиросерная кислота, дифениламин - пиридин.
. Изотермы этого
типа свойственны системам, компоненты которых существенно разнятся по вязкости,
а выход продукта взаимодействия (гетеромолекулярного ассоциата) недостаточно
велик для того, чтобы повышение вязкости вследствие взаимодействия привело к
появлению максимума. Примером могут служить изотермы вязкости систем серная
кислота - пиросерная кислота, дифениламин - пиридин.
Тип III составляют кривые, общим признаком которых
является выпуклость от оси состава, т.е. для которых  .
На всем концентрационном интервале значения избыточной вязкости
.
На всем концентрационном интервале значения избыточной вязкости 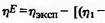
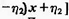 положительны.
положительны.
Для систем с химическим воздействием изотермы
типа III наиболее распространены, и поэтому они характеризуются известным
геометрическим разнообразием, побуждающим разделить этот тип на подтипы.
ПодтипIIIа
- монотонно выпуклые от оси состава кривые, не имеющие максимума (т.е. ни в
одной точке концентрационного интервала ). Примером может служить зависимость вязкости от концентрации системы
вода - монохлоруксусная кислота.
). Примером может служить зависимость вязкости от концентрации системы
вода - монохлоруксусная кислота.
Подтип IIIб
- изотермы с иррациональным максимумом (т.е. с максимумом, не приходящимся на
стехиометрическое соотношение компонентов смешанного растворителя). Системы с
изотермами вязкости такого типа - пожалуй, наиболее распространенная
разновидность двойных жидких систем с взаимодействием. В качестве примера назовем
систему трифторуксусная кислота - уксусная кислота. Методы установления
стехиометрии образующихся в таких системах соединений описаны в работе.
Подтип IIIв
- изотермы с максимумом, приходящимся на рациональное соотношение компонентов и
отражающим стехиометрию процесса гетеромолекулярной ассоциации. Примером такого
рода систем может служить система пиросерная кислота - монохлоруксусная
кислота.

Иногда, впрочем не часто, встречаются изотермы
вязкости с сингулярным максимумом, которыми характеризуются, например, системы
горчичные масла - амины [7].
Приведенная классификация исчерпывает основные
типы изотерм вязкости двойных систем. Несмотря на то, что в ее основу положены
геометрические предпосылки, следует учесть, что между геометрической формой
изотермы вязкости и глубиной процесса гетеромолекулярной ассоциации,
протекающей в системе, существует достаточно прямая связь: относительная
степень взаимодействия увеличивается от систем, характеризующихся типом I
изотерм вязкости, к системам с изотермами типа III.
3.3
Плотность,
молярный объем
Так как, в отличие от изотерм отклонения
плотности от аддитивности, изотермы отклонения от аддитивности молярного объема
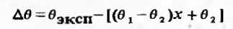
позволяют обоснованно судить о стехиометрии
процесса гетеромолеку-ллрной ассоциации, классификацию изотерм объемных свойств
двойных смешанных растворителей проведем для величин Δθ
(называемых также часто избыточным молярным объемом θЕ)
.
Взаимодействие, связанное с образованием
гетеромолекулярных ассоциатов, как показывает анализ метрических уравнений
объемных свойств жидких систем [8], необходимо приводит к сжатию, т.е. к
положительным отклонениям плотности от аддитивности (объемно-долевой),
следовательно, к отрицательным отклонениям молярного объема от аддитивности
(молярно-долевой).
Различают три основных геометрических типа
изотерм Δθ,
свойственных двойным системам с химически взаимодействующими компонентами (рис.
4).
Тип I - рациональные изотермы Δθ,
свидетельствующие о том, что в системе образуется один продукт присоединения
(либо что константы равновесия образования остальных комплексов значительно
меньше, чем у основного аддукта). Чаще всего таким соединением является аддукт
эквимолекулярного состава, вследствие чего максимум изотермы Δθ
приходится на х=05. К этому типу относится, в частности, система
фторсульфоновая кислота - трифторуксусная кислота.
Тип II - иррациональные изотермы Δθ,
т.е. с максимумом, не приходящимся на концентрацию, отвечающую стехиометрии
образующегося в системе гетеромолекулярного ассоциата. Иррациональность изотерм
Δθ
с бесспорностью свидетельствует о том, что в системе образуется более одного
аддукта. В случае образования двух продуктов присоединения максимум Δθ
приходится на состав, располагающийся между точками стехиометрии каждого из
этих комплексов. Так, если в системе образуется два продукта присоединения АВ и
АВ2, то максимум Δθ
в такой системе будет располагаться между значениями хА, равными 0,5 и 0,33
молярной доли. Этот тип диаграмм Δθ
наиболее распространен в двойных жидких системах, например диэтиланилин -
галоген-уксусные кислоты.
Типу III отвечают изотермы Δθ
сингулярного типа. Согласно метрическому анализу [8], диаграммы этого типа
реализуются в системах, константа образования продукта присоединения в которых
->∞. Примером здесь могут служить уже упоминавшиеся системы горчичные
масла - амины.
Относительная степень взаимодействия в общем
случае повышается от систем, характеризующихся изотермами Δθ
типа I, к системам с изотермами Δθ
типа III, что помимо анализа метрических уравнений молярного объема
подтверждается и сопоставлением систем, образованных одним и тем же компонентом
с рядом других, химическая активность которых по отношению к первому изменяется
в заведомо известном направлении.
3.4
Электрическая проводимость
Характер зависимости удельной электрической
проводимости от состава двойного смешанного растворителя помимо ряда причин,
приводимых далее, зависит от электропроводимости исходных компонентов
смешанного растворителя. Поэтому логично в основу классификации изотерм
электропроводимости двойных жидких систем положить наличие (либо отсутствие)
электропроводимости у компонентов. Основные геометрические типы изотерм
электропроводимости изображены на рис.5.
К изотермам типа I относятся концентрационные
зависимости электропроводимости систем, образованных обоими проводящими ток
(электролитными) компонентами. Такого рода смешанные растворители довольно
редко встречаются в исследовательской и технологической практике. К подтипам
этой разновидности изотерм относятся 1а - изотермы х с минимумом
(пример: система селеновая кислота - ортофосфорная кислота) и 16 - изотермы æ
с
максимумом (пример: ортофосфорная кислота - азотная кислота).
Изотермы типа II описывают концентрационную
зависимость электропроводимости двойных систем, у которых в индивидуальном
состоянии проводящим является только один компонент. Здесь также различают два
геометрических подтипа. Подтип IIа
- изотермы, монотонно (т.е. без экстремума) выпуклые к оси состава. Примером
может служить система селеновая кислота - уксусная кислота. К этому подтипу
относятся изотермы с максимумом, - наиболее распространенная разновидность
изотерм х (пример: система хлорная кислота - три-фторуксусная кислота).
Из данного подтипа изотерм должна быть выделена нередко встречающаяся
разновидность IIб-1:
изотермы, приходящие к значению æ≈0
в середине концентрационного интервала смешанного растворителя. Такие изотермы
встречаются, например, в системе серная кислота - этилацетат.
Геометрически изотермы электропроводимости типов
I и II не отличаются от изотерм х систем с химически не
взаимодействующими компонентами. Прием, позволяющий по данным кондуктометрии
различить системы, в которых электропроводимость обусловлена лишь диссоциацией
электролитного компонента, от систем, в которых протекает химическое
взаимодействие, заключается в предложенном М. И. Усановичем [9] исправлении
электропроводимости на вязкость: изотермы х в системах с
взаимодействием, в отличие от систем с химически не взаимодействующими
компонентами, характеризуются наличием максимума. Кроме того, различить по
данным кондуктометрии эти два типа систем можно, анализируя концентрационные
зависимости абсолютного и относительного температурных коэффициентов
электропроводимости.
Системы, образованные двумя неэлектролитными
компонентами, - наиболее распространенный тип электролитных систем, электропроводимость
которых обусловлена взаимодействием, протекающим по всем стадиям схемы. Таким
образом, само возникновение электропроводящего раствора при образовании
смешанного растворителя является фактом, бесспорно указывающим на
взаимодействие между компонентами системы.
Для таких систем наиболее распространены
изотермы подтипа IIIа
- с одним максимумом, приходящие в нулевые (в пределах строгости определения
понятия „непроводящий" компонент) значения электропроводимости. Такой тип
изотерм реализуется, например, в системе вода - трифторуксусная кислота.
Подтип IIIб
- изотермы х с минимумом, расположенным между двумя максимумами.
Появление минимума обусловлено сильным возрастанием вязкости вследствие далеко
прошедшего процесса гетеромолекулярной ассоциации, доказательством чего
является исчезновение минимума при исправлении электропроводимости на вязкость.
Примером является электропроводимость в системе пиросерная кислота - уксусная
кислота.
Генетически связана с подтипом IIIб
разновидность изотерм х с изгибом - подтип IIIб-1.
Изгиб также связан с влиянием вязкости, свидетельством чему может служить то,
что изотермы IIIб с
повышением температуры переходят в тип IIIб-1
(если позволяет температурный интервал существования жидкой фазы). Пример -
концентрационная зависимость электропроводимости в системе трихлорид сурьмы -
метиловый спирт.
4.
ХИМИЧЕСКИЕ СВОЙСТВА СМЕШАННЫХ РАСТВОРИТЕЛЕЙ
Сольватирующая способность компонентов
смешанного растворителя отличается по термодинамическим характеристикам от
сольватиру-ющей способности каждого из компонентов в отдельности. Помимо
изменения ДП и связанного с этим изменения энергии электростатических
взаимодействий, это обстоятельство обусловлено рядом причин, важнейшие из
которых рассматриваются в этом разделе.
4.1
Константы автопротолиза
Пусть оба компонента смешанного растворителя АН-
ВН способны к процессу автопротолиза:

В.В. Александров [10] показал, что произведение
сумм активностей ионов лиония 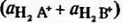 на
сумму активностей ионов лиата
на
сумму активностей ионов лиата 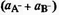 есть величина
постоянная для каждого смешанного растворителя данного состава. Это
произведение и является ионным произведением смешанного растворителя:
есть величина
постоянная для каждого смешанного растворителя данного состава. Это
произведение и является ионным произведением смешанного растворителя:
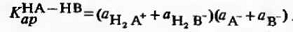
Если компоненты смешанного растворителя вступают
друг с другом в химическое взаимодействие, то равновесие процессов существенно
сдвигается в ту или иную сторону. При этом в большинстве случаев концентрации
ионов лиония одного компонента и ионов лиата другого компонента становятся
столь исчезающе малыми, что соответствующими активностями можно попросту
пренебречь, и выражение для константы автопротолиза смешанного растворителя
превращается в
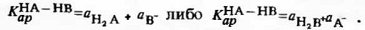
В качестве примера рассмотрим смешанный
растворитель вода - муравьиная кислота, компоненты которого подвергаются
процессам автопротолиза:

Очевидно, что в этом смешанном растворителе
концентрации ионов НСООН2+ (самой сильной кислоты из обоих ионов лиония,
возможных в этой системе) и ОН- (самого сильного основания из обоих ионов
лиата) будут исчезающе малы, так как эти ионы вступают в характеризующуюся
высокой константой равновесия реакцию нейтрализации.
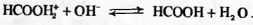
Таким образом, согласно (4.1.1), для этого
смешанного растворителя
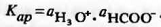
Поскольку активности ионов лиония и лиата
каждого из компонентов смешанного растворителя зависят от состава смешанного растворителя,
56
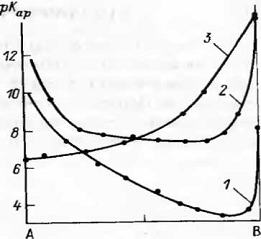

Зависимость  от
состава смешанных растворителей: 1 - ДМСО - муравьиная кислота; 2 - ДМСО
- уксусная кислота; 3 - муравьиная кислота - уксусная кислота то и
значение константы автопротолиза смешанного растворителя является функцией его
состава. На рис.6 приведены зависимости величин рКар=-lgКар
от состава некоторых смешанных растворителей. Пользуясь этими
зависимостями, можно изменять условия нейтральности раствора в весьма широких
пределах. Так, раствор в смешанном растворителе ДМСО - муравьиная кислота при
молярном содержании кислотного компонента 80 % будет нейтральным при
концентрации ионов Н+ (разумеется, сольватированных) порядка 3 -10-2 г-ион-л-1;
в смешанном растворителе, содержащем 10% кислотного компонента, условием
нейтральности будет [Н+] =10-4 г-ион - л-1.
от
состава смешанных растворителей: 1 - ДМСО - муравьиная кислота; 2 - ДМСО
- уксусная кислота; 3 - муравьиная кислота - уксусная кислота то и
значение константы автопротолиза смешанного растворителя является функцией его
состава. На рис.6 приведены зависимости величин рКар=-lgКар
от состава некоторых смешанных растворителей. Пользуясь этими
зависимостями, можно изменять условия нейтральности раствора в весьма широких
пределах. Так, раствор в смешанном растворителе ДМСО - муравьиная кислота при
молярном содержании кислотного компонента 80 % будет нейтральным при
концентрации ионов Н+ (разумеется, сольватированных) порядка 3 -10-2 г-ион-л-1;
в смешанном растворителе, содержащем 10% кислотного компонента, условием
нейтральности будет [Н+] =10-4 г-ион - л-1.
Как отмечает В. В. Александров, ионное
произведение смешанного растворителя определяется энергией сольватации и
собственной кислотностью молекул растворенного вещества, а также сольватирующей
способностью нейтральных молекул этого растворителя по отношению к ионам лиония
и лиата.
4.2
Сольватирующая способность
Исходя из
широко применяющегося в химической термодинамике принципа линейности свободных
энергий, легко показать, что любое свойство у, линейно зависящее от
свободной энергии либо от свободной энергии активации данного процесса, в
смешанном растворителе, компоненты которого не вступают друг с другом в
специфическое взаимодействие, будет линейно зависеть от молярно-долевого
состава х этого растворителя:
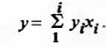
Аналитически уравнение (4.2.1)
выведено В. А. Пальмом [10].
В смешанных растворителях, компоненты которых
вступают в химическое взаимодействие, геометрия зависимостей у =f(х)
может существенно отличаться от линейной, включая появление экстремумов.
Подбор компонентов смешанного растворителя
позволяет в большинстве случаев обеспечить направленную сольватацию участников
химического процесса, протекающего в этом растворителе. Большей частью это
достигается сочетанием сольватоактивных растворителей с сольватоинертными. Так,
очевидно, что в смешанном растворителе ДМСО-СCl4
специфическая сольватация растворенной в этом растворителе кислоты на всем
интервале концентраций (за исключением, разумеется, 100% ССl4)
будет осуществляться диметилсульфоксидом. Аналогично, в смешанном растворителе
муравьиная кислота - хлорбензол сольватация растворенного в нем донорного
соединения будет осуществляться исключительно муравьиной кислотой.
Выбор ДП второго (“индифферентного”) компонента
смешанного растворителя позволяет направленно управлять и его универсальной
сольватацией. В только что приведенных примерах повышение концентрации
сольватоинертных компонентов будет приводить к одновременному падению ДП
растворителя. Напротив, в системах уксусная кислота - пропиленкарбонат или
анилин - пропиленкарбонат добавление пропиленкарбоната вызовет повышение ДП
(поскольку в названных растворителях сольватоактивными компонентами выбраны
уксусная кислота и анилин, подразумевается, что специфической сольватации в
первом из этих смешанных растворителей подвергается донорное, а во втором
акцепторное растворенное соединение).
4.3
Донорно-акцепторные свойства
Ряд параметров, характеризующих донорность либо
акцепторность, из числа тех, которые были рассмотрены в предыдущей главе, а
также полярные свойства индивидуальных растворителей, могут быть перенесены на
смешанные растворители.
В работе [10] показано, что параметры ET
и
z двойного
смешанного растворителя 1,2-дибромэтан - 1,2-дибромпропан являются строго
мо-лярно-аддитивной функцией состава. В смешанных растворителях, компоненты
которых вступают в специфическое взаимодействие, зависимости  нелинейны
и даже экстремальны, как это можно видеть из примеров, приводимых на рис. 7.
нелинейны
и даже экстремальны, как это можно видеть из примеров, приводимых на рис. 7.
Предложен метод [10], позволяющий линеаризовать
показатель полярности смешанного растворителя путем введения параметра,
связывающего величины ET и
z с
функцией отношения концентраций компонентов смешанного растворителя.
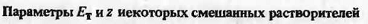
5.
ВЫВОДЫ
В данной курсовой работе я изучил классификацию
растворителей, физические и химические свойства смешанных растворителей.
Убедился в потребности применения в физической
химии смешанных растворителей.
Убедился в различиях свойств растворителей,
образованных химически взаимодействующими и невзаимодействующими компонентами.
7
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Басов В.П., Карапетян Ю.А.,
Крысенко А.Д. // Укр. хим. журнал - 1975. - С. 582-585.
. Мищенко К.П., Полторацкий Г.М.
Термодинамика и строение водных и неводных растворов электролитов //
Санкт-Петербург - 1976. - С. 253-269.
. Фиалков Ю.Я., Тевтуль Я.Ю.
// ЖНХ - 1983. - №9 С. 2342-2347
. Фиалков Ю.Я. Двойные жидкие
системы // Санкт-Петербург - 1984 - С. 144-161.
. Макітра
Р.Г. Пиріг Я.Н. //
Укр. хим. журнал - 1980. - №1 С. 83-84.
. Ахадов Я.Ю. Диэлектрические
свойства бинарных растворов // Москва - 1977. - С. 399-401
. Амис Э. Влияние
растворителя на скорость и механизм химических реакций // Москва - 1978. - С.
328-330.
. Усанович М.И. Исследования
в области теории растворов // Алма-Ата - 1980. - С. 364-367.
. Житомирский А.Н. Эйчис В.Н.
// Укр. хим. журнал - 1980 - №3 С. 237-242.
. Фиалков Ю.Я. Растворитель,
как средство управления химическим процессом // Санкт-Петербург - 1990. - С.
41-59.