Химические превращения метилфеофорбида (а). Реакция Даффа
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ
АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО
«СЫКТЫВКАРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
ХИМИКО-БИОЛОГИЧЕСКИЙ
ФАКУЛЬТЕТ
КАФЕДРА ХИМИИ
КУРСОВАЯ
РАБОТА
«Химические
превращения метилфеофорбида (а).
Реакция
Даффа»
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1.ОБЗОР
ЛИТЕРАТУРЫ
1.1 Механизм
реакции Даффа
1.2 Уротропин C6H12N4
1.3 Субстраты в реакции
Даффа
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Приборы и
материалы
2.2
Хроматографическое исследование синтезированных соединений
2.3 Получение
метилфеофорбида (а)
2.3.1 Выделение
метилового эфира 13(2)-гидроксифеофорбида (а)
3. ОБСУЖДЕНИЕ
РЕЗУЛЬТАТОВ
3.1 Получение
метилфеофорбида (а)
3.2 Превращения
метилфеофорбида (а) в условиях реакции Даффа
ВЫВОДЫ
Список использованной литературы
ВВЕДЕНИЕ
Порфирины
представляют большой интерес для химии, в связи с их повышенной биологической
активностью и относительно низкой стабильностью. Их актуальность возрастает с
каждым годом, исследование в этой области (присоединение различных заместителей
к порфиринам) дает все новые и новые соединения, с уникальными наборами
физических и химических свойств. Применение, которых, захватывает все больший
круг интересов: на основе порфиринов создаются катализаторы
<#"510567.files/image001.gif"> <#"510567.files/image002.jpg">
Как
видно из обобщенной схемы, в реакции Даффа участвуют обычно два компонента. Это
субстрат - ароматическое соединение, подвергаемое формалированию и катион
<#"510567.files/image003.jpg">
Катион
<#"510567.files/image004.gif">
Формальдегид сильный восстановитель и довольно легко вступает в реакцию с
аммиаком, поэтому выход уротропина довольно хороший.
Физические свойства
Уротропин - бесцветные кристаллы или белый кристаллический порошок жгучего и
сладкого, а затем горьковатого вкуса, без запаха. Легко растворим в воде
(1:1,5) и спирте (1:10). Также растворим в хлороформе, метаноле. Плохо
растворим в бензоле, эфире, четыреххлористом углероде. При нагревании уротропин
улетучивается не плавясь. Горит бледным пламенем. Водные растворы имеют
щелочную реакцию (рН 40 % раствора 7,8 - 8,2).
Химические свойства
Уротропин
- довольно слабый нуклеофил,
содержащий только NCH2-связи.
Со слабыми кислотами дает малоустойчивые соли, сильными кислотами разлагается
на соли аммония и формальдегид, к действию щелочей устойчив. Со спиртовым
раствором азотной кислоты дает мононитрат. С водной 60% азотной кислотой дает
осадок динитрата. При действии бензил-, аллил- и фенацилгалогенидов образует
монозамещенные гексаминиевые соли; последние при алкоголизе превращаются в
первичные амины (Делепина реакция), а при кислотном гидролизе - в альдегиды
(Сомле реакция). Раствор уротропина в уксусной кислоте - мягкий окисляющий
агент, используемый для превращения аминов в альдегиды или кетоны. С фенолом
реагирует в присутствии глицеринборной кислоты с образованием орто- или, если
орто-положение занято, пара-гидроксибензальдегида (Даффа реакция).
Ароматические углеводороды при нагревании с уротропином в присутствии
трифторуксусной кислоты превращаются в альдегиды. При нитровании уротропина
дымящей азотной кислотой в присутствии нитрата аммония и уксусного ангидрида
образуется гексоген
<#"510567.files/image005.jpg">
Фармакологические свойства и применение в медицине
Уротропин (Гексаметилентетрамин) ─ одно из очень немногих синтетических
лекарственных средств, используемых в настоящее время, с более чем 100-летней
историей: он начал применяться еще в 1884 г. Препарат оказывает антисептический
эффект, главным образом, в мочевых путях. Применяется в чистом виде и в составе
комбинированных лекарственных средств (например, кальцекс). В чистом виде
гексаметилентетрамин применяется перорально или внутривенно, в виде солей:
гиппурата, индигокармината или камфората. Механизм действия основан на
высвобождении свободного формальдегида, который денатурирует белки бактерий.
Этим обусловлена тканевая специфичность действия гексаметилентетрамина и
относительная безопасность препарата, так как он расщепляется с выделением
активного формальдегида только в кислой среде мочи, тем самым действуя
непосредственно на бактерии, вызывающие заболевания мочевыводящих путей.
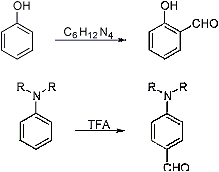
1.3
Субстраты в реакции Даффа
Субстратом
в реакции Даффа может быть довольно ограниченный круг органических соединений:
различные соединения, имеющие циклические сопряженные структуры и содержащие
подвижный атом водорода при атоме углерода, стоящего по соседству с
функциональной группой: фенолы и его производные (алкилфенолы
<#"510567.files/image006.jpg">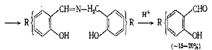
 <#"510567.files/image009.gif">
<#"510567.files/image009.gif">
Нуклеофильным формилирующим агентом может служить анион 1,3-дитиана
(синтетический эквивалент формил-аниона):
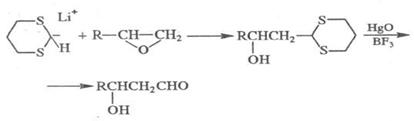
Примером формилирования неорганическим соединением служит реакция
динатрийтетракар-бонилжелеза с N-формилимидазолом в присутствии триалкилборатов
в среде ТГФ; в результате один атом Na замещается на формильную группу:
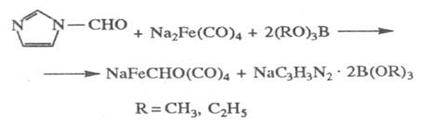
реакция даффа метилфеофорбид эфир синтезирование
2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
.1 Приборы
и материалы
Спектры ЯМР 1Н полученных веществ записывали на приборе TESLA BS 587A
(рабочая частота 80 МГц) и Bruker
АМ-300 (рабочая частота 300 МГц) в дейтерохлороформе.
В качестве сырья для получения производных хлорофилла использовали высушенную
измельченную спирулину.
Для проведения колоночной и тонкослойной хроматографии использовали
четыреххлористый углерод марки “ч”, ацетон марки “ч”. Для приготовления
элюентов соотношение растворителей брали по объему. При проведении колоночной
хроматографии, колонку наполняли “мокрым способом”, используя четыреххлористый
углерод.
Для экстракции производных хлорофилла из спирулины использовали 95%-ый
этанол марки “ч” без дополнительной очистки.
Для осаждения феофитинов использовали разбавленную водой соляную кислоту
квалификации “ч” в соотношении 1:9 (по объему). Концентрированную соляную
кислоту использовали в реакциях гидролиза.
Для обработки реакционных смесей, нанесения веществ на колонку и
пластинки для проведения тонкослойной хроматографии (ТСХ), а также в качестве
растворителя использовали хлороформ квалификации “ч”, без предварительной
очистки, а так же хлористый метилен.
Безводный сульфат натрия, квалификации “х.ч.” использовали для удаления
остатков воды из растворов в органических растворителях (при обработке
реакционных смесей).
Ацетон, марки «ч» без дополнительной очистки использовался для колоночной
и тонкослойной хроматографии.
Серная кислота квалификации «х.ч.» использовалась для обработки бензола.
Бензол, обработанный серной кислотой и перегнанный при температуре 80,05
- 80,150С.
Уксусная кислота марки «ч.» использовались для проведения реакций Даффа.
Колоночную хроматографию проводили на силикагеле L 100/400 и оксиде алюминия.
Уротропин
использовался в реакциях Даффа, для получения катион
<#"510567.files/image014.gif">
Рисунок 1 Схема получения метилфеофорбида (а)
Для получения метилфеофорбида (а) сухую спирулину экстрагировали
настаиванием с этанолом и полученный этанольный экстракт подкисляли
разбавленной соляной кислотой (7%). Феофитины в отличие от хлорофиллов плохо
растворимы в этаноле. Поэтому, когда при подкислении густого этанольного
экстракта спирулины соляной кислотой, происходит удаление магния из
координационной сферы хлорофиллов, образующиеся феофитины выпадают в осадок,
т.е. кислотная обработка вызывает гидролиз фитилпропионатного остатка, при этом
происходит отщепление фитола и образование феофорбида. Считается, что,
поскольку кислота добавляется в относительно небольшом количестве, другие
вещества соосаждаются с феофитинами незначительно. Далее экстракт подкисляли
соляной кислотой и выпавшие при этом в осадок феофитины этерифицировали
метанолом в присутствии концентрированной серной кислоты. Превращения
хлорофиллов, происходящие при этом, можно представить следующим образом:
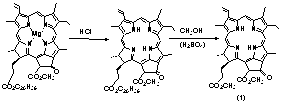
Рисунок
2 Получение метилфеофорбида а из хлорофиллов
(где С20H39
- фрагмент спирта
фитола, этерифицирующего фитилпропионатный заместитель хлорофиллов высших
растений).
Колоночной хроматографией и кристаллизацией был выделен метилфеофорбид (а)
массой 0,4 г. Структура метилфеофорбида (а) подтверждена данными ЯМР 1Н
спектроскопии. Сигналы спектра ЯМР 1Н метилфеофорбида (а)
соответствуют литературным данным.
Рисунок 3 Спектры ЯМР 1Н метилового эфира 13(2) -
гидроксифеофорбида а (5) и метилфеофорбида а (1) соответсвенно.
3.2
Превращения метилфеофорбида (а) в условиях реакции Даффа
Взаимодействии
уротропина с метилфеофорбидом (а) в кислой среде проводили в условиях
реакции Даффа, с целью получения соответствующего продукта конденсации.
Первоначально в молекуле уротропина в среде уксусной кислоты происходит
отщепление электрофильного формилирующего агента - высокореакционной
промежуточной частицы катион
<#"510567.files/image017.jpg">
Далее
происходит взаимодействие катион
<http://www.chemport.ru/chemical_encyclopedia_article_1607.html>а формальдимина
CH2=NH2+ с метилфеофорбидом (а). Катион
формальдимина присоединяется к ароматическому кольцу метилфеофорбида (а) в
α-положение, относительно кето-группы. Это обусловлено
нахождением в α-положение молекулы метилфеофорбида (а)
наиболее активного реакционного (нуклеофильного) центра, а именно подвижного
атома водорода. Немаловажную роль играют стерические факторы, которые делают
этот центр единственным в структуре метилфеофорбида (а) (не считая
реакций приводящих к размыканию экзоцикла).
Реакцию
формилирования проводили при комнатной температуре в течение часа, однако, по
происхождению времени метод TCX (Silufol, СС14: ацетон - 4:1) показал что реакция
практически не прошла, поэтому формилирование проводили еще в течение
последующих трех дней. В последующем анализе было выявлено, что продукт не
соответствует заявленному (Рисунок 4): по сравнения хроматографической
подвижности в условиях тонкослойной хроматографии использовали метод свидетеля.
Он показал, что значений Rf полученного
соединения заметно отличается от метифеофорбида (а), причем в меньшую
сторону, что характерно в первую очередь для аминоциклов, а перед нами стояла
задача заместить подвижный атом водорода на формильную группу.
Данное превращение в условиях реакции Даффа может быть объяснено неэффективным
кислотным гидролизом, недостаточностью комнатной температуры для прохождения
реакции.
Возможным путем решения может быть исследование химического превращения в
условиях кипячения реакционной смеси, определение времени нагревания,
необходимого, для эффективного формилирования метилфеофорбида (а).
ВЫВОДЫ
Основные
результаты данной курсовой работы заключаются в следующем. Исследована
формилирование экзоцикла метилфеофорбида (а) в условиях реакции Даффа
(смешение в уксусной кислоте с уротропином). Показано, что в условиях реакции
Даффа (при низкой температуре) не может быть реализованно формилирование с
использованием катион
<http://www.chemport.ru/chemical_encyclopedia_article_1607.html>а
формальдимина CH2=NH2+. Необходимы
исследования в условиях кипячения реакционной смеси.
Список
использованной литературы
1. Вацуро
К.В., Мищенко Г.Л. Именные реакции в органической химии. М., 1976
. Шабаров
Ю.С. Курс органической химии. М., Химия, 1998
. Реутов,
О.А. Органическая химия. - М: БИНОМ. Лаборатория знаний, 2004, с. 89-92.
. Ингольд,
К.К. Механизм реакций и строение органических соединений. - М: Изд-во
иностранной литературы, 1959, с. 256-270.
. Ломова
Т.Н. Основы синтеза и механизмы химических превращений порфиринов и их
аналогов. Часть 1,2 Текст лекций. Иваново 2007, с.78.