Исследование реакций восстановления метилфеофорбида (а)
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФГБОУ ВПО
«СЫКТЫВКАРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
ИНСТИТУТ
ЕСТЕСТВЕННЫХ НАУК
КАФЕДРА
ХИМИИ
КУРСОВАЯ
РАБОТА
Исследование
реакций восстановления метилфеофорбида (а)
Научный
руководитель:
к.х.н.,
доцент А.Л. Тулаева
Исполнитель:
Студентка
240 группы И.В. Маркова
Сыктывкар
2012
Содержание
Структура метилфеофорбида (А)
Введение
. Обзор литературы
.1 Получение и направления
химической модификации хлорофилла (а) и его ближайших производных
.2 Реакции восстановления
производных хлорофилла
.2.1 Восстановление винильной группы
.2.2 Восстановление сложноэфирных
групп
.2.3 Восстановление карбонильных
групп
.3 Другие реакции производных
хлорофилла
.4 Реакции нуклеофильного замещения
при карбонильном атоме углерода в положении 13(1) форбиновых производных
хлорофилла
.5 Положение сигналов спектров ЯМР1Н
метилфеофорбида (а)
. Экспериментальная часть
.1 Приборы и реактивы
.2 Получение феофитинов из спирулины
.3 Получение метилфеофорбида(а) из
феофитинов
.4 Хроматографическое исследование
соединений
Обсуждение результатов
.1 Получение метилфеофорбида (а)
Выводы
Список использованной литературы
Приложения
Структура метилфеофорбида (а)
Нумерация атомов углерода
производных хлорофилла (а)
Введение
реакция восстановление
метилфеофорбид хлорофилл
Порфирины - природные и синтетические
тетрапиррольные соединения, формально - производные порфина азотосодержащие
пигменты, входят в состав небелковой части молекулы гемоглобина, хлорофилла,
ряда ферментов.
Относятся к высшим гетероциклам. Благодаря
уникальному набору физических и химических свойств порфирины и их аналоги
привлекают интерес исследователей в области химии, биологии, медицины, оптики и
материаловедения.
На основе порфиринов созданы катализаторы,
сенсоры, лекарственные средства, органические полупроводники, жидкие кристаллы
и материалы для нелинейной оптики.
Прежде всего, уникальным представителем этого
класса являются хлорофилл - важнейший природный порфирин, участвующий в
процессе фотосинтеза в зеленых растениях, и гем крови - красный пигмент,
осуществляющий транспортировку кислорода в живом организме.
Известны также пирропорфирины - синтетические
пиррольные соединения и их модификации, простейшим представителем которых
является тетрафенилпорфирин, по применению не уступающий природным порфиринам.
Большой практический интерес составляют
модификации хлорофилла. В ходе установления его строения было получено большое
количество хлоринов: феофетины, феофорбиды, хлорин е6 феопорфирины и
др. Изучение свойств этих модельных соединений способствовало исследованию
механизмов фотосинтеза и позволило выявить новые области применения.
Целью данной
работы является исследование реакций восстановления метилфеофорбида а.
Задачи:
1. Получение метилфеофорбида а из сухой
спирулины;
. Исследование восстановления метилфеофорбида
(а)
.Провести литературный обзор на тему:
”Исследование реакций восстановления метилфеофорбида а”
1.
Обзор литературы
.1
Получение и направления химической модификации хлорофилла а и его ближайших
производных
Хлорофилл
(от греч. chloros - зеленый и phyllon - лист), зеленый пигмент растений, с
помощью которого они улавливают энергию солнечного света и осуществляют
фотосинтез, т. е. превращают солнечную энергию в энергию химических связей
органических соединений. Хлоропласты высших растений и зеленых водорослей
содержат два типа хлорофиллов, близких по структуре молекул, - хлорофиллы (a) и
(b) (I,II).
Хлорофилл (а) (I)
является самым доступным из всех хлорофиллов, встречающихся в живых организмах.
Этот пигмент и его ближайшие производные могут быть препаративно получены из
высших растений (крапива, шпинат и водоросли). Источником производных
хлорофилла (а) могут служить разного рода отходы переработки зеленых
частей растений, такие как смола наперстянки и липидная фракция экстракта
серпухи венценосной. Получение производных хлорофилла (а) из всех этих
источников осложняется тем, что помимо хлорофилла (а) в них содержится
хлорофилл (b)
(II).
Наличие хлорофилла (b)
обуславливает необходимость использования хроматографии при получении
индивидуальных соединений. Этого недостатка лишена сине-зеленая водоросль
(спирулина), промышленное получение которой налажено относительно недавно.
Доступность спирулины, выращиваемой как в промышленных реакторах, так и на
плантациях, обуславливает ее перспективность как источника тетрапиррольных
соединений.
Сам хлорофилл (а) редко используется в
качестве исходного соединения в химических превращениях ввиду его относительной
неустойчивости и трудностей, возникающих при получении в чистом виде. Более
удобными исходными соединениями для химических превращений являются феофитин (а)
(III) и метилфеофорбид
(а) (IV), а так же
ряд получаемых из них хлоринов (V-VIII)
(рисунок 1):
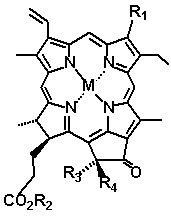
 фитол (PhytOH)
фитол (PhytOH)
М = Mg
(I) Хлорофилл
(а): R1 = CH3; R2 = Phyt; R3 = CO2CH3; R4 = Н.
(II) Хлорофилл
(b): R1 = CH=О; R2 = Phyt; R3
= CO2CH3; R4 = Н.
М = 2Н
(III) Феофитин
(a): R1 = CH3; R2 = Phyt; R3
= CO2CH3; R4 = Н.
(V) Пирофеофитин
(a): R1 = CH3; R2 = Phyt; R3
= R4 = Н.
(VI) Феофорбид
(a): R1 = CH3; R2 = Н;
R3 = CO2CH3; R4 = Н.
(VII) Пирофеофорбид
(a): R1 = CH3; R2 = Н;
R3 = CO2CH3; R4 = Н.
(IV) Метилфеофорбид
(a): R1 = R2 = CH3; R3 = CO2CH3;
R4 = Н.
(VIII) Метилпирофеофорбид
(a): R1 = R2 = CH3; R3 = CO2CH3;
R4 = Н.
(IX) Хлорин
е6:
R1 = CO2CH3; R2 = CH2CO2CH3.
(X)
Хлорин
р6:
R1 = R2 = CO2CH3. (XI)
Пурпурин 18
Рисунок 1. Формула производных хлорофилла
Химическая модификация хлорофилла (а) и
его производных предпринималась как в связи с решением ряда фундаментальных
проблем (построение моделей фотосинтеза, установление строения хлорофиллов и
др.), так и для решения ряда практических задач, важнейшая из которых
заключается в синтезе противоопухолевых препаратов с различным механизмом
действия.
Для химической модификации с целью внедрения
дополнительных заместителей на периферию хлоринового макроцикла в большинстве
случаев используют реакции винильной группы в положении 3 и
карбометоксильной группы пропионатного заместителя в положении 17. В
связи с тем, что атом углерода карбонильной группы в положении 13 (1)
доступен для нуклеофильной атаки и имеется возможность делокализации
отрицательного заряда на атоме углерода в положении 13 (2) возможно
раскрыть экзоцикл при действии нуклеофилов, или ввести в структуру производной
хлорофилла какую-либо функциональную группу. Однако, эти реакционные центры
используется в химических превращениях в основном хлорофилла (а),
феофитина (а), метилфеофорбида (а).
1.2 Реакции восстановления
производных хлорофилла
.2.1 Восстановление винильной группы
Восстановление винильной группы
до этильной с образованием соответствующих мезопроизводных хлорофилла
осуществляют каталитическим гидрированием. Так феофитин (а) с высоким выходом
гидрируется водородом над палладированным графитом в ацетоновом или
пиридин-ацетоновом растворе при комнатной температуре [1]. Аналогично
гидрируется комплекс Zn-(II)
3-(2-метилвинил)-3-дезформил родин g7
[2]. В работе [3] сообщают о гидрировании феофитина (а) и феофорбида (а)
водородом в присутствии Pd
или PtO2
в ацетоне или диоксане. Остальные мезопроизводные получают обычно из
мезофеофитина (а) или мезофеофорбида (а). Реакция восстановления винильной
группы гидразингидратом не является специфичной [3]. Кроме восстановления
других групп могут происходить и «невосстановительные» побочные реакции.
Например, при восстановлении гидразингидратом феофорбида (а) может происходить
нуклеофильное раскрытие экзоцикла Е с образованием γ-монометилового
эфира 6-гидразида хлорина е6 .
1.2.2 Восстановление сложноэфирных
групп
Восстановление м.э. пурпурина
18 было изучено при синтезе фотосенсибилизаторов на основе производных
хлорофилла [4,5]. Восстановление м.э. пурпурина 18 тетрагидроборатом натрия в
пропаноле с небольшими количествами пиридина дает смесь у- и 6-лактонов в
соотношении 6:1 с выходом 42%.
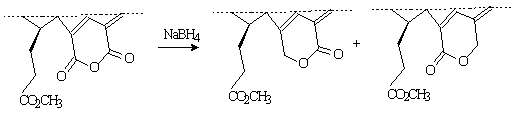
Рисунок 2. Восстановление м.э.
пурпурина 18 тетрагидроборатом натрия
Предполагаемый механизм
восстановления заключается в образовании под действием тетрагидробората натрия
у-полуацеталя, который обратимо раскрывается в пурпурин 5. Альдегидная группа
последнего восстанавливается тетрагидроборатом натрия до гидроксиметильной,
которая при взаимодействии с 6-карбоксильной группой образует циклический
у-лактон.
Аналогично, по-видимому,
образуется и b-лактон. Описанный
механизм был косвенно подтвержден тем, что при восстановлении борогидридом
натрия д.м.э. пурпурина 5 получается у-лактон. В работе [6] для изучения
агрегации производных хлорофилла был синтезирован ряд форбинов, содержащих
карбонильные и карбметоксильные группы исходя из метилмезопирофеофорбида (а)
(1). Карбметоксильная группа метилпропионатного остатка метилмезопирофеофорбида
(а) (1) восстанавливается в гидроксиметильную при действии литий алюмогидрида в
сухом диэтиловом эфире под азотом при 0° С [6]:
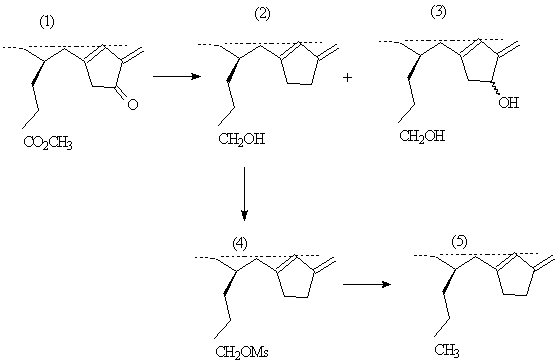
Рисунок 3. Восстановление
карбметоксильной группы метилпропионатного остатка метилмезопирофеофорбида (а)
(39) в гидроксиметильную
В случае, если
кетогруппа в положении 9 не защищена, образуется смесь мажорного спирта (2) и
минорного диола (3). Удаление гидроксильной группы мажорного компонента
проводят восстановлением мезитильного производного (4). Последнее получают
действием мезитилхлорида в сухом хлористом метилене в присутствии триэтиламина
при 0° С с выходом 83%. Обработка мезитильного производного литий алюмогидридом
дает хлорин (5) с выходом 59% без существенного образования продуктов
осмоления.
При получении 7-пропил-7-дезметилпропионат-метилмезопирофеофорбида
(а) карбонильную группу в положении 9 метилмезопирофеофорбида (а) защищают в
виде ацеталя. Восстановление карбметоксильной группы проводят
литийалюмогидридом в сухом диэтиловом эфире под азотом. Реакцию проводят при -78°
С, так как при комнатной температуре происходит восстановительное раскрытие
1,3-диоксоланового цикла.
Аналогичная проблема возникает
при восстановлении мезитильного производного. С одной стороны, нельзя допустить
раскрытие 1,3-диоксоланового цикла, с другой стороны, при низких температурах
не происходит восстановление мезитильного производного. Наилучший выход (52%)
получен при проведении реакции при -7° С (баня лед с солью) в течение 20 минут.
Удаление защитной группы проводят действием соляной кислоты в ацетоне с 83%
выходом.
.2.3 Восстановление карбонильных
групп
Альдегидные группы в различных
положениях хлоринового цикла селективно восстанавливают Na[BH3CN]
в метаноле [3]. Хемоселективное восстановление альдегидной группы
метилпирофеофорбида а до гидроксиметильной проводят тем же
восстановителем в смеси хлористого метилена с метанолом при комнатной
температуре под аргоном [7] или триацетоксиборогидридом тетрабутиламмония в
хлористом метилене с уксусной кислотой [8].
Хемоселективное восстановление
альдегидной группы 2-(формилметил)-2-дезвинилметилпирофеофорбида а с
образованием b-гидроксиэтильного
производного проводят цианотриборогидридом тетрабутиламмония в
гексаметилфосфортриамиде, содержащем 0.2 М водную серную кислоту [9].
Ацетильную группу 2-(ацетокси)-2-дезвинил-9-дезоксо-метилпирофеофорбида (а)
восстанавливают до а-гидроксиэтильной тетрагидроборатом натрия в хлористом
метилене с метанолом [10]. В тех же условиях восстанавливает до спиртовой
кето-группу форбиновых производных хлорофилла в положении 9 [10]. Действие
борогидрида натрия в ТФК [6,11], или в ТФК с хлористым метиленом [10] ведет к
восстановлению карбонила в положении 9 до метиленовой группы с образованием
соответствующих 9-дезоксопроизводных.
1.3 Другие реакции производных
хлорофилла
Реакция с ацетилацетоном
a-метоксильное производное т.м.э. хлорина е6
(11) используется для синтеза фотосенсибилизаторов с удаленной
гидроксильной группой. Одна из стадий этого синтеза заключается в реакции с
ацетилацетоном (см. рис.4) [9]:
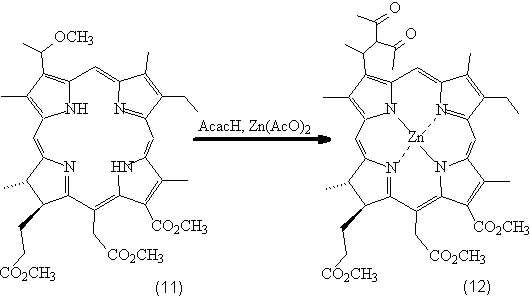
Рис. 4. Взаимодействие 3-(a-метоксиэтил)-хлорин
е6 т.м.э. с ацетилацетоном.
Ацетатат цинка в этой реакции вводится в
качестве слабого основания, необходимого для ионизации и для образования
цинкового комплекса.
Реакция Вильсмейера
Активность безметальных производных хлорофилла в
реакциях электрофильного замещения по раскрытию цикла невелика, поэтому такие
преврашения проводят с соответствующими металлокомплексами [14-16]. В случае
реакции Вильсмейера используют комплексы меди (II),
никеля (II) и железа (III).
При формилировании по Вильсмейеру производных
хлорофилла, не содержащих винильной и карбонильной групп, замещение происходит
в 20-положении. При действии комплекса Вильсмейера на Cu
(II)
дезоксо-метилмезопирофеофорбида (а) образуется соответствующее формильное
производное в положении 20 [17]:
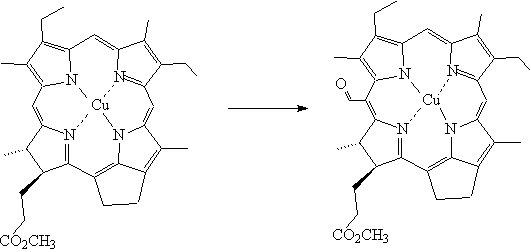
Рис. 5. Формилирование по Вильсмейеру Cu
(II)
дезоксо-метилмезопирофеофорбида (а).
Винильная группа более реакционноспособна, чем
метиновый мостик в положении 20. При обработке формилирующей смесью комплекса Fe(III)-
хлорина е6 т.м.э. образуются моноформильное (по винильной группе) и
диформильное (по винильной группе и по 20-положению) производные с выходами 7%
и 30%.
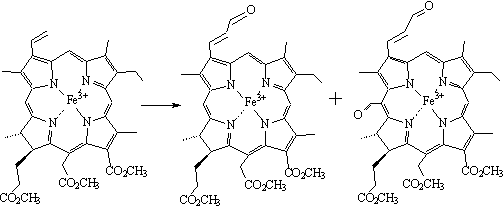
Рисунок 6. Формилирование по Вильсмейеру Fe(III)-хлорина
е6 т.м.э.
При формилировании Fe(III)-изохлорина
е4 д.м.э. (12) образуется только продукт реакции по винильной
группе .
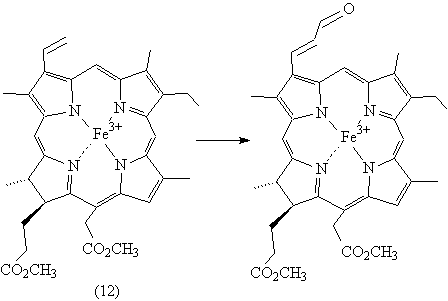
Рисунок 7. Формилирование по Вильсмейеру
При действии формилирующей смеси на Cu(II)-метилмезопирофеофорбид
(а) происходит замена гидроксила енольной формы на хлор с последующим
формилированием енольной формы .
Реакция производных хлорофилла и комплекса
Вильсмейера с N,N-диметиламиноакролеином
проходит по 20-положению хлоринового цикла, даже если в молекуле исходного
соединения есть карбонильная и винильная группа. При действии этого комплекса
на Ni (II)
9-дезоксо-метилмезопирофеофорбид (а) (13) [17] или комплекса Ni
(II) мезохлорина е6
т.м.э. (14) дает 20-формилвинильное производное (выходы 80% и 75%
соответственно). В случае комплексов Ni
(II)
метилмезопирофеофорбида (а) (15) и метилпирофеофорбида (а) (16)
замещение идет также в 20-положение (выходы 83% и 63%) .
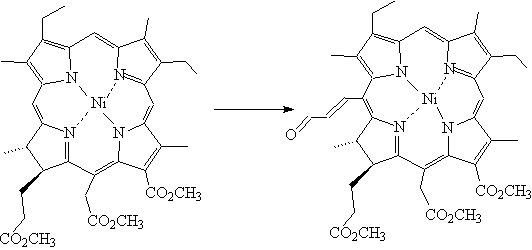
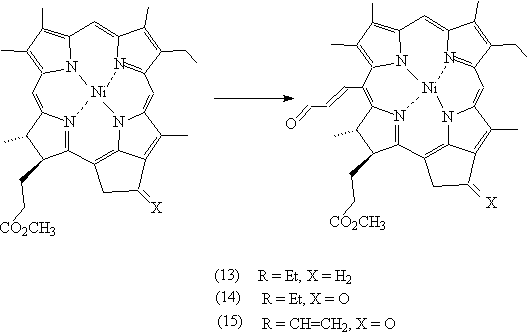
Рисунок 8. Синтез формил-винильных производных
по Вильсмееру.
Цианирование комплекса Cu
(II)
метилмезопирофеофорбида (а) проводилось при помощи бромциана в хлороформе в
присутствии хлорида олова и суспендированного карбоната калия. Реакция обычно
заканчивается через 7-9 часов с выходом 40-50% после деметаллирования.
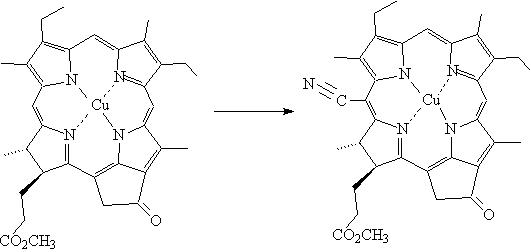
Рис. 9. Цианирование Cu
(II) метилмезопирофеофорбида
(а)
Действием на Cu
(II)
метилмезопирофеофорбид (а) хлорметилметилсульфида в присутствии хлорида титана
в сухом хлористом метилене при 40оС было получено 20-СН2SCH3
производное с выходом 74-77% после ПТСХ.
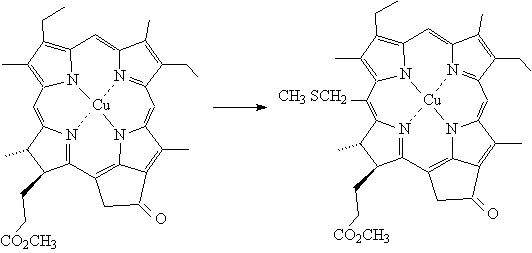
Рис. 10. Получение 20-СН2SCH3
Cu (II)
метилмезопирофеофорбида (а)
1.4
Реакции нуклеофильного замещения при карбонильном атоме углерода в положении
13(1) форбиновых производных хлорофилла
В связи с тем, что атом
углерода карбонильной группы в положении 13 (1) доступен для нуклеофильной
атаки и имеется возможность делокализации отрицательного заряда на атоме
углерода в положении 13 (2) за счет сопряжения с хлориновым циклом и
карбметоксильной группой, для форбиновых производных хлорофилла возможны реакции
раскрытия экзоцикла V при
действии нуклеофилов по схеме :
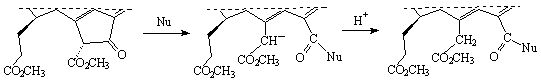
Рис.11 Схема реакции нуклеофильного раскрытия
экзоцикла V
Например,
действием на феофорбиды (а) (2) и (b)
(4) щелочью (КОН) в метаноле получают хлорин е6 (7) и
родин g7
(9) . Обработкой феофорбидов (а) и (b)
диазометаном получают триметиловые эфиры соответствующих хлоринов (7) и (9)
. По-видимому, и в том и в другом случае нуклеофилом, раскрывающим экзоцикл,
является метилат-анион. Это подтверждается результатами работы, в которой
т.м.э. хлорина е6 (8) и родина g7
(10) получают из соответствующих метилфеофорбидов действием раствора
метилата калия в метаноле с пиридином. В работе такая же реакция проведена в
более жестких условиях. Смесь т.м.э. хлорина е6 (8) и родина g7
(10) получают действием метилата натрия на смесь метилфеофорбидов (а) (3)
и (b) (6) в
сухом метаноле с ТГФ под азотом и затем смесь разделяют колоночной
хроматографией на оксиде алюминия.
Рисунок 12 Форбиновые производные хлорофилла
(1)
феофитин
(а): R1=CH3,
R2=Phyt,
R3=H,
R4=CO2CH3
(2)
феофорбид
(а): R1=CH3,
R2=H,
R3=H,
R4=CO2CH3
(3)
метилфеофорбид
(a): R1=R2=CH3, R3=H, R4=CO2CH3
(4) феофитин
(b): R1 = CH=O, R2 = Phyt, R3 = H, R4
= CO2CH3
(5) феофорбид
(b): R1 = CH=O, R2 = H, R3 = H, R4
= CO2CH3
(6) метилфеофорбид
(b): R1 = CH=O, R2 = CH3, R3 = H, 4
= CO2CH3
Рис.13 Производные хлорофилла
(7) хлорин е6: R1
=
R2 =
R3 =
H, R4
=
CH3
(8) т.м.э. хлорин е6: R1
=
R2 =
R3 =
CH3,
R4 =
CH3
(9) родин g7:
R1=R2=R3=H,
R4 =
CH=O
(10) т.м.э. родин g7:
R1 =
R2 =
R3 =
CH3,
R4 =
CH=O

Рисунок14. Механизм реакции раскрытия экзоцикла V
с аминами
При действии на метилфеофорбид (а) (3)
метиламина и этиламина в ТГФ при комнатной температуре получают с хорошим
выходом соответствующие амиды. В реакцию вступают все форбиновые производные
хлорофилла, содержащие фрагмент ß-кетокислоты.
Сравнение реакционной способности в этой реакции феофитинов (а) и (b)
и соответствующих хлорофиллов, то есть магниевых комплексов, показывает, что
комплекс более реакционно способен в этой реакции .
Зависимость скорости размыкания экзоцикла от
природы металла, координированного с H2ХЛ,
оказывается сложной . Центральные атомы ведут себя существенно различно: Mg,
Cd благоприятствуют
расщеплению, Zn и Co
несколько замедляют его, Ni
практически не изменяет скорости, Hg
сильно тормозит ее. Скорости размыкания для Mg2+,
Cd2+,
Co2+ и
Hg2+
линейно зависят от электроотрицательности металлов. Zn2+
и
Ni2+ не
укладываются на прямую.
1.5 Положение сигналов спектров ЯМР 1Н
метилфеофорбида (а)
Таблица 1 Положение сигналов
спектров ЯМР 1Н метилфеофорбида а (литературные данные)
|
Отнесение
|
Метилфеофорбид
(а) Лит - ые данные
|
|
10
- Н
|
9.48
с 1Н
|
|
5
- Н
|
9.33
с 1Н
|
|
20
- Н
|
8.58
с 1Н
|
|
3(1)
- Н
|
7.97
дд (1Н, 18.4 и 11.5Гц)
|
|
3(2)
- Н транс
|
6.27
дд (1Н, 17.8 и 1.4Гц)
|
|
3(2)
- Н цис
|
6.17
дд (1Н, 12.8 и 1.4Гц)
|
|
13(2)
- R
|
R= H 6.28 с 1Н
|
|
18
- Н
|
4.48
м 1Н
|
|
17-Н
|
4.22
м 1Н
|
|
13(4)
- СН3
|
3.91
с 3Н
|
|
12(1)
- СН3
|
3.65
с 3Н
|
|
8(1)
|
3.69
м 2Н
|
|
17(4)
- СН3
|
3.59
с 3Н
|
|
2(1)
- СН3
|
3.40
с 3Н
|
|
7(1)
- СН3
|
3.19
с 3Н
|
|
17(1)
-СН2
|
2.39
- 2.20 м 4Н
|
|
17(2)
- СН2
|
|
|
18(1)
|
1.84
д (3Н, 7.2Гц)
|
|
8(2)
|
1.68
т (3Н, 7.6Гц)
|
|
I -
NH
|
0.52
уш.с 1Н
|
|
III -
NH
|
-1.58
уш.с 1Н
|
2. Экспериментальная часть
.1 Приборы и реактивы
Для получения производных
хлорофилла в качестве сырья использовали высушенные листья спирулины, которые
предварительно подвергали механическому измельчению.
Для проведения колоночной и тонкослойной
хроматографии использовали четыреххлористый углерод марки “ч”, ацетон марки
“ч”. Для приготовления элюентов соотношение растворителей брали по объему. При
проведении колоночной хроматографии, колонку наполняли “мокрым способом”,
используя четыреххлористый углерод.
Для экстракции производных хлорофилла из
спирулины использовали этанол марки “ч” без дополнительной очистки.
Для получения метилфеофорбидов
использовали метанол марки “ч” без дополнительной очистки.
Для осаждения феофитинов использовали
разбавленную соляную кислоту квалификации “ч” в соотношении 1:10 (по объему).
При получении метилфеофорбидов
использовали концентрированную серную кислоту марки “ч”.
Для переосаждения из хлороформа
выделенных соединений использовали пентан, квалификации “ч” без дополнительной
очистки.
Безводный сульфат натрия, квалификации “х.ч.”
использовали для удаления остатков воды из растворов.
Колоночную хроматографию
проводили на силикагеле L
100/400.
.2 Получение феофитинов из спирулины
г сухой измельченной спирулины экстрагировали в
1 дм3 этанола. Хорошо перемешивали и ставили в тёмное место.
Полученный экстракт упаривали примерно до 50мл. Затем подкисляли соляной
кислотой (9 Н2О:1 НСl).
Спирт после ротора заново заливали для дальнейшего экстрагирования. Через
несколько дней выпавшие феофетины отфильтровывали. Отмывали небольшим
количеством воды для нейтрализации кислоты (проверяли с помощью индикаторной
бумажки), затем спиртом до обесцвечивания раствора. Феофитины на фильтре
оставляли сушиться на воздухе. (Раствор после промывания выливать не следует,
оставляли для дальнейшего выпадения феофитинов). Экстрагирование проводили 4
раза. Получали 0,7 г феофитинов.
.3 Получение метилфеофорбида(а) из
феофитинов
Высушенные 0,7 г феофитинов растворяли в смеси
34 см3 метанола и 1,4 см3 концентрированной серной
кислоты. Смесь кипятили в течение 60 минут с обратным холодильником. Далее в
остывшую реакционную смесь прилили 70 см3 дистиллированной воды.
Выпавший в осадок метилфеофорбид (а) отфильтровали и отмыли водой до рН
промывных вод (от метанола и серной кислоты). Растворили метилфеофорбид (а)
на фильтрах в 50 см3 хлороформе высушили над безводным сульфатом натрия.
Раствор упаривали досуха на роторе. Полученную смесь метилфеофорбидов разделяли
колоночной хроматографией на силикагеле с изменением соотношения компонентов
элюирующей системы (ССI4
:
ацетон) от 80:1 до 50:1. За ходом разделения следили при помощи TCX
(Silufol, СС14 :
ацетон - 4:1). Фракцию, содержащую основное вещество, упарили и получили
метилфеофорбид (а).
.4 Хроматографическое исследование
соединений
Метод ТСХ. Контроль
за процессами выделения, разделения и превращениями производных хлорофилла при
помощи ТСХ проводили на пластинках Silufol
и Sorbifol. В качестве
элюентов использовали смеси ССI4
с ацетоном в соотношениях 4:1 (по обьему).
Для сравнения
хроматографической подвижности в условиях тонкослойной хроматографии
использовали метод свидетеля. Для этого исследуемая смесь и эталонный образец
хроматографировали на одной и той же пластинке, совпадения значений Rf
при близких концентрациях исследуемого пигмента и “свидетеля” означает
хроматографическую идентичность этих соединений в данной хроматографической
системе.
3 Обсуждение результатов
Получение метилфеофорбида а из спирулины
через феофитины см. Рисунок 15.

Рисунок 15. Схема получения метилфеофорбида а
Для получения метилфеофорбида а сухую
спирулину экстрагировали настаиванием с этанолом и полученный этанольный
экстракт подкисляли разбавленной соляной кислотой (7%). Феофитины в отличие от
хлорофиллов плохо растворимы в этаноле. Поэтому, когда при подкислении густого
этанольного экстракта спирулины соляной кислотой, происходит удаление магния из
координационной сферы хлорофиллов, образующиеся феофитины выпадают в осадок. Считается,
что, поскольку кислота добавляется в относительно небольшом количестве, другие
вещества осаждаются с феофитинами незначительно. Далее экстракт подкисляли
соляной кислотой и выпавшие при этом в осадок феофитины обрабатывали метанолом
в присутствии концентрированной серной кислоты. Превращения хлорофиллов,
происходящие при этом, можно представить следующим образом (см. 16)
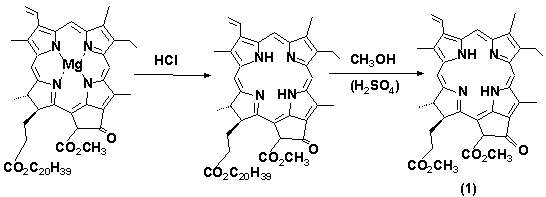
Рисунок 16 Получение метилфеофорбида
а из хлорофиллов (где С20H39 - фрагмент
спирта фитола, этерифицирующего фитилпропионатный заместитель хлорофиллов
высших растений).
Колоночной
хроматографией и кристаллизацией был выделен метилфеофорбид а массой 70
мг. Строение полученного соединения подтверждено данными ПМР- и
ИК-спектроскопии (приложение А, приложение Б).
Выводы
1. Проведен анализ литературы по реакциям
восстановления метилфеофорбида а.
2. Отработана методика выделения
производных хлорофилла а из спирулины.
3. Методом колоночной хроматографии
выделен метилфеофорбид а. Структура полученного соединения подтверждена
методом ИК- и ЯМР-спектроскопии.
Список использованной литературы
1 Kenner
G. V.,
Mac Combie
S. W.,
Smith K.
M. Pyrrols
end related
compounds. Part
XXIV. Separation and oxidative degradation of chlorophyll derivatives. // J.
Chem. Soc. Percin Trans 1 (1973) p. 2517-2523.
Smith K. M., Bushell M.J.,
Rimmer J, Unsworth J.F. Bacteriochlorophylls (c) from Chloropseudomonas
etilenium. Comparation and NMR studies of the pheophorbides and
derivatives.// J. Chem. Soc. (1980) v 102, p. 2437-2448
Seely G. R. The structure and
chemistry of functional groups. In “The chlorophylls” //ed. By L. P. Seely and
C.R. Vernon ,N-Y., Acad. Press (1966) p.
67-108
Миронов А. Ф. Разработка
сенсибилизаторов второго поколения на основе природных хлорофиллов. // Росс.
Хим. Журн. (1998) №5, с.
23-26
Mironov A. N., Efremov A. V.,
Efremova O. A., Bonnet R. Novel chlorines with
δ-lacton ring.// Mendeleev Commun. (1997) p. 244-245
6 Abraham R.J., Rowan A.E.,
Smith N.N., Smith K. M. NMR spectra of the porphyrins. Part 42. The synthesis
and aggregation behavior of some chlorophylls analogous. // J. Chem. Soc.
Perkin Trans 2 (1993) p. 1047-1059
Osuka A., Wada U., Shinoda S.
Covalently linked pyropheophorbide dimmers as model of thr special pair in the
photosynthetic reaction center. // Tetragedron (19960 v. 52 ., № 12, p.
4311-4326
Fuscher R., Engel N.,
Henseleler A., Gossauer A. Synthesis of chlorophyll (a) labeled at C(32)
from pheophorbide (a) methyl ester. // Helv. Chem. Acta (1994) v. 77, p.
1046-1050
Smith K. M., Bisset J. M.F.,
Bushell M.J. partial synthesis of optically pure methyl bacteriopheophorbides
(c) and (D) from methyl pheophorbides (a). // J. Org. Chem.(19800 v. 45, p.
2218-2224
Tamiaki H., Miyatake T.,
Tanicaga R. Self-aggregation of synthetic zinc chlorines possessing “invers”
keto-hydroxyl groups.// Tetragedron Lett. (1997) voll. 38, № 2, p. 267-270.
Mettath S., Shibata M.,
Alderfer J. L., Seng M.O., Smith K. M., Rein R., Dougherty T.J., Pandey R.K.
Synthesis and spectroscopic properties of novel benzochlorines derived from
chlorophyll (a).// J. Org.
Chem. (1998) v.
63 , p. 1646-1656.
Бажанова, Н.В., Маслова,
Т.Г., Попова, И.А., Попова, О.Ф., Сапожников, Д.И., Эйдельман, З.М. При участии
Черноморского, С.М. и Меницкой, Я.М. Пигменты пластид зеленых растений и
методика их исследования. - М.-Л.: Наука, 1964. - 120 с.
Порфирины: структура,
свойства, синтез. / Под ред. Н.С. Ениколопяна - М.: Наука, 1985. - 334 с.
Wasielewski
M.R.,
Johnson D.J.,
Neimczuc
M.P.,
Gaines G.l.,
O’Neil
M.P.,
Svec W.A.
Chlorophyll-porphyrin
heterodimers
with orthogonal
π-systems:
solvents
polarity
dependent
photophysics.// J.Am.
Chem. Soc. (1990) v. 112, p. 6482-6488.
Tamiaki H., Kouba M. Synthesis
of chlorophyll (a) homologos by Wittig and Knoevenagel reaction with methyl
pyropheophorbide (d).// Tetragedron (1997) v.
53, №31, p. 10677-10688.
Ломова Т. Н. Основы синтеза и
механизмы химических превращений порфиринов и их аналогов. Часть
1,2 Текст
лекций.
Иваново
2007, с.78.
Smith K. M., Goff D.A., Simpson
D. J. Mesosubstitution of chlorophyll derivatives: direct rote for
transformation of bacteriopheophorbides (d) into bacteriopheophorbides (c).// J.
Am. Chem.
Soc. (1985) v.
107, p. 7946-4954
Приложение А
Положение и мультиплетность сигналов спектров
ПМР метилфеофорбида а
|
Отнесение
сигналов
|
Метилфеофорбида
(литературные данные)
|
|
10-Н
|
9,48
(с 1Н)
|
|
5-Н
|
9,33
(с 1Н)
|
|
20-Н
|
8,58
(с 1Н)
|
|
3(1)-Н
|
7,97
(д д, 1Н, 18,4 и 11,5 Гц)
|
|
3(2)-Н
(транс)
|
6,27
(дд 1Н, 17,8 и 1,4 Гц)
|
|
3(2)-Н
(цис)
|
6,17
(дд 1Н, 12,8 и 1,4 Гц )
|
|
13(2)-СН2
|
6,28
(с 2Н)
|
|
18-Н
|
4,48
(м 1Н)
|
|
17-Н
|
4,22
(м 1Н)
|
|
13(4)-
СН3
|
3,91
(с 3Н)
|
|
12(1)-СН3
|
3,65
(с 3Н)
|
|
17(4)-СН3
|
3,59 (с 3Н)
|
|
2(1)-СН3
|
3,40
(с 3Н)
|
|
7(1)-СН3
|
3,19
(с 3Н)
|
|
8(1)-СН2
|
3,61
(кв 2Н, 8,1 Гц)
|
|
17(1),17(2)-СН2
|
2,39-2,20
(м 4Н)
|
|
18(1)-СН3
|
1,84
(д 3Н, 7,2 Гц)
|
|
8(2)-СН3
|
1,68 (т 3H,
7,6 Гц)
|
|
I-NH
|
|
III-NH
|
-
|
Приложение Б
Положение полос в ИК-спектре (ν,
см-1) метилфеофорбида а
|
Отнесение
|
Метилфеофорбид
а
|
|
ν
С=N
(оксима)
|
-
|
|
Колебания
хлоринового цикла
|
|
«хлориновая
полоса»
|
1624
|
|
скелетные
колебания хлоринового цикла
|
1558
1504 1352 1300 776
|
|
Колебания
винильной группы
|
|
νпл
(-СН2 -)
|
1404
|
|
νвнепл
(-СН2
-)
|
990,916
|
|
ν
C=С
|
900
|
|
Колебания
алифатических заместителей
|
|
ν
(-CH3)
|
2964
|
|
ν
(-CH2-)
|
2936
|
|
νножн
(-CH2-)
|
1455
|
|
νas
(-CH3)
|
1438
|
|
Колебания
кето-группы в экзоцикле
|
|
ν
C=О
|
1706
|
|
Колебания
кето-группы в экзоцикле
|
|
ν
С=О
|
1476
|
|
νasС=О
|
1224
|
|
νsС=О
|
1036
|
|
νs(СH3
в СООС H3)
|
1372
|
|
Колебания
карбоксильной группы
|
|
ν
С=О
|
-
|
|
-
|
|
ν
ОH
(уш. полоса)
|
-
|
|
NH полоса в
хлориновом цикле
|
3412
|