Оценка метанолутилизирующей активности биопрепарата экологического назначения для очистки окружающей среды от метанола
МИНИСТЕРСТВО
СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное
государственное бюджетное образовательное учреждение высшего образования
«Московская
государственная академия ветеринарной медицины и биотехнологии - МВА имени
К.И.Скрябина»
Ветеринарно-биологический
факультет
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ РАБОТА
Направление подготовки 19.03.01
«Биотехнология»
Квалификация (степень) - Бакалавр
биотехнологии
На тему: «Оценка метанолутилизирующей
активности биопрепарата экологического назначения для очистки окружающей среды
от метанола»
Студентки IV
курса ветеринарно-биологического факультета
Богаш Александры Сергеевны
Научный руководитель
Доктор биологических наук, профессор
кафедры иммунологии и биотехнологии
ФГБОУ ВО «МГАВМиБ МВА им К.И. Скрябина»
М.Ю. Волков
МОСКВА 2017
Введение
Загрязнение почвенного покрова и водной среды, обусловленное наличием
значительных источников загрязнения (главными из которых являются: промышленные
предприятия, сельское хозяйство, транспорт, жилые дома и бытовые предприятия),
приводят к тому, что токсические вещества накапливаются и способствуют
постепенному изменению компонентного состава почв и водных бассейнов, нарушая
химические, биохимические и микробиологические характеристики среды обитания
живых организмов.
Одним из основных источников загрязнения почв являются промышленные
предприятия, в твердых и жидких отходах которых постоянно присутствуют
различные вещества, способные оказывать токсическое воздействие на живые
микроорганизмы и их сообщества. Одним из таких соединений, представляющих
серьезную проблему, обусловленную его высокой токсичностью и приводящему к
возникновению экологических рисков, связанных со сбросами в окружающую среду на
предприятиях газовой промышленности, является метанол. [2,3].
На объектах газовой промышленности разрешается использовать метанол
только как средство предотвращения или разрушения кристаллогидратных пробок в
аппаратах, приборах и газопроводах, а также для обработки призабойных зон
газовых скважин. При этом очень большое количество операций с метанолом в ходе
одной поставки. Каждая операция - потенциальный риск срыва всей поставки и
возможной транспортной аварии, и соответственно розлива метанола и загрязнения
окружающей среды. [1]
В настоящее время для очистки воды от метанола предлагается использовать
стандартные технологии очистки, такие, как активный ил.
Недостатком их является низкая скорость деградации, необходимость
дополнительной очистки образующихся органических соединений.
К биодеградации метанола способны также многие микроорганизмы (бактерии,
дрожжи, микроскопические грибы). При этом основными агентами биодеградации
метанола являются бактерии.
Таким образом, создание универсального и эффективного
биопрепарата-метанолдеструктора, состоящего из композиции микроорганизмов,
способных не только перерабатывать метанол, но и сопутствующие нефтепродукты
(газовый конденсат), и одновременно облагораживать обработанную среду является
актуальной задачей.
Цель настоящей работы состоит в оценке метанолутилизирующей активности
биопрепарата экологического назначения для очистки окружающей среды от
метанола.
Для достижения поставленной цели необходимо решить следующие задачи.
. выбор компонентов и штаммов биопрепарата с наибольшей скоростью
накопления биомассы и глубиной разложения метанола, обосновать соотношения
штаммов микроорганизмов метанолутилизаторов, их концентрации в конечной форме
биопрепарата;
. определить критические концентрации метанола в воде и почве,
позволяющих использовать биопрепарат
. оценить возможность применения биопрепарата в морской воде, засоленной
почве;
. разработка ТУ на биопрепарат;
микроорганизм
метанол биопрепарат засоленный
1. Обзор литературы
1.1. Использование метанола в газовой промышленности
Техногенные газовые гидраты могут образовываться в системах добычи газа:
в призабойной зоне, в стволах скважин, в шлейфах и внутрипромысловых
коллекторах, в системах промысловой и заводской подготовки газа, а также в
магистральных газотранспортных системах. В технологических процессах добычи,
подготовки и транспорта газа твердые газовые гидраты вызывают серьезные
проблемы, связанные с нарушением протекания этих процессов.
Для борьбы с гидратами разработан ряд методов, показанных на рисунке 1, в
том числе и методы, использующие химические реагенты - ингибиторы гидратообразования.

Рисунок 1. Методы борьбы с техногенным гидратообразованием в
газопромысловых и газотранспортных системах
Наиболее распространенным методом предупреждения гидратообразования в
системах сбора является ввод ингибитора гидратообразования (метанол).
Основным методом предупреждения гидратообразования на установках
подготовки природного газа к транспорту, также, как и в случае борьбы с
гидратообразованием в системах промыслового сбора углеводородного сырья,
является ввод ингибитора гидратообразования (метанол).
В настоящее время на действующих месторождениях Крайнего Севера России в
качестве ингибитора гидратообразования используется практически только метанол.
Метанол - широко распространенный антигидратный реагент, используемый как для
предупреждения гидратообразования, так и для ликвидации возникающих по
каким-либо причинам гидратных отложений (несплошных гидратных пробок).
Повсеместное использование метанола в качестве ингибитора
гидратообразования на газодобывающих предприятиях России обусловлено следующими
причинами:
относительно низкой стоимостью (по сравнению с другими ингибиторами
гидратообразования), широко развитой промышленной базой. Производство метанола
может быть развернуто непосредственно в местах потребления - газовых промыслах;
высокой технологичностью процесса ввода и распределения метанола в
требуемые участки технологической цепочки; отпадает необходимость в блоке
приготовления реагента, что, например, является характерной особенностью
применения ингибиторов неэлектролитов;
наивысшей среди известных ингибиторов антигидратной активностью,
сохраняющейся даже при низких температурах;
очень низкой температурой замерзания концентрированных растворов метанола
и исключительно малой их вязкостью даже при температурах ниже -50 °С;
сравнительно малой растворимостью метанола в нестабильном конденсате,
особенно при контакте нестабильного газового конденсата с отработанным
(насыщенным) водным раствором метанола, концентрацией менее 50 масс. %;
некоррозионностью метанола и его водных растворов;
наличием достаточно простых технологических схем регенерации отработанных
растворов;
принципиальной проработанностью в настоящее время вопросов утилизации и
захоронения промышленных стоков, содержащих метанол, в связи с постоянно
возрастающими требованиями к охране окружающей среды;
высокой эффективностью реагента не только для предупреждения
гидратообразования, но и при ликвидации возникающих при нарушениях
технологического режима несплошных гидратных пробок (отложений) в промысловых
коммуникациях (скважинах, шлейфах, коллекторах, АВО, теплообменном
оборудовании).
Взамен чистого метанола практически с той же антигидратной эффективностью
можно использовать технические сорта, а также его водные растворы.
Однако использование ингибиторов на основе метанола имеет ряд серьезных
недостатков, к которым прежде всего относятся:
очень высокая токсичность (как при действии паров, так и при попадании на
кожные покровы и внутрь организма), а также высокая пожароопасность;
возможность выпадения солей при смешивании с сильно минерализованной
пластовой водой и, как следствие, солеотложения в промысловых коммуникациях;
эффект ускоренного роста кристаллогидратов в присутствии разбавленных
водных растворов метанола недостаточной концентрации для предупреждения
гидратов;
высокая упругость паров метанола (нормальная температура кипения ~ 65
°С), связанная с этим его очень высокая растворимость в сжатом природном газе
и, соответственно, повышенный удельный расход метанола.
Промышленная и экологическая безопасность работы с метанолом на объектах
газовой промышленности
Безопасность работы с метанолом на объектах газовой промышленности
России, определяется различного рода документами (инструкции, санитарные
правила, правила безопасности, ГОСТы), указанными в Сборнике документов по
безопасности работы с метанолом на объектах газовой промышленности России. [12,
13, 14]
Основным документом указанного сборника, регламентирующим применение
метанола, является Инструкция о порядке получения от поставщиков, перевозки,
хранения, отпуска и применения метанола на объектах газовой промышленности,
утвержденная заместителем Министра газовой промышленности М.И. Агапчевым 7 июля
1975 года и согласованная с Минздравом СССР N 122-19/134-4 от 27.05.75 и МВД
СССР 14.05.75. [12]
Порядок применения метанола на технологические нужды определяется в
соответствии с утвержденными проектами обустройства газовых месторождений,
«Правилами технической эксплуатации магистральных газопроводов» и «Правилами
безопасности в нефтегазодобывающей промышленности».
Ответственность за обеспечение необходимых условий для правильной
организации работ с метанолом и контроль за соблюдением настоящей Инструкции
возлагается на руководителей предприятий.
Руководители объединений и управлений обязаны специальным приказом
определить предприятия, в которых разрешается создание базовых складов
метанола, а также обеспечить места и условия его содержания на производственных
объектах.
Высокая токсичность метанола и его пожароопасность обуславливают
необходимость строгого соблюдения требований техники безопасности, что
практически сводит к минимуму возможность отравлений метанолом подготовленного
технического персонала. Тем не менее, всегда существует вероятность аварии на
любом этапе применения метанола в качестве ингибитора гидратообразования на том
или ином объекте газовой промышленности, и, в результате, розливы метанола,
загрязнение окружающей среды и отравление персонала.
Тем более вероятность аварии увеличивается с ростом потребления метанола
в качестве ингибитора гидратообразования.
Основные требования на качество товарного природного газа,
транспортируемого по магистральным газопроводам, регламентируются ГОСТом
51.40-93 «Газы горючие природные, поставляемые и транспортируемые по
магистральным газопроводам. Технические условия».
По существу, предотвращение гидратообразования является одним из
элементов подготовки газа к транспорту. При этом, чем ниже температура
реализации технологических процессов добычи, сбора и промысловой подготовки
газа, тем выше вероятность образования гидратов и тем больше ингибиторов, а
именно метанола, требуется для предотвращения процесса выпадения гидратов.
[15-17]
1.2. Свойства метанола
Метанол (CAS 67-56-1) - бесцветная жидкость с запахом, напоминающим запах
этилового спирта. Горючая жидкость (категория 1), высокотоксичное вещество
(категория 1), обладающее репродуктивной токсичностью 1B и токсичное для
определенных органов (при многократном воздействии). [18]
Внешний вид: Бесцветная прозрачная жидкость
Запах: Характерный запах спирта средней интенсивности
Порог восприятия запаха: обнаружение: 4,2 - 5960 промилле (среднее
геометрическое) 160 промилле; распознавание: 53 - 8940 промилле (среднее
геометрическое) 690 промилле: Не определяется
Точка замерзания: -97,8°C
Точка кипения: 64,7°C
Область кипения: Не определяется
Температура воспламенения: 11,0°C
Растворимость: Полностью растворим
Частный коэффициент:Log P (oct) = -0,82
Давление пара: 12,8 кПа при 20°C
Высший предел взрываемости: 36,5 %
Низший предел взрываемости: 6%
Температура самовоспламенения: 464°C
Растворимость в других жидкостях: Растворяется в любых пропорциях в
этиловом спирте, бензоле, других спиртах, хлороформе, диэтиловом эфире и прочих
эфирах, а также в сложных эфирах, кетонах и большинстве органических
растворителей.
Критическая температура: 239,4°C
Удельный вес: 0,791 при 20°C
Скорость испарения: 4,1 (n-бутилацетат = 1)
Плотность пара: 1,105 при 15°C (воздух = 1)
Температура разложения: Не определяется
Чувствительность к ударам: Отсутствует
Чувствительность к статическому разряду: Низкая
ПДК-СВК: 200 промилле, кожа (262 мг/м3);
ПДК-КПУВ: 250 промилле, кожа (328 мг/м3);
ДУВ-СВК: 200 промилле, кожа
СВК-КПУВ: 250 промилле, кожа. [18-23]
Критическое воздействие ПДК: невропатия, нарушения зрения и центральной
нервной системы.
Доза, непосредственно опасная для жизни и здоровья: 6000 промилле, острая
токсичность у животных при вдыхании. [20]
Метанол - яд, действующий на нервную и сосудистую системы. Токсическое
действие метанола обусловлено так называемым «летальным синтезом» -
метаболическим окислением в организме до очень ядовитого формальдегида. Приём
внутрь 5-10 мл метанола приводит к тяжёлому отравлению (одно из последствий -
слепота), а 30 мл и более - к смерти.
Токсичность для окружающей среды: НЕ ДОПУСКАТЬ попадания в канализационный
коллектор или источники водоснабжения.
Находясь в пресной или соленой воде, метанол способен оказывать серьезное
воздействие на водную флору и фауну. Исследования токсического действия
метанола на бактерии водоочистных сооружений показали незначительное влияние на
его усвоение при уровне 0,1%, в то время как концентрация 0,5% замедляла
усвоение. Метанол разлагается на двуокись углерода и воду.
Устранение в условиях окружающей среды:
Разложение микроорганизмами: Легко разлагается микроорганизмами в воде и
почве.
Бионакопление:
Устранение в почве: Согласно схеме классификации, приблизительное
значение величины Кока, равное 1 и полученное с помощью структурного метода
оценки, указывает на высокую мобильность метанола в почве. Улетучивание с
поверхности влажной почвы является важной составляющей устранения метанола при
значении постоянной закона Генри, равной 4,55х10-6 (атм. м3/моль). Возможность
улетучивания метанола с поверхности сухой почвы может существовать при давлении
пара, составляющем 127 мм рт.ст. Важным фактором устранения метанола также
является разложение его микроорганизмами.
Устранение в воде: Согласно схеме классификации, приблизительное значение
величины Кока, равное 1 и полученное с помощью структурного метода оценки,
указывает на то, что метанол не поглощается взвешенными твердыми частицами или
осадком.
Интенсивность улетучивания метанола с поверхности воды определяется
значением постоянной закона Генри, равной 4,55X10-6 (атм. м3/моль). Используя
эту постоянную и метод оценки, находим продолжительность полуулетучивания
метанола для эталонной реки и эталонного озера, которая будет составлять 3 и 35
дней соответственно. Согласно схеме классификации, значение фактора
биоконцентрации (ФБК), не превышающее 10 и измеренное у рыб, указывает на
низкую степень накопления метанола в водных организмах. Гидролиз и фотолиз на
освещенной солнцем поверхности воды не будут играть значительной роли в
процессе устранения метанола, поскольку у данного соединения нет функциональных
групп, подверженных гидролизу или абсорбирующих свет в условиях окружающей
среды. При проведении различных отборочных исследований метанол
продемонстрировал подверженность быстрому разложению бактериями очистных
сооружений и осадочными культурами, что указывает на то, что в условиях
водоемов будет иметь место устранение его микроорганизмами.
Устранение в воздухе: Согласно модели декомпозиции газа/частиц
полулетучих органических соединений в атмосфере, метанол, давление пара
которого составляет 127 мм рт.ст. при температуре 25°C, будет существовать в
окружающей атмосфере исключительно в виде пара. Парообразный метанол
разлагается в ней благодаря реакции с гидроксильными радикалами фотохимического
происхождения; полупериод данной реакции в воздухе, определенный на основании
постоянной ее скорости, равной 9,4X10-13 см./молекула-сек. При температуре
25°C, составляет 17 дней.
Порядок утилизации:
Перед утилизацией метанола ознакомьтесь со всеми федеральными,
региональными, государственными или местными нормативными актами. Допускается утилизация
путем контролируемого сжигания или безопасного захоронения. По мере возможности
подвергайте метанол переработке. Значительные его количества пригодны для
вторичной перегонки или, в случае загрязнения - для сожжения. Метанол может
утилизироваться и на очистных сооружениях. При концентрации, равной 0,1%, он
служит питательной средой для бактерий. Однако в случае превышения указанного
уровня может быть токсичен для микроорганизмов. При прокачке через систему
канализационных коллекторов необходимо поддерживать уровень метанола ниже
уровня огнеопасности (25-процентная водно-метаноловая смесь не воспламеняется
при температуре ниже 39°C). 1 промилле метанола эквивалентна 1,5 промилле
БПК-нагрузки на очистных установках. [17-23]
1.3. Метилотрофия
Метилотрофия - это специализированный тип питания микроорганизмов,
растущих на восстановленных одноуглеродных (С1) соединениях, или соединениях с
несколькими С-атомами, но не имеющими C-C связи. Cпектр C1-соединений
биогенного и абиогенного происхождения достаточно широк и включает около 50
наименований: от предельно восстановленного СН4 до предельно окисленного СО2,
среди которых моноокись углерода, муравьиная кислота, диметиловый эфир,
метилированные амины, галометаны, метилсульфид, метилсульфоксиды, тиоцианаты и
др. Многие из этих летучих соединений обладают цитотоксическим и даже
канцерогенным действием, а также ответственны за так называемый парниковый
эффект, поскольку истощают озоновый слой атмосферы. Аэробные метилотрофы,
использующие восстановленные C1-соединения,
усваивают их одновременно в качестве источника углерода и энергии, выполняют
уникальную функцию природного биофильтра на пути их эмиссии в атмосферу.
Жизненно важная роль аэробных метилотрофов, осуществляющих трансформацию и
деградацию C1-соединеннй, является причиной большого интереса, проявляемого
мировым научным сообществом к исследованию разнообразия, особенностей
метаболизма и физиологии этих микроорганизмов, занимающих промежуточное
положение между типичными автотрофами и гетеротрофами [24-33].
Несмотря на структурную простоту, C1-соединения существенно различаются
по физико-химическим свойствам, что, в свою очередь, определяет особенности
биологии и метаболизма метилотрофных микроорганизмов. В принципе, все
C1-соединення являются окисленными или замещенными производными метана. В
зависимости от того, какая группировка (радикал) ассоциирована с C1-атомом,
пути метаболизма этих соединений значительно различаются. Так, метанол,
метилированные амины и формальдегид могут иметь до пяти путей катаболизма
[33-45].
Метилсодержащие соединения (серин, глицин, биотин, холин, бетаин,
метионин, триптофан, гистидин, лигнин, тимин, никотин и др.) являются
центраболитами при синтезе многих полиуглеродных соединений (рис. 3). В центре
их превращений те самые C1-единицы (метильные, метиленовые, оксиметильные и
формальные группировки), которые участвуют в метаболизме Cn-соединений. Таким
образом, мы видим, что C1-фрагменты очень важны метаболически для существования
всего живого, поэтому использующие их метилотрофные микроорганизмы представляют
значительный интерес как в плане изучения особенностей биологии, так и в целях
практического применения [24, 36-80].
Способность к метилотрофии встречается как у прокариотных, так и
эукариотных микроорганизмов. Среди аэробных эукариот известны 3 рода метанол
использующих дрожжей: Hansenula, Candida и Pichia. В свою очередь, прокариоты
(бактерии) разделены на две большие группы: одни растут на метане
(метанотрофы), другие используют в качестве субстратов окисленные или замещенные
производные метана, но не растут на метане (метилобактерии) [7-72].

Рисунок 3. Метаболические превращения с участием «активных» С1-фрагментов
В связи с тем, что метан и метанол являются возобновляемыми субстратами,
их доступность и относительная дешевизна создали реальные предпосылки для
использования аэробных метилотрофов в биотехнологических процессах. Второе
обстоятельство, позволяющее активно применять метилотрофные микроорганизмы в
биотехнологии - хорошая изученность их метаболизма. Третье важное
обстоятельство - метилотрофынепатогенны [25-29].
Метилотрофы используются в качестве биокаталитических агентов для
получения ферментов и генетической трансформации, для аналитических целей как
биосенсоры, для синтеза моно- и полимеров (полигидроксибутирата. полисахаридов,
каротиноидов, различных биопротекторов и др.), а также для биодеградации
токсичных C1- и Cn-поллютаитов или биоремедиации
окружающей среды. Список соединений и продуктов, которые можно синтезировать с помощью
аэробных метилотрофов, постоянно пополняется новыми наименованиями. Таким
образом, аэробные метилотрофы можно с полным основанием считать идеальными и
перспективными объектами современной биотехнологии для целей биокатализа,
биосинтеза и биоремедиации [29-34].
Следует особо отметить, что аэробные метилотрофы не имеют себе равных в
микробном мире по филогенетическому и физиолого-биохимическому разнообразию. По
мере расшифровки их структурно-функциональных особенностей становится все более
очевидным, что аэробные метилотрофы являются одним из важнейших первичных
звеньев в трофической цепи нашей планеты.
Метанотрофы и метилобактерии в биотехнологии.
Метилотрофы являются весьма неоднородной группой микроорганизмов, которые
обладают большим количеством специализированных генов/ферментов, обеспечивающих
рост на более восстановленных, чем С02, субстратах, не имеющих C-C связи. Вследствие физиолого-биохимических особенностей,
разные метилотрофы реализуют разные метаболические возможности, что следует
принимать во внимание при рассмотрении вопроса об их применении в
биотехнологических процессах. Наибольшие выходы биомассы и скорости роста
получены для метилотрофов с РМФ-путем ассимиляции формальдегида, в отличие от
метилотрофов с сериновым циклом, включающим энергоемкие реакции
карбоксилирования [24-37].
Скорости роста и метаболическая эффективность превращения субстратов в
биомассу и/или продукт зависят от условий культивирования и могут быть улучшены
с помощью инженерии. Они являются важными критериями для оценки основных
технологических показателей того или иного микроорганизма в промышленных
масштабах. Как и в случае других микробиологических процесссов, ключевыми
вопросами при использовании метилотрофов являются скорости синтеза продуктов
(производительность), выход (эффективность преобразования углерода) и
концентрация продукта.
Для окисления 1 г метанола требуется 0.85 г кислорода, при этом
выделяется 0,52 г С02. Оптимальные скорости роста для накопления биомассы можно
получить путем поддержания низкой и стабильной концентрации метанола, поскольку
более высокие концентрации и внезапные ее сдвиги оказывают токсичное действие
на бактерии в связи с накоплением формальдегида. Кроме того, метаболизм
метанола должен тщательно регулироваться для обеспечения большей толерантности
культуры и скорости потребления. Это удалось достигнуть увеличением числа копий
генов ГФС и ФГИ у факультативного метилотрофа В. Methanoticus. [35].
Типичные продукты биотехнологических процессов с участием метилотрофов -
полигидроксиалканоаты и аминокислоты. Первые примеры метаболической инженерии
метилобактерий в производстве лизина уже известны. Повышение синтеза лизина
достигнуто за счет гетерологичной экспрессии в Methylophilusmethylotrophus
устойчивых к ретроингибированию биосинтетических ферментов из Е. соli, либо
экспортера аминокислот изCorynebaeteriumglulamicum [80].
Другими продуктами являются ЭПС, ИУК, трансзеатин, а также различные
белки, такие как зеленый флуоресцирующий белок (GFP), энтероцин П,
ациламидгидролаза, галоалкандегалогеназа и эстераза. М.
Для синтеза специфических продуктов разработаны специальные методы
культивирования с целью повышения уровня целевого продукта. Например, общая
стратегия синтеза ПГБ - это двухстадийный процесс, разделенный на фазу
наращивания биомассы и фазу накопления биополимера, последняя индуцируется
лимитированием по азоту. С помощью этой стратегии были достигнуты высокие
уровни биомассы (130 г/л) и ПГБ (до 60%) [62-80].
Биосинтез кормового белка. Промышленные процессы с использованием
метилотрофных бактерий были созданы с целью получения больших количеств белка
одноклеточных (SCP) для питания людей и животных.
Масштабное промышленное производство кормового белка (гаприна) из
природного газа с использованием термотолерантного штамма А/с. capsulatus 874
было реализовано в СССР в середине 1980-х гг.
Экзополисахариды (ЭПС). Многие метанотрофы родов Methylomonas,
Methylococcus и Methylomierobium, а также метилобактерии родов Methylobacillus,
Methylophilus,Methylophaga и Xanthobacter, реализующие РМФ- или РБФ- пути C1-метаболизма, синтезируют ЭПС из
метана или метанола, причем выход ЭПС можно регулировать факторами среды и
условиями культивирования [24-37].
Цитохромы, Пигменты (каротиноиды, меланин). Метилобактерии синтезируют
пигменты, наиболее обычными из которых являются каротиноиды, придающие
культурам розовый цвет. Термофильные метанотрофы рода Methylocaldum образуют
меланиновый пигмент при понижении температуры культивирования до 42°С. В случае
необходимости синтез этих пигментов можно интенсифицировать, варьируя дозы
физико-химических факторов (pH, температуру, р02).
Бнодеградация токсичных соединений. Перспективность аэробных метилотрофов
в биотехнологии обусловлена не только способностью синтезировать различные
полезные продукты, довольствуясь минимальными, в сравнении с гетеротрофами,
питательными потребностями, но и разлагать широкий спектр токсичных соединений.
Природа конечных продуктов биодеградации важна для экологии производства.
Аэробные метилотрофы способны утилизировать вещества наиболее полно и без
нежелательных побочных продуктов. Существенное значение имеют условия наработки
биомассы для сорбции в биореакторе на носителе. Метилотрофы хорошо растут на
простых минеральных средах, активно атакуют поллютанты. Иммобилизованные клетки
метилотрофовобеспечивают полную конверсию ряда токсичных соединений в проточных
условиях, что открывает перспективы широкого использования для целей
биодеградации и биоремедиации.
1.4. Специализированный биопрепараты
Биопрепараты и их получение.
Среди биопрепаратов, разработанных для решения задач охраны окружающей
среды, можно выделить следующие группы по их назначению:
для ликвидации загрязнений;
для рекультивации территорий и восстановления плодородия почв;
для переработки отходов;
для очистки природных водоемов;
для биомониторинга и биотестирования.
В России биопрепаратами называют препараты, полученные на основе штаммов
микроорганизмов, имеющих разрешения санитарно-эпидемиологических служб на их
производство и применение. Подавляющее большинство этих штаммов прототрофные,
природного происхождения, т. е. не относятся к генетически модифицированным и
не содержат мутаций, требующих дополнительных источников ростовых факторов.
Выпускаемые коммерческие биопрепараты, предназначенные для очистки
природных сред, представляют в основном массу жизнеспособных клеток
микроорганизмов-биодеструкторов. Они различаются используемыми для их получения
штаммами, имеющими различные физиолого-биохимические свойства, такие как
термотолерантность, осмофильность, оптимальные для роста значения pH,
способность включать в метаболические процессы разные классы загрязнений.
Этифизиолого-биохимические свойства штаммов биодеструкторов определяют
эффективность применения биопрепаратов в разных почвенно-климатических зонах и
средах, для удаления различных по химическому составу загрязнений. Конечным
продуктом биотрансформации загрязнений являются простые минеральные вещества и
микробная биомасса, которая в природных условиях легко вовлекается в
биогеохимические циклы превращения веществ.
Препараты для очистки природных сред должны отвечать ряду требований:
быть получены на основе непатогенных штаммов, выделенных из природных
ценозов или селекционированных в лаборатории; не содержать патогенных
инфицирующих микроорганизмов;
микроорганизмы биопрепаратов должны иметь высокие технологические
показатели: способность к росту и накоплению биомассы в промышленных
ферментерах больших объемов; высокая конкурентоспособность по отношению к
сопутствующей микрофлоре ферментера, позволяющая проводить процесс в не строго
асептических условиях; сохранение жизнеспособности при высушивании и длительном
хранении;
быть технически простыми в использовании и экономически приемлемыми;
обеспечивать эффективное снижение уровня загрязнения без образования
опасных промежуточных и конечных продуктов трансформации и не оказывать
неблагоприятного воздействия на окружающую среду;
дозы препаратов, интродуцированных в окружающую среду, должны
активировать самоочищающую способность природных биоценозов, не разрушать их
структуру и функции, не стимулировать рост патогенных микроорганизмов.
Исследования по получению биопрепаратов направлены на подбор культур
продуцентов, выбор форм препаратов, разработку технологии их применения.
В лабораторных условиях определяется активность отобранных штаммов по
отношению к углеводородам разных групп и конкретного загрязнения, определяются
оптимальные условия для проявления деструкционного потенциала микроорганизмов в
почве, получают оценочные значения расходных норм препарата и возможной
продолжительности очистки конкретного места загрязнения.
Для наработки препарата в производственных условиях разрабатывают
технологический регламент, обеспечивающий получение продукта, соответствующего
техническим условиям, сопутствующие рабочие инструкции по эксплуатации
оборудования, микробиологическому контролю и т. п., разрабатываются
рекомендации, инструкции по применению препарата.
Товарной формой препаратов могут быть сухой порошок и жидкая
концентрированная суспензия клеток.
Технология получения сухих товарных форм биопрепаратов включает следующие
стадии:
прием, хранение и подготовка сырья, органического субстрата, растворов
минеральных солей;
обеспечение ферментационного процесса источником кислорода,
технологической водой, паром, моющими и дезинфицирующими средствами,
пеногасителями;
выращивание посевного материала;
накопление биомассы в рабочем аппарате - ферментере;
концентрирование суспензии микроорганизмов сепарацией, микрофильтрацией,
адсорбцией на инертных материалах-наполнителях;
сушка;
если предусмотрено, гранулирование, компаундирование препарата с
различными наполнителями и внесение добавок;
расфасовка, упаковка, складирование, отправка готового продукта;
очистка сточных вод, газовоздушных выбросов со стадии ферментации,
сепарации и сушки.
На стадии ферментации микроорганизмы культивируют периодическим или
непрерывным способом, на питательных субстратах и при режимах, гарантирующих
получение микроорганизмов с необходимыми свойствами или активностью ферментов,
участвующих в удалении загрязнений. При использовании таких субстратов, как
углеводороды, биодоступные аналоги ксенобиотиков (например, нехлорированные
аналоги хлорсодержащих соединений) возможно культивирование в не строго
асептических условиях, что существенно упрощает требования к технологическому
обеспечению ферментационного процесса и квалификации обслуживающего персонала.
При концентрировании биомассы и сушке используются методы и
технологические режимы, обеспечивающие сохранение жизнеспособных клеток
микроорганизмов, что особенно важно при получении биопрепаратов на основе
неспоровых форм микроорганизмов. В частности, сепараторы и циркуляционные
контуры мембранных установок оснащаются рубашкой для охлаждения суспензии, что
позволяет в процессе сепарирования поддерживать температуру ниже температуры
инактивации клеток микроорганизмов, для сушки применяют распылительные,
лиофильные или вакуум-термические сушилки.
При получении иммобилизованных биопрепаратов суспензию клеток
микроорганизмов (обычно до стадии концентрирования) смешивают с носителем
(сорбентом). Носитель может быть порошкообразным, гранулированным, волокнистым,
тканым. Процедура иммобилизации может предусматривать внесение дополнительных
реагентов, флокуляцию, осаждение клеток на носителе и другие приемы, повышающие
эффективность иммобилизации. В процессе созревания, длящемся от 2-3 недель до
1,5-2 мес, биомасса микроорганизмов деструкторов нарастает на носителе,
увеличиваются титр жизнеспособных клеток, их активность и срок хранения
препарата.
Внесение различных добавок (наполнителей, осмопротекторов и других
защитных веществ, компонентов питания и т. п.) в полученную биомассу позволяет
исключить из технологической схемы стадию сушки, инактивирующую клетки
микроорганизмов, стандартизировать характеристики биопрепарата, увеличить срок
хранения, выживаемость и активность микроорганизмов, эмульгирующую,
диспергирующую, адгезионную, пенообразующую способности, уменьшить
слеживаемость.
Задачей разработки технологии применения биопрепаратов является
обеспечение необходимых условий (содержание минеральных компонентов,
дополнительных субстратов, мелиорантов, наполнителей и других добавок,
оптимальные условия влажности, температуры, рН среды, аэрации и др.) для
активного развития микроорганизмов биопрепарата в загрязненной среде,
использования их биоокислительного потенциала.
Для активации микроорганизмов биопрепаратов (восстановления сниженной
жизнеспособности клеток, индукции и повышения активности деструкционных
ферментов) перед использованием рекомендуется препараты разводить в водной
среде, содержащей питательные компоненты и, возможно, загрязняющее вещество, и
выдерживать некоторое время (от нескольких часов до суток), если требуется, при
аэрировании среды.
При высокой концентрации загрязнений может потребоваться предварительная
обработка среды другими методами. Например, при высоком содержании загрязнения
на поверхности почвы сначала механическими способами (бульдозером, лопатами)
собирается верхний слой и лишь, затем проводится обработка биопрепаратом.
Собранный грунт складируют. Возможна его дальнейшая обработка биопрепаратами на
площадках складирования.
Контроль за качеством очистки осуществляют при использовании
физико-химических, химико-аналитических и биологических (микробиологических,
фитотоксикологических) методов.
По окончании очистных работ проводят рекультивационные мероприятия и при
необходимости утилизируют и обезвреживают образовавшиеся отходы.
Биопрепараты для ликвидации загрязнений
Большое количество биопрепаратов разработано для биодеструкции нефти и
продуктов ее переработки, загрязняющих природные среды в результате утечек,
проливов, разного масштаба экологических катастроф.
Потенциальными потребителями биопрепаратов могут быть промышленные
предприятия, нефтедобывающая и нефтеперерабатывающая промышленность,
нефтеналивные и заправочные станции ГСМ, подразделения МЧС, автотранспортные
предприятия и станции технического обслуживания, предприятия по транспортировке
нефти и нефтепродуктов, морские и речные порты, фирмы, специализирующиеся на
продаже недвижимости и земельных участков, городские и муниципальные службы и
др.
Современные биопрепараты на основе нефтедеструкторов, как правило,
предназначаются для очистки не только нефтезагрязненных почв и грунтов, но и
пресных водоемов, акваторий морей, стоков промышленных предприятий, внутренних
поверхностей технологических резервуаров и танков, обезвреживания
нефтесодержащих твердых отходов, рассоления засоленных и загрязненных нефтью
почв (на основе смешанных культур галофильных бактерий и бактерий
нефтедеструкторов). Часть биопрепаратов рекомендуется для удаления таких
загрязнений, как сланцевое масло (используется для пропитки шпал), отработанные
машинные и моторные масла, смазочно-охлаждающие жидкости, не подлежащие
регенерации и вторичному использованию, пищевые масла и жиры в стоках, а также
остаточных нефтепродуктов (котельное топливо, смазочные мазуты, гудроны,
вазелины и другие нефтепродукты кубового остатка). Для расширения сферы
применения, повышения эффективности использования биопрепаратов в них добавляют
различные сорбенты, пенообразователи, эмульгаторы, минеральные и биологические
добавки (источники азота, фосфора, микроэлементы, ПАВы, лецитины,
биостимуляторы и т. д.).
Биопрепараты на основе смешанных культур и ассоциаций микроорганизмов
имеют более широкие адаптационные и экологические возможности для использования
и наряду с бактериями или грибами-гетеротрофами могут содержать микроводоросли,
цианобактерии.
Преимущество препаратов с носителем - более высокая выживаемость клеток
микроорганизмов при хранении, при контакте с повышенными концентрациями
загрязнений. Носитель служит своеобразным протектором, обеспечивающим
оптимальное микроокружение клеткам. Иммобилизация клеток на носителе позволяет
получать препараты комбинированного действия: сорбенты для поглощения и одновременно
биологической деструкции загрязнений. Некоторые носители используются с целью
повышения плавучести препарата для увеличения времени контакта
микроорганизмов-деструкторов с нефтепленкой (при очистке водных поверхностей),
адгезивной способности, диспергируемости и других технологически важных
характеристик, могут содержать питательные вещества, необходимые для
биодеструкционной активности микроорганизмов, компоненты, обеспечивающие
пролонгированное высвобождение минеральных соединений азота и фосфора с целью
сведения к минимуму возможности избыточного попадания их в водоемы и
предотвращения эвтрофикации.
Среди наиболее популярных органических материалов, используемых в
качестве носителя и сорбента, - природный торф и различные его модификации, а
также сосновая кора, модифицированный мох, древесные стружки, опилки; из
синтетических полимерных материалов - пенополиуретан, поликапроамидные волокна
и др. Среди неорганических материалов в качестве носителя используются
глинистый минерал вермикулит (природный или модифицированный), диатомовая
земля, вспученный перлит, вспученный вермикулит, вспененный графит, цеолиты,
каолин, керамика и др.
Общий недостаток биопрепаратов с сорбентами - высокий расход и, как
следствие, высокая стоимость очистки. Биопрепараты с сорбентами эффективнее
использовать при аварийных разливах загрязнения, особенно в городских условиях,
когда нужно быстро очистить загрязненный участок. Биопрепарат с сорбированным
загрязнением может быть собран и обезврежен на специальных площадках или в биореакторах.
Большинство биопрепаратов производится на основе мезофильных и
термотолерантных штаммов микроорганизмов. Однако в холодном климате России при
insitu очистке более эффективны психрофильные микроорганизмы. В то же время
микроорганизмы, имеющие низкотемпературный оптимум роста, нетехнологичны, при
низких температурах их сложно накопить в промышленных условиях. Поэтому для
условий России актуальным остается получение биопрепаратов на основе
микроорганизмов с максимально широким диапазоном толерантности к температурному
фактору, активных при невысоких плюсовых температурах (от 0 до +10 °С). Также
важно создание биопрепаратов, предназначенных для ликвидации нефтяных
загрязнений в условиях закисления (например, для ликвидации кислых гудронов),
которые были бы активны при pH 1-3.
Другая проблема обусловлена тем, что активное начало многих предлагаемых
на рынке биопрепаратов составляют спорообразующие культуры, поскольку они более
устойчивы к ряду технологических операций, в частности к высушиванию. Такие микроорганизмы
быстро переходят в неактивные («покоящиеся») формы при возникновении условий,
отличных от оптимальных, длительно находятся в неактивном состоянии, длительно
переходят в вегетативное состояние при возникновении благоприятных условий.
Переход в активное состояние требует оптимальных параметров, которых часто в
природных условиях достигнуть сложно. Это ведет к увеличению расхода
биопрепаратов и стоимости очистки.
Кроме биопрепаратов, предназначенных для очистки сред от нефти, начинают
находить все большее применение и биопрепараты для очистки от других
загрязнений, таких как фенолы, другие классы ароматических и гетероциклических
соединений, хлорорганических соединений, пестицидов.
Для извлечения радионуклидов и тяжелых металлов могут быть использованы
биосорбенты, получаемые из микробной биомассы и отходов микробиологического
производства, в частности из биомассы мицелиальных грибов.
Микробные системы конструируют таким образом, чтобы они обладали
наибольшим разнообразием путей метаболизма участвующих в деструкции
ксенобиотиков, синтезировали вещества, например, биосурфактанты, способствующие
биодоступности загрязнений, могли бы активно функционировать в различных
физико-химических условиях окружающей среды, были безопасны для человека, легко
элиминировались из природной среды после удаления контаминантов.
Использование генетически модифицированных микроорганизмов в настоящее
время в большинстве стран разрешено лишь для проведения полевых экспериментов.
Биопрепараты для рекультивации территорий и восстановления плодородия
почв
Рекультивация - комплекс мероприятий, направленных на восстановление
плодородия и практической ценности нарушенных земель, почвенного покрова,
естественного экологического равновесия ранее загрязненных или выведенных из
хозяйственного использования территорий.
Почвы могут не содержать опасных концентраций загрязнений, но их
механическая структура может быть нарушена, изменены физико-химические
свойства, снижены содержание биогенных элементов и активность биоты, ухудшено
фитосанитарное состояние почв и посевов растений, т. е. в целом нарушено
плодородие почвы. Биопрепараты, предназначенные для рекультивации, активизируют
почвенные процессы, направленные на восстановление ее плодородия.
2. Материалы и методы исследования
Работа выполнена на базе кафедры иммунологии и биотехнологии ФГБОУ ВО
МГАВМиБ - МВА имени К. И. Скрябина, а также на базе ООО «Синбионт» г. Киров,
ФГУП «ВНИИПРХ».
2.1. Микроорганизмы
Штаммы были получены из коллекции штаммов Всероссийской Коллекции
Промышленных Микроорганизмов (ВКПМ) ФГУП ГосНИИ Генетика.
2.1.1 Штамм - Acinetobactercalcoaceticus 134
Регистрационный номер в коллекции: ВКПМ В-3780.
Происхождение штамма: сточные воды производства фенолформальдегидных
смол.
Культурально-морфологические признаки штамма: грамотрицательные палочки,
спор не образуют, аэробы.
Область промышленного применения штамма: деструкция метанола, фенола и
формальдегида.
Условия культивирования штамма (состав среды, температура и т. д.): МПА;
среда L: (г/л): дрожжевой экстракт-5,0; пептон-15,0; NaCl-5,0; агар-15,0; вода
дист-1,0 л., t-25-28°C.
Сведения о безопасности использования штамма:
Штамм ВКПМ В-3780 Acinetobactercalcoaceticus 134 не является генетически
модифицированным штаммом.
Штамм ВКПМ В-3780 Acinetobactercalcoaceticus 134 не относится к
микроорганизмам, патогенным для человека согласно классификации
микроорганизмов, приведенной в Санитарных правилах СП 1.3.2322-08. Работа со
штаммом ВКПМ В-3780 Acinetobactercalcoaceticus 134 не требует специальных мер
предосторожности.
2.1.2 Штамм - Methylobacterium sp. IK
Регистрационный номер в коллекции: ВКПМ В-5603
Происхождение штамма: почва, выделен в 1987 году из ассоциации м/о,
утилизирующих метанол методом накопительных культур с использованием метанола в
качестве единственного источника С.
Условия культивирования штамма (состав среды, температура и т. д.):
(г/л): КН2РО4 - 3,0, NH4NO3 - 1,0, MgCl2 - 0,1, *метанол - 5,0 мл, агар - 15,0,
вода дист. - 1,0л рН=7,6, *Метанол добавить после стерилизации, t -30°.
Инкубация 2-4 суток.
Культурально-морфологические признаки штамма: грамотрицательные палочки,
подвижные.
Область промышленного применения штамма: деструкция метанола.
Сведения о безопасности использования штамма:
Штамм ВКПМ В-5603 Methylobacterium sp. 1К не является генетически модифицированным
штаммом.
Штамм Methylobacterium sp. 1К не относится к микроорганизмам, патогенным
для человека согласно классификации микроорганизмов, приведенной в Санитарных
правилах СП 1.3.2322-08. Работа со штаммом не требует специальных мер предосторожности.
2.1.3 Штамм: Bacillusmegaterium
Регистрационный номер в коллекции: ВКПМ В-607.
Происхождение штамма: ВКМ В-396.
Культурально-морфологические признаки штамма: клетки крупные
палочки с закругленными концами, расположенные одиночно, парами, цепочками.
Колонии серовато-белого цвета, матовые.
Условия культивирования штамма (состав среды, температура и т. д.):
L-среда (г/л): дрожжевой экстракт - 5,0, пептон - 15,0, NaCl - 5,0, агар -
15,0, вода диет. - 1,0л, 300 С.
Сведения о безопасности использования штамма:
Штамм Bacillusmegatenum ВКПМ В-607 не является генетически
модифицированным штаммом.
Штамм Bacillusmegaterium ВКПМ-607 относится к микроорганизмам,
непатогенным для человека, согласно классификации микроорганизмов, приведенных
в Санитарных правилах СП 1.3.2322-08. Работа со штаммом Bacillusmegaterium ВКПМ
В-607 не требует специальных мер предосторожности.
2.2. Плотные питательные среды
Пропись 1
Плотная питательная среда Ворошиловой - Диановой с добавлением метанола.
Состав среды (г/л):
Калий фосфорнокислый однозамещенный (KH2PO4) - 1,2;
Калий фосфорнокислый двузамещенный (K2HPO4) - 3,8;
Аммоний сернокислый ((NH4)2SO4) - 1,0;
Магний сернокислый (MgSO4) - 2,0;
Хлористый кальций (CaCl26H2O) - 0,01;
Сернокислое железо (Fe2(SO4)37H2O) - 0,0013;
Агар микробиологический - 20;
рН - 7,2-7,4 ед. рН.
Все компоненты среды помещали в стеклянную колбу, доводили
дистиллированной водой до нужного объема, тщательно перемешивали и
автоклавировали при (121,0±1,0)°С в течение 15 минут. Затем среду охлаждали до
комнатной температуры и вносили метанол в необходимых концентрациях,
перемешивали и стерильно разливали в чашки Петри. Чашки хранили при комнатной
температуре, не переворачивая.
Пропись 2
Плотная питательная среда FT-агар.
Состав основы (г/л):
Сернокислотный гидролизат рыбной муки -17,0;
Стимулятор роста гемофильных микроорганизмов - 5,0;
Экстракт пекарских дрожжей - 2,3;
Магний сернокислый (MgSO47H2O) - 0,5;
Натрий сернокислый (Na2SO4) - 0,7;
Цистеин гидрохлорид - 0,5;
Агар микробиологический - 15,0;
рН - 7,0±0,2 ед. рН.
Способ приготовления:
г основных компонентов среды размешивается в 970 мл дистиллированной воды
и автоклавируется при (121±1)°С в течение 15 минут. Полученную основу среды
охлаждают до температуры 45...50°С и вносят в нее 20 см3 на 1 дм3 глюкозо-витаминной
добавки, перемешивают и разливают в чашки, пробирки или матрацы.
2.3. Приготовление рабочей культуры
Ампулы с культурами штаммов метанолутилизирующих микроорганизмов
тщательно протирают стерильным ватным тампоном, смоченным 70 %-ным этиловым спиртом.
После этого ампулы вскрывают над пламенем спиртовки и вводят стерильный
физиологический раствор до исходного объема культуры до сушки. Полученную
суспензию высевают по 0,1 мл на скошенную плотную питательную среду и по 0,2 мл
на жидкую питательную среду в колбах и выращивают при температуре 28-30°С в
течение 48-96 часов.
Культуры, выросшие на скошенной в пробирках плотной питательной среде,
используются для выращивания биомассы культур метанолутилизаторов на скошенной
плотной питательной среде в матрацах.
Для выращивания культур штаммов метанолутилизаторов на скошенной плотной
питательной среде в матрацах используются микробные суспензии, смытые с
поверхности плотной питательной среды 10,0 см физиологического раствора.
В каждый матрац вносят по 10,0 см посевного материала, который равномерно
распределяют по поверхности плотной питательной среды, скошенной в матраце.
Инкубирование осуществляют 48-96 часов при температуре 28-30 °С.
Процесс приготовления микробной взвеси в защитной среде включает смыв микробной
культуры с поверхности плотной питательной среды в матрацах защитной средой и
розлив полученных рабочих культур во флаконы емкостью 10,0 см.
С этой целью в каждый матрац вносят по 20-25 дм3 защитной среды и по
15-20 штук стеклянных или фарфоровых бус. Культуру с матрацев смывают их
покачиванием в горизонтальном положении, не допуская при этом смачивания
ватно-марлевых пробок. Полученную суспензию переносят в колбу после проверки
наличия посторонней микрофлоры и заключения о ее отсутствии по данным микроскопии.
Приготовленную в колбе рабочую культуру разливают по 5,0 см во флаконы
емкостью 10,0 см, которые пробкуют, замораживают и хранят в течение одного года
при температуре минус 18-22 °С.
2.4. Материалы, растворы, реактивы
Биопрепарата БИОМ-М, серия 180516, дата производства 18.05.2016, срок
годности 18.05.2018.
Глауконит поступал из Каринского месторождения Челябинской области.
Использовали сырье, реактивы и материалы, прошедшие входной контроль и
отвечающие требованиям действующих нормативных документов.
2.5. Технологическое оборудование
Культивирование штаммов проводили во флаконах (объемом 0,1 дм3) на
качалках NewBrunswick (США, модель G-53), в ферментерах марки «БИОР-0,25».
Оптическую плотность нативных культур определяли с помощью колориметра
фотоэлектрического концентрационного КФК-2МП, а рН - иономером типа ЭВ-74.
Просеивание глауконита осуществляли на вибросите ВС-100, с диаметром
отверстий сетки 1 мм.
Прокаливание глауконита осуществляли в сухожаровом шкафу ШСС-250, при
температуре 200±15°С.
Для иммобилизации смеси культур на природном ионообменнике - глауконите
применяли установку гранулирования и сушки типа 524Р-АК.
Смешение с аэросилом для получения сухой порошковой формы БИОМ-М
проводили в барабанном смесителе с 1-2 кг стальных шаров диаметром от 6 до14
мм.
Порошок рассыпали по 1000±10 мг в двойные пакетики из ламинированной
бумаги на автомате типа АР - И 3.
2.6. Методы исследований
РН сред и растворов определяли потенциометрическим методом.
Общую концентрацию микроорганизмов (ОК) определяли методом
последовательных десятикратных разведений испытуемого микробного материала в
0,85%-ном растворе хлористого натрия с последующим подсчетом бацилл в камере
Горяева.
Концентрацию живых микроорганизмов (БК) определяли методом
последовательных десятикратных разведений испытуемого микробного материала в
0,85%-ном растворе хлористого натрия с последующим его высевом на МПА в чашки
Петри. После (24+4) ч инкубации при температуре (37+1)0С проводили подсчет
выросших колоний. Учету подлежали чашки, на которых выросло от 150 до 300
колоний. БК в сухой культуре определяли после их регидратации.
Биологическую концентрацию термоустойчивых клеток (БКt) определяли
методом последовательных десятикратных разведений испытуемой микробной
суспензии в 0,85 %-ном растворе хлористого натрия с последующим нагреванием до
(94,0+0,5)0С в течение (13+1) минут и высевом микробной суспензии на МПА. После
(24+4) ч инкубации при температуре (37+1)0С проводили подсчет выросших колоний.
Влажность препарата «БИОМ-М» определяли по разности массы проб до и после
высушивания при температуре (105±2)°С.
Величину относительной гигроскопичности порошка определяли по формуле:
 (1)
(1)
где
К - относительная гигроскопичностъ, ед;- влагосодержание в исследуемом
материале при соответствующей влажности воздуха, кг/кг (по абсолютно сухому
веществу);э - влагосодержание эталона при соответствующей влажности воздуха,
кг/кг.
За
эталон была принята фильтровальная бумага, удельная влагоемкость которой
считается величиной постоянной во всем диапазоне относительной влажности
окружающей среды и равной 0,01 Umax (Umax ~ максимальное сорбционное
влагосодержание эталона при температуре 25°С).
Коэффициент
неоднородности смеси массы рассчитывали по формуле:
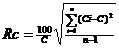 (2)
(2)
где
Rc - коэффициент неоднородности смеси, %;- истинная концентрация одного из
компонентов, %;
С
- средняя концентрация того же компонента, %;число проб;
∑
- сумма.
Для
определения сыпучести порошков пробу весом (50+0,5) г засыпали в воронку. С
открытием конуса и началом высыпания порошка регистрировали время истечения
всей навески. Расчет проводили по формуле:
 (3)
(3)
где
V - сыпучесть порошка, г/мин;- навеска порошка, г;
τS - время истечения всей навески порошка через воронку, мин.
Определение
адсорбционной активности по ГОСТ 4453-74.
Для
определения сроков годности и условий хранения «БИОМ-М» использовали метод
«ускоренного старения» в соответствии с «Временной инструкцией по проведению
работ с целью определения сроков годности лекарственных средств на основе
метода «ускоренного старения» при повышенной температуре. И-42-2-82.
Министерство здравоохранения СССР. Министерство медицинской промышленности.
1983 г.» и «Методами контроля бактериологических питательных сред. Методические
указания. Мук 4.2.2316-08 (утв. Роспотребнадзором 18.01.2008)».
Отбор
проб производился в соответствии с инструкцией. Почва: точечные пробы отбирали
в квадратах 1х1 м, расположенных по периметру и в центре площадки, с помощью
пробоотборника. Глубина отбора, 0-20 см. Вода: точечные пробы отбирали из озера
на различной глубине, из полученного количества составляли усреднённую пробу
объёмом 1,5 л.
Контроль
метанолутилизирующей активности.
ПДК
для метанола в почве не разработана, поэтому должен проводиться пересчет данных
по водной вытяжке из почвы (в мг/кг почвы) на содержание в почвенном растворе (в
мг/л раствора). Содержание метанола в почвенном растворе (мг/л) рекомендуется
сравнивать с санитарной нормой для водоемов (ПНДФ 14.1:2.102-97, РД
52.24.423-2006).
Для
извлечения метанола из почвы рекомендуется метод экстракции его
дистиллированной водой при соотношении почвы к воде 1:3. Пробы отбирают в банку
с притертой пробкой (возможно использование плотно завязанных полиэтиленовых
пакетов) и анализируют в тот же день. Хранение образцов почвы допускается при
температуре не выше 2-3°С в течение 1-2 суток. Перед анализом почву растирают в
фарфоровой ступке и просеивают через сито 1-2 мм. Все операции с почвой
(растирание, просеивание и взятие навески) проводят в вытяжном шкафу.
Полученные
в экспериментах результаты подвергали статистической обработке на компьютере с
использованием стандартного пакета программ "Statistica" по
общеизвестным методам вариационной статистики с оценкой статистической
значимости показателей и различий рассматриваемых выборок по t-критерию
Стьюдента. Различия в сравниваемых группах считались достоверными при уровне
значимости 95% (p<0,05).
3. Результаты
3.1. Выбор штаммов микроорганизмов
Штаммы микроорганизмов биопрепарата выбирали из коллекции ВКПМ обладающих
метанолдеструктирующими свойствами и микроорганизмы, способствующие восстановлению
ризосферы, находящиеся в открытом доступе:
. Номер штамма - B2664. Род штамма - Corynebacterium. Вид штамма -
sp. Родословная штамма и способ его
получения - почва, загрязненная метанолом, ЩПО "Азот".
Оптимальная температура роста - 40°С.
Применение штамма - утилизация метанола.
Среда для переноса штамма (номер) - 113.
Параметры среды: NH4H2PO4 - 2,0; (NH4)2 HPO4 - 0,5; K2SO4 - 0,2;
MgSO4x7H2O - 0,2; агар - 20,0; раствор микроэлементов - 0,5мл; вода дист. - 1,0
л; рН=6,8-7,0э
Раствор микроэлементов (г/л): KI - 0,02; H3BO3 - 0,02; MnSO4x5H2O - 0,02;
(NH4)6Mo7O24x4H2O - 0,02; FeSO4x7H2O - 0,1; вода дист. - 1,0 л.
Метанол в концентрации 0,5-1% добавляют после стерилизации.
Штамм ВКПМ B-2664 Corynebacterium sp. не является генетически
модифицированным штаммом. Штамм Corynebacterium sp. не относится к
микроорганизмам, патогенным для человека согласно классификации
микроорганизмов, приведенной в Санитарных правилах СП 1.3.2322-08. Работа со
штаммом не требует специальных мер предосторожности.
. Номер штамма - В5603. Род штамма - Methylobacterium. Вид штамма - sp. Название (имя) штамма - 1K.
Родословная штамма и способ его получения - почва, выделен в 1987 году из
ассоциации микроорганизмов, утилизирующих метанол методом накопительных культур
с использованием метанола в качестве единственного источника C.
Оптимальная температура роста - 30°С.
Применение штамма - деструкция метанола; очистка сточных вод; категория
С.
Среда для переноса штамма (номер) - 234.
Параметры среды: KH2PO4 - 3,0; K2HPO4 - 7,0; NH4NO3 - 1,0; MgCl2 - 0,1;
метанол - 5,0 мл; агаp - 15,0; вода дист. - 1,0 л; pH=7,6. Метанол добавить
после стерилизации.
Условия культивирования штамма (состав среды, температура и т. д.):
(г/л): КН2РО4- 3,0, NH4NO3 - 1,0, MgCl2 - 0,1, *метанол - 5,0 мл, агар - 15,0,
вода дист. - 1,0 л; рН=7,6 *Метанол добавить после стерилизации, t -30°С.
Инкубация 2-4 суток.
Штамм ВКПМ В-5603 Methylobacterium sp. 1К не является генетически
модифицированным штаммом. Штамм Methylobacterium sp. 1К не относится к
микроорганизмам, патогенным для человека согласно классификации
микроорганизмов, приведенной в Санитарных правилах СП 1.3.2322-08. Работа со
штаммом не требует специальных мер предосторожности.
. Номер штамма - В3780.
Род штамма - Acinetobacter. Вид штамма - calcoaceticus. Название (имя)
штамма - 134. Имена-синонимы штамма (номера в других коллекциях) - (Pseudomonas
sp.). Родословная штамма и способ его получения: сточные воды производства
фенолформальдегидных смол.
Оптимальная температура роста - 25 - 28°С.
Применение штамма - деструкция метанола; деструкция формальдегида;
деструкция фенола; очистка сточных вод.
Среда для переноса штамма (номер) - 1.
Параметры среды: мясная вода - 1,0л; NaCl - 5,0; пептон - 10,0; агар
(если нужно) - 20,0; рН= 6,8-7,0.
Стерилизовать при 1 атм. 30 минут.
Мясная вода: 500 г обезжиренного фарша залить 1л водопроводной воды,
проэкстрагировать при 37-39°С в течение 2 часов, отжать через марлю, затем прокипятить 30 минут,
отфильтровать через вату и довести объем до 1 л.
Условия культивирования штамма (состав среды, температура и т. д.): МПА;
среда L:(г/л): дрож. экстракт - 5,0; пептон - 15,0; NaCl - 5,0; агар - 15,0;
вода дист. - 1,0 л., t-25-28°C.
Штамм ВКПМ В-3780 Acinetobactercalcoaceticus 134 не является генетически
модифицированным штаммом. Штамм ВКПМ В-3780 Acinetobactercalcoaceticus 134 не
относится к микроорганизмам, патогенным для человека согласно классификации
микроорганизмов, приведенной в Санитарных правилах СП 1.3.2322-08. Работа со
штаммом ВКПМ В-3780 Acinetobactercalcoaceticus 134 не требует специальных мер
предосторожности.
. Номер штамма - В5150. Род штамма - Pseudomonas. Вид штамма - putida.
Автор(ы) вида или подвида - (Trevisan 1889) Migula 1895. Название (имя) штамма
BS-2. Родословная штамма и способ его получения - почва около предприятия
газовой промышленности, выделен в 1987г. из ассоциации м/о, утилизирующих
диэтиленгликоль методом накопительных культур.
Оптимальная температура роста - 20 - 25°С.
Применение штамма - деструкция диэтиленгликоля; очистка сточных вод.
Среда для переноса штамма (номер) - 1.
Параметры среды: мясная вода - 1,0л; NaCl - 5,0; пептон - 10,0; агар
(если нужно) - 20,0; рН= 6,8-7,0.
Стерилизовать при 1 атм. 30 минут.
Мясная вода: 500 г обезжиренного фарша залить 1л водопроводной воды,
проэкстрагировать при 37-39°С в течение 2 часов, отжать через марлю, затем прокипятить 30 минут,
отфильтровать через вату и довести объем до 1 л.
Условия культивирования штамма - МПА (МПБ), температура культивирования -
20-25°С. Не растет при температуре 37°С. Инкубация 2-4 суток.
Штамм ВКПМ В-5150 Pseudomonasputida BS-2 не является генетически
модифицированным штаммом. Штамм ВКПМ В-5150 Pseudomonasputida BS-2 не относится
к микроорганизмам, патогенным для человека согласно классификации
микроорганизмов, приведенной в Санитарных правилах СП 1.3.2322-08. Работа со
штаммом не требует специальных мер предосторожности.
. Номер штамма - Y1246. Род штамма - Candida. Вид штамма - methylica.
Автор(ы) вида или подвида - Trotsenkoetal., 1974. Имена-синонимы штамма (номера
в других коллекциях) - BKM Y-2356.
Оптимальная температура роста - 28°С.
Применение штамма - способность утилизировать метанол.
Среда для переноса штамма (номер) - 140.
Параметры среды: глюкоза - 20,0; пептон - 10,0; дрож. экстракт - 5,0;
агар - 20,0; вода дист. - 1,0 л
Условия культивирования штамма: полная дрожжевая среда (г/л): глюкоза -
20; дрожжевой экстракт - 5; пептон - 10; t = 28°С.
Штамм Candidaboidinii ВКПМ Y-1246 относится к микроорганизмам 4 группы
патогенности согласно классификации микроорганизмов, приведенной в Санитарных
правилах СП 1.3.2322-08. Работа со штаммом ВКПМ Y-1246 требует специальных мер
предосторожности, соответствующих уровню работы с патогенными микроорганизмами
3-4 групп патогенности.
. Номер штамма - В607. Род штамма Bacillus. Вид штамма - megaterium.
Автор(ы) вида или подвида - deBary 1884. Имена-синонимы штамма (номера в других
коллекциях) - BKM-396, ИHMИA 909. Родословная штамма и способ его получения -
серозем, Таджикистан.
Оптимальная температура роста - 30°С.
Применение штамма - категория С.
Среда для переноса штамма (номер) - 1.
Параметры среды: мясная вода - 1,0л; NaCl - 5,0; пептон - 10,0; агар
(если нужно) - 20,0; рН= 6,8-7,0.
Стерилизовать при 1 атм. 30 минут.
Мясная вода: 500 г обезжиренного фарша залить 1л водопроводной воды,
проэкстрагировать при 37-39°С в течение 2 часов, отжать через марлю, затем прокипятить 30 минут,
отфильтровать через вату и довести объем до 1 л.
Условия культивирования штамма (состав среды, температура и т. д.):
L-среда (г/л): дрож. экстракт - 5,0, пептон - 15,0, NaCl - 5,0, агар - 15,0,
вода дист. - 1,0л, 30°С.
Штамм Bacillusmegaterium ВКПМ В-607 не является генетически
модифицированным штаммом. Штамм Bacillusmegaterium ВКПМ-607 относится к
микроорганизмам, непатогенным для человека, согласно классификации
микроорганизмов, приведенных в Санитарных правилах СП 1.3.2322-08. Работа со
штаммом Bacillusmegaterium ВКПМ В-607 не требует специальных мер.
Штамм Bacillusmegaterium ВКМ В-396 (RU 2147181, 2000) входит в состав
биопрепарата «Альбит» повышающего урожай растений и защищающего их от болезней.
Штамм синтезирует комплекс рост стимулирующих соединений: естественный
биополимер поли-бета-гидроксимасляная кислота.
Штамм ВКПМ B-2664 Corynebacterium sp. оказался не жизнеспособным. Штамм
Candidaboidinii ВКПМ Y-1246 относится к микроорганизмам 4 группы патогенности,
что определило невозможность его использования в биопрепарате. Штамм ВКПМ
В-5150 Pseudomonasputida обладает выраженными свойствами деструкции
ароматических углеводородов и не является метанолодеструктором.
Учитывая, что метанол, как источник углерода и энергии, используется
бактериями, объединенными в группу метилотрофов, выбор штаммов, обладающих
метанолутилизирующей способностью, проводился на основе аналитического анализа
микроорганизмов, обладающих этим свойством и находящихся на хранении в ВКПМ. В
результате были отобраны и приобретены следующие штаммы:
Acinetobactercalcoaceticus, ВКПМ В-3780,
Methylobacterium sp, ВКПМ В-5603.
В качестве почвенного микроорганизма был выбран и приобретен штамм
Bacillusmegaterium, ВКПМ В-607.
Наиболее эффективным и экономически выгодным является препарат с
клеточным титром 109 колониеобразующих единиц (КОЕ) в 1 г препарата, получивший
условное наименование «БИОМ-М».
Увеличение концентрации клеток более 1010 мкл/г не приведет к
значительному увеличению скорости деструкции загрязнителя, однако неоправданно
увеличит стоимость работ по очистке, так как увеличение скорости биодеструкции
будет незначительным по сравнению с увеличением стоимости препарата. При концентрации
клеток микроорганизмов менее 107 KOE/г в биопрепарате, технический результат
достигнуть не удастся, вследствие снижения требуемой скорости биодеструкции
загрязнителя.
3.2. Выбор компонентов препарата
Выбор компонентов биопрепарата основывался в первую очередь на выборе
эффективного сорбента для иммобилизации микроорганизмов биопрепарата, сорбента
для использования при контактно-сорбционном обезвоживании биопрепарата, с целью
отказаться от высокого затратного способа лиофилизации, ионообменника способствующего
восстановлению ризосферы обрабатываемых участков, удобрения для роста
растительности на обрабатываемых участках почвы и как следствие более
длительного действия микроорганизмов биопрепарата и безопасного для флоры и
фауны.
Все этим требованиям в полной мере отвечает природный алюмосиликат,
ионообменник - глауконит.
По решению Международного номенклатурного комитета глауконитом следует
называть железистую диоктаэдрическую слюду, неразбухающую, с (Al, Fe3+) IV>
0.2, (Fe3+, Al) IV1.2, Fe3+ ≥ Al.
Отличительной особенностью глауконита от остальных цеолитов в первую
очередь является то, что он обладает слоистым строением, благодаря чему площадь
активной поверхности значительно увеличивается и самое главное глауконит
содержит обширный набор микроэлементов, которыми он может обмениваться по
ионообменному принципу, и плюс он содержит в значительном количестве K,
являющийся незаменимым удобрением для большинства растений. Еще одно
преимущество глауконита, то, что он увеличивает диффузию кислорода и влаги в почве,
что обеспечивает оптимальный водный, газо-воздушный и тепловой режим для роста
численности микроорганизмов, как иммобилизованных на нем, так и содержащихся в
почве. При этом усиливается активность метаболитных ферментов и значительно
увеличивается энергия всех биохимических процессов.
Выявлено стимулирующее действие глауконита на развитие полезной
микрофлоры почв, определяющих их плодородие. Предпосылкой этому, прежде всего,
является высокое содержание в глауконитах оксида калия (от 5,0 до 9,5%), способность
его быстро разрушаться в почве с высвобождением калия в виде легко усвояемых
соединений. Важным обстоятельством является то, что в глауконитах нередко в
значительных количествах присутствуют микроэлементы (Mn, Cu, Co, Ni, B и др.),
а многие залежи глауконитовых пород содержат высокую примесь P2O5 и даже
включают горизонты фосфоритов. Все это дает основание рассматривать глаукониты
как природное минеральное удобрение, позволяющее не только обогащать почву
калием, но и улучшать ее структуру, сохранять влагу, стимулировать рост и
снижать заболеваемость растений.
Глаукониты обладают высокими адсорбционными и катионообменными свойствами
и могут использоваться в качестве адсорбента тяжелых металлов, нефтешламов,
загрязняющих водные объекты и почву, а также для ликвидации загрязнений,
находящихся в осадках очистных сооружений и промышленных стоков, в грунтах и
водных объектах, с помощью площадного внесения и создания геохимических
барьеров. Глауконит применяется при реабилитации территорий, пораженных радионуклидами
или имеющих высокую техногенную нагрузку в результате деятельности промышленных
предприятий.
Высокая поглотительная способность глауконита может быть использована для
решения задач инженерной геоэкологии по защите окружающей среды от воздействия
различных экотоксикантов, способных интенсивно мигрировать в гидро- и геосфере
и тем самым нарушать нормальный ход биохимических процессов.
С помощью глауконита из загрязненных вод практически полностью удаляются
соединения аммиака, нейтрализуются соединения кальция и железа. Сорбционные
свойства глауконита позволяют осуществить комплексную очистку вод до требований
СанПин 2.1.4.1074-01. При этом глауконит не только детоксицирует, но и
регулирует кислотность и жесткость любой воды.
В животноводстве и птицеводстве глауконит используется как кормовая
добавка (до 30%) и основа конструирования БАД к пище с энтеросорбционными и
ионообменными свойствами. Он улучшает обменные процессы, повышает переваримость
и усвояемость корма, снижает концентрацию аммиака, микотоксинов и других
токсичных компонентов, образующихся в организме при пищеварении и
жизнедеятельности, а также поступающих с кормом тяжелых металлов, радионуклидов
и других токсикантов, в том числе биологического происхождения; регулирует
соотношение кальция и натрия и улучшает снабжение организма железом. Так как он
в итоге представляет собой минеральное удобрение, то после применения
биопрепарата отпадает необходимость его утилизации.
Глауконит относится к IV группе классификации химических соединений (ГОСТ
12.1.00.76), не обладает кумулятивным, аллергизирующим действием, не оказывает
раздражающего действия на кожу и слизистые оболочки. Биологическая проба,
проведенная на белых крысах, показала, что скармливание животным кормов,
содержащих 4% глауконита, способствует увеличению массы тела крыс.
В качестве глауконит содержащего носителя может использоваться как чистый
глауконит, так и глауконитовую породу, содержащую от 60 до 80% глауконита.
Уникальность свойств глауконита определило его использование как компонента
биопрепарата.
3.3. Конструирование биопрепарата
На основании проведенного аналитического анализа данных литературы была
предложена экспериментальная лабораторная пропись метанолутилизирующего
препарата «БИОМ-М», состоящая из масс. %: алюмосиликата осадочного
происхождения (глауконита) - 89%; аэросила - 1%; биокомпонента, содержащего
культуры штаммов метанолутилизаторов - 10%.
Микроорганизмы биопрепарата Bacillusmegaterium ВКПМ B-607;
Methylobacterium sp. ВКПМ B-5603; Acinetobactercalcoaceticus ВКПМ B-3780
выращиваются раздельно в биореакторе до содержания 1011-1012 мкл/мл, известными
способом и, затем готовят микробную ассоциацию смешиванием в реакторе при 25°С определенного соотношения
культуральных жидкостей, до содержания 1012 мкл/мл, полученную микробную
ассоциацию захолаживают в реакторе при температуре 14-16°С.
Выращивание культур проводили в цехе культивирования ООО «СИНБИОНТ» г.
Киров.
Раздельное культивирование позволяет широко варьировать при
конструировании биопрепаратов в отличие от совместного выращивания.
Глауконит препарата измельчается на шаровой мельнице до 50% содержания
частиц размером 500-600 мкм, просеивается через сита №600 и досушивается до
остаточной влажности 4% при температуре 190°С в сушильных шкафах. Приготовление биопрепарата
осуществляется методом контактно сорбционного обезвоживания на глауконите
смешивание ассоциации с глауконитом осуществляется, в специализированном
смесителе обеспечивающим смешиванием в одном объеме расчетных долей
культуральных жидкостей с глауконитом до содержания 109 мкл/мл. Процесс в
смесителе осуществляется напылением расчетного количества (10 л) микробного
аэрозоля ассоциации микроорганизмов на фонтанирующий слой глауконита (50 кг)
при температуре теплоносителя - воздуха (стерильного) 40°С и скорости 10 м/с. Иммобилизация
завершается при достижении влажности в конечном биопрепарате 4% и содержании
живых бактериальных клеток 109 мкл/г.
Наиболее экономически оправдано проводить процесс при содержании
глауконита в носителе не менее 60%.
Следующим этапом конструирования биопрепарата стало установление
диапазона метилутилизирующей способности штаммов микроорганизмов, полученных из
ВКПМ, уточнение прописи биокомпонента с учетом совместимости микробных культур,
их биологической концентрации и внесения дополнительных ингредиентов для
улучшения эксплуатационных свойств конечного препарата.
Оценку метанолутилизирующей способности при выращивании на плотной
питательной среде проводят на основании способности к формированию колоний при
аналогичных условиях выращивания.
Результаты теоретических и экспериментальных исследований свидетельствуют
о том, что отобранные штаммы метилотрофных микроорганизмов
Acinetobactercalcoaceticus ВКПМ В-3780 и Methylobacterium sp. ВКПМ В-5603
обладают способностью к росту при культивировании на плотной питательной среде
при добавлении в качестве источника углерода 2% метанола.
С учетом полученных результатов исследований на следующем этапе
экспериментальных работ было проведено определение минимально подавляющей
концентрации метанола, блокирующей полное развитие микробных культур на плотной
(пропись 1) питательной среде, в которую после приготовления вносился метанол в
концентрации 20, 40, 60, 80, 100, 120 см3/дм3. Концентрация вносимых микробных
клеток в реакционную смесь соответствовала аналогичному показателю для
экспериментального образца биопрепарата, а также рекомендациям для оценки
ингибирующего действия антибиотиков, химиопрепаратов, дезинфектантовinvitro и
составляла 1,3х10^8 живых микробов.
Результаты проведенных исследований представлены в таблице 1.
Таблица 1. Результаты оценки устойчивости изучаемых штаммов
микроорганизмов к метанолу в плотной питательной среде
|
Используемая культура
|
Наличие роста исследуемой культуры при содержании метанола,
см3/дм3
|
Величина мпк, см3/дм3
|
|
20
|
40
|
60
|
80
|
100
|
120
|
|
|
Acinetobacter Calcoaceticus
|
+
|
+
|
+
|
+
|
-
|
-
|
100
|
|
Methylobacterium sp.
|
+
|
+
|
+
|
+
|
+
|
-
|
120
|
|
Bacillus megaterium
|
+
|
-
|
-
|
-
|
-
|
-
|
40
|
+ Наличие роста изучаемых микроорганизмов
Отсутствие роста изучаемых микроорганизмов
Наличие жизнеспособности изучаемых микробных штаммов определяли на
основании контрольного высева из опытных проб на плотную питательную среду
(пропись 2). Заключение о величине минимально подавляющей концентрации при
выращивании на плотной питательной среде, содержащей метанол, делали на
основании отсутствия роста колоний.
Полученные результаты исследований показали, что величина минимально
подавляющей концентрации метанола составляет для штаммов метилотрофов:
Acinetobactercalcoaceticus - 100 см3/дм3;sp. - 120 см3/дм3.
Для культуры Bacillusmegaterium аналогичный показатель соответствовал
показателю 40 см3/дм3.
В то же время изучение морфологии микробных клеток в мазках, окрашенных
по Грамму, свидетельствовало о том, что при содержании метанола в концентрации
20 см3/дм3 происходит переход изучаемых микроорганизмов из бациллярной формы в
споровую.
Оценка совместимости микробных культур, входящих в состав предлагаемого
биопрепарата, не выявила взаимного ингибирующего действия отобранных штаммов.
На последующем этапе экспериментальных исследований была проведена оценка
метанолутилизирующей способности двух вариантов биопрепарата, состоящих из:,
Methylobacterium sp. - первый вариант и аналогичный, но с включением
Bacillusmegaterium - второй вариант.
При приготовлении первого варианта биопрепарата соотношение культур
составляло с учетом исходной концентрации микробов 1х10^9 КОЕ/см3:- 50%;sp. -
50%.
Второй вариант содержал:- 30%;sp. - 60%;- 10%
и соответствовал композиции экспериментального образца, в котором
концентрация микробов каждого штамма составляла 1х109 КОЕ/см3.
Заключение о величине ингибирующей дозы делали на основании контрольного
высева из реакционной среды на чашки с плотной питательной средой (пропись 2),
обеспечивающий формирование колоний исследуемых микроорганизмов на ее
поверхности при наличии жизнеспособных клеток. Аналогичный метод использовался
при определении минимально подавляющей концентрации метанола при ингибировании
изучаемых биокомпонентов на чашках с плотной питательной средой (пропись 1).
Концентрация вносимых микробных клеток в реакционную смесь
соответствовала аналогичному показателю для экспериментального образца
биопрепарата, а также рекомендациям для оценки антибактериального действия
антибактериальных препаратов и дезинфектантовinvitro.
Результаты проведенных исследований представлены в таблице 2.
Таблица 2. Результаты оценки устойчивости изучаемых композиций
метанолутилизаторов к метанолу в плотной питательной среде
|
Используемая культура
|
Наличие роста исследуемой культуры при содержании метанола,
см3/дм3
|
Величина мпк, см3/дм3
|
|
20
|
40
|
60
|
80
|
100
|
120
|
|
|
Acinetobactercalcoaceticus+
Methylobacterium sp.
|
+
|
+
|
+
|
+
|
+
|
-
|
100
|
|
Acinetobactercalcoaceticus+
Methylobacterium sp. + Bacillus megaterium
|
+
|
+
|
+
|
+
|
+
|
-
|
40
|
+ Наличие роста изучаемых микроорганизмов
Отсутствие роста изучаемых микроорганизмов
При пересеве и выращивании на плотной универсальной накопительной
питательной среде определялось формирование колоний всех штаммов, входящих, как
в первую, так и во вторую композицию метанолутилизаторов.
Таким образом, проведенные исследования позволяют сделать заключение о
возможности использования разработанной композиции биокомпонента при содержании
метанола в воде или почве, не превышающие 100 см3/кг (см3/дм3).
3.4. Экспериментальная оценка возможности применения
метанолутилизирующего препарата в морской воде, засоленной почве
Для оценки метанолутилизирующей способности метилотрофов, входящих в
состав биопрепарата при наличии в реакционной среде различных концентраций
солей (в перерасчете на NaCl), была проведена экспериментальная оценка по
определению блокирующей размножение изучаемых микробов величины содержания NaCl
в плотной питательной среде (пропись 1), содержащей 100 г метанола на 1 дм3
среды.
При определении количества вносимой соли (NaCl) учитывали имеющиеся
данные литературы об аналогичной величине в морях (Черном, Азовском,
Балтийском, Каспийском и других), находящихся на территории России, и
составляющей максимально 50 г на дм3 воды. На основании этих результатов в питательную
среду вносили 10, 20, 40, 60, 80, 100, 120, 140 г NaCl на 1 дм3 плотной
питательной среды (пропись 1). Величина посевной дозы соответствовала
количеству микробных клеток, содержащихся в одном грамме биопрепарата.
Культивирование осуществляли при температуре 30°С в шуттель-аппарате. По
истечении указанного срока для оценки наличия жизнеспособных микроорганизмов
производили высев на накопительную плотную питательную среду (пропись 2).
Полученные результаты показали, что величина 120 см3/дм3 NaCl в плотной
питательной среде, содержащей метанол, блокирует развитие микроорганизмов,
входящих в состав биопрепарата. При внесении 100 см3/дм3 NaCl после
инкубирования на плотной питательной среде с последующим высевом на плотную
накопительную питательную среду (пропись 2) выявляется рост колоний изучаемых
штаммов.
Результаты проведенных исследований представлены в таблице 3.
Таблица 3. Результаты оценки устойчивости изучаемой композиции
метанолутилизаторов к действию NaCl
|
Исследуемый материал
|
Наличие роста исследуемых культур при содержании NaCl, см3/дм3
|
Величина мбк, см3/дм3
|
|
10
|
20
|
40
|
60
|
80
|
100
|
120
|
140
|
|
|
Биопрепарат, включающий
Acinetobactercalcoaceticus; Methylobacterium sp.; Bacillus megaterium
|
+
|
+
|
+
|
+
|
+
|
+
|
-
|
-
|
120
|
+ Наличие роста изучаемых микроорганизмов
Отсутствие роста изучаемых микроорганизмов
Таким образом, проведенные исследования показали, что при концентрации
метанола в плотной питательной среде в качестве единственного источника
углевода для размножения микроорганизмов, входящих в состав биокомпонентаметанолутилизатора,
в концентрации 100 см3/дм3 сохраняется способность к утилизации метанола и
накоплению биомассы при содержании в плотной питательной среде солей (в
перерасчете на NaCl) не более 100 см3/дм3.
Полученные результаты определили пограничные условия использования
созданного биопрепарата в морской воде и засоленной почве.
3.5. Оценка возможности улучшения эксплуатационных характеристик
за счет внесения дополнительных ингредиентов в состав биопрепарата
На заключительном этапе данной научно-исследовательской работы изучалась
возможность улучшения эксплуатационных свойств разработанного биопрепарата, что
определялось следующими показателями:
повышением выживаемости микробных клеток при аэрозольном нанесении на
сорбент (глауконит) в процессе витания в аэрозоле и последующем его
прикреплении к алюмосиликату осадочного происхождения;
повышением устойчивости к ингибирующему действию метанола на основании
повышения минимально подавляющей концентрации роста метанолутилизаторов при
наличии избыточного количества соли, в перерасчете на NaCl.
Анализ данных литературы свидетельствует о том, что повышение
устойчивости микробных клеток к действию экстремальных факторов определяется
созданием псевдокапсулы, за счет дополнительно вносимых ингредиентов, и в первую
очередь глицерина.
Для оценки возможности улучшения эксплуатационных характеристик были
приготовлены две разновидности биопрепарата, одна из которых содержала
микробные культуры отобранных штаммов, а во вторую, приготовленную по
аналогичной прописи, был добавлен глицерин в количестве 6%.
Для оценки выживаемости микробных клеток при аэрозольном нанесении 10 см3
эмульсии, содержащей 2,5х10^9 живых микробных клеток, на 90 г сорбента
определяли содержание живых микробов в 1,0 г готового биопрепарата.
Результаты проведенных исследований представлены в таблице 4.
Проведенные исследования позволяют сделать заключение о повышении
концентрации микробных клеток в биопрепарате в результате внесения в композицию
биопрепарата 6% глицерина, обеспечивающее повышение устойчивости микробов к
аэрозолированию с последующим осаждением на сорбент.
Таблица 4. Результаты оценки внесения глицерина в композицию
биокомпонента на конечную концентрацию живых микробов в биопрепарате
|
Исследуемый биопрепарат
|
Концентрация микробных клеток в биопрепарате, КОЕ/ см3, 109
|
Концентрация микробных клеток в 1 г бипрепарата, КОЕ/г, 109
|
Эффективность нанесения, %
|
|
Без внесения глицерина
|
2,52
|
0,16
|
6,3
|
|
С внесением 6% глицерина
|
2,50
|
0,23
|
9,2
|
На следующем этапе проводимых исследований было изучено влияние вводимого
в композицию глицерина на повышение устойчивости метанолутилизаторов к действию
метанола на основании определения его минимально подавляющей концентрации при
выращивании на плотной питательной среде, содержащей метанол в количестве 60, 80,
100, 120, 140 см3/дм3. Результаты проведенных исследований представлены в
таблицах 5, 6.
Таблица 5. Результаты оценки внесения глицерина в композициюбиопрепарат
на устойчивость к метанолу в плотной питательной среде
|
Используемый биопрепарат
|
Наличие роста исследуемых культур при содержании метанола,
см3/дм3
|
Величина мпк, см3/дм3
|
|
60
|
80
|
100
|
120
|
140
|
|
|
Без внесения Глицерина
|
+
|
+
|
+
|
-
|
-
|
120
|
|
С внесением 6% глицерина
|
+
|
+
|
+
|
-
|
-
|
120
|
+ Наличие роста изучаемых микроорганизмов
Отсутствие роста изучаемых микроорганизмов
Таблица 6. Результаты оценки внесения глицерина в композицию биопрепарата
на ее устойчивость к действию NaCl в плотной питательной среде
|
Используемый биопрепарат
|
Наличие роста исследуемых культур при содержании метанола,
см3/дм3
|
Величина мпк, см3/дм3
|
|
60
|
80
|
100
|
120
|
140
|
|
|
Без глицерина
|
+
|
+
|
+
|
-
|
-
|
120
|
|
С 6% глицерина
|
+
|
+
|
+
|
-
|
-
|
120
|
+ Наличие роста изучаемых микроорганизмов
Отсутствие роста изучаемых микроорганизмов
Количество метанола в пробах составляло 100 см3/дм3.
Проведенные исследования показали, что внесение глицерина в состав
биопрепарата не обеспечивает повышение устойчивости метанолутилизаторов к
метанолу.
Аналогичная оценка метанолутилизирующей способности метилотрофов,
входящих в состав биокомпонента, при наличии в реакционной среде различных
концентраций солей в перерасчете на NaCl для определения показателя их
блокирующей размножение микробов концентрации (таблица 7) показала, что
внесение 6% в пропись композиции метилотрофных штаммов также не повышало
устойчивость к действию NaCl при культивировании на плотной питательной среде,
содержащей предельно допустимую концентрацию метанола, что подтверждалось
показателем минимально блокирующей концентрации NaCl.
Таблица 5. Результаты оценки внесения глицерина в композицию
биокомпонента на ее устойчивость к действию NaCl в плотной питательной среде
|
Изучаемый биопрепарат
|
Наличие роста исследуемых культур при содержании NaCl, см3/дм3
|
Величина мпк, см3/дм3
|
|
60
|
80
|
100
|
120
|
140
|
|
|
Без внесения Глицерина
|
+
|
+
|
+
|
-
|
-
|
120
|
|
С внесением 6% глицерина
|
+
|
+
|
+
|
-
|
-
|
120
|
+ Наличие роста изучаемых микроорганизмов
Отсутствие роста изучаемых микроорганизмов
Количество метанола в пробах составляло 100 см3/дм3.
3.6. Разработка технических условий на биопрепарат «БИОМ-М» и
технологического регламента на промышленный выпуск биопрепарата
Разработано ТУ 9291−002−26447891−2016 включающее
контрольные показатели качества и безопасности и методы контроля.
По органолептическим показателям «БИОМ-М» должен соответствовать
требованиям, приведенным в таблице 8.
Таблица 8. Органолептическим показателям «БИОМ-М»
|
Наименование Показателя
|
Содержание характеристики
|
|
Внешний вид Цвет (в массе продукта) Запах
|
Однородная порошкообразная масса (допускается слабое
комкование) От серого до светло зеленого Без запаха
|
По физико-химическим показателям «БИОМ-М» должен соответствовать
требованиям, указанным в таблице 9.
Таблица 9. Физико-химическим показателям «БИОМ-М»
|
Наименование показателя
|
Значение показателя
|
|
Массовая доля влаги, %, не более Средний размер частиц, мм,
не более Наличие металлических примесей Фазовый состав (подлинность)
Глауконит, %, не менее Адсорбционная активность по индикатору метиленовому
синему в мг/г продукта, не менее рН водной вытяжки Метанолутилизирующая
активность, %, не менее
|
5,0 0,3±0,05 Не допускается 33±3 2,0 6,5-7,5 98,0
|
«БИОМ-М» по содержанию токсичных элементов должен соответствовать
требованиям безопасным для гидробионтов и указанным в таблице 10.
Таблица 10. Содержание токсичных элементов «БИОМ-М»
|
Наименование вещества (элемента)
|
Допустимый уровень его содержания, мг/кг, не более
|
|
Токсичные Элементы
|
Свинец
|
6,0
|
|
Мышьяк
|
3,0
|
|
Кадмий
|
1,0
|
|
Ртуть
|
1,0
|
Суммарная удельная эффективная активность естественных радионуклидов в
«БИОМ-М» должна соответствовать требованиям НРБ-99 и быть не более 370 Бк/кг.
По микробиологическим показателям «БИОМ-М» должен соответствовать
требованиям безопасным для гидробионтов и указанным в таблице 11.
Таблица 11. Микробиологические показатели «БИОМ-М»
|
Наименование показателя
|
Значение Показателя
|
|
Общее количество жизнеспособныхBacillus
<http://genetika.ru/vkpm/katalog-mikroorganizmov/group_1456/group_1462/>megaterium
<http://genetika.ru/vkpm/katalog-mikroorganizmov/group_1456/group_1462/group_1474/> ВКПМ B-607; Methylobacteriumsp. ВКПМB-5603;
Acinetobactercalcoaceticus ВКПМB-3780, КОЕ/г, не менее1 000 000 000
|
|
|
Подлинность культур в препаратеBacillus
<http://genetika.ru/vkpm/katalog-mikroorganizmov/group_1456/group_1462/>megaterium
<http://genetika.ru/vkpm/katalog-mikroorganizmov/group_1456/group_1462/group_1474/> ВКПМ B-607; Methylobacteriumsp. ВКПМ B-5603; AcinetobactercalcoaceticusВКПМ B-3780Характеристика
культурально-морфологических свойств
|
|
|
Масса продукта (г), в которой не допускается:
|
БГКП (колиформы)
|
1,0
|
|
Патогенные (в том числе сальмонеллы)
|
25,0
|
|
Посторонняя микрофлора
|
не более 5% от общего количества клеток, рост плесневых
грибов не допускается
|
Таблица 12. Нормы расхода биопрепарата «БИОМ-М» в зависимости от степени
загрязнения
|
Степень загрязнения, %
|
Концентрация метанола в 1 т. почвы
|
Норма расхода биопрепарата (кг) /1 т почвы
|
Количество обработок
|
Количество препарата на все обработки на га почвы, кг
|
|
До 0,5 %
|
5 кг метанола
|
0,5
|
1
|
1,7
|
|
0,5-1%
|
5-10 кг метанола
|
0,5
|
1
|
3,4
|
|
1-5%
|
10-50 кг метанола
|
0,5
|
1
|
17,0
|
|
5-10%
|
50-100 кг метанола
|
0,5
|
1
|
34,0
|
|
10-20%
|
100-200 кг метанола
|
0,5
|
1
|
68,0
|
Максимальная концентрация метанола, допустимая при биологической очистке
- 30 мг/л
Приведенные исследования убедительно доказали, что создан высоко
эффективный, простой и экономичный биопрепарат - метанолдеструктор «БИОМ-М» с
высокой метанолутилизирующей активностью, простым и рентабельным режимом
получения перспективный для очистки метанолзагрязненных почв, сточных вод,
водоемов и резервуаров, в частности, в районах с коротким тепловым периодом.
4. Обсуждение
В результате исследований была предложена пропись
биокомпонентаметанолутилизатора, состоящая из комбинации штаммов:
Bacillus megaterium, ВКПМ, В-607 - 10%;, ВКПМ, В-3780 - 30%;
Methylobacterium sp., ВКПМ В-5603 - 60% и дополнительного ингредиента -
глицерина, вносимого в количестве 6% в приготовленный биокомпонент.
С его использованием был приготовлен метанолутилизирующий биосорбент,
состоящий из масс. %: биокомпонента - 10%; сорбента (алюмосиликата осадочного
происхождения) - 89%; аэросила - 1%.
Определены показатели минимально-подавляющей концентрации метанола для
штаммов:
Bacillus megaterium, ВКПМ, В-607;, ВКПМ, В-3780;
Methylobacterium sp., ВКПМ В-5603
и их комбинации - 120 см3/дм3 (кг).
Показана возможность применения биопрепарата в морской воде и засоленной
почве при содержании солей (в перерасчете на NaCl), не превышающем 100 см3/кг
(см3/дм3).
Установлено, что внесение глицерина в рецептуру биокомпонента повышает
устойчивость микробов к аэрозолированию с последующим осаждением на сорбент.
Полученные результаты обеспечили выполнение работ по определению
эксплуатационных характеристик экспериментального образца метанолутилизирующего
препарата.
Выводы
1. В результате анализа были отобраны и приобретены штаммы:, ВКПМ
В-3780, Methylobacteriumsp, ВКПМ В-5603, в качестве почвенного микроорганизма
был выбран и приобретен штамм Bacillusmegaterium, ВКПМ В-607. Уникальность
глауконита не только как депо для иммобилизации микроорганизмов биопрепарата,
но и как калийное удобрение с ионообменными свойствами убедительно определило
его использование как компонента биопрепарата.
Наиболее эффективным и экономически выгодным является биопрепарат с
клеточным титром 109 колониеобразующих единиц (КОЕ) в 1 г биопрепарата.
Определена пропись метанолутилизирующего препарата «БИОМ-М», состоящая из
масс. %: алюмосиликата осадочного происхождения (глауконита) - 89%; аэросила -
1%; биокомпонента, содержащего культуры штаммов метанолутилизаторов - 10%.
Пропись штаммов биопрепарата метанолутилизатора «БИОМ-М»:
Bacillus megateriumВКПМВ-607 - 10%;ВКПМВ-3780
- 30%;
Methylobacteriumsp. ВКПМ В- 5603 - 60%
и дополнительного ингредиента - глицерина, вносимого в количестве 6% в
приготовленный биопрепарат.
В результате анализа были отобраны и приобретены штаммы: Acinetobactercalcoaceticus,ВКПМ В-3780, Methylobacteriumsp,ВКПМ В-5603, в качестве почвенного
микроорганизма был выбран и приобретен штамм Bacillusmegaterium,ВКПМ В-607. Уникальность глауконита
не только как депо для иммобилизации микроорганизмов биопрепарата, но и как
калийное удобрение с ионообменными свойствами убедительно определило его
использование как компонента биопрепарата.
Наиболее эффективным и экономически выгодным является биопрепарат с
клеточным титром 109 колониеобразующих единиц (КОЕ) в 1 г биопрепарата.
Определена пропись метанолутилизирующего препарата «БИОМ-М», состоящая из
масс. %: алюмосиликата осадочного происхождения (глауконита) - 89%; аэросила -
1%; биокомпонента, содержащего культуры штаммов метанолутилизаторов - 10%.
Пропись штаммов биопрепарата метанолутилизатора «БИОМ-М»:
Bacillus megateriumВКПМВ-607 - 10%;ВКПМВ-3780
- 30%;.ВКПМ В- 5603 -
60%
и дополнительного ингредиента - глицерина, вносимого в количестве 6% в
приготовленный биопрепарат.
. Минимально подавляющей концентрации метанола составляет для штаммов
метилотрофов: Acinetobactercalcoaceticus- 100 см3/дм3; Methylobacteriumsp.- 120 см3/дм3; Bacillusmegaterium - 40 см3/дм3.
. Определение пограничных условий использования созданного биопрепарата в
морской воде и засоленной почве установило возможность использования
разработанной композиции биопрепарата при содержании метанола в воде или почве,
не превышающие 100 см3/кг (см3/дм3). При концентрации метанола в плотной
питательной среде в качестве единственного источника углевода для размножения
микроорганизмов, входящих в состав биопрепарата метанолутилизатора, в
концентрации 100 см3/дм3 сохраняется способность к утилизации метанола и
накоплению биомассы при содержании в плотной питательной среде солей (в
перерасчете на NaCl) не более 100
см3/дм3.
. На биопрепарат «БИОМ-М» разработаны технические условия ТУ 9291−002−26447891−2016
включающее контрольные показатели качества и безопасности и методы контроля.
Список использованной литературы
1. Гриценко
А.И., Истомин В.А., Кульков А.Н., Сулейманов Р.С. Сбор и промысловая подготовка
газа на северных месторождениях России. - М.: ОАО «Издательство «Недра», 1999.
- 473 с.: ил. - ISBN 5-247-03818-5.
. Воронцов
А.И., Николаевская Н.Г. Вопросы экологии и охраны окружающей среды.: М, 1986.
. Воронцов
А.И., Щетинский Е.А., Никодимов И.Д. Охрана природы.: М, Агропромиздат, 1989.
. Истомин
В.А. Предупреждение и ликвидация газовых гидратов в системах сбора и
промысловой обработки газа, и нефти. - М.: ВНИИЭгазпром, 1990, 214 с.
. Природные
и техногенные газовые гидраты: Сборник научных трудов/Под редакцией А.И.
Гриценко, В.А. Истомина. - М.: ВНИИГАЗ, 1990, 210 с.
. Истомин
В.А., Якушев В.С., Карпюк В.В. Аналитический библиографический указатель
литературы по газовым гидратам (1983-1987 гг.). - М.: ВНИИГАЗ, 1988, 246 с.
. Дегтярев
Б.В., Бухгалтер Э.Б. Борьба с гидратами при эксплуатации газовых скважин в
северных районах. - М.: Недра, 1976, 197 с.
. Бухгалтер
Э.Б. Предупреждение и ликвидация гидратообразования при подготовке и транспорте
нефтяного и природного газов. - Нефтепромысловое дело. - М.: ВНИИОЭНГ, 1982,
выпуск 10 (34), 41 с.
. Девликамов
В.В., Кабиров М.М., Фазлутдинов А.Р. Борьба с гидратами при эксплуатации
газлифтных скважин: Учебное пособие. - Уфа: УфНИИ, 1984, 80 с.
. Макогон
Ю.Ф., Малышев А.Г., Седых А.Д., Унароков К.Л., Топчев Ю.И. Временная инструкция
по предупреждению и ликвидации гидратов в системах добычи и транспорта газа. -
М.: ВНИИГАЗ, 1983, 132 с.
. Временное
методическое руководство по предупреждению и ликвидации гидратных пробок в
нефтяных скважинах. - Тюмень: СибНИИНП, 1984.
. Жданова
Н.В., Халиф А.Л. Осушка углеводородных газов. - М.: Химия, 1984, 192 с.
. Грунвальд
А.В. Использование метанола в газовой промышленности в качестве ингибитора
гидратообразования и прогноз его потребления в период до 2030 г. //
Нефтегазовое дело. 2007. № 2.
. Сборник
документов по безопасности работы с метанолом на объектах министерства газовой
промышленности. Под редакцией заместителя начальника Управления охраны труда,
военизированных частей и охраны предприятий Министерства газовой промышленности
Яновича А.Н., 1987 г.
. Инструкция
о порядке получения от поставщиков, перевозки, хранения, отпуска и применения
метанола на объектах газовой промышленности. 1975 г.
. Инструкция
по расчету нормативов потребления метанола для использования в расчетах
предельно допустимых или временно согласованных сбросов метанола для объектов
ОАО "ГАЗПРОМ" ВРД 39-1.13-010-2000, Москва 2000.
. Чуракаев
А.М. Газоперерабатывающие заводы и установки. - М.: Недра, 1994, 333 с.
. Гухман
Л.М. Подготовка газа северных газовых месторождений к дальнему транспорту. -
Л.: Недра, 1980, 161 с.
. Бекиров
Т.М. Промысловая и заводская обработка природных и нефтяных газов. - М.: Недра,
1980, 293 с.
. Международная
программа химической безопасности, метанол, критерий здоровья окружающей среды,
ВОЗ, 1997 г.
. Производственная
гигиена и токсикология Патти, 5-е издание.
. Опасные
материалы. Руководство по противопожарной защите, 13-е издание.
. Ланиган
С. (Lanigan, S.), Сводный отчет, по оценке безопасности метилового спирта,
InternationalJournalofToxicology., том 20, (2001 г.).
. Руководство
NIOSH по опасным химическим веществам.
. База
данных по опасным веществам.
. Троценко
Ю.А., Доронина Н.В., Хмеленина В.Н., Понаморева О. Н. Биология и биотехнология
аэробных метилотрофов/ Уч. пос. Тула.:ТулГУ. 2010.
. Безбородов
А.М., Загустина Н.А., Попов В. О. Ферментативные процессы в биотехнологии / М.:
Наука. 2008. 335 с.
. Гальченко
В.Ф. Метанотрофные бактерии / М.: ГЕОС. 2001. 500 с.
. Троценко
Ю.А., Доронина Н.В., Торгонская М.Л. Аэробные метилобактерии. ОНТИ ПНЦ РАН,
Пущино, 2010.325 с.
. Троценко
Ю.А., Торгонская М.Л. Метилотрофные дрожжи. «ТР-Принт», М., 2011.313 с.
. Троценко
Ю.А., Хмеленина В.Н. Экстремофильныеметанотрофы. ОНТИ ПНЦ РАН, Пущино, 2008.208
с.
. Федоров
Д.Н., Доронина Н.В., Троценко Ю.А. Фитосимбиоз аэробных метилобактерий: новые
факты и гипотезы. Микробиология 80: 2011.435-446.
. Малашенко
Ю.Р., Хайер Ю., Бергер У., Романовская В.А., Мучник Ф.В. Биология
метанобразующих и метанокисляющих микроорганизмов / Киев: Паукова думка. 1993.
255 с.
. Пиневич
А.В. Микробиология. Биология прокариотов: Учебник В 3 т. / 2-е изд., СПб.:
Изд-во СПбГУ. 2007. Т. 1-3.
. Подгорский
B.C. Физиология и метаболизм метанолусваивающих дрожжей / Киев: Паукова думка.
1982. 152 с.
. Троценко
Ю.А., Хмеленина В.Н. Экстремофильныеметанотрофы / Пущино: ОНТИ ПНЦ РАН. 2008.
206 с.
. Троценко
Ю.А., Доронина Н.В., Торгонская М.Л. Аэробные метилобактерии / Пущино: ОНТИ ПНЦ
РАН. 2010. 325 с.
. Труды
Института микробиологии имени С.Н. Виноградского РАН. Выпуск XIII. К 100-летию
открытия метанотрофии / Под ред. В.Ф. Гальченко, М.: Нау¬ка. 2006. 343 с.
. Large
P.J., Bamforth C.B. Methylotrophy and biotechnology / New York: Longman
Scientific & Technical. John Wiley & Sons Inc. 1988. 303 p.
. Methane
and methanol utilizers / Eds.: J.C. Murrell, H. Dalton // New York: Ple¬num
Press. 1992. 286 p.
. Bélanger L., Figueira M.M.,
Bourque D., Morel L., Béland M., Laramée L., Groleau D., Míguez C.B. (2004)
Production of heterologous protein by Methylobacteriumextorquens in high cell
density fermentation. FEMS Microbiol. Lett. 231: 197-204.
. Bodrossy
L., Kovacs K.L. (1994) Methane utilizing bacteria and their biotechnological
applications.Indian J. Experim. Biol. 32: 443-449.
. Bothe
H., Jensen K.M., Mergel A., Larsen J., Jorgensen C., Bothe H., Jorgensen L.
(2002) Heterotrophic bacteria growing in association with
Methylococcuscapsulatus (Bath) in a single cell protein production process.
Adv. Appl. Microbiol. 59: 33-39.
. Clark
D.S., Geresh S., DiCosmo R. (1995) Enantioselective oxidation of
2-methyl-1-alkanols by alcohol oxidase from methylotrophic yeasts. Bioorg.
Medic. Chem. Lett. 5: 1383-1388.
. Cos
O., Ramón R., Montesinos J.L., Valero F.
(2006) Operational strategies, monitoring and control of heterologous protein
production in the methylotrophic yeast Pichia pastoris under different
promoters: A review. Microb. Cell Fact. 5: 17.
. De
Boer L., Grobben G., Vrijbloed J.W., Dijkhuisen L. (1990) Biosynthesis of
aromatic amino acids in Nocardia sp. 239: effects of amino acid analogues on
growth and regulatory enzymes. Appl. Microbiol. Biotechnol. 33: 183-189.
. Eisenberg
A., Seip J.E., Gavagan J.E., Payne M.S., Anton D.L., DiCosimo R. (1997) Pyruvic
acid production using methylotrophic yeast transformants as catalyst. J. Mol.
Catalysis B: Enzymatic 2: 223-232.
. Flanagan
W.P. (1998) Biodegradation of dichloromethane in a granular activated carbon
fluidizedbed reactor. Water Environ. Res. 70: 60-66.
. Hall
E.A.H., Preuss M., Gooding J.J. (1998) Exploring sensors to monitor some
environmental discharges. In: Nikolelis D.P., Krull U.J., Wang J., Mascini M.
(Eds.) Biosensors for direct monitoring of environmental pollutants in field.
London: Kluwer Acad. Publ., p. 227-237.
. Hammer
G., Harrison D.E.F. (1980) Single cell protein: the technology, economics and
future potential. In: Harrison D.E.F., Higgins I.J., Watkinson R. (Eds.)
Hydrocarbons in biotechnology. London: Heyden, p. 59-73.
. Hartner
F.S., Glieder A. (2006) Regulation of methanol utilisation pathway genes in
yeasts. Microb. Cell Fact. 5: 39.
. Higgins
I.J., Best D.J., Hammond R.C. (1980) New findings in methane-utilizing bacteria
highlight their importance in the biosphere and their commercial potential.
Nature. 286: 561-564.
. Hou
C.T., Laskin A.I., Patel R.N. (1978) Growth and polysaccharide production by
Methylocystis parvus OBBP on methanol. Appl. Environ. Microbiol. 37: 800-804.
. Ishikawa
K., Toda-Murakoshi Y., Ohnishi F., Kondo K., Osumi T., Asano K. (2008) Medium
composition suitable for L-lysine production by Methylophilusmethylotrophus in
fed-batch cultivation. J. Biosci. Bioeng. 106: 574-579.
. Izumi
Y., Yoshida T., Miyazaki S.S., Mitsunaga T., Ohshiro T., Shimao M., Miyata A.,
Tanabe T. (1993) L-serine production by a methylotroph and its related enzymes.
Appl. Microbiol. Biotechnol. 39: 427-432.
. Kanamaru
K., Iwamura Y., Mikami Y., Obi Y., Kisaki T. (1982) 2-O-Methyl-D-mannose in an
extracellular polysaccharide from Hyphomicrobium sp. Agric. Biol. Chem. 46:
2419-2424.
. Kato
N., Kobayashi H., Shimao M., Sakazawa C. (1986) Dihydroxyacetone production
from methanol by a dihydroxyacetone kinase deficient mutant of
Hansenulapolymorpha. Appl. Microbiol. Biotechnol. 23: 180-186.
. Keppler
F., Hamilton J.T.G., Brass M., Roeckmann T. (2006) Methane emissions from
terrestrial plants under aerobic conditions. Nature. 439: 187-191.
. Khmelenina
V.N., Kalyuzhnaya M., Sakharovsky V.G., Suzina N.E., Trotsenko Y.A., Gottschalk
G. (1999) Osmoadaptation in halophilic and alkaliphilicmethanotrophs. Arch.
Microbiol. 172: 321-329.
. Lacava
P.T., Silva-Stenico M.E., Araújo W.L. Simionato A.V.C.,
Carrilho E., Tsai S.M., Azevedo J.L. (2008) Detection of siderophores in
endophytic bacteria Methylobacterium spp. associated with Xilellafastidiosa
subsp. pauca. Pesq. Agropec. Bras. 43: 521-528.
. Madhaiyan
M., Poonguzhali S., Senthilkumar M., Seshadri S., Chung H., Yang J., Sundaram
S., Sa T. (2004) Growth promotion and induction of systemic resistance in rice
cultivar Co-47 (Oryza sativa L.) by Methylobacterium sp. Bot. Bull. Acad. Sin.
45: 315-324.
. Nichols
P.D., White D.C. (1989) Accumulation of polyhydroxybutirate in a
methane-enriched, halogenated hydrocarbon-degrading soil column: implications
for microbial community structure and nutritional status. Hydrobiologia.
176/177: 369-377.
. Odac
D., Timur S., Telefoncu A. (2004) Carboxyl esterase-alcohol oxidase based
biosensor for the aspartame determination. Food Chemistry. 84: 493-496.
. Odom
J.M. (2006) Antioxidant activity from methanotrophic biomass. US Patent №
20060045871.
. Oh
D.B., Park J.S., Kim M.W., Cheon S.A., Kim E.J., Moon H.Y., Kwon O., Rhee S.K.,
Kang H.A. (2008) Glycoengineering of the methylotrophic yeast Hansenula
polymorpha for the production of glycoproteins with trimannosyl core N-glycan
by blocking core oligosaccharide assembly. Biotechnol. J. 3: 659-668.
. Oren
A. (2002) Halophilic microorganisms and their environments. Dordrecht: Kluwer
Acad. Publ., 545 p.
. Paryzhak
S., Demkiv O., Gayda G. (2007) Enzyme- and cells-based biosensors for assay of
formaldehyde in vaccines. In: Proc. 2nd Polish-Ukrainian Weigl Conference
«Microbiology in the XXI century». Warsaw Agricult. Univ. SGGW, Warsaw, p.
170-173.
. Ryabova
O.B., Chmil O.M., Sibirny A.A. (2003) Xylose and cellobiose fermentation to
ethanol by the thermotolerant methylotrophic yeast Hansenula polymorpha. FEMS
Yeast Res. 2003. 4: 157-164.
. Sakai
Y., Tani Y., Kato N. (1999) Biotechnological application of cellular functions
of the methylotrophic yeast. J. Mol. Catalysis B Enzymatic. 6: 161-173.
. Smutok
O., Ngounou B., Pavlishko H., Gayda G., Gonchar M., Schuhmann W. (2006) A
reagentlessbienzymeamperometric biosensor based on alcohol oxidase/peroxidase
and an Os-complex modified electrodeposition paint. Sensors Actuators B: Chem.
113: 590-598.
. Stasiuk
N.L., Gayda G.Z., Koval’chuk L.P, Stasyk O.V., Gonchar M.V. (2010) Human
arginase I from the recombinant yeast Hansenula polymorpha: isolation and
characterization of the enzyme. Ukr. Biochim. Zh. 82: 14-21.
. Sulter
G., Looyenga L., Veenhuis M., Harder W. (1990) Occurrence of peroxisomal
membrane proteins in methylotrophic yeasts grown under different conditions.
Yeast 6: 35-43.
. Tani
Y. (1991) Production of useful chemicals by methylotrophs. Biotechnology. 18:
253-270.
. Tsujimoto
N., Gunji Y., Ogawa-Miyata Y., Shimaoka M., Yasueda H. (2006) L-lysine
biosynthetic pathway of Methylophilus methylotrophus and construction of an
L-lysine producer. J. Biotechnol. 124:327-337.
. Trotsenko
Y.A., Bystrykh L.V. (1990) Production of metabolites by methylotrophic yeasts.
Biotehcnol. Adv. 8: 105-119.
. Ubiyvovk
V.M., Ananin V.M., Malyshev A.Y., Kang H.A., Sibirny A.A. (2011) Optimization
of glutathione production in batch and fed-batch cultures by the wild-type and
recombinant strains of the methylotrophic yeast Hansenula polymoprha. BMC
Biotech. 11: 8.
. Ueda
S., Matsumoto S., Takagi A., Yamane T. (1992) Synthesis of
poly(3-hydroxybutyrate-co-3-hydroxyvalerate) from methanol and n-amyl alcohol
by the methylotrophic bacteria Paracoccusdenitrtificans and Methylobacterium
extorquens. Appl. Environ. Microbiol. 58: 3574-3579.
. Van
Dien S.J., Okubo Y., Hough M.T., Korotkova N., Taitano T., Lidstrom M.E. (2003)
Reconstruction of C3 and C4 metabolism in Methylobacterium extorquens AM1 using
transposon mutagenesis. Microbiology. 149: 601-609.
. Woodward
J. (1990) Biochemistry and applications of alcohol oxidase from methylotrophic
yeasts. In: Codd G.A., Dijkhuisen L., Tabita F.R. (Eds.) Autotrophic
microbiology and one-carbon metabolism. Dordrecht: Kluwer Acad. Publ., p.
193-225.
. Yurimoto
H., Oku M., Sakai Y. (2011) Yeast methylotrophy: metabolism, gene regulation
and peroxisome homeostasis. Int. J. Microbiol. ID 101298: 1-8.
82. Zhao
S., Fan C., Hu X., Chen J., Feng H. (1993) The microbial production of
polyhydroxybutyrate from methanol. Appl. Biochem. Biotechnol. 39/40: 191-199.