Генетические маркеры молочной продуктивности крупного рогатого скота
Министерство
образования и науки Российской Федерации
Федеральное
государственное бюджетное образовательное учреждение
высшего
профессионального образования
«КУБАНСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
(ФГБОУ ВПО
«КубГУ»)
Кафедра
биохимии и физиологии
ДОПУСТИТЬ
К ЗАЩИТЕ В ГАК
Заведующий
кафедрой - канд. биол.
наук,
доцент ________ В. В. Хаблюк
ВЫПУСКНАЯ
КВАЛИФИКАЦИОННАЯ РАБОТА БАКАЛАВРА
Генетические маркеры молочной продуктивности крупного
рогатого скота
Работу
выполнил Г. А. Набережных
Факультет
биологический
Направление
06.03.01 Биология
Научный
руководитель,
д-р
биол. наук,
проф
Н. В. Ковалюк
Нормоконтролёр,
доцент,
канд. биол.
наук
Н. Н. Улитина
Краснодар
2015
РЕФЕРАТ
Данная работа выполнена на 47 листах
машинописного текста. Содержит 13 таблиц и шесть рисунков. Для выполнения
данного исследования было использовано 35 литературных источников.
молочная продуктивность, ГОЛШТИНСКИЙ СКОТ,
генечские маркеры, полиморфизм длин рестрикционных фрагментов, ГЕН BoLA
DRB3, ГЕН
КАППА-КАЗЕИН, аЛЛели, ЧУВСТВИТЕЛЬНЫЕ, УСТОЙЧИВЫЕ, НЕЙТРАЛЬНЫЕ
Цель работы - выявить генотип по локусам BoLA
DRB3 и каппа - казеина оптимальный в отношении продуктивных показателей и
резистентности к лейкозу у коров черно-пестрой голштино-фризской породы.
Работа проводилась на базе лаборатории
биотехнологии Северо-Кавказского научно-исследовательского института
животноводства Россельхозакадемии в период с 17.06.14 г. по 27.07.14 г. и с
02.07.14г. по 12.10.14 г.
Объектом исследования были коровы голштинской
породы. Материалом для исследований служила кровь коров.
В институте выполнен ПЦР-анализ образцов на
наличие полиморфизма в генах BoLA
DRB 3 и каппа-казеин.
По результатам анализа определена частота встречаемости генотипов и установлена
связь с ними продуктивных качеств.
СОДЕРЖАНИЕ
Введение
.
Аналитический обзор
.1
Современное состояние молочной продуктивности крупного рогатого скота
.2
Краткая характеристика голштинских коров
.3
Аналитический обзор генетических маркеров молочной продуктивности
.3.1
Структура и полиморфизм гена BoLA
DRB3
.3.2
Структура и полиморфизм гена каппа-казеина
.
Материал и методы исследования
.1
Материал исследования
.2
Выделение ДНК
.3
Проведение полимеразной цепной реакции
.4
Анализ полиморфизма длин фрагментов рестрикции
.5
Электрофорез
.
Генетические маркеры молочной продуктивности крупного рогатого скота
.1
Частоты встречаемости аллелей и генотипов по гену BoLA-DRB3
в исследуемом стаде
.2
Качественные и количественные показатели молочной продуктивности чёрно-пёстрых
голштинских коров и их взаимосвязь с генотипом по гену BoLA
DRB 3
.3
Частота встречаемости генотипов по гену каппа-казеина и взаимосвязь генотипа с
показателями молочной продуктивности у чёрно-пёстрых голштинских коров
.4
Повышение частоты встречаемости оптимального в хозяйственном отношении генотипа
Заключение
Список
использованных источников
ВВЕДЕНИЕ
В результате экономических преобразований в
сельском хозяйстве России, за последние 20 лет, произошли радикальные перемены,
носящие в основном негативный характер. Во всех отраслях животноводства, в том
числе и молочном скотоводстве, резко снизилось количество животных, что привело
к снижению их продуктивности, ухудшению показателей воспроизводства, увеличению
подверженности к заболеваниям, рождению молодняка с пониженной
жизнеспособностью, как в ранние, так и в более поздние периоды роста и
развития, что, в свою очередь, привело к значительному экономическому спаду
отрасли.
Традиционные зоотехнические методы оценки
сельскохозяйственных животных, основанные на анализе фенотипических признаков,
не всегда обеспечивают объективность суждения о селекционной перспективности
животных и не могут в полной мере удовлетворить требования, предъявляемые к
селекции.
Большинство хозяйственно-полезных признаков
имеют непрерывную фенотипическую изменчивость и находятся под контролем многих
генетико-физиологических систем, а также различных факторов внешней среды. В
связи с этим методы биохимической и молекулярной генетики, основанные на
использовании генетических маркеров, находят все большее применение в
практической селекции.
Беспрецедентные возможности открыло
использование ДНК-маркеров для генетического маркирования локусов, сцепленных с
хозяйственно-ценными признаками.
Генетические маркеры - это нуклеотидные
последовательности, чье положение (локализация) определено в хромосоме или
участке хромосомы.
Использование генетических маркеров молочной
продуктивности в практической селекции крупного рогатого скота, позволит более
достоверно оценивать генетический потенциал пород, популяций и отдельно взятых
особей, контролировать селекционные процессы и корректировать их
направленность.
Так зарубежными исследователями был выявлен ген
BoLA DRB3, который является одним из ключевых генов, определяющих первичный
иммун-ный ответ организма на вирусную инфекцию. Разные аллели этого гена играют
не одинаковую роль в формировании устойчивости КРС к персистентному
лимфоцитозу, вызываемому вирусом лейкоза КРС [Xu, Van Eijk., Park, 1993].
В нашей стране Г. Е. Сулимова и др. (1995)
провели исследования, профинансированные Фондом фундаментальных исследований
Российской академии, и установили на большой выборке животных различных пород
(черно - пестрой, айрширской и горбатовской) достоверную взаимосвязь между
генотипом и устойчивостью к лейкозу.
А в работе «Associations of the bovine major histocompatibility complex DRB3 (BoLA DRB3) wish production traits in Canadian dairy cattle» [Sharif
<#"863982.files/image001.jpg">
Рисунок 1 − Общая геномная организация
казеинов КРС
Хотя по результатам проведенных
Н. Юхмановой и Л. Калашниковой [2004] исследований на животных красно-пестрой
породы можно сделать вывод, что в исследуемой популяции не
установлено прямолинейной зависимости между
генотипом по локусу каппа-казеина и
удоем.
В настоящее время в литературе описано10
вариантов к-казеина, из которых наиболее часто встречающимися являются А и В, а
среди редких аллелей - С, Е, F
и G.
2. Материал и методы
исследования
.1 Материал
исследования
Исследования были проведены на базе лаборатории
биотехнологии Северо-Кавказского научно-исследовательского института
животноводства Россельхозакадемии в период с 17.06.14 по 27.07.14 и с 02.09.14
по 12.10.14.
Объектом исследования были коровы голштинской
породы. Материалом для исследований служила кровь коров. Забор крови у коров
проводился в хозяйстве ЗАО «Племзавод «Колос» Каневского района, в количестве n=115.
Выделение ДНК, постановка ПЦР, ПДРФ - анализа, электрофореза проводились по
описанным в литературе методикам (Van
Eijk, Stewart-Haynes,
Lewin, 1992]. Для
статистической обработки результатов применялись стандартные методики Т.Ф.
Лакина [1980] с использованием программных возможностей Microsoft
Exel.
Обработка данных проводилась в программе на
основе шаблона Microsoft
Exel (BoLA-статистика),
разработанной лабораторией биотехнологии СКНИИЖ (Н.В. Ковалюк). После внесения
данных по генотипам коров программа автоматически определяет частоты
встречаемости генотипов (в абсолютных и относительных значениях), аллелей (по
группам и разновидностям), позволяет сортировать животных по генотипам и
определять достоверность различий с использованием критерия Стьюдента.
2.2 Выделение
дезоксирибонуклеиновой кислоты
При выделении ДНК из образцов крови использовали
наборы реагентов Diatom
DNA Prep
100 ООО «Лаборатория Изоген» город Москва.
. Первичная обработка образцов.
К 100 мкл крови добавляем 400 мкл лизирующего
раствора (Lysis
Reagent). Далее идёт
выделение без термостатирования.
. В пробирку с лизатом добавляем 20 мкл
суспензии сорбента (диатомовые водоросли). Перед этим сорбент встряхиваем на
вортексе. Ротируем 10 мин.
. Центрифугируем десять секунд при 5000 об/мин.
. Осторожно, не задевая, осадка, удаляем
супернатант с помощью водоструйного насоса. К осадку прибавляем 200 мкл
лизирующего раствора.
. Центрифугируем десять секунд при 5000 об/мин.
. Удаляем супернатант. К осадку добавляем 1 мл
рабочего однократного раствора солевого буфера (десятикратный солевой буфер (1М
NaCl и 1M KCl) разводим водой до 100 мл, а затем 96% этиловым спиртом до 300 мл
и перемешиваем).
. Центрифугируем десять секунд при 5000 об/мин.
. Удаляем супернатант, к осадку добавляем 1 мл
рабочего раствора солевого буфера, перемешиваем, центрифугируем десять секунд
при 5000 об.
. Удаляем супернатант. Убираем полосками
фильтровальной бумаги остатки жидкости над сорбентом, меняя полоски от пробы к
пробе.
. Осадок сушим в термостате при 65 градусах
Цельсия пять минут.
. К осадку добавляем 100 мкл ЭкстраГена (10%
смесь ионообменников (типа Chelex), и 0,01% тритон X-100). Пробирку с
ЭкстраГеном хорошо перемешать. Ресуспендируем на вортексе и термостатируем пять
минут при 65 градусах Цельсия.
. Центрифугируем при 12000 об/мин
. Перенести содержащую ДНК надосадочную жидкость
(80 мкл) в чистую пробирку.
.3
Проведение полимеразной цепной реакции
Полиморфизмы гена BoLA
DRB3 определяли с
помощью полимеразной цепной реакции (ПЦР) по методике Van
Eijk M.J.T.,
Stewart-Haynes
J.A.,
Lewin H.A.
[1992], Сулимова, Г.Е., Удина И.Г., Шайхаев Г.О., Захаров И.А. [1995],
используя соответствующие праймеры.
Для амплификации участков гена использовались
следующие последовательности праймеров:
HLO-30: 5' - ATС
СTC
TCT CTG CAG CAC ATT TCC - 3': 5' - TСG
CCG CTG CAC AGT GAA ACT СTC
- 3'
Полиморфизмы гена каппа-казеина (CSN3) определяли с
помощью полимеразной цепной реакции по методике [Сулимова,
1991], используя соответствующие праймеры.
Для амплификации участков гена использовались
следующие последовательности праймеров:
SGE: 5'
- TAT-CAT-TTA-TGG-CCA-TTG-GAC-CA -3'О : 5'
- CTT-CTT-TGA-TGT-CTC-CTT-AGA-GTT -3'
ПЦР поводили с 200 нг ДНК в конечном объеме 30
мкл.
Состав реакционной смеси:
мМ трис-НСl
рН 8,8 (Sigma)
,6 мМ сульфата аммония (Sigma)
,0 l%
Tween 20 (Sigma)
,5-2,5 мМ (в зависимости от анализа) хлористого
магния (Sigma)
,2 мМ дезоксирибонуклеотидтрифосфатов (по 0,05
мМ каждого) (Sigma)
пМ каждого праймера
ед. Taq
- полимеразы (ООО «СибЭнзим» Москва)
В пробирки с реакционной смесью добавляли
минеральное масло (ООО «Хеликон») для предотвращения испарения жидкости и
помещали в термоциклер МС-2, разработанный АО «ДНК-Технология» (Москва) для
проведения ПЦР. С учетом особенностей работы амплификатора МС-2 и особенностей
амплифицируемых участков нами были установлены следующие режимы амплификации:
При амплификации экзона 2 гена BoLA
DRB 3
º С - 3 мин.
º С - 1 мин.
º С - 1 мин. 5 циклов
º С - 1 мин.
º С - 30 с.
65º С - 30 с. 27 циклов
72º С - 30 с.
72º С - 3 мин. 1 цикл
При амплификации участка гена каппа-казеина
95º С - 3 мин.
95º С - 30 с.
62º С - 30 с. 34 цикла
72º С - 30 с.
95º С - 1 мин.
62º С - 1 мин. 1 цикл
72º С - 3 мин.
В результате полимеразной цепной реакции
получаются ПЦР-продукты с размерами: 284 пары нуклеотид для BoLA
DRB3 и 228 пар
нуклеотид для каппа-казеина.
Для контроля прохождения реакции и оценки
качества и концентрации проводили электрофорез в 1.5% агарозном геле с
использованием пятикратного трис-боратного буфера (TBE имеет состав: 54 г
Трис-НСl; 27,5 г борная кислота; 2 мл 0,5 M ЭДТА, рН 8,0 доводят
дистиллированной водой до одного литра) [Уильямс, Уилсон, 1978].
Приготовление 1,5% и 2% агарозного геля:
Агароза - 1,5 г
Доводим до 100 мл 1% TBE-буфером
Бромистый этидий - 5 мкл
После смешивания компонентов гель нагревают до
кипения и оставляют в термостате на два часа при температуре 50 градусов
Цельсия, чтобы молекулы полисахарида сформировали однородную решетку геля.
Образцы ДНК смешивали с буфером для нанесения
проб, содержащим 50% глицерина, 50% TBE-буфера
и 0,025% бромфенолового синего. Смешанные пробы вносили в лунки геля под
электрофорезный буфер. Электрофорез обычно вели при постоянном напряжении 100
V.
Гель после электрофореза высушивали и
просматривали в ультрафиолетовых лучах, при этом краситель, интеркалирующий в
молекулу ДНК, испускал волны в красно-оранжевой области видимого спектра 590
нм. После визуального осмотра гель фотографировали в ультрафиолетовых лучах.
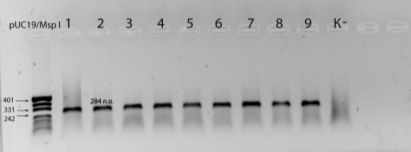
Рисунок 2 − Электрофорез в 1,5% агарозном
геле продуктов ПЦР экзона 2 гена BoLA DRB3; pUC19/Msp I-
маркер молекулярных масс, К - отрицательный контроль, 1-9 - исследуемые образцы
На рисунке 2 видно, что в ПЦР с геномной ДНК из
образцов крови прошла хорошо, в геле видна полоса ДНК с ожидаемым размером 284
п.о., яркость полосы свидетельствует о достаточном количестве в пробе
дезоксинуклеозидтрифосфатов, Taq-ДНК-полимеразы,
правильном составе буфера для полимеразной реакции.
2.4 Анализ полиморфизма
длин фрагментов рестрикции
В зависимости от целей исследований ПЦР-продукты
обрабатывались рестриктизами.
В работе были использованы следующие ферменты: Rsa
I, Bst
Y I
(Psu I,
Xho II,
Bst X2I),
Bsu R
I (Hae
III), Hinf
I.
Rsa
I в буфере,
содержащем 10 мМ трис - ацетата (рН = 7, 9), 10 мМ ацетата магния, 66 мМ
ацетата калия, 0, 1мг/мл BSA;
Bst
Y I
в буфере, содержащем 10 мМ трисНСl
(рН 7,9), 50 мМ NaCl,
10 мМ MgCl2 и 1 мМ
дитиотреитола;
Bsu
R I
в буфере, содержащем 10 мМ трис - НС1(рН = 8, 5), 10 мМ MgCl2,
100 мМ KCl, 0, 1мг/мл BSA;
Hinf
I в буфере,
содержащем 50 мМ трис - НС1(рН = 7,6), 10 мМ MgCl2,
100 мМ NaCl, 1 мМ DTT.
Последовательности, узнаваемые этими
эндонуклеазами:
Rsa
I - 5’GT
^ AC
Bst Y I - 5’ (A/G) ^ GATC (C/T) 3’R
I - 5’GG^CC 3’I - 5’G ^ A(A,G,C,T)T C 3’
2.5 Электрофорез
Молекулярный вес продуктов ПЦР и их фрагментов,
полученных после рестрикции, определяли с помощью электрофореза в
полиакриламидном геле (6-12 %) [Херрингтон, 1999].
Состав ПААГ:
Вода, ТБЕ-буфер, 30 % ПАА, ТЕМЕД, 10 %
персульфат аммония.
Бромистый этидий не добавляли, так как он плохо
связывается с гелем и при электрофорезе первым покидает гель.
Электрофорез длился 1,5 часа.
Гели окрашивали в растворе этидиум бромида (1
мкг/мл), отмывали дистиллированной водой и просматривали в ультрафиолетовых
лучах, при этом краситель, интеркалирующий в молекулу, испускал излучение в
красно-оранжевой области видимого спектра (590 нм). После просмотра гели
фотографировали в ультрафиолетовых лучах с использованием цифрового
фотоаппарата SONY
DSC W15.
Снимки анализировали в программах Adobe
Photoshop 6.
После рестрикции амплификата гена каппа-казеина
эндонуклеазой Hinf
I гомозиготные
животные по аллелю A (генотип AA)
образуют два фрагмента величиной 135 и 93 пары нуклеотид, гетерозиготные AB
- три фрагмента: 228, 135 и 93 пары нуклеотид, а несущие генотип BB
- один фрагмент 228 пар нуклеотид.
На рисунке 3 показан
результат электрофореза фрагментов ДНК - продуктов рестрикции гена
каппа-казеина в 6% полиакриламидном геле.

Рисунок 3 − Анализ аллельного полиморфизма
гена каппа-казеина
На рисунках с 4 по 6 представлены
электрофореграммы продуктов рестрикции амплификата участка гена BoLА DRB 3
размером 284 пары нуклеотидов (пн), эндонуклеазами HaeIII, BstX2I, Bst2UI, Rsa
I, позволяющие определить BoLА DRB 3 генотип животного.

Рисунок 4 − Электрофореграмма продуктов
рестрикции амплификата участка гена BoLА
DRB 3 эндонуклеазой Hae
III.

Рисунок 5 −
Электрофореграмма продуктов рестрикции амплификата участка гена BoLА
DRB 3 эндонуклеазой BstX

Рисунок 6 − Электрофореграмма
продуктов рестрикции амплификата участка гена BoLА DRB 3
эндонуклеазой Rsa I
Для разных аллельных вариантов гена BoLA
DRB 3 характерно
образование после рестрикции продуктов амплификации наборов рестриктных
фрагментов (ДНК - паттернов) (таблица 1).
Сопоставление ДНК - паттернов, полученных с
использованием указанных выше рестриктаз, позволяет идентифицировать более 50
аллелей гена BoLA
DRB 3 (таблица 2).
Допустим, при рестрикции ПЦР - продукта эндонуклеазой Rsa
I образуются
фрагменты 141, 104 и 39 пн (по таблице 1 находим, что это Rsa
I - паттерн g);
эндонуклеазой Bst
Y I
- 112, 87, 85 пн (Bst
Y I
- паттерн е); эндонуклеазой Hae
III - 167, 65, 52 (Hae
III - паттерн а).
Затем по таблице 2 определяем, какой аллели соответствует комбинация
установленных ДНК - паттернов.
Комбинация Rsa
I - паттерна g,
BstY I
- паттерна e и Hae
III - паттерна а
соответствует 11 аллели гена BoLA
DRB 3. Как видно из
таблицы 2 эта аллель определяет устойчивость к лейкозу.
Таблица 1 - ДНК-паттерны и соответствующие им
фрагменты рестрикции
|
Rsa I - паттерны
|
Bst Y I - паттерны
|
Hae III - паттерны
|
|
Название
|
Величина
фрагментов рестрикции, пн
|
Название
|
Величина
фрагментов рестрикции, пн
|
Название
|
Величина
фрагментов рестрикции, пн
|
|
A
|
78,54,50,39,33,30
|
a
|
199, 85
|
a
|
167, 65, 52
|
|
B
|
111, 54,50,39,30
|
b
|
284
|
b
|
219, 65
|
|
C
|
111, 93, 50,30
|
c
|
196, 85
|
c
|
167, 65, 49
|
|
D
|
143, 111, 30
|
d
|
97, 87
|
d
|
190, 65, 29
|
|
E
|
141, 51, 50, 39
|
e
|
112, 87, 85
|
e
|
167, 117
|
|
F
|
141, 54, 50, 39
|
f
|
281
|
f
|
167, 65, 48
|
|
G
|
141, 104, 39
|
|
|
g
|
164,65,55
|
|
H
|
111, 69, 54, 50
|
|
|
h
|
167,65,46
|
|
I
|
180, 54, 50
|
|
|
i
|
167,113.4
|
|
J
|
78, 93, 63, 50
|
|
|
|
|
|
K
|
156, 78, 50
|
|
|
|
|
|
L
|
234, 50
|
|
|
|
|
|
M
|
111, 104, 69
|
|
|
|
|
|
N
|
180, 104
|
|
|
|
|
|
O
|
284
|
|
|
|
|
|
P
|
111, 51,50, 39, 30
|
|
|
|
|
|
Q
|
141, 90, 50
|
|
|
|
|
|
R
|
111, 90, 50, 30
|
|
|
|
|
|
S
|
141, 93, 50
|
|
|
|
|
|
T
|
78, 69, 54, 50, 33
|
|
|
|
|
|
U
|
153,
78, 50
|
|
|
|
|
|
V
|
102,78.54,50
|
|
|
|
|
|
W
|
78,69,54,50.33
|
|
|
|
|
|
X
|
104,78,69,33
|
|
|
|
|
Сулимова Г.Е., Удина И.Г., Шайхаев Г.О, Захаров
И.А. [1995] отмечают, что подобный метод ДНК - типирования может быть
использован в сельскохозяйственной практике для генотипирования быков -
производителей с тем, что бы снизить широкое распространение аллелей,
обусловливающих чувствительность к лейкозу.
Таблица 2 - Таблица определения аллелей гена BoLA
DRB 3 на основе данных
рестрикционного анализа с использованием эндонуклеаз Rsa
I, Hae
III, Bst
Y I
и их связь с устойчивостью к лейкозу
|
ПЦР
-ПДРФ аллели BoLA DRB 3
|
Название
ДНК - паттернов
|
Отношение
к лейкозу*
|
|
Rsa I
|
BstY I
|
Hae III
|
|
|
1
|
A
|
a
|
a
|
Н
|
|
2
|
B
|
b
|
a
|
Н
|
|
3
|
B
|
b
|
b
|
Н
|
|
4
|
C
|
a
|
a
|
Н
|
|
5
|
R
|
c
|
c
|
Н
|
|
6
|
D
|
a
|
a
|
Н
|
|
7
|
E
|
c
|
c
|
Н
|
|
8
|
f
|
a
|
a
|
Ч
|
|
9
|
f
|
d
|
a
|
Н
|
|
10
|
f
|
b
|
a
|
Н
|
|
11
|
g
|
e
|
a
|
Р
|
|
12
|
h
|
a
|
a
|
Н
|
|
13
|
h
|
b
|
a
|
Н
|
|
14
|
h
|
b
|
b
|
Н
|
|
15
|
i
|
b
|
a
|
Н
|
|
16
|
j
|
b
|
d
|
Ч
|
|
17
|
k
|
b
|
b
|
Н
|
|
18
|
l
|
b
|
f
|
Н
|
|
19
|
s
|
b
|
b
|
|
20
|
l
|
b
|
b
|
Н
|
|
21
|
l
|
b
|
e
|
Н
|
|
22
|
m
|
b
|
a
|
Ч
|
|
23
|
n
|
b
|
a
|
Р
|
|
24
|
n
|
b
|
b
|
Ч
|
|
25
|
o
|
a
|
a
|
Н
|
|
26
|
o
|
a
|
b
|
Н
|
|
27
|
o
|
b
|
f
|
Н
|
|
28
|
o
|
b
|
b
|
Р
|
|
29
|
p
|
c
|
c
|
Н
|
|
30
|
q
|
c
|
c
|
Н
|
|
31
|
i
|
b
|
f
|
Н
|
|
32
|
m
|
a
|
a
|
?
|
|
33
|
n
|
b
|
f
|
?
|
|
34
|
l
|
a
|
b
|
Н
|
|
35
|
c
|
b
|
b
|
Н
|
|
36
|
l
|
b
|
a
|
Н
|
|
37
|
o
|
b
|
a
|
Н
|
|
38
|
b
|
d
|
a
|
Н
|
|
39
|
t
|
b
|
a
|
Н
|
|
40
|
u
|
b
|
a
|
Н
|
|
41
|
a
|
b
|
a
|
Н
|
|
42
|
h
|
b
|
f
|
Н
|
|
43
|
k
|
b
|
f
|
Н
|
|
44
|
k
|
b
|
i
|
Н
|
|
45
|
s
|
d
|
b
|
Н
|
|
46
|
v
|
b
|
a
|
Н
|
|
47
|
w
|
a
|
a
|
Н
|
|
48
|
w
|
b
|
a
|
Н
|
|
49
|
w
|
b
|
e
|
Н
|
|
50
|
x
|
b
|
a
|
Н
|
|
51
|
g
|
a
|
a
|
Н
|
|
52
|
s
|
d
|
a
|
Н
|
|
53
|
y
|
b
|
a
|
Н
|
|
54
|
j
|
d
|
b
|
?
|
Статистическая обработка результатов
производилась как по стандартным методикам Н.А. Плохинский (1969), Н.А.
Плохинский (1970); Е.К. Меркурьева (1979); Т.Ф. Лакин (1980), так и с
использованием программных возможностей.
3. Генетические маркеры
молочной продуктивности крупного рогатого скота
.1 Частоты
встречаемости аллелей и генотипов по гену BoLA-DRB3.2 в
исследуемом стаде
По гену BoLA-DRB3.2
было прогенотипировано 115 коров черно - пестрой голштинской породы.
Распределение генотипов представлено в таблице
3.
Таблица 3 − Частота встречаемости
генотипов по локусу BoLA DRB 3
|
Генотип
BoLA
DRB3
|
Коровы
(n=115)
|
|
Кол-во
животных данного генотипа
|
%
животных данного генотипа
|
|
(Ч/Ч)
|
30
|
26,1
|
|
(Ч/У)
|
30
|
26,1
|
|
(Ч/Н)
|
30
|
26,1
|
|
(У/У)
|
5
|
4.3
|
|
(Н/Н)
|
10
|
8,7
|
|
(Н/У)
|
10
|
8,7
|
Из таблицы 3 видно, что наиболее многочисленными
оказались группы животных, относящиеся к (Ч/Ч), (Ч/У) и (Ч/Н) генотипам, т.е.
генотипам, в состав которых обязательно входят чувствительные аллели.
Соответственно в распределении аллелей гена BoLA
DRB 3.2 наблюдается смещение в сторону чувствительных (Ч) аллелей - 52,2%
(таблица 4).
Подсчет частот встречаемости аллелей проводился
по формуле:
P(A)
= (2 +
+ )/2n,
(1)
)/2n,
(1)
где P
- частота встречаемости аллели; А - аллель; N1
-
число гомозигот по исследуемому аллелю; N2
-
число гетерозигот; n - объем
выборки.
Таблица 4 − Частота встречаемости аллелей
по локусу BoLA DRB 3
|
Частота
встречаемости аллелей, N=115
|
Процент
аллеля, %
|
Количество
носителей
|
Процент
носителей аллеля, %
|
|
Н
|
26,1
|
50
|
43,5
|
|
Ч
|
52,2
|
90
|
78,3
|
|
У
|
21,7
|
45
|
39,2
|
На сегодняшний день известно 54 аллели гена BoLA
DRB3.2, из них три аллели (*11, *23, *28) имеют статус устойчивых (У), четыре
(*8, *16, *22, *24) - чувствительных (Ч), а остальные сорок семь аллелей
относятся к нейтральным по отношению к лейкозу КРС. Таким образом, теоретически
аллели должны иметь следующие частоты встречаемости: (У) - 5,6 %, (Ч) - 7,4 %,
(Н) - 87,0 %. Но мы наблюдаем совершенно иное распределение в исследуемом стаде
- смещение в сторону Ч - аллелей и элиминацию 60 % Н - аллелей. При
сопоставлении эмпирических частот с ожидаемыми мы можем установить
достоверность или случайность наблюдаемого между ними расхождения с помощью
критерия c², предложенного К.
Пирсоном в 1900 г.
(p
- p΄)²
c² = ∑ ────
(2)
p΄
Этот критерий представляет сумму квадратов
отклонений эмпирических частот (p)
от частот ожидаемых (p΄),
отнесенную
к ожидаемым частотам (p΄)
(формула
2) [Лакин, 1980] (таблица 5).
Таблица 5 − Расчет критерия c²
в
исследуемом стаде
|
Аллели
|
Частоты
|
(p- p΄)
|
(p - p΄)²
|
(p - p΄)²/
p΄
|
c²
|
|
эмпирические
(p)
|
ожидаемые
(p΄)
|
|
|
|
|
|
Н
|
26,1
|
87,0
|
-60,9
|
3708,81
|
42,63
|
360,13
|
|
Ч
|
52,2
|
7,4
|
44,8
|
2007,04
|
271,22
|
|
|
У
|
21,7
|
5,6
|
16,1
|
259,21
|
46,28
|
|
Таблица 6 − Частоты встречаемости
отдельных аллелей BoLA DRB3 в стаде и исследуемой выборки
|
Статус
аллели по отношению к лейкозу КРС
|
Аллель
BoLA DRB3
|
Частота
встречаемости аллелей в выборке (N=115)
|
|
|
%
|
носителей,
N
|
|
Ч
|
8
|
6,2
|
13
|
|
16
|
17,1
|
31
|
|
22
|
15,8
|
32
|
|
24
|
13,6
|
29
|
|
У
|
11
|
6,5
|
15
|
|
23
|
14,5
|
29
|
|
28
|
0,9
|
2
|
|
3
|
3,0
|
7
|
|
7
|
0,9
|
2
|
|
9
|
0,4
|
1
|
|
10
|
6,9
|
15
|
|
12
|
3,9
|
7
|
|
13
|
0,4
|
1
|
|
Н
|
14
|
0,4
|
1
|
|
15
|
0,9
|
2
|
|
18
|
0,4
|
1
|
|
25
|
5,2
|
11
|
|
26
|
0,9
|
2
|
|
27
|
2,1
|
4
|
В нашем случае фактически полученная величина c²
равна
360,13, что во много раз превышает критическое значение c²
= 5,99, для
5 % - го (Р = 0,05) уровня значимости. Таким образом, нулевая гипотеза, т.е.
предположение о том, что расхождение между эмпирическими и ожидаемыми частотами
носит случайный характер, опровергается. Это говорит о том, что в результате
искусственного отбора действовали довлеющие факторы, которые и привели к такому
резкому смещению генного равновесия в сторону чувствительных аллелей.
Из 54 известных аллелей гена BoLA DRB3 в
исследуемом стаде (N=115) было обнаружено девятнадцать аллелей. Причем
известные на сегодняшний день чувствительные (BoLA DRB3*8, 16, 22, 24) и
устойчивые (BoLA DRB3*11, 23, 28) аллели все встретились в исследуемом стаде, а
нейтральные аллели встретились частично. Из таблицы 3 видно, что самыми
распространенными из чувствительных аллелей являются BoLA DRB3*22 (15,8 %),*16
(17,1 %) и *24 (13,6 %), из устойчивых - *23 (14,5 %), из нейтральных - *3 (3,0
%), *10 (6,9 %), *25 (5,2 %).
.2 Качественные и
количественные показатели молочной продуктивности черно - пестрых голштинских
коров и их взаимосвязь с генотипом по гену BoLA
DRB 3
В настоящее время черно-пестрый голштинский скот
- самый распространенный в мире. Этому способствует его высокая продуктивность,
хорошая пригодность к машинному доению и приспособленность к промышленной
технологии содержания. Голштино-фризский скот широко используется для
разведения во всех зонах России, что говорит о высокой продуктивности и
адаптационной способности этой породы [Сошенко, Сафонова, Кухарская, 2005].
Но внутри породы, или даже одного стада,
показатели молочной продуктивности варьируют. Нами была изучена продуктивность
в исследуемой выборке (n=115),
состоящей из шести групп, сформированных по итогам генотипирования по гену BoLA
DRB3.
Часто выборочные характеристики не
совпадают по абсолютной величине с соответствующими генеральными параметрами.
Величина отклонения выборочного показателя от его генерального параметра
называется статистической ошибкой этого показателя, или ошибкой
репрезентативности. Эти ошибки возникают в процессе отбора вариант из генеральной
совокупности и к ошибкам измерений отношения не имеют. Величина ошибки
репрезентативности измеряется средним квадратическим отклонением ( ), и чем
сильнее варьирует признак, тем больше величина этого показателя.
), и чем
сильнее варьирует признак, тем больше величина этого показателя.
О близости выборочной средней к
генеральному параметру можно судить по отношению ошибки репрезентативности к
сопровождаемой ею средней величине (Cs). Точность
средних показателей, которыми оцениваются результаты наблюдений, считается
вполне удовлетворительной, если коэффициент Cs не
превышает 3-5%.
Таблица 7 − Количественные
показатели молочной продуктивности
|
I лактация
|
|
Генотип
|
Количество измерений
|
Продуктивность,
кг/сут.,  ± ± Cs
(%)Продуктивность, (кг/305 дн. лактации) Cs
(%)Продуктивность, (кг/305 дн. лактации)
|
|
|
|
(Ч/Ч),
N=30
|
235
|
24,8**
± 0,62
|
2,5
|
7398
|
|
(Ч/У),
N=30
|
225
|
26,0
± 0,69
|
2,6
|
7685
|
|
(Ч/Н),
N=30
|
222
|
23,9***
± 0,80
|
3,3
|
|
(У/У),
N=5
|
30
|
25,5
± 1,39
|
5,4
|
7604
|
|
(Н/Н),
N=10
|
62
|
26,5
± 1,09
|
4,1
|
7860
|
|
(Н/У), N=10
|
57
|
24,5*
± 0,84
|
3,4
|
7306
|
|
Итого,
N=115
|
831
|
25,0±0,35
|
1,4
|
7447
|
|
II лактация
|
|
(Ч/Ч),
N=26
|
239
|
24,1***
± 0,91
|
3,7
|
7203
|
|
(Ч/У),
N=28
|
268
|
26,2
± 0,63
|
2,4
|
7831
|
|
(Ч/Н),
N=23
|
211
|
23,9***
± 1,04
|
4,3
|
7143
|
|
(У/У),
N=5
|
42
|
25,2
± 1,06
|
4,2
|
7532
|
|
(Н/Н),
N=8
|
80
|
26,0
± 0,98
|
3,7
|
7771
|
|
(Н/У), N=9
|
90
|
24,4**
± 0,67
|
2,7
|
7293
|
|
Итого,
N=99
|
930
|
24,9 ± 0,40
|
1,6
|
7442
|
Примечание: здесь и далее: * - p<0.05;
** - p<0.01; ***- p<0.001.
Достоверность различий определялась относительно группы Ч/У.
Данные, приведенные в таблице 7 , по I
и II лактациям
исследуемых животных показывают превосходство по количественным показателям
молочной продуктивности в группах Ч/У, У/У и Н/Н, но так как две последние
группы довольно малочисленны по своему составу и, к тому же, имеют одни из
самых высоких показателей репрезентативных ошибок (по I
лактации: У/У - 1,39; Н/Н - 1,09; по II
лактации: 1,06 и 0,98 соответственно), целесообразным будет определение
достоверности различий выборочных средних, используя критерий Стьюдента,
относительно группы Ч/У.
Таким образом, группа Ч/У (26,0-26,2
кг/сут) превосходит по молочной продуктивности группы Ч/Ч (24,8-24,1 кг/сут),
Ч/Н (23,9 кг/сут) и У/Н (24,5-24,4 кг/сут), достоверно от них отличаясь и имея
при этом наименьшее значение ошибки репрезентативности  (0,63-0,69).
В пересчете на 305 дней лактации животные генотипа Ч/У дают молока на 287-544
кг больше в I лактации и
на 628-688 кг больше во II лактации, в отличие от животных
генотипов Ч/Н и Ч/Ч. Животные с генотипом Ч/Ч имеют не самые низкие показатели
молочной продуктивности, но во II лактации они немного
снижаются (24,8 Þ 24,1
кг/сут), видимо, вследствие более частого поражения инфекционными
заболеваниями. Наименьшая молочная продуктивность отмечена в группе животных с
генотипом Ч/Н (23,9 кг/сут), причем эти животные изначально имеют низкий
продуктивный потенциал и, к тому же, чаще остальных подвергаются выбраковке по
причине инфекционных заболеваний.
(0,63-0,69).
В пересчете на 305 дней лактации животные генотипа Ч/У дают молока на 287-544
кг больше в I лактации и
на 628-688 кг больше во II лактации, в отличие от животных
генотипов Ч/Н и Ч/Ч. Животные с генотипом Ч/Ч имеют не самые низкие показатели
молочной продуктивности, но во II лактации они немного
снижаются (24,8 Þ 24,1
кг/сут), видимо, вследствие более частого поражения инфекционными
заболеваниями. Наименьшая молочная продуктивность отмечена в группе животных с
генотипом Ч/Н (23,9 кг/сут), причем эти животные изначально имеют низкий
продуктивный потенциал и, к тому же, чаще остальных подвергаются выбраковке по
причине инфекционных заболеваний.
Качественные показатели молока
показаны в таблице 14.
При исследовании качественных
показателей молочной продуктивности достоверных отличий установлено не было, за
исключением двух моментов: во II лактации достоверно
отличались показатели содержания в молоке белка в группах Ч/У (2,99 г/л) и Н/Н
(2,91 г/л) и лактозы Ч/У (4,52 г/л) и У/У (4,42 г/л).
Была исследована связь молочной
продуктивности и отдельных генотипов.
Таблица 8 − Качественные
показатели молочной продуктивности
|
I лактация
|
|
Генотип
|
Качественные
показатели молочной продуктивности
|
Жир, %  ±
± Белок, г/л
Белок, г/л
 ±
± Лактоза, г/л
Лактоза, г/л
 ±
± Сухое в-во, г/л
Сухое в-во, г/л
|
 ± ±
|
|
|
|
|
|
(Ч/Ч),
N=30
|
3,43
± 0,18
|
2,90
± 0,08
|
4,53
± 0,03
|
11,84
± 0,25
|
|
(Ч/У),
N=30
|
3,33
± 0,24
|
2,79
± 0,12
|
4,52
± 0,04
|
11,67
± 0,28
|
|
(Ч/Н),
N=30
|
3,52
± 0,19
|
2,79
± 0,08
|
4,52
±0,04
|
11,82
± 0,22
|
|
(У/У),
N=5
|
3,35
± 0,38
|
2,69
± 0,12
|
4,52
± 0,09
|
10,85
± 1,53
|
|
(Н/Н),
N=10
|
3,52
± 0,33
|
2,71
± 0,12
|
4,55
± 0,03
|
11,79
± 0,35
|
|
(Н/У),
N=10
|
3,85
± 0,53
|
2,88
± 0,13
|
4,54
± 0,07
|
12,29
± 0,62
|
|
Итого,
N=115
|
3,46
± 0,10
|
2,82
± 0,05
|
4,52
± 0,02
|
11,78
± 0,14
|
|
II лактация
|
|
(Ч/Ч),
N=26
|
3,44
± 0,14
|
2,95
± 0,05
|
4,50
± 0,02
|
11,71
± 0,12
|
|
(Ч/У),
N=28
|
3,28
± 0,13
|
2,99
± 0,04
|
4,52
± 0,02
|
11,38
± 0,48
|
|
(Ч/Н),
N=23
|
3,46
± 0,16
|
2,96
± 0,08
|
4,50
± 0,03
|
11,73
± 0,14
|
|
(У/У),
N=5
|
3,03
± 0,36
|
2,94
± 0,21
|
4,42**
± 0,08
|
11,16
± 0,25
|
|
(Н/Н),
N=8
|
3,55
± 0,39
|
2,91*
± 0,07
|
4,50
± 0,04
|
11,79
± 0,37
|
|
(Н/У), N=9
|
3,57
± 0,43
|
2,95
± 0,20
|
4,53
± 0,08
|
12,03
± 0,44
|
|
Итого,
N=99
|
3,41
± 0,08
|
2,96
± 0,03
|
4,50
± 0,01
|
11,64
± 0,14
|
|
P<0.05; ** - P<0.01;
Достоверность различий определялась относительно группы Ч/У.
|
Определены среднесуточные удои по каждому Ч/Ч
генотипу, за исключением генотипов 16*22, 8*8 и 8*22, как редко встречаемых.
Признак варьировал в пределах 22,6 - 28,2 кг/сут. Но так как коэффициент Cs
(точность средних показателей) для групп животных с генотипами 16*8, 22*22,
24*24 и 24*8 превышал допустимый предел 5%, то при установлении достоверности
отличий эти группы во внимание не брались. А между группами с генотипами 16*16,
16*24 и 22*24 достоверных отличий выявлено не было.
Таблица 9 − Показатели продуктивности животных
генотипов Ч/Ч по локусу BoLA
DRB 3
|
Показатели
|
Генотип
Ч/Ч по локусу BoLA DRB3
|
|
16*16
|
16*24
|
16*8
|
22*24
|
22*22
|
24*24
|
24*8
|
|
Количество
измерений
|
63
|
32
|
22
|
40
|
32
|
14
|
14
|
|
Среднесуточный
удой, кг (M ± m)
|
25,3±0,98
|
25,3±1,04
|
22,6±2,0
|
24,9±1,17
|
22,8±1,80
|
28,2±4,76
|
22,9±2,67
|
|
Cs (%)
|
3,8
|
4,1
|
8,8
|
4,6
|
7,8
|
16,8
|
11,6
|
Подобные расчеты были проведены и для групп Ч/У
и Ч/Н.
Таблица 10 − Показатели продуктивности
животных генотипов Ч/У по локусу BoLA
DRB 3
|
Показатели
|
Генотип
Ч/У по локусу BoLA DRB3
|
|
22*23
|
23*24
|
16*11
|
24*11
|
22*11
|
16*23
|
11*8
|
|
Количество
измерений
|
47
|
67
|
23
|
22
|
22
|
15
|
11
|
|
Среднесуточный
удой, кг (M ± m)
|
24,8±1,65
|
26,3±1,17
|
25,4±1,34
|
26,5±1,46
|
25,4±2,25
|
28,6±2,53
|
28,7±1,95
|
|
Cs (%)
|
6,6
|
4,4
|
5,2
|
5,5
|
8,8
|
8,8
|
6,7
|
В группе Ч/У среднесуточная продуктивность варьирует
в пределах 24,8 - 28,7 кг, но достоверность отличий между подгруппами различных
генотипов Ч/У определить не представляется возможным по причине высоких
значений коэффициента Cs.
Таблица 11 − Показатели продуктивности
животных генотипов Ч/Н по локусу BoLA
DRB 3
|
Показатели
|
Генотип
Ч/Н по локусу BoLA DRB3
|
|
22*25
|
16*10
|
10*24
|
16*26
|
25*16
|
12*22
|
22*3
|
|
Количество
измерений
|
29
|
23
|
21
|
15
|
15
|
13
|
14
|
|
Среднесуточный
удой, кг (M ± m)
|
28,4±1,45
|
23,8±1,59
|
25,6±2,09
|
28,3±2,12
|
22,0±3,23
|
23,1±1,90
|
25,4±2,14
|
|
Cs (%)
|
5,1
|
6,6
|
8,1
|
7,4
|
14,6
|
8,2
|
8,4
|
Среди генотипов группы Ч/Н признак
продуктивности сильно варьирует в пределах 22,0 - 28,4 кг/сут. Но высокие
значения коэффициента Cs
не позволяют определить достоверность отличий по молочной продуктивности между
группами животных, относящихся к различным генотипам Ч/Н.
Таким образом, можно предположить, что отдельные
генотипы достоверно на молочную продуктивность не влияют.
3.3 Частота
встречаемости генотипов по гену каппа-казеина и взаимосвязь генотипа с
показателями молочной продуктивности у чёрно-пёстрых голштинских коров
Изучаемая выборка коров (n=115)
была также исследована по гену каппа - казеина и по итогам генотипирования
разделена на три группы - АА, АВ и ВВ. Были определены частоты встречаемости
каждого генотипа. В свою очередь, каждая из групп была разбита на подгруппы в
зависимости от принадлежности к тому или иному генотипу по BoLA
DRB3.2, в каждой из которых были посчитаны среднесуточные показатели молочной
продуктивности, данные представлены в таблице 12.
Таблица 12 − Количественные показатели
молочной продуктивности коров различных генотипов по гену каппа - казеина
|
АА
|
АВ
|
ВВ
|
|
%
|
 ± ± Cs (%)% Cs (%)% ± ± Cs (%)% Cs (%)% ± ± Cs (%) Cs (%)
|
|
|
|
|
|
|
|
|
Ч/Ч
|
20,2
|
25,2±0,89
|
3,5
|
4,3
|
22,6±1,71
|
7,5
|
1,7
|
25,9±2,63
|
10,1
|
|
Ч/У
|
15,7
|
25,8±0,82
|
3,1
|
10,4
|
26,1±1,45
|
5,5
|
-
|
-
|
-
|
|
Ч/Н
|
14,9
|
22,9***±0,80
|
3,4
|
11,2
|
25,0±1,03
|
4,1
|
-
|
-
|
-
|
|
У/У
|
4,3
|
25,6±1,84
|
7,1
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Н/Н
|
8,7
|
26,4±0,46
|
1,7
|
-
|
-
|
-
|
-
|
-
|
-
|
|
У/Н
|
4,3
|
25,3±0,92
|
3,6
|
4,3
|
23,0±0,12
|
0,5
|
-
|
-
|
-
|
|
выборка
|
68,1
|
25,0±0,41
|
1,6
|
30,2
|
24,9±0,73
|
2,9
|
1,7
|
25,9±2,63
|
10,1
|
Из таблицы 14 видно, что наиболее встречаемыми
являются генотипы группы АА (68,1%), менее встречаемыми - ВВ (1,7%),
гетерозиготный генотип АВ по частоте встречаемости занимает среднее положение
(30,2%). В свою очередь, в группе АА чаще остальных встречаются генотипы Ч/Ч,
Ч/У и Ч/Н (20,2%, 15,7% и 14,9%, соответственно). В группе АВ часто
встречаемыми являются генотипы Ч/У (10,4%) и Ч/Н(11,2%). Генотипы У/У и У/Н в
группе АВ вообще не встречаются. А в группе ВВ встречаются лишь животные
генотипа Ч/Ч.
В группе АА наибольшую продуктивность имеют
животные генотипа Н/Н, но так как группа АА-Н/Н имеет довольно невысокую
частоту встречаемости и по продуктивности достоверно не отличаются от группы
АА-Ч/У, то достоверность отличий по молочной продуктивности оценивалась
относительно группы АА-Ч/У.
Таким образом, продуктивность группы АА-Ч/Н
(22,9 кг/сут.) имеет более низкую молочную продуктивность, которая с высокой
степенью достоверности отличается от группы АА-Ч/У (25,8 кг/сут). Животные
остальных генотипов в группе АА достоверных отличий по показателям молочной
продуктивности относительно группы АА-Ч/У не имеют. В группе АВ наиболее
продуктивными являются животные генотипов Ч/У и Ч/Н, причем они достоверно
превосходят по молочной продуктивности животных с генотипами Ч/Ч и У/Н. Но так
как в группах АВ-Ч/Ч и АВ-Ч/У коэффициент Cs
превышает допустимые пределы, то со стопроцентной долей уверенности мы не можем
утверждать о достоверности отличий по молочной продуктивности между различными
генотипами по гену BoLA
DRB 3 в пределах
группы каппа - казеинового генотипа АВ.
А в самой малочисленной группе ВВ
встречаются только животные Ч/Ч генотипа, среднесуточная продуктивность которых
составляет 25,9 кг/сут, но значения  (ошибки средней) и Cs
(коэффициента точности определения средней) высоки, что говорит о довольно
большом разбросе данных в пределах этой группы. А это, в свою очередь, не
позволяет сравнивать показатели молочной продуктивности животных группы ВВ с
животными групп АА и АВ, которые между собой также достоверно не отличаются.
Таким образом, по количественным показателям молочной продуктивности, все
генотипы (АА, АВ и ВВ) гена каппа-казеина равнозначны.
(ошибки средней) и Cs
(коэффициента точности определения средней) высоки, что говорит о довольно
большом разбросе данных в пределах этой группы. А это, в свою очередь, не
позволяет сравнивать показатели молочной продуктивности животных группы ВВ с
животными групп АА и АВ, которые между собой также достоверно не отличаются.
Таким образом, по количественным показателям молочной продуктивности, все
генотипы (АА, АВ и ВВ) гена каппа-казеина равнозначны.
Изучение качественных показателей
молочной продуктивности представлено в таблице 13.
Из таблице 15 видно, что группа
ВВ-Ч/Ч по содержанию жира в молоке достоверно уступает группе АВ-Ч/Ч. Группа
АА-Ч/У достоверно уступает группе АВ-Ч/У. По содержанию белка в молоке группа
АА-Ч/Ч достоверно уступает группе АВ-Ч/Ч. По содержанию сухого вещества группа
АВ-Ч/Ч достоверно превосходит группу ВВ-Ч/Ч, а группа АВ-Ч/У - группу АА-Ч/У. В
остальных группах достоверных отличий выявлено не было.
Таблица 13 − Качественные показатели
молочной продуктивности коров различных генотипов по гену каппа - казеина
|
генотип
|
Кач.пок-ли
|
Ч/Ч
|
Ч/У
|
Ч/Н
|
У/У
|
Н/Н
|
У/Н
|
|
АА
|
Ж
|
3,44±0,22
|
3,22*±0,18
|
3,51±0,17
|
3,35±0,68
|
3,52±0,21
|
3,78±0,23
|
2,84**±0,07
|
2,75±0,07
|
2,76±0,07
|
2,69±0,15
|
2,71±0,09
|
2,92±0,08
|
|
Л
|
4,52±0,04
|
4,51±0,03
|
4,48±0,04
|
4,52±0,13
|
4,55±0,10
|
4,56±0,05
|
|
С/В
|
11,83±0,23
|
11,52**±0,18
|
11,83±0,16
|
10,85±0,62
|
11,79±0,12
|
12,22±0,31
|
|
АВ
|
Ж
|
3,50*±0,01
|
3,49*±0,15
|
3,54±0,14
|
-
|
-
|
3,92±0,30
|
|
Б
|
3,20**±0,42
|
2,85±0,12
|
2,84±0,06
|
-
|
-
|
2,83±0,05
|
|
Л
|
4,56±0,05
|
4,53±0,03
|
4,57±0,03
|
-
|
-
|
4,52±0,14
|
|
С/В
|
12,21*±0,24
|
11,91**±0,14
|
11,82±0,11
|
-
|
-
|
12,35±0,20
|
|
ВВ
|
Ж
|
3,20*±0,22
|
-
|
-
|
-
|
-
|
-
|
|
Б
|
2,90±0,01
|
-
|
-
|
-
|
-
|
-
|
|
Л
|
4,55±0,06
|
-
|
-
|
-
|
-
|
-
|
|
С/В
|
11,14*±0,90
|
-
|
-
|
-
|
-
|
-
|
Таким образом, наилучшими качественными
показателями молока обладают животные, имеющие генотип АВ по гену
каппа-казеина.
3.4 Повышение частоты
встречаемости оптимального в хозяйственном отношении генотипа
Представленные выше исследования и расчеты
показывают преобладание в изучаемой выборке и стаде в целом чувствительных (Ч)
аллелей, которые, по всей вероятности, являются маркером повышенной молочной
продуктивности. Ведь именно в этом направлении ведется селекция в молочном
скотоводстве. Но в случае с западными странами, где преобладающее большинство
ферм и хозяйств являются свободными от вирусоносительства лейкоза крупного
рогатого скота и других опасных инфекционных заболеваний, такой отбор, а как
следствие этого - накопление чувствительных аллелей, приводит к повышению
показателей молочной продуктивности и увеличению экономического эффекта. В
наших хозяйствах, где процент инфицированности тем же вирусом лейкоза крупного
рогатого скота (ВЛКРС) достигает в отдельных регионах 70-90%, животные с таким
генетическим потенциалом чаще других поражаются инфекционными заболеваниями,
теряют продуктивность с каждой лактацией, попадают в группу больных и вовсе
выбраковываются из стада. В связи с этим, для того чтобы добиться повышения
молочной продуктивности, необходимо повысить резистентность животных к
инфекционным заболеваниям, путем увеличения частоты встречаемости устойчивых
(У) аллелей в популяции, а именно - Ч/У генотипа. Так как этот генотип, как
нами было установлено, является наиболее выгодным в хозяйственном отношении,
потому что сочетает в себе Ч - аллель как маркер повышенной молочной
продуктивности и У-аллель как маркер хорошего иммунитета. Для селекционной
практики установленная закономерность важна как возможность моделирования
очередных поколений животных с высокой частотой встречаемости выгодного генотипа.
Располагая данными по частотам встречаемости генотипа BoLA
DRB3 у
быков-производителей и у маточного поголовья, можно предсказать генетическую
структуру по этому локусу в следующем поколении животных.
Так, например, для коров с генотипами Ч/Ч, Н/Н,
Ч/Н можно подобрать быков У/У; с генотипами У/У, У/Н, Ч/У - быков Ч/Ч.
Но периодически всё же необходимо отклоняться от
предложенной схемы закрепления с целью повышения гетерогенности популяции,
чтобы избежать обеднения генетического разнообразия, ведь именно генетическое
разнообразие между индивидами - основной фактор выживания популяции при
постоянно меняющихся условиях окружающей среды [Терлецкий, 2007]. В то время
как гомозиготность животных по локусу BoLA DRB3, предполагает наличие в
генотипе идентичных генетических блоков, отвечающих за продуктивные качества, и
может привести к резкому снижению эффективности селекционного процесса за счёт
гомогенности исходного материала. Как показывают исследования ряда авторов, в
стадах животных голштинской и айрширской пород обозначенные тенденции уже имеют
место, негативно сказываясь на сохранности и продуктивности поголовья [Ковалюк,
Шостак, Сацук, 2005].
ЗАКЛЮЧЕНИЕ
По результатам работы сделаны следующие выводы.
1. По гену BoLA
DRB3 в ЗАО «Племзавод Колос» было прогенотипировано 115 коров голштинской
породы. Определено, что генное равновесие смещено в сторону аллелей, имеющих
статус Ч - чувствительных по отношению к персистентному лимфоцитозу (Ч -
аллелей - 52,2 %, Н - 26,1 %, У - 21,7 %).
. Определено, что наиболее ценным в
хозяйственном отношении генотипом является Ч/У, сочетающий в себе Ч - аллель
как маркер повышенной молочной продуктивности и У - аллель - показатель
хорошего иммунитета. В пересчете на 305 дней лактации животные генотипа Ч/У
дают молока на 287-544 кг больше в I
лактации и на 628-688 кг больше во II
лактации, в отличие от животных генотипов Ч/Н и Ч/Ч. Было так же определено,
что не отдельные аллели, а именно их конкретные сочетания влияют на показатели
молочной продуктивности коров.
. Определены генотипы по гену каппа - казеина и
установлено, что генное равновесие смещено в сторону гомозиготного АА генотипа.
Достоверных отличий по количественным показателям молочной продуктивности между
животными различных генотипов (АА, АВ и ВВ) по гену каппа - казеина выявлено не
было. По качественным показателям молока гетерозиготный генотип АВ достоверно
превосходит гомозиготные генотипы АА и ВВ.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1
Богданов Г.А. Кормление сельскохозяйственных животных. М., Агропромиздат. 1990.
265 с.
Борисовец
К.Ф., Краско В.Е., Рыткина З.П.. Качество молока и эффективность его
производства. Минск: Ураджай, 1978. 142 с.
Глазко
В.И. Полиморфизм молекулярно-генетических маркеров у домашней лошади и лошади
Пржевальского // Тез. докл. II международной научн. конф.: Биотехнология в
животноводстве и ветеринарии. М., 2000. С. 151-152.
ДНК-полиморфизм
гена BoLA-DRB 3 у крупного рогатого скота в связи с устойчивостью и
восприимчивостью к лейкозу / Г. Е. Сулимова [и др.] // Генетика. 1995. №. 9.
С.1294-1299.
Жебровский
Л.С. Селекционно-генетические основы белкового состава молока коров. М. Колос.
1973. 248 с.
Калашникова
Л.А., Дунин И.М., Глазко В.И. // ДНК-технологии оценки сельскохозяйственных
животных. Московская область, Лесные Поляны: Изд-во ВНИИплем, 1999. С 89-94.
Ковалюк
Н.В., Сацук В.Ф., Мачульская Е.В. Использование генетических маркеров для
повышения молочной продуктивности коров // Зоотехния. 2007. № 8. С.2-4
Кравченко
Н.А. Разведение сельскохозяйственных животных. М., 1973. 234 с.
Лакин
Г.Ф. Биометрия. М., 1980. 293 с.
Меркурьева
Е.К. Биометрия в селекции и генетике сельскохозяйственных животных. М., 1979.
423 с.
Молекулярно
- генетическая оценка гетерозиготности в популяциях сельскохозяйственных
животных / В. П. Терлецкий [и др.] // Материалы международной научной
конференции «Современные методы генетики и селекции в животноводстве». СПб.,
2007. С. 273-277.
Петров
Р.В. Иммунология. М., 1982. 368 с.
Плохинский,
Н.А. Биометрия. М., 1970. 367 с.
Плохинский,
Н.А. Руководство по биометрии для зоотехников. М., 1969. 256 с.
Полиморфизм
белков и анонимных последовательностей ДНК в оценке генетической дифференциации
видов Ovis / Глазко В.
И. [и др.] // Третья междунар. конфер. «Актуальные проблемы биологии в
животноводстве» ВНИИФиБП. Боровск, 2000. С. 389-391.
Селекционно-генетический
способ создания высокопродуктивного и устойчивого к персистентному лимфоцитозу
крупного рогатого скота / Н. В. Ковалюк [и др.] // Вестник РАСХН. 2005. № 6.
С.67-69.
Сошенко
Л.П., Сафонова А.П., Кухарская А.Г. Резистентность животных и её значение в
молочном животноводстве // Вестник Рос. ун-та дружбы народов. Сер. с.-х. н.
2005. №12. С. 51-61.
Сулимова
Г.Е., Шайхаев Г.О., Берберов Э.М. Генотипирование локуса каппа - казеина у
крупного рогатого скота с помощью полимеразной цепной реакции // Генетика.
1991. Т. 27. С. 2053-2062.
Тузов
И.Н., Гнатышак С.А. Взаимосвязь хозяйственно полезных признаков у
голштинизированных коров // Труды Кубанского аграрного университета. Краснодар,
2005. Вып. 414 (442). С. 15-19.
Тузов
И.Н., Одабашян Х.А. Результаты совершенствования красной степной породы
голштинскими красно-пёстрыми быками // Труды Кубанского аграрного университета.
Краснодар, 2005. Вып. 414 (442). С. 24-27.
Удина
И.Г. Гены главного комплекса гистосовместимости человека и животных // Успехи
современной генетики. 1994. № 19. С. 133-177.
Херингтон
С. Молекулярная клиническая диагностика. Методы. М., 1999. 558 с.
Юхманова
Н., Калашникова Л. Влияние каппа-казеина на качество молока и его
сыропригодность // Молочное и мясное скотоводство. 2004.
№ 8. С
24-25.
24 Associations of the bovine major
histocompatibility complex DRB3 (BoLA DRB3) wish production traits in Canadian
dairy cattle / S. Sharif
<http://www.elibrary.ru/author_items.asp?authorid=770622> [et al.] //
Animal Genetics <http://www.elibrary.ru/issues.asp?id=2464&selid=207933>.
1999. № 30. Р.
157-160
Cloning of cDNAs and the molecular
evolution of a bovine MHC class II DRA gene / Y. Aida [et al.] // Biochemical
and Biophysical Research Communications. 1994. V. 204. P. 195-202.
Elsik C. G. The genome sequence of
taurine cattle: A window to ruminant biology and evolution // Science. 2009. V.
324. P. 522-528.
Ferretti L., Leone P., Sagarmella V.
Long range restriction analysis of the bovine casein genes // Nucleic Acids
Research. 1990. V. 18. P. 6829-6833.
Hediger R., Ansari H.A., Stranzinger
G.F. Chromosome banding and gene localizations support extensive conservation -
of chromosome structure between cattle and sheep // Cytogenet Cell Genet. 1991.
V. 57(2-3). P. 127-34.
Lewin H.A., Russel G.C., Glass E.J.
Comparative organization and function of the major histicompatibility complex
of domesticated cattle // Immunol. Rev. 1999. V. 167. P. 145-158.
Miretti M.M., Ferro J.A. Restriction
fragment length polymorphism (RLFP) in exon 2 of the BoLA DRB 3 gene in South
American cattle // Biochem Genet. 2001. № 39. Р. 311-324.
Scott P.C., Choi C.L., Brandon M.R.
Genetic organization of the ovine MHC class II region // Immunogenetics 1987.
V.25. P.116-122.
The impact of genetic polymorphisms
on the protein composition of ruminant milks / P. Martin [et al.] //
Reproduction Nutrition Development. 2002. V. 42. P. 433-459.
The nucleotide sequence of bovine
MHC class II DQB and DRB genes / M.A.M Groenen [et al.] // Immunogenetics.
1990. №31. P. 37.
Van Eijk M.J.T., Stewart-Haynes
J.A., Lewin H.A. Extensive polymorphism of the BoLA DRB3 gene distinguished
PCR-RFLP // Anim. Genet. 1992. V . 23. P. 483-496.
Xu A., Van Eijk V.J. T., Park Ch.
Polymorphism in BoLA-DRB3 Exon 2 correlates with resistance to persistent
lymphocytosis caused by bovine leukemia virus. // J. of Immunology. 1993.V.
151. № 12. Р.
6977-6985.