Световая депривация не влияет на характер протекания регенерации глаза гигантской африканской улитки Achatina fulica
Световая
депривация не влияет на характер протекания регенерации глаза гигантской африканской
улитки Achatina fulica
О.С.
Тартаковская, С.Л. Борисенко, В.В. Жуков
Исследовали
морфо-функциональную регенерацию периферического отдела зрительной системы
брюхоногого моллюска Achatina fulica в условиях постоянного освещения и
световой депривации. Показано, что свет не является лимитирующим фактором и не
оказывает модулирующего воздействия на протекание регенерации глаза моллюска.
Введение
Свет
является жизненно важным и лимитирующим экологическим фактором организмов и их
сообществ [3]. При этом влияние этого фактора на протекание процессов
регенерации мало изучено. Известно, что содержание при разных световых режимах
влияет на скорость регенерации хвоста у ящериц Hemidactylus flaviviridis [13]
таким образом, что длинный фотопериод стимулирует процесс регенерации, а
короткий – замедляет. Световая депривация несколько замедляет регенерацию
оптического нерва у золотых рыбок Carassius auratus по сравнению с особями,
содержащимися при стандартных световых условиях [12]. Сведения о влиянии
депривации света на регенерацию глаза у брюхоногих моллюсков крайне скудны.
Gillary [10] отмечает, что содержание моллюсков Strombus luhuanus с удаленными
щупальцами в постоянной темноте не оказывает принципиального влияния на течение
регенерации. По крайней мере, не изменяется ни форма электрических ответов
глаза на световую стимуляцию (ЭРГ), ни спектральная чувствительность глаза.
Исследования процессов структурной регенерации глаза и его электрических
ответов проводились и на других видах улиток [9, 10], однако вопрос о влиянии
световой депривации на течение регенерации не изучался.
В
отношении регенерации органа зрения гигантская африканская улитка Achatina
fulica выделяется особо. У сравнительно взрослых особей этого моллюска после
удаления оптического щупальца восстановление глаза протекает с аномалиями [5,
8], которые выражаются в различного вида отклонениях структуры вновь
образующегося глаза от нормальной, а также в появлении нескольких (2 – 3)
структурно независимых глаз. Представлялось логичным выяснить, не является ли
свет дополнительным к возрасту фактором, определяющим течение процесса
регенерации. Были поставлены задачи: определить, влияет ли световая депривация
на скорость и полноту регенерации структуры глаза A. fulica, а также на ЭРГ
регенерировавших глаз.
Методики и материалы
Объект
исследования. Опыты проводили на особях лабораторной культуры Achatina fulica.
Улиток содержали в частично затененных террариумах в специально оборудованном
помещении при поддерживаемых температуре (26 – 28 °С), влажности воздуха (98 – 100 %) и постоянных условиях
освещения (две лампы дневного света ЛБ-40). Моллюсков кормили морковью,
капустой, листьями одуванчика, яичной скорлупой 2 – 3 раза в неделю, 1 – 2 раза
в месяц животных мыли и производили замену грунта (песок). Плотность содержания
молодых животных не превышала 100 особей на 1 м2.
Были
сформированы две экспериментальные и две контрольные группы только что вышедших
из яйцевой капсулы животных, по десять моллюсков в каждой группе. Животные
первой экспериментальной и первой контрольной группы содержались при
круглосуточном освещении (две лампы дневного света ЛБ-40), животные второй
экспериментальной и второй контрольной группы содержались в темноте.
Удаление
оптических щупалец проводили через одну неделю после вылупления моллюсков в
обеих экспериментальных группах животных. Визуально определяли количество
щупалец, содержавших регенерировавшие глаза, через одну, две и три недели, а
также через месяц после операции.
Гистология
и морфометрия регенерировавших и нативных глаз. Фиксацию дистальной части
оптического щупальца проводили в жидкости Буэна, заливку в парафин проводили по
стандартной методике [2, 4]. Срезы толщиной 3 – 4 мкм изготавливали на санном
микротоме МС. Препараты окрашивали гематоксилин-гемаляумом или гематоксилином
по Генденгайну.
Полученные
препараты рассматривали при помощи микроскопа БИОЛАМ-70, фотографировали на
цифровую камеру и на фотографическую пленку. Измерения при помощи
окуляр-микрометра проводили на трех последовательных максимальных по размеру
срезах каждого глаза. Измеряемые параметры:
–
максимальные размеры главного глаза в длину (Lгл) и ширину (Hгл);
–
длина (Lхр) и ширина (Hхр) хрусталика главного глаза;
–
толщина капсулы глаза (hкап); роговицы (hрог); пигментного (hпигм), ядерного
(hяд) и микровиллярного (hмик) слоев сетчатки главного глаза.
Электрофизиология.
Регистрировали электрические ответы нативных и регенерировавших глаз на
предъявление парных вспышек света.
Отсеченное
глазное щупальце помещали в ванночку с физиологическим раствором. Дальнейшее
приготовление препарата проводили под источником красного света с тепловым фильтром.
Глазной бокал очищали от окружающих тканей и по возможности ориентировали
роговицей в направлении стимулирующего светового потока. Приготовленный
препарат глаза оставляли в экспериментальной камере на 30 минут для темновой
адаптации.
Регистрацию
электрических сигналов глаза осуществляли стеклянным электродом-присоской с
диаметром кончика 70 мкм. Подводимый сверху электрод прижимали к середине
глазного бокала и создавали в электроде разряжение 20 – 30 см водяного столба.
Сигнал с хлор-серебряных электродов подавали на вход усилителя постоянного тока
и оцифровывали (АЦП L-761 фирмы Lcard).
Источником
световой стимуляции служила лампа КГМ-150. Световой поток, пропущенный через
монохроматор (λ = 500 нм), подавали на препарат по световолоконному жгуту.
Величину квантового потока регулировали оптическим клином и измеряли
фотометром. Подачу светового стимула продолжительностью в одну секунду
регулировали электромагнитным затвором. Перед началом измерений определяли
величину квантового потока, вызывающего максимальный по амплитуде электрический
ответ глаза. В ходе измерений применяли свет интенсивностью 50 % полученной
величины. Время между двумя предъявляемыми стимулами изменяли от 20 до 1
секунды. На каждом препарате выполняли три серии опытов по 7 – 9 пар стимулов в
каждой. Время между парами стимулов в каждом опыте составляло 3 минуты, а
перерыв между сериями опытов – 10 минут.
Физиологический
раствор (мМ): NaCl – 61; KCl – 3,2; CaCl2 – 10; MgCl2 – 13; глюкоза – 5; pH –
7,6 – 7,8 (Tris-HCl) [14].
Статистическая
обработка. Определяли средние латентности первого и второго ответов, отношение
второй амплитуды к первой и коэффициент корреляции между интервалом, между
стимулами и вычисленными величинами [1].
Результаты
При
визуальном наблюдении за оперированными животными обеих экспериментальных групп
отмечали образование пигментных пятен на оставшихся участках щупалец на третьей
неделе после операции. Через месяц после операции глаза регенерировали в 100 %
случаев как у животных, содержавшихся на свету, так и у животных, содержавшихся
в темноте.
В
ряде случаев у нативных и регенерирующих глаз животных, содержавшихся в
темноте, наблюдали большую толщину микровиллярного слоя и меньшую толщину
пигментного слоя по сравнению с глазами животных, содержавшихся на свету.
Данные таблицы 1 свидетельствуют о том, что происходит полное восстановление
линейных размеров структур регенерировавших глаз. Статистически достоверные
различия в толщине микровиллярного и пигментного слоев светоадаптированного и темноадаптированного
глаз не выявлены.
Таблица
1
Линейные
размеры параметров глаза Achatina fulica, содержавшихся при различных световых
режимах, через месяц после удаления щупалец, мкм
|
Глаза
|
Условия содержания
|
L гл
|
H гл
|
L хр
|
H хр
|
h пигм
|
h яд
|
h мк
|
h рог
|
h кап
|
|
Нативные
|
Свет
|
215,00
±2,57
|
164,08
±9,07
|
84,58
±13,52
|
64,42
±6,56
|
17,08
±2,60
|
10,25
±1,99
|
12,33
±2,37
|
35,33
±5,34
|
4,08
±0,34
|
|
Темнота
|
212,92
±27,34
|
158,88
±11,88
|
79,31
±22,25
|
59,00
±20,23
|
14,13
±2,56
|
12,63
±2,44
±1,94
|
31,75
±6,86
|
6,13
±10,24
|
|
Регенерировавшие
|
Свет
|
227,94
±40,41
|
168,83
±46,59
|
89,24
±18,30
|
60,13
±14,54
|
28,22
±7,95
|
17,90
±2,68
|
16,11
±4,89
|
29,83
±0,62
|
3,92
±1,10
|
|
Темнота
|
199,30
±42,08
|
150,42
±19,59
|
71,00
±16,28
|
51,70
±19,44
|
20,00
±6,83
|
17,37
±5,93
|
11,90
±2,84
|
24,71
±6,90
|
3,13
±0,87
|
Электроретинограмма
(ЭРГ) регенерировавшего глаза Achatina fulica характеризуется наличием фаз
быстрой деполяризации и более медленной реполяризации, характерных также для
ЭРГ нативных глаз (рис. 1). ЭРГ глаз животных, содержавшихся на свету и в
темноте, принципиально не отличались друг от друга.



Рис.
1. ЭРГ нативного а и регенерировавшего б глаз содержавшихся на свету моллюсков
A. Fulica в ответ на предъявление двух вспышек света с интервалом в 10 с.
Стрелками обозначены моменты нанесения световой стимуляции
При
предъявлении пары световых стимулов средние латентности второй ЭРГ глаз
животных всех групп были больше по сравнению с латентностями первого ответа.
Статистически достоверных различий латентностей как первого, так и второго
ответов глаза на световую стимуляцию между группами моллюсков не выявлено
(табл. 2).
Таблица
2
Средние
латентности ответов нативного и регенерировавшего глаз
|
Параметр ЭРГ
|
Нативные глаза
|
Регенерировавшие глаза
|
|
Световые
|
Депривированные
|
Световые
|
Депривированные
|
|
Количество ЭРГ
|
72
|
46
|
199
|
55
|
|
Латентность 1-го ответа, мс
|
63,50
±19,29
|
91,87
±19,56
|
72,02
|
66,60
±14,05
|
|
Латентность 2-го ответа, мс
|
91,89
±21,27
|
124,56
±26,85
|
85,80
±37,51
|
95,96
±27,40
|
|
Отношение средних латентностей
|
1,45
|
1,36
|
1,19
|
1,44
|
Амплитуда
второго ответа ЭРГ глаз моллюсков всех групп была меньше первой при интервале
между ними до трех минут. При уменьшении интервала между стимулами наблюдалось
статистически достоверное уменьшение амплитуд второго ответа. Об этом
свидетельствует статистически значимая положительная корреляция между
межстимульным интервалом и отношением амплитуды второго ответа к амплитуде
первого ответа (табл. 3).
Таблица
3
Коэффициент
корреляции межстимульного интервала с латентостями первого и второго ответов
глаза и с отношением амплитуд ЭРГ
|
Параметр ЭРГ
|
Глаза моллюсков, содержавшихся на свету
|
Глаза светодепривированных моллюсков
|
|
Нативные
|
Регенерировавшие
|
Нативные
|
Регенерировавшие
|
|
Латентность 1-го ответа
|
-0,23
|
-0,24
|
-0,14
|
0,09
|
|
Латентность 2-го ответа
|
-0,39
|
-0,26
|
0,19
|
-0,14
|
|
Отношение амплитуд
2-го и 1-го ответов
|
0,64
|
0,52
|
0,83
|
0,68
|
Латентности
второго ответа показывают незначительную тенденцию к уменьшению при увеличении
интервала между стимулами, однако коэффициент корреляции интервала между двумя
вспышками света и латентностью первого и второго ответов статистически
недостоверен (табл. 3).
Слияние
отдельных ЭРГ на последовательные вспышки света происходит при межстимульном
интервале в 1 – 2 секунды у нативных глаз моллюсков обеих групп и
регенерировавших глаз моллюсков, содержавшихся на свету (рис. 2а, б). Ответы
регенерировавших глаз светодепривированных животных сливаются при интервале
около 5 секунд (рис. 2в, г).



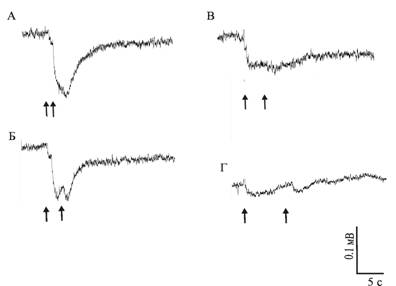
Рис.
2. ЭРГ нативного (а, б) и регенерировавшего (в, г) глаз светодепривированных
моллюсков A. fulica. Стрелками обозначены моменты нанесения световой
стимуляции. Интервал между стимулами:
а
– 1 с, б – 2 с, в – 5 с, г – 10 с
Обсуждение
Световая
депривация влияет на некоторые проявления жизнедеятельности Achatina fulica. В
частности, содержание этих моллюсков при отсутствии света негативно сказывается
на их репродуктивных способностях [11]. Уменьшаются также двигательная
активность животных и количество потребляемой ими пищи. С другой стороны,
постоянная темнота, так же как и удаление оптических щупалец, не приводит к
изменению циркадианного ритма A. fulica [15].
Ограничение
светового потока на сетчатку глаза нарушает формирование зрения в онтогенезе за
счет недоразвития центрального отдела сенсорной системы как у позвоночных [6],
так и у беспозвоночных [7] животных. Показано также, что длительная
монохроматическая депривация приводит к нарушениям структуры соответствующих
колбочек сетчатки рыбы [16]. Основываясь на сходстве процесса регенерации с
формированием органов в онтогенезе, можно было бы предположить, что световая
депривация влияет хотя бы на скорость восстановления глаза A. fulica. Однако
наши исследования показали, что световая депривация не влияет на восстановление
структуры и электрических свойств глаз брюхоногих моллюсков. Скорость
регенерации глаз была одинакова у животных обеих экспериментальных групп: через
месяц после удаления дистальной части оптического щупальца восстановление
структур глаза наблюдалось в 100 % случаев. Восстановление линейных размеров
глаза происходит также через месяц после операции. Наши данные, полученные на
молодых особях A. fulica, подтверждают предварительные выводы [10], полученные
на Strombus luhuanus. Таким образом, световая стимуляция не является
необходимым фактором для протекания регенерационных процессов в периферическом
отделе зрительной системы у брюхоногих моллюсков. Более того, электрические
ответы регенерировавших глаз животных, содержавшихся в темноте, не отличаются
от ответов регенерировавших глаз животных, содержавшихся при постоянном
освещении. Остается, однако, вероятность того, что световые условия содержания
регенерирующих улиток могут влиять на восстановление связей формирующегося
глаза с нейронами церебральных ганглиев, что, безусловно, требует специального
исследования.
Список литературы
1.
Лакин Г.Ф. Биометрия: Учеб. пособие для биологов спец. вузов. М., 1990.
2.
Меркулов Г.А. Гистологическая техника. М., 1961.
3.
Одум Ю. Экология. М., 1986.
4.
Ромейс Б. Микроскопическая техника. М., 1954.
5.
Сидельников А.П. Регенерация глазного щупальца у гигантской африканской улитки
Achatina fulica // Изв. РАН. Сер. биол. 1991. №5. С. 716 – 725.
6.
Хьюбел Д. Глаз, мозг, зрение. М., 1990.
7.
Barth M., Hirsch H.V., Meinertzhagen I.A., Heisenberg M.
Experience-dependent developmental plasticity in the optic lobe of
Drosophila melanogaster // J. Neurosci. 1997. Vol. 17(4). Р. 1493 – 1504
8. Chase R., Kamil R. Morphology and odor sensitivity of regenerated
snail tentacles // J. Neurobiol. 1983. Vol. 14. №1. Р.
43 – 50.
9. Eakin R.M., Ferlatte M.M. Studies of eye regeneration in a snail,
Helix aspersa // J. Exp. Zool. 1973. Vol. 184. №1. P. 81 – 95.
10. Gillary H. Electrical potentials from the regenerating eye of
Strombus // J. Exp. Biol. 1983. Vol. 107. P. 293 – 310.
11. Hodasi J.K.M. The effects of different light regimes on the
behaviour and biology of Achatina (Linne) // J. Moll. stud. 1982. Vol. 48. Р. 283 – 293.
12. Leitner D., Francis A., Gazzaniga M. Optic nerve regeneration in
goldfish under light deprivation // Brain Research Bulletin. 1982. Vol. 8. Р. 105 – 107.
13. Ramachandran A.V., Ndukuba P.I. Preliminary evidence for
pineal-mediated extraretinal photoreception in relation to tail regeneration in
the Gekkonid lizard, Hemidactylus flaviviridis // J. Pineal. Res. 1989. Vol.
6(2). P. 121 – 134.
14. Suzuki H., Watanabe M., Tsukahara Y., Tasaki K. Duplex system in
the simple retina of a gastropode mollusc, Limax flavus L. // J. Comp. Physiol.
1979. Vol. 133. P. 125 – 130.
16. Wagner H.J., Kroger R.H.H. Effects of long-term spectral
deprivation on the morphological organisation of the outer retina of the blue
acara (Aequidens pulcher) // Phil. Trans. R. Soc. Lond. 2000. Vol. 355.
P. 1249 – 1252.
Для
подготовки данной работы были использованы материалы с сайта http://elib.albertina.ru