Рукокрылые Беларуси
Содержание
Введение
. Аналитический
обзор
. Технологическая
часть
.1
Физико-химические основы процесса получения этилбензола в присутствии хлорида
.2 Технологическая
схема процесса
.3 Расчет
материального баланса процесса производства этилбензола алкилированием в
присутствии хлорида алюминия
.4 Расчет основного
аппарата
.5 Расчет теплового
баланса алкилатора
. Экологическая
часть
Заключение
Список
использованных источников
Введение
В промышленности для получения
различных органических и неорганических веществ используются различные
процессы: гидрирование, дегидрирование, гидратации, дегидратации,
алкилирование, окисление, восстановление и т.д.
В данной курсовой работе будет
описан процесс алкилирования на примере получения этилбензола в присутствии
катализатора хлорида алюминия, будут описаны физико-химические основы процесса
и технологическая схема данного процесса. Также в ходе курсовой работы по
исходным данным будут рассчитаны основные величины, необходимые для составления
материального и теплового балансов процесса и произведен
расчет основного аппарата - алкилатора.
1.
Аналитический обзор
Алкилированием называется
процесс введения алкильных групп в молекулы органических веществ и некоторых
неорганических веществ. Процесс алкилирования часто является промежуточной
стадией в производстве мономеров, моющих веществ и т.д.
Вещества, которые участвуют в
процессе алкилирования, называются алкилирующими агентами. Все алкилирующие
агенты по типу связей, разрывающихся в них при алкилировании, делятся на следующие
группы:
ненасыщенные соединения
(олефины и ацетилен);
хлорпроизводные с неподвижным
атомом хлора;
спирты, простые и сложные эфиры
(оксиды олефинов).
Олефины (этилен, бутилен,
пропилен и т.д.) имеют первостепенное значение в качестве алкилирующих агентов.
В виду дешевизны ими стараются пользоваться во всех случаях, где это возможно.
Основное применение они нашли для С-алкилирования парафинов ароматических
соединений. Алкилирование олефинами в большинстве случаев протекает по ионному
механизму через промежуточное образование ионов аргония и катализируется
протонными и апротонными кислотами.
Реакционная способность
олефинов при реакции такого типа определяет их склонность к образованию ионов
карбония:
= СH2 + H+ -> R+СНСН3
Это означает, что удлинение и разветвление
цепи атомов углерода значительно повышает реакционную способность олефина к
алкилированию.
В ряде случаев алкилирование
олефинами протекает под влиянием инициаторов радикально-цепных реакций,
освещения или высокой температуры. Здесь промежуточными активными частицами
являются свободные радикалы и реакционная способность разных олефинов при таких
реакциях значительно снижается.
Хлорпроизводные являются
алкилирующими агентами наиболее широкого диапазона действий. Применять их
рационально для тех процессов, в которых их невозможно заменить олефинами или
когда хлорпроизводные дешевле и доступнее олефинов. Алкилирующее действие
хлорпроизводных проявляется в трех различных типах взаимодействия:
электрофильного;
нуклеофильного;
свободно-радикального.
Механизм электрофильного
замещения характерен в основном для алкилирования по атому углерода, но в
отличие от олефинов реакции катализируются только апротонными кислотами.
Процесс идет с промежуточным образованием ионов аргония, в связи с чем,
реакционная способность хлористых алкилов зависит от поляризации связи С-Сl и
повышается при удлинении цепи.
При нуклеофильном замещении
атомов Сl, характерном для алкилирования S и N, механизм аналогичен гидролизу
хлорпроизводных, причем реакция протекает в отсутствии катализаторов:
RCl + : NH3
-> RN+ H3 + Cl- -> RNH2 + HCl
Спиртами, оксидами и простыми
эфирами алкилируют в присутствии кислых катализаторов. Процесс идет с разрывом
таких связей, как С-О, С-N, С-S. Спирты применяют для алкилирования только в
тех случаях, когда они дешевле и доступнее хлорпроизводных. Нерационально
использовать спирты с катализатором хлоридом алюминия, так как при
алкилировании спиртами катализатор разлагается, а протонные кислоты
разбавляются образовавшейся водой. В этих случаях происходит дезактивирование
катализатора, что обуславливает его большой расход.
Алкилирование олефинами
применяется в промышленности в основном для получения компонентов моторного
топлива с высокой антидистанционной способностью. Каталитическое алкилирование
протекает при обычной температуре или даже при охлаждении до 0°С и давлении,
близком к атмосферному (кроме этилена).
Влияние строения ароматических
соединений при реакциях алкилирования в общем такое же, как при других
процессах электрофильного замещения ароматического ядра, но имеет свои
особенности. Реакция алкилирования отличается низкой чувствительностью к
электронно-донорным заместителям в ядре. Правила ориентации при алкилировании,
в общем, подобны другим реакциям электрофильного замещения, но строение
продуктов может существенно изменяться в зависимости от катализатора и условий
реакции. Так электронно-донорные заместители и атомы галогенов направляются
преимущественно в пара- и орта- положения. Однако, в более жестких условиях при
катализаторе хлориде алюминия происходит изомеризация гомологов бензола с
внутримолекулярной миграцией алкильных групп и образование равновесных смесей,
в которых преобладают термодинамически более стабильные изомеры.
Алкилирование ароматических
углеводородов это сложный многостадийный процесс, состоящий из ряда
взаимосвязанных реакций: алкилирование, изомеризация, полимеризация и др. В
качестве катализаторов могут использоваться как протонные, так и кислоты
Льюиса. Протонные кислоты широко применяются при алкилировании бензола
олефинами и спиртами, причем их активность падает в ряду:
При алкилировании ароматических
соединений в присутствии любых катализаторов происходит последовательное
замещение атомов водорода с образованием смеси продуктов разной степени
алкилирования. При умеренной температуре каждая стадия практически не обратима.
С6Н6 + С2Н4 -> С6Н5С2Н5 +
С2Н4 -> С6Н4(С2H5)2 + С2Н4 -> С6(С2H5 )6
На хлориде алюминия и в жестких
условиях происходит обратная реакция переалкилирования с межмолекулярной
миграцией алкильных групп:
H4(C2H5)2 + C6H6 ->
2C6H5C2H5
Следовательно, в процессе на
хлориде алюминия может установиться равновесие, что необходимо учитывать при
выборе условий процесса оптимального мольного соотношения реагентов. На
протонных катализаторах состав продуктов определяется кинетикой процесса, а на
хлориде алюминия и в жестких условиях - равновесием.
2.
Технологическая часть
.1
Физико-химические основы процесса получения этилбензола в присутствии хлорида
алюминия
Исходные продукты (бензол и
олефины) для процесса алкилирования необходимо очищать от разных примесей, в
том числе и воды, так как при наличии влаги будет гидролизоваться А1С13 с
образованием НСl. Как очистка, так и осушка требуют значительных энергетических
затрат. В связи с этим чаще всего осуществляют гетероазеотропную осушку
исходных продуктов только до 0,002 - 0,005 %. Кроме того, необходимая
активность А1Сl3 достигается только в присутствии НС1, который требуется для
образования каталитического комплекса. Для образования комплекса, как правило,
используют алкихлориды. Можно использовать и безводный НСl, однако его
содержание в реакционной массе регулировать трудно.
Процесс алкилирования бензола
олефинами, катализируемый комплексом на основе А1Сl3, является жидкофазным и
протекает с выделением тепла. Для проведения процесса можно предложить три типа
реактора. Наиболее простым является трубчатый аппарат (рисунок 1), в нижней
части которого размещается мощная мешалка, предназначенная для эмульгирования
катализаторного раствора и реагентов. Такой тип аппарата часто используется при
организации периодического процесса.
Реагент, а также катализаторный
раствор подают в нижнюю часть реактора. Эмульсия поднимается вверх по трубам,
охлаждаясь за счет воды, подаваемой в межтрубное пространство. Продукты
синтеза, не прореагировавшие бензол и олефины, а также катализаторный раствор
выводятся из верхней части реактора и поступают в сепаратор. В сепараторе
происходит отделение каталитического раствора от остальных продуктов
(алкилата). Катализаторный раствор возвращается в реактор, а алкилаты
направляются на разделение.
Для обеспечения непрерывности
процесса может быть применен каскад из 2-4 трубчатых ректоров. На рисунке 2
представлен каскад из двух реакторов. Катализаторный раствор подают в оба
реактора, реагенты - в верхнюю часть первого реактора. Оба реактора
представляют пустотелые аппараты с мешалками. Тепло отводится с помощью воды,
подаваемой в «рубашки». Реакционная масса из верхней части первого реактора
поступает в сепаратор, из которого нижний (катализаторный) слой возвращается в
реактор, а верхний - поступает в следующий реактор. Из верхней части второго
реактора реакционная масса также поступает в сепаратор. Нижний (катализаторный)
слой из сепаратора поступает в реактор, а верхний слой
(алкилаты) направляется на разделение. Конверсия реагентов определяется числом
реакторов. Процесс проводится при 40 - 60 °С.
Непрерывное алкилирование
газообразными олефинами можно проводить в барботажных колоннах (рисунок 3). Как
правило, внутреннюю поверхность колонн защищают кислотоупорными плитками.
Верхняя часть колонн заполнена кольцами Рашига, которые играют роль
каплеотбойника, остальная часть - катализаторным раствором. Реагенты подают в
нижнюю часть колонны. Газообразный олефин, барботируя через колонну, интенсивно
перемешивает реакционную массу. Конверсия реагентов зависит от высоты
катализаторного слоя. Частично тепло отводится через «рубашку», разделенную на
секции, а основная часть тепла - за счет нагрева реагентов и испарения
избыточного количества бензола. Пары бензола вместе с другими газами,
содержащимися в олефине, поступают в конденсатор, в котором конденсируется
главным образом бензол. Конденсат возвращают в реактор, а несконденсированные
вещества выводят из системы для утилизации. В этом случае можно установить
автотермический режим, варьируя давление и количество отходящих газов.
Катализаторный раствор вместе с продуктами алкилирования и не прореагировавшим
бензолом выводят из верхней части колонны и направляют в сепаратор. Нижний слой
возвращают в колонну, а верхний слой направляют на разделение.
Технология жидкофазного
алкнлирования имеет следующие подсистемы:
гетероазеотропная осушка
бензола;
реакторный узел;
очистка газов от НС1;
очистка продуктов алкилирования
от НС1;
разделение продуктов алкилирования.
Рециклы по бензолу и
полиалкилбензолам объединяют эти подсистемы и систему. В систему входят потоки:
А1Сl3, этилхлорид. бензол, этан-этиленовая фракция, водный раствор щелочи.
Выходят из системы следующие потоки: алкилбензолы, абгазы, водный раствор
щелочи, водный раствор хлороводородной кислоты, катализаторный раствор.
Следовательно, наряду с продуктами выводятся потоки, которые требуют
утилизации, нейтрализации и очистки. От этих процессов в значительной степени
зависит как экономическая, так и экологическая эффективность предлагаемой
технологии.
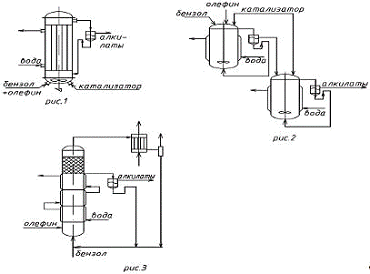
Рисунок 1 - трубчатый реактор;
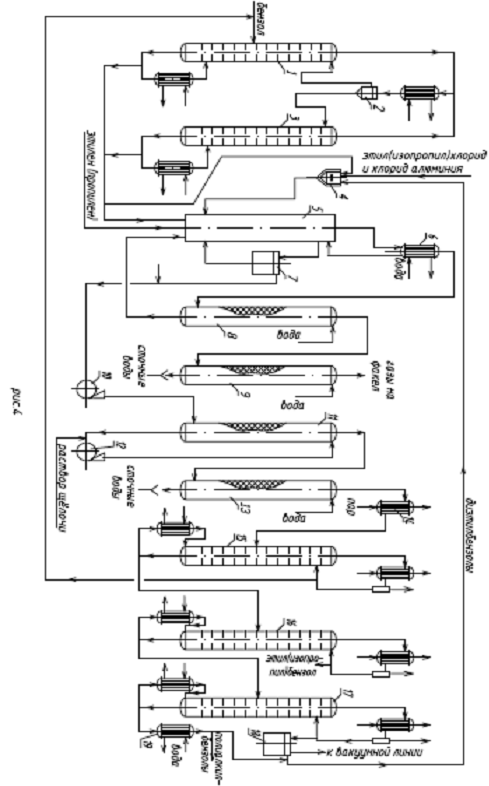
рисунок 2 - каскад реакторов;
рисунок 3 - реактор колонного типа.
2.2 Технологическая схема процесса
Технологическая схема
рассматриваемой технологии представлена на рисунке 4.
, 15, 16, 17 - ректификационные
колонны; 2 - флорентийский сосуд; 3 - отгонная колонна; 4 - аппарат для
приготовления катализаторного комплекса; 5 - реактор алкилирования; 6 -
конденсатор; 7 - отстойник; 8 - скруббер поглощения бензола; 9 - скруббер
водной промывки отходящих газов; 10, 12 - насосы; 11 - скруббер щелочной
промывки; 13 - скруббер водной промывки алкилата; 14 - подогреватель; 18 -
вакуум-приемник; 19 - холодильник полиалкилбензола.
На колонном агрегате, состоящем
из ректификационной колонны 1, отгонной колонны 3 и флорентийского сосуда 2
происходит гетероазеотропная осушка исходного бензола. Из куба колонны 1
выводится обезвоженный бензол, часть которого поступает в аппарат 4
приготовления катализаторного раствора, остальная часть - в реактор 5. В
колонну 1 поступает как свежий, так и возвратный бензол. Верхние паровые потоки
колонн 1 и 3 представляют собой гетероазеотропные смеси бензола и воды.
После конденсации и
расслаивания во флорентийском сосуде 2 верхний слой (обводненный бензол)
поступает в ректификационную колонну 1, а нижний слой (вода), содержащий
бензол, направляется в отгонную колонну 3. Каталитический комплекс готовится в
аппарате 4 с мешалкой и «рубашкой», куда подается бензол, а также хлорид
алюминия, этилхлорид и полиалкилбензолы. Максимальной активностью обладают
комплексы, получаемые на шихте, в которой мольное соотношение бензол:
алкилбензолы составляет (3-5): 1. Мольное соотношение хлорид алюминия
ароматические углеводороды составляет 1: (2,5 - 3). Катализаторным раствором
заполняется реактор, а затем в ходе процесса для подпитки подают катализаторный
раствор, так как он частично выводится из реактора при регенерации. Реактором
служит колонный аппарат, отвод теплоты в котором осуществляется за счет подачи
охлажденного сырья и испаряющегося бензола. Катализаторный раствор, осушенный
бензол и этан - этиленовую фракцию подают в нижнюю часть реактора 5. После
барботажа из реактора выводят не прореагировавшую парогазовую смесь и
направляют ее в конденсатор 6, где прежде всего конденсируется бензол,
испарившийся в реакторе. Конденсат возвращается в реактор, а
несконденсированные газы, содержащие значительное количество бензола, особенно
при использовании разбавления олефина, и НСl поступают в нижнюю часть скруббера
поглощения бензола 8, орошаемого полиалкилбензолами для улавливания бензола.
Раствор полиалкилбензола направляется в реактор, а не сконденсированные газы
поступают в скруббер 9, орошаемый водой для улавливания НСl. Водный раствор НС1
направляется на нейтрализацию, а газы - на утилизацию теплоты. Катализаторный
раствор вместе с продуктами поступают в отстойник 7, нижний слой которого
возвращается в реактор, а верхний слой с помощью насоса 10 направляется в
нижнюю часть скруббера 11. Скрубберы 11 и 13 предназначены для отмывки НС1 и
А1Сl3, растворенных в алкилате. Скруббер 11 орошается раствором щелочи, который
перекачивается насосом 12. Для потпитки в ре-циркуляционный поток щелочи подают
свежую щелочь в том количестве, которое расходуется на нейтрализацию НС1. Далее
алкилат поступает в нижнюю часть скруббера 13, орошаемого водой, которая
вымывает щелочь из алкилата. Водный раствор щелочи направляется на
нейтрализацию, а алкилат через подогреватель 14 на ректификационную колонну 15.
В колонне 15 выделяется в виде дистиллята бензол вместе с растворенной водой.
Выделившийся бензол направляется в ректификационную колонну 1 для
обезвоживания, а кубовый остаток - на дальнейшее разделение. Кубовый продукт из
колонны 15 направляется в ректификационную колонну 16 для выделения в качестве
дистиллята продуктов этилбензола. Кубовый продукт колонны 16 направляется в
ректификационную колонну 17 для разделения полиалкилбензолов на две фракции.
Колонна 17 работает под вакуумом 5,3 кПа. Верхний продукт направляется в
аппарат 4 и реактор 5, а нижний продукт (смолы) выводится из системы. Основным
недостатком этой технологии является отсутствие регенерации теплоты реакции,
которая отводится с водой в конденсаторе 6.
.3 Расчет материального баланса
процесса производства этилбензола алкилированием в присутствии хлорида алюминия
Производительность стадии
алкилирования по 100% этилбензолу составляет:
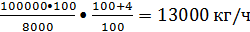
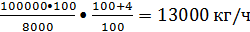 или
или 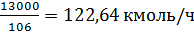
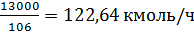
где 10000 -
производительность в расчете на 100%-й этилбензол, т/год;
- число рабочих
часов; 4 - потери этилбензола на стадиях выделения, %; 106 - молярная масса
этилбензола, кг/кмоль.
Расход этилена с
учетом селективности процесса составляет:
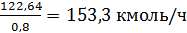
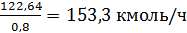 или
или 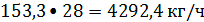
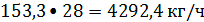
где 0,8 -
селективность по этилбензолу в расчете на этилен;
- молярная масса
этилена, кг/кмоль.
Определяем расход
этиленовой фракции, учитывая объемную долю этилена:
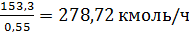
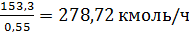 или
или 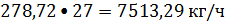
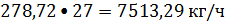
где 0,55-
процентное содержание этилена в этиленовой фракции.
Рассчитываем состав
этиленовой фракции:
Метан: 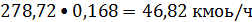
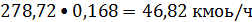 или
или 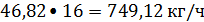
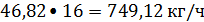
Ацетилен: 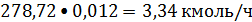
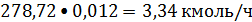 или
или 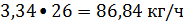
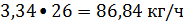
Этилен :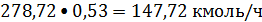
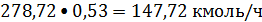 или
или 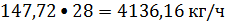
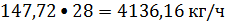
Этан: 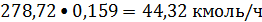
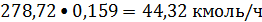 или
или 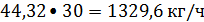
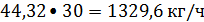
Пропилен: 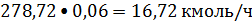
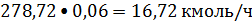 или
или 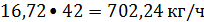
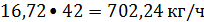
Водород: 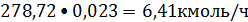
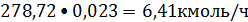 или
или 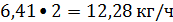
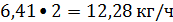
Азот: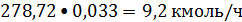
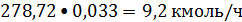 или
или 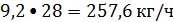
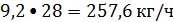
Кислород: 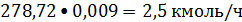
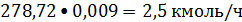 или
или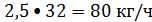
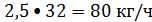
Оксид углерода: 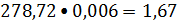
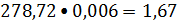 кмоль/ч или
кмоль/ч или 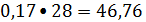
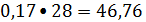 кг/ч
кг/ч
Таблица 1
Состав этиленовой
фракции
|
Наименование компонента
|
n τ, кмоль/ч
|
Xi,%
|
m τ , кг/ч
|
|
Метан СH4
|
42,24
|
15,5
|
676
|
|
Ацетилен С2Н2
|
1,36
|
0,5
|
35
|
|
Этилен С2H4
|
163,52
|
60,0
|
4578
|
|
Этан С2Н6
|
32,43
|
11,9
|
973
|
|
Пропилен С3H6
|
13,63
|
5
|
572
|
|
Водород H2
|
6,27
|
2,3
|
13
|
|
Азот N2
|
8,18
|
3
|
229
|
|
Кислород О2
|
3,27
|
1,2
|
105
|
|
Оксид углерода CO
|
1,64
|
0,6
|
46
|
|
Всего:
|
272,54
|
100
|
7227
|
Молярное отношение
бензол-этилен на входе в реактор равно 3:1, следовательно, расходуется бензола:
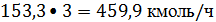
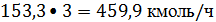 или
или 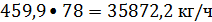
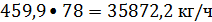
Массовая доля воды
в бензоле после азеотропной осушки составляет 0,002%, следовательно, с бензолом
поступает воды:
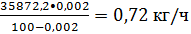
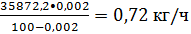 или
или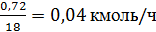
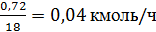
Расход хлорида
алюминия составит:
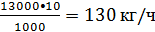
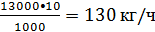 или
или 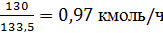
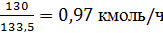
где 10 - расход
хлорида алюминия на 1 т образующегося этилбензола, кг;
,5 - молярная масса
хлорида алюминия.
Рассчитываем
массовое количество диэтилбензола, возвращаемое со стадии ректификации:
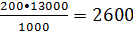
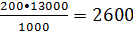 кг/ч
кг/ч 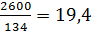
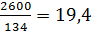 кмоль/ч
кмоль/ч
где 200 -
масса диэтилбензола, возвращаемого со стадии ректификации на 1 т получаемого
этилбензола, кг;
- молярная
масса диэтилбензола.
Для
определения состава отходящих газов рассчитывают содержание в них хлорида
водорода, этилена, бензола, оксида углерода. Метан, этан, водород, азот и
кислород, входящие в состав этиленовой фракции, переходят в отходящие газы
полностью. Влага в составе бензола взаимодействует с хлоридом алюминия по
реакции:
AlCl3+3H2O
-> Al(OH)3+3HCl,
при этом
реагирует хлорид алюминия
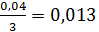
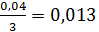 кмоль/ч или 3кг/ч
кмоль/ч или 3кг/ч
Образуется;
- гидроксида
алюминия 0,013 кмоль/ч или 2кг/ч
хлорида
водорода 0,04 кмоль/ч или 2кг/ч.
В отходящие
газы переходит:
- 1% подаваемого
этилена 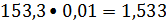
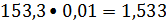 кмоль/ ч или 42,92 кг /ч
кмоль/ ч или 42,92 кг /ч
- 90% подаваемого
оксида углерода 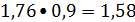
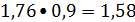 кмоль/ч
кмоль/ч
или 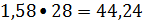
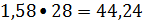 кг/ч
кг/ч
- 0,3 кг бензола на
1 т этилбензола
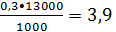
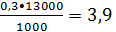 кг/ч или 0,05кмоль/ч
кг/ч или 0,05кмоль/ч
Для определения
состава алкилата рассчитывают изменение состава исходной смеси в процессе
алкилирования.
Таблица 2
Состав отходящих
газов
|
Наименование компонента
|
n τ ,кмоль/ч
|
Xi,%
|
m τ ,кг/ч
|
|
МетанCH4
|
42,24
|
44,05
|
705
|
|
Этилен С2Н4
|
1,635
|
1,7
|
48
|
|
Этан C2H6
|
32,43
|
33,8
|
1014
|
|
Бензол С6H6
|
6,27
|
6,5
|
13
|
|
Водород H2
|
8,18
|
8,5
|
238
|
|
Азот N2
|
3,27
|
3,4
|
109
|
|
Кислород O2
|
1,48
|
1,5
|
42
|
|
Оксид углерода CO
|
|
|
|
|
Хлорид водорода HCl
|
0,01
|
*
|
1
|
|
Всего:
|
95,89
|
100
|
2174
|
В связи с
малыми значениями бензола (0,044%) и хлорида водорода (0,036%) в дальнейших
расчетах их не учитывают.
По реакции (1)
переалкилирования:
C6H5-(C2H5)2
+ C6H6
-> 2C6H5-C2H5
(1)
расходуется бензола
19.4 кмоль/ч или
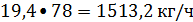
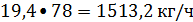 ;
;
образуется
этилбензола 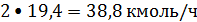
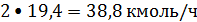
или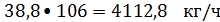
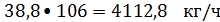
Следовательно,
алкилированием бензола получают этилбензол:
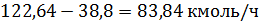
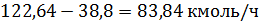 или
или 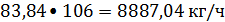
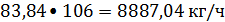
По основной реакции
(2):
C6H6+C2H4 -> C6H5-C2H5 (2)
расходуется бензола
83,84 кмоль/ч или 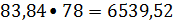
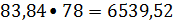 кг/ч;
кг/ч;
расходуется этилена
83,84 кмоль/ч или 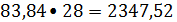
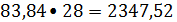 кг/ч.
кг/ч.
По реакции (3):
C6H6+2C2H4
->C6H4-(C2H)2
(3)
расходуется
38,2% от поступившего этилена, что составляет:
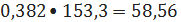
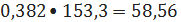 кмоль/ч или
кмоль/ч или 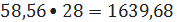
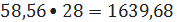 кг/ч
кг/ч
бензола 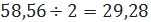
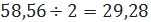 кмоль/ч или
кмоль/ч или 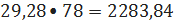
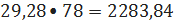 кг/ч;
кг/ч;
образуется диэтилбензола
29,28 кмоль/ч или 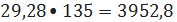
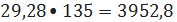 кмоль/ч .
кмоль/ч .
По реакции (4):
С6H6+3С2H4-> С6H3-(C2H5)3 (4)
расходуется
11% от поступившего этилена, что составляет:
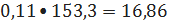
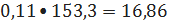 кмоль/ч или
кмоль/ч или 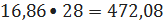
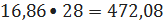 кг/ч
кг/ч
этилбензол хлорид
алкилирование алюминий
бензола 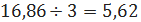
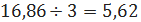 кмоль/ч или
кмоль/ч или 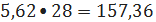
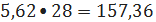 кг/ч;
кг/ч;
образуется
триэтилбензола 5,62 кмоль/ч или 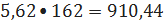
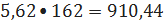 кг/ч.
кг/ч.
По реакции (5):
С6H6 +4 С2H4 -> С6H2-(С2H5)4 (5)
расходуется
этилена с учетом его расхода по реакциям (2) - (4) и содержания в отходящих
газах:
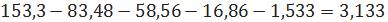
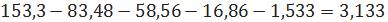 кмоль/ч
кмоль/ч
или 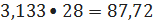
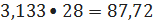 кг/ч
кг/ч
бензола 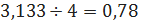
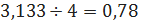 кмоль/ч или
кмоль/ч или 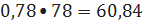
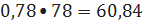 кг/ч;
кг/ч;
образуется
тетраэтилбензола 0,78 кмоль/ч или 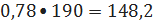
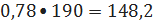 кг/ч.
кг/ч.
По реакции (6):
С6H6+С3H6->C6H5-С3H7 (6)
расходуется
пропилена 16,78 кмоль/ч или 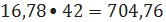
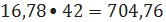 кг/ч;
кг/ч;
бензола 16,78
кмоль/ч или 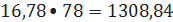
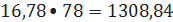 кг/ч;
кг/ч;
образуется
изопропилбензола 16,78 кмоль/ч или 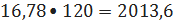
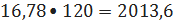 кг/ч.
кг/ч.
По реакции
(7):
С6H6+С2H2->(С6H5)2-С2H4 (7)
расходуется
ацетилена 3,34
кмоль/ч или 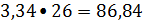
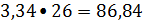 кг/ч;
кг/ч;
бензола 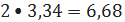
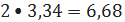 кмоль/ч или
кмоль/ч или 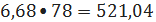
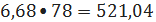 кг/ч;
кг/ч;
образуется
дифенилэтана 3.34
кмоль/ч или 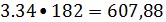
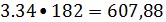 кг/ч.
кг/ч.
По реакции (8):
2C6H6 + CO -> (C6H5)2 - CHOH (8)
расходуется оксида
углерода 1,76-1,58=0,18 кмоль/ч
или 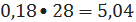
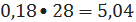 кг/ч;
кг/ч;
бензола 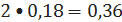
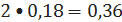 кмоль/ч или
кмоль/ч или 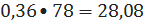
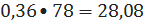 кг/ч;
кг/ч;
образуется
дифенилкабинола 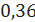
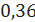 кмоль/ч или
кмоль/ч или 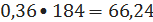
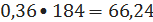 кг/ч.
кг/ч.
Общий расход
бензола по реакциям (1) - (8) составляет:
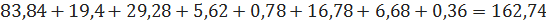
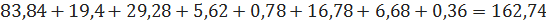 кмоль/ч или
кмоль/ч или 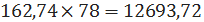
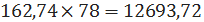 кг/ч.
кг/ч.
В составе отходящих
газов содержится бензола 0,05 кмоль/ч или 3,9кг/ч.
Остается в составе
алкилата бензола
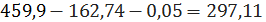
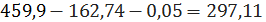 кмоль/ч или
кмоль/ч или 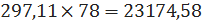
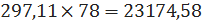 кг/ч, хлорида
алюминия
кг/ч, хлорида
алюминия 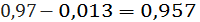
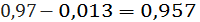 кмоль/ч или
кмоль/ч или 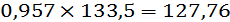
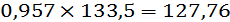 кг/ч
кг/ч
Таблица 3 Состав
алкилата
|
Компонент
|
Nτ, кмоль/ч
|
Xi,%
|
mτ,г/с
|
ωi,%
|
|
C6H6
|
297.11
|
60.71
|
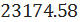 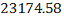 52.70 52.70
|
|
|
C6H5-C2H5
|
153.3
|
31.32
|
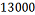
|
29.57
|
|
C6H4-(C2H5)2
|
29.28
|
5.98
|
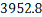
|
8.99
|
|
C6H3-(C2H5)3
|
5.62
|
1.14
|
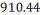
|
2.07
|
|
C6H2-(C2H5)4
|
0.78
|
0.15
|
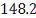
|
0.34
|
|
C6H5-C3H7
|
16.78
|
3.42
|
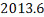
|
4.58
|
|
(C6H5)2-CHCH3
|
3.34
|
0.68
|
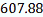
|
1.38
|
|
(C6H5)2-CHOH
|
0.18
|
0.03
|
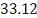
|
0.08
|
|
AlCl3
|
0.957
|
0.195
|
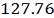
|
0.29
|
|
Al(OH)3
|
0.013
|
0.004
|
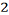
|
0.005
|
|
Всего:
|
489.36
|
100
|
43970.38
|
100
|
В связи с
малыми значениями дифенилкабинола (0,03%) и гидроксида алюминия (0,004%) в
дальнейших расчетах их не учитываем.
Состав
алкилатора соответствует оптимальному технологическому режиму.
Рассчитываем
основные расходные коэффициенты (кг/кг):
- по бензолу 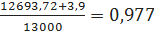
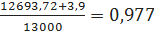
- по этилбензолу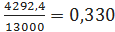
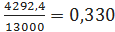
- по этиленовой
фракции 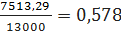
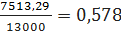
где 12693,72 -
расход бензола по реакциям (1) - (8), кг/ч; 3,9 - потери бензола с отходящими
газами, кг/ч; 13000 - производительность стадии алкилирования по 100%
этилбензолу, кг/ч;
,4 и 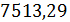
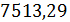 - расход этилена и этиленовой
фракции соответственно, кг/ч.
- расход этилена и этиленовой
фракции соответственно, кг/ч.
.4 Расчет основного
аппарата
В качестве
основного аппарата - алкилатора - принят вертикальный цилиндрический полый
аппарат со сферическими днищами, выполненный из углеродистой стали. Внутренняя
поверхность аппарата футерована
кислотоупорной плиткой. Сферические днища крепятся к обечайке при помощи
плоских приварных фланцев с уплотнительной поверхностью типа «выступ -
впадина». Реактор заполнен смесью бензола с продуктами реакции и жидким
алюминиевым комплексом (ЖАК). Исходное сырье (свежий и возвратный бензол,
этиленовая фракция, возвратный диэтилбензол и ЖАК) попадают в нижнюю часть
алкилатора через распределительный коллектор. Жидкие продукты (алкилат) отводят
через один из боковых штуцеров. Парогазовая смесь выводится через штуцер в
верхнем днище аппарата.
Избыточное тепло
отводится за счет испарения части бензола при температуре 90°С, то есть процесс
ведут при кипении реакционной массы.
Техническая
характеристика алкилатора:
Диаметр стальной
обечайки внутренний - 2400 мм;
Толщина стенки
обечайки - 14 мм;
Толщина футеровки -
80 мм;
Высота
цилиндрической части - 11800 мм;
Высота общая -
15000 мм;
Вместимость
аппарата:
полная - 50 м3;
полезная-38±2м3;
Производительность
по этилбензолу в расчете на 1 м3алкилатора - 180-200 кг/ч
Число аппаратов для
обеспечения заданной производительности (при минимальной вместимости
алкилатора):
= 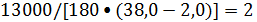
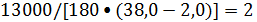 шт.
шт.
Таким образом,
необходимо установить два аппарата, соединенные параллельно.
.5 Расчет теплового
баланса алкилатора
Исходные данные:
-
материальные потоки, кмоль/с:
этиленовая
фракция 278,72/(2•3600)=0,0387;
технический
бензол 459,9/(2•3600) =0,0639;
диэтилбензол
19.4/(2•3600) =0,0027;
отходящие
газы 258.82/(2•3600) = 0,0359;
жидкий
алкилат 489.36/(2•3600) = 0,0679;
температура,
°С:
на входе в
алкилатор - 20;
на выходе из
алкилатора - 90,
Цель теплового
расчета определение количества испарившегося бензола в алкилаторе.
Ф1 + Ф2 + Ф3 +
Ф4 = Ф5 + Ф6 + Ф7 + Ф8 + Фпот,
где
Ф1,Ф2,Ф3,Ф5,Ф6,Ф7 тепловые потоки этиленовой фракции, жидкого бензола,
диэтилбензола, отходящих газов, алкилата и паров бензола соответственно, кВт;
Ф4 - теплота
экзотермических реакций, кВт;
Ф8 - расход
теплоты на испарение бензола, кВт.
Для
определения значений Ф1 и Ф5 рассчитывают средние молярные теплоемкости
этиленовой фракции при температуре 20+273=293 К
и отходящих
газов при 90+273=363 К.
Таблица 4
Средние
молярные теплоемкости
|
Компонент
|
Xi,%
|
С i , Дж /(моль • К)
|
С i • Xi /100,Дж /(моль • К)
|
|
Этиленовая фракция: Метан СН4
|
16.8
|
34.7
|
5.8296
|
|
Ацетилен С2Н2
|
1.2
|
43.7
|
0.5244
|
|
Этилен С2H4
|
53.0
|
43.82
|
23.2246
|
|
Этан С2Н6
|
15.9
|
52.09
|
8.28231
|
|
Пропилен С3Н6
|
6.0
|
63.55
|
3.8130
|
|
Водород H2
|
2.3
|
28.82
|
0.66286
|
|
Азот N2
|
3.3
|
29.13
|
0.96129
|
|
Кислород O2
|
0.9
|
28.06
|
0.25254
|
|
Оксид углерода CO
|
0.6
|
29.07
|
0.17442
|
|
Всего:
|
100.0
|
-
|
43.72502
|
|
Отходящие газы: Метан СН4
|
41.64
|
39,12
|
16.3013
|
|
Этилен С2Н4
|
1.36
|
50,62
|
0.68843
|
|
Пропилен С3Н6
|
39.41
|
61,69
|
24.31203
|
|
Водород H2
|
5.70
|
28,84
|
1.64388
|
|
Азот N2
|
8.18
|
29,43
|
2.4737
|
|
Кислород О2
|
2.22
|
29,83
|
0,66223
|
|
Оксид углерода CO
|
1.41
|
29,55
|
0.41665
|
|
Всего:
|
100.0
|
-
|
46.49822
|
Тепловой поток
этиленовой фракции:
Ф1 = 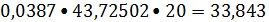
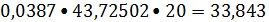 кВт
кВт
Тепловой поток
отходящих газов:
Ф5= 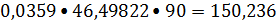
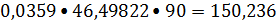 кВт
кВт
Тепловой поток
технического бензола:
Ф2 = (0,0639+n6)
 134,218
134,218
 20 =171,53+2684,36
20 =171,53+2684,36
 n6 кBт
n6 кBт
где n6 - количество
циркулирующего бензола в системе холодильник - конденсатор - алкилатор,
кмоль/с.
Определяем тепловой
поток диэтилбензола, значение молярной теплоемкости диэтилбензола находим по
справочнику:
Ф3 = 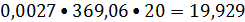
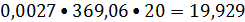 кBт
кBт
Рассчитываем
теплоты реакций (1) - (7), кДж/моль, приведенные в табл. 5.
Таблица5
|
Реакция
|
∆H0298=∑∆H0298
-∑ ∆H0298(исх)
|
|
C6H6+C2H4
-> C6H5-C2H5
|
-12,48-49,03-52,30=-113,81
|
|
C6H4-(C2H5)2+C6H6-2C6H5-C2H5
|
2 • (- 12,48 -49,03-(-72,35)) = -1,64
|
|
C6H6+2C2H4 -> C6H4-(C2H5)2
|
-72,35-49,03-2•52,30=-225,98
|
|
C6H6+3C2H4 -> C6H3-(C2H5)3
|
-122,63-49,03-3•52,30=-328,56
|
|
C6H6+4C2H4 -> C6H3-(C2H5)4
|
-174,54-49,03-4•52,30=-432,77
|
|
C6H6+C3H6 -> C6H5-C3H7
|
-41,24-49,03-20,41 =-110,68
|
|
2C6H6+C2H2 -> (C6H5)2-C2H4
|
-297,31-2•49,03-226,75=-27,50
|
|
2C6H6+CO -> (C6H5)2-CHOH
|
-46,17-2•49,03-(-110,53)= -33,70
|
Рассчитываем
теплоту экзотермических реакций.
Ф4=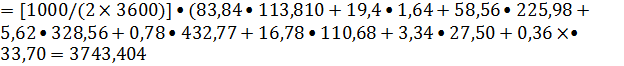
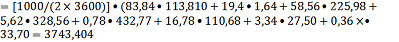 кBт
кBт
Общий приход
теплоты составляет:
Фприх=33,843+171,53+2684,36
 n6+19,929+
n6+19,929+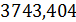
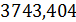 =3968,706+2684,36
=3968,706+2684,36
 n6 кBт
n6 кBт
Для определения
теплового потока алкилата рассчитываем его среднюю молярную теплоемкость при
температуре 363 К:
Сm=152,07
 0,64+186,56
0,64+186,56
 0,247+396,06
0,247+396,06
 0,061+464,46
0,061+464,46
 0,012+ 559,86
0,012+ 559,86
 0,002+321,36
0,002+321,36
 0,034+415,94
0,034+415,94
 0,002+94,48
0,002+94,48
 0,001=184,465 Дж/(моль×К)
0,001=184,465 Дж/(моль×К)
Тепловой поток
жидкого алкилата:
Ф 6=0,0679
 184,465
184,465
 90 =1127,266 кВт
90 =1127,266 кВт
Тепловой поток
паров бензола:
Ф 7=101,77
 90
90 
 n6 = 9159,3
n6 = 9159,3
 n6 кВт
n6 кВт
Расход теплоты на
испарение бензола:
Ф8=78
 391,3
391,3
 n6 = 30521,4
n6 = 30521,4
 n6 кВт
n6 кВт
Принимаем, что
потери в окружающую среду составляют 3% от общего прихода теплоты:
Ф пот = 0,03
 (3968,706+2684,36
(3968,706+2684,36
 n6) = 119,061 + 80,53
n6) = 119,061 + 80,53
 n6 кВт
n6 кВт
Общий расход
теплоты:
Фрасх=150,236+
1127,266 + 9159,30
 n6 +30521,4
n6 +30521,4
 n6 + 119,061 + 80,53
n6 + 119,061 + 80,53
 n6 =1396,563+39761,23
n6 =1396,563+39761,23
 n6 кВт
n6 кВт
Массовое количество
циркулирующего бензола находится из условия равенства прихода и расхода
теплоты:
,706+2684,36
 n6=1396,563+39761,23
n6=1396,563+39761,23
 n6
n6
37076,87×
 n6=2572,143= 0,06937 кмоль/с
n6=2572,143= 0,06937 кмоль/с
Масса бензола,
испаряющегося на стадии алкилирования:
,06937
 2
2
 3600=499,464 кмоль/ч или 38958
кг/ч,
3600=499,464 кмоль/ч или 38958
кг/ч,
что составляет
38958/13000=2,99 т на 1 т получаемого этилбензола и соответствует оптимальному
технологическому режиму.
Всего в алкилатор
подают бензол (с учетом циркулирующего бензола):
,9+499,464=959,364
кмоль/ч или 74830,392 кг/ч
Общее массовое
количество отходящих газов (с учетом испаряющегося бензола):
.453+499,464=611,917
кмоль/ч или 38551 кг/ч
Составляем
материальный баланс стадии алкилирования (табл 6)
|
Приход
|
кмоль/ч
|
кг/ч
|
Расход
|
кмоль/ч
|
кг/ч
|
|
Технический бензол, в т.ч.:
|
959.42
|
74831.392
|
Отходящие газы
|
611,917
|
38551
|
|
Чистый бензол
|
959.364
|
74830.392
|
Алкилат
|
489.36
|
43970.38
|
|
примеси
|
0.056
|
1.0
|
|
|
|
|
Этиленовая фракция
|
278.72
|
7513.29
|
|
|
|
|
Диэтилбензол
|
19.4
|
2600
|
|
|
|
|
Хлорид алюминия
|
0.97
|
130
|
|
|
|
|
Всего:
|
1258.566
|
85075.682
|
Всего:
|
1101.277
|
82521.38
|
Невязка
баланса:
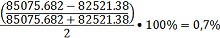
По
рассчитанному массовому количеству испаряющегося бензола уточняют тепловые
потоки:
Ф2 =
(0,0639+0,06937)
 134,218
134,218
 20=357,745 кВт
20=357,745 кВт
Ф7 =0,06937
 101,77
101,77
 90=635,381 кВт
90=635,381 кВт
Ф8 =0,06937
 78×
78×
 391,3 =2117,270 кВт
391,3 =2117,270 кВт
Тепловой поток
отходящих газов:
,236+635,381=785,617
кВт
Составляем тепловой
баланс алкилатора (табл.7). Значение Фпот определяем по разности прихода и
расхода теплоты.
Таблица 7
Тепловой баланс
алкилатора
|
Приход
|
кВт
|
%
|
Расход
|
кВт
|
%
|
|
Тепловой
поток этиленовой фракции
|
33.843
|
0.8
|
Тепловой
поток отходящих газов
|
785.617
|
18.9
|
|
Тепловой поток технического бензола
|
357.745
|
9.0
|
Тепловой
поток алкилата
|
1127.266
|
27.1
|
|
Тепловой
поток диэтилбензола
|
19.929
|
0.4
|
Расход
теплоты на испарение бензола
|
2117.270
|
50.9
|
|
Тепловой поток процесса
|
3743.404
|
90.0
|
Теплопотери
в окружающую среду
|
124.772
|
3.1
|
|
Всего:
|
4154.921
|
100,0
|
Всего:
|
4154.921
|
100,0
|
3.
Экологическая часть
С точки зрения
экологии рассматриваемого производства следует организовать взаимную
нейтрализацию кислых и щелочных вод, но для этого
необходимо, чтобы соблюдалось соотношение кислоты и щелочи. Раствор А1Сl3 может
быть использован как коагулянт для очистки сточных вод, а смолы, получаемые в
процессе, можно использовать как топливо и в строительстве.
В ходе
производства происходит образование отходящих газов в состав которых входят
метан, водород, азот, кислород оксид углерода, хлорид водорода, этилен, этан и
бензол. Одним из наиболее токсичных веществ, загрязняющих атмосферу, является
оксид углерода СО, который активно взаимодействует с гемоглобином крови и уже
при очень низких концентрациях снижает ее способность переносить кислород.
Содержание СО в воздухе около 0,01 % (по объему) вызывает головную боль,
снижение умственной деятельности и расстройство ряда физиологических функций
организма.
Оксид углерода
(II) - химически довольно инертный газ: в тропосфере он очень медленно
окисляется кислородом и озоном воздуха. Может продуцировать в почвах, причем и
небиологическим путем. Его ПДКр.з - 20 мг/мЗ, ПДКм.р. - 3 мг/мЗ.
Одним из
наиболее распространенных методов улавливания оксида углерода является
поглощение водой способ, не требующий сложной, дорогостоящей аппаратуры,
расхода теплоты и основан на использовании дешевого растворителя. Однако он не
достаточно эффективен. Для очистки газовых выбросов от СО используют реакцию
его доокисления до СО2
СО + Н2О =
СО2+ Н2 - 3,75 кДж/моль
проводимую с
использованием оксидных железных катализаторов.
К числу
глобальных загрязнений биосферы следует отнести ее загрязнение углеводородами.
Почти не представляя опасности как самостоятельные загрязняющие вещества
воздушной среды, углеводороды обусловливают мощность и плотность
фотохимического смога. При этом в результате фотохимических реакций
углеводороды образуют весьма токсичные продукты: альдегиды, кетоны. Метан и
другие низшие алканы, такие, как этан, пропан, накапливаясь в атмосфере, влекут
за собой постепенное повышение среднегодовой температуры, что является
следствием «парникового» эффекта. Метан устойчив в восстановительной среде, но
при доступе кислорода и повышении окислительных потенциалов он уже в почве
может окисляться метанотрофами с образованием углекислого газа и воды.
Таким образом,
необходимо проводить доочистку отходящих газов во избежание попадания вредных
токсичных веществ в атмосферный воздух.
Заключение
В данной
курсовой работе был рассмотрен процесс получения этилбензола в присутствии
хлорида алюминия, описана и изучена технологическая схема данного процесса,
были выявлены недостатки и достоинства данного процесса, составлены
материальный и тепловой балансы. Также были описаны вредные вещества, которые
выделяются в ходе данного процесса и способы их очистки или дальнейшего
использования.
Список использованных
источников
1. Филимонова
О.Н. Технологические расчеты производственных процессов [текст]: учеб. Пособие
/ О.Н. Филимонова, М.В. Енютина. - Воронеж: Воронеж, гос. технол. акад., 2005.
- 120 с.
2. Родионов
А.И. Техника защиты окружающей среды [текст]: учебник для вузов /А.И. Родионов,
В.Н. Клушин, Н.С. Торочешников. - 2-е изд., перераб. и доп. - М.: Химия, 1989.
- 512 с.
. Орлов
Д.С. Экология и охрана биосферы при химическом загрязнении [текст] / Д. С.
Орлов, Л.К. Садовников, И.Н. Лозановская - М.: Высшая школа, 2002. - 325 с.
4. Тимофеев
В.С. Принципы технологии основного органического и нефтехимического синтеза
[Текст]: учебное пособие для вузов / В.С. Тимофеев, А.А. Серафимов. - М.:
Химия, 1992.- 432с.
. Лазарев
И.В. Вредные вещества в промышленности [Текст]: справочник для химиков,
инженеров и врачей / И.В. Лазарев; под ред. проф. И.В. Лазарева и докт. биол.
наук И.Д. Гадаскиной. - 7-е изд., том 3.- Л.: Химия, 1979. - 810 с.
. Расчеты
химико-технологических процессов / Под общей редакцией проф. И.П. Мухленова. -
Л.: Химия, 1976. - 304 с.
7. Гутник С.П. Расчеты по технологии органического синтеза./С.П.
Гутник, В.Е., В.Е. Сосонко, В.Д. Гутман/ - М.: Химия,1988 - 272 с.
. Мухленов И.П. Расчеты
химико-технологических процессов/ И.П. Мухленов/ - Л.: Химия,1976. - 304 с.
. Протасов В.Ф. Экология,
здоровье и охрана окружающей среды в России /В.Ф. Протасов/ - М. Финансы и
статистика 1999 - 672 с.
. Курляндский Б.А. Общая
токсикология. /Б.А. Курляндский, В.А. Филатова/ - М.: Медицина, 2002-422 с.