Анализ изучения органической химии
Введение в органическую химию
1. Предмет органической химии
Органическая химия - это химия углеводородов и их
функциональных производных.
Специфика углеводородов в сравнении с водородными соединениями других
элементов заключается в особых свойствах атома углерода. Находясь в четвертой
группе второго периода периодической системы, углерод при образовании
химических связей не имеет на валентной оболочке ни электронных пар, ни
вакантных орбиталей; это обстоятельство обусловливает высокую химическую
устойчивость соединений. Кроме атомов углерода и водорода в состав органических
соединений входят и другие атомы периодической системы - O, S, N, P, атомы
галогенов и другие. Производные углеводородов, в которых один или несколько
атомов водорода замещены на другие атомы или группы атомов (функциональные
группы), называют функциональными производными.
1.1 Теория химического строения А, М. Бутлерова
Теория химического строения А. М. Бутлерова (1861) явилась фундаментом,
на котором строилась теоретическая органическая химия. Основные ее положения в
современной формулировке сводятся к следующему:
) Атомы в молекулах соединены друг с другом в определенной
последовательности в соответствии с их валентностью. Углерод во всех
органических соединениях четырехвалентен.
Химические формулы, отражающие порядок соединения атомов, называют
структурными:
Структурные формулы могут быть изображены и в сокращенном виде, например,
CH3 − CH2 − NH2 или C2H5NH2.
) Свойства веществ зависят не только от того, атомы каких элементов и в
каком количестве входят в состав молекул, но и от последовательности соединения
атомов в молекулах, т.е. от химического строения молекул.
) Атомы или группы атомов, образующие молекулу, взаимно влияют друг на
друга.
) Строение молекул может быть установлено на основе изучения их
химических свойств.
Изомерия органических веществ
Явление изомерии - наглядная иллюстрация второго положения теории А. М.
Бутлерова.
Изомеры - вещества, имеющие одинаковый качественный и
количественный состав, но различающиеся по строению, и, вследствие этого, по
физическим и химическим свойствам.
Различают структурную и пространственную изомерию.
Структурная изомерия связана с различным порядком соединения атомов в молекулах.
Разновидности структурной изомерии:
1) изомерия углеродного скелета
Этот тип изомерии обусловлен возможностью построения различных углеродных
скелетов из n углеродных атомов, если n больше или равно четырем. Например,
молекулярной формуле C4H10 соответствуют два вещества - бутан и 2-метилпропан
(изобутан):
3−CH2−CH2−CH3 CH3−CH−CH3
2)
3) изомерия положения
Атомы или группы атомов (заместители), не входящие в состав скелета,
могут быть соединены с различными углеродными атомами цепи:
−CH2−CH2−CH2−CH3 CH3−CH−CH2−CH3
К такому типу изомерии можно отнести изомерию, обусловленную различным
положением кратных связей:
=CH−CH2−CH3 CH3−CH=CH−CH3
4) межклассовая изомерия
Изомерами могут быть соединения, содержащие различные функциональные
группы и относящиеся к различным классам органических соединений, например:
3−CH2−NO2 H2N−CH2−COOH
Пространственная изомерия обусловлена различным расположением в пространстве
атомов и групп атомов в молекулах с одинаковой последовательностью соединения
атомов.
1) геометрическая изомерия
Этот вид изомерии характерен для соединений, содержащих двойную связь или
цикл. В таких молекулах часто можно провести условную плоскость таким образом,
что заместители у различных атомов углерода могут оказаться по одну сторону (цис-)
или по разные стороны (транс-) от этой плоскости:
2) оптическая изомерия
Оптическими изомерами называют молекулы, зеркальные изображения которых
не совместимы друг с другом. Таким свойством обладают молекулы, имеющие
асимметрический центр - атом углерода, связанный с четырьмя различными
заместителями. Например, в виде двух оптических изомеров существует молекула
молочной кислоты CH3−CH(OH)−COOH:
1.2 Особенности углерод-углеродных связей
Одной из причин многообразия органических веществ является способность
атома углерода к образованию различных типов углерод-углеродных связей.
Электронная конфигурация углерода 1s22s22p2, т. е. атом углерода имеет два
неспаренных p-электрона, которые могут принимать
участие в образовании двух ковалентных связей. Однако известно, что углерод,
как правило, образует четыре ковалентные связи. Это объясняется тем, что при
образовании ковалентных связей один из 2s-электронов переходит на свободную p-орбиталь, в результате чего появляются четыре неспаренных
электрона, которые могут образовать четыре ковалентные связи с другими атомами.
Но при этом одна из них будет образована за счет сферического s-электронного облака, а три - за счет
p-облаков, имеющих форму гантели.
Экспериментально установлено, что в молекулах предельных углеводородов
все связи атомов углерода равноценны. Это можно объяснить с привлечением
представлений о гибридизации электронных облаков. Согласно теории гибридизации
(Л. Полинг, 1931), в образовании химической связи могут принимать участие
гибридные (комбинированные) электронные облака, форма которых отличается от
форм исходных облаков.
sp3-гибридизация. В этом случае гибридные облака формируются за счет одного s- и трех p-облаков. Доля сферической s-орбитали в общей электронной плотности невелика, поэтому
четыре гибридных облака имеют форму немного несимметричной восьмерки.
Электронные облака одноименно (отрицательно) заряжены и стремятся максимально
удалиться друг от друга, что достигается при их ориентации в пространстве в
направлении от центра к вершинам тетраэдра (рис. 1). Углы между осями гибридных
электронных облаков составляют 109º28/. Подобным расположением химических
связей атомов углерода обусловлена
зигзагообразная форма углеродных цепей предельных углеводородов и
тетраэдрическое строение простейшего алкана - метана.

Рис. 1. sp3- гибридизованные орбитали
2-гибридизация. Этот тип гибридизации орбиталей реализуется при комбинации
одной s- и двух p-орбиталей. Образующиеся три sp2-орбитали лежат в одной плоскости и образуют углы 120º
(рис. 2). Доля s-орбитали в гибридной орбитали
увеличивается, поэтому sp2-орбиталь
представляет собой восьмерку, одна из долей которой короче и толще, чем в sp3-орбитали; атомный объем
уменьшается. Облако одного из p-электронов,
не участвующего в гибридизации, имеет форму симметричной относительно ядра
восьмерки и располагается перпендикулярно плоскости, в которой находятся
гибридные орбитали. При взаимодействии sp2-углеродных атомов расширяются возможности перекрывания их
орбиталей: наряду с перекрыванием по линии, соединяющей ядра атомов
(образование σ-связи) возможно боковое перекрывание негибридных орбиталей
(образование π-связи). Такая связь называется двойной связью и представляет
собой комбинацию σ- и π-связей (рис. 3). Поскольку объем sp2-углеродного атома меньше объема sp3-гибридного углерода, соответственно
и длина двойной связи будет меньше, чем длина одинарной.
В гибридизации участвуют лишь две орбитали атома углерода (s- и p-). Форма гибридной орбитали еще более приближается к
шарообразной, атомный объем становится еще меньше. Две гибридные орбитали,
стремясь максимально удалиться друг от друга, образуют с другими атомами связи,
ориентированные под углом 180º. Две другие p-орбитали атома углерода не участвуют в гибридизации и при
боковом перекрывании с подобными орбиталями другого sp-гибридного углерода образуют π-связи, расположенные во взаимно
перпендикулярных плоскостях (рис. 4). Возникаю-


Рис. sp-гибридизованные орбитали (а) и
пространственное расположение орбиталей в молекуле
ацетилена (б)
щая при этом химическая связь носит название тройной связи - это
комбинация одной σ- и двух π-связей. Атомный объем sp-гибридного углерода меньше, чем sp2-гибридного, поэтому тройная связь
должна быть короче двойной, а ее энергия - больше. Данные о различных типах
углерод-углеродных связей приведены в табл. 1.2.
Таблица 1.2. Сравнительная характеристика углерод-углеродных связей
|
Тип связи
|
Тип
гибридизации
|
Длина связи, нм
|
Угол между
гибридными орбиталями
|
Энергия связи,
кДж/моль
|
Форма молекулы
|
|
| | -C-C-
| |
|
sp3
|
0,154
|
109º28/
|
350
|
тетраэдри- ческая
|
|
>C=C<
|
sp2
|
0,134
|
120º
|
605
|
плоская
|
|
-C≡C-
|
sp
|
0,120
|
180º
|
825
|
линейная
|
Длина связи - среднее расстояние между ядрами атомов.
Энергия связи - энергия, которую необходимо затратить для разрыва
химической связи.
Простой расчет показывает, что на долю π-связи в двойной связи приходится (605
- 350) = 255 кДж/моль, что свидетельствует о том, что боковое перекрывание
орбиталей менее эффективно, чем линейное. На долю каждой из π-связей в тройной связи приходится еще
меньше [(825 - 350) : 2] = 237,5 кДж/моль. Из этого можно сделать вывод, что π-связи в молекуле наиболее слабые,
следовательно, в первую очередь будут подвергаться разрушению в химических
превращениях.
Электронные эффекты в органических молекулах
Все атомы, составляющие органическую молекулу, находятся во взаимосвязи и
испытывают взаимное влияние. Это влияние передается в основном через систему
ковалентных связей с помощью электронных эффектов.
Электронный эффект - смещение электронной плотности в молекуле под влиянием
отдельных атомов или групп атомов.
Смещение электронов, приводящее к поляризации связи, определяется
разностью электроотрицательностей атомов, образующих химическую связь. Атомы,
связанные полярной связью, несут частичные заряды:
-C → Cl (χC = 2,5; χCl = 3,0)
Смещение электронной плотности по цепи σ-связей называется индуктивным
эффектом и обозначается I.
Индуктивный эффект передается по цепи с затуханием, что объясняется малой
подвижностью электронов σ-связи:
3 → CH2 → CH2 → Cl δ+ >> δ/+ >> δ//+
В зависимости от того, удаляется ли электронная плотность от
рассматриваемого атома углерода или приближается к нему, индуктивный эффект
называют отрицательным (−I) или
положительным (+I).
Электроноакцепторные заместители, смещающие электронную плотность σ-связи от атома углерода к себе,
проявляют отрицательный индуктивный эффект (−I): галогены, NH2, OH, >C=O, COOH и др.
Электронодонорные заместители, смещающие электронную плотность к атому
углерода от себя, проявляют положительный индуктивный эффект (+I): атомы металлов, углеводородные
радикалы.
Индуктивный эффект проявляется и в случае, когда связанные между собой
атомы углерода различаются по типу гибридизации:
C → CH = CH2
Мезомерным эффектом, или эффектом сопряжения, называется
перераспределение электронной плотности, происходящее с участием негибридных p-орбиталей. Мезомерный эффект (M) осуществляется как через систему π-связей (например, в бутадиене-1,3),
так и через участие гетероатомов с неподеленными электронными парами (O, N, S):
=CH−CH=CH2 CH2=CH−O−CH=CH2
Мезомерный эффект, как и индуктивный, может быть как отрицательным, так и
положительным. Благодаря большей подвижности электронов π-связи M-эффект практически не ослабевает при передаче по сопряженной
цепи. По этой причине |M|
> | I |.
.3 Особенности органических реакций
Реакции органических соединений в принципе подчиняются тем же законам,
что и реакции неорганических веществ, хотя и имеют некоторые специфические
особенности.
В неорганических реакциях обычно участвуют ионы; реакции протекают быстро
(10−10 - 10−7 с) при достаточно низких температурах. В реакциях
органических соединений участвуют молекулы, при этом разрываются одни
малополярные ковалентные связи и образуются другие. Органические реакции
протекают медленнее ионных, часто для их осуществления необходимы
повышенные температуры, давление, катализаторы.
Органические реакции редко приводят к высокому выходу
продукта. Наличие в
молекуле нескольких идентичных или близких по энергии связей приводит к тому,
что реакции происходят одновременно по нескольким направлениям. Это
обстоятельство определяет способ записи органических реакций: как правило,
используют не химические уравнения, а схемы реакций, в которых обычно не
приводятся стехиометрические отношения:
Любая химическая реакция сопровождается разрывом одних связей между
атомами и образованием других. Разрыв ковалентных связей может осуществляться
следующими способами:
а) гомолитический разрыв - при этом пара электронов делится таким
образом, что каждая из образующихся частиц получает по одному электрону:
: X → R· + ·X
Нейтральный атом или частица с неспаренным электроном называется
свободным радикалом, а реакции с их участием - радикальными.
б) гетеролитический разрыв - при этом оба электрона связи остаются
с одной из ранее связанных частиц:
C : X R3C : + BXC : X R3C+ + AX
в этом случае образуется карбкатион.
Реакции, идущие с гетеролитическим разрывом ковалентных связей, относят к
ионным реакциям.
Разрыв химической связи происходит при нагревании, облучении, а чаще при
действии на молекулу вещества активной частицы - реагента. Активная частица
может быть ионом, нейтральной молекулой или радикалом.
Если реагент - отрицательный ион (OH−, Cl−)
или нейтральная молекула с неподеленной электронной парой (:NH3, H2O:), то его
называют нуклеофильным, т.е. обладающим сродством к ядру. Реакции с
участием таких реагентов называют нуклеофильными.
Если реагент - положительный ион (H+, Cl+, NO2+, H3C+), готовый
принять неподеленную пару электронов для образования новой связи, то его
называют электрофильным, а реакции с участием таких реагентов - электрофильными.
Классификация органических веществ
Основными структурными признаками, положенными в основу классификации
органических соединений, являются углеродный скелет и функциональная группа.
Классификация по типу углеродного скелета
В зависимости от строения углеродного скелета органические соединения
разделяют на ациклические - соединения с открытой (незамкнутой)
углеродной цепью и циклические.
Ациклические соединения могут быть как насыщенными (алканы), так и
ненасыщенными (алкены, алкины).
Циклические соединения - соединения с замкнутой цепью - в зависимости от
природы атомов, составляющих цикл, делят на карбоциклические и гетероциклические.
Карбоциклические соединения содержат в цикле только атомы углерода и делятся на
две существенно различающиеся по химическим свойствам группы: алифатические
циклические (сокращенно алициклические) и ароматические.
Гетероциклические соединения содержат в цикле, кроме атомов углерода, один или
несколько атомов других элементов - гетероатомов.
Классификация по типу функциональной группы
В большинстве органических соединений, кроме атомов углерода и водорода,
содержатся атомы других элементов (не входящие в скелет). Эти атомы или их
группировки, во многом определяющие физические и химические свойства
органических соединений, называют функциональными группами.
Функциональная группа оказывается окончательным признаком, по которому
соединения относятся к тому или иному классу. Важнейшие группы приведены в
табл. 1.1.
Соединения, имеющие одинаковые функциональные группы, но различающиеся
числом атомов углерода, обладают похожими физическими и химическими свойствами.
Такие соединения называются гомологами. Совокупность всех гомологов образует
гомологический ряд.
Таблица 1.1. Важнейшие функциональные группы
|
Функциональная
группа
|
Класс
соединения
|
|
Обозначение
|
Название
|
|
|
−F,
−Cl, −Br, −I
|
галоген
|
галогенопроизводные
|
|
−OH
|
гидроксил
|
спирты, фенолы
|
|
>C=O
|
карбонил
|
альдегиды,
кетоны
|
|
−COOH
|
карбоксил
|
карбоновые
кислоты
|
|
−NH2, >NH, >N−
|
аминогруппа
|
амины
|
|
−NO2
|
нитрогруппа
|
нитросоединения
|
|
−SO3H
|
сульфогруппа
|
сульфокислоты
|
1.4
Номенклатура органических соединений
Современная номенклатура (система присвоения названий) должна быть
систематической и международной, чтобы специалисты всего мира могли отобразить
в названии структуру соединения и, наоборот, по названию однозначно представить
структуру. В настоящее время в органической химии используется систематическая
номенклатура ИЮПАК (IUPAC − Международный союз теоретической и прикладной
химии).
В основу названия соединения по этой номенклатуре положена углеродная
цепь молекулы, содержащая максимальное число функциональных групп и кратных
связей. Начало нумерации цепи определяет наиболее старшая функциональная
группа. Порядок старшинства основных функциональных групп следующий:
−COOH > −C≡N >
−CHO > >C=O > −OH > −NH2 > −NO2
> Hal
Основу названия соединения составляет корень слова, обозначающий
предельный углеводород с тем же числом атомов, что и главная цепь; затем
следует суффикс, характеризующий степень ненасыщенности углеродной цепи (−ан,
−ен, −ин), а после суффикса арабскими цифрами указывается положение
кратной связи. Далее в суффикс выносится название самой старшей функциональной
группы в молекуле с указанием ее положения цифрой. Прочие заместители
обозначаются с помощью приставок. При этом они перечисляются не в порядке
старшинства, а по алфавиту. Положение заместителя указывается цифрой перед приcтавкой. Например:
2.
Алифатические
углеводороды
Углеводороды - это соединения, молекулы которых содержат только атомы
углерода и водорода. Углеводороды можно рассматривать как фундамент
органической химии.
Предельные
углеводороды (алканы)
Предельными углеводородами называют соединения, состоящие из атомов
углерода и водорода, соединенных между собой только σ-связями, и не содержащие циклов.
Общая формула алканов CnH2n+2, где n -
число атомов углерода. Для таких соединений характерно тетраэдрическое
состояние атома углерода (sp3-гибридное состояние).
.1 Номенклатура и изомерия алканов
Первые четыре члена гомологического ряда предельных углеводородов имеют
тривиальные названия: метан (CH4),
этан (C2H6), пропан (C3H8), бутан (C4H10). За основу
названий следующих гомологов берутся греческие числительные, соответствующие
числу атомов углерода, и окончание -ан: пентан (C5H12), гексан (C6H14) и т. д.
Номенклатура разветвленных алканов связана с выбором наиболее длинной
главной углеродной цепи. Нумерацию атомов углерода проводят таким образом,
чтобы сумма локантов (номеров углеродных атомов) в названии была наименьшей.
Алкильные группы рассматриваются как заместители. Единственным видом изомерии в ряду алканов является изомерия углеродного
скелета. Возможность существования соединений с разветвленной цепью − изомеров
нормальных углеводородов возникает, начиная с бутана С4Н10 (n=4). У бутана два
изомера:
С увеличением числа углеродных атомов n число изомеров возрастает. У
октана С8Н18 (n=8) 18 изомеров, у декана С10Н22 (n=10) − 75.
2.2 Методы получения алканов
Алканы, как правило, получают разделением природных смесей углеводородов.
Лабораторных способов получения немного:
1. Гидрирование алкенов
Сn Н2n + Н2 Сn H2n+2
2. Реакция Вюрца (взаимодействие галогеналканов с активными
металлами)
2 RBr + 2 Na R-R + 2 NaBr
3. Реакция Дюма (термическое декарбоксилирование солей органиче- ских
кислот)
−COONa + NaOH R−H + Na2CO3
.3 Химические свойства алканов
Предельные углеводороды при обычных условиях химически инертны. Это
объясняется большой прочностью неполярных и малополярных σ-связей С−С и С−Н. Алканы
не вступают в реакции присоединения, при умеренных температурах не
взаимодействуют с сильными окислителями. При сравнительно низких температурах
протекает лишь небольшое число реакций замещения, при которых происходит замена
атомов водорода на другие атомы и группы.
Реакция галогенирования
Смесь простого алкана (метана, этана, пропана) и хлора может существовать
без следов взаимодействия при комнатной температуре в темноте. Однако облучение
такой смеси ультрафиолетовым светом или нагревание до 300о приводит к бурной
экзотермической реакции с образованием галогенозамещенных углеводородов
(галогеналканов) по уравнению:
RH + X2 RX + HX (Х
: Сl, Br; R : алкил)
СН4 + Сl2 CH3Cl + HCl
Реакция протекает по свободнорадикальному механизму, который включает
следующие стадии:
. Инициирование. Процесс начинается с поглощения
молекулярным хлором кванта УФ-света и распада на два радикала:
Сl : Cl 2 Cl
2. Рост цепи. Образовавшийся атом хлора может оторвать атом
водорода от молекулы метана с получением метильного радикала и хлористого
водорода:
CH4 + Cl · CH3 · + НCl
Свободный метильный радикал может дальше оторвать атом хлора от молекулы
хлора и образовать хлористый метил и новый атом хлора:
CH3 · + Cl2 CH3Cl + Cl ·
Реакции такого типа называются цепными, поскольку один атом
хлора может инициировать хлорирование бесконечного числа молекул метана.
. Обрыв цепи. На практике протекание процесса
галогенирования ограничивается обрывом цепи, при которых два радикала реагируют
друг с другом:
· + Cl · CH3Cl· + Cl · Cl2
В этой реакции образуются не только монозамещенные, но и ди-, три- и
тетразамещенные производные метана:
CH3Cl + Cl2 CH2Cl2 (дихлорметан, хлористый метилен)
СH2Cl2 + Cl2 CHCl3 (трихлорметан, хлороформ)+ Cl2 CCl4 (тетрахлорметан,
четыреххлористый углерод)
При хлорировании разветвленных алканов следует иметь в виду, что
замещение атомов водорода при различных углеродных атомах протекает
неодинаково. В первую очередь замещается водород при третичных атомах углерода,
затем при вторичных, и в последнюю очередь замещается водород при первичных
атомах углерода. В итоге, как правило, получается смесь продуктов
галогенирования.
Нитрование алканов (реакция Коновалова)
Протекает по свободнорадикальному механизму в условиях высокой температуры,
которая способствует распаду молекул азотной кислоты на активные частицы.
+ HNO3 RNO2 + H2O
По аналогии с хлорированием процесс нитрования включает следующие стадии:
−CH3 + HNO3 CH3−CH2 −NO2
При нитровании этана и высших алканов образуются только
мононитропроизводные.
При высоких температурах протекают реакции с разрывом как С−Н, так
и С−С - связей: горение, дегидрирование, крекинг, изомеризация.
Горение алканов
Алканы горят на воздухе с выделением большого количества тепла:
2 C2H6 + 7 O2 4 CO2 + 6 H2O
Реакции дегидрирования
При сильном нагревании (выше 1000 ºС) разлагаются на простые вещества:
4 C + 2 H2
Если метан нагреть до более высокой температуры (1500 ºС), то образуется ацетилен:
2 CH4 H−C≡C−H + 3 H2
Эта реакция имеет большое практическое значение, так как открывает путь к
синтезу многих органических соединений.
Под действием катализаторов и при высокой температуре алканы отщепляют
водород и превращаются в непредельные углеводороды:
Крекинг алканов
Пиролиз или крекинг алканов при высоких температурах и давлениях без
доступа воздуха приводит к расщеплению молекул:
2.4 Применение алканов
Алканы применяют в качестве топлива в быту и на производстве. Особенно
широко используется метан в составе природного газа - это сырье для промышленного
получения водорода, ацетилена, сажи, галогенопроизводных. Изомеры углеводородов
разветвленного строения используют в производстве каучуков, высококачественных
сортов бензина.
Этиленовые углеводороды (алкены)
Углеводороды, содержащие в углеродной цепи одну двойную связь, называют алкенами
или олефинами. Общая формула гомологического ряда алкенов Сn H2n.
Номенклатура и изомерия алкенов
Названия этиленовых углеводородов образуются от названий соответствующих
предельных углеводородов заменой окончания -ан на -ен.
Как и для насыщенных углеводородов, для алкенов характерна изомерия скелета,
наряду с ней появляется изомерия положения двойной связи. В этом
случае при составлении названия соединения за основу берется название
насыщенного углеводорода и указывается наименьший номер атома углерода, при
котором находится двойная связь:
СН3−СН=СН−СН2−СН3
СН2=СН−СН2−СН2−СН3
В связи с отсутствием вращения вокруг двойной связи в алкенах появляется
еще один вид изомерии - геометрическая изомерия. Этот вид
изомерии характерен для алкенов, в молекулах которых с каждым из углеродных
атомов, образующих двойную связь, связаны два разных заместителя.
Различают цис- и транс- изомеры. В
цис-изомере заместители располагаются по одну сторону плоскости двойной связи.
В транс-изомере − по разные стороны (cis −(лат.) по эту сторону;
trans − по ту сторону, через):
Способы получения алкенов
В природе алкены встречаются редко. Основные методы получения -
синтетические. Как правило, образование двойной связи происходит в результате
реакций элиминирования - отщепления атомов или групп от двух соседних атомов
углерода в насыщенной углеродной цепи. Отщепление фрагментов типа НХ происходит
по правилу Зайцева: водород отщепляется от атома углерода, связанного с
наименьшим количеством атомов водорода. Наиболее распространенными способами
получения алкенов являются
1. Дегидрирование алканов:
−CH(Hal)−CH2−Hal + Zn R−CH=CH2 +
ZnHal2
. Дегидрогалогенирование галогенопроизводных:
−CH2−CH2−Hal + KOH R−CH=CH2 + KHal +
H2O
4. Дегидратация спиртов:
−CH2−CH2−OH R−CH=CH2 + H2O
Химические свойства алкенов
В противоположность алканам алкены - очень реакционноспособные вещества. Химические
свойства алкенов связаны прежде всего с реакционной способностью двойной связи.
Характерная особенность двойной связи - концентрация электронной плотности над-
и под плоскостью расположения σ-связей (рис. 3). Распределение
электронной плотности неравномерно, поэтому алкены склонны к реакциям электрофильного
присоединения по двойной связи с восстановлением термодинамически более
выгодной sp3-конфигурации углеродных атомов:
Повышенная электронная плотность у атомов углерода при двойной связи
притягивает соединения или частицы с дефицитом электронной плотности − электрофильные
частицы.
Реакция галогенирования
При взаимодействии алкенов с галогенами образуются дигалогеналканы:
=CH2 + Br2 Br−CH2−CH2−Br
В этой реакции роль электрофильной частицы выполняет молекула галогена,
поляризованная под воздействием повышенной электронной плотности двойной связи
:
Далее поляризованная молекула брома ориентируется около электронной
плотности -связи положительным полюсом, образуя комплекс
:
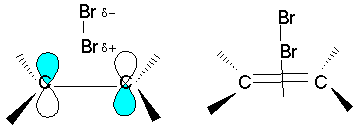
На следующей стадии происходит разрыв связи Вr-Br и -комплекс
превращается в σ- комплекс − карбокатион:

Реакция завершается присоединением аниона брома с получением
1,2-дибромэтана.
Аналогично бромируются и другие алкены:
СН3−СН=СН2 + Br2
CH3− CH−CH2
Реакция бромирования алкенов сопровождается обесцвечиванием бромной воды
и является качественной на двойную связь.
Реакция гидрогалогенирования
По электрофильному механизму протекает и присоединение по двойной связи
галогеноводородов. Так, этилен при взаимодействии с хлороводородом превращается
в хлорэтан:
=CH2 + HCl CH3−CH2Cl
В случае несимметричных алкенов реакция гидрогалогенирования может
протекать по двум направлениям:
В реакции в значительной степени преобладает один из двух возможных
продуктов, а именно 2-бромпропан.
Присоединение по двойной связи происходит по правилу Марковникова:
водород присоединяется к атому углерода, связанному с наибольшим количеством
водородных атомов.
Реакция протекает в присутствии катализатора − серной кислоты. При
этом в результате реакции из алкенов получают спирты. Например, из этилена
реакцией гидратации получают этиловый спирт:
=CH2 + HOH CH3−CH2−OH
В случае несимметричных алкенов гидратация протекает по правилу
Марковникова
CH2 = CH−CH3 + HOH
CH3−CH−CH3
Реакция гидрирования
Реакция присоединения водорода по двойной связи протекает в присутствии
катализатора (Ni, Pd, Pt) с образованием
насыщенных соединений:
2=CH2 + H2  CH3−CH3
CH3−CH3
Реакция полимеризации
Разновидностью реакций присоединения являются и реакции полимеризации:
CH2=CHR (−CH2−CHR−)n
Полимеризацией называется процесс, при котором небольшие молекулы реагируют
друг с другом с образованием высокомолекулярного соединения. Число n называют степенью полимеризации.
Полимеризацией тетрафторэтилена получают тефлон :
CF2=CF2 (−CF2−
CF2 −)n
Поливинилхлорид получают полимеризацией хлорэтена (хлористого винила):
CH2=CHCl (−CH2−CH −)n
Реакции окисления алкенов
Реакции окисления также затрагивают в первую очередь двойную связь. При
мягком окислении алкенов водным раствором перманганата калия (реакция Вагнера)
образуются двухатомные спирты:
CH2=CH2 + 2 KMnO4 + 4 H2O 3 HOCH2−CH2OH + 2 MnO2 + 2
KOH
В результате реакции фиолетовый раствор перманганата калия
обесцвечивается; эта реакция, как и реакция обесцвечивания бромной воды,
является качественной на двойную связь.
Как и все другие углеводороды, алкены горят:
n + 3n/2 O2 n CO2↑ + n H2O
2.5 Применение алкенов
Низшие алкены - важные исходные вещества для промышленного органического
синтеза. Из них получают полимеры, присадки к моторному топливу, растворители и
другие продукты.
Углеводороды, содержащие две двойные связи, называются диенами.
Они имеют общую формулу СnH2n-2 и классифицируются по принципу
взаимного расположения двойных связей:
1. Соединения с изолированными двойными связями, например
СН2=СН−СН2−СН=СН2
В этих соединениях двойные связи находятся достаточно далеко друг от
друга и не оказывают взаимного влияния. Свойства диенов с изолированными
двойными связями аналогичны свойствам алкенов:
СН2=СН−СН2−СН=СН2 + 2 HBr
СН3−СНBr−СН2−СНBr−СН3
2. Соединения с кумулированными двойными связями
(1,2-диены). Такие соединения называют алленами. Простейший представитель
алленов − пропандиен-1,2: СН2=С=СН2. Аллены менее стабильны, чем другие
представители диенов. Для них также характерны реакции присоединения по двойной
связи.
. Соединения с сопряженными двойными связями (1,3-диены), в
которых двойные связи разделены одной простой. Представители этой группы:
СН2=С−СН=СН2
СН2=СН−СН=СН2
3. Электронное строение сопряженных диенов
Атомы углерода, образующие двойные связи, находятся в sp2-гибридном состоянии и,
следовательно, имеют по одной негибридной p-орбитали, которые в 1,3-диенах перекрываются не только у
первого и второго, третьего и четвертого углеродных атомов, но вследствие
пространственного расположения также у второго и третьего углеродных атомов,
образуя общее для всех углеродных атомов π-электронное облако (рис. 5). Такое
взаимодействие двух соседних π-связей называется сопряжением.
Благодаря сопряжению в бутадиене -1,3 расстояние между атомами углерода,
связанными двойной связью, несколько больше, чем в алкенах, а между вторым и
третьим атомами - короче связи С-С в алканах:
3.1 Химические свойства сопряженных диенов
Реакции присоединения по двойным связям 1,3-диенов протекают значительно
легче, чем для большинства алкенов. При этом получаются продукты как 1,2-, так
и 1,4- присоединения:
СН3−СНBr−СН=СН2
СН2=СН−СН=СН2 + HBr
СН3−СН=СН−СН2Br
1-бромбутен-2
В большинстве случаев в смеси преобладает продукт 1,4-присоединения; его
образование обусловлено участием в реакции сопряженной электронной системы.
3.2 Применение сопряженных диенов
1,3-Диены применяются для получения искусственных каучуков реакцией
полимеризации:
n СН2=СН−СН=СН2 (−СН2 −СН=СН−СН2 −)n
n СН2=С−СН=СН2 (−СН2 −С=СН−СН2 −)n
3.3 Получение диенов
Бутадиен получают по способу Лебедева из этилового спирта:
, Al2O3
CH3−CH2−OH СН2=СН−СН=СН2 + 2 H2O + H2
или каталитическим дегидрированием бутана
Cr
СН3−СН2−СН2 −СН3 СН2=СН−СН=СН2 + 2 H2
Изопрен получают дегидрированием 2-метилбутана:
СН3−СН−СН2 −СН3 СН2=С−СН=СН2 + 2 H2
4. Углеводороды с одной тройной связью
(алкины)
Алкины -
углеводороды, содержащие кроме σ-связей две π-связи (тройную связь) у одной пары
углеродных атомов. Первый представитель этого класса веществ - ацетилен HC≡CH, в связи с чем алкины также называют ацетиленовыми
углеводородами. Общая формула гомологического ряда алкинов Сn Н2n−2 (изомерны алкадиенам).
4.1 Номенклатура и изомерия алкинов
Названия ацетиленовых углеводородов образуются от названий соответствующих
предельных углеводородов заменой окончания -ан на -ин.
Для алкинов характерны изомерия углеродного скелета и изомерия положения
тройной связи:
≡C−CH2−CH2−CH3 CH≡C−CH−CH3 CH3−C≡C−CH2−CH3
4.2 Методы получения алкинов
Общий способ получения алкинов - отщепление двух молекул галогеноводорода
от дигалогеналканов, которые содержат два атома галогена либо у соседних (а),
либо у одного атома углерода (б), под действием спиртового раствора щелочи:
а) R−CH(Hal)−CH2(Hal) + 2 KOH R−C≡C−H + 2 KHal + 2 H2O
б) R−C(Hal)2−CH3 + 2 KOH R−C≡C−H + 2 KHal +
2H2O
Ацетилен получают высокотемпературным крекингом метана
2 СН4 Н−С≡С−Н + 3 Н2,
а также гидролизом карбида кальция, образующегося при высоких
температурах из оксида кальция и углерода:
СаО + 3 С → СаС2 + СО СаС2 + 2 Н2О → Н−С≡С−Н
+ Са(ОН)2
4.3 Химические свойства алкинов
Типичными реакциями для алкинов являются реакции электрофильного
присоединения. Отличие алкинов от алкенов заключается в том, что реакции
присоединения могут протекать в две стадии, более медленно и, как правило,
требуют присутствия катализатора. Снижение реакционной способности алкинов по
сравнению с алкенами обусловлено большей прочностью тройной связи за счет
меньшей длины и более симметричного распределения электронной плотности.
Реакция галогенирования
Взаимодействие алкинов с галогенами протекает ступенчато, при этом
сначала образуются транс-дигалогеналкены, а затем тетрагалогеналканы:
=CHBr + Br2 CHBr2−CHBr2
Алкины, так же как и алкены, обесцвечивают бромную воду.
Реакция гидрогалогенирования
Эти реакции, как правило, проводят в присутствии катализаторов. Для
несимметричных алкинов на каждой стадии присоединение идет по правилу
Марковникова:
−C≡CH + HBr CH3−CBr=CH2
CH3−CBr=CH2 + HBr CH3−CBr2−CH3
Реакция гидратации (реакция Кучерова)
Вода присоединяется к алкинам с образованием неустойчивых продуктов −
енолов, которые быстро изомеризуются в карбонильные соединения. Реакция
протекает в присутствии сульфата ртути HgSO4 :
−C ≡C−R1 + H2O [ R−CH = C−R1 ] R−CH2−C=O
Реакция гидратации ацетилена по Кучерову имеет промышленное значение, в
результате образуется уксусный альдегид:
≡CH + H2O [ CH2=CH] CH3−C=O
Взаимодействие со спиртами
К реакциям электрофильного присоединения относится и реакция получения
виниловых эфиров:
−C ≡C−R + R1−OH R−CH=C−R
HC ≡CH + CH3OH CH2=C−OCH3
Реакция гидрирования
Реакция присоединения водорода к алкинам протекает в присутствии
катализатора (Ni, Pd, Pt ) с образованием ненасыщенных и насыщенных соединений.
Реакцию можно остановить на стадии получения алкенов.
≡CH + H2 CH2=CH2 CH2=CH2 + H2 CH3−CH3
Реакции полимеризации
В присутствии катализаторов алкины могут реагировать друг с другом,
причем в зависимости от условий образуются разные продукты. Так, в водном
растворе CuCl и NH4Cl ацетилен
димеризуется, давая винилацетилен:
HC≡CH + HC≡CH CH2=CH−C≡CH
В присутствии активированного угля при 600 ºС происходит тримеризация ацетилена с
образованием бензола:
Реакции замещения водорода
Атом водорода, находящийся у углерода в sp-гибридном состоянии, достаточно подвижен и способен
замещаться на атомы металлов. Поэтому алкины, в отличие от алкенов, способны
образовывать соли - ацетилениды:
СН≡СН + NaNH2 СН≡ СNa + NH3
HC≡CH + 2 [Ag(NH3)2]OH Ag−C≡C−Ag↓ + 2 NH3 +
2 H2O
Ацетилениды тяжелых металлов Ag, Cu, Hg представляют собой не истинные
соли, а ковалентно построенные соединения, нерастворимые в воде, взрывоопасные
в сухом виде.
Окисление алкинов
а) реакция горения:
2 С2Н2 +5 О2 4 CO2 + 2 H2O
При горении ацетилена в кислороде температура достигает 2800º − значительно выше, чем при
горении других углеводородов; это объясняется небольшим содержанием водорода в
ацетилене, а следовательно, и образованием при горении небольшого количества
воды, обладающей большой теплоемкостью.
б) взаимодействие с окислителями:
Алкины легко окисляются различными окислителями, в частности,
перманганатом калия; раствор KMnO4
обесцвечивается, что служит указанием на наличие тройной связи. При окислении
алкинов обычно происходит расщепление тройной связи с образованием карбоновых
кислот:
−C≡C−R/ + 3
[O] + H2O R−COOH + R/−COOH
Ацетилен в этой реакции образует углекислый газ и воду:
, H+≡CH 2 CO2 + H2O
Ацетилен используют в качестве горючего при газовой сварке и резке
металлов, в синтезе растворителей, полимеров, лекарств и других веществ.
5.
Ароматические
углеводороды
5.1 Понятие ароматичности. Правило Хюккеля
Ароматические углеводороды (арены) - вещества, молекулы которых
представляют собой плоские циклы с особым характером связи.
Наиболее распространены ароматические соединения, содержащие в цикле
шесть углеродных атомов; родоначальником этого ряда является бензол C6H6. Рентгеноструктурный анализ показывает, что молекула
бензола плоская, а длина С-С связей составляет 0,139 нм. Из этого следует, что
все шесть атомов углерода в бензоле находятся в sp2-гибридном состоянии, каждый атом углерода образует σ-связи с двумя другими атомами
углерода и одним атомом водорода, лежащими в одной плоскости, валентные углы
составляют 120º. Таким образом, σ-скелет молекулы бензола представляет
собой правильный шестиугольник. При этом каждый атом углерода имеет негибридную
p-орбиталь, расположенную
перпендикулярно плоскому скелету молекулы; все шесть негибридных p-электронов взаимодействуют между
собой,

Рис. 6. Перекрывание орбиталей (сопряжение) в молекуле бензола образуя π-связи, не локализованные в пары, а
объединенные в единое π-электронное облако.
Таким образом, в молекуле бензола осуществляется круговое сопряжение
(рис. 6). Графически строение бензола можно передать следующей формулой:
Круговое сопряжение дает выигрыш в энергии в 154 кДж/моль - эта величина
составляет энергию сопряжения - количество энергии, которое нужно
затратить, чтобы разрушить ароматическую систему бензола.
Для образования устойчивой ароматической системы необходимо, чтобы p-электроны формально группировались в
3, 5, 7 и т. д. двойных связей; математически это выражается правилом
Хюккеля: повышенной термодинамической стабильностью обладают
циклические соединения, имеющие плоское строение и содержащие в замкнутой
системе сопряжения (4n + 2)
электронов, где n - натуральный
ряд чисел. Например, все приведенные ниже структуры
5.2 Номенклатура и изомерия производных бензола
Структурная изомерия в ряду бензола связана с взаимным расположением
заместителей в кольце. Если в бензольном ядре содержится только один
заместитель, то такое соединение не имеет ароматических изомеров, так как все
атомы углерода в бензоле равноценны. Если с ядром связаны два заместителя, то
они могут находиться в трех разных положениях относительно друг друга.
Положение заместителей указывают цифрами или традиционно обозначают словами:
орто (о-), мета (м-) и пара (п-). Для соединений ряда
бензола широко применяются и тривиальные названия:
Методы получения аренов
В промышленности бензол и его гомологи получают при разделении природных
смесей углеводородов, а также фракционированием коксового газа и
каменноугольной смолы.
Синтетические методы:
1. Дегидрирование циклогексана и его гомологов:
2. Тримеризация ацетилена (метод Н.Д.Зелинского):
5.3 Химические свойства аренов
Реакции замещения
Подобно другим ненасыщенным соединениям бензол проявляет склонность к
реакциям с электрофильными реагентами. Однако в отличие от них бензол вступает
не в реакцию присоединения, а в реакции электрофильного замещения
водорода в бензольном кольце (SE):
Стадии электрофильного замещения
А) образование электрофильной частицы:
↔ X+ + Y−
Б) взаимодействие электрофила с ароматическим ядром:
При образовании π-комплекса электрофил X+ взаимодействует со всеми электронами бензольного кольца.
Затем два из шести π-электронов кольца образуют σ-связь между X+ и одним из атомов углерода. При этом ароматичность системы
нарушается, так как в кольце остается только четыре π-электрона, распределенные между пятью
атомами углерода (σ-комплекс)
В) восстановление ароматичности:
Для восстановления ароматичности σ-комплекс выбрасывает протон, а два
электрона связи C-H переходят в π-электронную систему кольца.
По механизму электрофильного замещения протекают следующие реакции
ароматических углеводородов:
а) галогенирование
б) нитрование
в) сульфирование
г) алкилирование
д) ацилирование
В бензоле реакционная способность всех шести атомов углерода одинакова.
Если же в бензольном кольце находится заместитель, он вызывает
перераспределение электронной плотности и определяет место вступления второго
заместителя, т.е. обладает ориентирующим действием. Заместители в бензольном
кольце делятся на два типа:
а) ориентанты I рода - электронодонорные - увеличивают электронную плотность в ядре, способствуя
протеканию реакции - NH2, OH, Cl, Br, алкил -
направляют новый заместитель в орто- или пара- положение;
б) ориентанты II рода - электроноакцепторные - оттягивающие электронную плотность ядра: NO2, SO3H, COOH и др. − направляют заместитель
в мета-положение:
Реакции присоединения
В реакциях присоединения разрушается ароматическая система, поэтому такие
реакции требуют больших затрат энергии и идут только в жестких условиях. органический углеродный диен карбонильный
а) гидрирование
б) галогенирование
При действии ультрафиолетовых лучей на раствор хлора в бензоле происходит
радикальное присоединение трех молекул галогена с образованием сложной смеси
стереоизомеров гексахлорциклогексана (гексахлорана):
Реакции окисления
По устойчивости к действию окислителей бензол напоминает алканы. Только
при сильном нагревании (400ºС) паров бензола с кислородом в
присутствии катализатора получается смесь малеиновой кислоты и ее ангидрида:
При действии окислителей на гомологи бензола происходит разрушение
боковой цепи. Какой бы сложной не была цепь заместителя, она разрушается, за
исключением α-углеродного атома, который окисляется в карбоксильную группу:
5.4 Полициклические арены. Нафталин
Примером конденсированных многоядерных ароматических соединений может
служить нафталин
Энергия сопряжения у нафталина меньше, чем у бензола, и химически он
более активен. Распределение электронной плотности в молекуле нафталина
неравномерно; длина β−β связей больше, чем остальных.
Электрофильное замещение в нафталине протекает в α-положение:
Реакция сульфирования нафталина в зависимости от условий приводит к
различным продуктам: при 50ºС образуется α-нафталинсульфокислота, при
температуре свыше 150ºС - β-изомер.
Окисление нафталина смесью дихромата калия и концентрированной серной
кислоты приводит к образованию фталевой кислоты, тогда как при каталитическом
окислении образуется фталевый ангидрид:
6.
Спирты и фенолы
6.1 Классификация спиртов
Спирты -
производные углеводородов, в которых один или несколько атомов водорода
замещены на гидроксильную группу ОН.
В зависимости от числа гидроксильных групп спирты делятся на одноатомные
(содержащие одну OH-группу) и
многоатомные (содержащие две и более OH-групп). Количество гидроксильных групп определяет атомность
спирта:
3C−CH2−OH HO−CH2−CH2−OH HO−CH2−CH−CH2−OH
В зависимости от того, при каком атоме углерода находится гидроксильная
группа, различают спирты
−CH2−OH R−CH−OH R/−C−OH
По характеру углеводородного радикала, связанного с гидроксильной
группой, различают предельные, непредельные и ароматические спирты. Причем к
ароматическим спиртам относят те, у которых гидроксогруппа отделена от
бензольного кольца хотя бы одним углеродным атомом.
Практически не удается получить спирты, в которых OH-группа непосредственно соединяется с
углеродом, участвующим в образовании двойной связи и спирты, содержащие две
гидроксогруппы у одного углеродного атома.
Общая формула предельных одноатомных спиртов СnН2n+1ОН. Попробуем
изобразить все возможные изомеры соединения состава C4H10O. Среди них четыре, относящиеся к
классу спиртов:
CH3−CH2−CH2−CH2−OH CH3−CH−CH2−CH3
CH3−CH−CH2−OH CH3−C−OH
СH3−CH2−O−CH2−CH3 CH3−O−CH−CH3 CH3−O−CH2−CH2−CH3
Очевидно, что для предельных одноатомных спиртов характерны следующие
виды изомерии: а) углеродного скелета, б) положения функциональной группы, в)
межклассовая.
Названия спиртов производят от названий соответствующих углеводородов
добавлением окончания -ол: CH3OH - метанол, C2H5OH - этанол и т. д. Положение OH-группы в цепи указывается цифрой. Нумерацию
цепи начинают с того края, ближе к которому расположена гидроксильная группа:
Методы получения спиртов:
1. Гидратация алкенов
−CH=CH2 + H2O R−CH−CH3
Присоединение воды протекает по правилу Марковникова, поэтому из
первичных спиртов по данной реакции можно получить только этанол.
2. Гидролиз галогенопроизводных водными растворами щелочей
R−Br + NaOH R−OH + NaBr
. Восстановление карбонильных соединений. При восстановлении
альдегидов образуются первичные спирты, при восстановлении кетонов -
вторичные:
−CH=O + H2 R−CH2−OH R−C−R/ + H2 R−CH−R/
Реакцию проводят, пропуская смесь паров альдегида или кетона и водорода
над никелевым катализатором.
Этанол получают при спиртовом брожении глюкозы:
С6Н12О6 2 С2Н5ОН + 2 СО2
6.2 Физические свойства. Водородная связь
Среди веществ гомологического ряда спиртов нет газообразных. Сравним
значения температур кипения низших спиртов и соответствующих им углеводородов:
|
вещество
|
Т. кип.
|
вещество
|
Т. кип.
|
|
CH4
|
−162º
|
C2H6
|
−88º
|
|
CH3OH
|
65º
|
C2H5OH
|
78º
|
Высокие температуры кипения спиртов свидетельствуют о значительном
межмолекулярном взаимодействии. Причина его - водородная связь между
молекулами:
O: [ H-O . . . H-O
Низшие спирты хорошо растворимы в воде опять же вследствие образования
водородных связей:
-O: [ H-O . . . H-O .
. . H-O
С увеличением количества атомов углерода в радикале R растворимость спиртов в воде
уменьшается.
Химические свойства
Связи С−О и О−Н в спиртах сильно поляризованы и способны к
разрыву. Различают два основных типа реакций одноатомных спиртов:
1. Реакции, идущие с разрывом связи О−Н:
а) с щелочными и щелочноземельными металлами
Кислотные свойства спиртов выражены слабо. Низшие спирты активно
реагируют с щелочными металлами:
2 C2H5OH + 2 Na 2 C2H5ONa + H2↑,
C2H5ONa + H2O C2H5OH + NaOH
Это свидетельствует о том, что спирты - более слабые кислоты, чем вода.
Кислотные свойства спиртов можно усилить введением электроноакцепторных групп,
например:
←CH2←CH2-OH.
б) с органическими и минеральными кислотами (этерификация)
H5OH + HO−NO2 C2H5O−NO2 + H2O
Скорость реакций, при которых разрывается связь O-H, уменьшается в
ряду: первичные спирты > вторичные > третичные.
. Реакции, идущие с разрывом связи С−О:
а) с галогеноводородами
3−CH2−OH + HBr CH3−CH2−Br + H2O
б) внутримолекулярная дегидратация
−CH2−OH H2C=CH2 + H2O
В спиртах сложного строения атом водорода отщепляется от атома углерода,
связанного с наименьшим количеством атомов водорода (правило Зайцева):
в) межмолекулярная дегидратация
Скорость реакций, при которых разрывается связь C-O, уменьшается в
ряду: третичные спирты > вторичные > первичные.
. Окисление спиртов
В качестве окислителей используются оксид меди, дихромат и перманганат
калия в присутствии серной кислоты. При окислении первичных спиртов образуются
альдегиды:
Третичные спирты окисляются в более жестких условиях, при этом происходит
разрыв ближайших к гидроксильной группе углерод-углеродных связей.
H5OH + 3 O2 2 CO2 + 3 H2O
Физические свойства. Этиленгликоль и глицерин - вязкие жидкости, сладкие на вкус,
хорошо растворимые в воде. Многоатомные спирты имеют большее количество
полярных гидроксильных групп, участвующих в образовании водородных связей,
поэтому их Т. кип. значительно выше, чем одноатомных спиртов:
|
вещество
|
Т. кип.
|
вещество
|
Т. кип.
|
|
CH3−СH2−OH
|
78º
|
CH3−CH2−CH2−OH
|
97º
|
|
CH2−CH2
| | OH OH
|
197º
|
CH2−CH−CH2
| | | OH OH OH
|
290º
|
Химические свойства многоатомных спиртов сходны со свойствами одноатомных
спиртов. В реакциях может участвовать либо одна, либо несколько гидроксильных
групп. Однако −I-эффект
дополнительных гидроксильных групп делает атомы водорода OH-групп более подвижными, поэтому
многоатомные спирты, в отличие от одноатомных, реагируют с щелочами, образуя
соли:
HO−CH2−CH2−OH + 2
NaOH NaO−CH2−CH2−ONa + 2 H2O
Особенно легко идет замещение атома водорода гидроксильной группы на ионы
тяжелых металлов в результате образования комплексов. Осадок гидроксида меди
растворяется в глицерине с получением ярко-синего раствора комплексного
соединения глицерата меди:
Реакция с гидроксидом меди используется при качественном определении
многоатомных спиртов, имеющих ОН-группы у соседних атомов углерода.
Этиленгликоль получают окислением этилена в водном растворе перманганата
калия:
СH2 = CH2 + H2OHO−СH2−CH2−OH
Глицерин ранее получали гидролизом растительных или животных жиров. В
настоящее время его получают из пропилена:
.3 Фенолы
Фенолами называют производные ароматических углеводородов, молекулы которых
содержат одну или несколько гидроксильных групп, непосредственно связанных с
бензольным кольцом.
Физические свойства. Большинство фенолов при комнатной температуре -
кристаллические вещества. Они обладают характерным запахом, довольно плохо
растворимы в холодной воде, но хорошо - в горячей.
Химические свойства. В фенолах неподеленная пара атома кислорода гидроксильной
группы образует с ароматическим кольцом единую π-систему. Вследствие этого электронная
плотность у атома кислорода уменьшается, а в бензольном кольце увеличивается.
Полярность связи O-H повышается и атом водорода
становится более подвижным. Кислотность фенола существенно выше, чем у
предельных спиртов, он реагирует не только с ативными металлами, но и с
щелочами:
Реакции электрофильного замещения в феноле протекают значительно легче,
чем в ароматических углеводородах вследствие донорного влияния гидроксильной
группы. Так, при действии бромной воды на фенол без присутствия катализатора на
бром замещаются сразу три атома водорода:
При нагревании фенола с формальдегидом происходит реакция поликонденсации
и образуется фенолформальдегидная смола - высокомолекулярное соединение с
разветвленной структурой типа
Способы получения.
1. Из галогенбензолов:
При обработке образовавшегося фенолята натрия кислотой получают фенол.
. Из ароматических сульфокислот. Реакция проводится при сплавлении
сульфокислот с щелочами. Первоначально образующиеся феноляты обрабатывают
сильными кислотами для получения свободных фенолов. Этот метод обычно применяют
для получения многоатомных фенолов.
3. При каталитическом окислении изопропилбензола (кумола) кислородом
воздуха образуются фенол и ацетон:
В настоящее время это основной промышленный способ производства фенола.
7. Карбонильные соединения
7.1 Классификация карбонильных соединений
Карбонильные соединения или оксосоединения - органические
вещества, в молекулах которых содержится карбонильная группа >С=О. Они
делятся на две родственные группы - альдегиды и кетоны. В
молекулах альдегидов карбонильная группа связана с атомами водорода или с одним
углеводородным радикалом: Н−С−Н , R−C−H, а в молекулах кетонов - с двумя
углеводородными радикалами:
−C−R/.
По строению углеводородного радикала различают алифатические (предельные
и непредельные), алициклические и ароматические карбонильные соединения. Общая
формула предельных альдегидов и кетонов СnН2nО.
Изомерия и номенклатура
Изомерия альдегидов связана только со строением углеродного скелета, а
кетонов - еще и с положением карбонильной группы.
Названия альдегидов образуются путем добавления окончания -аль к
названию предельного углеводорода, содержащего такое же количество углеродных атомов.
Кетоны называют, добавляя к названию предельного углеводорода окончание -он
и указывая номер атома углерода, связанного с карбонильным кислородом. В
рациональной номенклатуре названия простых кетонов составляют из названий
радикалов, связанных с карбонильной группой и слова «кетон», например:
Если альдегидная группа не является старшей в молекуле, то она
обозначается префиксом «формил», а кетонная - «оксо»:
Методы получения альдегидов и кетонов
1. Каталитическое дегидрирование спиртов:
Окисление происходит легко, однако образующиеся оксосоединения (особенно
альдегиды) необходимо во избежание их превращения в кислоты быстро удалять из
реакционной смеси.
2. Гидролиз геминальных дигалогенопроизводных:
−COOH + R/−COOH R−CO−R/ + CO2 + H2O
Усли R = R/, то получается симметричный кетон; если одна из кислот -
муравьиная (R/ = Н), то образуется альдегид.
Физические свойства
Первые члены гомологического ряда альдегидов - газ и низкокипящие
жидкости:
Температуры кипения альдегидов и кетонов значительно ниже, чем
соответствующих спиртов. Причина заключается в том, что карбонильные соединения
не в состоянии образовать эффективные водородные связи вследствие слабой
поляризации связи C-H:
Низшие альдегиды имеют резкий запах, у альдегидов с числом атомов
углерода от 3 до 6 весьма неприятный запах, высшие альдегиды обладают
цветочными запахами и применяются в парфюмерии.
Химические свойства
Химические свойства альдегидов и кетонов определяются наличием в их
составе карбонильной группы с полярной двойной связью. Электронная плотность
связи C = O смещена в сторону более электроотрицательного атома
кислорода:
- CH2 → C ← CH2 - R/
Как и в случае двойной С=С связи, для связи С=О характерны реакции
присоединения, однако протекают они не по электрофильному, а по нуклеофильному
механизму (AN). Активность альдегидов и кетонов в
реакциях присоединения определяется величиной положительного заряда на атоме
углерода карбонильной группы. Электронодонорные группы, связанные с группой
С=О, уменьшают величину этого заряда. Поэтому кетоны, карбонильная группа
которых связана с двумя электронодонорными углеводородными радикалами, менее
активны, чем альдегиды.
Кроме того, сильно поляризованная карбонильная группа оказывает
существенное влияние на водородные атомы, находящиеся у соседних с карбонильной
группой атомов углерода - они приобретают повышенную реакционную способность.
Реакции присоединения:
а) присоединение водорода (восстановление)
−CH=O + H2 R−CH2−OH
При взаимодействии альдегидов с водородом получаются первичные спирты,
кетоны в этой реакции образуют вторичные спирты.
б) присоединение циановодородной (синильной) кислоты
3−CH=O + H−CN CH3−CH−OH
Образовавшееся соединение - оксинитрил (циангидрин) содержит на один атом
углерода больше, чем исходный альдегид или кетон, поэтому подобные реакции
используются для удлинения углеродной цепи. Оксинитрилы легко превращаются в α-гидрокси- и α-аминокислоты.
в) получение бисульфитных производных
Гидросульфитные соединения - кристаллические вещества, которые при
нагревании с разбавленными кислотами разлагаются с образованием исходных
альдегидов. Они служат для выделения альдегидов и кетонов из их смесей с
другими веществами и получения их в чистом виде.
г) образование ацеталей
В присутствии каталитических количеств безводных кислот к альдегидам легко
присоединяются спирты с образованием ацеталей:
Эта реакция играет важную роль в превращении линейных форм углеводов в
циклические.
Реакции замещения карбонильного кислорода
а) реакции с аминосоединениями
С гидроксиламином альдегиды и кетоны дают оксимы:
3−C=O + H2N−OH CH3−C=NOH + H2O
При действии на альдегиды и кетоны гидразина и его производных образуются
гидразоны:
3−C=O + H2N−NH2 CH3−C=N−NH2 + H2O
Оксимы и гидразоны так же, как и бисульфитные производные, используются
для идентификации альдегидов и кетонов и для выделения их из смесей с
веществами других классов.
б) замещение кислорода на галоген
При действии пентахлорида или пентабромида фосфора атом кислорода в
молекуле альдегида или кетона замещается двумя атомами галогена:
−CH=O + PCl5 R−CHCl2 + POCl3
При гидролизе дигалогенпроизводные вновь образуют альдегиды и кетоны.
7.2 Реакции с участием атома водорода в α-положении к карбонильной группе
а) взаимодействие с галогенами
Атомы водорода в α-положении к карбонильной группе легко замещаются на
атомы галогенов. Эти реакции катализируются как основаниями, так и кислотами:
−CH2−C=O + Br2 R−CH−C=O + HBr
Образующиеся α-галогенпроизводные альдегидов и кетонов - сильные лакриматоры.
Их пары оказывают раздражающее действие на слизистые оболочки глаз и носа.
б) альдольная конденсация
В кислой или щелочной среде ацетальдегид и его гомологи способны
димеризоваться с образованием альдолей (альдегид + алкоголь):
−C=O + CH3−C=O CH3−CH−CH2−C=O
Альдоли - малоустойчивые соединения, они легко дегидратируются с
образованием α,β-непредельных карбонильных соединений:
−CH−CH2−C=O CH3−CH=CH−C=O + H2O
Конденсация альдегидов, протекающая с отщеплением воды, называется
кротоновой.
Окисление альдегидов и кетонов
Альдегиды легко (гораздо легче, чем спирты) окисляются в соответствующие
карбоновые кислоты:
2 [Ag(NH3)2]OH + R−C=O R−C=O + 2 Ag ↓ + H2O + 3 NH3
б) реакция медного зеркала
−C=O + 2 CH-O + 2 H2O R−C=O + Cu2O↓ + 2 CH-OH
CuOH Cu2O + H2O
Обе эти реакции реакции являются качественными реакциями на альдегиды.
Кетоны инертны по отношению к большинству окислителей и реагируют только
с очень сильными окислителями, способными разорвать связи С−С в их
молекулах.
Метаналь (формальдегид) используется для производства
фенолформальдегидных смол, красителей, лекарственных веществ, в качестве
дезинфицирующего средства; ацетальдегид используют главным образом для синтеза
уксусной кислоты.
8.
Карбоновые
кислоты
8.1 Классификация карбоновых кислот
Карбоновые кислоты - соединения, в которых карбоксильная группа связана с углеводородным радикалом или атомом водорода.
В зависимости от числа карбоксильных групп в молекуле различают кислоты
одноосновные, двухосновные и т. д., а в зависимости от строения углеводородного
радикала, с которым связана карбоксильная группа - алифатические,
алициклические, ароматические.
Если в углеводородном радикале карбоновых кислот один или несколько
атомов водорода замещены на другие функциональные группы, такие кислоты
называют полифункциональными, например, оксикислоты, аминокислоты.
Карбоновые кислоты с числом атомов углерода свыше шести называютвысшими(жирными)
кислотами; такое название они получили потому, что большинство из них могут
быть выделены из жиров.
Номенклатура и изомерия
Для насыщенных одноосновных карбоновых кислот характерна изомерия
углеродного скелета (начиная с бутановой кислоты), а также межклассовая
изомерия: карбоновые кислоты изомерны сложным эфирам.
В основе названий карбоновых кислот лежат названия соответствующих
углеводородов. Наличие карбоксильной группы отражается окончанием
овая кислота; углеродную цепь нумеруют, начиная с атома углерода
карбоксильной группы, например:
3−CH2−CH−CH2−CH2−CH−COOH CH3−C=CH−COOH
Методы получения
1. Окисление альдегидов и первичных спиртов (окислители - перманганат
калия KMnO4 и дихромат калия K2Cr2O7):
−CH2−OH R−CH=O R−COOH
2. Гидролиз галогенозамещенных углеводородов, содержащих три атома
галогена у одного атома углерода:
−CCl3 [R−C(OH)3] R−COOH +
H2O
3. Гидролиз нитрилов и других производных карбоновых кислот (эфиров,
амидов, ангидридов):
−CN + 2 H2O R−COONH4 R−COOH + NH4+
Для отдельных кислот существуют специфические способы получения.
Физические свойства
Насыщенные одноосновные карбоновые кислоты образуют гомологический ряд с
общей формулой CnH2n+1COOH. Низшие члены этого ряда при обычных условиях -
жидкости с характерным острым запахом, средние представители ряда - вязкие
маслообразные жидкости, начиная с С10 - твердые вещества.
Кислоты, содержащие 1 - 3 углеродных атома, неограниченно смешиваются с
водой; с ростом углеводородного радикала растворимость кислот уменьшается,
твердые высшие жирные кислоты в воде не растворяются.
Температуры кипения кислот выше, чем у спиртов с тем же количеством
углеродных атомов:
CH3OH (65ºС) и HCOOH (101ºС); CH3−CH2−OH
(78ºС) и CH3−COOH (118ºС)
Это объясняется большей прочностью водородных связей между молекулами
кислот, т.к. связи О -Н в них в большей степени поляризованы. Кроме того, в
твердом и жидком состояниях карбоновые кислоты существуют в виде димеров:
Химические свойства
Карбоксильная группа СООН состоит из карбонильной группы С=О и
гидроксильной группы О−Н. Свойства карбоксильной группы отличаются от
свойств составляющих ее групп, которые оказывают взаимное влияние друг на
друга. Распределение электронной плотности в карбоксильной группе можно
представить следующей схемой:
Участие неподеленнй пары атома кислорода гидроксильной группы в
сопряжении с электронами π-связи карбонильной группы значительно ослабляет связь
О-Н в гидроксиле и облегчает отщепление атома водорода в виде протона (Н+). В
водных растворах карбоновые кислоты обратимо диссоциируют:
−COOH ↔ R−COO−
+ H+
Введение в углеводородный радикал акцепторных заместителей повышает, а
донорных - понижает силу карбоновых кислот.
Карбоновые кислоты обладают всеми свойствами обычных кислот: они
реагируют с активными металлами, основными оксидами, основаниями и солями
слабых кислот, например:
2 CH3−COOH + Mg (CH3−COO)2Mg + H2↑
CH3−CH2−COOH + NaOH CH3−CH2−COONa + H2O
При замещении группы −ОН в карбоксиле образуются различные
функциональные производные кислот: сложные эфиры, ангидриды, галогенангидриды,
амиды.
Реакция образования сложных эфиров:
Образование галогенангидридов:
Атом водорода при соседнем с карбоксильной группой атоме углерода
способен замещаться на атомы галогенов:
3−CH2−COOH + Br2 CH3−CHBr−COOH +
HBr
И, наконец, при сплавлении солей карбоновых кислот со щелочами происходит
реакция декарбоксилирования; этой реакции способствует наличие в углеводородном
радикале акцепторных заместителей:
3−CH2−COONa + NaOH CH3−CH3 + Na2CO3
Муравьиная (метановая) кислота НСООН отличается от остальных рядом
особенностей, поскольку является не только кислотой, но и альдегидом.
Непредельные кислоты
Состав непредельных одноосновных кислот с одной двойной связью можно
выразить общей формулой СnH2n−1COOH. Простейшая непредельная одноосновная кислота -
пропеновая (акриловая) CH2=CH−COOH. α,β−непредельные кислоты
превосходят по силе соответствующие им кислоты жирного ряда. Непредельные
кислоты - бифункциональные соединения: для них характерны реакции как по
карбоксильной группе, так и по двойной связи.
Реакции присоединения по двойной связи протекают медленнее, чем в алкенах
вследствие акцепторного влияния карбоксильной группы; по той же причине
присоединение реагентов типа HX
идет против правила Марковникова:
2=CH−COOH + HBr Br−CH2−CH2−COOH
Более ценным полимером является полиметилметакрилат - органическое
стекло, получаемое из метилового эфира 2-метилпропеновой кислоты:
Широко распространены в природе непредельные кислоты, соответствующие
стеариновой кислоте С17Н35СООН (следует заметить, что большинство природных
кислот содержит четное число атомов углерода).
Линолевая кислота - С17Н31СООН - составная часть льняного масла содержит
две двойных связи:
3−(CH2)4−CH=CH−CH2−CH=CH−(CH2)7−COOH
Линоленовая кислота - С17Н29СООН - составная часть конопляного масла
содержит три двойных связи:
3−CH2−CH=CH−CH2−CH=CH−CH2−CH=CH−(CH2)7−COOH
Все природные непредельные высокомолекулярные кислоты, как правило,
являются цис-изомерами.
Липиды
К липидам относятся жиры и жироподобные вещества растительного и
животного происхождения. Обычно их разделяют на две подгруппы: простые липиды -
жиры и сложные липиды.
Жиры
Жиры наряду с углеводами и белками входят в состав всех растительных и
животных организмов и являются одним из важнейших компонентов пищи. Животные
жиры, как правило, твердые вещества, растительные - жидкие.
Жиры являются сложными эфирами, образованными высшими одноосновными
карбоновыми кислотами трехатомным спиртом глицерином:
В составе твердых жиров наиболее часто встречаются насыщенные кислоты:
пальмитиновая (С15H31COOH) и стеариновая (C17H35COOH). В составе
растительных жиров присутствуют непредельные карбоновые кислоты: олеиновая CH3−(CH2)7−CH=CH−(CH2)7−COOH (C17H33COOH) и линолевая CH3−(CH2)4−CH=CH−CH2−CH=CH−(CH2)7−COOH (C17H31COOH).
При гидролизе жиров в щелочной среде можно получить соли высших
карбоновых кислот. Например, гидролиз тристеарата глицерина в растворе
гидроксида натрия приводит к образованию натриевой соли стеариновой кислоты и
глицерина: Натриевые соли пальмитиновой и
стеариновой кислот обладают моющими свойствами и являются основой твердого
мыла. Калиевые соли этих кислот входят в состав жидкого мыла. В качестве
исходного сырья для производства мыла используют животные жиры, а также
растительные масла, которые предварительно подвергают гидрогенизации для
превращения в твердые жиры:
2C−O−C−(CH2)7−CH=CH−(CH2)7−CH3 H2C−O−C−C17H35−O−C−(CH2)7−CH=CH−(CH2)7−CH3 +
3 H2 H2C−O−C−C17H352C−O−C−(CH2)7−CH=CH−(CH2)7−CH3 H2C−O−C−C17H35
Сложные липиды
Сложные липиды - важнейший компонент клеточных мембран. К сложным липидам
относятся, в частности, фосфатиды - липиды, образующие при
гидролизе помимо глицерина и высших монокарбоновых кислот фосфорную кислоту и
аминоспирты. Наиболее известные фосфатиды - лецитины и кефалины.
Лецитины - глицериды, в которых две спиртовые группы глицерина
этерифицированы двумя, обычно разными, жирными кислотами, а третья -
фосфохолиновой группировкой. Кефалины построены по тому же
принципу, что и лецитины, но в их состав вместо холина входит остаток коламина
(этаноламина).
[HO−CH2−CH2−N(CH3)3]+ OH− HO−CH2−CH2−NH2
Липиды в биологических мембранах образуют бимолекулярный слой толщиной 5
- 8 нм с полярными группами по обе стороны слоя. Этот слой регулирует обмен
веществ в клетках, определяя проницаемость мембран для ионов, неэлектролитов и
воды.
9.
Оксикислоты.
Оксокислоты
9.1 Оптическая изомерия
Оптическая изомерия - один из видов пространственной изомерии. Явление
оптической изомерии связано с хиральностью молекул. Хиральность - свойство
объекта не быть тождественным своему зеркальному отражению (от слова
«хирос» - рука). Одна из причин (не единственная!) оптической изомерии -
наличие в молекуле органического соединения асимметрического углеродного
атома - атома, у которого все четыре заместителя различны. В этом
случае возникают две формы молекулы - два изомера, которые нельзя совместить в
пространстве, один из них является зеркальным отражением другого. Такие изомеры
называют оптическими изомерами или энантиомерами:
Оптические изомеры имеют одинаковые физические и химические свойства, за
исключением одного: они вращают плоскость поляризации света (это свойство
называется оптической активностью) на одинаковый угол, но в
противоположных направлениях. Величину оптической активности измеряют
поляриметрами.
Если вещество вращает плоскость поляризации вправо, то его называют правовращающим
(+), если влево, то левовращающим (−).
Оптически активные соединения с одним асимметрическим атомом
углерода.
К таким соединениям можно отнести, например, бутанол-2:
- CH2 - C*-CH3
Однако само по себе наличие асимметрического атома углерода не означает,
что вещество оптически активно. Бутанол-2, полученный обычными методами, не
обладает оптической активностью, поскольку содержит равное число молекул энантиомеров.
Такая смесь называется рацемической. Иногда физические свойства
рацемической смеси отличаются от свойств энантиомеров - в этом случае
происходит образование рацемата - соединения, имеющего иную
кристаллическую структуру, чем чистые энантиомеры. Так, синтетическая яблочная
кислота
HOOC-C*H-CH2-COOH
Проекционные формулы Фишера
При изображении молекул оптически активных веществ на бумаге обычно
пользуются проекционными формулами Э. Фишера. Для этого тетраэдрическую модель
молекулы располагают так, чтобы две ее связи находились в горизонтальной
плоскости - к читателю, а две другие - в вертиткальной - от читателя. Видимую в
таком положении картину переносят на плоскость бумаги. Вот как выглядят два
изомера молочной кислоты в виде проекционных формул:
В этих формулах асимметрические атомы углерода не записывают, а
подразумевают в точках пересечения вертикальной и горизонтальной линий. В
проекционных формулах нельзя произвольно менять местами заместители; запись
должна производиться так, как это следует из рассмотрения модели молекулы.
Разрешается только поворачивать всю формулу на 180º
в плоскости проекции, т.
е. в плоскости бумаги.
Оптически активные соединения с несколькими асимметрическими атомами углерода
Если в молекуле имеется n
асимметрических центров, то в общем случае число оптических изомеров составляет
N = 2n, но если молекула обладает какими-либо элементами симметрии,
то число стереоизомеров может быть меньше. Так, 2-гидрокси-3-хлорбутандиовая
(хлоряблочная) кислота
HOOC - C*H - C*H - COOH
Пары I - III, I - IV, II - III, II - IV являются диастереомерами. Диастереомеры
обладают различными физическими и химическими свойствами, так как расстояния
между соответствующими атомами и группами атомов у них различны, различно
поэтому и распределение электронной плотности в молекулах, а следовательно, и
свойства.
Молекула винной кислоты
- C*H - C*H - COOH
так же, как и молекула хлоряблочной кислоты, содержит два асимметрических
атома углерода, поэтому можно было ожидать для нее наличия четырех стереоизомеров:
D(+)-винная
кислота L(−)-винная кислота мезовинная
кислота рацемат - виноградная кислота
Однако винная кислота имеет два оптически активных изомера, один
оптически неактивный изомер и один рацемат. Молекула мезовинной кислоты имеет
элемент симметрии, поэтому структуры III и IV - это одна и та же кислота.
.2 Генетические ряды
Вещества, различные по строению, но имеющие родственную конфигурацию у
асимметрического центра, относят к одному стереохимическому ряду (D или L). Отнесением оптических антиподов к D и L
рядам целесообразно пользоваться лишь для углеводов и аминокислот. Знаки D (правый) и L (левый) не указывают направления вращения плоскости
поляризации: возможны варианты D(+), D(−), L(+) и L(−).
В качестве модели сравнения для отнесения вещества к D- или L-ряду
выбраны D(+) и L(−) глицериновые альдегиды:
Если расположение заместителей у асимметрического центра молекулы такое
же, как у D(+)-глицеринового альдегида, то его
относят к D-ряду и наоборот, независимо от того,
в каком направлении вещество вращает плоскость поляризации света.
Оксикислоты
Оксикислоты (правильнее - гидроксикислоты) - производные углеводородов,
молекулы которых одновременно содержат спиртовый гидроксил и карбоксильную
группу. В предыдущем разделе уже упоминались представители этого класса:
молочная, яблочная, винная кислоты; их названия свидетельствуют о том, что
гидроксикислоты широко распространены в природе.
По количеству карбоксильных групп различают одноосновные (гликолевая,
молочная) и многоосновные (яблочная, лимонная) гидроксикислоты. Атомность
гидроксикислот определяется количеством гидроксильных групп, включая гидроксил
карбоксильной группы.
По взаимному расположению ОН- и СООН-групп различают α,
β, γ- и т.д.
кислоты:
−CH−COOH HO−CH2−CH2−CH2−COOH
Способы получения
Одновременное присутствие в оксикислотах ОН- и СООН-групп позволяет
получать эти соединения как из спиртов, так и из кислот.
1. Окисление 1,2-диолов (гликолей)
−CH2−CH2−OH + O2 HO−CH2−COOH + H2O
2. Гидролиз галогензамещенных кислот
Cl−CH2−COOH + H2O HO−CH2−COOH + HCl
3. Синтез из карбонильных соединений
Физические и химические свойства
Оксикислоты - кристаллические вещества, легко растворимые в воде. Они
плавятся при значительно более высоких температурах, чем соответствующие
предельные кислоты, и лучше растворяются в воде. Причина этого - большее
количество водородных связей между молекулами оксикислот.
Благодаря акцепторному действию ОН-группы оксикислоты обладают более
выраженными кислотными свойствами:
CH3−CH2−COOH CH3−CH−COOH
Наличие в молекулах оксикислот карбоксильной и гидроксильной групп
приводит к тому, что эти вещества вступают в реакции, свойственные как спиртам,
так и кислотам. В то же время они обладают и специфическими свойствами.
1. Образование эфиров
Реакция этерификации может протекать как по карбоксильной, так и по
гидроксильной группе:
−CH2−COOH + (CH3CO)2O CH3−C−O−CH2−COOH
+ CH3COOH
2. Деструкция α-оксикислот
При нагревании с разбавленной серной кислотой α-оксикислоты распадаются до альдегидов
и муравьиной кислоты:
3. Дегидратация
Оксикислоты легко отщепляют воду, причем в зависимости от взаимного
положения гидроксильной и карбоксильной групп образуются различные вещества.
α-оксикислоты при нагревании образуют циклические
сложные эфиры - лактиды (от латинского названия молочной кислоты
- acidum lacticum):
Обратная реакция - гидролиз лактидов - один из способов получения α-оксикислот.
β-оксикислоты при нагревании отщепляют воду,
образуя непредельные кислоты:
3−CH−CH2−COOH CH3−CH=CH−COOH +
H2O
γ- и δ-оксикислоты в
свободном состоянии очень неустойчивы (существуют в виде солей). При действии
на эти соли сильных кислот они переходят в пяти- и шестичленные внутренние
сложные эфиры - лактоны:
Оксокислоты
Оксокислоты - бифункциональные соединения, молекулы которых содержат
карбоксильную и альдегидную или кетонную группы и подразделяются соответственно
на альдегидо- и кетокислоты.
Оксокислоты широко распространены в природе, являются промежуточными
соединениями во многих процессах обмена веществ.
Способы получения оксокислот
1. Окисление гидроксикислот
2. Гидролиз нитрилов, образующихся при взаимодействии хлорангидридов
кислот с цианидом натрия
.Конденсация Кляйзена (по своему механизму напоминает альдольную
конденсацию)
Химические свойства
1. Сила кислот
Введение в молекулу кислоты акцепторной карбонильной группы, обладающей
значительным −I-эффектом,
существенно увеличивает силу кислот. С ростом углеродной цепи этот эффект
затухает:
3−CH2−COOH pKa = 4,88
CH3−CO−COOH pKa = 1,49
CH3−CO−CH2−COOH pKa = 3,51
CH3−CO−CH2−CH2−COOH pKa = 4,63
. Специфические реакции оксокислот
а) Аминирование - метод синтеза аминокислот
−CH2−C−COOH … HOOC−CH2−CH−COOH
б) Декарбоксилирование
Большинство оксокислот - неустойчивые соединения. При хранении или
небольшом нагревании они легко разлагаются с выделением углекислого газа. В
организме этот процесс протекает под действием фермента декарбоксилазы.
.3 Ацетоуксусный эфир. Таутомерия
Строение ацетоуксусного эфира было предметом спора химиков в течение
многих десятилетий. Одни рассматривали его как ацетоуксусный эфир(I), другие считали его эфиром
3-гидроксикротоновой кислоты (II):
Обе версии имели эспериментальное подтверждение. Так, подобно другим
кетонам, ацетоуксусный эфир присоединяет циановодородную кислоту с образованием
циангидрина:
3C−C−CH2−COOC2H5 + HCN H3C−C−CH2−COOC2H5
Кроме того, как спирт, имеющий гидроксил при атоме углерода с двойной
связью (енол), ацетоуксусный эфир дает с хлоридом железа фиолетовое
окрашивание.
Исследования показали, что ацетоуксусный эфир представляет собой смесь
двух изомеров: кетонной (92,5 %) и енольной (7,5 %) форм. Оба изомера находятся
в равновесии друг с другом. Прибавив к раствору ацетоуксусного эфира хлорид
железа, заметим появление фиолетовой окраски, прибавляя затем по каплям бром,
переведем енол в бромпроизводное - окраска исчезнет, однако со временем
появится вновь, так как нарушенное равновесие восстановится и часть кетонной
формы (I) перейдет в енольную (II).
Явление существования вещества в виде нескольких изомерных
форм, легко переходящих друг в друга и находящихся в подвижном равновесии,
называется таутомерией.
Чаще всего переход одной изомерной формы в другую связан с миграцией
подвижного атома водорода:
10. Моносахариды
10.1 Общая характеристика углеводов
Углеводы - природные органические соединения, представляющие собой
многоатомные альдегидо- или кетоспирты неразветвленного строения, большинство
из которых отвечает общей формуле Cn(H2O)m.
Однако не все соединения с таким соотношением количеств атомов углерода,
водорода и кислорода - углеводы, например, CH2O - формальдегид и
C2H4O2 - уксусная
кислота не являются углеводами. Существуют углеводы иного количественного
состава, например, C5H10O4 - дезоксирибоза, C6H12O5 - рамноза.
Углеводы широко распространены в природе, являются компонентами продуктов
питания. Сахар, мед, крахмал представляют собой чистые углеводы. В организмах
растений и животных углеводы выполняют опорную, энергетическую, дыхательную
функции. Важную роль играют соединения углеводов с другими классами веществ,
такие как гликопротеиды, нуклеотиды.
Животные организмы не способны синтезировать углеводы и получают их с
продуктами растительного происхождения. Растения и некоторые бактерии образуют
углеводы из углекислого газа и воды в процессе фотосинтеза, общая схема
которого может быть представлена уравнением:
6 CO2 + 6 H2O C6H12O6 + 6 O2
Ежегодно в результате фотосинтеза образуется около 100 млрд т
органического вещества (более 15 т на каждого жителя планеты).
10.2 Классификация углеводов
Углеводы делятся на две большие группы - моносахариды (монозы, простые
сахара) и полисахариды (сложные сахара).
Моносахариды - углеводы, которые не могут гидролизоваться с образованием
более простых углеводов. Моносахариды являются многоатомными альдегидо- или
кетоспиртами и подразделяются соответственно на альдозы и кетозы.
Полисахариды образуются из моносахаридов при конденсации их в процессе
биосинтеза. Полисахариды делятся на низкомолекулярные (сахароподобные,
олигосахариды) и высокомолекулярные (несахароподобные).
Олигосахариды содержат в молекуле небольшое число (2-10) остатков моноз.
Одни из них восстанавливают ионы серебра и меди (II) и называются восстанавливающими, другие не
восстанавливают - невосстанавливающие.
Высокомолекулярные полисахариды содержат от десятков до нескольких десятков
тысяч остатков моноз. Если молекулы моносахарида состоят из остатков одного
моносахарида, его называют гомополисахаридом. Гетерополисахариды
содержат в цепи остатки различных моносахаридов.
Альдозы. Изомерия. Генетические ряды
По числу атомов углерода альдозы делятся на триозы ( n=3), тетрозы (n =4), пентозы (n =5) и гексозы (n =6). Две последние группы наиболее
распространены в природе.
Все альдозы содержат асимметрические атомы углерода и существуют в виде
нескольких оптических изомеров, общее число которых можно определить по формуле
Фишера: N = 2n, где n -
число асимметрических центров.
Для каждого из оптических изомеров существует один его оптический антипод
- энантиомер, все остальные являются диастереомерами.
Принадлежность моносахарида к тому или иному генетическому ряду
определяется по конфигурации его наиболее удаленного от альдегидной группы
асимметрического углеродного атома. Если она соответствует конфигурации D-глицеринового альдегида, то моноза
относится к D-ряду, если L-глицеринового альдегида - к L-ряду.
Альдозы проявляют далеко не все свойства, характерные для альдегидов.
Так, они не дают реакции с фуксинсернистой кислотой и очень медленно реагируют
с гидросульфитом натрия. В то же время наблюдается повышенная активность одной
из гидроксильных групп, количество изомеров альдоз в два раза больше, чем
предсказывает формула Фишера, кроме того, для альдоз характерно явление мутаротации
- изменение угла вращения свежеприготовленных растворов.
Для объяснения этих противоречий в конце XIX в. была высказана мысль, что моносахариды могут
существовать не только в линейной форме, но и в форме циклических внутренних
полуацеталей, не содержащих карбонильной группы. В дальнейшем было доказано,
что для моносахаридов характерна цикло-цепная таутомерия: в
кристаллическом состоянии они имеют циклическое строение, а в растворах
существуют в виде циклических и открытоцепных форм, находящихся в динамическом
равновесии.
Образование циклических форм моносахаридов обусловлено взаимодействием
альдегидной группы с гидроксилом, находящимся у С5, реже у С4-атома:
Образовавшееся соединение - внутренний циклический полуацеталь. Поэтому
циклические формы моноз называют полуацетальными.
В результате замыкания цикла в молекуле появляется новый асимметрический
центр - это приводит к удвоению числа изомеров:
Более наглядно строение циклических форм моносахаридов можно представить
с помощью «перспективных» формул Хеуорса:
Группа −ОН при первом углеродном атоме в циклических формах
называетя гликозидным гидроксилом. Он гораздо реакционноспособнее
остальных гидроксильных групп, легко реагирует со спиртами или со второй
молекулой моносахарида с образованием гликозидов.
Кристаллические формы α- и β-глюкозы вполне устойчивы, но в
растворе каждая из них медленно превращается в равновесную смесь обеих форм:
Изменение угла вращения свежеприготовленных растворов сахаров, связанное
с переходом одних таутомерных форм в другие до наступления состояния
равновесия, называется мутаротацией.
Кетозы
Кетозы являются изомерами альдоз с тем же количеством углеродных атомов.
Они имеют на один асимметрический центр меньше, чем альдозы, а следовательно,
меньшее количество изомеров. Кетозы, как и альдозы, существуют в нескольких
таутомерных формах:
.3 Химические свойства моносахаридов
Моносахариды - бифункциональные соединения, поэтому их химические
свойства обусловлены наличием в молекулах как карбонильных (в линейной форме),
так и гидроксильных групп.
А. Реакции альдегидной группы.
Альдегидная группа альдоз легко окисляется в карбоксильную даже такими
слабыми окислителями, как аммиачный раствор оксида серебра или гидроксид
меди(II):
−CH2−(CHOH)4−CH=O + Ag2O HO−CH2−(CHOH)4−COOH + 2 Ag
Глюконовая кислота относится к так называемым альдоновым
кислотам. В более жестких условиях образуются сахарные кислоты:
HO−CH2−(CHOH)4−CH=O HOOC−(CHOH)4−COOH
Альдоновые и сахарные кислоты из-за отсутствия карбонильной группы не
способны к цикло-цепной таутомерии.
Фруктоза при окислении образует две кислоты: щавелевую и винную:
−(CHOH)3−C−CH2OH HOOC−COOH + HOOC−CH−CH−COOH
2. Восстановление
При восстановлении моносахариды превращаются в многоатомные спирты. Так,
при восстановлении глюкозы образуется шестиатомный спирт - сорбит:
−CH2−(CHOH)4−CH=O HO−CH2−(CHOH)4−CH2−OH
Б. Реакции гидроксильных групп.
1. С гидроксидом меди(II) без нагревания глюкоза реагирует как
многоатомный спирт и образует раствор синего цвета.
. Образование простых эфиров
Образование простых эфиров в первую очередь происходит по гидроксилу,
связанному с С1 (гликозидный, или полуацетальный гидроксил); такие эфиры носят
название гликозидов. Гликозиды - широко распространенные
природные соединения.
. Образование сложных эфиров
При действии на глюкозу ангидридов кислот образуются сложные эфиры:
Большое значение имеют сложные эфиры, образованные моносахаридами и
ортофосфорной кислотой.
В. Реакции брожения
Важным свойством моносахаридов является их ферментативное брожение.
Брожению подвергаются в основном гексозы. Молекулы глюкозы способны к
расщеплению под действием различных микроорганизмов. Основные виды брожения:
а) спиртовое брожение
С6Н12О6 2 С2Н5ОН + 2 СО2
б) молочнокислое брожение
С6Н12О6 2 СН3−СН(ОН)−СООН
в) маслянокислое брожение
С6Н12О6 С3Н7−СООН + 2 СО2 + 2 Н2