Параметры хемилюминесцентной активности нейтрофилов у практически здоровых людей
ОГЛАВЛЕНИЕ
СПИСОК СОКРАЩЕНИЙ.. 2
ВВЕДЕНИЕ. 3
ОБЗОР ЛИТЕРАТУРЫ.. 4
1.1 Нейтрофильные
гранулоциты.. 5
1.2 Созревание
нейтрофилов. 6
1.3 Движение
нейтрофилов. 7
1.4 Функции нейтрофилов. 8
2.1 Хемилюминесцентный
анализ оценки активности нейтрофильных гранулоцитов 10
2.2 Основные стадии
хемилюминесцентного анализа. 10
2.3 Свободные радикалы
хемилюминесценции клеток. 11
2.2 Применение
хемилюминесцентного анализа. 13
МАТЕРИАЛЫ И МЕТОДЫ.. 13
3.1 Объект исследования. 14
3.2 Хемилюминесцентный
анализ. 14
3.2.1Реактивы.. 14
3.2.2 Принцип действия
хемилюминесцентного анализа. 14
3.2.3Методика
определения хемилюминесценции. 15
3.2.4 Расчеты.. 16
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ. 17
ВЫВОДЫ.. 19
РЕФЕРАТ(SUMMARY) 20
СПИСОК ЛИТЕРАТУРЫ.. 21
ХЛ – Хемилюминесценция
СР – Свободный радикал
ХЛсп – Спонтанная хемилюминесценция
ХЛакт – Активированная хемилюминесценция
Ихл – Индекс хемилюминесценции
АФК – Активные формы кислорода
В современном мире огромное значение уделяется профилактике
заболеваний. Но, кроме того, чтобы следовать профилактике, необходим огромный
диагностический комплекс. В последние десятилетия медицина стремиться
усовершенствовать самые различные анализы крови.[[1]]
Кровь - самая исследуемая и самая информативная из сред
организма: современная лабораторная диагностика показателей крови даёт более
60% информации о пациенте. В первую очередь, любая патология отражается на
обменных процессах в организме вообще и на состоянии иммунного (антигенного)
статуса в частности.[[2]]
Иммунная система человека обеспечивает его биологическую
индивидуальность и защищает организм человека от чужеродных агентов, антигенов.
Она представляет собой комплекс органов и клеток, способных выполнять
иммунологические функции. Центральная роль в иммунном ответе всегда принадлежит
лейкоцитам, а точнее нейтрофилам. Нейтрофильный ответ - самый первый ответ на
бактериальные и многие другие инфекции. Нейтрофильный ответ при острых
воспалениях и инфекциях всегда предшествует более специфическомулимфоцитарному.[[3]]
Целью моей работы является определение параметров в хемилюминесцентной
активности нейтрофильных гранулоцитов у практически здоровых людей.
На основании поставленной цели были определены следующие
задачи:
1. Составить
обзор литературы по данной проблеме.
2. Отработать
метод хемилюминесценции.
Лейкоциты, или белые кровяные клетки, периферической крови
позвоночных и человека разнородны по морфологическим признакам и биологической
роли. Все лейкоциты подразделяются на две большие группы: зернистые лейкоциты
(или гранулоциты) и не зернистые лейкоциты (агранулоциты). Группа зернистых
лейкоцитов характеризуется наличием в цитоплазме специфической зернистости и
сегментированными ядрами. При окраске смесью кислого (эозин) и основного (азур)
красителей по методу Романовского-Гимзы зернистость в одних лейкоцитах
обнаруживает сродство к кислым красителям, и такие лейкоциты называются
эозинофильными, или ацидофильными, в других — косновным красителям —
базофильные лейкоциты; зернистость третьих обнаруживает сродство к кислым и основным
красителям, такие лейкоциты называются нейтрофилъными, или гетерофильными. Группа
незернистых лейкоцитов отличается отсутствием специфической зернистости в
цитоплазме и несегментированными ядрами. Они подразделяются на лимфоциты и
моноциты, имеющие разные морфологические и функциональные показатели.[4]
Нейтрофильные гранулоциты (granulocytusneutrophilicus) —
нейтрофильные лейкоциты, или нейтрофилы, имеют округлую форму, их диаметр в
капле свежей крови около 7—9 мкм. На стекле при изготовлении мазка они
несколько распластываются, и их диаметр составляет 10—12 мкм. В крови взрослого
человека нейтрофилов содержится больше, чем других лейкоцитов; их относительное
количество достигает 65—75% от общего числа лейкоцитов.[4]
Цитоплазма нейтрофилов слабо оксифильна, в ней содержится
мелкая зернистость, плохо заметная не только на свежих, но и на фиксированных,
окрашенных препаратах. Количество гранул в каждой клетке может быть от 50 до
200. При окраске по методу Романовского-Гимзы зернистость принимает
розово-фиолетовый цвет. Зернистостью занята не вся цитоплазма — поверхностный
слой ее в виде узкой каемки остается гомогенным, содержит тонкие филаменты.
Этот слой играет главную роль при амебоидном движении клетки, участвуя в
образовании псевдоподии.[4]
В зависимости от строения и химического состава различают
два основных типа зернистости: специфическую (вторичные гранулы) и азурофильную
(первичные гранулы). Специфическая зернистость преобладает и составляет около
80-90% всех гранул. В ней выявляется щелочная фосфатаза, пероксидаза,
цитохромоксидаза, мурамидаза, аминопептидаза, а также гликоген, липиды и др.
Количество азурофильных гранул составляет 10-20%, они представляют собой лизосомы
с характерным набором гидролитических ферментов.[4]
Ядра нейтрофилов содержат довольно плотный хроматин,
особенно по периферии, в котором трудно различить ядрышки. Зрелые нейтрофилы
имеют сегментированное ядро, состоящие из 2-3 долек, связанных очень тонкими
перемычками. Они составляют 60-65% лейкоцитов. 3-5% нейтрофилов содержат ядро в
виде палочки или подковы. 0-0,5% в периферической крови юных форм нейтрофилов,
имеющих бобовидное ядро.[4]
Нейтрофилы обладают высокой подвижностью и фагоцитарной
способностью, способны к хемотаксису. Они захватывают бактерии и другие
частицы, которые разрушаются (перевариваются) под действием гидролитических ферментов.
Живут нейтрофильные гранулоциты до 8 сут. В кровеносном русле они находятся
8-12 ч, а затем выходят в соединительную ткань, где осуществляют свои функции.[[4]]
Период пребывания нейтрофилов в периферической крови
составляет примерно 6-8 ч, и это, вероятно, объясняет их продукцию с
удивительно высокой скоростью - 2.5 биллиона клеток в час. Так же как и другие
лейкоциты, нейтрофилы происходят из общей полипотентной стволовой клетки в
костном мозгу (рис, 1).[5]
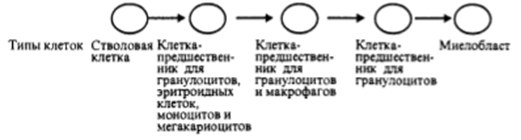
Рисунок1 - Происхождение
нейтрофилов
Длительность цикла дифференцировки нейтрофилов от
клетки-предшественника до зрелой клетки составляет в зависимости от степени
активности процесса от 7 до 10 дней.[5]
Созревание нейтрофилов в костном мозгу сопряжено с динамикой
морфологических изменений клеток: постепенное уменьшение размеров ядра с
увеличением доли цитоплазмы, исчезновение ядрышек, конденсация хроматина и
концентрация его у оболочки клетки, сегментация ядра, утрата базофилии
цитоплазмы, появление специфической нейтрофильной зернистости. Особенности
ультраструктуры и цитохимии миелобластов (наличие ядрышек, большое количество
рибосом, развитые аппарат Гольджи и система эндоплазматического ретикулума)
свидетельствуют о том, что метаболизм этих клеток направлен на поддерживание
высоких темпов синтеза нуклеиновых кислот и цитоплазматических белков. На
стадии поздних миелобластов и промиелоцитов в аппарате Гольджи и в системе
эндоплазматического ретикулума происходит интенсивное образование первичных
гранул.[5]
Для процесса созревания нейтрофилов необходимо наличие двух
условий: поддержание достаточного количества стволовых клеток и дифференцировка
этих клеток в зрелые под воздействием различных факторов роста.[[5]]
Активное перемещение относится к числу наиболее характерных
признаков нейтрофилов. Нейтрофильный гранулоцит двигается гораздо быстрее
других лейкоцитов и более чувствителен к действию разнообразных модуляторов
миграционной функции. При спонтанной миграции нейтрофил двигается беспорядочно,
периодически меняя вектор движения. Клетка выбрасывает псевдоподии, которые
необязательно совпадают с осью уже начавшегося перемещения, а потому вызывают
изменение миграционного маршрута. Структурной основой миграционной функции
служат сократительные белки, подобные, но не идентичные актину и миозину
мышечных клеток. Они собраны в микрофиламенты, которые располагаются по
клеточной периферии и агрегируют при стимуляции с образованием сократительных
волокон – двигательного аппарата нейтрофила.[5]
Хемотаксис отражает способность клетки двигаться в сторону
нахождения стимулирующих веществ, именуемых хемоаттрактантов или
хемо(цито)токсинами. Направление движения определяется градиентом концентрации
хемоаттрактантов. Хемотаксис является предстадией фагоцитоза, поскольку он
необходим для сближения нейтрофила с фагоцитируемым объектом.[5]
Функцией зрелых нейтрофильных лейкоцитов является
уничтожение, проникших в организм инфекционных агентов. Осуществляя ее они
тесно взаимодействуют с макрофагами, Т- и В-лимфоцитами. На важность функционального
вклада нейтрофилов и защиту организма от инфекции указывает, например, тяжесть
течения инфекционных заболеваний у больных, страдающих сниженной продукцией или
качественными нарушениями этих клеток. Нейтрофилы секретируют вещества, обладающие
бактерицидными эффектами, способствуют регенерации тканей, удаляя из них
поврежденные клетки, а также секретируя стимулирующие регенерацию вещества. Часть
нейтрофильных гранул, дают положительную окраску на фермент миелопероксидазу,
представлены лизосомами, содержащими многочисленные энзимы: лизоцим,
повреждающий стенку бактерий; катионные белки, нарушающие дыхание и рост
микроорганизмов; нейтрофильные протеазы и кислые гидролазы, позволяющие
нейтрофилам легко переваривать фагоцитированные объекты.[6]
Гранулы нейтрофилов, не окрашивающиеся на миелопероксидазу,
содержат лактоферрин, оказывающий бактериостатическое действие, транскобаламины
I и III — переносчики витамина В12 в крови, лизоцим. В гранулах третьего типа
содержатся кислые глюкозаминогликаны, участвующие в процессах размножения,
роста и регенерации тканей. Гранулы 2-го и 3-го типов — это секреторные
органеллы, выделяющие секрет и вне фагоцитоза, что позволяет отнести нейтрофилы
к клеткам, постоянно секретирующим биологически активные вещества.[[6]]
Нейтрофилы осуществляют свои функции, благодаря способности
быстро мигрировать и накапливаться в инфицированном или поврежденном участках
организма, фагоцитировать, т.е. захватывать и разрушать в фагоцитарных вакуолях
внутри клетки поглощенные бактерии и поврежденные клетки. Их способность к
миграции связана с хорошо развитым аппаратом движения. Выбор направления их
движения к воспаленным или инфицированным тканям обусловлен появлением в этих
тканях вазоактивных и хемотаксических факторов. Вазоактивные факторы повышают
проницаемость капилляров, что способствует миграции нейтрофилов в ткань.
Хемотаксические факторы взаимодействуют с рецепторами на поверхности
гранулоцитов, образуя лигандрецепторный комплекс, определяющий движение нейтрофилов
к воспаленному участку. Самым мощным хемотаксическим эффектом обладают
лейкотриены, производные метаболизма арахидоновой кислоты в мембране клеток.
Они секретируются активированными Т-лимфоцитами и макрофагами после воздействия
на них бактериальных веществ. Помимо лейкотриенов эти клетки секретируют другие
хемоатрактанты — эндотоксины. Важными хемотаксическими факторами являются
продукты активации комплемента — фрагменты его молекул С2а и С5а. Некоторые из
этих факторов, особенно С, функционируют как опсонины, т.е. вещества,
облегчающие фагоцитоз бактерий (от греческого opsonein — делать съедобным).[7]
Большинство реакций, в которых участвуют нейтрофилы,
совершается в тканях. Поэтому адгезивность, характеризующая способность клеток
прикрепляться и задерживаться на определенных субстратах, имеет важное значение
при оценке функционального потенциала нейтрофильного гранулоцита.[[7]]
Нейтрофильные гранулоциты способны осуществлять киллинг
микроорганизмов с помощью двух принципиально различных механизмов:
кислородозависимого и кислороднезависимого.[7]
К кислородзависимому пути относят «респираторный взрыв»,
который развивается при взаимодействии нейтрофилов с объектами фагоцитоза.
Кислородзависимый механизм не является системой жизнеобеспечения нейтрофила,
который хорошо переносит гипоксию и нормально выполняет ряд функций (например,
поглощение) в условиях анаэробиоза. «Респираторный взрыв» относится к серии
метаболических процессов, имеющих место при стимуляции нейтрофилов: увеличение
потребления кислорода и усиление окисления глюкозы в пентозофосфатном цикле
(ПФП), и как результат этого – продукция активных форм кислорода, обладающих
бактерицидным действием и обеспечивающих цитотоксический эффект в отношении
опухолевых клеток. Именно на регистрации интенсивности «респираторного взрыва»
основаны многие клинико-диагностические методы оценки состояния организма, в
частности и хемилюминесцентный анализ.[7]
Одним из наиболее перспективных методов, позволяющих оценить
функциональную активность нейтрофильных гранулоцитов, является
хемилюминесцентный анализ.[8]
Хемилюминесцентный анализ позволяет получать информацию о
нативном состоянии и функциональной активности клеток. Установлена возможность
непосредственного исследования клеточного ответа при воздействии физиологических
и патологических агентов. Доказан высокий уровень корреляции между уровнем
хемилюминесценции фагоцитов и киллингом.[8]
В связи с этим, определение хемилюминесценции нейтрофилов
может использоваться как один из критериев их способности к завершенному
фагоцитозу. Уровень хемилюминесценции нейтрофилов характеризует интенсивность
«респираторного взрыва» в клетках с продукцией активных форм кислорода,
оказывающих бактерицидное действие (супероксидный анион-радикал, перекись
водорода, гидроксильный радикал, синглетный кислород и др.).[8]
Метод регистрации ХЛ клеток крови позволяет проводить
изучение и отбор иммуномодулирующих фармакологических препаратов на основании
сравнения люминолзависимой стимулированной хемилюминесценции до и после
введения в пробу с лейкоцитарной взвесью исследуемых препаратов.[8]
Хемилюминесцентный тест является высокочувствительным и
безопасным методом диагностики непереносимости лекарственных средств. В случае
непереносимости инкубация цельной крови с раствором этих препаратов в
терапевтических концентрациях сопровождается достоверным снижением генерации
активных форм кислорода нейтрофилами, стимулированными неспецифическими
активаторами. Снижение люминолзависимой хемилюминесценции цельной крови при
непереносимости лекарственного препарата отмечается независимо от химических
свойств и принадлежности медикаментов к фармакологическим группам.[[8]]
Явление хемилюминесценции - свечения, сопровождающего
химические реакции, – все более широко используется в практических целях,
поскольку позволяет создать ультра чувствительные и специфические методы
анализа различных биологических субстратов. Хемилюминесценция (ХЛ) обусловлена,
реакциями экзотермического типа и протекает, как правило, в три стадии :[9]
1. Восстановление
одного из участников реакции (присоединение электрона) и окисление второго
(отрыв электрона), что приводит к запасанию химической энергии в системе,
которая позднее выделится в виде фотона.[9]
2. Перенос
электрона (окислительно-восстановительная реакция) на один из более высоких
энергетических уровней и образование продукта реакции в электронно-
возбужденном состоянии.[9]
3. Высвечивание
фотона при переходе молекулы из электронно-возбужденного в основное состояние
(люминесценция). Обычно химические реакции, сопровождающиеся свечением,
протекают через целый ряд промежуточных стадий, но основные этапы образования и
испускания энергии сходны.[9]
Хемилюминесцентный метод позволяет регистрировать
короткоживущие свободные радикалы, которые можно разделить на четыре группы: а)
свободные радикалы (CР) активных форм кислорода, б) СР липидов, в) СР,
осуществляющие ферментативное дыхание в митохондриях, г) СР естественных
антиоксидантов.[[9]]
Живые клетки - фагоциты (к которым относятся гранулоциты и
моноциты крови, а также тканевые макрофаги) сами образуют активные формы
кислорода при их стимулировании. При этом наблюдается хемилюминесценция,
особенно яркая в присутствии люминола (или люцигенина). В качестве примера
показана хемилюминесценция клеток крови при действии на кровь кратковременных
электрических импульсов, вызывающих увеличение проницаемости клеточных мембран
и стимуляцию выделения клетками активных форм кислорода. Такие же
"хемилюминесцентные ответы" можно получить, если добавить к лейкоцитам
крови суспензию бактерий, изолированные оболочки дрожжевых клеток, кристаллы
кварца или сульфата бария, а также определенные химические соединения; все эти
агенты получили собирательное название "стимулов". Стимулированная ХЛ
клеток в присутствии люминола - ценный показатель функционального состояния
фагоцитов крови и тканей, их способности производить при необходимости активные
формы кислорода, т.е. выполнять свою защитную функцию. Эта способность обычно
усиливается про возникновении в организме очагов воспаления (например, после
инфаркта миокарда) и в ряде других случаев. Наоборот, при длительном недостатке
кислорода, связанном с общим ослаблением организма, активность фагоцитов и
ХЛ-ответы снижаются.[11]
Уровень хемилюминесценции при фагоцитозе характеризует
интенсивность "респираторного взрыва" в клетках с продукцией активных
форм кислорода, оказывающих бактерицидное действие. Первичными метаболитами
активированного кислорода являются супероксидный анион-радикал (О2•), перекись
водорода (Н2О2), гидроксильный радикал (ОН•), синглетный кислород (1О2). В
качестве основных вторичных метаболитов необходимо отметить гипохлорную кислоту
(HOCl), хлорамины и продукты перекисного окисления липидов. Взаимопревращения
первичных и вторичных оксидантов с мощным энергетическим потенциалом создают
динамический спектр молекул, которые прямо или косвенно вовлекаются в реакции
фагоцитов. При этом, взаимодействие высокоэнергетических оксидантов с
люминесцирующими посредниками (люминол, люцигенин и др.) приводит к переходу
последних в электронно-возбужденное состояние, выход из которого сопровождается
испусканием кванта света. Регистрация светоизлучения хемилюминесцентной реакции
производится на хемилюминометрах отечественного или зарубежного производства.[[10]]
В целом, о каком бы разнообразии конечных и промежуточных
эффекторов не шла бы речь, в основе реактивной хемилюминесценции лежит прямое
или опосредованное вовлечение кислорода в образование высоко реактогенных
молекул, излучающих свет. Главное содержание таких реакций - мобилизация
кислорода активированными клетками - сближает хемилюминесценцию с реакцией
восстановления нитросинеготетразолия (НСТ). Следовательно, отмечая объективные
преимущества хемилюминесцентного анализа, необходимо помнить о базисной
информации накопленной при использовании в клинической
практике НСТ-теста.[[11]]
В патогенезе многих болезней и патологических процессов
играет важную роль оксидативный стресс. Метод ХЛ оказывается полезным при
изучении таких патологий, поскольку дает возможность измерять уровень свободных
радикалов (АФК, NO), оценивать параметры антиоксидантной защиты и влияние
антиоксидантов. Хемилюминесценцию успешно применяют при изучении иммунных
нарушений, нарушений метаболизма, дисфункции эндотелия, ишемии/реперфузии
миокарда и мозга, онкологических и воспалительных заболеваний, а также многих
других болезней, патогенез которых связан с оксидативным стрессом.[12]
Наиболее известные хемилюминесцентные реакции в
биохимических системах – собственное (сверхслабое) свечение при цепном
окислении липидов, реакции люминола с АФК (гидроксильным радикалом и
супероксидом) и органическими радикалами, реакции люцигенина и ряда производных
люциферинов с супероксидным радикалом. Все они включают в себя на определенном
этапе взаимодействие двух радикалов, которое позволяет образовавшейся молекуле
накопить такое количество энергии, что ее оказывается достаточно для излучения
фотона конечныхпродуктов. [12]
Метод ХЛ стал одним из основных методов изучения
свободнорадикальных процессов в научных и клинических исследованиях.[[12]]
МАТЕРИАЛЫ И МЕТОДЫ
Во время проведения анализов мы
использовали кровь потенциально здоровых людей. Кровь взята из локтевой вены на
голодный желудок. Медицинское учреждение, в котором брали кровь – Красноярский
Краевой Центр Крови №1.
В методе хемилюминесцентного анализа используют такие
реактивы как:
·
Раствор Хенкса
·
Уксусная кислота
·
Люминол или люцигенин в концентрации 100 мкг/мл
·
Зимозан или бактериальная суспензия Staphylococcusepidermidisили
Staphylococcusaureus в концентрации (0,4 ОП)
·
Физиологический раствор.
Метод хемолюминесцентного анализа основан на регистрации
квантового потока, образующегося при переходе вещества из
электронно-возбужденного в основное состояние. Наибольшее значение этот метод
приобрел в исследовании воспалительных процессов, сопровождающихся образованием
клетками активных форм кислорода (супероксидного анион-радикала,
гидропероксидного и гидроксильного радикалов, пероксида водорода, синглетного
кислорода). Вследствие низкой интенсивности собственного свечения исследуемых
образцов при хемилюминесцентном исследовании используются вещества, в частности
люминол (5-амино-2,3-дигидро-1,4 фталазидинедион), способные многократно
усиливать световой поток, который затем регистрируется датчиком и отображается
ввиде графика. По оси Х откладывается время, по оси Y - интенсивность
излучения, характеризующая число квантов света, попадающих на единицу
поверхности датчика. Кривая ХЛ исследуемых клеток характеризуется уровнем
спонтанной (ХЛсп) и активированной (ХЛакт) люминесценции (рис. 2). Для
активации клетки использовался зимозан.[13]

Рисунок2 - График ХЛ
фагоцитирующих клеток. Стрелкой на шкале времени показан момент активациии
клеток зимозаном
«1.Лейкоцитарныйсупернатант дважды отмывают в растворе
Хенкса без фенолового красного по 10 мин при 500g. Супернатан сливают,
оставшиеся нейтрофильные гранулоциты разводят в 1 мл Хенкса и получают взвесь.
2. Для подсчета клеток в планшет добавляют 40 мкл уксусной
кислоты и 10 мкллейковзвеси и подсчитывают количество нейтрофильных
гранулоцитов в камере Горяева в 5 больших квадратах по диагонали. Количество
клеток определяют по формуле (Х1*11*1000)/0,02=(Х2/2000000)-1 количество Хенкса
необходимое добавить к 1 мл лейкоцитарной суспензии, где Х1 – суммарное
количество клеток в 5 квадратах , Х2- количество нейтрофилов в1 мл суспензии (необходимое
количество клеток 2*10 в 6 степени).
3.Для проведения хемилюминесцентного анализа используют
следующие реактивы : донорскую сыворотку (группа крови АВ резус-фактор
отрицательный), раствор Хенкса (без фенолового красного), люминол или люцигенин
в концентрации 100 мкг/мл.
·
Готовят пробу : 200 мкл взвеси нейтрофильных гранулоцитов, 20 мкл
донорской сыворотки, 240 мкл раствора Хенкса, 50 мкллюминола или люцигенина и
40 мклзимозана или бактериальной суспензии Staphylococcusepidermidis или
Staphylococcusaureus в концентрации (0,4 ОП).
·
Бактериальную взвесь делают из суточной бактериальной культуры,
которую разводят в 3 мл физиологического раствора.
·
Концентрацию клеток измеряют на приборе КФК-2 при λ=590 им
относительно физ.раствора, затем доводят физиологическим раствором
концентрацию бактериальной суспензии до 0,4 ОП.
4.Хемилюминесцентный анализ проводят в 8 кюветах ( в первых
4 используем люминол; во вторые 4 добавляем люцигенин). Спонтанная
хемилюминесценция осуществляется без добавления индуктора, во вторую кювету
добавляют зимозан, в третью бактериальную суспензию Staphylococcusepidermidis,
в четвертую Staphylococcusaureus при помощи хемилюминесцентного анализатора,
например « CL.3604» в течение 90 мин.Регистрация результатов и управление
хемилюминесцентным анализатором осуществляется через компьютер. Получают кривую
хемилюминесценция. Определяют величину TmaxImaxSmax для каждого показателя
(спонтанная хемилюминесценция, зимозан-зависимая хемилюминесценция и стафилококк-зависимая
хемилюминесценция).»[[13]]
О функциональном состоянии нейтрофилов судили по величине
спонтанной ХЛ, активированной ХЛ и хемилюминесцентному индексу – Ихл,
отражающему резервные возможности клеток:
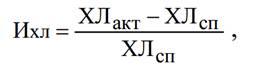
где ХЛсп – максимальный
показатель спонтанного теста, ХЛакт – максимальный показатель стимулированного
теста хемилюминесценции.[13]
В ФБГУ НИИ МПС СО РАМН ведется набор контрольной группы.
Поэтому в результатах своей работы я представляю такой набор. Для составления
контрольной группы было проведен метод хемилюминесцентной активности
нейтрофилов крови 15 практически здоровых людей. Были получены следующие данные:
Таблица 3 - Хемилюминесцентная активность нейтрофилов
|
Пациент
|
Хемилюминесцентная активность нейтрофилов
|
|
T max
|
I max
|
S qur
|
Идекс активации
|
|
Спонтанная
|
Индуцированная
|
Спонтанная
|
Индуцированная
|
Спонтанная
|
Индуцированная
|
|
|
1.27.01.2014
|
810
|
2423
|
5670
|
3046
|
312000
|
2400000
|
7,692308
|
|
1.27.01.2014
|
1138
|
1302
|
1868
|
2377
|
129000
|
154000
|
1,193798
|
|
2.27.01.2014
|
449
|
393
|
468
|
631
|
33000
|
36500
|
1,106061
|
|
2.27.01.2014
|
1096
|
1153
|
607
|
614
|
46100
|
51300
|
1,112798
|
|
3.27.01.2014
|
246
|
2848
|
9114
|
88900
|
294000
|
3,307087
|
|
3.27.01.2014
|
1215
|
1111
|
600
|
4327
|
47400
|
216000
|
4,556962
|
|
4.27.01.2014
|
630
|
312
|
403
|
1124
|
31400
|
56500
|
1,799363
|
|
4.27.01.2014
|
157
|
851
|
357
|
438
|
25700
|
34400
|
1,338521
|
|
1.03.02.2014
|
662
|
169
|
29862
|
92536
|
1190000
|
3300000
|
2,773109
|
|
1.03.02.2014
|
709
|
461
|
18893
|
42755
|
1100000
|
2530000
|
2,3
|
|
2.03.02.2014
|
388
|
385
|
19229
|
41482
|
934000
|
2340000
|
2,505353
|
|
2.03.02.2014
|
1823
|
1494
|
5440
|
11937
|
584000
|
984000
|
1,684932
|
Таблица 3 - Хемилюминесцентная активность нейтрофилов
Продолжение
|
3.03.02.2014
|
154
|
682
|
58379
|
97777
|
4360000
|
5400000
|
1,238532
|
691
|
933
|
20590
|
41588
|
1790000
|
2930000
|
1,636872
|
|
1.06.02.2014
|
236
|
506
|
9608
|
13118
|
1770000
|
2110000
|
1,19209
|
|
1.06.02.2014
|
1804
|
1801
|
5103
|
5397
|
970000
|
988000
|
1,018557
|
|
1.20.02.2014
|
1152
|
945
|
13778
|
111827
|
1010000
|
8260000
|
8,178218
|
|
1.20.02.2014
|
1563
|
1280
|
45545
|
61504
|
4440000
|
6020000
|
1,355856
|
|
2.20.02.2014
|
1531
|
1038
|
6921
|
36070
|
664000
|
2490000
|
3,75
|
|
2.20.02.2014
|
1575
|
3333
|
11600
|
35428
|
1150000
|
3430000
|
2,982609
|
|
3.20.02.2014
|
3217
|
1213
|
36988
|
58585
|
3930000
|
4910000
|
1,249364
|
|
3.20.02.2014
|
1426
|
1505
|
21845
|
26447
|
2080000
|
2510000
|
|
1.13.03.2014
|
1641
|
745
|
45058
|
123355
|
4530000
|
10100000
|
2,229581
|
|
1.13.03.2014
|
2137
|
1527
|
33079
|
40127
|
3030000
|
3220000
|
1,062706
|
|
2.13.03.2014
|
1775
|
1206
|
39308
|
119801
|
3700000
|
10200000
|
2,756757
|
|
2.13.03.2014
|
1250
|
1621
|
22157
|
52609
|
1470000
|
4320000
|
2,938776
|
|
3.13.03.2014
|
1664
|
809
|
48880
|
130903
|
4490000
|
10000000
|
2,227171
|
|
3.13.03.2014
|
1629
|
1469
|
13517
|
53438
|
1100000
|
4220000
|
3,836364
|
|
Персентиль 0,25
|
654
|
638
|
4539,25
|
5129,5
|
266250
|
811500
|
1,230582
|
|
Персентиль 0,75
|
1632
|
1475,25
|
30666,25
|
59314,75
|
2317500
|
4467500
|
2,949734
|
|
Медиана
|
1183,5
|
1074,5
|
13647,5
|
38098,5
|
1100000
|
2,013267
|
Результаты ХЛ анализа характеризовали
по следующим параметрам: по времени выхода на максимум интенсивности (Tmax), по
максимальному значению интенсивности ХЛ (Imax) и площади под кривой
интенсивности ХЛ (S). Усиление ХЛ, индуцированной зимозаном, оценивали
соотношением площади индуцированной (S2) к площади спонтанной (S1) и определяли
как индекс активации.
ЗАКЛЮЧЕНИЕ
1. Проанализирована научная литература.
2. Был освоен метод хемилюминесценции нейтрофильных
гранулоцитов.
3. Получены данные хемилюминесценции нейтрофильных
гранулоцитов у практически здоровых людей.
РЕФЕРАТ(SUMMARY)
Blood is the body's internal environment. In
the blood cells of the immune system. Among them are such cells as neutrophils.
Neutrophils are phagocytes is not specific. They carry no specific cellular
immune response.
Neutrophilic response - the first response
to bacterial infection and many others.Neutrophilic response in acute
inflammation and infection is always preceded by a specific lymphocytic
[1]Никулин Б.А. Оценка и коррекция иммунного статуса :
руководство для врачей / Б. А. Никулин.// Москва : ГЭОТАР-Медиа, 2007. - 375 с.
[2]Ингерлейб М.Б. Медицинские Анализы : диагностический
справочник / М.Б. Ингерлейб – Москва 2011. С.13.
[3] Земсков А.М. Клиническая иммунология: учебное пособие
для студентов медицинских вузов/Под ред.А.М.Земскова. М.: ГЭОТАР-Медиа, 2005.С
20.
[4] Елисеев В.Г. Гистология : под редакцией / В.Г.
Елисеев, Ю.И. Афанасьев, Н.А. Юрина. – Москва : Медицина, 1983.- 146 с.
[5]Маянский А.Н., Маянский Д.Н. Очерки о нейтрофиле и макрофаге.
— Новосибирск: Наука, 1983. — 283 с.
[6] Пинегин Б.В., Маянский А.Н. Нейтрофилы: структура и
функции//Иммунология.-2007.-№6.-С.374-381.
[7] Ткаченко Б.И. Основы физиологии человека. Учебник для
высших учебных заведений, в 2-х томах, под редакцией акад. РАМН 1994. Т.1 —
567с, т.2 C 413.
[8] Борисов А. Разработка хемилюминесцентного метода
подбора иммуноактивных препаратов для персонифицированного лечения пациентов с
инфекционно-воспалительными заболеваниями [Электронный ресурс]. Режим доступа: [9] Винник Ю.С. Савченко А.А. Клинические аспекты
применения хемилюминесцентного анализа/Ю.С. Винник А.А. Савченко //Сибирское
медицинское обозрение -2006 №3 -С 42-44
[10]Blazheevskly M. Ye., Bondarenco N. Yu.
Chemiluminescence-based kinetic determination of drug / M. Ye. BlazheevsklyN. Yu. Bondarenco// Методы химического анализа, 2011, т6, №3. С124-142.
[11] Грачева Т.А. Совершенствование хемилюминесцентного
метода исследования функциональной активности фагоцитирующих
клеток//Клиническая лабораторная диагностика.-2008.-№2.-С54-55.
[12] Владимиров Ю.А. Проскурнина Е.В. Свободные радикалы
и клеточная хемилюминесценция : под редакцией / Ю.А. Владимиров Е.В. Проскурина
– Москва : Факультет фундаментальной медицины МГУ им. М.В. Ломоносова, 2009,
С.341-388.
[13] Дмитриева Н.Ю. Савченко А.А. Вычислительное
моделирование динамики хемилюминесценции нейтрофильных гранулоцитов / Н.Ю.
Дмитриева А.А. Савченко // Journal of SiberianFederalUniversity.
Mathematics&Physics 2008, 1(4). С 435-442.