Проект рационального водопользования промышленного предприятия
Министерство
образования и науки Российской Федерации
Федеральное
государственное бюджетное образовательное учреждение
Высшего
профессионального образования
«Южно-Уральский
государственный университет»
(национальный
исследовательский университет)
Факультет
«Химический»
Кафедра
«Экология и природопользование»
Проект
рационального водопользования промышленного предприятия
ПОЯСНИТЕЛЬНАЯ
ЗАПИСКА
К
СЕМЕСТРОВОМУ ЗАДАНИЮ
ЮУрГУ
241000. 62.2014.893.ПЗ.СЗ
Автор работы
студентка группы
Х-434
К.А. Шекунова
Челябинск
2015
Аннотация
Шекунова К.А., Пояснительная записка к курсовому
проекту по курсу процессы и аппараты защиты водных объектов. - Челябинск:
ЮУрГУ, Хим - 434.
Курсовой проект выполнен с целью разработки
проекта рационального водопользования для цеха покрытий промышленного
предприятия г. Челябинска.
В курсовой работе проведён литературный обзор
основных технологических процессов гальванического производства, сточных вод и
методов их очистки. Произведен расчет переработки осадков. Разработана балансовая
схема очистки сточных и конструктивное оформление одного из сооружений в плане
разреза.
Оглавление
Введение
. Литературный обзор
.1 Характеристика сточных вод
гальванического производства
.2 Очистка сточных вод от тяжелых
металлов
.2.1 Реагентные методы очистки
сточных вод от тяжелых металлов
.2.2 Сорбционные методы
.2.3. Метод ионного обмена
.2.4. Электрохимические методы
.2.5. Гальванокоагуляци
.3 Очистка хромсодержащих сточных
вод
.3.1 Реагентный метод
.3.2 Биологические методы очистки
хромсодержащих сточных вод
.3.3 Очистка сточных вод от хрома
(VI)
.4 Обработка осадков сточных вод
гальванического производства
.5 Oрганизация oбoрoтнoгo
водоснабжения на гальванических производствах
. Анализ существующей схемы обработки
сточных вод и предложения по ее реконструкции
. Специальная часть
.3 Вертикальный отстойник
оборудованный тонкослойными модулями
.4 Расчёт уплотнителя осадка и
центрифуги для обезвоживания осадка
.5 Расчёт установки ультрафильтрации
.6 Расчёт установки нанофильтрации
Заключение
Библиграфический список
Введение
рациональный водопользование очистка
металл отстойник
Гальваническое производство - это отрасль
промышленности, которая занимается нанесением защитных или декоративных
покрытий на металлические и неметаллические изделия. Это производство является
очень важным и нужным в промышленности, однако оно имеет существенные минусы,
основные из них: большая энергоемкость и, следовательно, дороговизна
производства; сложность обработки сточных вод цехов.
Основные металлы, применяемые в гальванотехнике,
обладают токсическим действием - Cd,
Cu, Ni,
Cr; аллергенным
действием - Ni, Cr;
тератогенным действием (возникновение уродств) - Cd;
канцерогенным действием - Ni,
Cr, Zn;
мутагенным действием - Cd,
Cu, Ni,
Cr, Zn.
Поэтому требования охраны окружающей среды для промышленных сточных вод жёстко
ограничивают концентрации загрязнителей в спускаемых водах, а для решения этой
проблемы предлагается множество методов очистки стоков.
Цель курсового проекта - создание проекта
рационального водопользования цеха гальванопокрытий.
Задачи проекта:
) произвести анализ работы сооружений цеха
покрытий одного из предприятий города Челябинска;
) предложить мероприятия по изменению
технологического процесса с целью снижения содержания загрязняющих веществ в
сточных водах и водопотребления;
) разработать вариант реконструкции, обосновать
и провести укрупненный расчет очистных сооружений водоотведения;
) рассмотреть возможность применения оборотной
системы водоснабжения;
) предложить способы утилизации осадков сточных
вод.
1. Литературный обзор
.1 Характеристика сточных вод гальванического
производства
В процессе химической и электрохимической
обработки изделий, образуются воды загрязненные кислотами, щелочами, солями,
соединениями хлора, цинка, меди, никеля, цианосоединениями и другими
химическими веществами (50 - 80
%).
Они содержат тяжёлые металлы в виде растворимых химических соединений. По
объёму, составу загрязнений третья категория сточных вод является
преобладающей.
Сточные воды, которые образуются на гальванических
производствах делятся на отработанные и промывные. Отработанные сточные воды
образуются периодически, при смене отработанных технологических растворов на
свежие растворы, а также при промывке заготовок. Характерной чертой всех
сточных вод гальванических отделений является низкая концентрация кислот и
высокая концентрация ионов металлов.
Сточные воды, поступающие из гальванических
отделений, по химическому составу подразделяются на три основных потока:
хромосодержащие, кислотно - щелочные, цианосодержащие.
После электрохимического хромирования, травления
в растворах содержащих хромовую кислоту и прочих процессов образуются стоки,
содержащие большое количество хрома.
В ходе процессов травления, активации,
обезжиривания, фосфатирования и нанесения гальванических покрытий образуются
кислотно - щелочные стоки.
Цианосодержащие стоки образуются в процессе
покрытий в цианосодержащих электролитах. Для них характерно наличие цианогрупп,
Zn, Cu,
Cd [1].
1.2 Очистка сточных вод от тяжелых металлов
Загрязнение водной среды ионами тяжелых металлов
опасно для всей биосферы, а также свидетельствует о расточительном отношении к
ресурсам.
Сточные воды гальванического производства
содержат около 50 % ионов тяжелых металлов, которые предназначены для
декоративных, защитных и других покрытий. Помимо этого тяжелые металлы являются
токсичными для живых и растительных организмов. Они способны накапливаться в
пищевых цепочках, что усиливает их опасность для человека. Самыми опасными
являются ионные комплексные формы тяжелых металлов. Так как эти вещества очень
опасны, необходим строгий контроль за их поступлением в окружающую среду, что
требует на практике использования сравнительно недорогих, доступных методов их
улавливания [1].
.2.1 Реагентные методы очистки сточных вод от
тяжелых металлов
Реагентный метод очистки сточных вод
гальванического производства является самым распространенным. Он заключается
переводе растворимых веществ в нерастворимые при добавлении различных реагентов
с последующим отделением их в виде осадков. Обычно для удаления ионов тяжелых
металлов из сточных вод используют NaOH
и Ca(OH)2,
а также Na2CO3,
сульфиды натрия, различные отходы (феррохромовый шлак).
Лучшим реагентом для очистки сточных вод
является едкий натр NaOH,
так как он обладает высокой реакционной способностью и осадки, полученные с его
использованием, относительно чисты, легче отмываются, перерабатываются и
эффективно разделяются при осветлении [3].
К достоинствам данного метода относятся:
) Широкий интервал начальных концентраций ИТМ;
) Универсальность;
) Простота эксплуатации;
) Отсутствует необходимость в разделении
промывных вод и концентратов.
Недостатки метода:
) Не обеспечивается ПДК для рыбохозяйственных
водоемов;
) Громоздкость оборудования;
) Значительный расход реагентов;
) Дополнительное загрязнение сточных вод;
) Невозможность возврата в оборотный цикл
очищенной воды из-за повышенного солесодержания;
) Затрудненность извлечения из шлама тяжелых
металлов для утилизации.
Обезвреженные щелочные цианистые и
хромсодержащие стоки, а также другие щелочные или кислые стоки перед выпуском в
канализацию или водоёмы (в зависимости от местных условий) нейтрализуют до pH
= 6,5 - 9 и освобождают от ионов металлов. Эти задачи не всегда имеют
положительный результат, так как осаждение различных металлов происходит при
различных рН и в то же время наличие в растворе ионов различных металлов часто
улучшает условия их осаждения.
Осаждение металлов производится, как правило,
одновременно с нейтрализацией. Тяжёлые металлы осаждаются в виде гидроокисей
или труднорастворимых основных солей.
Осаждение гидроксидом кальция Ca(0H)2
Гидроксид кальция используется наиболее широко.
Осаждение металлов происходит в виде гидроксидов. Процесс проводится при
различных значениях рН. Гидроксид кальция часто используют для нейтрализации
минеральных кислот.
При нейтрализации сточных вод, содержащих серную
кислоту (H2SO4),
реакция протекает по уравнению:
H2SO4+Ca (OH)2 = CaSO4+2H2O,
бразующийся в результате нейтрализации сульфат
кальция (гипс) кристаллизуется из разбавленных растворов в виде CaSO4·2H2O.
Растворимость этой соли при температуре 0-40 0С
колеблется от 1,76 до 2,11 г/л.
При более высокой концентрации сульфат кальция
выпадает в осадок, поэтому при нейтрализации сильных кислот, кальциевые соли
которых труднорастворимы в воде, необходимо устраивать
отстойники-шламонакопители. Существенным недостатком метода нейтрализации
серной кислоты известью является образование пресыщенного раствора гипса
(коэффициент пресыщения может достигать 4-6), выделение которого из сточной
воды может продолжаться несколько суток, что приводит к зарастанию
трубопроводов и аппаратуры. Присутствие в сточных водах многих химических
производств высокомолекулярных органических соединений усиливает устойчивость
пресыщенных растворов гипса, поскольку эти соединения сорбируются на гранях
кристаллов сульфата кальция и препятствуют их дальнейшему росту.
Осаждение карбонатом натрия Na2СО3
Соли цинка, которые содержатся в стоках,
обрабатывают гидроксидом натрия. Дозирование реагента проводят при строгом
контроле за рН обрабатываемого стока. Это необходимо для того чтобы не
создавать условия для растворения амфотерных гидроксидов.
Выделение катионов Zn2+
щелочами основано на переводе их в труднорастворимый гидроксид цинка:
Zn2++2OH-
→ Zn(OH)2
(1)
При действии соды на сточные воды образуются
основные карбонаты:
ZnCl2+2NaCO3=2ZNCO3+4NaCl (2)
ZnCO3 + H2O = CO2 + (ZnOH)2CO3 (3)
ZnCl2 + 2Na2CO3 + H2O → 4NaCl
+ CO3 + (ZnOH)2CO3 (4)
ЗСu(NO3)2 + 4Na2CO3 + 2H2O ↔
CaCO3 ∙ Cu(OH)2 + 6NaNO3+2NaHCO3 (5)
Хотя осаждение основных карбонатов начинается
при более низких значениях рН, чем соответствующих гидроксидов, расход соды на
осаждение выше, чем при использовании едкого натра или извести. Так как при
осаждении содой тяжелых металлов поцесс протекает через стадию образования
гидрокарбонатов и для завершения реакции требуется избыток реагента.
Диоксид углерода, который выделяется в
результате осаждения содой, способствует тому, что пузырьки газа обволакивают
частицы осадка и поднимают их, из - за чего происходит всплытие части осадка в
отстойниках.
Газ удаляется продувкой воздухом по достижении
рН = 4,5.
Гидроксид меди осаждается при рН = 5,3.
Так как гидроксид-карбонат растворяется очень
плохо, медь осаждают в виде основного карбоната. Для этого в растворе нейтрализующего
агента необходимо иметь одновременно как гидроксидные, так и карбонатные ионы.
Из этого следует, что невыгодно использовать для осаждения меди только щелочи
или извести высшего сорта. Поэтому реагентом является известь III
сорта, которая содержит «недожог» СаСО3.
Также для осаждения меди используют ферроцианид
калия. Этот реагент можно использовать и для осаждения других ионов тяжёлых
металлов.
Осаждение гидроксидом натрия NaОН
При обработке сточных вод едким натром также
происходит осаждение металлов в виде гидроксидов и труднорастворимых
соединений, например:
Ni SO4 + 2NаОН ↔ Ni(OH)2 +
Na2SO4 (6)
FeCl3+5Ca(0H)2 ↔
2Fe(0H)3+3CaCl2 (7)+ 2NaOH ↔ Сu(ОН)2 + Na2SQ4 (8)
Несмотря на то, что в сточных водах обычно
содержатся катионы нескольких металлов, применение для удаления каждого из них
специфического метода невозможно. Поэтому сточную воду обрабатывают обычно
гидроксидом кальция (известковым молоком), который производят из извести III
сорта. При этом одновременно происходят два процесса осаждение катионов тяжёлых
металлов в виде гидроксидов и карбонатов. Известно, что достигаются лучшие
результаты при совместном осаждении нескольких металлов, чем при осаждении
каждого из металлов в отдельности. Это происходит в связи с образованием
смешанных кристаллов и адсорбцией ионов металлов на поверхности твёрдой фазы.
Щелочные реагенты, которыми обрабатываются
сточные воды, позволяют снизить содержание тяжёлых металлов в растворе до
величин, соответствующих ПДК для водоёмов санитарно-бытового пользования. Но
очистка щелочными реагентами не даёт необходимого эффекта при более глубокой
очистке [2].
Осаждение сульфидом натрия Na2S
Более глубокая очистка от тяжёлых металлов
достигается при обработке сточных вод сульфидом натрия. Это связано с тем, что
растворимость сульфидов тяжёлых металлов значительно меньше растворимости любых
других труднорастворимых соединений - гидроксидов и карбонатов. Осаждение
сульфидов происходит при более низком значении рН, чем гидроксидов и
карбонатов. Например, сульфид цинка осаждается при рН = 1,5, сульфиды никеля и
кобальта при рН = 3,3.
Процесс извлечения металлов сульфидом натрия:
Me2++S2-=MeS (9)++S2-=Me2S3 (10)
Таким образом, процесс осаждения ионов тяжёлых
металлов можно разделить на два этапа:
) перевод ионов металлов в нерастворимые и
труднорастворимые соединения, т.е. образование твёрдой фазы;
) седиментация, т.е. отделение твёрдой фазы от
жидкой под действием сил тяжести.
Первый этап процесса осаждения ионов металлов
обычно происходит в реакторах.
Для отделения твёрдой фазы применяют отстойники,
осветлители, фильтры. Процессу седиментации, как правило, предшествуют
флокуляция и коагуляция, т.е. обработка раствора различными реагентами,
способствующими образованию крупных хлопьев и быстрому их осаждению. В
зарубежной практике предпочтение отдается только флокуляции, так как для
коагуляции требуется много реагентов и образуется большое количество осадка.
Существует несколько типов коагулянтов.
Минеральные коагулянты
Их основой являются соли железа (FeCl3,
Fe(SO4)2
и т. д.) или алюминия (PAC
- полиоксихлорид алюминия, квасцы и т. д.). Это наиболее часто используемые
коагулянты. Заряд катиона создаётся ионами металлов Fe3+
или Al3+, которые
образуются из гидроокисей железа Fe(OH)3
или алюминия Al(OH)3
при контакте с водой. Соли железа имеют преимущества перед солями алюминия, а
именно: а) лучшее действие при низких температурах; б) более широкая область
оптимальных значений рН среды; в) большая прочность и гидравлическая крупность
хлопьев; г) возможность использовать для вод с более широким диапазоном
солевого состава.
При использовании смесей Al2(SO4)3
и FeCl3 в соотношениях от
1:1 до 1:2 достигается лучший результат коагулирования, чем при раздельном
применении реагентов. Также преимуществами таких коагулянтов являются универсальность
их применения и низкая стоимость.
Органические коагулянты
Заряд катиона создаётся функциональной группой,
которая представляет собой четвертичный аммоний, присоединённый к длинной
полимерной цепи.
В настоящее время наиболее распространенными
являются четыре основных семейства органических коагулянтов: полиамины,
полидадмак, дициандиамидные, меламиноформальдегидные смолы.
Основными преимуществами таких коагулянтов
являются небольшие дозы и небольшой объём образующегося ила (нет гидроокиси).
Также данные коагулянты не влияют на рН или титриметрический анализ жёсткости.
Свое применение нашли и смеси из минеральных и
органических коагулянтов:
Эти смеси позволяют в одном коммерческом
продукте объединить преимущества как органических, так и минеральных коагулянтов.
В таких смесях в качестве минерального коагулянта чаще всего используется РАС.
В соответствии с химической активностью
применяют следующие синтетические флокулянты:
)неионогенные полимеры (поливиниловый спирт,
полиэтиленоксид, полиакриламид);
)анионоактивные полимеры (полиакрилат,
полиметакрилат);
)катионоактивные полимеры (полиэтиленамин,
полимеры с аммонитными группами);
)сополимеры с ионогенными и неионогенными
группами (с акриламид- и акрилатгруппами).
На рынке представлен широкий спектр флокулянтов.
Например, Besfloc:
анионные (выпускаемые в гранулах и эмульсиях), катионные (гранулы и эмульсии),
неионогенные (гранулы) - позволяют выбрать предприятиям наиболее оптимальный
вариант очистки воды. Обычно флокулянтBesfloc
широко используется в химической и нефтехимической промышленности на стадии
очистки.
ФлокулянтFlopam
- продукция компании SNF
Floergerr. Флокулянты
выпускаются в виде гранул, порошков, водных растворов и эмульсий. Полимеры
Флопам используются совместно с коагулянтами, что способствует увеличению
размеров образовавшихся хлопьев и их дальнейшего удаления.
ФлокулянтMagnafloc
LT (производства
швейцарской фирмы CibaSpecialtyChemicals)
изготавливаются на основе полиакриламида. ФлокулянтМагнафлок вводится
непосредственно после коагуляции, увеличивая размер микрохлопьев, производя
очистку воды путем фильтрации и осветления. Для того, чтобы обеспечить высокую
результативность флокулянтаMagnafloc
LT, достаточно будет
осторожного перемешивания.
ПАА (полиакриламид) - представляет собой
гранулированный полиакриламид, выступающий в тандеме с сульфатом аммония. На
сегодняшний день ПАА является универсальным нейтральным флокулянтом, и
применяется во многих областях промышленности. Однако по сравнению с
современными флокулянтами является недостаточно эффективным.
Флокулянт Praestol
обычно используют для ускорения водоочистительных процессов, уплотнения осадков
и их дальнейшего обезвоживания. Химические реагенты, которые испальзуют как
электролиты, снижают электрический потенциал молекул воды. Из - за этого
частицы начинают объединяться друг с другом. Затем флокулянт объединяет частицы
в хлопья - «флоккулы».
Благодаря действию Praestola,
микрохлопья объединяются в макрохлопья, скорость осаждения которых в несколько
сотен раз выше обычных частиц. Таким образом, комплексное воздействие
флокулянтаPraestol
способствует интенсификации осаждения твердых частиц. ФлокулянтPraestol
находит свое применение в водоочистительных процессах химической и
нефтехимической промышленности и целлюлозно-бумажном производстве. Кроме этого,
флокулянт Praestol
имеет все необходимые гигиенические сертификаты и сертификаты соответствия
Госсанэпиднадзора России [3].
Рассмотрим несколько типов отстойников, которые
могут применяться для осаждения.
Отстойником называется технологическое
оборудование, которое используется для очистки сточных вод от взвешенных
веществ и нефтепродуктов. Отстойники подразделяются на первичные и вторичные.
Первичные используются перед промышленными или биологическим очистными
сооружениями, вторичные - для извлечения активного ила. В зависимости от
направления движения потока жидкости, отстойники подразделяются на
вертикальные, горизонтальные и радиальные. Осветлители также относятся к
отстойникам. В них одновременно с отстаиванием производится фильтрация сточной
воды через слой взвешенного осадка, и осадкоуплотнители, в которых одновременно
с очисткой воды производится уплотнение образовавшегося осадка.
Горизонтальный отстойник (рис.1) -
прямоугольный, вытянутый в направлении движения воды резервуар, в котором
осветляемая вода вдоль отстойника движется в направлении, близком к
горизонтальному. Различают одно- и двухэтажные горизонтальные отстойники [4].
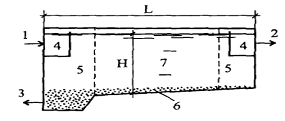
Рис. 1. Горизонтальный отстойник [1]: 1 - подача
исходной воды; 2 - отвод очищенной воды; 3 - отвод осадка; 4 -
распределительные карманы; 5 - распределительные решетки; 6 - зона накопления
осадка; 7 - зона отстаивания
Вертикальный отстойник (рис. 2) представляет
собой круглый в плане резервуар диаметром 510 м, глубиной до 7 м, оборудованный
камерой хлопьеобразования водоворотного типа и конусным днищем для накопления и
уплотнения осадка.
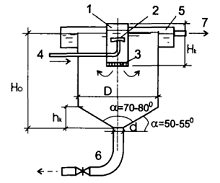
Рис. 2. Вертикальный отстойник [1]: 1 - камера
хлопьеобразования вертикальноготипа; 2 - сегнерово колесо с насадками; 3 -
гаситель; 4 - подача исходной воды (из смесителя); 5 - сборный желоб; 6 - труба
для отвода осадка; 7 - отвод осветленной воды.
В настоящее время существуют более современные
отстойники.
Тонкослойные отстойники (рис. 3) - представляют
собой модули различных конструкций с близко расположенными друг к другу
полками, на которых оседает взвесь. Глубина
осаждения в таких конструкциях не превышает 70 - 100 мм.
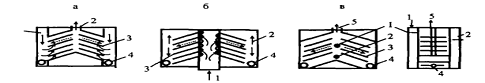
Рис. 3. Схемы тонкослойных отстойников [1]: а -
противоточная, б - прямоточная, в - перекрестная. 1 - подача исходной воды; 2 -
отвод осветленной воды с противоположного от ввода кармана; 3 - тонкослойные
модули, 4 - трубопровод удаления осадка, 5 - отвод нефтепродуктов и взвеси [1].
Широко применяют отстойник - флокулятор (рис.
4). Внутри отстойника имеется камера флокуляции, в которую через центральную
трубу поступает сточная вода. В камере флокуляции происходит эжекция воздуха,
частичное окисление органических веществ, хлопьеобразование и сорбция загрязнений.
В отстойной зоне вода проходит через слой взвешенного осадка, где задерживаются
мелкодисперсные примеси. Выпавший осадок
удаляется под действием гидростатического напора.
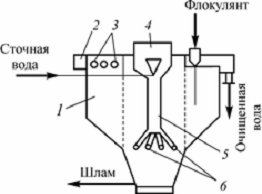
Рис.4. Отстойник-флокулятор [1]: 1 - корпус; 2 -
желоб; 3 - отверстия для удаления осветленной воды; 4 - воздухоотделитель; 5 -
центральная труба; 6 - распределительные трубы [1].
.2.2 Сорбционные методы
Сорбционные методы очистки сточных вод
достаточно распространены, так как имеют высокую эффективность и отсутствуют
вторичные загрязнения. Сорбционные материалы способны поглощать из водных
растворов металлы практически до любых остаточных концентраций [4].
В зависимости от механизма взаимодействия
сорбента с сорбатом сорбционные процессы делятся на: адсорбция; экстракция;
ионный обмен; осадкообразование.
Адсорбция - это процесс концентрирования
компонентов на поверхности химического инертного сорбента вследствие
межмолекулярного взаимодействия. Процесс экстракции заключается в растворении компонентов
в растворителе, нанесенном на сорбент. Ионным обменом называется обратимая
химическая реакция компонентов электролита с подвижными катионами или анионами
ионита.
Образование компонентами раствора
малорастворимых соединений при взаимодействии с химически активными веществами,
находящимися в порах сорбента является осадкообразованием.
В настоящее время существует множество
сорбентов, которые в свою очередь делятся на углеродные (активные угли, торф и
другие материалы, получаемые в основном при переработке различных органических
материалов) и минеральные (силикагели, алюмогели, цеолиты). Большинство
сорбентов поглощают как нефтепродукты, так и ионы металлов.
Активированные угли (АУ) обычно используют в
качестве сорбента. Различают три типа АУ: порошковый, гранулированный и
формованный. Существуют различные марки АУ: Активные (активированные) дробленые
угли марок (ГОСТ 6217-74): БАУ-А (для очистки ликероводочных изделий, пива и
безалкогольных напитков); БАУ-Ац (наполнение ацетиленовых баллонов); ДАК (очистка
технической и питьевой воды в промышленных и бытовых фильтрах; парогазового
конденсата на тепловых эл. станциях).
Активные (активированные)порошкообразные
марок:
ОУ,
ГОСТ 4453-73 (для очистки и изготовления органических кислот, очистки сиропов,
масел, жиров, медицинских препаратов); АУП, ТУ 6-16-2401-80 (для изготовления
бесшлаковых электродов и некоторых электротехнических элементов (деталей)).
Сырьём для получения АУ может быть практически
любой углеродсодержащий материал: уголь, древесина, полимеры, отходы пищевой,
целлюлозно-бумажной, микробиологической и других отраслей промышленности.
Известно, что АУ хорошо обезвреживает
гальванические стоки от содержащихся в них цианистых соединений.
Так как технология получения АУ очень
энергоемкая, готовый продукт имеет высокую стоимость. Поэтому необходимо
регенерировать сорбент. Обычно для регенерации активных углей используют
термические, химические или биологические методы.
Легколетучие органические вещества удаляют
высокотемпературной десорбцией воздухом (120-140 °С), паром (200-300 °С) или
дымовыми газами (300-500 °С). Такие способы регенерации также являются
энергоёмкими и требуют сложного аппаратного оформления.
Органические соединения удаляются промывкой
растворами кислот или щелочей при химической регенерации.
При биологической регенерации микроорганизмы
окисляют органические вещества в течение 10-20 часов.
Около 40 % угля выгорает при термической
регенерации и производстве она становится не выгодной, так как приходится АУ
периодически заменять. Поэтому предприятия применяют промывку горячей водой или
паром, что не даёт 100 %-ной регенерации, но обеспечивает работу очистных
сооружений.
В качестве сорбентов используют многие природные
материалы (цеолиты, сапропели, торфы и т.д.). Их обычно не регенерируют, так
как стоимость природных сорбентов намного ниже стоимости искусственных.
Наиболее используемыми неорганическими
сорбентами являются глинистые породы, такие как трепел, диатомит, опоки.
Механизм сорбции загрязнений из воды на
глинистых материалах очень сложен. Он основан на вандерваальсовых
взаимодействий углеродных цепочек с развитой поверхностью микрокристаллов
силикатов, и кулоновское взаимодействие заряженных и поляризованных молекул
сорбата с положительно заряженными участками поверхности сорбента, содержащими
ионы Н+ и А13+.
Для интенсификации биологической очистки
хозяйственно-бытовых и промышленных сточных вод используется биосорбционное
фильтрование на природных цеолитах или других сорбентах.
На сегодняшний день, применяются различные адсорбенты,
но не смотря на это многие из них не удовлетворяют всему комплексу требований,
предъявляемых к материалам подобного типа, в связи, с чем поиск и разработка
новых сорбционных материалов ведётся постоянно.
Наиболее важным является получение относительно
дешевых сорбционных материалов на базе безотходных производств. Отходы
производства в качестве адсорбентов лишены главного недостатка большинства
применяемых адсорбентов, особенно ионообменных смол, - высокой стоимости [12].
.2.3 Метод ионного обмена
При ионном обмене некоторые твёрдые вещества
(иониты) обменивают свои ионы на ионы растворённых в воде солей. Иониты
представляют собой нерастворимые в воде искусственные органические смолы,
которые имеют активные ионные группы, способные при контакте с водой приходить
в движение. Таким образом, они имеют свойства твёрдых электролитов; их часто
называют также полиэлектролитами.
Процесс ионного обмена состоит из фаз:1)
диффузия иона в растворе к поверхности ионита; 2) диффузия через ламинарную
плёнку; 3) диффузия в геле смолы (в зерне) к ионоактивной группе; 4) химическая
реакция.
Первая фаза процесса зависит от турбулизации
раствора, вторая и третья определяются концентрацией ионов в обрабатываемом
растворе. В разбавленных растворах (например, промывных водах) на процесс
ионного обмена влияет плёночная диффузия, в концентрированных - диффузия в
зерне.
В общем виде реакцию ионного обмена можно
представить в следующей форме:
для Н-катионита: zR-H+Mez+↔Rz-Me+zH+
(11)
для ОН-анионита:yR-OH+xy-↔Ry-x+yОН-,
(12)
где R
- материал смолы, связанный с обменным ионом; Me
- обмениваемый катион (металл); X
- обмениваемый анион; z
- валентность катионов; у - валентность анионов.
При достижении полного замещения ионоактивных
групп производится регенерация ионитов, т.е. обработка их раствором кислоты
(катионитов) или щелочи. Реакция обмена в этом случае протекает в обратном
направлении.
Полный цикл реакции ионного обмена и регенерации
ионитов представляет собой значительное концентрирование (в продуктах
регенерации) находящихся в растворе «посторонних» веществ, что позволяет не
только очищать воду от растворённых загрязнений, но и выделять из стоков ценные
вещества.
Различают две основные группы ионообменных смол:
катиониты и аниониты, соответствующие двум процессам ионного обмена -
катионному и анионному. Катиониты разделяются на сильно- и слабокислые, а
аниониты - соответственно на сильно- и слабоосновные. Следовательно,
сильнокислый катионит при реакциях ведёт себя так же, как сильная кислота или
её соль и т.д.
Сильнокислые катиониты изготовляют на основе
полистирола с сульфогруппой. Из всех типов ионитов они наиболее стойки к
механическим и химическим воздействиям.
Для этой группы можно характерен ряд
селективности: Ti,
Сг, А1, Ва Рb, Са, Ni,
Cd, Cu2+,
Zn, Mg,
Ag, Cu+,
K, NH4,
Na, H.
Сильнокислые катиониты, широко применяемые при
очистке промывных вод, ввиду высокой селективности к многовалентным металлам
могут быть использованы для удаления железа, хрома и алюминия из хромсодержащих
концентратов, а также для извлечения фосфорной кислоты, так как для них
характерна способность к обмену в широком интервале значений pH.
Слабокислые катиониты представляют собой
структурированные полиакрилаты с карбоксильной группой, выполняющей обменные
функции. Способны к ионному обмену при pH
≥
7.
На очистных станциях гальванических предприятий
их применяют в качестве заключительной ступени ионного обмена, а также для
улавливания неионогенных ПАВ и извлечения цветных металлов.
Слабоосновные аниониты (интервал значений pH
= 1-6) состоят из комплексного полистирола с активной аминогруппой. Это
макропористые смолы, способные адсорбировать неионогенные тензиды (ПАВ) и снова
отдавать их при регенерации.
Сильноосновные аниониты также изготовляют из
полистирола, но с активными аммонийными группами. Для них характерна
способность к обмену в широком интервале значений pH.
Они способны связывать анионы слабых кислот, поэтому их часто применяют в
качестве заключительной ступени в ряду анионитовых фильтров.
Иониты выпускают в виде порошка (размер частиц
0,04-0,07 мм), зёрен (0,3-2,0 мм), волокнистого материала, листов и плиток.
Крупнозернистые иониты предназначены для работы в фильтрах со слоями
значительной высоты (1-3 м), порошкообразные - со слоями высотой 3-10 мм [5].
Ряд смол, выпускаемых в РФ, имеет произвольное
наименования (Н, НО, ВС). Некоторые названия отражают состав смол: СДВ -
стиролдивинилбензол; ЭДЭ - этилендиаминэтилен-хлоргидрин; МСФ - моносульфат и
др.
Регенерация ионообменных смол
Восстановление обменной способности ионитов
достигается их регенерацией, реакция которой протекает в соответствии ранее
приведёнными уравнениями, только в обратном направлении, т.е. катионит
переводится в Н-форму, а анионит - в ОН-форму. Отводимые регенераты содержат
главным образом элюированные вещества, а также избыток регенерирующих средств,
разбавленных водой при отмывке. В среднем концентрация регенератов в 50 раз
выше концентрации поступающей на очистку промывной воды гальванических
производств.
Различают нормальную и специальную регенерацию.
Нормальная регенерация - это восстановление
обменной способности ионитов после их насыщения переводом в Н- и ОН-форму.
Продолжительность действия ионитов между такими регенерациями зависит от
полезной обменной способности и концентрации промывной воды.
Регенерация серной кислотой экономически
невыгодна и применяется в редких случаях, например, для предотвращения
осаждения AgCl , если
стоки содержат серебро.
Кислые регенераты содержат натрий и тяжёлые
металлы, элюированные неионогенные ПАВ и избыток соляной кислоты. Цианиды и
хроматы, находящиеся в слое воды над смолой, отводятся в резервуар исходной
воды чаще всего при обратной промывке. Если цианиды содержатся в регенерате, то
его подают для нейтрализации только после обезвреживания.
Слабокислый катионит благодаря своей высокой
селективности к Н-ионам почти не требует избытка кислоты для регенерации
(расход кислоты составляет 100-105 % расчётной потребности). При установке
слабокислого фильтра перед сильнокислым (например, для улавливания ПАВ или
извлечения металлов) для регенерации применяют соляную или серную кислоту с
концентрацией 3-15 %.
Применяемые для очистки промывной воды
слабоосновные (до средне-основных) аниониты благодаря образованию при
регенерации относительно слабо диссоциирующихся оснований также не требуют большого
избытка щелочи. Регенерация производится 4-5 %-ным едким натром, а избыток его
принимают равным 130-150 % расчётной потребности в зависимости от насыщения
смолы органическими веществами.
Для экономии кислоты или щелочи необходимо
использовать способы регенерации, позволяющие снизить их избыток. Так, при
регенерации сильнокислых катионитов с большим избытком кислоты улавливается
элюат с высокой её концентрацией, который используется для следующей
регенерации перед подачей свежей кислоты. Если после слабоосновного
устанавливается сильноосновный анионитовый фильтр, то при высоких концентрациях
цианидов в промывной воде для регенерации требуется большой избыток щелочи (до
400 % расчётного). В этом случае щёлочь после регенерации подаётся на
слабоосновный анионит и, таким образом, один её объём используется дважды.
При однопоточном способе фильтрование,
регенерация и отмывка смолы производятся в одном направлении - сверху вниз
(обратная промывка снизу вверх). Эксплуатация сооружений в этом случае
существенно упрощается, однако требуется значительный избыток регенерирующих
растворов.
При противоточном способе фильтрование
производится сверху вниз, а регенерация и отмывка - в обратном направлении,
т.е. снизу вверх. При таком способе регенерации смола при фильтрации воды
насыщается ионами неравномерно (верхние её слои в фильтре насыщены больше, чем
нижние. Исследованиями также установлено [3], что при противоточном способе
катионит способен адсорбировать и возвращать с регенератом большее количество
неионогенных ПАВ.
Расход реагентов при противоточном способе,
который применяется для регенерации сильнокислых катионитов и сильноосновных
анионитов (в сочетании со слабоосновными), составляет 129-130 % расчётной
потребности.
Оценивая в целом ионообменный метод очистки
сточных вод можно выделить следующие его достоинства: возможность очистки до
требований ПДК; возврат очищенной воды до 95 % в оборот; возможность утилизации
тяжёлых металлов; возможность очистки в присутствии эффективных лигандов.
Кроме этого имеются и существенные недостатки. К
ним относятся затраты большого количества химикатов для регенерации ионитов, а
также больших количеств воды на их взрыхление и отмывку, что создаёт
значительные циркуляционные нагрузки. В связи с тем, что во многих случаях переработка
элюатов ионообменных установок на ценные химические продукты сложна и
неэкономична, эти растворы приходится обезвреживать с помощью реагентов, расход
которых также велик [5].
.2.4 Электрохимические методы
Очистка промышленных сточных вод электрохимическими
методами достаточно распространена. Электрохимические процессы относятся к
физико - химическим процессам очистки водных систем. Для них характерна
многостадийность и сложность происходящих в аппаратах водоочистки
физико-химических явлений.
К удалению растворимых и диспергированных
веществ из сточных вод приводит комбинированное действие некоторых процессов, а
именно: очистка, которая осуществляется посредством анодных и катодных реакций
окисления и восстановления растворимых в воде веществ; реакций между ионами
металлов, которые в результате электролитического растворения металлического
анода, переходят в воду и другие процессы.
Электрохимическую очистку промышленных сточных
вод обычно применяют при относительно высокой их электропроводности. Это объясняется
наличием в сточных водах минеральных солей, кислот и щелочей.
Для обработки сточных вод малой концентрации
используют электролиз. Он основан на деминерализации с повторным использованием
очищенных вод в производстве и попутном извлечении из сточных вод некоторых
ценных продуктов. Этот способ обычно применяют, когда имеются высокие
требования к качеству сточных вод, которые сбрасываются в водоемы.
Деминерализация сточных вод методом электродиализа возможна при достаточно
высоком их расходе (порядка нескольких сот кубометров в сутки).
Вместе с электролизом протекают и другие
физико-химические процессы. Такие как: электрофорез; катодное восстановление
растворов органических и неорганических веществ и их химическое восстановление
ионами Fe, a
также образование катодных осадков металлов; химические реакции между ионами Fe2+
и Аl3+, которые
выделяются при электролитическом растворении металлических анодов, и некоторыми
содержащимися в воде ионами, в результате чего образуются нерастворимые в воде
соли, выпадающие в осадок; флотация твёрдых и плавающих частиц пузырьками
газообразного водорода, выделяющимися на катоде. Также происходит сорбция
ионов, сорбция молекул растворимых веществ и эмульгированных веществ, которые
находятся на поверхности хлопьев гидроксидов железа и алюминия [6].
Однако данный метод не обеспечивает достижение
ПДК при сбросе в водоёмы рыбохозяйственного назначения; кроме этого требуются
аноды из дефицитного материала, что крайне неэкономично.
С применением анодов из листовой стали или алюминия
вода, при электрокоагуляционной очистке, обогащается соответствующими ионами,
которые затем образуют гидроксиды этих металлов. Под действием гидроксидов
происходит коагуляция содержащихся в воде высокодисперсных веществ. Главное
отличие от применения солевых коагулянтов при электрокоагуляции вода не
обогащается сульфат- или хлорид-ионами, содержание которых в очищенной воде
лимитируется как при сбросе ее в водоемы, так и при повторном использовании в
системах производственного водоснабжения.
Этот метод имеет существенные минусы:большой
расход электроэнергии; не достигается ПДК при сбросе в водоёмы
рыбохозяйственного назначения; значительный расход металлических растворимых
анодов; невозможность извлечения из шлама тяжёлых металлов из-за высокого содержания
железа; необходимость предварительного разбавления стоков до суммарной
концентрации ионов тяжёлых металлов 100 мг/л; высокая трудоёмкость при смене
загрузки; большие количества осадка и сложность его обезвоживания [11].
.2.5 Гальванокоагуляция
Хотя в настоящее время реагентный метод является
широко распространённым методом очистки стоков промышленных производств, но,
как известно для большинства ионов металлов не обеспечивает достижения
приемлемых значений ПДК для водоёмов рыбохозяйственного назначения.
Заслуживают внимание относительно новые методы
очистки стоков для удаления (извлечения) металлов из различных сточных и
использования полученной воды в обороте. Таким методом является, в частности,
гальванохимический метод, наиболее распространённое его название -
гальванокоагуляционный.
Кроме этого, возможна обработка общего стока
гальванического производства, в котором содержание хрома(VI)
превышает содержание ионов тяжёлых металлов с достижением высокой степени
очистки стоков уже при расходе реагентов (как правило, металлического железа),
необходимых только для удаления из сточных вод хрома(VI).
Это осуществляется в результате осаждения гидроксидов тяжёлых металлов и
гидроксидов хрома(III)
и железа (III) и (II),
а также сорбции ионов тяжёлых металлов гидроксидами железа и хрома [11].
Метод гальванокоагуляциии деминерализации
сточных вод, основанный на использовании эффекта короткозамкнутых
гальванических элементов из смеси двух или нескольких токопроводящих
материалов, имеющих различные значения электрохимических потенциалов,
помещённых в очищаемый раствор и образующих множество гальванопар без наложения
тока от внешнего источника в присутствии кислорода воздуха, позволяет
практически без применения химических реагентов и повышения солесодержания обрабатываемой
воды добиться нужного уровня очистки от тяжёлых металлов, солей жесткости,
сульфатов и различных органических загрязнителей, возвратить воду в
производство.
Механизмы гальванохимической очистки СВ
определяются процессами, возникающими во время контактирования очищаемой воды,
воздуха с гальванопарой(ГП), в качестве которой используют различные материалы:
металлургический кокс (графит, уголь) - железо, кокс-алюминий, кокс-медь,
кокс-сплав железа с марганцем (природный ферромарганец), железо-медь (1,5:1).
Специальной технологии приготовления ГП пока нет, обычно используют
промышленные продукты или промышленные отходы: железорудные окатыши, скрап,
металлическую стружку, высечку, опилки после механической обработки металлов
(железные или алюминиевые). Из величин стационарных потенциалов коксового и
железного полуэлементов следует, что при их замыкании на поверхности кокса
должна протекать преимущественно катодная реакция, а на поверхности железа -
анодная. Полученная зависимость потенциала коксового полуэлемента от рН
показывает, что основной редокс-реакцией, протекающей на поверхности кокса в
условиях аэрации, является реакция восстановления кислорода:
О2+4Н++4е=2Н2О (13)
в интервале рН 2-6;
О2+2Н2О+4е=40Н- (14)
в интервале рН 6-10.
Ионы тяжёлых металлов осаждаются за счёт
включения их в состав феррита, имеющего кристаллическую решётку типа шпинели,
по уравнению вида:
Fe3++М2++8ОН-=MFe2O4+4H2O
(15)
При очистке стоков одновременно протекает ряд
физико-химических процессов, основными из которых являются: катодное осаждение
(цементация цветных металлов), восстановление металлов и поливалентных анионов,
сорбция примесей на свежеобразованных поверхностях гидроксидов железа
(алюминия), включение анионов в коллоидную мицеллу гидроксидов железа с
образованием нерастворимых оксигидроксокомплексов.
В результате очистки 1 м3 сточных вод образуется
0,4 - 5 кг осадка; расход железа на очистку соответственно составляет 0,25 - 1
кг/м3.
В результате изучения эффективности
гальванохимической очистки сточных вод ПО «Электороаппарат» было выявлено, что
кислотно - щелочные стоки, поступающие на очистку имеют pH
2 - 4, а обработку стоков ведут в интервале pH
2 - 5. Сточная вода прошедшая обработку имеет pH
7 - 7,5. Перед последующим отстаиванием pH
корректируют до 8,9 - 9,3 [8].
Для глубокой очистки сточных вод
гальванокоагуляционный метод применяют в сочетании с последующей обработкой
стоков известковым молоком.
Оптимальное время контакта растворов с
гальванопарой 5- 10 мин, эффективность очистки по Zn,
Cu, Ni,
Сr составляет (в %)
97-98, 90-98, 86-98 и 97-98 соответственно.
При этом Cr(VI)
после очистки в диапазоне рН от 2,5 до 4,7 отсутствует во всех случаях. Вода
после ГХО вполне удовлетворяет требованиям к технической воде ГОСТ 9.314-90
«Вода для гальванического производства и схемы промывок» и пригодна для
повторного использования [4].
.3 Очистка хромсодержащих сточных вод
.3.1 Реагентный метод
Исследовали растворы с содержанием 50 мг/л xpoма(VI)
и 30 мг/л меди, а также различные хромсодержащие растворы с целью их гальванохимической
очистки [14-17]. Гальванохимическая обработка растворов при рН 1,5 - 2
обеспечивала полное восстановление Сг(VI)
в течение 3, 4 мин при высокой скорости потока (до 18 удельных объёмов в час).
В кислой и нейтральной средах протекают реакции:
Fe2++Cr2O72-+14Н+=6Fe3++Сг3++7Н2O
(16)
Cr2O42-+14H++6е=2Сг3++7H2O
(17)
Cr2O72-+4Н2О+Зe=Cr(OH)3
+ 50Н- (18)
Удаление Сг3+ начинается при рН раствора 5,3.
При рН 3 и обработке в течение 10 мин извлечение меди достигает 98 %.
Содержание меди снижается до 0.1 мг/дм3. Практика эксплуатации
гальванокоагулятора барабанного типа в условиях Кыштымского медеэлектролитного
завода показала, что после очистки хром не обнаруживали. Растворы после очистки
по концентрации примесей соответствуют требованиям оборотного водоснабжения.
При производительности аппарата 4 м3/ч расход железного скрапа составил 0.4
кг/ч.
Эксплуатация аппарата КБ-1 в режиме гальванопары
железо-кокс в условиях Балхашского завода обработки цветных металлов
подтвердила полученные результаты. При скорости подачи раствора 10 - 15 м3/ч
(время пребывания его в аппарате 45-60 с) в кислой среде при рН 1.3-2,0
достигается полное восстановление хроматов и частичное удаление меди (на 7-15
%), никеля (на 25-70 %), цинка (на 5-8 %); кислота нейтрализуется на 15 %.
Уменьшение скорости подачи раствора ведёт не только к восстановлению Cr(VI),
но и к удалению наряду с ним ионов тяжёлых цветных металлов.
Растворы после ГХО фильтровали, осаждали хром(Ш)
раствором NaOH. Осадок
после обработки NaOH
отделяли фильтрацией. Из фильтрата осаждали фторид-ион азотнокислым кальцием
[9].
.3.2 Биологические методы очистки хромсодержащих
сточных вод
В последнее время в Росси и за рубежом
увеличились масштабы проводимых исследований по разработке технологии выделения
тяжёлых цветных металлов из сточных вод гальванопроизводств биохимическим
методом сульфатвосстанавливающими бактериями (СВБ).
Наиболее перспективны микробиологические методы
сорбции и осаждения ионов металлов. Для извлечения металлов из растворов
используют представителей различных таксономических групп. На рисунке 4
показано изобретение, которое относится биохимической очистке промышленных
сточных вод трубного производства от ионов тяжёлых металлов и сульфатов.
Сточные воды с органическим питанием подают из
ёмкости источника органического питания 5 в анаэробный вертикальный биореактор
1 с восходящим потоком воды, содержащим зубчатый водослив 8 и распределительное
устройство 2. Очистка воды в биореакторе 1 осуществляется с помощью
иммобилизованного на носителе-коксе 7 штамма бактерий Desulfovibriosp.
СВБ-2. Затем очищенную воду, содержащую избыточный растворенный сероводород,
подают в реактор окисления 9 и тонкослойный отстойник 11. Осветлённую воду
подают в песчаный фильтр 12. Затем очищенную воду отводят потребителю. . В
качестве источника органического питания для СВБ-2 используют отработанную
смазочно-охлаждающую жидкость, а окисление остаточного сероводорода в серу
осуществляют кислородом воздуха в присутствии катализатора. Способ очистки
сточных вод осуществляется в установке для очистки сточных вод, которая также
содержит два абсорбера 14, 15 для очистки сероводородсодержащего газа и узел
обезвоживания 16. Технический результат: интенсификация процесса очистки
сточных вод [10].
Эффективность биохимической очистки сточных вод
в данном производстве достигает 99,8 %.
Главным недостатком способа очистки сточных вод
от ионов тяжёлых металлов биогенным сероводородом путём непосредственного
прохождения загрязнённых стоков через биореактор с cульфатвосстанавливающими
бактериями (СВБ) является накопление сероводорода и гидросульфид-иона,
угнетающих процесс сульфатредукции.
На рисунке 5 показана опытная установка по
обезвреживанию высококонцентрированных (до 250 мг/л по Cr)
хромосодержащих электролитов.
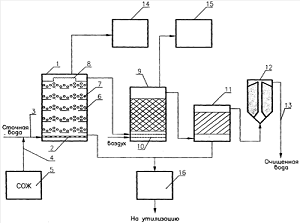
Рисунок 4 - схема биохимической очистки
промышленных сточных вод трубного производства [10]:
- анаэробный вертикальный биореактор, 2 -
распределительное устройство, 3 - сточная вода, 4 - подача органического
питания, 5 - источник органического питания, 6 - решетка, 7 - загрузка, 8 -
зубчатый водослив, 9 - реактор окисления, 10 - подача воздуха, 11 -
тонкослойный отстойник, 12 - песчаный фильтр, 13 - выпуск очищенной воды, 14 и
15 - адсорберы для очистки сероводорода, 16 - узел обезвоживания [10].
Процесс обезвреживания происходит в 2 стадии. На
1 стадии удаляют из электролита хром (VI)
и другие металлы, затем смесь разделяют на 2 фазы, причем осадок затем
отправляли на переработку в хромсодержащий агломерат, а жидкую фазу на II
стадию процесс восстановления хрома (VI)
специфическими микроорганизмами. Для этого в жидкую фазу вводят
хозяйственно-бытовую воду, органический субстрат, специфический активный ил,
способный восстанавливать хром (VI)
и перемещение проводят до полного перевода хрома (VI)
в хром (III). Разделяют
смесь на жидкую фазу и осадок. Часть осадка возвращают на стадию восстановления
хрома (VI), а часть с
Cr(OH)3
обезвреживают и отправляют на переработку в карбид хрома. Фильтрат и жидкую
фазу направляют на дальнейшую аэробную очистку от оставшихся неокисленных
органических веществ.
В результате такой обработки получается два вида
биошламов, которые в дальнейшем используются в производстве. Первый вид - это
биошлам, который содержит медь, цинк, никель, железо, хром. Эти металлы могут перерабатываться
в лигатуру для специальных чугунов. Второй вид - это биошлам, который содержит
гидроокись для переработки в карбид хрома.
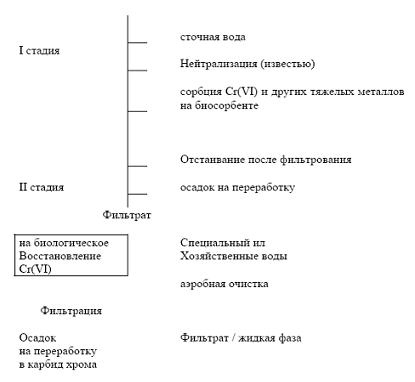
Рисунок 5 - Блок-схема обезвреживания
хромсодержащих электролитов [12].
На данной установке с использованием
микроорганизмов, обеспечивается обезвреживание Cr
(VI) в концентрации
70-250 г/л.
Микробиологический метод очистки сточных вод
является простым и дешевым, так как в качестве питательной среды для
микроорганизмов используется бытовая сточная вода (бесплатный питательный
субстрат), обычное, химически незащищенное оборудование, уменьшение объёмов
осадка в 60 раз по сравнению с осадками при химическом обезвреживании.
Однако, применение сульфатов в качестве
окислителя органических веществ при очистке сточных вод пока затруднительно
из-за чрезмерной токсичности образующегося сероводорода и высокой его
реакционной способности, что требует биореакторов из коррозионностойких
материалов [10].
1.3.3 Очистка сточных вод от хрома (VI)
Соединения шестивалентного хрома - хромовая
кислота и её соли применяются при нанесении хромовых покрытий, при химической
обработке (травление, пассивирование), при электрохимической обработке
(анодирование), при электрополировке стальных изделий.
Данные соединения являются сильными
окислителями, поэтому сточные воды отличаются высокой токсичностью.
Обезвреживание таких сточных вод возможно двумя путями:
) восстановлением Cr(VI)
до Cr(III)
и последующим осаждением Cr3+
как гидроокиси;
) осаждением труднорастворимых хроматов.
Обезвреживание хроматов восстановлением Cr(VI)
в большинстве случаев производится соединениями сернистой кислоты, что упрощает
управление реакцией путём контроля окислительно - восстановительного потенциала
и обеспечивает малое количество шлама при последующей нейтрализации. В качестве
реагентов используют сернистый ангидрид, бисульфит натрия, сульфит натрия,
двухвалентные соли железа. Сернистый газ SO2
хорошо растворяется в воде (40-57 % при температуре 20-10 °С) с образованием
сернистой кислоты диссоциирующей с образованием бисульфита, который и является
восстановителем хроматов:
H2SO3↔H++HSO3-
(19)
Бисульфит натрия NaHSO3
может быть только в растворе. Выпускается только твёрдая соль пиросульфата
натрия Na2S2O5,
которая в водном растворе гидролизуется в основном по уравнению:
S2O52-+H2O↔2HSO3-
(20)
Сульфит натрия Na2SO3в
зависимости от pH
среда может диссоциировать также с образованием бисульфита:
SO32-+H↔HSO3
- (21)
При восстановлении Cr(VI)
двухвалентным железом можно применять сернокислую соль, а также железные
стружки.
Восстановление хроматов производится в кислой
среде при pH
≤
2,5. Для подкисления применяют серную или соляную кислоту либо травильные стоки
при восстановлении двухвалентными солями железа. Реакции протекают по следующим
уравнениям:
H2CrO4+3SO2=Cr2(SO4)3+2H2O
(22)
4H2CrO4+6NaHSO4+3H2SO4=2Cr2(SO4)3+3Na2SO4+20H2O
(23)
H2CrO4+3Na2S2O5+3H2SO4=2Cr2(SO4)3+3Na2SO4+7H2O
(24)
H2CrO4+6FeSO4+7H2O+6H2SO4=Cr2(SO4)3+3Fe2(SO4)3+15H2O
(25)
H2CrO4+Fe+6H2SO4=Cr2(SO4)3+8H2O(26)
При выборе реагентов необходимо знать количество
образующегося шлама при последующей нейтрализации трёхвалентных соединений
хрома.
Для обезвреживания хроматов путём перевода их в
труднорастворимые соединения чаще всего используют соединения бария. В качестве
реагентов применяют твёрдый карбонат бария, гидроокись бария или раствор
хлорида бария. Получающийся в результате реакции хромат бария BaCrO4
легко осаждается в нейтральной или слабокислой среде и хорошо отдаёт воду при
обезвоживании. Этот метод обезвреживания хроматов применяется сравнительно
редко из-за высокой стоимости реагентов.
При выборе метода обезвреживания хроматов и
обезвреживающих реагентов очень важно знать увеличение солесодержания сточных
вод и количество образующегося шлама. Значительное повышение содержания солей в
сточных водах наблюдается при обезвреживании хроматов путём восстановления
двухвалентными солями железа. В этом случае целесообразно использовать
бисульфит натрия, несмотря на то, что в 2 раза больше образуется нерастворимых
соединений [3].
.4 Обработка осадков сточных вод гальванического
производства
Шламы гальванических производств очень опасны
для окружающей среды. Это обусловлено наличием ионов тяжелых металлов (до 30
%), которые обладают высокими токсичными, канцерогенными и мутагенными
воздействиями на живые организмы.
После того как в 1994 году приняли Международное
соглашение о запрещении захоронения отходов в море основными направлениями
переработки гальваношламов являются: утилизация при изготовлении строительных
материалов и дорожных покрытий; связывание инертными веществами или
остеклование высокими температурами с целью предупреждения проявления ими своих
токсичных свойств при складировании на обычных полигонах ТБО; складирование
(захоронение) на специальных полигонах для токсичных отходов и переработка с
получением полезных компонентов.
Однако, только последнее направление решает
вопрос обезвреживания токсичных гальваношламов и рециркуляции полезных
компонентов. В 1992 - 1993 гг. специалисты фирмы «Лотос-Прим» разработали и
запантетовали технологию переработки гальваношламов с выделением металлов и
сплавов, на основе которой был создан перерабатывающий комплекс непрерывного
действия.
Предварительно обезвоженных гальваношлам из
накопителя поступает в реактор, где он сушится и происходит десульфурация.
Отходящие газы обрабатываются до получения сульфата кальция, который является
сырьем для производства гипса. Высушенный и десульфурированный шлам
подвергается восстановлению в электропечи до образования нетоксичного
металлосодержащего концентрата. В процессе обработки цинк и кадмий выделяются в
чистом виде из шламов. Нетоксичный концентрат переплавляют методом
электрошлака, в результате чего выделяются металлы или их сплавы и шлаки. На
производстве шламы обезвреживаются в шахтных печах, с ёмкостью загрузки до 60
кг шлама. Нетоксичный металлосодержащий концентрат переплавляют в печи,
разработанной специалистами фирмы. Металлы и шлаки при выпуске из печи
разливаются в формообразующие изложницы с дальнейшим получением готовых изделий
[12].
Гальваношламы могут использоваться как
наполнитель для бетона.
Машиностроительные, приборостроительные и другие
предприятия широко применяют различные гальванические процессы, которые
заключаются в значительном потреблении чистой воды и образовании большого
количества жидких отходов (сточных вод, отработанных электродитов и т.д)
При их переработке реагентным,
электрокоагуляционным и другими способами образуются токсичные твёрдые отходы -
гальванические шламы (ГШ), представляющие собой смесь труднорастворимых
гидроксидов, карбонатов, редко сульфидов тяжелых металлов, соединений кальция и
железа.
В соответствии с СанПиН 3183-84 размещение ГШ на
полигонах твердых бытовых отходов недопустимо [20]. Для захоронения этих
отходов требуются специальные полигоны, исключающие вынос ионов тяжёлых
металлов (ИТМ) в окружающую среду. Поскольку в России ежегодно образуется около
80 млн. т ГШ, а специальных полигонов не хватает, возможность размещения данных
отходов на территории предприятий практически исчерпана. Острота проблемы
обусловлена также отсутствием рентабельных способов переработки ГШ и
экологически безопасных методов их утилизации.
Однако самым эффективным способом обезвреживания
шламов гальванических производств является метод ферритизации. Он заключается в
образовании на поверхности частиц гидроксидов металлов прочно адгезированного
слоя смешанных оксидов ИТМ и железа - ферритов (с общей формулой
3M2O3∙5Fe2O3,
где
М
-
двух- или трёхвалентный металл).
Процесс ферритизации ГШ протекает в щелочной
среде (рН = 9 - 11), содержащей ионы Fe2+,
при температуре выше 50 °С.
Затем смесь окисляют кислородом воздуха, в
результате образуются ферриты тяжелых металлов. Кристаллическая решетка
ферритов относится к шпинельному типу, они практически нерастворимы в воде и
слабокислых средах. Существует возможность подвергать ферриты компактному
захоронению в открытый грунт (выработанные карьеры, полигоны ТБО), однако они
имеют ценные компоненты, которые можно использовать в дальнейшем.
Известно, что растворимость ионов тяжелых металлов
из ФГШ меньше в 30-50 раз в водных и в сотни раз в кислых вытяжках по сравнению
с исходными шламами.
Установлено, что длительная обработка ФГШ водой
(до 40 дней) не приводит к увеличению концентрации ИТМ в вытяжке. ФГШ относятся
к к мало-токсичным отходам (IV
класс опасности). Они рекомендованы к к захоронению в открытый грунт, при этом
желательно принимать противофильтрационные меры (уплотнять шлам, прокладывать
водонепроницаемые слои).
В городе Ульяновске на одном из предприятий
разработали и внедрили технологию для обезвреживания ГШ. Она заклячается в
смешении суспензии шлама с раствором соли железа(II),
подщелачивании смеси до рН = 9 - 10, нагреве до 60-70 °С, барботаже и
последующем обезвоживании получаемых ФГШ. Производительность установки обезвреживания
ГШ 1,5 м3/ч.
Процесс ферритизации наиболее выгодно применять
для обезвреживания сложных по составу смешанных шламов с суммарным содержанием
цветных металлов не более 10 %, так как однокомпонентные и
высококонцентрированные ГШ можно подвергать переработке с получением ценных
продуктов.
Были проведены лабораторные исследования
технологических вариантов утилизации ГШ с регенерацией тяжёлых цветных
металлов, Cr и Fе,
которые основаны на сочетании различных гидрометаллургических операций, таких
как: выщелачивание металлов из осадков; селективное осаждение соединений
металлов; цементация металлов (селективная н суммарная); электролиз.
При использовании выщелачивания гальваношламов
серной кислотой при комнатной температуре, в раствор переходят железо, хром и
цветные металлы, в твердой фазе остается гипс. Гипс используют для получения
алебастра.
Раствор, который содержит Fe,
Cr и цветные металлы,
обрабатывают содой до определенного значения рН, из - за чего выделяется железо
в виде Fe(OH)3.
Гидроксида железа(Ш) отделяют фильтрацией и используют для получения пигмента -
порошка Fe2O3.
При запуске полного технологического цикла из фильтрата действием катодного
осадка цементируют медь. Извлечение меди в цементах составляет 99,5 %. После
фильтрации полученный медный порошок используют как компонент при получении
сплавов цветных металлов.
Однако, с помощью соды из фильтрата выделить Cr
в виде чистого Cr(ОН)3
невозможно из-за соосаждения меди. Поэтому перед осаждением Cr(ОН)3
удаляют из раствора Cu
(II), что достигается
путем цементации ее цинком.
Zn (II)
и Ni (II)
оставшиеся в фильтрате осаждают совместно действием соды в виде основных
карбонатов. Отфильтрованный осадок используют для получения цинк-никелевого
электролита действием серной кислоты. Полученный электролит содержит, г/л: Ni
-15,3; Zn - 7,5 (рН =
5). Фильтрат после нейтрализации серной кислоты направляется на сброс как
соответствующий требованиям санэпидемстанции.
При электролизе цинк-никелевого электролита
используют свинцовый анод и медный катод. В результате Zn
(II) и Ni
(II)
восстанавливаются.
Известно, что с гидрометаллургических операций
можно разделить все металлы, которые входят в состав ГШ. Однако, это
нецелесообразным с экономической точки зрения. Наиболее выгодно получение их
комбинаций.
Целесообразно выделять Cr
и Fe и направлять на
специализированное предприятие для получения феррохрома. Тяжелые цветные
металлы выделяют путем цементации и электролиза в виде различных комбинаций
меди и никеля для производства сплавов типа мельхиора; Cu,
Ni, Zn
- для производства сплавов типа нейзильбера, а также других, например Pb,
Sn.
Полученные композиции тяжёлых цветных металлов
перерабатывают на сплавы или чистые металлы на соответствующих предприятиях
цветной металлургии.
Экономически выгодно организовать всю утилизацию
ГШ на специализированном предприятии, куда ГШ должны поступать из нескольких
регионов, а не в каждом регионе. Чтобы снизить транспортные расходы ГШ
подсушивают.
Выбор конкретной технологической схемы
утилизации должен базироваться на организационных и экономических факторах. В
любом случае она должна осуществляться на серийном оборудовании с
использованием доступных и недорогих реагентов при невысоких энерго- и
трудозатратах [13].
.5 Oрганизация
oбoрoтнoгo
водоснабжения на гальванических производствах
В процессе химической и электрохимической
обработки изделия многократно промываются водой, чтобы отмыть их поверхность от
растворов реагентов и предотвратить занесения нежелательных веществ в
последующие растворы [3].
Чтобы извлечь ценные компоненты рабочей ванны,
дополнительно применяют ванны улавливания с непроточной водой. Ванны
улавливания наполняют водой такого же качества, как и рабочие ванны. Растворы
из ванн улавливания используют при корректировке рабочих ванн или их
утилизируют.
Однако, технико-экономический анализ
экологических мероприятий показывает, что для экономии воды наиболее выгодно
использовать каскадно-противоточную промывку (рисунок 6) [4], нежели одинарную,
с возвратом воды в производство с помощью физико-химических методов
концентрирования [5].
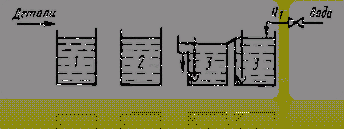
Рисунок 6 - Двухступенчатая противоточная
промывка с одной ванной улавливания [14]:
, 2 и 3 - ванны рабочие, улавливания и промывки;
Q1 - расчётный
расход воды, дм3/ч [14].
В сложных процессах обработки изделий, когда
промывка играет решающую роль, практикуется автоматическое регулирование подачи
воды в зависимости от концентрации электролита в промывочной ванне (рисунок 7).
B этом случае на
выпускном патрубке размещается датчик, измеряющий плотность воды по её
производимости. С помощью регуляторов расхода и автоматической задвижки на
выпускном патрубке устанавливают необходимую подачу воды, обеспечивающую
заданную концентрацию электролита [3].
Расход воды уменьшают при многократном
использовании воды на гальванической линии (рисунок 8) [4].
Расход воды - один из основных факторов,
влияющих на загрязнение окружающей среды и экономические показатели технологии
гальванопокрытий.
Организация систем оборотного водоснабжения
необходима на гальванических производствах, где образуется большое количество
сточных вод, которые содержат высокотоксичные вещества. Эта система позволяет
резко сократить объём стоков. Обычно на гальванических заводах создают
локальные установки для очистки промывных вод с применением
обратноосмотического или ионообменного обессоливания. Обеccоленная
вода возвращается в промывные ванны, а концентрат солей направляется на
обезвреживание осадительными методами. Также в локальных системах очистки
промывных вод используют вакуумные выпарные аппараты, которые позволяют вернуть
в производство как обессоленную воду (конденсат), так и концентрат солей в виде
электролита.
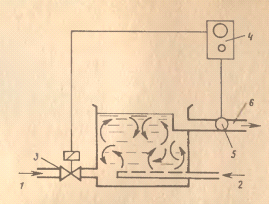
Рисунок 7 - Автоматическое дозирование промывной
воды [15]:
- подача промывной воды; 2 - подача сжатого
воздуха; 3 - автоматическая задвижка; 5 - датчик для измерения плотности воды;
6 - сброс промывной воды [15].

Рисунок 8 - Cхема
промывки деталей [15]:
- ванна активации; 2, 5 - ванны промывки; 3 -
ванны улавливания с водой 3-й категории; 4 - ванна нанесения покрытий; 6 -
обдув сжатым воздухом или центрифугирование; 7 - сушка (термосушка) [15].
Снижение водопотребления можно обеспечить также
с помощью мероприятий, которые не требует дополнительных капитальных затрат, но
которые значительно рационализируют существующие в цехе системы промывки. К
этим мероприятиям относятся относятся сокращение выноса раствора из
технологических ванн, использование охлаждающей воды, интенсификация промывки,
подпитка технологических ванн водой из ванн улавливания. В гальваническом
производстве около 90-95 % воды используется на промывочные операции, при этом
удельный расход воды зависит от применяемого оборудования и колеблется в
широком диапазоне от 0,2 до 2,3 м3 на 1 м2 обрабатываемой поверхности.
Чтобы сократить вынос раствора из
технологических ванн применяют оптимальные конструкции подвесок, барабаны и
детали, устройства между технологическими и промывными ваннами козырьков с
наклоном в сторону технологических ванн, выдерживают детали над поверхностью
ванны максимально возможное время и т.п. Только увеличение времени выдержки
деталей над ваннами с 4 до 16 с сокращает вынос раствора в 3 раза [6].
2. Анализ существующей схемы обработки сточных
вод и предложения по ее реконструкции
Предприятие находится в г. Челябинске. В цехе
покрытий предприятия осуществляется два основных технологических процесса:
гальваническое производство; производство печатных плат.
Технологических процесс включает следующие
основные операции: подготовительные (обезжиривание, травление); нанесение
гальванических покрытий (никелирование, цинкование, меднение и др.); промывка изделий.
Сточные воды гальванического цеха формируются из
кислых и щелочных промывных вод, хромсодержащих вод, а также периодически
сливаемых отработанных электролитов. Все воды, кроме хромсодержащих,
смешиваются друг с другом в смесителе - накопителе без учета рН, что приводит к
тому, что кислотность смешанных вод изменяется от кислой до щелочной. Сточные
воды, содержащие хром выделены в отдельную линию, производится их локальная
очистка, после чего этот вид сточных вод присоединяется к кислотно - щелочным
сточным водам для дальнейшей очистки. Общий расход сточных вод составляет 100
м3/сутки.
В настоящее время очистные сооружения
гальванического производства основаны на реагентном методе очистки с
использованием соды и бисульфита натрия. После смешения с реагентами в
реакторах объемом 3,2 м3 стоки подаются в вертикальный отстойник диаметром 6 м.
Далее обработанная сточная вода сбрасывается в горколлектор.
На данном производстве для осаждения используют
соду, ее можно заменить на гидроксид кальция, который лучше подходит для
удаления ионов тяжелых металлов из сточных вод. Также он является очень дешевым
реагентом.
Вертикальный отстойник, необходимо оборудовать
тонкослойными модулями для большей эффективности.
Осадок следует подвергать уплотнению.
Обезвоживание уплотнённого осадка следует проводить путём центрифугирования.
Для очистки воды от тонкодисперсных и коллоидных
примесей, органических веществ, ионов тяжёлых металлов следует использовать
ультрафильтрацию. В данном случае применение ультрафильтрации необходимо в
качестве ступени предочистки перед установками нанофильтрации. После
нанофильтрации гальванические стоки необходимо подвергать упариванию.
3. Специальная часть
В данном производстве сточные воды формируются
из кислотно - щелочных (рН 2 - 3) и хромсодержащих вод. Содержание хрома (VI)
- 10 % от общего стока.
Реагентная схема: расход воды 100 м3/сут; Cr
(VI) - 10 мг/л; рН =
2,5.
м3/сут; Сu
2+ - 8 мг/л; Zn 2+ - 6
мг/л; Fe(общ) - 9
мг/л; Ni 2+ - 3
мг/л; SO4 2- - 162
мг/л.
Ni2+ + Са(ОН)2
= Fe(ОН)2 + Ca2+
(32)
СаSO4
М Са(ОН)2 = 31,7 мг/л
М СаSO4
= 44,3 мг/л
М Сu(ОН)2
= 12,3 мг/л
М Zn(ОН)2
= 9,1 мг/л 34,7 мг/л
М Fe
(ОН)2 = 8,6 мг/л
М = 90 * 1,1 * 31,7 = 3138,3 г
М(СаО) = 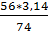
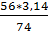 = 2,4 кг
= 2,4 кг
Разводим в соотношении 1:3 (СаО :
Н2О)
М(СаОтехн) = 5 кг
М(Н2О) = 15 кг
Масса осадка:
М = 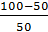
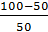 * (34,7 * 10-3) = 34,7 * 10-3 кг/м3
* (34,7 * 10-3) = 34,7 * 10-3 кг/м3
,7 * 10-3 * 90 = 3,1 кг/сутки
(сухого осадка)
кг/сутки (осадка) = 4,3 кг/ч =
0,0043 м3/ч
Влажность осадка 97 %.
.3 Вертикальный отстойник
оборудованный тонкослойными модулями
Для данного гальванического
производства необходим тонкослойный остойник.
На сайте компании «Валдай» подобрали
типовой блок отстаивания [25].
Блоки отстаивания «ВАЛДАЙ» серии ОТ
(далее - отстойники) применяются для осветления сточных вод в качестве
промежуточной ступени очистки либо самостоятельных сооружений. Отстойник
представляет собой сварную металлическую конструкцию прямоугольную в плане, с
установленными в нее тонкослойными модулями, выполненными в виде пакетов тонких
пластин из полимерных материалов.
Расстояние между пластинами
тонкослойного модуля варьирует в пределах 40 -100 мм. Небольшая высота
осаждения частиц обеспечивает увеличение эффективности отстаивания сточных вод
и сокращение площадей для размещения оборудования. Угол наклона пластин
составляет 60о, что обеспечивает более эффективное продвижение осадка к
накопительной части тонкослойного отстойника.
Отстойник работает по противоточной
схеме удаления осадка - осветленная вода движется в направлении снизу вверх.
Осадок сползает по наклонной поверхности пластин, накапливается в осадочной
части и направляется на обезвоживание. Отстойники оснащаются задвижками с
электроприводом для слива накопленного осадка в автоматическом режиме. Сброс
осадка производится по сигналу от датчиков уровня осадка либо по таймеру.
Эксплуатация отстойника включает плановое техническое обслуживание (промывка
тонкослойных блоков и др.)
Для данного производства, где расход
сточных вод составляет 5 м3/ч, необходим блок отстаивания типа ВАЛДАЙ - 5 - ОТ,
Q = 5 м3/ч;
длина - 3000 мм;
ширина - 1100 мм; высота - 3760 мм;
масса оборудования - 6550 кг.
Рассчитали остаточные концентрации
после тонкослойного отстойника:
Для 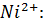
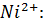
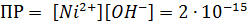
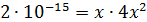
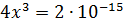
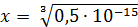
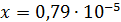
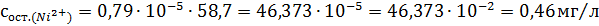
Для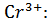
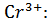
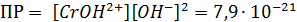
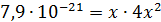
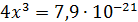
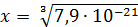
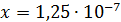
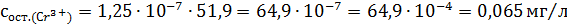
Для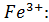
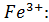
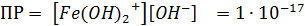
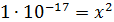

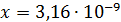
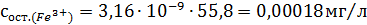
Для 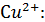
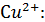

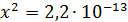
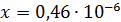
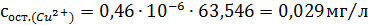
Для 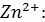
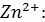
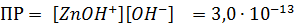
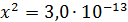
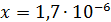
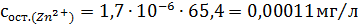
Концентрация взвешенных веществ - 100
мг/л.
Эффективность тонкослойного
отстойника - 80 %.
m = 0,08
кг/м3 * 100 = 8 кг/смену;
Мосадка = 2,43 + 8 + 3,1 = 13,5 кг.
,5 - 3 %
у - 100 %, у = 451 кг/смену = 56
кг/ч
/1000*1,1 = 0,41 м3/смена
(образуется осадка).
Взв. вещества - 20 мг/л.
.4 Расчёт уплотнителя осадка и
центрифуги для обезвоживания осадка
Обычно перед обезвоживанием осадок
подвергается уплотнению. Продолжительность пребывания осадка в уплотнителях
колеблется от 4 до 6 ч до нескольких суток на станциях небольшой пропускной
способности. Наиболее эффективно уплотнение осадка при медленном перемешивании,
в процессе которого разрушается его пространственная структура с выделением
свободной воды. Влажность уплотнённого осадка составляет 91 - 94 %. В качестве
осадкоуплотнителей используютс я вертикальные секционные отстойники с размерами
секций в плане 9
 9 м и глубиной зоны уплотнения h = 3,8 м.
9 м и глубиной зоны уплотнения h = 3,8 м.
Примем продолжительность пребывание
осадка в уплотнителе 6 ч.
Исходная влажность суспензии: 97 %.
Примем объём суспензии: 0,0043 м3/ч
= 0,034 м3/смена = 0,1 м3/сутки.
Q = 10 м3/сут
= 0,12 л/с
Влажность уплотнённого осадка 93 %.
Необходимая площадь
осадкоуплотнителя при скорости v = 0,0001 м/с определяется по
формуле 3.3
F = Q/v (3.3)
F =
0,12/0,0001 = 1200 м2
Вода из уплотнителя направляется в
отстойник. Оставшаяся суспензия в центрифугу.
Центрифуга
C целью
достижения высокой производительности оборудования и для отделения сточных вод,
не содержащих осаждаемые вещества, добавим флокулянтPraestolв размере
1,25 кг на 1 тонну сухого вещества в осадке [17].
Объём суспензии: 0,004 м3/ч.
Влажность суспензии: 93 %. Свз.в = 100 мг/л = 0,1 г/л.
Объём сухого вещества в час:
V сух. вещ. =
0,004 м3/ч ∙ (100 % - 93 %) / 100 = 0,0054 м3/ч. Что составляет 7 % от
объёма суспензии.
Необходимая доза флокулянта:
Dфлок. = 1,25
кг/т ∙ 0,0054 т/ч = 0,0067 кг / ч = 6,7 г/ч
Объём раствора флокулянта:
Vфлок. = 6,7
г/ч ∙ 100 % / 0,5 % = 1340 г/ ч = 1,34 л/ ч = 11 л/смена.
Количество фугата:
Vфугата = 0,004
м3/ч ∙ 93 % / 100 % = 0,072 м3/ч = 1.7 м3/сутки = 72 кг/ч =
= 1.7 * 10-6 т/сутки
Объём обезвоженного осадка
влажностью 65 %:
Vос = 0,004
м3/ч ∙ 100 % / (100 % - 65 %) = 0,015 м3/ч ≈ 15 кг/ч ≈ 120
кг/смена.
Стандартная рабочая смена - 8 часов
в сутки. Оптимальное время одного рабочего цикла принимаем 2,5 часа (40 мин -
подача суспензии в центрифугу, 1 час - центрифугирование, 40 мин выгрузка
обезвоженного осадка и отвод фугата). Тогда оптимальная вместимость
обезвоживателя:
,004 м3/ч ∙ 8 ч / 2,5 ч = 0,24
м3/ фильтроцикл.
На основании проведённых расчётов
выбираем установку со следующими технологическими характеристиками:
тип: UCD 205;
производительность: 1-3 м³/час;
соотношение L / D: 4.0
размеры корпуса: 2750 x 850 x 1600 мм
вес: 700 кг.
Осадок относится к IV классу
опасности, и его можно применять для всех типов асфальтобетонных смесей при
строительстве автомобильных дорог, в качестве добавок при производстве
пигментов а также использовать в качестве сырьевых добавок в производстве
бетонных изделий. К рассчитанным количествам природных известняка и глины,
необходимым для производства цемента, добавляют 5-35 мас.% осадка сточных вод
взамен рассчитанного количества глины с эквивалентным суммарным содержанием
алюминия, железа и хрома.
.5 Расчёт установки ультрафильтрации
Расход сточных вод поступающих на
очистку составляет:
Qуф. = 100
м3/ч - 0,004 м3/ч = 99,9 м3/ч,
где 100 м3/ч - расход сточных вод,
поступающих в отстойник, 0,004 м3/ч - количество суспензии после отстаивания.
В соответствии с производительностями
ультрафильтрационных установок, размещёнными на сайте производителя «Центр
Водных Технологий (ЦВТ)», представляющего на российском рынке оборудование
водоподготовки крупнейших зарубежных производителей и собственной сборки,
выбираем соответствующий типовой блок ультрафильтрации со следующими
техническими характеристиками:
модель: UF 20/4
площадь фильтрующей поверхности м2:
1100;
производительность, м3/час: 50 -
100;
габаритные размеры, мм:
4000х1600х2950;
Эффективность работы установки ультрафильтрации
и представлена в таблице
17.
Таблица 17 - Эффективность работы
установки ультрафильтрации
|
Эффективность работы установки
ультрафильтрации, %
|
|
Тяжёлые металлы
|
95 - 99
|
|
Хлориды
|
0
|
|
Сульфаты
|
0
|
|
|
|
Нитраты
|
0
|
|
|
|
Механические примеси
|
94 - 99
|
Рассчитаем эффективность очистки сточных вод по
среднему значению эффективности работы установки. Результаты
представлены в таблице 18.
Таблица 18 - Эффективность очистки
сточных вод ультрафильтрацией
|
Состав сточной воды
|
Концентрация
загрязняющих веществ, мг/л
|
|
После тонкослойного отстойника
|
После ультрафильтрационной очистки
|
Степень очистки, %
|
|
Cr(VI)
|
0
|
0
|
-
|
|
Cu2+
|
0,029
|
0,00087
|
97
|
|
Ni2+
|
0,46
|
0,0138
|
97
|
|
Zn2+
|
0,00011
|
0,0000033
|
97
|
|
Fe
|
0,00018
|
0.0000054
|
97
|
|
|
|
|
|
Cl-
|
101
|
101
|
0
|
|
SO42-
|
162
|
162
|
0
|
|
|
|
|
|
|
|
|
В процессе эксплуатации периодически один раз в
30 - 60 минут проводится обратная промывка мембран пермеатом.
Расход пермеата на промывку мембраны:
Qпромыв = Qэлюаты
= 100* 10 % / 100 % = 10 м3/ч.
Поскольку данная установка не предусмотрена для
задержания солей промывка кислотой и щёлочью не требуется, поэтому один-два
раза в сутки дополнительно будем проводить только санобработку раствором
гипохлорита натрия. Для этого в воду для обратной промывки добавляют гипохлорит
натрия.
Таким образом, на нанофильтрацию поступит:
QНФ = 100 - 10 = 90
м3/ч.
.6 Расчёт установки нанофильтрации
Селективность нанофильтрационных мембран
представлена в таблице 19.
Таблица 19 - Селективность
мембранных элементов нанофильтрации [22]
|
Ион / Показатель
|
Селективность, %
|
|
Ca2+
|
86
|
|
Na+
|
50
|
|
SO42-
|
97
|
|
Cl-
|
60
|
Расход сточных вод поступающих на очистку
составляет 90 м3/ч.
В соответствии с данными представленными на
сайте производителя [22] выбираем соответствующий типовой блок ультрафильтрации
со следующими техническими характеристиками:
модель: Альтсофт РОсист-90-НФ,НН,ВС/П;
производительность, м3/час: 90;
степень очистки воды, %: 84 - 99,7;
энергопотребление, кВт: 55,0 - 111,0
габаритные размеры, мм: 7,3 х 2,2 х 2.8.
Рассчитанная эффективность очистки сточных вод
представлена в таблице 20.
Таблица 20 - Эффективность очистки сточных вод
нанофильтрацией
|
Состав сточной воды
|
Концентрация
загрязняющих веществ, мг/л
|
|
После НФ
|
Степень очистки, %
|
|
Cr(VI)
|
0
|
-
|
|
Cu2+
|
0,0000261
|
97
|
|
Ni2+
|
0,000414
|
97
|
|
Zn2+
|
0,9*10-8
|
97
|
|
Fe
|
1,6*10-8
|
97
|
|
Cl-
|
40.4
|
60
|
|
SO42-
|
0,68
|
97
|
Кроме этого нанофильтрационная мембрана способна
удалять ионы Ca2+, которые
поступают в очищаемую воду при доведении pH
до определённого значения.
В процессе эксплуатации периодически один раз в
30 - 60 минут проводится обратная промывка мембран пермеатом [22].
Расход пермеата на промывку мембраны:
Qпромыв = Qэлюаты
= 90* 30 % / 100 % = 27 м3/сут.
Дополнительно один-два раза в сутки проводят
обработку раствором кислоты.
Очищенный сток в размере 70 % от поступившего,
т.е. 63 м3/ч возвращаются в производство. При этом, по физико - химическим
показателям данная вода соответствуют воде 1 - й категории используемой в
гальваническом производстве (таблица 21).
Таблица 21 - Сравнение показателей очищенной
воды с нормами для воды используемой в гальваническом производстве [4].
|
Наименование показателя
|
Норма
для воды 1-й категории, мг/л
|
Норма
для воды 2-й категории, мг/л
|
Концентрация
после НФ, мг/л
|
|
Cr(VI)
|
-
|
-
|
0
|
|
Cu2+
|
1,0
|
0,3
|
0,3*10-5
|
|
Ni2+
|
5,0
|
1,0
|
0,000414
|
|
Zn2+
|
5,0
|
1,5
|
0,9*10-8
|
|
Cl-
|
350
|
35
|
40.4
|
|
SO42-
|
500
|
50
|
0,68
|
|
pH
|
6,0 - 9,0
|
6,5 - 8,5
|
9,0
|
|
|
|
|
|
Заключение
В данном проекте проведена
реконструкция существующей схемы очистки сточных вод гальванического
производства.
Обоснована схема обезвреживания и
очистки сточных вод гальванического производства с финишной обработкой на
установке нанофильтрации, обеспечивающей возможность применения оборотного
водоснабжения.
Выполнен укрупнённый расчёт
аппаратов очистки сточных вод и расчет балансовой схемы очистки сточных вод.
Библиграфический список
Феофанов,
В.А. Электрохимическое восстановление хромат-ионов / Г.Г. Вдовкин, Л.П.
Жданович, Б.С. Луханин // Способы очистки сточных и кондиционирования оборотных
вод и использование гидротехнических сооружений. Сб.
науч. трудов. Алма-Ата. - 1985. -№28. - С. 96-103.
Алексеев,
В.И. Проектирование сооружений переработки и утилизации осадков сточных вод с
использованием элементов компьютерных информационных технологий: учебное
пособие / В.И. Алексеев, Т.Е. Винокуров,
Е.А.
Пугачёв.
- М.: Изд-во АСВ, 2003. - 176 с.
Иванов,
В.В. Повторное использование воды при производстве аккумуляторных батарей /
А.К. Самсонов, О.П. Чернова // Экология и промышленность России. - 2000. - С.
6-8.
Будиловский,
Ю. Основные методы очистки промышленных стоков / Ю. Будиловский, Л. Будкина, А.
Медведев, С. Шкундина // Информационный бюллетень № 2 «Печатные платы и
покрытия». -2011. - С. 37-41.