Клинико-биохимические показатели у больных с почечной патологией в условиях реанимационного отделения
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное
государственное бюджетное образовательное учреждение
высшего
профессионального образования
«КУБАНСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
(ФГБОУ ВПО
«КубГУ»)
Кафедра
биохимии и физиологии
ВЫПУСКНАЯ
КВАЛИФИКАЦИОННАЯ (ДИПЛОМНАЯ) РАБОТА
КЛИНИКО-БИОХИМИЧЕСКИЕ
ПОКАЗАТЕЛИ У БОЛЬНЫХ С ПОЧЕЧНОЙ ПАТОЛОГИЕЙ В УСЛОВИЯХ РЕАНИМАЦИОННОГО ОТДЕЛЕНИЯ
Работу выполнила И.А. Рашевская
Факультет биологический
Специальность 050102.65 Биология
Краснодар
2014
Реферат
Хроническая почечная недостаточность, мочевина,
аланинаминотрансфераза, аспартатаминотрансфераза, острая почечная
недостаточность, общий билирубин, общий белок, глюкоза, креатинин
Цель работы: определение особенностей динамики
биохимических показателей у больных с почечной патологией в условиях лечения в
реанимационном отделении.
В работе были использованы колориметрические,
турбодиметрические методы и метод ионоселективных электродов.
Исследования проводились в период с августа 2013
по декабрь 2013 года, на базе МБУЗ Северская ЦРБ.
В ходе данной работы проводились исследования
больных с различной почечной патологией: острой и хронической почечной
недостаточностью. Результаты этих исследований приводят к следующему выводу:
правильно выбранный спектр биохимических исследований позволяет своевременно
оценить почечную патологию: острая или хроническая - обеспечивать контроль за
проводимым адекватным лечением больного в условиях реанимационного отделения
больницы.
Содержание
Введение
. Аналитический обзор
.1.............................................................. Характеристика
почечных синдромов
.1.1 Краткая характеристика острой
почечной недостаточности
.1.2 Краткая характеристика
хронической почечной недостаточности
.2............... Биохимические и
клинические показатели при заболеваниях почек
. Материал и методы исследований
.1 Материал исследования
.2 Контингент обследованных больных
.3 Методы определения биохимических
показателей при различной почечной патологии
.3.1 Определение общего белка
.3.2 Определение мочевины
.3.3 Определение креатинина
.3.4 Определение аминотрансфераз
.3.5 Определение общего билирубина
.3.6 Определение электролитов
.3.7 Определение глюкозы
.3.8 Статистическая обработка
результатов
. Клинико-биохимические показатели у
больных с почечной патологией в условиях реанимационного отделения
.1 Динамика концентрации мочевины у
больных острой и хронической почечной недостаточностью
.2 Динамика концентрации креатинина
у больных острой и хронической почечной недостаточностью
.3 Динамика концентрации общего
белка у больных острой и хронической почечной недостаточностью
.4 Динамика активности трансаминаз у
больных острой и хронической почечной недостаточностью
.5 Динамика концентрации общего
билирубина у больных острой и хронической почечной недостаточностью
.6 Динамика концентрации
электролитов у больных острой и хронической почечной недостаточностью
.7 Динамика концентрации глюкозы у
больных острой и хронической почечной недостаточностью
Заключение
Библиографический список
Определения, обозначения и сокращения
АЛТ - аланинаминотрансфераза
АСТ - аспартатаминотрансфераза
ОПН - острая почечная недостаточность
СКФ - скорость клубочковой фильтрации
ХПН - хроническая почечная недостаточность
почечный недостаточность белок
билирубин
Введение
Проблема диагностики и лечения острой и
хронической почечной недостаточности продолжает оставаться весьма актуальной
для современной медицины. В настоящее время по статистическим данным количество
взрослого населения с диагнозом ХПН и ОПН увеличилось на 32 процента среди
госпитализаций больных с патологией почек, по сравнению с 80-ми годами прошлого
века [Сумин, Руденко, Бородинов, 2010].
Самым распространенным заболеванием почек и
мочевыводящих путей является пиелонефрит. Данное заболевание занимает второе
место, после инфекции верхних дыхательных путей, которое является наиболее
частым по обращению пациентов. По обобщенным статистическим данным он
встречается чаще, чем гломерулонефрит и другие заболевания почек. Среди
госпитализаций больных с патологией почек на его долю приходится до 58
процентов. Хронический гломерулонефрит является одной из причин развития
хронической почечной патологии.
Ранняя диагностика лабораторных исследований,
подтверждающая диагноз острая или хроническая почечная недостаточность,
позволяет наиболее точно и своевременно назначить курс лечения и реабилитации
больных с данным заболеванием. Поэтому вовремя поставленный диагноз и
своевременно назначенный врачом курс лечения увеличивает шанс на положительную
динамику лечения и выздоровление пациента.
Цель работы: определение особенностей динамики
биохимических показателей у больных с почечной патологией в условиях лечения в
реанимационном отделении.
Для достижения поставленной цели решались
следующие задачи:
1. Выявить клинико-биохимические показатели,
имеющие информативную ценность в диагностике и лечении различных форм
заболевания почечной патологии;
2. Изучить динамику биохимических тестов
при острой почечной недостаточности;
. Изучить динамику биохимических тестов
при хронической почечной недостаточности;
. Выделить закономерности в изменении
концентрации биохимических показателей больных с острой и хронической почечной
недостаточностью
В данной работе были проведены биохимические
исследования пациентов реанимационного отделения с почечной патологией, их
лабораторные показатели на момент поступления в стационар и в динамике лечения
пациентов.
Практическая значимость полученных результатов
исследований состоит в том, что правильно выбранный спектр биохимических
исследований позволяет своевременно оценить почечную патологию: острая или хроническая
- обеспечить контроль за проводимым адекватным лечением больного в условиях
реанимационного отделения больницы.
1. Аналитический обзор
Заболевание почек - это нередко длительное
страдание, вызывающе нарушения трудоспособности и, в ряде случаев, имеющие
неблагоприятный прогноз. Патология почек - важнейший раздел дисциплины
«внутренние болезни», изучающий закономерности возникновения, течения,
проявлений и исхода наиболее часто встречающихся структурных и функциональных
нарушений почек, а также принципы их профилактики, диагностики, лечения и
прогноза. Различные виды патологии почек у конкретных больных, изучающая
нефропатология (нефрология) - важная составная часть внутренних болезней
человека. Патология почек проявляется разнообразными видами нефропатий
(nephropathia, от греч. nephros - почка, pathos - страдание, болезнь). Термин
«нефропатия» используют для обозначения различных поражений почек, в том числе
воспалительного, дистрофического и опухолевого характера [Аляев, 2010].
Необходимо отметить, что при нефрологических
заболеваниях лабораторная диагностика имеет большое значение, при уточнении
диагноза. Существующие лабораторные методы позволяют контролировать течение
заболевания и корректировать проводимую терапию [Сиротко, 2008].
1.1 Характеристика почечных синдромов
.1.1 Краткая характеристика острой почечной
недостаточности
Острая почечная недостаточность - острое,
потенциально обратимое выпадение выделительной функции почек, проявляющееся
быстронарастающей азотемией и тяжелыми водно-электролитными нарушениями
[Пермяков, Зимина, 1983].
Острая почечная недостаточность - угрожающее
жизни состояние, возникающее вследствие поражения почек, в результате чего их
функции не отвечают метаболистическим потребностям организма. Нарушение
секреторной или экскреторной функций почек в первую очередь проявляется
основным клиническим признаком острой почечной недостаточности - олигурией.
Острая почечная недостаточность ведёт к тяжелым нарушениям гомеостаза, задержке
в крови продуктов азотистого распада, изменияем водно-электролитного баланса и
кислотно-щелочного состояния [Дударь, 2008].
В хирургической практике острая почечная
недостаточность встречается как осложнение заболеваний и хирургических
вмешательств. Анализ 2400 наблюдений почечной недостаточности, собранных в
различных учреждениях мира, показал, что 43 процента недостаточности
наблюдается после хирургических операций, в девяти процентах имеет отношение к
травме, в 26 процентах осложняет терапевтические заболевания, в 14 процентах
возникает при беременности и после септических абортов и в восьми процентах
развивается при отравлении нефротоксическими ядами [Аляев, 2010].
При микроскопическом исследовании почки больных
с острой почечной недостаточностью несколько увеличены, капсула их напряжена и
легко снимается. Поверхность почек светло-серого цвета, масса увеличена до
300-400 грамм. Кора почек может оказаться более широкой, чем в норме,
бледно-желтой окраски. Пирамиды, как правило, резко полнокровны, багрового
цвета. На границе коркового и мозгового слоя нередко видна полоса полнокровия,
соответствующая экстамедулярной зоне. В чашечно-лоханочной системе могут быть
воспалительные изменения (в случае развитая острого пиелонефрита), а также
нередко наблюдается кровоизлияние в слизистую оболочку лоханки.
При оклюзионной этиологии острой почечной
недостаточности чашечно-лоханочная система может быть сильно изменена
(пиелоэкстазия, гидроколикоз с кровоизлиянием в слизистую оболочку) [Пирогов,
2005].
Гистологические изменения в паренхиме почки
обычно представлены зонами различных участков нефрона попеременно с неизменными
зонами. Наиболее характерным видом поражения является расширение и уплощение
эпителия дистальных отделов канальцев. Некротические изменения встречаются
повсюду, наряду с этим постоянно имеет место гидролитические превращения
эпителия, особенно проксимальных отделов канальцев.
Следует еще раз подчеркнуть, по Е.М. Тарееву
[1983], что для острой почечной недостаточности характерно отсутствие
параллелизма между степенью морфологических изменений канальцевого аппарата и
глубиной нарушений функций почек. При полной блокаде функции почек может иметь
место скудная картина патоморфологических изменений.
В настоящее время различают несколько
этиологических групп острой почечной недостаточности:
.Механические нарушения свободной проходимости
мочевыводящих путей (камни почечных лоханок и мочеточников, воспалительные
процессы мочеточников и мочевого пузыря);
.Острые нарушения почечного кровотока:
длительная гипотония (шок), спазм сосудов почек вследствие недостаточного
подавления болевой чувствительности во время операции, тромбоз;
.Токсико-аллергические поражения:
гемотрансфузионный шок, сепсис, резус-конфликт;
.Острый токсический невроз: отравление ртутью,
эссенцией;
.Нарушения водно-электролитного обмена и
кислотно-щелочного состояния, в первую очередь метаболистический ацидоз;
.Сочетания различных причин [Тареев,1983].
Однако, несмотря на разнообразие этиологических
факторов острой почечной недостаточности, её можно подвергнуть следующей
классификации:
.Преренальная - острая циркуляторная нефропатия;
.Ренальная - острая токсическая нефропатия,
острая инфекционная нефропатия и острая сосудистая нефропатия;
.Постренальная - обтурация мочевых путей;
.Аренальная [Лопаткин, Кучинский, 1972].
Но часто различают три формы ОПН - преренальную
(гемодинамическую), обусловленную острым нарушением почечного кровообращения,
ренальную (паренхиматозную), вызванную поражением почечной паренхимы, и
постренальную (обструктивную), развивающуюся в результате острого нарушения оттока
мочи. Такое разделение ОПН имеет важное практическое значение, так как
позволяет наметить конкретные мероприятия по предупреждению и борьбе с ОПН.
Начальная стадия обычно совпадает с периодом
этиологического воздействия (шок, сепсис и др.). Состояние шока может длиться
до нескольких часов. Однако, уже в первые сутки болезни диурез и олигурия
переходят в анурию. Параллельно растёт задержка жидкости и гиперазотемия,
которая во вторые сутки составляет 1,5 - 2 г/л, как считает Г.А. Рябов [1976].
Олигоанурическая стадия - основная стадия
болезни. Именно в этот период в организме происходят наиболее тяжкие изменения
гомеостаза и наиболее высока частота летальных исходов. Моча или совсем не
поступает в мочевой пузырь или количество ее не превышает 200- 300 мл в сутки.
В осадке мочи - большое количество эритроцитов, цилиндров вследствие тяжелых
изменений в паренхиме почки. Быстро растёт гиперазотемия, составляя к
пятому-шестому дню до 30ммоль/л мочевины, до1000 мколь/л креатинина в сыворотке
крови. Миграция калия из клеток в сосудистое русло обуславливает гиперкалиемию
до 6-8ммоль/л, которая приводит к снижению чувствительности, угнетению
сухожильных рефлексов. Снижение уровня натрия (даже 170 ммоль/л) приводит к
набуханию нервных клеток, что проявляется вялостью, сонливостью.
Кислотно-щелочное состояние нарушается в сторону ацидоза, снижается рН
сыворотки крови, чему способствует задержка в ней фосфатов, сульфатов и
органических кислот.
Диуретическая стадия обычно протекает в два
этапа: ранняя диуретическая фаза и фаза полиурии. Моча с пониженным содержанием
креатинина и мочевины, но обычным количеством натрия и калия. Исчезает
гиперазотемия и восстанавливается электролитное равновесие. Стадия
выздоровления затягивается на долгие месяцы и годы.
Четвертая фаза острой почечной недостаточности
длится от двух до десяти лет. В этот период имеется опасность появления
хронической почечной недостаточности, поэтому такие больные требуют
диспансерного наблюдения.
ОПН - острое нарушение основных почечных функций
(фильтрационной, экскреторной, секреторной), возникающее в результате
патологического воздействия на ее паренхиму внешних и внутренних факторов. К
факторам, вызывающим ОПН относятся различные по происхождению шоковые состояния
- травмы (кардиогенный, геморрагический, ожоговый шок); синдром размножения
ткани; отморожения; электротравмы; тяжелые инфекционные заболевания; отравления
ядовитыми веществами; интоксикации; закупорка мочевыводящих путей. Начальные
проявления заболевания - клиника шока, вызванного указанными факторами,
уменьшение диуреза. Последующая стадия - олигоанурическая (количество мочи
уменьшается до 400 мл и ниже), появляются изменения со стороны
сердечнососудистой (миокардит, сердечная недостаточность) и центральной нервной
системы (слабость, судороги, головная боль). На стадии выздоровления - полное
восстановление функции почек (через шесть -12 месяцев) [Бурчигский, Вищ, 2000].
Среди пусковых механизмов преренальной ОПН -
снижение сердечного выброса, острая сосудистая недостаточность, гиповолемия и
резкое снижение объема циркулирующей крови. Нарушение общей гемодинамики и
циркуляции и резкое обеднение почечного кровообращения индуцируют почечную
афферентную вазоконстрикцию с перераспределением (шунтированием) почечного
кровотока, ишемией коркового слоя почки и СКФ. При усугублении почечной ишемии
преренальная ОПН может перейти в ренальную за счет ишемического некроза
эпителия почечных извитых канальцев [Радужный, 2007].
.1.2 Краткая характеристика хронической почечной
недостаточности
ХПН - это симптоматический комплекс, который
развивается вследствие снижения числа и изменения функции нефронов, что
приводит к нарушению экскреторной и инкреторной деятельности почек
[Джанад-Заде, Мальков, 1978].
ХПН - прогрессирующее заболевание, обусловленное
ухудшением функции клубочков и канальцев вплоть до состояния, при котором почки
перестают поддерживать гомеостазы (деятельность всех органов и систем
организма). Хронические гломерулонефрит и пиелонефрит в 80 процентов являются
причиной развития хронической почечной недостаточности. Кроме того к числу
заболеваний, которые могут привести к хронической почечной недостаточности,
относятся: поликистоз, туберкулез, амилоидоз почек, стеноз почечных артерий,
злокачественная гипертония, мочекаменная болезнь, системная красная волчанка,
сахарный диабет и другие состояния. Признаки этого заболевания начинают
развиваться, когда количество функционирующей ткани почек уменьшается до 75
процентов. Клиническая картина ХПН у больных в определенной мере определяется
основным заболеванием. Отмечаются следующие клинические проявления: изменение
цвета кожных покровов, астенизация (слабость, сонливость); поражение органов
дыхания (пневмония, накопление жидкости в плевральной полости);
желудочно-кишечного (тошнота, рвота, энтероколит); нервной системы (головная
боль, снижение памяти, психозы); кроветворения (анемии). При прогрессировании
ХПН нарастают симптомы уремии, которые связаны с накоплением в крови азотистых
шлаков, изменения водно-электролитного обмена [Рябов, 1976].
Больные с диагнозом хронический пиелонефрит,
составляют до двух процентов всех терапевтических больных стационаров. При
статистических исследованиях хронический гломерулонефрит регистрируется в
0,22-0,25 процентов случаев. В практике участкового врача хронический
гломерулонефрит встречается чаще (в два-четыре раза), чем острый [Пирогов,
2005].
Установленное многообразие функций почек и их
изменение в поздних стадиях заболеваний определяет неправомерность старых
терминов - «азотемия» (повышение уровня остаточного азота в крови) и «уремия»
(мочекровие) и вполне оправдывают введение термина - «хроническая почечная
недостаточность. Под хронической почечной недостаточностью понимают нарушение
азотовыделительной, гомеостатической и эндокринной функций почки [Пелещук,
1974].
Хроническая почечная недостаточность является
конечной стадией развития различных заболеваний почек. В почках при хронической
недостаточности происходят необратимые процессы. На 1 млн. населения в развитых
странах приходится 200-250 больных с хронической почечной недостаточностью, из
них 70-80 человек ежегодно умирает. Такие тяжелые поражения почек у женщин
развиваются чаще в возрасте до 40 лет, у мужчин - после 40 лет [Аляев, 2010].
Хроническая почечная недостаточность является одной из основных причин
инвалидности и смерти людей, преимущественно молодого возраста. Так, в Европе
на миллион населения 300 человек умирает от хронической почечной
недостаточности [Дударь, 2008].
К развитию хронической почечной недостаточности
от её начальной и до терминальной стадии могут привести различные заболевания
почек и мочевых путей:
. Первичные поражения клубочков
(гломерулонефрит, гломеруло-склероз);
. Первичные поражения канальцев (хроническая
идиопатическая гиперкальциемия, хроническое отравление тяжелыми металлами -
кадмием, свинцом и др.);
. Сосудистые заболевания (двусторонний стеноз
почечных артерий);
. Инфекционные заболевания почек (хронический
пиелонефрит, туберкулёз);
. Обструктивные заболевания верхних мочевых
путей (камни, опухоли) и нижних мочевых путей, врожденные аномалии шейки
мочевого пузыря и мочеиспускательного канала и др.);
. Коллагеновые заболевания (склеродермия,
волчанка);
. Обменные заболевания почек (амилоидоз,
каркоидоз);
. Врожденные двусторонние аномалии почек и
мочеточников (губчатая пачка, нервно-мышечная дисплазия мочеточников);
. Радиационный интерстициальный нефрит
[Маждраков, Попова, 1997].
Самой частой причиной развития хронической
почечной недостаточности является хронический гломерулонефрит и пиелонефрит,
как считает Р.Б. Минкин [1990], на эти два заболевания приходится примерно 80
процентов, остальные 20 процентов - на такие заболевания как амилоидоз, а также
заболевания, при которых почки вовлекаются в патологический процесс вторично,
например при системной красной волчанке, сахарном диабете. Таким образом, ХПН
оказывается конечной стадией поражения почек, обусловленных равными причинами.
Однако, несмотря на различный характер заболеваний, вызывающих хроническую
почечную недостаточность, конечные результаты оказываются сходными как по
морфологическим, так и по клиническим картинам, кроме того, они идентичны и по
механизму нарушений функций почек.
В почках при ХПН происходит разрастание
соединительной ткани, почки уменьшаются в размерах, одерживаются, клубочки
заменяются соединительно-тканными рубцами, канальцы атрофируются - происходит
понефронное запустевание с прогрессирующим уменьшением количества
функционирующих нефронов [Минкин, 1990]. Капсула клубочка утолщена, а
большинство клубочков гиелинизированы. В поздних стадиях развития пиелонефрит
микроскопическая картина напоминает щитовидную железу. В этой стадии
хроническая почечная недостаточность не может быть обратимой. Корковый слой
истончается, обильно инфильтрирован лимфоцитами. Мозговой слой - воспалительный
процесс с опустошением пирамид. Наступает медленное уничтожение коры почки с
полным исчезновением клубочков [Минкин, 1990].
В настоящее время приняты различные
классификации хронической почечной недостаточности, наиболее распространёнными
являются: классификация, предложенная, Американской кардиологической
ассоциацией и близкая ей классификация С.И. Рябова и Б.Б. Бондаренко. В таких
классификациях, помимо клинической картины, учитывается значение содержания
креатинина в сыворотке крови [Минкин, 1990]. Следует помнить, что на количество
мочевины в крови оказывает влияние питания, величина диуреза, мышечная
активность и другие причины. Уровень остаточного азота в крови в большей
степени зависит от внепочечных факторов и поэтому его считают менее надежным
показателем, чем концентрация мочевины в крови. Азот мочевины в норме
составляет 40-50 процентов всего остаточного азота. Из других компонентов
остаточного азота наибольшее значение имеет содержание в крови креатинина,
которое в отличие от концентрации мочевины мало зависит от характера питания,
величины диуреза и выраженности белкового катаболизма. Это делает определение
содержания креатинина ценным показателем состояния функции почек, а также
определение величины клубочковой фильтрации, что делает их удобным для
использования [Пелещук, 1974].
Первая стадия называется латентной, в ней
отсутствуют клинические признаки хронической почечной недостаточности, а
функциональная неполноценность почек в первой А стадии проявляется только при
исполнении нагрузочных проб.
Вторая стадия называется азотемической.
Клинические признаки нарастают ко второй Б стадии и к концу этой стадии больным
показана активная терапия гемодиализом, гемосорбцией почек. Если первая стадия
может носить обратимый характер, то вторая и более стадии являются
необратимыми.
Третья стадия называется уремической,
длительность жизни без активной терапии не превышает полутора лет и даже
нескольких месяцев.
У больных с патологией почек, сопровождающейся
воспалительной реакцией, мигрировавшие в ткани нейтрофилы и моноциты, а также
мезангиальные клетки при действии мембраноатакующих иммунных комплексов и
фактора, активирующего тромбоциты, выделяют активные формы кислорода. В этих
условиях кислород, необходимый организму для функционирования дыхательной цепи
становится одновременно токсичным веществом. Нефрология в ее современном виде,
сформированная совместными усилиями физиологов и нефрологов, урологов и
биохимиков, рентгенологов и микробиологов, стала одним из фундаментальных
разделов внутренней медицины. Высокая медико-социальная значимость
нефрологической патологии обусловлена распространенностью заболеваний почек,
превышающей 10 процентов взрослого населения индустриально развитых стран.
Примечателен тот факт, что свыше 60 процентов нефрологических больных
составляют лица моложе 40 лет, причем течение заболеваний у них отличается
затяжным течением и резистентностью к терапии. Первичная инвалидность как
результат почечной патологии высока и достигает пяти процентов суммарной
первичной инвалидности.
За последние 20-30 лет значительно изменилась
структура заболеваний почек. Так, количество больных с острыми диффузными
гломерулонефритами существенно снизилось, тогда как распространенность
пиелонефритов и нефропатий при системных заболеваниях неуклонно растет. Более
того, свыше 15 процентов почечной патологии сегодня обусловлено поражениями
лекарственного генеза. В настоящее время исследуется влияние антибиотиков,
сульфаниламидов, кортикостероидов и нестероидных противовоспалительных
препаратов, пероральных контрацептивов, влияющих на заболевания почек.
Возрастает распространенность заболеваний, в
патогенезе которых существенное значение имеет аутоиммунное (аутоагрессивное)
поражение почек. Особая роль при этом принадлежит аутоагрессивным реакциям,
направленным против базальной мембраны и мезангиальных клеток и характерным для
острого гломерунонефрита, некоторых форм злокачественного прогрессирующего
гломерулонефрита и нефропатий, развивающихся на фоне коллагенозов. Безусловным
достижением современной нефрологии является детальное описание так называемых
сателлитных нефропатий - поражений почек на фоне другой основной патологии
(коллагенозов, сахарного диабета и др.). Количество таких нозологических форм
постоянно растет, и весьма часто (более чем в 80процентов случаев) они
определяют прогноз заболевания для жизни и трудоспособности [Сиротко, 2008].
Выявление синдрома, с которым пациент поступил в
стационар, является главной задачей врача, оно основывается на комплексном
обследовании, однако ведущее место уделяется лабораторным методам диагностики.
Эти методы дают очень обширную информацию о функциональном состоянии почек в
каждом конкретном случае. В лаборатории проводится обследование биоматериала
(сыворотка, плазма, капиллярная либо венозная кровь, моча) биохимическими и
клиническими методами, при помощи автоматических и полуавтоматических
анализаторов. В связи с этой проблемой, мы поставили перед собой цель:
точнейшее обследование больных с почечной патологией, при постановке диагноза и
для назначения своевременного и точно скорректированного лечения [Мухин,
Гареева, 1995].
Обследуя больных реанимационного отделения, с
этой почечной патологией, лечащий врач назначает следующий спектр
клинико-лабораторных исследований: общий анализ крови, общий анализ мочи,
глюкозу крови, общий билирубин, АЛТ, АСТ, мочевину, креатинин, электролиты в
сыворотке крови.
Таким образом, в лечении и диагностике почечных
патологий важную роль играет правильно и своевременно поставленный диагноз.
Особую роль в этом процессе отводится клинико-биохимическим показателям крови.
1.2 Биохимические и клинические показатели при
заболеваниях почек
Биохимические и клинические показатели позволяют
врачам-практикам правильно поставить диагноз и определить этапы развития
заболеваний.
При ОПН изменяются следующие показатели:
Общий анализ крови - признаки гипохромной
анемии, высокий нейтрофильный лейкоцитоз, понижение числа тромбоцитов
[Меньшиков, 2008]. Анализ мочи - уменьшение суточного объема вплоть до анурии
(в период восстановления диурез нормализуется); плотность снижена, цвет - темный,
моча содержит много эритроцитов, белка и цилиндров, а также клетки почечного
эпителия [Хондкариан, Шульцев, 1980].
Биохимические исследования занимают особое место
- в сыворотке повышается содержания калия, магния, фосфора; снижается натрия,
кальция, хлоридов; возрастает уровень мочевины и креатинина, среднемолекулярных
пептидов, развивается картина метаболического ацидоза [Нестеров, Шиленок,
Козлова, 2002].
В первую очередь исследуется важнейшая группа
лабораторных признаков - содержание азотистых веществ в биохимических
показателях плазмы крови. Известно, что выведение азотистых веществ - едва ли
не основная функция почек. При патологии органа эта функция рано или поздно
нарушается, развивается азотемия и уремия. Основными азотистыми веществами, на которые
ориентируются клиницисты при определении степени декомпенсации, являются
креатинин и мочевина крови. Превышение верхней границы нормы говорит о развитии
почечной недостаточности, а выраженная декомпенсация выделительной функции
является показанием для гемодиализа или пересадки почки. Для выявления почечной
недостаточности и определения стадии процесса огромное значение имеет
показатель СКФ. Этот информативный тест позволяет выявить снижение функции
паренхимы почек задолго до повышения в крови концентрации азотистых веществ
(при патологии почек СКФ снижается). Дальнейшая диагностика заболеваний почек
строится на основе данных лабораторных и инструментальных методов и направлена
на уточнение диагноза и определение состояния функции органа. К обязательным
диагностическим процедурам относится ультразвуковое обследование, общий анализ
крови и протеинограмма (определение фракций белка крови). Описанные выше
анализы при патологии почек являются определяющими для диагностики заболевания,
оценки стадии и степени активности патологического процесса [Лифшиц,
Сидельникова, 2000].
При ХПН отмечаются следующие изменения в
показателях лабораторной диагностики: общий анализ крови - гипопластическая
анемия (характерный симптом ХПН), существенное снижение количество гемоглобина,
эритроцитов, эритропоэтина; появляется лейкоцитоз, нейтрофильный сдвиг влево,
возможно снижение числа тромбоцитов, в тяжелых случаях - повышение СОЭ
[Меньшиков, 2008]. Анализ мочи - ранние признаки: полиурия и никтурия, в
последующем - олигоурия; в моче белок, эритроциты, цилиндры; снижается
клубочковая фильтрация и осмолярность мочи. Так, при величине клубочковой
фильтрации по креатинину 85-30 мл/мин возникает подозрение на наличие почечной
недостаточности; 60-15 мл/мин наблюдается при компенсированной и
субкомпенсированной стадии почечной недостаточности; величина клубочковой
фильтрации ниже 15-10 мл/мин отмечается в декомпенсированную стадию (при этом
развивается выраженный метаболический ацидоз) [Хондкариан, Шульцев, 1980].
И, конечно, биохимические исследования, которые
позволяют определить степень выраженности изменений и связать со стадией
патологического процесса. Так, в латентной стадии уровень креатинина равен
176-352 мкмоль/л, то в тяжелой стадии он достигает от 702 до 1055 мкмоль/л и выше,
то же самое можно отметить и в отношении мочевины (в начальной - до 9,0
ммоль/л, в тяжелой - 10,1-19,0 ммоль/л). Прогрессирование ХПН сопровождается
нарастанием азотемии, снижением уровня кальция, натрия, повышением концентрации
калия, магния, фосфора. Величины рН, ВЕ и рСО2 в крови снижены
(ацидоз) [Бышевский, Терсенов, 2000]. Определение скорости клубочковой
фильтрации. При значениях ниже 50 мл/мин (содержание креатинина и мочевины при
этом повышено) показано консервативное лечение, при величине клубочковой
фильтрации ниже 10мл/мин (терминальная стадия) необходим диализ.
Клинико-биохимическая лаборатория отделения
анестезиологии и реанимации, при поступлении больного с почечной патологией,
производит полное обследование пациентов. В реанимации особое внимание
уделяется больным с ОПН, они остро нуждаются в полном спектре лабораторных
исследований и назначении точного курса лечения лекарственными препаратами. ОПН
может быть по месту возникновению: преренальная, ренальная, постренальная; либо
по этиопатогенезу: шоковая почка, токсическая почка, обструкция: сосудистая,
урологическая, аренальное состояние. Диагноз ОПН ставится после проведения
следующих исследований лабораторной диагностики: уровень концентрации
креатинина в сыворотке крови более 200-500 мкмоль/л, уровень мочевины превышает
20 ммоль/л, в клинических исследованиях мочи показатели количественного
содержания белка более 1,65 г/л [Елисеева, 2006].
Однократное исследование крови у больного при
обнаружении в ней изменений всегда менее показательно, чем динамическое
наблюдение. При таком подходе можно регистрировать направленность изменений,
оценивать динамику заболевания и эффективность проводимого лечения. Поэтому
лабораторные исследования пациентов проводятся в динамике, с момента
поступления его в стационар до его выписки из отделения.
Биохимические анализы крови и других
биологических жидкостей составляют около 40 процентов всех лабораторных
анализов. Поскольку обмен веществ между органами и тканями опосредован
кровотоком, в плазме крови содержатся в разных концентрациях все вещества,
поступающие в организм и синтезирующиеся в нем. Благодаря изменению
биохимических показателей можно диагностировать заболевание ОПН у пациентов.
Диагностируя начальную стадию ХПН, необходимо
клинически обследовать пациента. На первый план выступают общая слабость,
повышенная утомляемость, снижение трудоспособности. При объективном
исследовании выявляются бледность кожных покровов, желтоватый оттенок кожи
(задержка урохрома), «синяки» [Литвицкий, 1998].
В терминальной стадии наблюдается частый кожный
зуд, связанный с выделением через кожу кристаллов мочевины, которая иногда
видна в виде своеобразного уремического «инея». Из-за раздражения кожи и
слизистых часто возникают гнойничковые заболевания. На коже нередко отмечают
следы расчесов. С задержкой «уремических токсинов» связаны парестезии,
кровотечения из десен, носовые, желудочно-кишечные, маточные кровотечения и
подкожные геморрагии. Также наблюдаются боли в костях (остеомаляция,
остеосклероз); вторичная подагра с типичными приступами артрита, подагрический
палец - поражение первого плюснево-фалангового сустава, характерна частая смена
настроения, могут быть подергивания мышц, иногда болезненные судороги
икроножных мышц. При продолжительности болезни у больного усиливается слабость,
сонливость, утомляемость, апатия, тяжелые полинейропатии с болевым и
дистрофическим синдромами, судорожные подергивания, энцефалопатия вплоть до
развития уремической комы, с большим шумным ацидотическим дыханием. Иногда
развивается тяжелая миопатия. На фоне злокачественной гипертензии (до 90
процентов) могут развиться церебральные инсульты. У больных с ХПН наблюдаются
ларингиты, трахеиты, бронхиты, пневмонии, уремические пневмония и плеврит,
нефрогенный отек легких. Им характерны одышка, приступы удушья [Лопаткин,
Кучинский, 1972].
Суточный диурез в начальной стадии нормальный
или несколько повышен, в интермиттирующей стадии - полиурия (два с половиной и
более л/сут со сниженным удельным весом), в терминальной стадии - олиго - и
анурия.
В биохимических исследованиях изменяются
следующие показатели: повышение мочевины, креатинина, калия (в терминальную
стадию), снижение уровня кальция; при полиурии - гипокалиемия, метаболический
ацидоз (более характерно для терминальной стадии); при олиго - или анурии -
гиперкалиемия.
Чтобы диагностировать, какое заболевание привело
к ХПН, нужно проанализировать предыдущие лабораторные данные, но в
интермиттирующей и тем более в терминальной стадии этого сделать практически
невозможно даже при биопсии [Мухин, Моисеев, 1995].
Лечение при ХПН одновременно является
патогенетическим и симптоматическим и включает мероприятия, направленные на:
нормализацию артериального давления, коррекцию анемии, коррекцию липидного и
углеводного обмена, коррекцию кислотно-щелочного равновесия, коррекцию
водно-электролитных расстройств, предупреждение накопления в организме
токсичных продуктов обмена (дезинтоксикационная терапия), противоазотемическая
терапия с диетой [Тареев, 1993].
Таким образом, диагностика и лечение почечной
недостаточности остается одной из актуальных проблем, в решении которой особое
место занимают клинико-биохимические исследования крови больных: общий белок,
общий билирубин, активность аминотрансфераз, мочевина, креатинин, глюкоза и
электролиты крови.
2. Материл и методы исследований
Исследования проводились на базе
клинико-биохимической лаборатории МБУЗ Северская ЦРБ Краснодарского края с
августа 2013 года по декабрь 2013 года.
.1 Материал исследования
Материалом исследований являлись капиллярная
кровь, сыворотка крови больных реанимационного отделения с диагнозом ОПН и ХПН.
Весь материал исследования поступал в лабораторию к 7 часам утра [Инструкция
забора крови в стационарах, 2010].
Забор анализов проводился: 1) при
диагностировании заболевания (во время поступления в стационар), 2) во время
проведения курса лечения , 3) при выписке больного из отделения. В контрольной
группе больных для сравнительного анализа с показателями пациентов
экспериментальных групп биохимические исследования проводились одиножды при
поступлении для лечения в стационар по поводу травмы.
.2 Контингент обследованных больных
Была обследована категория пациентов трех групп:
первая - больные с заболеванием ОПН - 20 человек, вторая - больные с
заболеванием ХПН - 20 больных, третья - контрольная группа больных без
патологии - 20 человек. Всего было обследовано 60 человек. В работе
подвергались исследованию сыворотки крови пациентов реанимационного отделения в
возрасте от 20 до 50 лет (таблица 1).
Обращает внимание, что больных с диагнозом ОПН в
возрасте от 20 до 35 лет - пять человек, что составляет одну четверть от всего
контингент, а вот у больных с диагнозом ХПН на этот же возрастной период
больных приходится только трое больных от всего контингента - 85 процентов.
Наши данные совпадают с мнением В.М. Ермоленко [1982], что ХПН страдают лица
преимущественно среднего и старшего возраста, на который приходится 77
процентов случаев. Вообще, наиболее часто нарушения СКФ отмечается в среднем и
старшем возрасте в нашем случае составило - 80 процентов.
Таблица 1 - Контингент обследованных больных
|
Группы
больных
|
Возраст
пациентов
|
Количество
обследованных больных
|
|
20-35
лет
|
35-50
лет
|
|
|
ОПН
|
5
|
15
|
20
|
|
ХПН
|
3
|
17
|
20
|
|
Контрольная
группа больных
|
10
|
10
|
20
|
|
Всего
|
25
|
34
|
60
|
В нашей работе исследовалась сыворотка 57-95
процентов мужчин и трех женщин - пять процентов. Наши данные по принадлежности
пола совпали с данными Г. Междраков и А. Попов [1980].
.3 Методы определения биохимических показателей
при различной почечной патологии
В связи со специфичностью биохимических
показателей в нашей работе мы использовали только биохимические тесты, так как
клинические представляют собой тесты, характеризующие воспалительные процессы
любой этиологии. Для проведения исследований использовался полуавтоматический анализатор
«RAL-Clima MS-15», который позволил провести высокоточные биохимические и
иммунотурбидиметрические исследования. Анализатор позволяет использовать
следующие методы измерений: абсорбция, конечная точка, кинетика, фиксированное
время, дифференциальный и мультистандартный [Инструкция к анализатору
«RAL-Clima MS-15»].
.3.1 Определение общего белка
Принцип данного метода состоит в том, что белки
реагируют в щелочной среде с сульфатом меди с образованием комплексных
соединений, окрашенных в фиолетовый цвет (биуретовый метод). Интенсивность
окраски образовавшегося комплекса прямо пропорциональна концентрации общего
белка в пробе и измеряется фотометрически при длине волны 540 (520-560) нм. При
калибровке использовали раствор сывороточного человеческого альбумина.
Термостат обеспечивает температуру в + 37°С.
Нормальные величины общего белка 65-85 г/л
[Инструкция к анализатору «RAL-Clima MS-15», 2010].
.3.2 Определение мочевины
Мочевина - конечный продукт метаболизма белков.
Образуется в печени, выводится почками. Используется набор реагентов для
определения содержания мочевины в биологических жидкостях уреазным фенол-
гипохлоритным методом.
Принцип метода: мочевина под действием уреазы
гидролизируется с образованием углекислого газа и аммиака, содержание которого
определяется колориметрически по образованию окрашенных продуктов с
гипохлоритом и фенолом. Интенсивность пропорциональна концентрации мочевины в
пробе.
Расчет концентрации (С) мочевины в исследуемой
пробе проводим по формулам: сыворотка (плазма ) крови (1, 2) :
С = (Е пробы / Е калибратора )×30
мг/100
мл (1)
или С=(Е пробы /Е калибратора)×5
ммоль/л
(2)
где Е пробы - оптическая плотность опытной
пробы; Е калибратора - оптическая плотность калибровочной пробы.
Нормальные значения: сыворотка- 2,5-8,3 ммоль/л;
моча - 330-580ммоль/сутки [Инструкция к анализатору «RAL-Clima MS-15», 2010].
.3.3 Определение креатинина
В качестве унифицированного метода при
определении концентрации креатинина в крови и моче предложен метод Поппера,
основанный на реакции Яффе.
Принцип метода: в щелочной среде пикриновая
кислота взаимодействует с креатинином с образованием оранжево-красной окраски
(реакция Яффе - образование таутомера пикрата креатинина), которую измеряют
фотометрически.
Определение в сыворотке крови проводят после
депротеинизирования, в моче - после разведения водой. Определение не совсем
специфично, интерферируют вещества с активной метиленовой группой и некоторые
восстанавливающие вещества, например глюкоза, ацетон, ацетоуксусная и
пировиноградная кислоты.
Нормы содержание креатинина сыворотки крови: у
мужчин - 61-115 мкмоль/л или 0,061-0,115 ммоль/л; у женщин - 53-97 мкмоль/л или
0,053-0,097 ммоль/л [Инструкция к анализатору «RAL-Clima MS-15», 2010].
.3.4 Определение аминотрансфераз
Принцип метода: в результате переаминирования,
происходящего под действием ферманта ACT и фермента АЛТ, образуется
щавелевоуксусная кислота и пировиноградная кислота. При добавлении кислого
2,4-динитрофенилгиразина, энзиматический процесс останавливается и получается гидразон
пировиноградной кислоты, который в щелочной среде дает окрашивание,
интенсивность которого пропозициональна количеству образовавшейся
пировиноградной кислоты [Глориозова, 2000].
Аланинаминотрансфераза.
Принцип метода: АЛТ катализирует обратимое трансаминирование
L- аланина и альфа-кетоглутарата в пируват и L-глутамат. Затем пируват, в
присутствии лактатдегидрогеназы восстанавливается до лактата с сопряженным
окислением восстановленного (3-никотинамидаденин-динуклеотида (NADH)).
Референтные величины. AJIT у мужчин до 45 Е/л, у
женщин до 34 Е/л [Инструкция к анализатору «RAL-Clima MS-15», 2010].
Аспартатаминотрансфераза.
Принцип метода: АСТ катализирует обратимый
перенос аминогруппы с L-аспартата на б-кетоглутарат с образованием
оксалоацетата и L-глутамата. Затем оксалоацетат в присутствии
малатдегидрогеназы восстанавливается до малата с окислением восстановленного
никотинамидадениндинуклеотида (NADH) в 3-никотинамидадениндинуклеотид (NAD).
Скорость окисления НАДН прямо пропорциональна
активности АСТ и измеряется фотометрически при длине волны 340 нм [Инструкция к
анализатору «RAL-Clima MS-15», 2010].
Референтные величины: ACT у мужчин до 35 Е/л, у
женщин до 31 Е/л.
.3.5 Определение общего билирубина
Определение билирубина в сыворотке крови
проводили методом Иендрашика-Грофа. Принцип - в кислой среде в присутствии
диазотироанного 2,4-дихлоранилина, билирубин образовывает азотсоединение
красного цвета. Измерение проводят фотометрически при длине волны 546 (540-560)
нм. Термостат поддерживает температуру плюс 37°С. Для калибровки используется
калибратор соответствующей набору фирмам [Инструкция к анализатору «RAL-Clima
MS-15», 2010].
Нормальные величины в сыворотке крови общего
билирубина 6,8-20,5 мкмоль/л [Меньшиков, 2008].
2.3.6 Определение электролитов
Определение электролитов выполняется на
автоматическом анализаторе «Gem-Premier» [Инструкция к анализатору
«Gem-Premier», 2011]. Принцип метода - измерение разности электрических
потенциалов между двумя специальными электродами, помещенными в анализируемый
раствор (метод ионоселективных электродов).
Ход определения - для определения натрия
использовалась стеклянная ионообменная мембрана, а для определения калия -
мембраны валиномицина с нейтральными носителями. Обычные натриевые электроды
имеют в 1000 раз большую специфичность для натрия, чем для калия. На границе
раздела фаз электрод-электролит возникает скачек потенциала, равновесное
значение которого при постоянной температуре зависит от природы и активности
отдельных ионных компонентов в растворе [Дементьева, 2008].
Концентрация ионов калия в сыворотке крови в
норме равна 3,50 - 5,10 ммоль/л. Норма содержания ионов натрия в сыворотке
крови равна 135 - 150 ммоль/л.
.3.7 Определение глюкозы
Метод определения -
ферментативно-фотометрический тест с использованием глюкозооксидазы. Принцип
определения: определение глюкозы ферментативным окислением в присутствии
глюкозооксидазы. Окрашенный индикатор хинонимин образуется из фенола и
4-аминоантипирина под действием пероксида водорода при каталитическом воздействии
пероксидазы [Инструкция к анализатору «RAL-Clima MS-15», 2010].
Нормальные значения от 2,8 до 5,9 ммоль/л.
.3.8 Статистическая обработка результатов
Для получения точного заключения по
материалам исследований, чтобы объективно оценить, количественные данные всех
наблюдений проведена математическая обработка данных: методами вариационной
статистики - в программном приложении Microsoft Excel 
 , ошибка среднего арифметического (±m), показатель
достоверности (Р). Показатель достоверности определяем с помощью автоматической
системы расчета. Различия считались достоверными при 0,05 уровне значимости.
, ошибка среднего арифметического (±m), показатель
достоверности (Р). Показатель достоверности определяем с помощью автоматической
системы расчета. Различия считались достоверными при 0,05 уровне значимости.
3. Клинико-биохимические показатели
у больных с почечной патологией в условиях реанимационного отделения
.1 Динамика концентрации мочевины у больных
острой и хронической почечной недостаточностью
Динамика уровня мочевины представлена в таблице
2.
Таблица 2 - Биохимические показатели крови при
ОПН
|
Показатели
|
Контрольная
группа, Х±m
|
Референтные
значения
|
ОПН
|
|
|
|
Поступление
Х±m/Р
|
Лечение
Х±m/Р
|
Выписка
Х±m/Р
|
|
Мочевина,
ммоль/л
|
3,7
±2,4
|
2,5-8,3
|
7,3∙±0,75
|
11,68∙±2,36
|
5,82∙±2,15
|
|
|
|
|
Ропн1*
|
Ропн2*
|
Ропн3**
|
|
|
Креатинин,
мкмоль/л
|
89
±2,0
|
61-115
|
355,4
±27,6
|
102,6
±14,0
|
59,2
±7,75
|
|
|
|
|
Ропн4*
|
Ропн5*
|
Ропн6*
|
|
|
Общий
белок, г/л
|
60
±2,9
|
65-85
|
74,0±4,57
|
70,4±4,9
|
64,8
±2,25
|
|
|
|
|
Ропн7***
|
Ропн8*
|
Ропн9*
|
|
|
АЛТ,
Е/л
|
28
±2,0
|
7-45
|
68,2±5,3
|
56,8±2,16
|
27,8±2,77
|
|
|
|
|
Ропн10*
|
Ропн11*
|
Ропн12*
|
|
|
АСТ,
Е/л
|
25
±2,0
|
7-35
|
46,6
±4,22
|
43,6
±3,04
|
33,0
±2,45
|
|
|
|
|
Ропн13***
|
Ропн14*
|
Ропн15*
|
|
|
Общ
бил-н, мкмоль/л
|
7,5
±5,0
|
6,8-20,5
|
8,6
±0,29
|
6,8
±0,78
|
5,62
±0,24
|
|
|
|
|
Ропн16*
|
Ропн17*
|
Ропн18*
|
|
|
К
+, ммоль/л
|
3,5
±1,5
|
3,5-5,0
|
4,58
±0,34
|
8,7
±0,62
|
4,28
±0,9
|
|
|
|
|
Ропн19*
|
Ропн20*
|
Ропн21***
|
|
|
Na+, ммоль/л
|
136,0±2,0
|
135-150
|
130,2±6,14
|
142,6±2,79
|
125±1,87
|
|
|
|
|
Ропн22*
|
Ропн23*
|
Ропн24**
|
|
|
Глюкоза,
ммоль/л
|
4,5
±0,2
|
2,8-5,9
|
6,62
±0,3
|
4,9
±0,65
|
5,54
±0,33
|
|
|
|
|
Ропн25*
|
Ропн26**
|
Ропн27*
|
|
Примечание: *р - <0,01, ** р- <0,05, ***р
- >0,05
Для изучения процессов катаболизма у больных
страдающих острой почечной патологией мы оценивали динамику уровня концентрации
мочевины в крови.
Повышение уровня мочевины в сыворотке крови
наблюдается при: почечной недостаточности, рефлекторной анурии, камнях и
злокачественных новообразованиях в мочевыводящих путях [Чиж, 1998].
Из рисунка 2 видно, что концентрация мочевины
изменялась в течении всего периода наблюдения. Так, первые ее показатели
находились в пределах референтных значений и составили 7,3±0,75 ммоль/л, на
этапе лечения уровень мочевины поднялся до 11,68±2,36 ммоль/л (р<0,01), на
наш взгляд этот факт связан с тем, что ОПН обычно вторична, то есть к этому
заболеванию приводят другие заболевания, например: сепсис, перитонит,
панкреатит и пр. К концу периода лечения в стационаре показатель мочевины
вернулся к нормальным значениям и составил 5,82±2,15 ммоль/л (р<0,05).
Для изучения процессов катаболизма у больных
страдающих хронической почечной патологией мы оценивали динамику содержания в
крови концентрации мочевины.
Подробно процессы изменения концентрации
мочевины представлены в таблице 3.
В группе больных с ХПН (вторая экспериментальная
группа) мы наблюдали другую картину: концентрация мочевины в крови достоверно
понижалась с 19,56∙±2,07 ммоль/л от момента поступления больных в
реанимационное отделение стационара до 14,76∙±1,75 ммоль/л - к середине
периода лечебных мероприятий, на момент выписки - показатель мочевины
недостоверно опустился до отметки концентрации в 14,4∙±1,5, что на наш
взгляд понятно, так как нарушения произошедшие в почках влияют на СКФ.
Для представления полной клинической картины,
как изменялась концентрация мочевины в сыворотке крови у больных в двух
экспериментальных и контрольной группах обратимся к рисунку 1.
Таблица 3 - Биохимические показатели крови
больных при ХПН
|
Показатели
|
Контрольная
группа, Х±m
|
Референтные
значения
|
ХПН
|
|
|
|
Поступление
Х±m/Р
|
Лечение
Х±m/Р
|
Выписка
Х±m/Р
|
|
Мочевина,
ммоль/л
|
3,7
±2,4
|
2,5-8,3
|
19,56∙±2,07
|
14,76∙±1,75
|
14,4∙±1,5
|
|
|
|
Рхпн1*
|
Рхпн2***
|
Рхпн3*
|
|
Креатинин,
мкмоль/л
|
59
±2,0
|
61-115
|
241,80
±19,48
|
234,6±26,17
|
165
±18,25
|
|
|
|
Рхпн4***
|
Рхпн5*
|
Рхпн6*
|
|
Общий
белок, г/л
|
60
±2,9
|
65-85
|
73,4±6,88
|
61,4±2,36
|
57,0
±1,88
|
|
|
|
Рхпн7*
|
Рхпн8*
|
Рхпн9*
|
|
АЛТ,
Е/л
|
28
±2,0
|
141,4±2,0
|
123,0±8,36
|
56±10,84
|
|
|
|
Рхпн10*
|
Рхпн11*
|
Рхпн12*
|
|
АСТ,
Е/л
|
25
±2,0
|
7-35
|
82,2
±6,06
|
66,0
±3,08
|
77,8
±5,21
|
|
|
|
Рхпн13*
|
Рхпн14*
|
Рхпн15**
|
|
Общий
билирубин, мкмоль/л
|
7,5
±5,0
|
6,8-20,5
|
20,12
±0,69
|
16,36
±1,49
|
8,2
±0,4
|
|
|
|
Рхпн16*
|
Рхпн17*
|
Рхпн18*
|
|
К
+, ммоль/л
|
3,5
±1,5
|
3,5-5,0
|
5,12
±0,82
|
4,68
±0,91
|
4,5
±0,61
|
|
|
|
Рхпн19**
|
Рхпн20***
|
Рхпн21***
|
|
Na+, ммоль/л
|
136,0±2,0
|
135-150
|
141±3,8
|
133,8±3,9
|
123,4±2,07
|
|
|
|
Рхпн22*
|
Рхпн23*
|
Рхпн24*
|
|
Глюкоза,
ммоль/л
|
4,5 ±0,2
|
2,8-5,9
|
11,76
±0,84
|
16,24
±0,5
|
13,3
±0,46
|
|
|
|
Рхпн25*
|
Рхпн26*
|
Рхпн27**
|
Примечание: *р - <0,01
** р- <0,05
*** р- >0,05
Обращает на себя внимание, разница в значениях
показателей на момент поступления в стационар отличается почти в три раза - 7,3
ммоль/л - в группе больных с ОПН и 19,56 ммоль/л - в группе больных с ХПН
(р<0,01), что свидетельствует о вторичном возникновении почечной патологии
(достоверность различий представлена в таблице 4).

Рисунок 1 - Изменение концентрации мочевины у
больных почечной недостаточностью
К середине лечебного периода значения почти
сравнялись и составили 11,68 ммоль/л и 14,756 ммоль/л соответственно, различия
недостоверны, что говорит об особенностях хронического и острого процесса в
почках. К концу периода лечения у больных с ОПН значения показателей вернулись
к норме и составили 5,82±2,15 ммоль/л, а у больных с ХПН поднялись до 14,4 ±1,5
ммоль/л, что объясняется тем, что организм адаптируется к высоким значениям
мочевины, которая остается стабильно высокой [Тареев, 1982].
Таблица 4 - Биохимические показатели больных с
острой и хронической патологией почек
|
Показатели
|
Референ.
пределы
|
Поступление
|
Лечение
|
Выписка
|
|
|
ОПН
|
ХПН
|
ОПН
|
ХПН
|
ОПН
|
ХПН
|
|
Мочевина,
ммоль/л
|
2,5-8,3
|
7,3∙±0,75
|
19,56∙±2,07
|
11,68∙±2,36
|
14,76∙±1,75
|
5,82∙±2,15
|
14,4∙±1,5
|
|
|
Р1*
|
Р2**
|
Р3*
|
|
Креатинин,
мкмоль/л
|
61-115
|
355,4
±27,6
|
241,8±19,48
|
102,6
±14,0
|
234,6±26,17
|
59,2
±7,75
|
165
±18,25
|
|
|
Р4*
|
Р5*
|
Р6*
|
|
Общий
белок, г/л
|
65-85
|
74,0±4,57
|
73,4±6,88
|
70,4±4,9
|
61,4±2,36
|
64,8
±2,25
|
57,0
±1,88
|
|
|
Р7***
|
Р8*
|
Р9*
|
|
АЛТ,
Е/л
|
7-45
|
68,2±5,3
|
141,4±2,
|
56,8±2,1
|
123,0±8,3
|
27,8±2,7
|
56±10,84
|
|
|
Р10*
|
Р11*
|
Р12*
|
|
АСТ,
Е/л
|
7-35
|
46,6
±4,22
|
82,2
±6,06
|
43,6
±3,04
|
66,0
±3,08
|
33,0
±2,45
|
77,8
±5,21
|
|
|
Р13*
|
Р14*
|
Р15*
|
|
Общ.билирубин,
мкмоль/л
|
6,8-20,5
|
8,6
±0,29
|
20,12±0,69
|
6,8
±0,78
|
16,36
±1,49
|
5,62
±0,24
|
8,2
±0,4
|
|
|
Р16*
|
Р17*
|
Р18*
|
|
К+,
ммоль/л
|
3,5-5,0
|
4,58
±0,34
|
5,12
±0,82
|
8,7
±0,62
|
4,68
±0,91
|
4,28
±0,9
|
4,5
±0,61
|
|
|
Р19**
|
Р20*
|
Р21***
|
|
Na+, ммоль/л
|
135-150
|
130,2±6,14
|
141±3,8
|
142,6±2,79
|
133,8±3,9
|
125±1,87
|
123,4±2,07
|
|
|
Р22*
|
Р23*
|
Р24***
|
|
Глюкоза
ммоль/л
|
2,8-5,9
|
6,62
±0,3
|
11,76±0,84
|
4,9
±0,65
|
16,24
±0,5
|
5,54±0,33
|
13,3±0,46
|
|
|
Р25*
|
Р26*
|
Р27*
|
Примечание: * - <0,01,
** - <0,05,
*** - >0,05
Но следует отметить, что к значениям показателей
крови у больных контрольной группы не снизились.
.2 Динамика концентрации креатинина у больных
острой и хронической почечной недостаточностью
Для описания динамики значений креатинина
обратимся к таблицам 2 и 3. Повышение уровня концентрации креатинина в
сыворотке крови отмечается у больных с почечной патологией, когда нарушены
процессы фильтрации почек [Шиманко, Мусселиус, 2000]. В группе больных с ОПН мы
наблюдали, что концентрация креатинина на момент поступления в стационар
составляла 355,4±27,6 мкмоль/л, что в четыре раза превышало показатели
креатинина в сыворотке крови больных контрольной группы (89±2,0 мкмоль/л), хотя
по мнению авторов креатинин не всегда является прогностическим тестом у больных
ОПН [Междраков, Попова, 1997]. В процессе лечения функция восстанавливалась и
динамика показателей креатинина достоверно понижалась: сначала до 102,6±14,0
мкмоль/л (р<0,01), а затем возвращалась к референтным значениям (61-115
мкмоль/л), и составляла 59,2 мкмоль/л.
Более наглядно динамика значений креатинина
представлена на рисунке 2.

Рисунок 2 - Изменение концентрации креатинина у
больных почечной недостаточностью
У больных с ХПН в момент поступления в стационар
показатели креатинина составляли 241,8 ±19,48 мкмоль/л, что в четыре раза выше
показателей больных контрольной группы (89±2,0 мкмоль/л) и в два раза выше
верхнего предела показателей референтных значений (61-115 мкмоль/л). В течении
процесса лечения показатели значения креатинина недостоверно понижались, но к
концу лечебного периода практически вернулись к нормальным значениям и
составили 165±18,25 мкмоль/л (р<0,01). По мнению ряда ученых креатинин
является ценным показателем метаболического обмена при хронических заболеваниях
почек [Котовская, 2009].
Обращает на себя внимание, что высокие значения
креатинина отмечались как в группе больных с ОПН (355,4±27,6 мкмоль/л), так и
группе больных с ХПН - 241,8 мкмоль/л.
В момент поступления в стационар показатель
креатинина в сыворотке больных с ОПН был в полтора раза выше, чем этот же
показатель в другой экспериментальной группе больных - ХПН (различия
достоверны). Затем обращает на себя внимание, что «обвал» показателя креатинина
отмечался в группе больных с ОПН (102,6±14,0 мкмоль/л), что свидетельствует о
восстановлении функции СКФ почек, в сравнении с показателями крови больных с
ХПН (234,6±26,17 мкмоль/л) отмечается достоверность р<0,01 (таблица 5). На
момент выписки разница между показателями составляла почти в три раза, то есть
в сыворотке больных ХПН показатели креатинина не вернулись к референтным
значениям (61-115 мкмоль/л), а в сравнении с показателями креатинина
контрольной группы была выше в три раза (89,0±2,0 мкмоль/л). Наши исследования
совпадают с мнениями, что креатинин может являться ранним маркером нарушения
фильтрации почек.
3.3 Динамика концентрации общего белка у больных
острой и хронической почечной недостаточностью
Синтез и распад белков - единая система,
сбалансированная всеми промежуточными реакциями, протекающими на разных уровнях
организма. Все эти реакции, представленные в организме человека настолько
многочисленны и разнообразны и оценка ключевых звеньев промежуточного обмена
белков и азотистых соединений крайне важна для оценки функционального состояния
жизненно важных органов и тканей, таких как печень, почки, мышечная система
[Колб, Камышников, 1990].
Для описания динамики изменения концентрации
общего белка обратимся к таблицам 2 и 3.
Показатели концентрации общего белка у больных с
ОПН на момент поступления в стационар составляли 74±4,57 г/л, не выходя за
пределы референтных значений (65-85 г/л). В процессе получения лечения динамика
общего белка представляла картину постепенного недостоверного понижения до
70,4±4,9 г/л, на наш взгляд такая тенденция объясняется потреблением белка
организмом. На момент выписки показатель общего белка составил 64,8±2,25 г/л
(р<0,01). Но с показателями концентрации белка больных контрольной группы
так и не сравнялись (60±2,9 г/л).
Наглядно динамика представлена на рисунке 3.
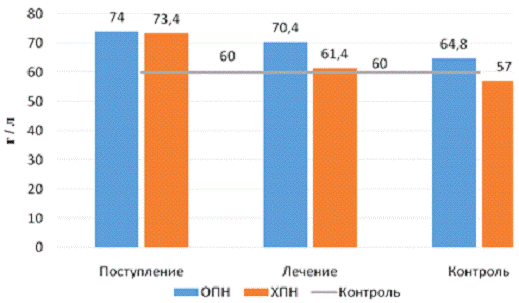
Рисунок 3 - Изменение концентрации общего белка
у больных почечной недостаточностью
У больных второй экспериментальной группы (ХПН)
динамика концентрации белка была такой же: отмечалось понижение. На момент
поступление в отделение реанимации показатели общего белка равнялись 73,4±6,88
г/л (р<0,01), к середине периода лечения - 61,4±2,36 г/л (р<0,01), при
этом показатели не выходили за пределы референтных значений (65-85 г/л). А на
момент выписки составили 57,0±1,88 г/л, что оказалось ниже референтных пределов
(65-85 г/л) и средних показателей контрольной группы (60±2,9 г/л).
Из таблицы 4 видно, что изменение концентрации
общего белка в группах больных с ОПН и ХПН идентичны, то есть имели общую
тенденцию к понижению концентрации белка. На момент поступления больных
показатели концентрации белка были недостоверно различны и составляли в группе
больных с ОПН - 74,0±4,57 г/л, в группе с ХПН - 73,4±6,88 г/л, не превышая
референтных значений (65-85 г/л) и показателей концентрации общего белка в
контрольной группе - 60±2,0 г/л. А по мере получения лечения показатели
достоверно снижались до: в первой экспериментальной группе (ОПН) до 64,8±2,25
г/л, во второй (ХПН) - 57,0±1,88 г/л. Этот факт мы связываем с тем, что выход
белков из русла крови происходит при нарушении работы почечного фильтра
вследствие заболеваний почек.
.4 Динамика активности трансаминаз у больных
острой и хронической почечной недостаточностью
Исследования динамики активности ферментов АЛТ и
АСТ у больных в реанимационном отделении позволяют оценить эффективность
лечебных мероприятий, а также нарушения процессов трансаминирования в тканях.
Так, широкое распространение и высокая активность трансаминаз в органах и
тканях человека, а также сравнительно низкие величины активности этих ферментов
в крови послужили основанием для определения уровня ряда трансаминаз в
сыворотке крови человека при органических и функциональных поражениях разных
органов [Маршалл, 2000].
Данные таблицы 2 позволили отметить изменения
активности АЛТ в сыворотке больных с ОПН. Обращает на себя внимание тот факт,
что на протяжении всего периода исследования активности фермента АЛТ показатели
были достоверно различны (р<0,01) и изменялись со следующей динамикой: на
момент поступления в реанимацию активность АЛТ составляла 68,2±5,3 Е/л,
превышало пределы референтных значений в полтора раза, а в сравнении с
показателями группы контроля - в два и четыре десятых раза. В результате
проведенного лечения на 5 сутки активность АЛТ составила - 56,8±2,16 Е/л, а к
окончанию лечения - 27,8±2,77 Е/л, то есть показатели вернулись к норме.
Данные таблицы 3 демонстрировали нам такую же
тенденцию к понижению активности фермента АЛТ. Так, в момент поступления
больных в отделение реанимации активность составила 141,4±2,0 Е/л, в середине
периода лечебных мероприятий - 123,0±8,36 (р<0,01), что превышает
референтные пределы значений в два и семь десятых раза. К моменту выписки
показатели активности АЛТ не вернулись к норме и составили 56±10,84 Е/л.
Наглядно картина активности фермента АЛТ
представлена на рис. 4
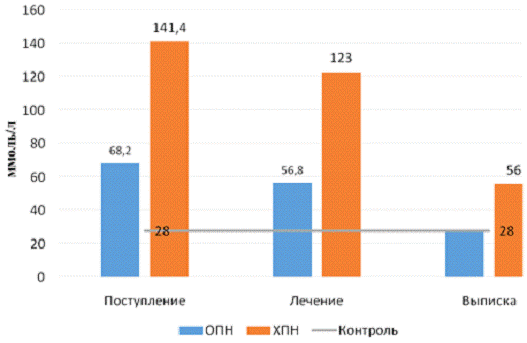
Рисунок 4 - Изменение активности АЛТ у больных
почечной недостаточностью
Данные таблицы 4 нам позволили сравнить между
собой активность фермента АЛТ. Так, на момент поступления в стационар
активность АЛТ больных с ОПН была достоверно ниже в два раза (р<0,01), такое
же примерно соотношение сохранилось к середине периода лечения - в два и один
десятых раза, на момент выписки больного и перевода его на амбулаторное лечение
разница достоверно составляла два раза: 27,8 Е/л у больных с ОПН и 56 Е/л- с
ХПН. На наш взгляд, этот факт связан с тем, органические поражения при острых и
хронических заболеваниях, сопровождающиеся деструкцией клеток, приводят к
выходу трансаминаз из очага поражения в кровь.
Совсем другая картина изменения активности
фермента АСТ.
Данные таблицы 2 позволили отметить изменения
активности АСТ в сыворотке больных с ОПН. В момент поступления в реанимацию
активность АСТ составляла 46,6±54,22 Е/л, несколько превышая пределы
референтных значений 7-35 Е/л, а в сравнении с показателями группы контроля - в
один и восемь десятых раза. В середине проводимого лечения активность АСТ
составляла - 43,6±3,04 Е/л, а к окончанию лечения - 33,0±2,45 Е/л, то есть показатели
вернулись к норме (р<0,01).
Данные таблицы 3 демонстрировали другую
тенденцию в изменении активности фермента АСТ. Так, в момент поступления
больных в отделение реанимации активность составила 82,2±6,06 Е/л, в середине
периода лечебных мероприятий - 66,0±3,08 (р<0,01), что превышает референтные
пределы значений в незначительное количество раз. К моменту выписки показатели
активности АСТ не вернулись, как отмечалось в случае изменения активности АЛТ,
а наоборот, поднялись и составили 77,8±5,21 Е/л.
Данные таблицы 4 нам позволили сравнить между
собой активность фермента АСТ у больных с ОПН и ХПН. Так, на момент поступления
в стационар активность АСТ у больных с ОПН была ниже почти в два раза
(р<0,01), чем у больных с ХПН. Такое же примерно соотношение сохранилось к
середине периода лечения - в полтора раза, на момент выписки больного и
перевода его на амбулаторное лечение разница достоверно составляла более чем в
два раза: 33,0 Е/л у больных с ОПН и 77,8 Е/л - с ХПН. На наш взгляд, этот факт
связан с тем, что АЛТ в основном локализуется в цитоплазме, а АСТ имеет две
формы - цитоплазматическую и митохондриальную, поэтому активность АСТ выше
активности АЛТ. Кроме того, у больных с диагнозом ХПН уже имеются ряд
сопутствующих заболеваний [Гудков, 2002].
Наглядно изменение активности АСТ представлено
на рисунке 5.

Рисунок 5 - Изменение активности АЛТ у больных
почечной недостаточностью
Таким образом, в клинических целях наибольшее
значение имеют обе трансаминазы: AСT и АЛТ [Маршалл, 2000]. Но тенденции
изменения активности разные в группах с почечной патологией.
.5 Динамика концентрации общего билирубина у
больных острой и хронической почечной недостаточностью
Для описания динамики изменения значений общего
билирубина обратимся к таблицам 2 и 3.
Показатели концентрации общего билирубина у
больных с ОПН на момент поступления в стационар составили 8,6±0,29 мкмоль/л, не
выходя за пределы референтных значений (6,8-20,5 мкмоль/л). В процессе
получения лечения динамика общего билирубина представляла картину постепенного
достоверного понижения - 6,8±0,78 мкмоль/л (р<0,01), на наш взгляд, такая
тенденция объясняется отсутствием патологии со стороны печени и желчных
протоков. Уровень достоверности различий между группами на протяжении всего
периода наблюдения составил р< 0,01. На момент выписки показатель общего
билирубина составил 5,62±0,24 мкмоль/л (р<0,01). Также в контрольной группе
больных (без патологии почек) также не отмечено несоответствия в референтных
значениях общего билирубина и уровень концентрации составил 7,5±5,0 мкмоль/л.
У больных второй экспериментальной группы (ХПН)
динамика изменения концентрации общего билирубина была такой же: отмечалось
понижение. На момент поступления в отделение реанимации показатели общего
билирубина равнялись 20,12±0,69 г/л (р<0,01), то есть находились на верхней
границе референтных значений (6,8-20,5 мкмоль/л). По мнению Л.В. Дударь [2008],
такое увеличение уровня общего билирубина произошло вследствие повреждения
внутрипечёночных протоков и нарушения механизмов образования и транспорта
желчи. Но к середине периода лечения показатели концентрации общего билирубина
поднялись до 16,36±1,49 мкмоль/л (р<0,01), при этом показатели не выходили
за пределы референтных значений. А на момент выписки составили 8,2,0±0,4
мкмоль/л, что оказалось также в пределах референтных значений и средних
показателей контрольной группы (7,5±5,0 мкмоль/л).
Из таблицы 4 видно, что изменение концентрации
общего билирубина в группах больных с ОПН и ХПН идентичны: отмечается понижение
концентрации. На момент поступления больных показатели концентрации билирубина
достоверно различны и составляли в группе больных с ОПН - 8,6±0,29 мкмоль/л, в
группе с ХПН - 20,12±0,69 мкмоль/л (р<0,01). А по мере получения лечения показатели
сыворотки крови снижались до: в первой экспериментальной группе (ОПН) до
5,62±0,24 мкмоль/л, во второй (ХПН) - 8,2±0,4 мкмоль/л (р<0,01)
Наглядно динамика представлена на рисунке 6.

Рисунок 6 - Изменение концентрации общего
билирубина у больных почечной недостаточностью
Таким образом, динамика концентраций общего
билирубина в двух экспериментальных группах была похожей.
.6 Динамика концентрации электролитов у больных
острой и хронической почечной недостаточностью
Калий - основной внутриклеточный электрогенный
катион. Уровень калия в клетке зависит от активности метаболических процессов,
состояния кислотно-щелочного равновесия. Гипокалиемия - свидетельство тяжелого
дефицита калия в организме. Гиперкалиемия является результатом нарушения
выведения калия с мочой при почечной недостаточности или освобождения калия из
поврежденных клеток [Кобалава, 1998].
Для описания динамики изменения значений калия
обратимся к таблицам 2 и 3.
Повышение уровня концентрации калия отмечался у
больных с острой почечной патологией, когда процессы нарушения функции почек
только начинаются, в группе больных с ОПН мы наблюдали, что концентрация калия
в сыворотке крови больных при поступлении в стационар составляла 4,58±0,34
ммоль/л, в процессе лечения динамика показателей калия достоверно повысилась до
8,7 ммоль/л, что превышало референтные значения концентрации ионов калия почти
в два раза (референтные значения составляли 3,5-5,0 ммоль/л). К моменту выписки
больных с ОПН из стационара значения калия вернулись к норме и составили
4,28±0,9 ммоль/л, в то время, как показатели сыворотки крови в контрольной
группе составили 3,5±1,5 ммоль/л. И в сравнении со значениями калия в момент
поступления оказались недостоверными (р>0,05).
У больных с ХПН в момент поступления в стационар
показатели калия в сыворотке крови составили 5,12 ±0,82 ммоль/л, что превышало
референтные значения калия (3,5-5,0 ммоль/л), а также показатели калия в
сыворотке больных контрольной группы. К середине периода лечебных мероприятий,
проводимых в отделении реанимации отметилось снижение концентрации калия и
составило 4,68±0,91 ммоль/л (р<0,05). К окончанию периода пребывания на
лечении в отделении реанимации у больных ХПН показатель калия вернулся к норме.
Что свидетельствует о нормализации водно-электролитного баланса у больных.
Более наглядно динамики изменения значений калия
представлены на рисунке 7.
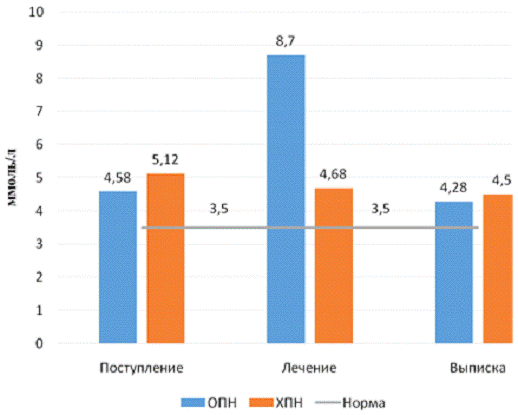
Рисунок 7 - Изменение концентрации калия у
больных почечной недостаточностью
Обращает на себя внимание тот факт (таблица 4),
что колебания значений уровня калия незначительны. Так как организм старается
сохранить основные биохимические процессы в организме человека, к которым
относится и водно-электролитный баланс [Мухин, Моисеев, 2009]. При сравнении
показателей калия в обеих группах исследования (ОПН и ХПН) обнаружилось
недостоверность различий. Но картины динамики изменения концентрации калия в
группах различны. Так, в группе больных с ОПН отмечался подъем показателей в
середине процесса лечения выше референтных пределов почти в два раза и выше
значений калия в сыворотке крови больных с ХПН в один и восемь десятых раза
8,7±0,62 ммоль/л, в группе ОПН и 4,68±0,9 ммоль/л - в группе с ХПН,
соответственно.
Для описания динамики изменения значений натрия
обратимся к таблицам 2 и 3.
Натрий - основной катион внеклеточной жидкости,
является гидрофобным катионом, который обеспечивает перенос воды в организме,
особенно в почках [Игнатова, Вельтищев, 1974].
Данные таблицы 2 позволили отметить изменения
концентрации натрия в сыворотке больных с ОПН. Обращает на себя внимание тот
факт, что на протяжении всего периода исследования натрия в сыворотке крови
показатели были достоверно различны (р<0,01) и изменялись со следующей
динамикой: на момент поступления больных в реанимацию значения натрия
составляли 130,2±6,14ммоль/л, не выходя за пределы референтных значений 135-150
ммоль/л, и не отличаясь от показателей в группе контроля - 136,0±2,0 ммоль/л. В
результате проведенного лечения на пятые сутки значения натрия поднялись до
142,6±2,79 ммоль/л, также оставаясь в пределах нормы. К моменту выписки из
стационара показатели натрия в сыворотке крови опустились до 125,0±1,87
ммоль/л. Данный факт свидетельствует о том, что ОПН не всегда сопровождается
нарушениями калиево-натриевого насоса в клетках [Сумин, Руденко, 2010].
Данные таблицы 3 демонстрировали нам другую
тенденцию в динамике изменения концентрации натрия: так, на момент поступления
больных в отделение реанимации концентрация натрия составляла 141±2,0 ммоль/л,
в середине периода лечебных мероприятий - 133,8±3,9 ммоль/л (р<0,01), что не
превышало референтных пределов значений, а затем в середине срока лечения
наметилась тенденция к понижению значений натрия: к моменту выписки показатели
натрия составили 123,4±2,07 ммоль/л (р<0,01).
Данные таблицы 4 нам позволили сравнить между
собой показатели концентрации натрия в обеих группах больных. Хочется отметить,
что ни в одном случае-динамике изменения показателей натрия выхода за пределы
референтных значений не отмечалось, что свидетельствует о своевременной
компенсации водно-электролитного баланса.
Наглядно картина изменения концентрации натрия в
обеих экспериментальных группах представлена на рисунке 8.

Рисунок 8 - Изменение концентрации натрия у
больных почечной недостаточностью
Таким образом, изменение картины динамики
концентраций электролитов отличны, что свидетельствует о различиях в течении
патологических процессов у больных с острой и хронической патологией почек. В
случае с хронической формой почек тенденция изменения концентрации электролитов
носила убывающий характер. А с случае с острым течением заболевания: повышения
к середине периода лечения, а затем понижения, возвращения к референтным
значениям.
.7 Динамика концентрации глюкозы у больных
острой и хронической почечной недостаточностью
Глюкоза является основным энергетическим
субстратом организма. Концентрация глюкозы в крови является производной
активности процессов гликогенеза, гликогенолиза, гликонеогенеза и гликолиза
[Пирогов, 1995].
Для описания динамики изменения концентрации
глюкозы обратимся к таблицам 2 и 3.
Показатели глюкозы у больных с ОПН на момент
поступления в стационар составили 6,62±0,3 ммоль/л (р<0,01), к середине
периода лечения - 4,9±0,65 ммоль/л (р<0,05), при этом показатели уже не
выходили за пределы референтных значений. А на момент выписки составляли
5,54±0,33 ммоль/л, что оказалось также в референтных пределах (2,8-5,9
ммоль/л), выше средних показателей контрольной группы (4,5±0,2 ммоль/л).
У больных второй экспериментальной группы (ХПН)
динамика концентрации глюкозы была другой: сначала отмечался подъем значений
концентрации глюкозы 11,76±0,84 ммоль/л, выходя за пределы референтных значений
в два раза (2,8-5,9 ммоль/л) и более, чем в два раза в контрольной группе
(4,51±0,2 ммоль/л). В процессе получения лечения динамика концентрации уровня
глюкозы представляла картину постепенного достоверного повышения до значений
16,24±0,5 ммоль/л (р<0,01). На момент выписки значение глюкозы понизилось,
но к референтным значениям не вернулось и составило 13,3±0,46 ммоль/л
(р<0,01), что на наш взгляд связано с развитием патологии поджелудочной
железы, как сопутствующего заболевания.
Наглядно динамика уровня глюкозы представлена на
рисунке 9.

Рисунок 9 - Изменение концентрации глюкозы у
больных почечной недостаточностью
Данные таблицы 4 нам позволили сравнить между
собой концентрации значений глюкозы у больных с ОПН и ХПН. Отметим, что на
протяжении всего периода исследования показатели уровня глюкозы в
экспериментальных группах сравнения показывали достоверные различия
(р<0,01). Так, на момент поступления в стационар значение уровня глюкозы
больных с ОПН составляла 6,62±0,3 ммоль/л, в то время как во второй экспериментальной
группе (больные с ХПН) - в два раза выше - 11,76±0,84 ммоль/л (р<0,01).
Показатели концентрации глюкозы в крови больных обеих экспериментальных групп
были выше референтных значений и показателей глюкозы в сыворотке крови больных
контрольной группы - 4,5±0,2 ммоль/л. К середине курса лечения соотношение
между показателями глюкозы в обеих группах стало еще больше - в три раза - за
счёт увеличения показателей уровня глюкозы в группе ХПН (16,24±0,5 ммоль/л) и
понижения показателей уровня глюкозы в группе ОПН - 4,9±0,65 ммоль/л, различия
достоверны (р<0,01). На момент выписки больных обеих групп и перевода на
амбулаторное лечение разница достоверно составляла более чем в два раза:
5,54±0,33 у больных с ОПН и 13,3±0,46 ммоль/л - с ХПН.
Таким образом, динамики уровней концентрации
глюкозы больных, страдающих почечной патологией отличаются, в зависимости от
степени тяжести заболеваний.
Заключение
В ходе данной работы были рассмотрены изменения
биохимических показателей больных при острой и хронической почечной
недостаточности.
Проведены исследования 40 пациентов с различной
почечной патологией и 20 пациентов контрольной группы без патологических
изменений.
По результатам этой работы сделаны выводы:
1. Информативными диагностическими тестами
диагностики и сопровождения лечебных мероприятий реанимационного отделения
являются: определение уровня мочевины и креатинина, определение концентрации
общего белка и общего билирубина, определение активности аланинаминотрансферазы
и аспартатаминотрансферазы, исследование уровня глюкозы и электролитов.
2. В развитии острой почечной
недостаточности диагностически значимыми биохимическими тестами стали:
определение уровня мочевины и креатинина, исследование активности
аминотрансфераз и определение концентрации электролитов.
. В развитии хронической почечной
недостаточности диагностически значимыми тестами могут быть: определение уровня
концентрации мочевины, креатинина, общего билирубина, глюкозы, а также
исследование активности аминотрансфераз и определение концентрации электролитов.
. Биохимические показатели сыворотки
крови больных с ОПН и ХПН отличались в процессе лечения закономерностями в
изменениях концентраций:
для острого течения почечной недостаточности
характерно нарастание биохимических показателей (концентрация мочевины, калия,
натрия) в процессе лечения; остальные биохимические показатели демонстрировали
картину постепенного снижения концентрации.
для хронического течения заболевания отмечалось
в процессе лечение нарастание только концентрации глюкозы в сыворотке крови;
остальные биохимические показатели в процессе лечения ХПН понижались.
Функционирование почки, как органа, через
который реализуются регуляторные влияния на водно-минеральный обмен,
поддержание кислотно-щелочного равновесия, регуляции артериального давления и
других видов обмена, в значительной степени определяет состояние этих сред. Для
изучения состава биологических жидкостей организма используются клинические и
биохимические исследования. Однако целенаправленное назначение лабораторных
анализов возможно только с учетом клинической картины заболевания. В ряде
случаев патологию почек удается выявить только при лабораторном обследовании.
Количество этих исследований в медицинской практике непрерывно растет.
Расширяется не только диапазон используемых показателей, но и постоянно
совершенствуются сами методы. Результаты лабораторных исследований не только
способствуют выявлению той или иной патологии, но а также используется для
контроля над динамикой заболевания и эффективностью проводимой терапии.
Библиографический список
1. Аляев Ю.Г. Мочекаменная
болезнь: современные методы диагностики и лечения. М., 2010. 147 с.
. Бурчигский Г.И., Вищ К.
Внутренние болезни. М., 2000. 307с.
. Бышевский А.И., Терсенов
О.А. Биохимия для врача. Екатеринбург, 2000. 177с.
. Глориозова Т.Г. Клиническая
патофизиология //Медицинский вестник. 2000. №11. С.94-97.
. Гудков К.М. Почечная
недостаточность //Журнал заведующего КДЛ. 2002. № 6. С.15-17.
. Дементьева И.И. Лаборатория
экспресс-диагностики (обоснование, цели, процесс анализа) //Клиническая
лабораторная диагностика. 2008. № 10. С. 25 - 29.
. Джанад-Заде М.-М.Д.,
Мальков П.С. Хроническая почечная недостаточность. М., 1978. 202 с.
. Дударь Л.В. Первичный
билиарный цирроз //Новости медицины и фармации. 2008. № 239. С. 33 - 36.
. Елисеева Ю.Ю. Полный
справочник. Анализы. М., 2006. 170с.
. Ермоленко Е.М. Хронический
гемодиализ. М., 1982. 329с.
. Игнатова М.С., Вельтищев
Ю.Е. Болезни почек //Трудный пациент, 1974. №12. С.23-26.
. Инструкция забора крови в
стационарах, 2010.
. Инструкция к анализатору
«Gem-Premier», 2011.
. Инструкция к анализатору
«RAL-Clima MS-15», 2010.
. Кобалава Ж.Д. Терапия и
профилактика при почечной патологии. //Русский медицинский журнал. 1998. №19.
С.26-28.
. Колб В.Г., Камышников В.С.
Справочник по клинической химии. Минск, 1990. 299 с.
. Котовская Ю.В. Ключи к
диагностике и лечению. //Медицинский Веб-журнал. 2009. № 13. С.32-37.
. Литвицкий П.Ф.
Патофизиология: учебник для медицинских ВУЗов. М., 1998. 350 с.
. Лифшиц В.М., Сидельникова
В.И. Медицинские лабораторные анализы. М., 2000. 145 с.
. Лопаткин И.А., Кучинский
И.Н. Лечение острой и хронической почечной недостаточности. М., 1972. 236с.
. Маждраков Г., Попов А.
Болезни почек. София, 1997. 155с.
. Маршалл В.Дж. Клиническая
биохимия. М.- СПб., 2000. 368 с.
. Междраков Г., Попов А.
Болезни почек. София: Медицина и физкультура, 1980. 582с.
. Меньшиков В.В. Частные
аналитические технологии в клинической лаборатории //Клиническая лабораторная
аналитика. 2008. №3. С.65-67.
. Минкин Р.Б. Болезни почек.
М., 1990. 96с.
. Мухин Н.А., Гареева Н.Е.
Диагностика и лечение болезней почек. М., 1995. 186 с.
. Мухин Н.А., Моисеев В.С.
Пропедевтика внутренних болезней: учебник для студентов медицинских ВУЗов. М.,
2009. 213 с.
. Нестеров С.Л., Шиленок
И.Г., Козлова Е.М., и пр. Лабораторные исследования при почечной
недостаточности //Клиническая лабораторная диагностика. 2002. №5. С.58-59.
. Пелещук А.П. Практическая
нефрология. Киев, 1974. 313с.
. Пермяков Н.К., Зимина Л.Н.
Острая почечная недостаточность. М., 1983. 301 с.
. Пирогов К.Т. Внутренние
болезни. М., 2005. 305с.
. Радужный Н.Л. Внутренние
болезни. Минск, 2007. 248с.
. Рябов С.И. Хроническая
почечная недостаточность. Л., 1976. 158с.
. Сиротко В.Л. Все о
внутренних болезнях: учебной пособие для студентов и аспирантов. Минск,
2008.180с.
. Сумин С.А., Руденко М.В.,
Бородинов И.М. Анестезиология и реаниматология. М., 2010. 316с.
. Тареев Е.М. Клиническая
нефрология. М., 1993. 177с.
. Тареев Е.М. Основы
нефрологии. М., 1983. 489 с.
. Хондкариан О.А., Шульцев
Г.П. Состояние нервной системы при хронических заболеваниях почек
//Лабораторное дело. 1980. № 8. С.45.
. Хашен Р., Шейх Д. Очерки по
патологической биохимии. М., 1991. 403 с.
. Чиж А.С. Нефрология в
терапевтической практике. Минск, 1998. 366 с.
. Шиманко И.И., Мусселиус
С.Г. Острая почечная недостаточность. М., 2000. 307 с.
. Автоматический расчет
критерия Стьюдента.