Сода. Приготування вапняного молока
Одеський національний
політехнічний університет
Кафедра технології
неорганічних речовин і екології
КУРСОВа
РОБОТА
з курсу «Теоретичні основи
технології неорганічних речовин»
на тему: Сода. Приготування
вапняного молока
Студентки
3 курсу ХТ-123 групи
напряму
підготовки 6.0513.01 - Хімічна технологія
спеціальності
7.05130101 - Хімічні технології неорганічних речовин
Яворської
О.М.
Керівник:
доцент
Іванченко Л.В.
м. Одеса - 2015 рік
ЗМІСТ
Вступ
. Розробка хімічної концепції цільового продукту
.1 Аналіз можливих варіантів одержання продукту
.2 Обґрунтування вибору способу виробництва
.3 Хімічна схема процесу
. Розробка технологічної концепції
.1 Основні і допоміжні стадії прийнятого до розробки
способу
.2 Принципова технологічна схема
.3 Технологічні розрахунки основного реакторного
процесу
.3.1 Фізико-хімічні основи процесу
.3.2 Обґрунтування обраного технологічного режиму
.3.3 Матеріальний баланс
. Апаратуро-технологічна схема
.1 Опис технологічної схеми
.2 Вибір типів основних апаратів
Висновок
Література
ВСТУП
Вуглекисла сода (натрію карбонат) була відома ще за давніх
часів. Соду добували із золи, морських та солончакових рослин і діставали з
ропи природних содових озер. Використовували соду у виробництві скла та як
миючий засіб.
Кальцинована сода - традиційний продукт, що має багаторічну
історію виробництва та використання. У теперішній час світове виробництво
складає 34 млн. тон на рік. Найбільшими споживачами соди є хімічна (28 % від
всього виробництва), скляна (26 %), металургійна (15 %) і інші
галузіпромисловості.
У хімічній промисловості сода застосовується для отримання
каустичної соди. Велика кількість натрію карбонату використовується у
кольоровій металургії в основному в процесі виробництва глинозему з бокситів
методом спікання кріоліту, під час перероблення свинцево-цинкових,
кобальт-нікелевих, а також вольфрамо-молібденових руд. Велике застосування сода
знаходить також у нафтохімічної і нафтопереробної промисловості в процесі
виробництва синтетичних жирних кислот, синтетичних миючих засобів, а також в
процесі перероблення нафти. У чорній металургії натрію карбонат
використовується для видалення сірки і фосфору з чавуну. В машинобудуванні
содо-продукти необхідні для пасивування і знешкодження деталей машин.
Середнє споживання кальцинованої соди з розрахунку на одну
людину в розвинутих країнах  25 кг. У країнах, що розвиваються і в країнах Азії
25 кг. У країнах, що розвиваються і в країнах Азії  2 кг. В Україні
2 кг. В Україні  l5 + 16 кг. За прогнозами у 2020 р.
світове споживання соди становитиме приблизно 65 млн. тон.
l5 + 16 кг. За прогнозами у 2020 р.
світове споживання соди становитиме приблизно 65 млн. тон.
. РОЗРОБКА ХІМІЧНОЇ КОНЦЕПЦІЇ ЦІЛЬОВОГО ПРОДУКТУ
1.1 Аналіз можливих варіантів
одержання продукту
В даний час у світі виробництво соди базується на чотирьох
способах її отримання:
аміачний (з натрію хлориду);
з природної соди;
з нефелінів;
карбонізацію натрію гідроксиду.
Аміачний спосіб отримання соди - це основний спосіб, що
володіє низкою великих переваг:
. Необхідна для здійснення способу сировина - поварена сіль і
кальцію карбонат - є недорогою, широко поширеною і легко видобуваємою.
. Основні реакції процесу здійснюються за невисоких
температур (до 100 °С) і близьких до атмосферного тисків.
. Гарна вивченість способу, злагодженість і стійкість
технологічних процесів.
. Висока якість вихідного продукту.
. Порівняно низька собівартість кальцинованої соди.
У аміачного способу отримання соди є й істотні недоліки,
головними з яких є:
. Низький ступінь використання вихідної сировини (натрій
використовується всього приблизно на 70 %, а хлор і кальцій не використовуються
зовсім).
. Великі кількості рідких і твердих відходів, які потребують
утилізації скидання або тривалого зберігання.
. Значна витрата енергетичних ресурсів.
. Великі питомі інвестиції, необхідні для створення содового
виробництва.
Недоліки аміачного способу отримання соди стають все
істотніше у міру посилення вимог до комплексного використання природної
сировини і до охорони навколишнього середовища від забруднень, а також зі
зростанням дефіциту і вартості енергоносіїв. Численні спроби зробити спосіб
безвідходним або маловідходним досі успіхом не увінчалися. Розроблений і
використовуваний промисловістю так званий модифікований аміачно-содовий процес
в якому поряд з содою отримують амонію хлорид, хоча і є практично безвідходним,
але широкого розповсюдження не отримав із-за невеликого попиту на амонію
хлорид.
Отримання кальцинованої соди з природної содовмісної речовини
- порівняно нова галузь содової промисловості світу, що стала одним з головних
конкурентів аміачного способу. Цей спосіб був відомий давно, але
лише відкриття в 1938 р. в США найбагатших покладів трони (Na2CO3∙NaHCO3∙2Н2О)
поклало початок розвитку технології переробки цієї сировини. В даний час
кальциновану соду з трони отримують двома основними способами -
сесквікарбонатним і моногідратним.
За першим з названих способів дроблену руду розчиняють з
отриманням насиченого розчину, який після освітлення, фільтрування, очищення
від органічних домішок випаровують і потім охолоджують. Кристали натрію сесквікарбонату,
шо випали, відокремлюють і кальцинують за 200 °С. Отримують чистий продукт з
насипний масою 800 кг/м3. Другий спосіб був розроблений в 1972 р. і
зараз є провідним. За цим способом руду кальцинують, отриману сиру соду
розчиняють, розчин освітлюють, фільтрують, обробляють активним вугіллям з метою
очищення від органічних домішок і випаровують за температури нижче точки
переходу натрію моногідрату карбонату в безводну соду. Отримані кристали
натрію, моногідрату карбонату відокремлюють і дегідратують за температури
близько 150 °С, з отриманням важкої соди, насипна маса якої 1070 кг/м3.
Отримувати кальциновану соду з природної набагато вигідніше,
ніж виробляти її аміачним способом. Питомі капіталовкладення (на 1 т на рік
потужності виробництва) становлять для підприємства з перероблення природної
соди 300 у.о., для підприємства аміачної соди - 546 у.о., витрати робочої сили
відповідно - 1,2 і 1,88 чол./год., витрата енергії - 6,З і 4,2 кДж/т.
Джерела природної соди є також у Бельгії, Бразилії, Мексиці, Пакистані,
Китаї, Туреччині, Канаді, Кенії. Частку природної соди в світовому виробленні
кальцинованої соди можна оцінити приблизно в 30 %.
Третій за значимістю з промислових способів отримання соди -
комплексна переробка нефелінів на глинозем, кальциновану соду, поташ і цемент.
Цей спосіб застосовується тільки в країнах СНД, і на його основі виробляються
значні кількості кальцинованої соди, найбільшим родовищем нефелінів є
Кія-Шалтирське, що знаходиться поблизу м. Ачинська. Великі родовища нефелінових
порід є і в Хібінах (Кольський півострів), на півдні Донбасу - в Приазов’ї
(Україна). Родовища нефеліну є в Норвегії і Гренландії. Кристали нефеліну у
вулканічних породах зустрічаються в Італії (Везувій). Комплексна переробка
нефелінів вигідна, оскільки дає можливість економити приблизно 15 %
капіталовкладень і 20 % експлуатаційних витрат порівняно з самостійними
виробництвами тих же продуктів з традиційної сировини.
У всьому світі в даний час діє лише кілька невеликих
установок по отриманню соди з каустичної соди, і частка цього способу в
світовому виробництві соди становить менше 1 %.
1.2 Обґрунтування вибору способу
виробництва
Вуглекисла сода (натрію карбонат) була відома ще за давніх
часів. Соду обували із золи, морських та солончакових рослин і діставали з ропи
природних содових озер. Використовували соду у виробництві скла та як миючий
засіб. До кінця ХVІІІ століття ці джерела вже не могли задовольнити зростаючу
потребу в соді. У 1775 р. французький фармацевт Леблан запропонував отримувати
соду прожарюванням суміші натрію сульфату, подрібненої крейди або вапна та
вугілля згідно за реакцією:
2SO4+СаСОз+2С→Na2CO3+CaS+2СО2.
З отриманого плаву соду вилуговували водою й розчин
упарювали, виділяючи Na2SO3 у твердому вигляді. У шламі
залишався CaS, який є відходом виробництва. Так як у природі натрій (Na)
зустрічається частіше у вигляді сполучень NaCl (кухонна сіль), то необхідний
для виробництва Na2SO4 було запропоновано отримувати
взаємодією натрію хлориду з сульфатною кислотою.
Спосіб Леблана відіграв велику ролъ у розвитку хімічної
промисловості та розробленні сировинних баз. Відхід содового виробництва НС1
переробляли на хлор і хлорні продукти: бемольне вапно і бертолетову сіль. З
відходу CaS отримували елементарну cіpкy (S).
Сама сода використовувалась як вихідний продукт для oтримання
багатьох натрієвих солей, наприклад, Na2CO3 (натрію
гідрокарбонат - харчова сода), NaOH (луг - каустична сода), NаНSОз, Na2SO3
та інші.
Содові заводи стали центром хімічної промисловості, яка
зароджувалась. У 1865 році бельгійським інженером Сольве було розроблено і
здійснено у промисловому масштабі аміачний спосіб отримання соди.
У цілому "аміачна сода" виходила більш дешевою та
кращої якості. Одночасно з розвитком аміачного способу отримування сод
ивдосконалювався і спосіб Леблана. Щоб не викидати в навколишнє середовище НС1,
було розроблено способи переробки HCl (водню хлорид) на хлор і хлоровмісні
продукти.
У ті роки содові заводи, які працювали за способом Леблана,
були єдиними постачальниками хлорних продуктів. Коли ж з 1890 р. став
поширюватися електрохімічний спосіб отримання хлору, виробництво соди за
способом Леблана поступово припинилось.
У більшості країн аміачний спосіб залишився провідним до
наших днів. Перший содовий завод, який працював за методом Леблана було збудовано
у Pocіі у l864 р. Аміачний спосіб став застосовуватися в Pocіі з 1883 р., коли
було побудовано завод у Березниках на базі Солікамського родовища кухонної
солі. В Україні в 1892 р. був побудований перший содовий завод у м.
Лисичанську, а в 1898 р. - в м. Слов'янську, який працював за способом
Гонігмана - менш досконалому в частині технологічної схеми й апаратури.
Цей спосіб був розроблений ще в 60-х роках XІX століття. Він
складається з декількох дуже раціонально оформлених стадій, що забезпечує
високу економічну ефективність і в даний час.
Сода являє собою натрію карбонат Na2CO3.
Сировиною для одержання служать природна поварена сіль NaCl і природний вапняк
CaCO3. Завдання процесу полягає в організації взаємного обміну іонами
Na+ і Ca2+.
Процес полягає в тому, що в результаті випалу вапняку CaCO3
одержують негашене вапно СаО і двоокис вуглецю СО2 за реакцією
(а). Останній реагує з NaCl і NH3 з утворенням амонію хлориду NH4Cl
і двовуглекислої соди NaHCO3 за реакцією (в). При нагріванні NaHCO3
відбувається її розкладання за реакцією (д) з утворенням цільового
продукту кальцинованої соди - Na2CO3 і діоксид вуглецю
повертається в процес. Хімічна схема процесу може бути представлена в такому
вигляді:

Рис. 1.1 - Хімічна схема виробництва кальцинованої соди
вапняний молоко реакторний технологічний
Оксид кальцію перетворюється в Ca(OH)2 за реакцією (б), а
потім взаємодіє з NH4Cl за реакцією (г) з утворенням газоподібного
аміаку і кальцію хлориду. Аміак повертається у виробничий цикл, а кальцію
хлорид виводиться з процесу як відхід.
Хімічна схема виробництва соди являє вдалий приклад кваліфікованого
оформлення хіміко-технологічного процесу. Саме цим пояснюється те, що,
незважаючи на великі успіхи хімічної технології, поки ще не знайдені більш
досконалі і більш дешеві способи одержання соди. Старий аміачний спосіб,
розроблений майже 150 років тому, успішно експлуатується і в даний час. Велику
частину соди в усьому світі одержують саме цим способом, навіть незважаючи на
великий його недолік, який полягає в тому, що одержуваний як відхід кальцію
хлорид поки не знайшов застосування. Його виводять із процесу у вигляді
водяного розчину і зливають у спеціально вириті котловани - «білі моря». Ці
«білі моря» отруюють ґрунт і водойми, що прилягають до них. Збереження й
утилізація величезних кількостей відходів кальцію хлориду, що накопичуються, є
важливою екологічною проблемою.
2. РОЗРОБКА ТЕХНОЛОГІЧНОЇ КОНЦЕПЦІЇ
2.1 Основні і допоміжні стадії
прийнятого до розробки способу
Виробництво кальцинованої соди за аміачним способом включає
вісім основних переділів (цехів або відділень):
. Одержання карбонатної сировини: видобування,
дроблення, сортування та транспортування.
. Перероблення карбонатної сировини: обпалювання,
охолодження та очищення карбон(ІV) оксиду, гасіння вапна з отриманням вапняної
суспензії.
. Очищення розсолу: взаємодія сирого розсолу з
реагентами в реакторах і відстоювання розсолу.
. Абсорбція: відмивання в відмивниках газів, що
виділяються на других стадіях, від аміаку, двох стадійне насищення розчину
натрію хлориду аміаком і частково карбон(ІV) оксидом, що потрапляють зі стадії
дистиляції, охолодження амонізованого розсолу.
. Карбонізація: відмивання від аміаку газу, що
відходить зі стадії карбонізації (супроводжується уловлюванням невеликих
кількостей карбон(ІV) оксиду), попередня карбонізація, карбонізація з
виділенням натрію гідрокарбонату в осаджуваних колонах, компримінування (перед
подачею в карбонізаційні колони) карбон(ІV) оксиду, що потрапляє зі стадій
перероблення карбонатної сировини і кальцинації.
. Фільтрація: відділення натрію гідрокарбонату на
фільтрах та відсмоктування повітря вакуум-насосами.
. Кальцинація: зневоднення і розкладення натрію
гідрокарбонату в содових печах, охолодження та очищення карбон(ІV) оксиду після содових
печей.
. Регенерація аміаку (дистиляція): попереднє
підігрівання і дисоціація в конденсаторі та теплообміннику дистиляції амонію
карбонатів і гідрокарбонатів, що містяться в фільтровій рідині, змішання і взаємодія
нагрітої рідини з вапняною суспензією в змішувачі та відгонка аміаку в
дистилері.
2.2 Принципова технологічна схема
В аміачному способі кальциновану соду отримують через
гідрокарбонат амонію за реакцією:
4HCO3 + NaCl ↔ NaHCO3 + NH4Cl
На содових заводах амонію гідрокарбонат отримують NH4
та СО2 безпосередньо у водних розчинах NaCl, тобто з хімічної точки
зору отримати натрію гідрокарбонат можна за реакцією:
+ NH3 + CO2 + H2O ↔
NaHCO3 + NH4Cl
Оскільки карбон(ІV) оксид погано розчиняється у воді за відсутності
аміаку, то практично спочатку розчин NaCl (розсіл) збагачують аміаком, а потім
отриманий амонізований розсіл обробляють CO2, тобто процес проводять
у дві стадії. Перша стадія поглинання аміаку протікає у відділені абсорбції, а
друга - поглинання СО2 - у відділені карбонізації.
Осад NaHCO3, який випав у процесі карбонізації,
відфільтровують, а далі він розкладається з отриманням соди за реакцією:
NaHCO3 Na2CO3 + CO2
+ H2O
Na2CO3 + CO2
+ H2O
В залежності від конструкції печі температура розкладання
NaHCO3 складає від 100 до 180 ºС. Ця операція проходить у
відділенні кальцинації. Карбон(ІV) оксид, який при цьому виділяється,
використовують у відділенні карбонізації.
Крім основних процесів на содових заводах здійснюється ряд
побічних, які не мають безпосереднього відношення до отримання соди. Амонію
хлорид (NH4Cl), який утворюється за реакцією (2.2), завод може
випускати як додатковий головний продукт. Однак зазвичай на содових заводах
аміак регенерують із амонію хлориду і повертають назад у виробництво. Із цією
метою гідрокарбонатний маточний розчин, який містить NH4Cl,
обробляють вапняним молоком за реакцією:
NH4Cl + Ca(OH)2 → 2NH3
+ 2H2O + CaCl2.
Аміак, який утворюється, відганяють із розчину і направляють
у відокремлення абсорбції.
Розчин кальцію хлориду (CaCl2) є відходом
виробництва. Операція регенерації аміаку протікає відокремлено від дистиляції.
На деяких заводах розчин кальцію хлориду використовується для отримання
продукційного CaCl2.
Для отримання вапняного молока потрібен кальцію оксид (СаО),
який на содових заводах отримують шляхом випалювання карбонатної сировини
(крейди або вапна) у вапняно-випалювальних печах за температури від 1100 до
1200ºС за реакцією:
3 → CaO + CO2.
Карбон(ІV) оксид, який утворюється при цьому, використовують
у процесі карбонізації, а вапно (СаО) гасять надлишком води з отриманням
вапняного молока за реакцією:
+ H2O ↔ Ca(OH)2.
І, нарешті, на всіх содових заводах проводиться попередня
очистка водного розчину натрію хлориду (сирого розсолу) від домішок - солей
кальцію, магнію за допомогою Na2CO3 і Ca(OH)2.
У процесі очищення утворюються практично нерозчинні Mg(OH)2 та CaCO3,
які випадають в осад:
2 + Ca(OH)2 ↔ Mg(OH)2 + CaCl2
; (2.7)2 + Na2CO3 → CaCO3
+ 2NaCl. (2.8)
Потім осад Mg(OH)2 та CaCO3 відокремлюють,
а очищений розсіл надходить у виробництво.
Принципова схема виробництва соди аміачним методом наведена в
додатку А.
2.3 Технологічні розрахунки
основного реакторного процесу
.3.1 Фізико-хімічні основи процесу
Процес гасіння полягає у взаємодії кальцію оксиду з водою за
реакцією:
(тв)+ H2O(р) ↔ Ca(OH)2(тв)+
65,4 кДж/моль.
Реакція супроводжується великим екзотермічним ефектом,
збільшенням об’єму твердої фази за використанням звичайного вапна і
самодиспергyванням вихідного вапна. У табл. 2.3.1 наведена коротка
характеристика вихідних речовин і продукту реакції.
Кальцію гідроксид не утворює стійких гідратів. Тому звичайно
надлишок води, що міститься в різних зразках гідроксиду (до 1 моль на 1 моль
СаО) пов’язаний силами поверхневої адсорбції і залежить від умов протікання
реакції гасіння, питомої поверхні і терміну зберігання.
Таблиця 2.1 - Характеристика речовин відділення гасіння
|
Властивість
|
Речовина
|
|
СаО
|
Н2О
|
Са(ОН)2
|
|
Молекулярна маса
|
56,1
|
18,0
|
74,1
|
|
Густина, кг/дм3
|
3,36
|
1,0
|
2,24
|
|
Мольний об’єм, дм3/кмоль
|
16,7
|
18,0
|
33,1
|
|
Пористість під час випалювання,%
|
34-55
|
-
|
-
|
Розчинність кальцію оксиду і гідроксиду обернено пропорційна
температурі в інтервалі 0 ≤ t ≤ 100 °С і визначається за формулами:
 ,
% мас; (2.10)
,
% мас; (2.10)
Процеси гідратації вапна класифікують залежно від мольного
відношення взаємодіючих реагентів (водовапняне відношення).
Сухою гідратацією або сухим гасінням називають процес, під
час якого вода, що надходить на гасіння вапна, повністю витрачається на хімічні
реакції і випаровування. Продукт такої гідратації являє собою сухий порошок.
Водовапняне відношення за сухої гідратації залежить від фізико-хімічних властивостей
вихідного вапна і зазвичай становить близько 2.
Більш поширеним є процес мокрої гідратації, під час якого
отримують тістоподібний продукт або вапняну суспензію.
На кінетику процесу гідратації, фізико-хімічні параметри
одержуваної вапняної суспензії і вихід готового продукту впливають такі основні
фактори:
вид, структура і хімічний склад карбонатної породи;
температура і тривалість випалювання;
наявність домішок у застосовуваному паливі;
гранулометричний склад вапна, час та умови його зберігання;
температура води;
водо-вапняне відношення;
спосіб та інтенсивність перемішування в процесі гідратації;
застосування добавок і т.д.
Видаляють такі основні стадії процесу гідратації вапна, які в
практичних умовах можуть накладатися або заміняти одна одну:
. Абсорбція і капілярне проникнення води в глиб часток вапна.
. Розчинення кальцію оксиду.
З. Утворення та дисоціація проміжногоз’єднання.
. Зародкоутворення і кристалізація Са(ОН).
. Агломерація твердої фази та структурування суспензії.
В процесі сухої гідратації друга і четверта стадії відсутні.
В процесі мокрої гідратації будь-яка з перших чотирьох стадій може виявитися
лімітуючою. Так, найбільше впливають на першу і другу стадії процесу гідратації
вигляд, структура і хімічний склад вихідної карбонатної сировини, а також умови
її обпалювання. Тому для кожної конкретної вапняної сировини встановлюють
оптимальну температуру і тривалість випалювання, вид палива коефіцієнт надлишку
повітря, розміри шматків гартованого матеріалу і т.д.
Вапно, що отримане за низьких температур мас велику
поверхневу активність і внутрішню змочуваність із-за розгалуженого характеру
пір; процес гасіння протікає з високою швидкістю і характеризується значним
підйомом температури.
Загальне збільшення швидкості гетерогенного процесу неминуче
викликає зміну співвідношення швидкостей окремих стадій. З підвищенням ступеня
подрібнення і пористості вапна зростає пересичення розчину кальцію гідроксиду.
Це призводить до збільшення швидкості процесу утворення зародків і зниження
швидкості росту окремих кристалів, шо обумовлює стійкість вапняної суспензії.
Із збільшенням температури швидкість гідратації зростає
згідно рівняння:
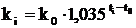 ,
(2.12)
,
(2.12)
де  - константа швидкості за температури
- константа швидкості за температури 
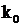 -
константа швидкості за температури
-
константа швидкості за температури  .
.
Це свідчить про лімітування реакції гасіння дифузійними процесами.
В процесі мокрого гасіння інтенсивне перемішування збільшує ступінь
диспергування і швидкість гасіння (особливо на кінцевій стадії процесу).
Домішки, що впливають на процес гасіння можна розділити на дві групи:
домішки, що потрапляють в зону реакції у твердій (тобто з вапном і паливом) і в
рідкій фазах. Домішки, що містяться в сирої карбонатної породі і паливі в
основному побічно впливають на процес гасіння, впливаючи на ступінь
декарбонізації, структуру та активність вапна.
Деякі твердо фазні домішки безпосередньо впливають на кінетику гідратації
і якість вапняної суспензії. Так Fе2О3, TіО2, Сr2O3
сповільнюють процес гідратації, а добавка 5 % (мол.) MgO зменшує
швидкість реакції на третину. Покриття із СаСО3, на поверхні
гальмує, але не запобігає гідратації. Добавка кальцію сульфату суттєво уповільнює
процес. Домішки Аl2О3 підвищують в’язкість вапняного
молока.
Велике значення має проблема впливу розчинних домішок, що містятьсяв
рідині, яка подається на гасіння, на процес гасіння вапна, що обумовлено
перспективністю використання промислових стоків содових заводів (наприклад,
дистилерної рідини) для отримання вапняної суспензії. Ці домішки впливають на
кінетику реакції гасіння, її тепловий ефект, фізико-хімічні властивості
вапняної суспензії і навіть на кристалічну модифікацію Са(ОН)2.
Швидкість гідратації збільшується за допомогою добавок рідких лугів, кальцію
хлориду, натрію хлориду. Іон  не
тільки уповільнює процес гасіння, але й сприяє утворенню грубо дисперсної,
вапняної суспензії, що швидко освітлюється.
не
тільки уповільнює процес гасіння, але й сприяє утворенню грубо дисперсної,
вапняної суспензії, що швидко освітлюється.
Чим більша швидкість гасіння, тим вищий ступінь дисперсності
отримуваного вапняного молока. Так при підвищенні температури води, яка
подається на гасіння, зростає не тільки швидкість гасіння, але й ступінь
дисперсності отримуваної суспензії. На содових заводах початкова температура
води, що подається складає 60…80 °С.
2.3.2 Обґрунтування обраного технологічного
режиму
До найбільш важливих регламентованих показників, які характеризують
якість вапняного молока і забезпечують нормальну роботу відділення дистиляції,
належать концентрація Са(ОН)2 або вільного СаО і температура
вапняного молока. На содових заводах концентрацію вільного СаО у вапняному
молоці називають титром молока, оскільки її визначають титруванням молока
соляною кислотою у присутності індикатора - фенолфталеїну.
Для виробництва необхідно, щоб вміст Са(ОН)2 у вапняному
молоці був вищим, оскільки при цьому зменшується об’єм дистилятної рідини, а от
же підвищується продуктивність відділення дистиляції, знищуються витрати пари
та трати вапна й аміаку з рідиною дистиляту. Однак, з іншого боку, за надто
високої концентрації Са(ОН)2 підвищується в’язкість суспензії,
ускладняється робота гасителя та інших апаратів. Практика показала, що гранично
допустима концентрація Са(ОН)2 у вапняному молоці (титр) не перевищує
250 н.д. (нормальних ділень) або 35 % (мас).
Температура вапняної суспензії не перевищує 90 °С. Побічно можливість
підвищення температури вапняної суспензії обмежена необхідністю зберігати її в
порівняно великих буферних ємностях - мішалках, при цьому вапняна суспензія
остигає.
Продуктивність гасителя визначається потребою виробництва реакційно
здатному кальцію оксиду з урахуванням ступеня диспергування цього компоненту в
апаратах відділення гасіння та його виробничих трат у відділенні регенерації
аміаку. Витрата рідини, що подається на гасіння , є параметром регулювання,
залежним від витрати вапна і регламентованої концентрації вапняної суспензії.
Продуктивність підтримується шляхом регулювання подачі вапна на гасіння
і залежить від кількості вапняної суспензії, що витрачається споживачами.
.3.3 Матеріальний баланс
Розрахувати матеріальний баланс процесу гасіння вапна за реакцією:
 ,
(2.13)
,
(2.13)
Розрахунок вести на 1000 кг Ca(OH)2, концентрацією
35%, якщо у вихідному СаО міститься 80% СаО, 8% СаСОа
інше домішки. Врахувати ступінь використання СаО - 95%.
Розрахунок матеріального балансу:
Схема матеріальних потоків одержання гашеного вапна наведена
на рис. 2.1.

Рис. 2.1 - Схема матеріальних потоків одержання гашеного вапна
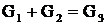 .
(2.14)
.
(2.14)
На схемі прийнято такі позначення.
 -
маса вапна, кг. Склад цього потоку:
-
маса вапна, кг. Склад цього потоку:
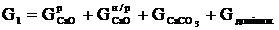 .
(2.15)
.
(2.15)
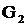 -
маса води, кг. Склад цього потоку:
-
маса води, кг. Склад цього потоку:
 (2.16)
(2.16)
 -
маса гашеного вапна. Склад цього потоку:
-
маса гашеного вапна. Склад цього потоку:
 .
(2.17)
.
(2.17)
Розраховуємо масу гашеного вапна за формулою:
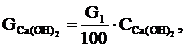 (2.18)
(2.18)
де  - маса гашеного вапна, кг;
- маса гашеного вапна, кг;
 -
концентрація гашеного вапна, %.
-
концентрація гашеного вапна, %.
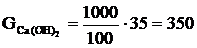 кг.
кг.
Масу вапна, яке прореагувало визначаємо по формулі:
 (2.19)
(2.19)
де  - маса вапна, яке прореагувало, кг;
- маса вапна, яке прореагувало, кг;
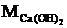 -
молярна маса кальцію гідроксиду, кг/кмоль;
-
молярна маса кальцію гідроксиду, кг/кмоль;
 -
молярна маса вапна, кг/кмоль.
-
молярна маса вапна, кг/кмоль.
 кг.
кг.
Масу непрореагованого вапна розраховуємо по формулі:
 (2.20)
(2.20)
де  - маса непрореагованого вапна, кг;
- маса непрореагованого вапна, кг;
 -
ступінь використання прореагованого вапна, %;
-
ступінь використання прореагованого вапна, %;
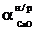 -
ступінь непрореагованого вапна, %.
-
ступінь непрореагованого вапна, %.
 кг.
кг.
 (2.21)
(2.21)
де 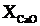 - відсотковий вміст вапна, %.
- відсотковий вміст вапна, %.
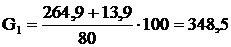 кг.
кг.
Масу вапняку розраховуємо по формулі:
 (2.22)
(2.22)
де  - маса вапняку, кг;
- маса вапняку, кг;
 -
відсотковий вміст вапняку, %.
-
відсотковий вміст вапняку, %.
 кг.
кг.
Масу домішок розраховуємо по формулі:
 (2.23)
(2.23)
де  - маса домішок, кг;
- маса домішок, кг;
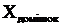 -
відсотковий вміст домішок, %.
-
відсотковий вміст домішок, %.
 кг.
кг.
Розраховуємо масу води, що прореагувала:
 (2.24)
(2.24)
де 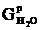 - маса води, що прореагувала, кг;
- маса води, що прореагувала, кг;
 -
молярна маса води, кг/кмоль.
-
молярна маса води, кг/кмоль.
 кг.
кг.
Розраховуємо масу води, яка не прореагувала:
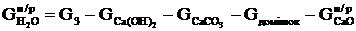 .
(2.25)
.
(2.25)
де 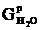 - маса води, що не прореагувала, кг;
- маса води, що не прореагувала, кг;
 кг.
кг.
Результати розрахунків заносимо в табл. 2.2.
Таблиця 2.2 - Матеріальний баланс гасіння вапна.
|
Прихід
|
Витрата
|
|
Потік
|
маса
|
Потік
|
маса
|
|
кг
|
%
|
|
кг
|
%
|
|
1. Вапно
|
348,5
|
100
|
3. Гашене вапно
|
1000
|
100
|
|
в т. ч. СаОр СаОн/р СаСО3
Домішки
|
264,9 13,9 27,9 41,8
|
76,0 4,0 8,0 12,0
|
в т.ч. Са(ОН)2 СаОн/р СаСО3
Н2Он/р Домішки
|
350 13,9 27,9 566,4 41,8
|
35 1,4 2,8 56,6 4,2
|
|
2. Вода
|
651,5
|
100
|
|
|
|
|
Н2Ор Н2Он/р
|
85,1 566,4
|
13,1 86,9
|
|
|
|
|
Всього:
|
1000
|
Всього:
|
1000
|
. АПАРАТУРНО-ТЕХНОЛОГІЧНА СХЕМА
3.1 Опис технологічної схеми
Технологічна схема відділення гасіння включає дві основні
операції: гасіння вапна гарячою водою та очищення вапняного молока від великих
шматків необпаленої карбонатної сировини, дрібних зерен недопалу та інших
нерозчинних домішок.
Схема приготування вапняного молока наведена в додатку Б.
З робочого бункера 2 вапно подається лотковим живильником 1
до обертаючого барабану-гасителя 3, куди одночасно надходять нагріта вода та
вода після промивання побутових домішок вапна (слабке вапняне молоко). В
Процесі гасіння в гасителі 3 утворюється вапняне молоко з домішками твердих
частинок різного розміру, яке поступає в сортувальний барабан 5, який
представляє собою сито з отворами розміром 40 мм. Сортувальний барабан є
продовженням гасителя, обертається разом із ним і служить для відокремлення від
вапняного молока великих кусків недопалу (розміром більш 40 мм). У кінці
барабану 5 ці куски промиваються гарячою водою, поступають на транспортер 6 і
передаються вапняних печей для повторного обпалювання. Сортувальний барабан 5
закритий кожухом, обладнаний двома витяжними трубами для виділення водяної
пари, яка утворюється в гасителі. Одна труба іде до конденсатора 4, де пар із
гасителя підігріває воду, яка витрачається на гасіння, а друга труба виведена в
атмосферу на випадок ремонту або чистки конденсатора.
Вапняне молоко разом із твердими частинками розміром менше 40
мм, які проходять через отвори у барабані 5, поступає в сортувальний барабан 7
(перфороване сито, яке обертається з отворами 2×10
мм). Тут від
вапняного молока відокремлюються частинки розміром більше 2 мм, і воно
пройшовши сито, попадає в приймач кожуха, що має форму конуса, в який замкнений
сортувальний барабан, і далі піддається остаточному очищенню від домішок у
класифікаторі 14.
Шлам, що осідає на дня класифікаторі, вигрібається ритковим
механізмом, промивається гарячою водою і поступає у мішалку шламу 13.
Концентроване молоко, що звільнене від шламу 3, подається в мішалку вапняного
молока15 і далі у відділення дистиляції.
Тверді частинки розміром більше 2 мм, які залишаються в
сортувальному барабані 7, під час обертання барабану поступово перемішуються у
вздовж нього і вивантажуються в шнек 8 за допомогою якого вони передаються в
шаровий млин мокрого помелу 9. У млині одночасно за розміром відбувається гасіння
вапна, яке прискорюється в наслідок розмелу кусків. Слабе вапняне молоко, яке
утворюється у млині, разом із домішками перетікає в мішалку 10, і далі для
очищення від шламу відточується відцентровим насосом (в/ц) у віброгрохот 11.
Шлам із віброгрохоту поступає в мішалку не придатного шламу 13, а очищене
слабке вапняне молоко направляється в мішалку 12, звідки насосом подається в
гаситель.
Шлам із класифікатора і віброгрохоту розбавляється в мішалці
13 відкидною рідиною дистилеру і за допомогою (в/ц) насоса передається у
покидьок (накопичувач побутової рідини так зване «біле море»).
3.2 Вибір типів основних апаратів
Гаситель вапна. Він представляє собою стальний зварений
барабан діаметром 1,75…2,5 м і довжиною 12…15 м, який опирається бандажами на
дві пари роликів і обертається з частотою 3…6 об/хв. Корпус гасителя зроблено
із листової сталі товщиною 12…15 мм і захищений у середині стальною сорочкою
(товщина 10 мм) від механічного впливу твердих частинок вапняного молока.
Барабан встановлюють із нахилом 0,5° у сторону виходу
вапняного молока. Для прискорення переміщення вапна і кращого його
перемішування в середині барабана приварені 6 смуг на відстані 60° одна від
одної по окружності.
З обох сторін гаситель закритий кришками, які мають
центральні отвори, через які з однієї сторони з бункера 2 за допомогою
лоткового живильника 1 подається вапно,вода і слабке вапняне молоко, а з другої
- вивантажується концентровані та великі тверді потупи. Останні видаляються з
гасителя спеціальними вивантажуючими ковшами, в які в процесі вивертання
барабана попадають в нерозкладені куски недопалу. Ці куски вивантажують в
сортувальний барабан крупного недопалу 10, який служить продовженням гасителя.
У теперішній час випробується гаситель із проти точним рухом
вапна та води.
Барабан грохоту зварено зі стальних листів товщиною 10…12 мм,
яких просвердллено отвори діаметром 40 мм. До внутрішньої поверхні барабану
приварено спрямовуючі кутники. Нерозкладені куски розміром більше 40 мм
представляють собою недопал, із сортувального барабану їх направляють на
повторне випалювання. Сортувальний барабан закритий кожухом 9, обладнано двома
витяжними трубами для виділення в гасителі пару, який утворюється.
Усе інше обладнання у відділенні гасіння вапна (змішувачі,
грохот, шнек, транспортер, в/ц насоси) є стандартними.
ВИСНОВОК
Сода має важливе значення в людській діяльності. Необхідно
нарощувати потужності содових заводів, удосконалюючи технологічні процеси
виробництва соди, знижуючи енергетичні витрати та собівартість соди. Для
майбутніх фахівців у галузі виробництва соди необхідно:. Глибоке вивчення фізико-хімічних
основ технологічних процесів у виробництві соди.
. Удосконалення обладнання содових заводів, при зниженні їх
енерговитрати і підвищенні продуктивності.
. Розроблення та впровадження нових типів апаратів у содовому
виробництві.
. Удосконалення методів контролю та управління технологічними
процесами за рахунок використання нових систем управління.
СПИСОК ЛІТЕРАТУРИ
1. Кожухар
В.Я. Сода. Навчальний посібник / В.Я. Кожухар., В.Г. Рябих, В.В. Брем, Л.В.
Іванченко. - Одеса: Сімекс-прінт, 2012 - 208 с.
. Дыбина
П.В. Расчеты по технологии неорганических веществ / П.В. Дыбина - М.: Высшая
школа, 1967. - 522 с.
. Загальна
хімічна технологія: [підруч. для студентів вищих навч. закл.] / В.Т. Яворський,
Т.В. Перекупко, З.О. Знак, Л.В. Савчук. - Львів: Національний університет
«Львівська політехніка», 2005. - 552 с.
. Методи
розрахунків у технології неорганічних виробництв: підруч. для студентів вищих
навч. закл. /[Лобойко О.Я., Товажнянський Л.Л., Слабун І.О. та ін.]. за ред.
проф. О.Я. Лобойка і проф. Л.Л. Товажнянського. - Х.: НТУ «ХПІ», 2001. - 512 с.