Расчет кривой титрования соляной кислоты
Задание
Рассчитать кривую титрования при
следующих условиях: титруется раствор сильной кислоты HCl объёмом 75 см3
и молярной концентрацией 0.1 моль/дм3,раствором слабого основания
гидроксидом аммония NH4OH с молярной концентрацией 0.25 моль/дм3.
По расчетам построить кривую
титрования, определить точку эквивалентности, прямую нейтральности.
Определить интервал перехода
окраски, подобрать индикатор, вычислить ошибку индикатора, написать вывод.
Физическая модель C(1/1HCl)=0.1
моль/м3, V=75 см3.

Введение
Объемным (титрометрическим) методом
анализа называют метод количественного анализа, основанный на измерении
количества реагента, требующегося для завершения реакции с данным количеством
определяемого вещества. Метод заключается в том, что к раствору определяемого
вещества постепенно прибавляют раствор реактива известной концентрации.
Добавление реактива продолжают до тех пор, пока его количество не станет
эквивалентным количеству реагирующего с ним определяемого вещества. Таким
образом, этот метод основан на точном измерении объема реакции затраченного на
реакцию с определенным компонентом. При титровании употребляют не избыток
реактива, а количество его химически эквивалентное определяемому веществу.
Поэтому очень важно в ходе титрования установить момент окончания реакции или
определить так называемую точку эквивалентности. Обычно ее устанавливают по
изменению окраски индикатора. Достигнув точки эквивалентности, титрование
прекращают. По затраченному объему титранта к его концентрации вычисляют
результат анализа. В этом методе очень важное значение имеет точное
установление точки эквивалентности. Практически точку эквивалентности
устанавливают индикаторным методом по изменению окраски индикатора.
Расчет кривой титрования
кривая титрование соляная кислота
В основе титрования HNO3
гидроксидом натрия лежит реакция:
+ NH4OH NH4Cl
+ H2O - в молекулярной форме- + H+ = H2O
- в ионной форме
- гидроксид натрия является сильным
основанием и имеет константу диссоциации, значение силового показателя которой
равно.
1. Определяем какой объем NaOH
потребуется для титрования 75 см3 HCl:
бюр = СК*VK*X%/Cбюр*100 см31
= 0.1*75*0/0.25*100 = 0 см32 = 0.1*75*99.9/0.25*100 =
29,97 см3 3 = 0.1*75*100/0.25*100 = 30 см3 4
= 0.1*75*100.1/0.25*100 = 30,03 см3 5 =
0.1*75*200/0.25*100 =60 см3
Где 0.5 - молярная концентрация
эквивалента HNO3, моль/дм3;
- объем колбы, см3;
.25 - молярная концентрация NН4OH,
моль/дм3.
2. В начальный момент у нас
имеется раствор сильной кислоты. Не учитывая изменения ионной силы раствора,
определим водородный показатель раствора pH по формуле:
рН = -lg [Н+ ],
В этом примере C[1/1HCl]=0.1
моль/дм3, тогда:
%:pH = -lg [Н+ ] = -lg
0.1 = 1
Молярную концентрацию эквивалента
кислоты в процессе титрования рассчитываем по формуле:
[Н+ ] = (CK*VK
- Cосн*Vосн)/(VK + Vосн)
.9%: С[Н+ ] = (0.1*75 -
0.25*29,97)/(75+29,97) = 0.00003 = -lg 0.00003 = 4.52288
%: С[Н+ ] = ((0.1*75 -
0.05*150)/(75+150))+10-7 = 0+10-7=10-7
[Н+ ][OH-]=10-14,
[Н+ ]=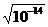 =10-7,
pH= -lg10-7=7
=10-7,
pH= -lg10-7=7
За точкой
эквивалентности наблюдается избыток щелочи. В этом случае расчет pH, без учета
разбавления, проводится по формуле расчета pH сильного основания:
= 14 - pOH, = -lg [ОH-]=-lg[C1/1
NaOH*V(NaOH)/V(HCl)+ V(NaOH)]
.1%: pOH= -lg [ОH-]=-lg[0.05*150.15/75+150.15]=
-lg0.03334=1.47703= 14 - 1.47703=12.52297
%: pOH= -lg [ОH-]=-lg[0.05*300/75+300]=
-lg0.04=1.39794
Проведение таких
расчетов удобнее производить в таблице.
Таблица1 - Изменение pH
при титровании 75 см3 раствора HCl с молярной концентрацией 0.1
моль/дм3 раствором NaOH концентрацией 0.45 моль/дм3.
|
Х%
|
V бюретки
|
Что в колбе
|
Уравнение
|
рН
|
0 0 HCl
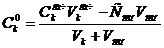
|
рН = -lg [Н+ ]1
|
|
4.52288
|
|
99.9
|
149.85
|
|
|
|
|
100
|
150
|
NaCl
|
pH= -lg[Н+ ][OH-]
|
7
|
|
100.1
|
150.15
|
NaCl +NaOH
|
pH = 14 - pOH
|
12.52297
|
|
200
|
300
|
|
|
12.60206
|
Выбор индикатора
По скачку титрования из справочника
Лурье выбираем индикатор Фенолфталеин (переход цвета от бесцветного к
красному).
Его область pH = 4.3 - 9.7.
Найдем рТ = ½*(4.3 + 9.7) = 7.
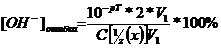 =
=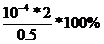 =0.04%
=0.04%
Так как индикаторная
ошибка меньше 0.1%, то индикатор выбран правильно. Таким образом фенолфталеин
для титрования подходит.
pH
V(NaOH)
0
Вывод
Я рассчитывал кривую титрования при
следующих условиях: титруется раствор сильной кислоты HCl с молярной
концентрацией эквивалента 0,1 моль/дм3, объемом 75см3
раствором сильного основания NaOH с молярной концентрацией эквивалента 0,05
моль/дм3.
По расчетам построил кривую
титрования, определил точку эквивалентности линию нейтральности. Определил
интервал перехода окраски, подобрал индикатор, вычислил ошибку индикатора.
Таким образом, использование кривых
титрования позволяет выбрать наиболее оптимальный вариант индикатора,
соответствующий скачку рН на данной кривой титрования. В нашем случае при
титровании NaOH и HCl можно использовать индикатор фенолфталеин, т.к
относительная ошибка незначительная.
Список использованной
литературы
1. Алексеев В.Н.
Количественный анализ. М.,”Химия” 1972-504c/
2. Крешков А.П.
Основы аналитической химии. М., ”Химия”1971-456с.
. Зингель
Э.М.Расчет кривых титрования. Красноярск: СибГТУ, 2002-38с.