Получение окиси пропилена
Курсовая работа
Получение окиси пропилена
ВВЕДЕНИЕ
Окись пропилена является крупнотоннажным сырьем для производства целого
ряда важнейших продуктов нефтехимии, таких как полиуретаны, гликоли,
косметические средства, медицинские препараты и др. Жесткий пенополиуретан,
получаемый на основе окиси пропилена, через взаимодействие пропиленгликоля с
многоатомными спиртами, широко применяется во всем мире в строительстве,
производстве мебели, транспорте, обувной промышленности. Применение пенополиуретанов
для теплоизоляции позволяет решить наиболее серьезную проблему современности -
проблему энергосбережения. Есть мнение, что количество потребляемого страной
полиуретана является показателем ее экономической стабильности.
Окись пропилена, или 1,2-эпоксипропан применяется в качестве фумиганта
для стерилизации упакованных продовольственных продуктов и других материалов.
Кроме того, окись пропилена является исходным сырьем для получения
пропиленкарбоната, изопропаноламинов, полиоксипропиленполиолов, полипропиленоксида,
пропиленоксидных каучуков, пропиленсульфида, некоторых ПАВ. Пропиленоксид -
промежуточный продукт в синтезе эфиров пропиленгликоля, эпихлоргидриновых
каучуков, полиуретанов и полиэфирных смол. [Н.А. Платэ и др, 331-338 с]
Окись пропилена обладает цитотоксичным и мутагенным действием, вызывает
расстройства гемодинамики. Воздействие этого вещества вызывает раздражение
кожи, глаз и дыхательных путей, угнетение центральной нервной системы, атаксию,
ступор и кому (последние в настоящее время наблюдались только у животных).
Было доказано, что окись пропилена или 1,2-эпоксипропан действует как
непосредственный алкилирующий агент для различных тканей, повышая, таким
образом, вероятность образования опухолей. Несколько экспериментов на животных
убедительно доказали и канцерогенность этого соединения. Основное
неблагоприятное воздействие на людей заключается в жжении и образовании пузырей
на коже при длительном контакте с этим нелетучим соединением. Это может
произойти даже при низких концентрациях окиси пропилена. Сообщалось также об
ожогах роговицы, вызванных с этим веществом. [#"876765.files/image001.gif">
Пропилен и Cl2 смешивают в эквимолярных количествах с избытком
Н2О (4-7 кратный). Реакцию проводят при 35-40оС, поддерживая
концентрацию пропиленхлоргидрина не более 4-6% масс. для уменьшения количества
побочных продуктов - дихлорпропана и дихлорпропилового эфира. Избыток пропилена
отделяют и возвращают в реакцию. На следующей стадии при комнатной температуре
водный раствор смеси пропиленхлоргидринов обрабатывают избытком известкового
молока - раствора Ca(OH)2. Образующийся оксид пропилена отгоняют для
предотвращения гидратации в гликоль.
Этот метод имеет недостатки, связанные с использованием дорогостоящих
свободного хлора и гидроксида кальция, а также с образованием больших количеств
разбавленного (5-6%) раствора хлорида кальция. [#"876765.files/image002.gif">С раствором NaOH после электролиза, а образующийся раствор
NaCl используют для растворения NaCl, направляемого на электролиз.
1.2.2 Пероксидный способ получения окиси пропилена
Начиная с 1968 г. появился альтернативный вариант − пероксидный,
так называемый халкон-процесс, основанный на взаимодействии пропилена с
гидропероксидами (например, третичным бутилпероксидом ):

Процесс проводят при температуре 100-120°С и давлении 2-3 МПа на катализаторе,
содержащем оксид молибдена. Селективность данного метода достигает 99%. Вполне
вероятно, что этот метод со временем полностью заменит хлоргидринный процесс.
Разновидностью пероксидного способа синтеза пропиленоксида является
окисление олефинов надкислотами (реакция Прилежаева). Оксид пропилена
образуется при взаимодействии пропилена с надуксусной или надпропионовой
кислотой, получаемыми окислением ацетальдегида или пропионовой кислоты. Этот
вариант синтеза окиси пропилена широкого применения не нашел. [Н.А. Платэ и др,
335 с]
1.2.3 Кумольная технология получения окиси пропилена
Кумольная технология получения окиси пропилена характеризуется высокой
конверсией (99,5%) и селективностью (98-99,3%). При этом на 1 т окиси пропилена
требуется: 0,78 т пропилена, 0,21 т кумола, 0,06 т водорода. Технология
апробирована в опытно-промышленном масштабе.
1.2.4. Совместное производство окиси пропилена и стирола
Эта технология реализована в России в промышленном масштабе на ОАО
"Нижнекамскнефтехим". Совместное производство окиси пропилена и
стирола вступило в строй действующих в декабре 1982 г. Уникальность его в том,
что в мире подобных производств всего четыре.
1. Сырьем служит этилбензол, который после окисления кислородом воздуха
при температуре 130°С превращается в гидропероксид и далее взаимодействует в
присутствии молибденсодержащих катализаторов при температуре 90-100°С и
давлении 1,6-6,5 МПа с пропиленом по реакциям:
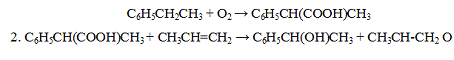
. Дегидратация метилфенилкарбинола при 180-280оС в присутствии TiO2 в
процессе совместного получения стирола и окиси пропилена протекает согласно
следующему механизму:
С6Н5СН(OH)CH3 → C6H5CH=CH2
+ H2O [#"876765.files/image005.jpg">
Поскольку присоединение хлора идет значительно быстрее, чем присоединение
хлорноватистой кислоты, нужно по возможности подавлять реакцию хлора с
пропиленом. Для этого взаимодействие хлора с водой следует проводить в
отдельной колонне. Собственно хлоргидринирование происходит в следующей второй
колонне. Большое значение имеет хороший контакт между жидкой фазой и
углеводородом. Целесообразно выбрать двухкамерную установку. [Н.А. Платэ и др,
335 с]
Недиссоциированная кислота всегда присоединяется по двойной связи. В
присутствии буферного бората (рН = 10) хлоргидрин практически не образуется,
между тем как в кислой среде (рН = 4,7) наступает хлоргидринирование.
Увеличение диссоциации равносильно уменьшению выхода хлоргидрина.
Так как степень диссоциации слабых кислот возрастает пропорционально
температуре, то хлоргидринирование при повышенных температурах идет, в
принципе, хуже.
Константа диссоциации НОСІ при 25°С равняется 1,05-10’7. Если определить
с помощью термодинамических характеристик показатель константы диссоциации для
65°С, то можно установить изменение только на одну десятую степени, которое так
мало, что не имеет практического значения.
По теории реакция взаимодействия должна проходить с образованием 1 моль
хлоргидрина на 1 моль НС1. Однако аналитическое исследование процесса
свидетельствует о избытке соляной кислоты.
Соотношение пропиленхлоргидрина и соляной кислоты зависит от температуры
и концентрации хлоргидрина, соотношения пропилен: хлор, концентрации пропилена
в исходном газе и от аппаратурного оформления процесса. С повышением
температуры растет избыточное количество соляной кислоты, которое может
достигнуть, например, при 75-80°С примерно 50%. При 40°С избыток колеблется в
пределах 6-10% при концентрации пропиленхлоргидрина 50 г/л. Омыление
пропиленхлоргидрина происходит так же, как омыление этиленхлоргидрина, однако
оно протекает примерно в 20 раз быстрее.
Уменьшение констант скорости во время реакции обмена можно объяснить
протеканием вторичных реакций. Действительно, окись пропилена реагирует с
образованием промежуточного соединения, которое затем медленнее омыляется. Это
нужно учитывать при промышленном производстве и быстро удалять образовавшуюся
окись пропилена из реакционного раствора.
При промышленном получении процесс лучше всего идет в реакторе с двойной
камерой, который применяется для превращения этиленхлоргидрина. При сравнимых
рабочих условиях выход в таком реакторе составляет 87,5% пропиленхлоргидрина с
одновременным образованием 11,0% пропилендихлорида и 1,5% ди -
хлордиизопропилового эфира. В противоположность этому реактор с одной камерой
дает только 69,2% продукта, одновременно 21,6% прореагировавшего пропилена
высаждается в виде пропилендихлорида, а 9,2% превращается в
дихлордиизопропиловый эфир. Это свидетельствует о несомненном превосходстве
двухкамерной системы для процесса превращения пропилена в хлоргидрин. В первой
камере такой установки хлор растворяется вместе с подаваемой свежей водой в
циркулирующем пропиленхлоргидрине, разбавленном водой. После введения хлора-
смесь подается во вторую камеру, где попадает в поток пропилена, и реакция
заканчивается.
При хлоргидринировании пропилена нельзя избежать образования побочных
продуктов, так как в растворе хлоргидрина наряду со свободной НОСІ имеются еще
свободные НС1 и С12. Реагируя с пропиленом, С12 вызывает образование
1,2-дихлорпропана, а в результате реакции с пропиленхлоридрином получается
дихлордиизопропиловый эфир.
Как и в случае этиленхлоргидрина, для подавления побочных реакций
желательно работать при температуре ниже 50-60 °С. При этих условиях
этилендихлорид можно в значительной степени вывести из верха колонны газовым
потоком и предотвратить образование второй фазы в реакторе. При реакции
превращения пропилена более тяжелый дихлорид не позволяет работать с чистым
пропиленом. Тем не менее, дихлорид можно отогнать во время реакции обмена при
50-60 °С, использовав поток углеводорода, содержащий более 45% пропилена. Не
вступивший в реакцию газ содержит инертные газы: метан, этан, пропан или азот.
При начальном контакте с пропиленовым потоком водная фаза должна содержать не
более 0,5 г/л хлора.
Концентрация самого раствора хлоргидрина также не должна значительно
повышаться, так как это способствует протеканию побочных реакций (рис. 1, 2).
Из этого следует, что концентрацию продукта нельзя привести к экономическому
показателю при однократном прохождении через аппарат и приходится использовать
вышеописанную циркуляционную систему. Концентрация пропиленхлоргидрина на
выходе из реактора влияет на конечный результат в гораздо большей степени, чем
при реакции обмена этилена. При 45°С и концентрации хлора 0,15 г/л в случае с
пропиленом получается 97% качественного продукта.
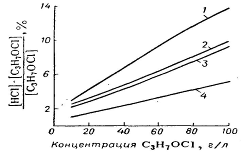
- 1 г/л хлора, 45 оС; 2 - 0,15 г/л хлора,45 оС; 3 -
1 г/л хлора, 35 оС;
- 0,15 г/л хлора, 35 оС;
Рисунок 1 - Влияние избытка HCl на образование пропиленхлоргидрина

- 0,15 г/л хлора, 35 оС; 2 - 0,15 г/л хлора,45 оС;
3 - 1 г/л хлора, 35 оС; 4 - 1 г/л хлора, 345 оС;
Рисунок 2 - Зависимость выхода пропиленхлоргидрина в пересчете на Cl2 от конечной концентрации пропиленхлоргидрина
Общая концентрация пропиленхлоргидрина ниже 5 г/л. При концентрации
пропиленхлоргидрина 50 г/л выход снижается до 89,5%, а при 70 г/л выход
примерно на 7%- ниже теоретически вычисленного (87%). Понижение, температуры до
35°С приводит к незначительному увеличению выхода. Дальнейшее уменьшение
температуры не повышает выхода, а при 15°С наблюдаются потери продукта из-за
затруднений с аппаратурным оформлением.
Омыление пропиленхлоргидрина в окись пропилена происходит в основном
аналогично образованию окиси этилена. Однако здесь можно использовать только
известковое молоко, содержащее не более 1% MgO, иначе - будет преобладать
образование пропионового альдегида.
Скорость образования окиси пропилена значительно ниже (примерно в 10
раз), чем при производстве окиси этилена. Однако показано, что образование
пропилена в основном замедляется присутствием продукта в реакционной среде.
Поэтому для ускорения реакции необходимо максимально быстро выделять продукт из
системы по мере его образования. [Андреас Ф., Гребе К., 1973. - 70-86 с.]
Обзор лабораторных опытов по получению пропиленхлоргидрина сделан Мейем и
Франке. Необязательно использовать чистый пропилен для хлоргидринирования, даже
лучше разбавлять его пропаном. Предложен способ проведения реакции пропилена с
хлором даже в 20-80%-ной серной кислоте при 10-И °С.
Окись пропилена можно получать и совместным хлоргидриниро - ванием
этилена и пропилена, так как образующийся пропиленхлоргидрин омыляется в
известковом молоке примерно в 20 раз быстрее, чем этиленхлоргидрин. Показатель
рН имеет решающее значение для направленного отщепления НС1 от
пропиленхлоргидрина. При рН = 9 - f - 12 образуется окись пропилена, при рН = 9
-4- 7 - пропиленгликоль, в очень кислой среде - ацетон. Увеличение мольного соотношения
Са(ОН)2: окись пропилена от 1:1 до 2:1 повышает выход
пропиленгликоля, уменьшает выход окиси пропилена и не влияет на выход
карбонильных соединений.
Оптимальные параметры производства окиси пропилена
|
Температура оС
|
100
|
|
Концентрация Ca(OH)2
г/л
|
200
|
|
pH
|
9-12
|
|
Подвод тепла, ккал/моль C3H7OCl
|
500
|
|
Концентрация C3H7OCl
|
высокая
|
При этих условия выход продуктов реакции составляет (в мол %):
Окись пропилена - 91;
Пропилен гликоль - 7;
Карбонильные соединения - 2.
Схема получения окиси пропилена методом хлор - гидрирования показана на
рисунке 3. Для получения хлорноватистой кислоты в нижнюю часть колонны 3 с
кислотостойкой облицовкой вводят газообразный хлор.
Газообразный пропилен, смешанный в незначительном избытке с циркулирующим
газом, подается в другом месте колонны 3.
Из колонны часть реакционного раствора отводится для дальнейшей
переработки в дегазационную колонну 4 с аналогичной кислотостойкой облицовкой.
Большая часть однако циркулирует через перепускное устройство. В верхнюю часть
перепускной трубы подается свежая вода в таком количестве, чтобы концентрация
хлоргидрина в колонне не превышала 40 г/л, а содержание свободного хлора было
не выше 0,3 г/л.
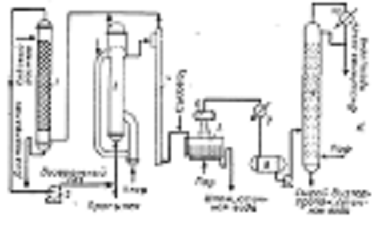
- промывная колонна с содовым раствором; 2 - компрессор; 3 - колонна для
хлорпикрина; 4 - дегазационная колона; 5 - гидролизёр; 6- дефлегматор; 7 -
конденсатор для неочищенной окиси пропилена; 8 - ёмкость для неочищенной окиси
пропилена; 9 - тарельчатая колонна; 10 - конденсатор для очищенной окиси
пропилена.
Рисунок 3 - принципиальная технологическая схема установки по
производству окиси пропилена
Температура реакции в колонне должна поддерживаться в пределах 40-45 °С.
Отходящие с верха колонны 3 и дегазационной колонны 4 непрореагировавшие
пропилен и пропан вместе с хлористым водородом, смешанным с дихлорпропаном,
направляются под небольшим вакуумом в куб промывной колонны 1, заполнен? ной
кольцами Рашига. Подаваемый в верхнюю часть промывной колонны раствор соды
нейтрализует реакционную смесь и одновременно поглощает дихлорпропан.
Нейтрализованная смесь пропан - пропилен возвращается через компрессор 2 в
колонну 3.
Для предотвращения накопления инертных газов осуществляется постоянный
сброс газа перед подачей циркулирующей газовой смеси на реакцию. Если содержание
пропилена в газе, вводимом в колонну 3, не превышает 40 объемн. %, то получают
оптимальный результат.
Из дегазационной колонны 4 реакционная смесь поступает в гидролизер 5
через перепускное устройство, где добавляется 10-20%- ное известковое молоко.
Гидролизер представляет собой горизонт тальный стальной резервуар, снабженный
перегородками. В каждую ячейку, образованную перегородками, подается пар и
реакционная смесь нагревается до 60-80 °С. При этом происходит моментальное
превращение пропиленгидрина в окись пропилена, которая испаряется и вместе с
водяным паром и дихлорпропаном поступает в дефлегматор 6, где часть водяного
пара конденсируется и возвращается в цикл. В холодильнике 7 дистиллят
охлаждается, после чего направляется для хранения в промежуточную емкость 8.
В ректификационной колонне 9 с 50 теоретическими тарелками фракционируют
сырую окись пропилена. Из верхней части выходит при 34 °С 98 %-ная окись
пропилена, а в кубе колонны остаются вода, дихлорпропан с небольшими примесями
дихлордиизопропилового эфира, прохшоновый альдегид и пропиленгликоль.
Дихлорпропан из куба колонны периодически удаляют осушкой хлоридом кальция.
Выход окиси пропилена составляет около 80% по отношению к исходному хлору.
Установка работает непрерывно и, несмотря на небольшие размеры аппаратов, имеет
высокую производительность. [Андреас Ф., Гребе К., 1973. - 70-86 с.]
2.1.2 Окисление пропилена в жидкой фазе под давлением
Имамура с сотрудниками провел обширные исследования жидкофазного
окисления пропилена. При 145-220°C и давлении 2-10 кгс/см2 нафтенат марганца
является наилучшим по селективности катализатором для образования окиси
пропилена. Индукционный период сокращают повышением парциального давления
кислорода и концентрации пропилена, а также добавкой ранее полученного
оксидата. Увеличение температуры реакции оказывает аналогичное действие (продолжительность
индукционного периода при 145°С составляет 6 ч, при 220 °С - 1 мин). Окисление
протекает по радикальному механизму, обрывают цепь перекисные соединения типа
CH2=CH-CH2O2. Ниже 190°С энергия активации составляет 16,1 ккал/моль, выше 190
°С - 0 ккал/моль. Скорость поглощения кислорода не зависит от его парциального
давления (при 2-5 кгс/см2) и пропорциональна количеству растворенного в бензоле
пропилена в 1,3-1,4 степени, добавка пропана не оказывает никакого влияния.
При 10-15%-ной конверсии наивысшую селективность для реакций получения
окиси пропилена и пропиленгликоля достигали при давлении 22-30 кгс/см2, получая
700 г окиси пропилена и пропиленгликоля на 1000 г израсходованного пропилена.
Пропилен в растворе можно превращать в окись пропилена и без катализатора. На
рисунке 4 представлена схема такой установки. В реактор 2, заполненный нагретым
до нужной температуры раствором пропилена в углеводороде, вводят кислород или
воздух. Выходящая из реактора смесь охлаждается в теплообменнике 3 до 10-20 C
C
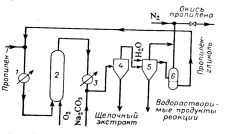
- подогреватель; 2 - реактор; 3 - теплообменник; 4 - флорентийский сосуд;
5 - экстрактор; 6 - отстойник.
Рисунок 4 - принципиальная технологическая схема производства окиси
пропилена прямым окислением
После теплообменника кислые фракции (жирные кислоты и т. д.),
получающиеся при окислении, нейтрализуются водным раствором едкой щелочи. Во
флорентийском сосуде 4 водный щелочной экстракт отводится снизу. Верхний слой,
содержащий раствор углеводородов, подается в экстрактор 5 для экстрагирования
водой при 10- 20°C По меньшей мере 50-70% окиси пропилена и пропиленгликоля
поглощается водой. Водный экстракт выводится из экстрактора и фракционируется в
колоннах для получения чистой окиси пропилена и пропиленгликоля. Участвовавший
в реакции углеводород возвращается через отстойник 6 в подогреватель 1. Таким
же образом непрореагировавший газ возвращается в процесс. Все агрегаты
установки за исключением ректификационных колонн работают под давлением.
Процесс характеризуется следующими параметрами:
|
Давление, кгс/см2
|
57
|
|
Температура, 0С
|
167-179
|
|
Подача кислорода, объёмн.
ч.
|
216
|
|
Повача пропилена, вес. ч.
|
233
|
|
Подача 3%-ного раствора К2СО3
вес. ч.
|
1437
|
|
Подача воды на экстракцию
при 100С, вес. ч.
|
540
|
|
Конверсия, %
кислорода пропилена
|
99,8 94,2
|
|
Выход окиси пропилена и
пропиленгликоля, %
|
46,3
|
|
Содержание окиси пропилена,
%
|
70
|
Окисление без давления при 200°С можно проводить во многих растворителях
(диметилфталат, силиконовое масло, фторутлеводо-роды, дибутилсебацинат и пр.),
но конверсия составляет только 1,0-1,5%/?, селективность не выше 55-60% . Для
окисления под давлением рекомендуются нитрилы, например ацетонитрил (при 200 0C
и 51 кгс/см2 выход окиси пропилена составляет 18%). При использовании в
качестве растворителей по-лиацилированных сложных эфиров, например
пропиленгликоль-диацетата, конверсия через 5 мин достигает 20%; при этом
получается смесь следующего состава (в мол. %):
|
Окись пропилена
|
44,6
|
|
Ацетон
|
2,2
|
|
Ацетальдегид
|
4,2
|
|
Муравьиная кислота
|
0,4
|
|
Метиловый спирт
|
10,2
|
|
Уксусная кислота
|
16,5
|
|
Метил ацетат
|
1,8
|
|
Вода
|
12,6
|
Для окисления в жидкой фазе предложены самые различные катализаторы,
например разлагающиеся при нагреве соли Со, Cu, Mn, V или Cr с карбонатом или
ацетатом свинца илибария в качестве промотора. После 10-минутного окисления при
200 0C и давлении 56 кгс/см2 в бензоле из 465 г пропилена в присутствии таких
катализаторов получают следующие количества (в г) окиси пропилена C3H6O и
пропиленгликоля C3H6O2:
|
C3H6O
|
C3H6O2
|
|
Co(CH3COO)2
|
265
|
61
|
|
PbCO3
|
190
|
73
|
|
Co(CH3COO)2
+ PbCO3
|
312
|
62
|
|
Co(CH3COO)2
+ BaCO3
|
307
|
65
|
|
Mn(CH3COO)2 + Ba(CH3COO)2
|
298
|
60
|
При окислении под давлением в бензоле рекомендуется добавлять фталоцианин
кобальта, никеля и особенно меди (при 175 °С через 10 мин получают 40,1% окиси
пропилена и 2,2% пропиленгликоля). Предложен еще ряд растворителей: эфир
борной кислоты в присутствии ацетата ртути (180 °С, 3 кгс/см2);
катализаторы кобальта, например каприлат Со, и частично смешанный с водой
растворитель, например смесь хлорбензола и ацетона (при 150 °С и 49 кгс/см2
получают 62,4% окиси пропилена наряду с пропиленгликолем и другими продуктами).
Как уже упоминалось, добавки альдегидов сильно снижают индукционный период и,
следовательно, температуру реакции. Например, при совместном окислении пропилена
и ацетальдегида при 10Oj0C и 80 кгс/см2 получили следующие
результаты:
|
Конверсия, %
|
Выход, мол. %
|
|
Пропилена
|
43
|
Окиси пропилена
|
57
|
|
Ацетальдегида
|
88
|
Уксусной кислоты
|
Окисление пропилена в метилацетате в присутствии ацетальдегида при 200 0C
привело к получению 49,4 мол. % окиси пропилена.
Ультрафиолетовое
облучение и перекисные алкильные и ацильные соединения ускоряют окисление в
присутствии ацетальдегида. Добавки перекиси водорода или алкилгидроперекисей в
присутствии солей Cu, Мй, Ni или Со также ускоряют окисление. В некоторых
патентах предлагается проводить окисление пропилена в окись пропилена
перекисными соединениями по аналогии с эпоксидированием по Прилежаеву.
Рекомендуются следующие перекисные соединения: альдегидмой операцетаты (например,
ацет-альдегидмоноперацетат) при 70°C; надуксусная кислота в ацетоне и уксусной
кислоте или в метилале под давлением и при 30- 80°C ; перекись треиг-бутила в
mpem-бутиловом спирте при 80°С и 28 кгс/см2 в присутствии нафтената Mo (выход
окиси пропилена 86%) или MoO3 при HU0C (селективность 86,7%);
аралкилгидроперекиси в присутствии катализатора Mo, V или W (при использовании
гидроперекиси кумола и нафтената Mo конверсия при 90 °С через 1 ч составляет
92,7%, селективность 98%); образующаяся из ацетальдегида надуксусная кислота
без катализатора или в присутствии CoCl2, FeCl3 или CuBr2 (при 56- 200 °С и
31-42 кгс/см2 образуется максимально 73,5% окиси пропилена). Можно применять
предварительное переокисление циклогексанола в присутствии CaCO3 и перекиси циклогексанона
при 120 °С, а также реакцию с пропиленом в присутствии фталевого ангидрида.
Наконец, можно окислять пропилен совместно с органическим соединением,
способным образовывать гидроперекись (насыщенный углеводород, алкилбензол,
карбонильное соединение), например, при 80 °С и 50 кгс/см2 совместно с
ацетальдегидом, который переходит в уксусную кислоту. Прямое эпоксидирование
пропилена осуществляют с помощью H2O2 при 50г-70 °С в присутствии уксусной
кислоты и кремнефосфорной кислоты. На фирме Monsanto Со. работает пилотная
установка, где пропилен окисляется надуксусной кислотой в смесь окиси пропилена
и пропиленгликоля, выход 60%. [Андреас Ф., Гребе К., 1973. - 70-86 с.]
2.1.3 Окисление пропилена в газовой фазе
До сих пор не удалось окислить пропилен в окись пропилена на серебряных
катализаторах с таким же хорошим выходом, как в случае превращения этилена в
окись этилена. При 130-260 °С и времени контакта 0,6-6 с получали менее чем
0,07% окиси пропилена. Основными продуктами реакции были CO2 и вода. Введение
промоторов должно улучшать выход. Для этого рекомендуются добавки CuO к
катализатору из Ag2O*, в этом случае при 160-180 °С получается окись пропилена,
при повышении температуры - акролеин. Были предложены катализаторы на основе
Ag/Au и Ag/Au/Cu. Катализаторы на основе AgO/Ba02 на различных носителях
теоретически должны дать конверсию 36% после непродолжительной обработки хлором
при 220 °С, однако выход составил только 18%. Хорошее действие оказывают
катализаторы серебра при работе в кипящем слое при 220-260 °С с промоторами и
без них. Катализаторы окиси Bi-P-Mo приводят к образованию небольшого
количества окиси пропилена наряду с акролеином. Ванадаты не способствуют
образованию окиси пропилена из пропилена. В ряде патентов описано прямое
окисление пропилена в смесь различных продуктов, в том числе в окись пропилена.
При 330-370 °С под давлением до 5 кгс/см2 и при конверсии 12,8%
выход окиси пропилена составил 24 мол. % наряду с другими продуктами. При 3150C
в исходном газе находилось только 2,7% окиси пропилена наряду с 3,4%
ацетальдегида и 0,7% акролеина. [П.Г. Сергеев, 133.]
По данным фирмы Farbenfabriken Bayer в окислительный реактор, состоящий
из подогревательного устройства, реакционной камеры емкостью 0,8 л и
холодильника, при 9 кгс/см2 подают каждый час 20 м3 газовой смеси с содержанием
45 объемн. % пропилена и 5 объемн. % кислорода (остальное составляет
преимущественно азот, окись и двуокись углерода). В подогревателе
поддерживается температура 280-300 °С, в реакционной камере она повышается до
430-450 °С. В результате реакции окисления содержание кислорода падает до 0,5-1
объемн. %. Выходящая из окислительной печи реакционная смесь охлаждается и
промывается водой под давлением. Из оставшихся газообразных фракций, содержащих
наряду с пропиленом кислород, азот, окись и двуокись углерода, выделяют окись
углерода и превращают ее в двуокись, которую затем удаляют промывкой щелочью. В
оставшиеся газы добавляют отработанный пропилен с кислородом, и смесь снова
подают через компрессор в окислительный реактор. При дистилляции экстракционной
воды при нормальном давлении на 1000 кг израсходованного пропилена получают
следующие продукты окисления (в кг):
Окись пропилена - 270 Акролеин -73
Окись этилена - 24 Ацетон - 16
Ацетальдегид - 330 Смесь высококипящих в-в. - 62
Пропионовый альдегид - 25
Выход в единицу времени на единицу объема для окиси пропилена
составляет-400-450г/(л-ч). Аналогичный метод описан в американском патенте.
Пропилен и смесь пропилена с пропаном окисляли при 340 °С (затем температура
повышалась до 450-510 °С); получали 8-11,5 мол. % окиси пропилена наряду с
пропионовым альдегидом, акролеином и гидроксиацетоном. В качестве разбавителя
предложено использовать для окисления водяной пар, что дает при 215-260 °С
19,7% смеси окиси пропилена и пропиленгликоля. Радиационное облучение повышает
выход спиртов, альдегидов и окиси пропилена при окислении пропилена воздухом.
Окись пропилена наряду с другими продуктами получается также и при окислении
пропана. На фирме ICI (Англия) работает опытная установка по прямому окислению
пропилена. Всеобщее внимание привлекли публикации и патенты, в которых описан
метод одновременного получения окиси пропилена и стирола. -В этом процессе
исходными продуктами являются этилбензол и пропилен. Этилбензол при 130 0C и
давлении около 3,5 кгс/см2 в присутствии катализатора нафтената молибдена под
воздействием кислорода превращается в гидроперекись а-этилбен-зола. При
одноразовом проходе конверсия достигает 13%, а выход- 84%. Из гидроперекиси
а-этилбензола при взаимодействии с пропиленом при 110 °С в присутствии
нафтената молибдена образуются фенилметилкарбинол и окись пропилена. В
результате отщепления воды от фенилметилкарбинола получается стирол. При
использовании в качестве катализатора двуокиси титана и температурах 182- 282
°С (оптимально 200-250 °С) выход стирола составляет 80-95%.
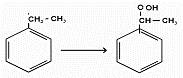
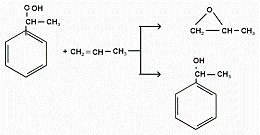
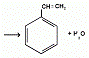
Подобные
результаты получают при использовании гидроперекиси кумола (образуется
а-метилстирол). Этот метод подробно описан Ланда. Реакция между'
гидроперекисью и пропиленом дает лишь незначительное количество окиси
пропилена. Применение катализатора существенно улучшает положение. Ниже
приведены результаты взаимодействия гидроперекиси а-этилбензола и пропилена при
110 0C в присутствии 0,002 моль/моль ROOH нафтенатов различных металлов
(селективность -95 моль окиси пропилена/моль прореагировавшего пропилена):
Нафтенат
…………………………… Mo W Ti Nb Re Ta
Конверсия, %
……………………… 97 83 54 22 25 100
Селективность,
моль оксипропиле-
на/моль
прореагировавшей ROOH.. 71 65
55 20 23 10
Из
молибденовых соединений можно употреблять как растворимые, так и нерастворимые.
Кроме гидроперекиси а-этилбензола применяют гидроперекись кумола, гидроперекись
ягреяг-бутила и др. Реакция протекает по ионному механизму.
Оптимальные
условия реакции:
|
Температура ,оС
|
80-130
|
|
Продолжительность, ч.
|
2-3
|
|
Давление, кгс/см2
|
17,5-70
|
|
Соотношение олефины:
гидроперекись
|
(2÷6):1
|
|
Концентрация катализатора,
моль/моль ROOH
|
0,001-0,006
|
Фирма Агсо -
Halcon внедрила в производство аналогичный метод получения mpem-бутилового
спирта и окиси пропилена с использованием гидроперекиси mpem-бутила. [Андреас
Ф., Гребе К., 1973. - 70-86 с.]
3. ПРИМЕНЕНИЕ ОКИСИ ПРОПИЛЕНА
Окись пропилена используется для получения целого ряда полимерных
веществ, которые используются в различных областях народного хозяйства. Одним
из способов использования данного материала является изготовление инсектицидов,
а также синтез растворителей, различных смазочных материалов и гидрожидкостей.
Также данный полимер используется при синтезе искусственных каучуков и
различных видов полиуретанов.
С тех пор как стало известно, что и сами оксиды, и их производные не
только остро токсичны, но и канцерогенны, все разрешения на их применение были
аннулированы. Кроме того, исключено также их использование в качестве
«исчезающего вещества», т.е. в качестве добавок, не требующих разрешения на
применение. В настоящее время ни в Европе, ни в США, ни в России окиси этилена
и пропилена не разрешены для применения в пищевых продуктах. Для окиси
пропилена ПДК в воде составляет 0,01 мг/л, класс опасности 2 (ГН-98, ПВ-01). [#"876765.files/image014.gif">. Порог
восприятия запаха человеком - 0,36 мг/дм .
.
Окись пропилена - легковоспламеняющаяся жидкость.
Температура вспышки в открытом тигле - минус 37 °С. Нижний предел области
воспламенения - 2,1%, верхний - 37%. Согласно правилам устройства
электрооборудования техническая окись пропилена относится к категории ПВ,
группе смеси Т2.
Окись пропилена в соответствии с ГОСТ 12.1.044-89 не
способна взрываться и гореть при взаимодействии с водой, кислородом воздуха и
другими веществами.
Все работы с окисью пропилена следует проводить,
применяя средства индивидуальной защиты в соответствии с типовыми отраслевыми
нормами. При концентрациях, превышающих ПДК, следует работать в противогазе
ФГП-13А и ФГП-130БКФ по ГОСТ 12.4.121-83.
При концентрациях, превышающих ПДК более чем в 100
раз, следует пользоваться изолирующими противогазами.
Все производственные помещения должны быть оборудованы
общей приточной и вытяжной от рабочего места вентиляцией.
Для тушения горящей окиси пропилена следует
использовать огнетушащий порошковый состав "Пиранит А" с
интенсивностью подачи 0,75 кг/м В системе пожарной защиты производства окиси
пропилена применяют установки пожаротушения типа УПАП. При розливе окись
пропилена обезвреживают разбавлением водой, а затем посыпают место розлива
песком.
Защита окружающей среды при изготовлении, транспортировании
и хранении технической окиси пропилена обеспечивается герметизацией
оборудования и тары. Газовые выбросы на месте производства не допускаются. [#"876765.files/image015.gif">C, давлении 2-10 кгс/см2, нафтенат марганца
является наилучшим по селективности катализатором для образования окиси
пропилена и выход продукта составляет 60%.
4. В курсовой работе показано, что окись пропилена является
крупнотоннажным сырьем для производства целого ряда важнейших продуктов
нефтехимии, таких как полиуретаны, гликоли, косметические средства, медицинские
препараты и др.
СПИСОК ЛИТЕРАТУРЫ
1. Н.А. Платэ, Е.В. Сливинский, Основы химии и технологии
мономеров / М.: Высшая школа, 2002. - 331-338 с.
2. Андреас
Ф., Гребе К. Химия и технология пропилена / Л.: Химия, 1973. - 70-86 с.
3. Марголис Л.Я. Гетерогенное каталитическое окисление
углеводородов / М.: «Химия»,1967. - 159 с.
4. Физер
Л., Физер М. Органическая химия. М.: Химия, 1т, 1966. - 156 с.
5. Петров
А. А., Бальян Х.В., Трощенко А.Т. и др. Органическая химия / СПб.: «Иван
Федоров» 2002. - 89 с.
.
Шабаров Ю.С. Органическая химия / М.: "Химия" 1994. - 74с.
7. В.В. Пигулевский, Е.Я. Яржемская, Труды опытно-ис-след.
завода Химгаз. Материалы по крекингу и химической переработке его продуктов /
вып.3. 1963. - 178-183с.
8. А.И. Артеменко, Органическая химия / M.: Высшая школа,
1998. - 535 с.
9. П.Г. Сергеев и др., Хим. наука и пром. / т.2. - 1957 -
133c.
10. А.Г. Полковникова, Л.А. Иванова, Хим. пром. / т.42 -№
1, 1996. - 16-19с.
11. http://megaresearch.ru/files/demo_file/1657.pdf
12. http://www.vsegost.com/Catalog/11/11800.shtml