Получение и сорбционные характеристики силикагелей с иммобилизованной формазановой группой
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное
учреждение
высшего профессионального образования
«КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
(ГОУ ВПО КубГУ)
Кафедра аналитической химии
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ
РАБОТА
Получение и
сорбционные характеристики силикагелей с иммобилизованной формазановой группой
Работу
выполнила М.С. Думенко
Факультет
химии и высоких технологий
Специальность
«Химия» - 020100.62
Нормоконтролер
канд.
хим. наук, доцент О.Б. Воронова
Краснодар
2014
ВВЕДЕНИЕ
Разработка простых, доступных экспрессных
методов определения ионов тяжелых токсичных металлов в различных объектах
окружающей среды, по-прежнему, остается актуальной задачей, для решения которой
успешно применяются интенсивно развивающиеся в последнее время
сорбционно-спектроскопические методы. Недостаточная чувствительность и
селективность используемых инструментальных методов обуславливает необходимость
предварительного концентрирования. В качестве твердофазного носителя чаще всего
используют иониты, хелатообразующие смолы, силикагели, целлюлозы, кремнеземы,
пенополиуретаны и органополимерные сорбенты. Улучшение структурных
характеристик носителей путем закрепления комплексообразующих реагентов на
поверхности носителей позволяет повысить чувствительность и селективность
извлечения определяемых металлов.
1. Аналитический обзор
Количественное определение тяжелых металлов в
объектах окружающей среды вызывает определенные затруднения у
химиков-аналитиков и экологов. Это объясняется тем, что известные методы
определения недостаточно чувствительны.
Для анализа объектов окружающей среды требуется
разработка чувствительных, селективных и поддающихся автоматизации методов
определения токсичных элементов.
Одним из эффективных приемов повышения
чувствительности в практике химического анализа является предварительное
концентрирование. Силикагели, содержащие формазановый - азогидразонный фрагмент
имеют ярко выраженные координационные свойства по отношению ко многим металлам,
что делает их перспективными сорбентами экотоксикантов. Изучение данного
химически модифицированного силикагеля позволяет предполагать возможность
реализации мультиэлементного концетрирования исследуемых металлов на
синтезированном материале.
1.1 Кремнеземы с
ковалентно иммобилизованными группировками
Возможность ковалентного закрепления
органических соединений преимущественно обусловлена наличием на поверхности
кремнезема силанольных групп Si-OH. Менее реакционноспособные силоксановые
группы Si- O-Si также могут вступать во взаимодействие с молекулами
модификаторов (неактивированный кремнезем). Химическую активность поверхности
кремнезема можно сильно увеличить в результате превращения силанольных групп в
Si-Cl, Si-OLi группы или путем физических взаимодействий (облучение, размол).
При химическом модифицировании следует
учитывать, что поверхность кремнезема геометрически и энергетически
неоднородна, т. е. равномерного распределения на поверхности носителя привитых
молекул добиться нельзя. Структура кремнеземов, модифицированных органическими
соединениями, может быть представлена на рисунке 1.
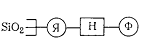
Рисунок 1 - Схема закрепления функциональной
группировки на поверхности кремнезема: где Я - якорь - группа, ответственная за
фиксацию на поверхности привитой молекулы; Н-«ножка»- группировка,
обеспечивающая связь между якорем и функциональной группой Ф
1.1.1 Кремнеземы с
иммобилизованными серосодержащими группировками
В последние годы интерес исследователей к
синтезу и изучению свойств серосодержащих функциональных кремнеземов заметно
вырос. Это объясняется высокой селективностью серосодержащих сорбентов по
отношению к ионам благородных и тяжелых металлов по сравнению с кислород- и
азотсодержащими аналогами.
В качестве серосодержащих группировок часто
выступают меркаптопропильные группы и производные тиомочевины. В работах [2-5]
для концентрирования металлов используют силикагель, ковалентно
модифицированный меркаптопропильными (МПС) группами. Предложена методика
сорбционно-фотометрического определения осмия и палладия из кислой среды [2-3].
В настоящее время в аналитической практике для разделения и концентрирования
элементов применяют химически модифицированные силикагели, обладающие
относительной инертность матрицы, высокой скоростью установления сорбционного
равновесия и не имеющие собственной окраски. В работе [2] для определения осмия
помимо силикагеля с модифицированными МПС группировками, предложен также
силикагель с иммобилизованными дипропилдисульфидными (ДПДСС) группами. Установлено,
что при применении силикагеля, модифицированного ДПДСС группами, время
установления сорбционного равновесия гораздо превышает время установления
равновесия силикагеля с МПС группами. Это объясняется низкой координирующей
способностью дисульфидных групп по сравнению с меркаптогруппами. Результаты
эксперимента по улавливанию осмия из газовой фазы показали, что сорбент
модифицированный дисульфидными группами, неэффективен для извлечения
тетраоксида осмия из газовой фазы. МПС напротив количественно извлекает OsO4
не только из растворов кислот, но и из газовой фазы при любых скоростях потока
воздуха через аппарат [2]. Авторы [3] работы для изучения сорбции палладия
помимо сорбционно-фотометрического метода [2], используют атомно-абсорбционный.
Выявлено, что атомно-абсорбционный метод обладает более высокой селективностью
и воспроизводимостью по сравнению с фотометрическим методом. При использовании
атомно-абсорбционной спектроскопии возрастает селективность определения
палладия в присутствии платиновых металлов. Так, определению 0,2 мкг/мл
палладия не мешают 300-кратные количества золота (III ), серебра (I),
100-кратные- других платиновых металлов. Работа [4 ] посвящена изучению
закономерностей извлечения на МПС ионов Pb(II),
Cd(II), Zn(II)
на уровне их ПДК в природных водах, а также изучено взаимное влияние Pb(II),
Cd(II), Zn(II)
при сорбционно-рентгенофлуоресцентном определении их макроколичеств с
предварительным извлечением на МПС. Было выбрано оптимальное значение единиц рН
и установлено, что МПС в нейтральной среде также извлекают ионы Cu
(II) и Fe (II,
III).Выявлено, что при рентгеноспектральных измерениях на интенсивность
характеристического излучения элемента IA,
химически закрепленного на силикагельном носителе, может влиять изменение
дисперсного состава силикагеля.
Методики сорбционно-люминесцентного определения
элементов характеризуются высокой селективностью за счет отделения
определяемого элемента от матричных компонентов и высокой чувствительностью за
счет сорбционного концентрирования элемента, метод также характеризуется
экспрессностью и простотой аппаратурного оформления. Его широко применяют для
определения следов элементов [5-8]. В сорбционно-люминесцентном методе
определения металлов перспективно использование сорбентов с серосодержацими
комплексообразующими группами, с которыми ионы концентрируемых металлов
образуют соединения, обладающие «собственной люминесценцией»- свечением, в
формировании которого принимают участие электроны иона
металла-комплексообразователя. Данный подход реализован в работах [5-8], где в
качестве сорбента выступал силикагель с ковалентно связанными
меркаптопропильными группами (МПС) [5-6] и силикагель химически
модифицированный 1,3,4-тиадиазол-2-тиольными группами (ТДТС), ковалентно
связанными через пропилмочевинный спейсер [7-8]. Работы 5,8 посвящены изучению
сорбции меди на силикагеле с меркаптановой и тиольной группами. Сорбция
изучалась в статическом и динамическом режимах. Установлено, что силикагель с
МПС группой можно использовать в более широком диапазоне рН, а отличие от
силикагеля с модифицированными тиольными группами. Силикагель, химически
модифицированный тиадиазолтиольными группами, извлекает медь(II) из хлоридных и
нитратных растворах в диапазоне рН 4-6 единиц [8], в отличие от силикагеля с
МПС группами - рН 2-9 единиц [5]. Соотношение реагирующих компонентов равно Cu:L=1:3
[8]. Одна функциональная группа затрачивается на восстановлении меди (II) до
меди (I), две другие координируются с образованием поверхностного комплекса
стехиометрии Cu:L=1:2,
где L-функциональная
группа, ковалентно закрепленная на силикагеле. Снижение сорбционной емкости при
дальнейшем увеличении концентрации меди (II) в растворе связано с окислением
тиадиазолтиольных групп до соответствующих дисульфидов, с которыми медь(I),
(II) не образует устойчивых комплексов. Форма и расположение спектров
возбуждения люминесценции и люминесценции поверхностных комплексов меди (I) на
поверхности ТДТС групп зависят от количества меди на поверхности сорбента. Это
связано с наличием на поверхности ТДТС двух типов комплексов, образующихся при
различных концентрациях меди. При концентрациях меди<50 мкг/0.1 г
поверхности ТДТС образуются соединения меди(I) с координированными
меркаптогруппами. При содержании меди(I)>50 мкг на поверхности ТДТС образуются
соединения меди (I) координированные с донорными атомами серы или азота,
входящими в ароматическое кольцо [8]. Аналогичные явления наблюдали при
исследовании сорбции меди (II) силикагелем, химически модифицированным МПС [5].
В работах 6,7 изучалось извлечение благородных металлов с помощью МПС и ТДТС. В
работе [6] при сорбции золото(III) восстанавливается тиольными группами,
ковалентно закрепленными на поверхности силикагеля, до золота (I) по реакции:
3-R-SH + H[AuCl4]-=[AuS-R] + S-S +
4HCl
Данная реакция упрощенно показывает состав
комплексов, образующихся на поверхности силикагеля с привитыми МПС группами.
Кроме того, восстановление золота (III) до золота (I) рядом серосодержащих
лигандов включает стадию координирования золотом (III) лигандов с последующим
восстановлением Au
(III) до Au (I) уже в
составе комплексного соединения. Интенсивность люминесценции возрастает с
увеличением концентрации золота на поверхности сорбента. Этот эффект положен в
основу разработки методики низкотемпературного сорбционно-люминесцентного
определения золота [6].
Установлено, что в процессе взаимодействия Au
(III) и Pt (IV)
с серосодержащими группами происходит их восстановление до Au
(I) и Pt (II).
Координационные соединения Au
(I) и Ag (I) с МПС
группами и Pt (II) с
группами производных тиомочевины, ковалентно закрепленных на поверхности
кремнеземов обладают интенсивной люминесценцией при 77 К при УФ- облучении.
Люминесценция поверхностных комплексов Pt
(II) с МПС группами малоинтенсивна и ее использование для аналитических целей
не целесообразно. Комплексы золота (I) и серебра (I) с производными
тиомочевины, ковалентно закрепленными на поверхности силикагеля, не
люминесцируют. Поэтому для данной работы выбран силикагель, химически
модифицированный тиодиазолтиольнами группами [7]. При максимальной степени
заполнения поверхности сорбента металлом соотношение раегирующих компонентов
составляет Au (III):L=1:2,
Pt (II): L=1:1,
Pt (IV)
): L=1:2. В процессе
взаимодействия Au
(III) с функциональными группами сорбента происходит его восстановление до Au
(I) с окислением двух из них, две другие группы участвуют в образовании
координационно-насыщенного комплекса. Сорбционная емкость ТДТС по Ag
(I) превышает количество функциональных групп, что связано с возможностью
координации двух ионов Ag
(I) при его высоких концентрациях в растворе с одной функциональной группой
сорбента [7].
1.1.2 Кремнеземы с
иммобилизованными азотсодержащими группами
1.1.2.1 Аминоорганокремнеземы
Наибольшее распространение для синтеза
аминоорганокремнеземов получили методы, основанные на непосредственном введение
в поверхностный слой активных групп с помощью аминоспиртов и аминосодержащих
алкоксиланов. Однако гидролитическая устойчивость покрытий, полученных в
результате этерификации структурных силанольных групп поверхности кремнезема
аминоспиртами невелика [9]. Вследствие этого использование
аминоорганокремнеземов со связью Si-O-C
существенно ограничено. Если для химического модифицирования используют
аминосодержащие алкоксисиланы, то привитые функциональные группы образуют c
поверхностью кремнезема гидролитические устойчивые связи. Впервые получение
аминоорганокремнезема взаимодействием диоксида кремния с γ-аминопропилтриэтоксисиланом
(γ-АПТС)
описано в работе[10]. Методом ИК-спектроскопии показано, что при адсорбции γ-АПТС
на поверхности кремнезема наблюдается взаимодействие силанольных групп с
аминогруппами силана [11]. При адсорбции из растворов выше нейтрального эти
водородные связи настолько сильны, что протон силанольной группы переходит к
аминогруппе давая цвиттер-ион. Более слабые водородные связи образуются при
рН<7.Химическое взаимодействие γ-АПТС
с поверхностью кремнезема осуществляется с участием одной или двух групп
молекулы этоксилана. С помощью температуры предварительной обработки более
вероятно протекание реакции одной молекулы этоксигруппы γ-АПТС
с одной силанольной группой поверхности диоксида кремния, что показано в работе
[12]. При длительном контакте аминопропилкремнезема с воздухом или
растворителем, содержащим следовые количества воды, непрореагировавшие эфирные
группы постепенно гидролизуются[13], а при нагревании до 300 ◦С образуют
силоксановые связи между соседними привитыми аминопропильными радикалами [14].
При этом аминопропильные группы не разрушаются до 450-500◦С [14,15].
Поверхность силикагелей имеет слабокислый характер, поэтому большой интерес
представляет модифицирование поверхности силикагелей соединениями, содержащими
аминогруппы. Такое модифицирование позволит получить сорбент с основными
свойствами поверхности [16]. Модифицирование поверхности силикагеля
моноэтаноламином протекает по схеме:
≡Si−OH +HO−(CH3)2−NH2→≡Si−O−(CH3)2−NH2
+H2O
Так как модифицированный моноэтаноламином
силикагель после промывки водой высушивался до сыпучего состояния при
температуре 60 °С, то на его термогравиметрической кривой (рисунок 2) в
интервале 60-150 °С наблюдается значительный спад, связанный с удалением
адсорбированной воды. Второй минимум на кривой дифференциального
термогравиметрического анализа модифицированного силикагеля, наблюдающийся при 270-400°С,
связан с разложением привитых аминоэтоксигрупп. При температуре 670°С достигает
максимума процессудаления связанных водородной связью силанольных групп с
выделением воды. Дегидратация, связанная с разрушением свободных силанольных
групп поверхности, происходит при температурах 790-800 °С.

Рисунок 2 - Термогравиметрическая кривая
силикагеля модифицированного моноэтаноламином
Данные проведенного анализа подтверждают
термическую устойчивость привитых на поверхность силикагеля аминогрупп вплоть
до 250°С, что свидетельствует о прочном связывании молекул моноэтаноламина с
гидроксогруппами поверхности. Установлено, что модифицированный
моноэтаноламином сорбент ведет себя подобно основанию и повышает рН водного
раствора после установления равновесия, связывая протоны.
Инфракрасные спектры исходных и модифицированных
моноэтаноламином силикагелей марок КСКГ (крупный силикагель крупнопористый
гранулированный) и КСМГ (крупный силикагель мелкопористый гранулированный) [17]
служат доказательством химического механизма адсорбции моноэтаноламина с
участием всех геминальных и части вицинальных силанольных групп.
Доказательством участия гидроксогрупп аминоспирта в поверхностном
взаимодействии выступает также появление новых полос поглощения поверхности
силикагеля КСМГ, вызванных симметричными и антисимметричными валентными (3390,
3330 см-1 ) и деформационными (1660 см -1 ) колебаниями связей N-H в
аминогруппах. Перечисленные спектральные характеристики указывают на
ковалентное связывание моноэтаноламина с поверхностью силикагелей с
образованием сложноэфирной связи Si-O-C.
Для концентрирования и разделения хрома (VI) и
хрома (III) из водных растворов, в качестве адсорбента было исследовано
использование амино-пропил функционализированного мезопористого кремнезема
[18]. Для этого производится функционализация кремнезема аминопропиловыми или
диэтитилентриаминовыми группировками (рисунок 3) по следующей схеме:
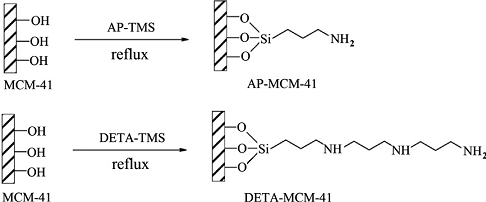
Рисунок 3 - Функционализация кремнезема аминопропиловыми
(AP-TMS)
или диэтитилентриаминовыми (DETA-TMS)
группировками
Степень извлечения хрома (VI) и хрома (III)
зависит от рН. При рН= 3, Cr (VI) силикагелем с аминопропиловыми группировками
был удален из раствора на 100%. А Cr(III) извлекается из раствора на 100% при
рН=9. В работе [19], два из аминотиофенола производных а именно,
2-аминотиофенол и 4-аминотиофенол взаимодействовали с тремя ионами металлов, Hg
(II), Cd (II) и Pb (II). Два хелата привиты к поверхности силикагеля с помощью
амидной связи (рисунок 4).

Рисунок 4 - Схема ковалентного присоединения
2-аминотиофенола и 4-аминотиофенола к поверхности кремнезема
В случае силикагеля с иммобилизованной
4-аминотиофенольной группировкой, наличие свободной группы SH позволяет легко и
доступно связывать ионы. Группа SH в 2-аминотиофеноле является пространственно
затрудненной из-за близости к точке присоединения с поверхностью, из этого
следует меньшая степень сорбции ионов по сравнению с модифицированным аналогом.
Силикагель модифицированный 1 - (2-аминоэтил)-3-фенилмочевиной (SG-AEP)
применяется для селективной твердофазной экстракции и концентрирования Sc (III)
из проб окружающей среды (рисунок 5). Время 95 % сорбции составляет менее 2
минут, определению не мешали сосуществующие ионы. Оптимальное значение рН
составило 4 единицы [20].
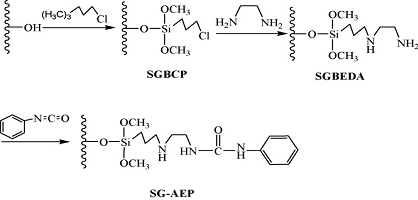
Рисунок 5 - Модификация силикагеля 1 -
(2-аминоэтил)-3-фенилмочевиной, где SGBCP-силикагель модифицированный
3-хлорпропил фазой, SGBEDA- продукт SGBCP модифицированный этилендиамином
В работе [21] три вида кремнезема, имеющие
различные площади поверхности и объемы пор, были модифицированы амино группами
для сорбции ионов меди из раствора. Получены 3-аминопропилтриметоксисилан
(3-APTMS), и N-[3-(триметоксисилил)пропил]-этилендиамин (MSDS), и, кроме того,
используя как 3-APTMS, так и MSDS их привили на одной подложке кремнезема (
рисунок 6).

Рисунок 6 - Структуры
SiON-I, SiON-I1 и
SiON- I2.
Медь поглощающие способности материала зависит
от комплексообразования ионов между Cu2+ и аминогрупп на поверхности
кремнезема. Формирование комплекса и его стабильность, зависит от среды , в
которой происходит реакция. В этой работе помехи рН и других хелатирующих
агентов, таких как NH 3+ и этилендиаминтетрауксусной кислоты (ЭДТА) были
изучены. Кроме того, три вида функционализированных материалов (SiON-I, SiON-I1
и SiON- I2) были исследованы на их способность к удалению меди из водного
раствора в присутствии мешающих видов ( рисунок 7).
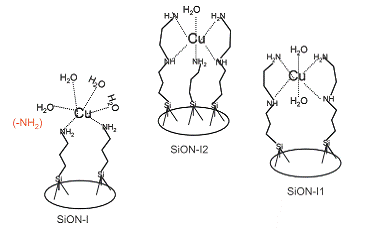
Рисунок 7 - Взаимодействие ионов меди с
аминогруппами SiON-I,
SiON-I1
и SiON- I2
Результаты исследований показали, что самый
стабильный комплекс образуется при взаимодействии Cu
2+ c SiON-
I2.
В работе [22] изучали получение
аминоорганокремнеземов в водной среде и толуоле. Поверхности частиц кремнезема
были модифицированы с 3-аминопропилтриэтоксисилана (APTES). Активацию
поверхности кремнезема проводили в воде при нейтральном рН и в толуоле, с целью
сравнения эффективности прививки в этих двух растворителях. В толуоле,
адсорбированные молекулы воды на поверхности диоксида кремния гидролизуют
молекулы APTES когда они приближаются к поверхности, тогда на молекуле APTES
создаются ОН-группы (рисунок 8).
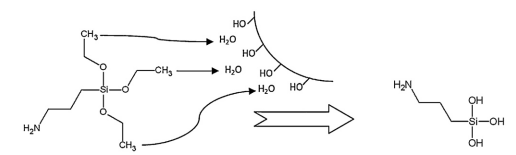
Рисунок 8 - Гидролиз молекул APTES в толуоле
Некоторые из групп ОН способны реагировать с
силанольной поверхностью кремнезема и создавать ковалентные связи, водородные
связи или электростатические взаимодействия с другими гидролизованными
молекулами APTES ( рисунок 9).


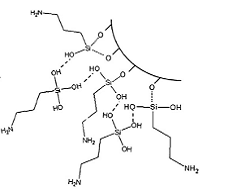
Рисунок 9 - Схема реакции гидролизованных
молекул APTES с силанольной поверхностью кремнезема, где …… − ковалентная
связь, ------ − водородная связь.
1.1.2.2 Кремнеземы с
химически закрепленными азотсодержащими циклическими соединиями
Исследованы адсорбционные свойства силикагеля с
4-(2-пиридилазо)резорцином, химически закрепленным на поверхности с помощью
реакции Манниха, по отношению к микроколичествам ионов Pb(II), Cd(II) и Hg(II)
в нейтральных водных растворах. Изучены возможности рентгенофлуоресцентного
определения указанных металло-ионов в фазе адсорбента при их одновременной
адсорбции. Предложен метод сорбционно-рентгенофлуоресцентного определения
следовых количеств свинца, кадмия и ртути в пробах природных и техногенных
растворов сложного химического состава [23] .Неорганические адсорбенты с
иммобилизованными на поверхности гетероциклическими азосоединениями, в том
числе 4-(2-пиридилазо)резорцином (ПАР), могут быть использованы для извлечения
и хроматографического разделения ионов тяжелых металлов. В работе [23] был
показан, простой в экспериментальном исполнении метод одностадийного
аминометилирования (реакция Манниха) с участием аминосодержащего
органоалкоксисилана и параформальдегида в качестве метилирующего реагента. Как
оказалось, в этом случае удается достичь более высоких концентраций привитых к
поверхности кремнезема гетероциклических азосоединений (оксина,
пиридилазонафтола и ПАР), чем в случае проведения многостадийных процессов.
Вместе с тем сорбционно-аналитические характеристики таких модифицированных
кремнеземных адсорбентов исследованы недостаточно. Силикагель с химически
связанным 4-(2-пиридилазо) резорцином получен по методике [24] методом
одностадийного модифицирования поверхности кремнезема с помощью реакции Манниха
(рисунок 10) с участием 3-аминопропилтриэтоксисилана и параформальдегида
согласно следующей схемы
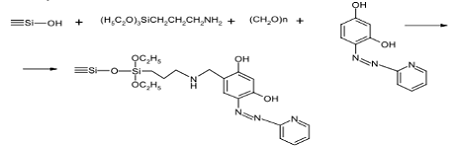
Рисунок 10 - Реакция Манниха
Сорбенты, модифицированные хромофорными
реагентами, применяются в визуально-тестовых методах, которые незаменимы при
проведении экспресс-анализа объектов окружающей среды, особенно
предварительного (оценочного) анализа. Работа [25] посвящена изучению
закрепления на силикагеле хромофорных реагентов для извлечения Se
(IV) в препаратах
витаминов и добавок. Для визуального тест-определения селена предложен
твердофазный реагент на основе индигокармина (ИК), закрепленном на сшитом
ионообменике [26].Также предложены анионообменики, модифицированные ксиленовым
оранжевым для сорбционно-спектрофотометрического определения ряда металлов, в
том числе Pb (II), Zn
(II) [27,28]. Однако чувствительность ионообмеников недостаточна для
определения микроколичеств элементов, что обусловлено собственным поглощением
органической матрицы. Известно, что кремнеземы не поглощают в видимой области и
поэтому являются боле перспективной по сравнению с ионообменниками матрицей для
закрепления хромофорных реагентов. Было показано, что анионы красителей хорошо
сорбируются и прочно удерживаются на поверхности кремнеземов, модифицированных
высокомолекулярными четвертичными аммониевыми солями (ЧАС). Определение селена
(IV) основано на
катализе реакции восстановления ИК в растворе сульфид-ионом. Восстановление
сопровождается изменением окраски ИК из синей (окисленная форма) в желтую
(восстановленная форма). Определению селена (IV)
не мешают ионы щелочных и щелочно-земельных металлов. Ионы тяжелых металлов,
образующие нерастворимые сульфиды, мешают определению. Поэтому их устраняют
введением в раствор ЭДТА [25]. В работе [29] предложен метод предварительного
концентрирования Cd(II),
Cu (II), Zn
(II) и Ni (II) на
мини-колонке, заполненной силикагелем, модифицированным шиффовым основанием -(N,N-
бис (салицилиден)фенилен-1,3-диамин). В связывании исследуемых металлов участвуют
два типа функциональных групп: льюисовы основания (=CO,
-OH) при кислотных
значениях рН и льюисовы кислоты (-NH2)
при основных значениях рН. В очень кислых (рН<2) или сильно основных
(рН>10) растворах исследованные металлы не сорбируются шиффовыми основаниями,
иммобилизованными на силикагеле. При этих условиях сорбция металлов очень мала
потому, что в кислых растворах кислотные функциональные группы сильно
протонируются, а в щелочной среде металлы связываются с гидроксильными
группами.
В работе [30] рассматривается применение
силикагеля, модифицированного дифенилкарбазидом (DPC-SBA-15) для определения Cd(II),
Cu (II) (рисунок 11).
Извлечение и концентрирование кадмия и меди на
DPC-SBA-15 сильно зависит от различных параметров, таких как рН, объем и
концентрация элюента образца, скорость потока элюента, объема концентрация
сосуществующих ионов. В данной работе процедура была оптимизирована для различных
аналитических параметров.
1.1.3 Кремнеземы с
иммобилизованными аминокислотами
В литературе существует много работ, посвященных
иммобилизации аминокислот на различных носителях. Большой интерес к этому
вопросу вызван прежде всего тем, что твердотельные матрицы с иммобилизованными
аминокислотами применяются в хроматографии ионов, пептидов, белков,
исследования рацемизации и препаративного выделения энантиомеров. Впервые
химическое закрепление аминокислот на поверхности кремнеземы было описано в работах
Даванкова, Гюбица и Кодэ в 1979 г. [31].Широкое распространение получил метод
иммобилизации незащищенных аминокислот, предложенный Гюбетцем [32]. Он
заключается в применении для химического закрепления аминокислот
органокремнезема с глицидооксипропильными группами. Этим методом получены
кремнеземы с закрепленными L-гидроксипролином, L-пролином, L-валином,
L-гистидином, L-фенилаланином, L-аспарагиновой кислотой, L-тирозином,
L-лизином, L-пипекалиновой кислотой. Применение водно-диоксановых смесей и повышение
щелочности среды обеспечивает увеличение поверхностной концентрации
аминокислот. Авторы [33] установили, что поверхностная концентрация привитых
аминокислот не зависит от типа аминокислоты и составляет примерно половину
концентрации привитых к кремнезему глицидооксипропильных групп. Достижению
высоких концентраций препятствует побочная реакция, связанная с раскрытием
эпоксицикла, невысокая плотность прививки глицидопропильных групп, а также
возможность связывания аминокислоты по карбоксильной группе. Однако
гидролитическая устойчивость многих кремнеземов с химически иммобилизованными
аминокислотами невысока. Впервые в работе [34] для повышения гидролитической
устойчивости было предложено покрывать поверхность пористого кремнезема
полимером.
В работе [35] для иммобилизации в матрице
силикагелей были выбраны аминокислоты лейцин, пролин и тирозин (рисунок 12).
Установлено, что аминокислоты фиксируются в
матрице силикагелей вследствие взаимодействия аминогрупп с силанольными
группами.
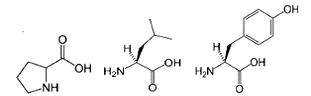
Рисунок 12 - Формулы использованных в работе
[35] аминокислот: а - пролин; б - лейцин; в - тирозин
Величины pKa1 , соответствующие ионизации
карбоксильных групп, мало изменяются при введении аминокислот в матрицу
силикагелей. Это легко объясняется отсутствием взаимодействия между
карбоксильными и слабокислыми силанольными группами силикагелей. Показатели
pKa2 соответствуют депротонированию групп -NH3+, а их изменение для аминокислот
указывает на изменение силы группировок -NH2 как оснований при иммобилизации
аминокислот в силикагеле. Величины pKa2 иммобилизованных аминокислот
приближенно на 3 порядка меньше, чем для их водных растворов. Это связано с
известным эффектом водородного взаимодействия аминогрупп с силанольными
группами силикагелей. В результате такого взаимодействия продуктом
депротонирования ионов -NH3+ являются не свободные аминогруппы, а их ассоциаты
с силанольным покровом кремнеземов. Водородным взаимодействием силанольных
групп и свободных электронных пар кислорода фенольной группы также объясняется
уменьшение константы ионизации тирозина pKa3. В работе [36] была исследована
сорбция лизина на мезопористом кремнеземе (МСМ-41) при различных условиях.
Степень адсорбции сильно зависит от рН и от ионной силы раствора адсорбата, за
счет сочетания ионного обмена и электростатических взаимодействий, регулирующих
процесс адсорбции. Выбрано оптимальное значение рН=6 при котором наблюдалась
максимальная емкость силикагеля - 21 ммоль/г. Адсорбционная способность МСМ-41
для лизина в данной работе ниже, чем для некоторых других адсорбирующих
материалов, таких как β-цеолита.
Это связано с относительно низкой кислотностью поверхности кремнистых МСМ-41.
Однако емкость может быть увеличена путем повторной гидратации адсорбента после
прокаливания, чтобы увеличить плотность силанольных групп или путем модификации
поверхности путем включения функциональных групп, таких как группы
сульфокислоты, рассчитанные на адсорбции аминокислоты. Последний подход имеет
дополнительное преимущество, он позволяет повышать стабильность мезопористого
молекулярного сита в водных растворах. Медно-аминокислотные комплексы были
иммобилизованы на силикагеле нанесением лиганда на носитель, а затем введения
иона металла по принципу «гость-хозяин»[37]. Аминокислоты были L
-тирозин, L -гистидин и L
-аспарагиновая кислота. Значительное закрепление произошло на силикагеле только
тогда, когда тирозин был лиганд. Тепловая стабильность полученных веществ была
заметна, полное разложение произошло при 673 K.
Также известно модифицирование
кремнезема полиаминокарбоновыми кислотами, в которых с атомом
<#"876752.files/image015.gif">
Рисунок 13 -
1-(4-адамантил-2-тиазолилазо)-2-нафтол
Закрепление реагента, как и в случае ТАН,
происходит при участии его донорных атомов и ОН-групп поверхности силикагеля. С
целью выбора оптимального растворителя для модифицирования силикагеля, сорбцию
АТАН изучали из ацетонового, гексанового и ацетонгексанового растворов.
Оказалось, что наиболее эффективно реагент сорбируется из гексанового раствора.
Результаты исследования сорбции АТАН на поверхности силикагеля в зависимости от
продолжительности контакта фаз свидетельствуют, что равновесие в системе
достигается в течение 5-7 минут. Результаты исследования взаимодействия
иммобилизованного АТАН с ионами металлов свидетельствуют о его перспективности
для определения меди в природных водах. В отличие от Co, Cd, Zn и Ni,
количественное извлечение которых происходит при рН 5-7, медь взаимодействует с
иммобилизованным АТАН в более кислой среде (рН ≈ 3). В интервале рН
3,2-3,5 частично сорбируется также никель.
Для группового выделения элементов из природных
вод достаточно хорошо зарекомендовали себя сорбенты с функциональными группами
8-оксихинолина, ковалентно закрепленными на поверхности полимерных матриц [40,
41] и кремнеземов [42]. Нековалентное закрепление 8-окисхинолина осуществлено
на поверхности кремнеземов, химически модифицированных предельными
углеводородами C 16 [43].
Работа [44] посвящена исследованию возможностей
применения кремнезема, модифицированного полигексаметиленгуанидином и
8-оксихинолин-5-сульфокислотой, для концентрирования и
сорбционно-атомно-эмиссионного (с индуктивно связанной плазмой) определения
ионов металлов в природных водах. Сложно осуществить эффективное закрепление на
поверхности кремнеземов реагентов, имеющих в своем составе отрицательно заряженные
сульфогруппы, из-за их отталкивания от депротонированных гидроксильных групп
поверхности. Для закрепления сульфопроизводных органических реагентов
предложено создание на поверхности кремнезема органического слоя, имеющего
эффективный положительный заряд, путем предварительной обработки поверхности
кремнезема полигексаметиленгунидином (ПГМГ) (рисунок 14). Достаточно прочное
закрепление ПГМГ на поверхности силикагеля осуществляется за счет образования
многоцентровых водородных связей между аминогруппами ПГМГ и гидроксильными
группами поверхности. Закрепление органического реагента осуществляется за счет
электростатического взаимодействия отрицательно заряженных сульфогрупп
органического реагента с протонированными аминогруппами ПГМГ, не участвующими в
образовании водородных связей с поверхностными гидроксильными группами. Такой
подход позволяет закрепить на поверхности кремнезема любой органический
реагент, имеющий в своем составе сульфогруппы.
В процессе последовательного модифицирования
кремнезема полигексаметиленгуанидином и 8-оксихинолин-5-сульфокислотой на его
поверхности образуется супрамолекулярный ансамбль соединений, связанных между
собой межмолекулярными силами.
фаза сорбент раствор иммобилизованный

Рисунок 14 - Закрепление полигексаметиленгуанида
и 8-оксихинолин-5-сульфокислоты на поверхности кремнезема
Полигексаметиленгуанидин закрепляется на
поверхности кремнезема посредством образования водородных связей между его
аминогруппами и гидроксильными группами поверхности. В силу многоцентровости
связей закрепление ПГМГ отличается достаточно высокой устойчивостью.
Закрепление органического реагента осуществляется за счет электростатического
взаимодействия сульфогруппы реагента с протонированными аминогруппами ПГМГ, не
участвующими в образовании водородных связей с поверхностными гидроксильными
группами. Низкая степень извлечения Oxin при рН <2, связана с разрушением
молекулярного ансамбля за счет протонизации сульфогруппы, входящей в состав
органического реагента, а при рН > 9 - с депротонизацией аминогрупп ПГМГ.
Время установления сорбционного равновесия при извлечении ионов металлов SiO2
-ПГМГ-Oxin из водных растворов в статическом режиме не зависит от природы
металла и не превышает 5 мин. Количественное (≥ 99 %) извлечение Cu(II),
Zn(II), Co(II), Ni(II), Cd(II), Fe(III) и Al(III) достигается из растворов с рН
4-7, Mn(II) - рН 5,5-7,0.
Авторы работы [45] определяют цветные металлы с
помощью модифицированных силкагелей. Продуктом синтеза является окрашенный
порошок, на поверхности частиц которого нековалентно закреплен
комплексообразующий органический реагент посредством промежуточного слоя
полигексаметиленгуанидина гидрохлорида (ПГМГ). В качестве органических
реагентов выбраны 2-(2-гидрокси-5-хлорфенил)азо-1,8-дигидроксинафталин-3,6-дисульфокислота,
динатриевая соль (ХТС) и 2-(4′-нитробензолазо) хромотроповая кислота
(хромотроп 2Б), обладающие комплексообразующими свойствами по отношению к ионам
цветных и тяжелых металлов (рисунок 15).
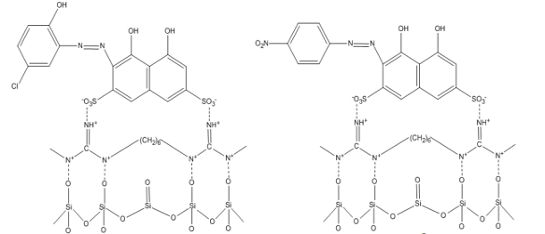
Рисунок 15 - Формулы силикагелей,
модифицированных ХТС (а) и хромотроповой кислотой (б)
В работе [46] был использован силикагель
ДИАСОРБ-100-ТА с триметиламмониевыми группировками (ТМАГ). Поскольку в
результате фиксации органический лиганд, благодаря геометрическим особенностям
его закрепления на поверхности твердофазной матрицы, может изменять свои
структурные характеристики, то были исследованы состав и строение новых
минеральных сорбентов с иммобилизованными гетарилформазановыми группировками,
представляющими интерес в качестве материалов с прогнозируемыми
комплексообразующими свойствами.
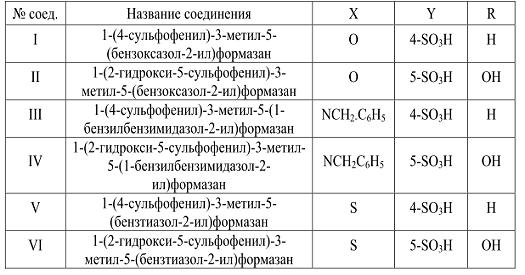
Для модификации силикагеля были выбраны ранее
синтезированные сульфофенилзамещенные бензазолилформазаны I-VI общей формулы (
таблица 1)

Рисунок 16 - Общая формула сульфофенилзамещенных
бензазолилформазанов I-VI
Таблица 1- Состав соединений I-VI
Наличие в силикагеле триметиламмониевых
группировок, а в формазане сульфогрупп позволило проводить закрепление новых
функциональных группировок на поверхности твердофазной матрицы по ионному
механизму:
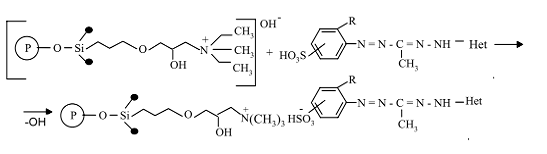
Рисунок 17 - Ионный механизм закрепления новых
функциональных группировок
Разработаны методики тест-определения кадмия
(II) с использованием 1-(2гидрокси-5-сульфофенил)-3-метил-5-(бензтиазол-2-ил)
формазанов на силикагеле ДИАСОРБ-100-ТА с триметиламмониевыми группировками в
динамическом режиме [47]. Пространственная структура силикагеля в качестве
носителя позволяет достичь более равномерного распределения органического
реагента по поверхности, что способствует уменьшению погрешности при
спектроскопическом и визуальном определении концентраций ионов металла и
улучшению воспроизводимости результатов. Именно гетарилформазаны образуют с
кадмием (II) устойчивые комплексные соединения с высокой контрасностью.
Разработана методика предварительного
концентрирования кадмия и свинца в виде комплексов с
2,3-димеркаптопропан-1-сульфоновой кислотой (унитиол) на поверхности кремнезема
с привитыми группами бромида триметиламмония в динамическом режиме [48].
Унитиол содержит сразу 2 серусодержащие компоненты. Сульфогруппа унитиола -
сильнокислотная, а тиольная группа- слабокислотная, что позволяет использовать
данный сорбент как в кислой, нейтральной и слабощелочной средах. Твердофазный
реагент, полученный путем нековалентной иммобилизации КО на ЧАС-СГ, не пригоден
для определения микроколичеств свинца и цинка из-за низкой контрасности
гетерофазной реакции. Это связано с появлением в спектре поглощения
иммобилизованного КО максимума при λ
=585 нм, обусловленного участием карбоксильных групп реагента в закреплении на
поверхности [49]. С целью предотвращения такого взаимодействия была предпринята
попытка закрепления КО в форме его комплексных соединений. Лучшие результаты
были получены при обработке сорбента водным раствором, содержащим КО и Fe(III)
в стехиометрических соотношениях, то есть в условиях, когда лиганд
диссоциирован лишь по сульфогруппе. Установлено, что в растворе образуется
комплексный цвиттер-ион FeКО,
суммарный заряд которого равен +1.
2
Экспериментальная часть и обсуждение результатов
2.1 Материалы и
использованное оборудование
спектрофотометр LEKI
SS2107UV
производство «Mediora
OY», Финляндия;
-атомно-эмиссионный спектрометр с индуктивно
связанной плазмой iCAP
6000 производство Thermo
scientific, США;
-энергодисперсионный рентгенофлуоресцентный
спектрометр Shimadzu
EDX-800HS;
pH-метр-иономер
«Эксперт - 001»;
кюветы кварцевые 10,00 мм;
- пресс-форма для изготовления таблеток ПФ13;
- гидравлический ручной пресс ПГР400 производство
ООО «Мониторинт», С. - Петербург;
- шейкер-инкубатор KS4000i
control IKA
pH-метр-иономер
«Эксперт - 001»;
- комбинированный электрод (аквилон);
магнитная мешалка;
- сушильный шкаф производство «Memmert»
дозатор 100-1000 мкл «BIOHIT»;
дозатор 10-100 мкл «BIOHIT»;
- весы аналитические лабораторные, ГОСТ
24104-80, класс точности 2 WA 34 (Польша);
- воронка стеклянная типа В, ГОСТ 25336;
пипетки 4-2-1, 4-2-2, 7-2-5, 7-2-10, ГОСТ
20292-74;
колба коническая КН-1-100-29/32 ГОСТ 25336-82;
колба мерная 2-10-2, 2-50-2, 2-100-2 «LabTex»,
ГОСТ 1770-74;
стакан НН-100, НН-150, НН-250 ГОСТ 25336-82;
цилиндр мерный ГОСТ 1770-74;
шприцы на 5 мл ГОСТ ISO 7886-1-2011;
- силикагель 60, 0,04-0,063 мм.
- этанол ректификованный ГОСТ 5962-67;
- вода дистиллированная, ГОСТ 6709-72;
- кислота соляная, х.ч., ГОСТ 3118-77;
кислота азотная, х.ч., ГОСТ 4461-77;
кислота уксусная, ледяная, х.ч., ГОСТ 61-75;
никель уксуснокислый четырехводный, ТУ
6-09-02-516-91;
- медь двухлористая ГОСТ 4167-74;
кобальт сернокислый семиводный ЧДА ГОСТ 4462-78;
- кадмий сернокислый ХЧ ГОСТ 4456-75;
тетраборат натрия, ГОСТ 8429-77;
-колба коническая на 500 мл со шлифом 29/32;
натрия гидроокись, х.ч., ГОСТ 4328-77;
- калия гидроокись, ХЧ ГОСТ 24363-80;
фильтры обеззоленные "синяя лента",
150ММ ТУ 2642-001- 42624157-98;
вата, ГОСТ 5556-81;
вода бидистиллированная, ГОСТ 6709-72;
- индикаторная бумага универсальная, ТУ
6-09-1181-76;
- борная кислота ГОСТ 18704-78;
4-(2-пиридилазо) резорцин (ПАР), МРТУ
6-09-2882-66;
2.2 Приготовление
рабочих растворов
Исходные растворы металлов готовили растворением
точных навесок CoSO4∙7H2O,
CuCI2, Ni(CH3COO)2∙4H2O
и CdSO4 8/3H2O
в бидистиллированной воде. Рабочие растворы готовили непосредственно в день
анализа разбавлением исходного раствора бидистиллированной водой.
Раствор 1 М НСI
готовили
из фиксонала.
Приготовление буферных растворов [167]:
рН=1,65 готовили растворение стандарт титра 3-го
разряда калия тетраоксата в 1 л;
рН=3,56 готовили растворение стандарт титра 3-го
разряда калия гидротартрата в 1 л;
рН=4,01 готовили растворение стандарт титра 3-го
разряда калия гидрофталата в 1 л ;
- рН=6,86 готовили растворение стандарт титра
3-го разряда натрия гидрофосфата в 1л;
рН=9,18 готовили растворение стандарт титра 3-го
разряда натрия тетрабората 10-водного в 1 л.
- рН=3 готовили добавлением к 10 мл 0,2М CH3COONa
90 мл 0,2М CH3COOH;
- рН=4 готовили добавлением к 18 мл 0,2 М CH3COONa
82 мл 0,2 М CH3COOH
- рН=5 готовили добавлением к 70 мл 0,2 М CH3COONa
30 мл 0,2 М CH3COOH
- рН=6 готовили добавлением к 91 мл 2 М CH3COONa
9 мл 0,2 М CH3COOH
- рН=8 готовили добавлением к 50 мл 0,025М Na2B4O7∙10H2O
19,7 мл 0,1M
HCI, раствор доводили
до 100 мл бидистиллированной водой;
- рН=9 готовили растворением точной навески Na2B4O7∙10H2O
для создания 0,05М раствора.
Значение рН всех рабочих буферных растворов
проверялось на иономере «Эксперт-001» с помощью откалиброванного
комбинированного стеклянного электрода ЭСК-10608.
Для приготовления 0.1 % раствора
4-(2-пиридил-азо)резорцина навеску мононатриевой соли реагента (ч) 0.1 г
растворяли в 100 мл бидистиллированной воды.
Растворы KHCO3,
NaHCO3, MgSO4∙7H2O,
CaCl2 готовили
растворением 0,0256, 0,0355, 0,1025, 0,02775 г в 100 мл бидистилированной воды
соответственно.
Растворы KHCO3,
NaCl, MgSO4∙7H2O,
CaCl2 готовили
растворением 2,564, 10,25, 2,775, 25,44 в 100 мл бидистилированной воды
соответственно.
2.3 Методика
фотометрического определения металлов в водной фазе
В мерные колбы емкостью 25 мл вносили 2.5-25 мкг
Co2+, Cd2+,
Сu2+ и Ni2+,
прибавляли 5 мл 0.05 М Na2B4O7,
0.5 мл 0.1 % ПАР. Раствор выдерживали в течение 30 мин и измеряли оптическую
плотность относительно раствора сравнения при длине оптического пути 1 см.
Длина волны для определения Co2+
и Сu2+-
510нм, а для Cd2+ и Ni2+
495нм .
Таблица 2 - Значения угловых коэффициентов и
свободных членов градуировочных функций y=((b±cb)x+(a±ca))
|
Me
|
(a±ca)
|
(b±cb)
|
|
Cu
|
0,01±0,01
|
0,94±0,01
|
|
Co
|
0,004±0,008
|
1,039±0,009
|
|
Ni
|
0,024±0,007
|
1,247±0,007
|
|
Cd
|
0,014±0,005
|
0,817±0,004
|
2.4 Зависимость степени
извлечения от рН раствора
Влияние рН среды на степень извлечения (R)
металлов изучали в статических условиях. Для этого в 20 мл раствора с заданным
значением рН и содержанием металлов 1 мкг/мл вносили 0,05г сорбента и
встряхивали в течение 3 часов. Затем отфильтровывали и определяли остаточную
концентрацию металлов в растворе по фотометрической методике с ПАР.
Значение величины степени извлечения (R,%)
металла рассчитывали по формуле [52]:
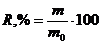
где m-масса
сорбата, мкг;
m0-масса металла в
исходном растворе, мкг.
2.5 Определение
кинетических параметров
Исследование кинетики сорбции металлов проводили
в статическом режиме методом ограниченного объема. Для определения кинетических
параметров модифицированного силикагеля в конические колбы объемом 100 мл
помещали 20 мл буферного раствора с рН=8 и 5 мл раствора металла, что
соответствует 50 мкг. В раствор помещали 0.05 г сорбента и перемешивали в
течение определенного промежутка времени. После чего отбирали аликвоту водной
фазы и определяли текущую концентрацию металла, находящегося в растворе в
фиксированный момент времени, по фотометрической методике с ПАР.
Сорбционную емкость сорбентов At
оценивали по формуле [53]:
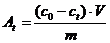
где со,сt- исходная и
текущая концентрация сорбата,
V- объем
раствора,
m-масса сорбента .
2.6 Зависимость степени
извлечения от объема раствора
Влияние объема раствора на степень извлечения (R)
металлов изучали в статических условиях. Для этого готовили растворы объемом от
100 до 500мл с заданным рН и содержанием металла 20мкг. Вносили 0,05г сорбента
и встряхивали в течение 2 часов. Количество сорбата оценивали непосредственно в
фазе сорбента методом РФА по предварительно построенным калибровочным
зависимостям.
Значение величины степени извлечения (R,%)
металла рассчитывали по формуле:
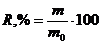
где m-масса
сорбата,
m0-масса
металла в исходном растворе.
2.7
Установление времени равновесия системы сорбент - раствор металла
Для изучения установления времени
равновесия системы сорбент -
раствор металла готовили серии растворов с заданным значением рН и содержанием
металла 4мг, что соответствует теоретическому значению емкости сорбента.
Систему выдерживали в течение недели, периодически отбирая аликвоту 0,1мл для
определения равновесной концентрации металла в растворе по фотометрической
методике с ПАР. Временем, необходимым для установления равновесия, считаем
время, при котором равновесная концентрация перестает существенно изменяться.
2.8
Получение изотерм сорбции
Для получения изотермы сорбции
металлов готовили серии растворов с заданным рН и содержанием металлов от 20
мкг до 12 мг, вносили 0,05г сорбента и выдерживали систему сорбент - раствор
металла в течение времени, необходимого для установления равновесия. Содержание
металла в маточном растворе в состоянии равновесия определяли по
фотометрической методике с ПАР.
Сорбцию компонентов оценивали по
формуле
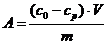
где со,ср- исходная и равновесная
концентрация сорбата,
V- объем
раствора,
2.9
Зависимость степени извлечения от времени контакта фаз
Влияние времени контакта фаз на степень
извлечения (R) металлов изучали
в статических условиях. Для этого в 20 мл раствора с заданным значением рН и
содержанием металлов 1 мкг/мл вносили 0,05г сорбента и встряхивали в течение
15, 30, 45, 60, 90, 120 и 180 минут. Затем отфильтровывали и определяли
остаточную концентрацию металлов в растворе по фотометрической методике с ПАР.
Значение величины степени извлечения (R,%)
металла рассчитывали по формуле:
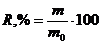
где m-масса
сорбата,
m0-масса
металла в исходном растворе.
2.10 Групповое
концентрирование Cu2+, Co2+,Ni2+ и Cd2+
Для изучение возможности группового
концентрирования в 20 мл раствора с заданным рН вносили по 5, 10, 15, 20, 25
мкг Cu2+,Co2+;
Ni2+ и Cd2+.
Растворы встряхивали с 0,05г сорбента в течение 1 часа. Концентрацию металлов в
растворе после сорбции определяли методом ИСП АЭС. Для построения
градуировочного графика в колбы на 25 мл вносили 20 мл раствора с заданными рН
и 0,25, 0,5, 0,75, 1,25 мл раствора Cu2+,Co2+;
Ni2+ и Cd2
с концентрацией 2 мкг/мл. Из результатов ИСП-АЭС были рассчитаны значения
концентрационного коэффициента распределения D
по формуле [54].
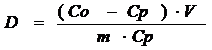
где С р -остаточная равновесная
концентрация извлекаемого элемента в растворе, моль/л
С о - концентрация элемента в
исходном растворе, моль/л,
m-масса
воздушно-сухого сорбента,г;
V- объем
исследуемого раствора, л.
2.11
Групповое концентрирование Cu2+, Co2+,Ni2+ и Cd2+ в условиях имитации
солевого фона
.11.1
Речные воды
Для имитации речных вод готовили
фон, характерный для речной воды.
Таблица 3 - Концентрации ионов для
речного фона
|
Ионы
|
Na+
|
Mg2+
|
Ca2+
|
K+
|
Cl-
|
SO42-
|
HCO3-
|
|
С
мг/мл
|
5,8
|
3,4
|
20
|
2,1
|
5,7
|
12
|
35
|
Затем готовили растворы содержащие буфер с
заданным рН, фон и 10, 20 мкг Cu2+,Co2+;
Ni2+ и Cd2+.
Таблица 4 - Состав растворов для 10, 20 мкг Cu2+,Co2+;
Ni2+ и Cd2+
с речным фоном
|
Объем
буферного раствора с рН=8,мл
|
Фон
концентрации солей 0,1 г/л, мл
|
Растворы
металлов с концентрацией 0,01 г/л, мл
|
|
VKHCO3
|
VNaHCO3
|
VMgSO4
|
VCaCl2
|
V(Cu+Co+Ni+Cd)
|
|
0,84
|
2,32
|
1,36
|
8
|
|
|
26,48
|
12,52
|
1
|
|
25,48
|
12,52
|
2
|
Растворы встряхивали с 0,05 г сорбента в течение
1часа, фильтровали. Концентрацию металлов в растворе после сорбции определяли
методом ИСП АЭС
2.11.2 Морские воды
Для имитации морских вод готовили фон,
характерный для морской воды [56].
Таблица 5 - Концентрации ионов для морского фона
|
Ионы
|
Na+
|
Mg2+
|
Ca2+
|
K+
|
Cl-
|
SO42-
|
HCO3-
|
|
С
мг/л
|
10560
|
1270
|
400
|
380
|
18980
|
140
|
Затем готовили растворы содержащие буфер с
заданным рН, фон и 10, 20 мкг Cu2+,Co2+;
Ni2+ и Cd2+.
Таблица 6 - Состав растворов для 10, 20 мкг Cu2+,Co2+;
Ni2+ и Cd2+
с морским фоном
|
Объем
буферного раствора с рН=8,мл
|
Фонконцентрации
солей 100 г/л
|
Растворы
металлов с концентрацией 0,01 г/л
|
|
VKHCO3
|
VNaCl
|
VMgSO4
|
VCaCl2
|
V (Cu+Co+Ni+Cd)
|
|
1,52
|
4,2
|
5,1
|
1,6
|
|
|
26,58
|
12,42
|
1
|
|
25,58
|
12,42
|
2
|
Растворы встряхивали с 0,05 г сорбента в течение
1часа, фильтровали. Концентрацию металлов в растворе после сорбции определяли
методом ИСП АЭС. Исходя из результатов анализа ИСП-АЭС были получены
коэффициенты селективности для каждого металла, которые определяются по
формуле:

где DA и DB -
концентрационные коэффициенты распределения веществ А и D.
2.12 Метод
рентгенофлуоресцентного определения металлов в фазе сорбента
Для построения индивидуальных
градуировочных зависимостей в конические колбы на100 мл вносили 20 мл буферного
раствора рН=8 и 0,5; 1; 1,5; 2; 2,5 мл раствора металла с концентрацией 0,01
мг/л, что соответствует 5, 10, 15, 20, 25 мкг металла. Присыпали 0,05 г
сорбента, встряхивали 1 час, отфильтровывали. Фильтрат высушивали,
спрессовывали в таблетку диаметром 13 мм с 0,1 г борной кислоты. Далее
анализировали методом РФА.(таблица ).
Таблица 7 - Значения угловых коэффициентов,
свободных членов градуировочных функций y=((b±cb)x+(a±ca)) и пределы
обнаружения (xd) металлов
|
Me
|
(a±ca)
|
(b±cb)
|
xd, мкг
|
|
Cu
|
0,05±0,03
|
0,063±0,002
|
2,9
|
|
Co
|
0,07±0,03
|
0,033±0,002
|
5,9
|
|
Ni
|
0,07±0,03
|
0,031±0,002
|
5,8
|
|
Cd
|
0,01±0,02
|
0,01±0,002
|
12,6
|
Для построения градуировочных зависимостей при
совместном присутствии определяемых металлов в конические колбы на100 мл
вносили 20 мл буферного раствора рН=8 и 0,5; 1; 1,5; 2; 2,5 мл раствора с
концентрацией 0,01 мг/л, содержащего Cu2+,
Co2+,Ni2+
и Cd2+. Вносили 0,05 г
сорбента, встряхивали 1 час, отфильтровывали. Фильтрат высушивали,
спрессовывали в таблетку диаметром 13 мм с 0,1 г борной кислоты. Далее
анализировали методом РФА. Из полученных данных были рассчитаны пределы
определения для меди при конкурентной сорбции: Xmin=2,9 мкг, (0,058мг/л).
ЗАКЛЮЧЕНИЕ
Спектр реакций комплексо-образования формазанов,
используемых для аналитических целей, достаточно широк. В последнее время можно
проследить тенденцию осуществления этих реакций на твердых носителях, так как
гетерогенизация классических реакций дает возможность улучшить их
химико-аналитические характеристики благодаря совмещению операций разделения,
концентрирования и детектирования аналитического сигнала в фазе концентрата.
Выбор различных кремнеземов в качестве матрицы для иммобилизации органических
молекул, помимо их коммерческой доступности, обуславливается возможностью
вариабельности классов соединений модифицирующего агента и закрепления его за
счет высокой реакционной способности поверхностных силанольных групп, что
соответственно позволяет изменять характер взаимодействия сорбент-сорбат от
полностью неспецифицеского до электростатического. Поэтому химически
модифицированные кремнеземы находят все большее применение в химическом
анализе, так как позволяют проводить не только предварительное концентрирование
из природных и технологических водных образцов, но и разнообразное
инструментальное детектирование - атомно -абсорбционной, атомно-эмиссионной
спектроскопией с индуктивно связанной плазмой, спектрофотомерией [50] . Однако,
исследования таких материалов показывают, что аналитические свойства
иммобилизованных реагентов существенно отличаются от их свойств в растворе, что
не позволяет проводить экстраполяцию химических свойств, поэтому изучение
характеристик системы «определяемое вещество в растворе - аналитический
реагент, иммобилизованный на поверхности матрицы», является актуальными [51].
Нами представлялось интересным провести постадийную сборку на поверхности
силикагеля формазанового фрагмента и изучить некоторые сорбционные
характеристики полученного материала. Как в случае самих молекул формазанов так
и в случае материалов, содержащих формазановый фрагмент, изучение свойств
целесообразно начинать с их «родовой» структуры. Поэтому в нашей группе был получен
материал на основе силикагеля, содержащий ковалентно иммобилизованную
формазановую группировку представляющий собой фрагмент 1,3,5-
трифенилформазана, который в 1 положении фиксирован к поверхности кремнезема.

Рисунок 18- Силикагель, модифицированный 1,3,5-
трифенилформазаном
Из большого числа литературных источников,
описывающих свойства и применение самих формазанов в химическом анализе можно
отметить, что 1,3,5-трифенилформазан образует в водно-органических средах
комплексные соединения с медью, никелем, кобальтом и кадмием, поэтому именно
эти металлы были выбраны для оценки некоторых сорбционных характеристик
синтезированного материала. Количественную оценку содержания металлов после
проведения сорбционных процессов проводили фотометрически по остаточной
концентрации в элюате в виде комплексов с ПАР.
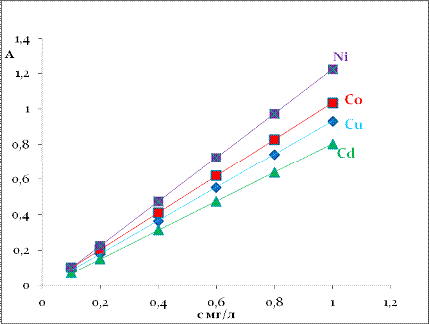
Рисунок 19 - Градуировочная зависимость
аналитического сигнала от концентрации Cu, Co, Ni, Cd
Влияние рН среды на степени извлечения металлов
проводили в диапазоне от 2 до 8 единиц рН, дальнейшее увеличение которого не
желательно вследствие гидролитической неустойчивости матрицы материала.
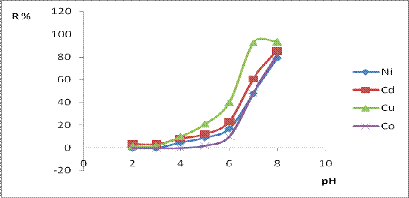
Рисунок 20 - Зависимость степени извлечения
металлов от рН среды
Координационная активность для самого
1,3,5-трифенилформазана по отношению к выбранным металлам и максимальные
коэффициенты распределения элементов на полученном материале наблюдаются в
области рН среды 7,5-8, создаваемым боратным буфером, поэтому для выбранного
диапазона рН было изучено распределение металлов между сорбентом и раствором в
состоянии равновесия и определена максимальная емкость материала для каждого
металла.
А изменение объема водной фазы от 50 мл до 500
мл влияет на степень извлечения при начальных концентрации металла.
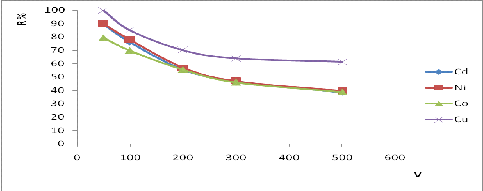
Рисунок 21 - Зависимость степени извлечения
металлов от объема водной фазы
Однако нельзя предсказать поведение полученного
материала в растворах, когда будут иметь место конкурентная сорбция между
выбранными элементами. Поэтому в выбранном диапазоне рН нами были получены
значения коэффициентов распределения в случае совместного присутствия всех
четырех металлов в эквивалентных количествах на разных уровнях начальных
концентраций от 0,25 мг/л до 1,25 мг/л. Остаточную концентрацию элементов
контролировали атомно-эмиссионной спектроскопией.
Таблица 8 - Концентрационные коэффициенты
распределения для Cu2+,Co2+;
Ni2+ и Cd2+
при совместном присутствии
|
cо, мг/л
|
Cu
|
Co
|
Ni
|
Cd
|
|
0,25
|
11,6
|
13,2
|
32,9
|
|
0,5
|
9,4
|
3,0
|
3,6
|
9,9
|
|
0,75
|
25,7
|
3,1
|
4,3
|
10,5
|
|
1
|
14,4
|
0,8
|
1,3
|
2,7
|
|
1,25
|
20,0
|
0,7
|
1,1
|
1,7
|
Как можно заметить, что при контакте химически
модифицированного силикагеля с растворами, с различными значениями начальных
концентраций элементов материал начинает проявлять избирательность при
извлечении ионов меди. Для каждого уровня концентраций были рассчитаны
коэффициенты селективности, которые приведены на слайде. Однако избирательность
материала может быть изменена путем не только варьирования рН среды, но и
изменением солевого фона. Далее нами была предпринята попытка оценить изменение
селективности извлечения исследуемых металлов на полученном материале в
условиях имитации солевого фона, характерного для речных и морских вод, для
уровней концентраций. Как видно увеличение общей минерализации водной фазы до
35 мг/л увеличивает селективность материала по отношению к ионам меди.
Количественная сорбция в случае меди в выбранном диапазоне концентраций
позволила нам оценить возможность детектирования ее рентгенофлуоресцентно после
извлечения непосредственно в фазе сорбента, избегая стадии минерализации
концентрата.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Лисичкин
Г.В., Кудрявцев Г.В., Сердан А.А, Староверов С.М., Юффа А. Я. Модифицированные
кремнеземы в сорбции, катализ и хроматография. М.: Химия 1986.
. Лосев
В.Н., Бахвалова И.П., Кудрина Ю.В., Трофимчук А. К. Сорбционно-фотометрическое
определение осмия после его выделения из газовой фазы силикагелем, химически
модифицированным меркаптогруппами. // Журнал аналитической химии. - 2004. -
Т.59. - №8. - С.796-799.
. Лосев
В.Н., Кудрина Ю.В., Мазняк Н.В., Трофимчук А. К. Применение силикагеля,
химически модифицированного меркаптогруппами, для выделения, концентрирования и
определения палладия спектроскопическими методами. // Журнал аналитической химии.
- 2003. - Т.58. - №2. - С.146-150.
. Яновская
Э.С., Карманов В.И., Слободняк Н.С., Особенности рентгенофлуоресцентного
определения следов токсичных металлов с предварительным извлечением и
концентрированием на силикагеле, химически модифицированном меркаптогруппами.
// Журнал аналитической химии. - 2007. - Т.62. - №6. - С.611-615.
. Лосев
В.Н., Аленникова Ю.В., Елсуфьев Е.В. Трофимчук А. К. Низкотемпературное
сорбционно-люминесценттное определение меди в природных водах с использованием
силикагеля, химически модифицированного меркаптогруппами. // Журнал
аналитической химии. - 2002. - Т.57. - №7. - С.721-725.
. Лосев
В.Н., Елсуфьев Е.В., Аленникова Ю.В., Трофимчук А. К. Низкотемпературное
сорбционно-люминесценттное определение золота с использованием силикагеля,
химически модифицированного меркаптогруппами. // Журнал аналитической химии. -
2003. - Т.58. - №3. - С.269-272.
. Лосев
В.Н., Метелица С. И., Елсуфьев Е.В., Трофимчук А.К. Сорбционно-люминесцентое
определение золота, серебра и платины с использованием силикагеля, химически
модифицированного N-(1,3,4-тиадиазол-2-тиол)-N´пропилмочевинными
группами. // Журнал аналитической химии. - 2009. - Т.64. - №9. - С.926-932.
. Лосев
В.Н., Елсуфьев Е.В., Трофимчук А.К., Метелица С. И., Бойченко И. Н.
Сорбционно-люминесцентое определение меди с использованием силикагеля,
химически модифицированного N-(1,3,4-тиадиазол-2тиол)N´пропилмочевинными
группами. // Журнал аналитической химии. - 2009. - Т.64. - №4. - С.360-364.
. Тертых
В.А.//Адсорбция и адсорбенты -1983.- Вып.11. - С.3-11
. Тертых
В.А., Чуйко А.А., Неймарк И.Е.// Теоритическая и экспериментальная химия -
1965.- 1,№3. - С.400-405
11. Culler
S.R., Ishida H., Koenig J.L. //Ibid. - 1985.- 106,№2. - P.334-346
12. Киселев
А.В., Лыгин В.И., Щепалин К.Л.//Оптические методы в адсорбции и катализе. -
Иркутск.-1980-С.34-41.
. Белякова
Л.А., Тертых В.А., Бортун А.И.//Химическая технология-1987.- Вып.2. - С.3-10
. Белякова
Л.А., Варварин А.М., Мельникова Л.С., Бондаренко Л. И.// Химическая
технология-1988.- Вып.3. - С.70-72
15. Salah
A. Idris, Khalid Alotaibi, Tanya A. Peshkur, Peter Anderson, Lorraine T.
Gibson. Preconcentration and selective extraction of chromium species in water
samples using amino modified mesoporous silica // Talanta. - 2012. -
V386.-P.344-349.
16. Диденко
Т. А., Веревкина О. А. Синтез и исследование свойств химически
модифицированного силикагеля с привитыми аминогруппами.// Омский научный
вестник-2003-№3-С.44-47
. Шаров
А.В., Филистеев О.В. Строение и взаимодействие с растворами металлоиндикаторов
силикагелей, модифицированных моноэтаноламином.// Вестник Курганского
государственного университета -2010- Вып.№3-С. 74-80.
18. Salah
A. Idris, Khalid Alotaibi, Tanya A. Peshkur, Peter Anderson, Lorraine T.
Gibson. Preconcentration and selective extraction of chromium species in water
samples using amino modified mesoporous silica // Talanta. - 2012. -
V386.P.344-349.
19. Amer
A.G., Al Abdel Hamid , Sofian
Kanan. An infrared study of adsorbed metal
ions on modified silica: Comparative chelation between mercury,cadmium,
and Lead divalent ions to silica functionalized with ortho- and
para-aminothiophenoles./ Vibrational Spectroscopy. -2011-№57-P.254-260
. Zhifeng
Tu, Zheng Hu, Xijun Chang, Lijun Zhang, Qun He, Jianping Shi, Ru Gao. Silica
gel modified with 1-(2-aminoethyl)-3-phenylurea for selective
solid-phaseextraction and preconcentration of Sc(III) from environmental
samples Talanta. - 2010. - V80.P.1205-1209
. Dang
Viet Quang, Jong Kil Kim, Pradip B. Sarawade, Dang Huu Tuan, Hee Taik Kim.
Preparation of amino-functionalized silica for copper removal from an aqueous
solution.// Journal of Industrial andEngineering Chemistry.-2012. - №12.
P.83-88.
. Fabrice
Cuoq, Armand Masion, Jérôme
Labille, Jérôme
Rose, Fabio Ziarelli , Benedicte Prelot c,Jean-Yves Bottero. Preparation of
amino-functionalized silica in aqueous conditions.// Applied Surface Science. -
2003.-№266.- P.155-160.
23. Яновская
Э. С. , Тертых В. А, Карманов В. И. , Дадашев А. Д. , Одинец Е.В., Кичкирук О.
Ю. Высокочувствительное сорбционно-рентгенофлуоресцентное определение свинца,
кадмия и ртути в природной воде с использованием модифицированного силикагеля
// Вісник Харківського національного університету.- 2008.- № 820. -С.168-174.
24. Tertykh
V.A., Yanishpolskii V.V., Panova O.Yu. Covalent attachment of some phenol
derivatives to the silica surface by use of single-stage aminomethylation. //
J. Therm. Anal. Cal. - 2000. - 62-
№2.
- P.545-549.
25. Запорожец
О.А., Билоконь С.Л. Визуальный тест-метод определения селена (IV)
иммобилизованным на кремнеземе индиокармином. // Журнал аналитической химии. -
2007. - Т.62. - №3. - С.208-212
26. Girdinic
V., Luterotti S., Stefanini-Oresic L. Analytical Profile on the Resin Sport
Test. Boca Raton, Florida:
CRC Press, Inc.,-1990.
-
P.12
27. Брыкина
Г.Д., Лебедева Г. Г.,Агапова Г. Ф.// Журнал аналитической химии. - 1990. -
Т.45. - №9. - С.1838
. Трутнева
Л. М., Швоева О. П., Саввин С. Б.// Журнал аналитической химии. - 1989. - Т.44.
- №10. - С.1804
. Шемирани
Ф., Миррошандел А.А., Ниасари М.С., Козани Р. Р. Силикагель модифицированный
шиффовыми основаниями. Синтез и применение в качестве адсорбента при
определении кадмия, меди, цинка и никеля методом пламенной атомно-абсорбционной
спектрометрии с предварительным концентрированием. //
Журнал
аналитической
химии.
- 2004. - Т.59. - №8. - С.261-266.
. Akbar
Bagheri, Mohammad Behbahani, Mostafa M. Amini, Omid Sadeghi, Mohsen Taghizade,
Lida Baghayi, Mani Salarian. Simultaneous separation and determination of trace
amounts of Cd(II) and Cu(II) in environmental samples using novel
diphenylcarbazide modified nanoporous silica // Talanta. - 2012. -
V89.-P.455-361.
31. Даванков
В.А. Журнал всесоюзного химического общества им.
Менделеева-1989.-34-№3-С.377-386.
32. Gubitz
G., Jellenz W.//J. Cromatogr.-1981-203,№2-P.377-386.
33. Малиновский
В.А., Староверов С.М., Лисичкин Г.В.//Журнал общей химии-1985-50,вып.12 -
С.2767-2772.
34. Roumeliotis
R., Unger K.K., Kurganov A.A., Davankov V.A.// J. Cromatogr.-1983-255,№1-P.51-66.
35. Шаров
А.В., Филистеев О.В., Воронцов Б.С. Термическая стабильность и протолитические
свойства силикагелей, модифицированных некоторыми аминокислотами.
36. Andrea
J. O’Connor , Akiko Hokura, Jenny M. Kisler Shogo Shimazu, Geoffrey W. Stevens,
Yu Komatsu. Amino acid adsorption onto mesoporous silica molecular sieves.//
Separation and Purification
Technology. - 2006- №48.- P. 197-201.
. Jakab
I.N., Hernadi K., Me´hn
D., Kolla´r
T., Pa´linko´
I. Anchoring copper-amino acid complexes on silica or in montmorillonite-an
FT-IR study.// Journal of Molecular Structure. -2003. - P.109-114.
38. Воронина
Р. Д., Зоров Н.Б. Высокочувствительное сорбционно-люминесцентное определение
следов европия с предварительным концентрированием на кремнеземе, химически
модифицированном иминодиуксусной кислотой.// Журнал аналитической химии. -
2007. - Т.67. - №3. С. 230-237.
. Запорожец
О. А., Линник Р. П., Воловенко О. Б., Радзиевская Т. М. Иммобилизованный на
кремнеземе 1-(-адамантил-2-тиазолилазо)-2-нафтол в анализе сосуществующих форм
меди в природных водах// Методы и объекты химического анализа. -2007. -Т.2.-
№3.- С. 40-50
40. Dierssen
H., Balzer W., Landing W.M. Simplified synthesis of an 8-hydroxyquinoline
chelating resin and a study of trace metal profiles from Jellyfish Lake, Palau
// Marine chemistry.- 2001.-V. 73. -P. -173-192.
. Landing
W.M., Haraldsson C., Paxeus N.Vinyl polymer agglomerate based transition metal
cation chelating ion-exchange resin containing the 8-hydroxyquinoline
functional group // Anal. chem.-1986.
-V.
58. -P.
3031-3035.
42. Холин
Ю.В., Зайцев В.Н. Комплексы на поверхности химически модифицированных
кремнеземов. Харьков: Фолио, 1997.-С. 135.
. Семенова
Н.В., Моросанова Е.И., Плетнев И.В., Золотов Ю.А. Сорбционные патроны,
нековалентно модифицированные 8-оксихинолином, для выделения, концентрирования
и атомно-абсорбционного определения кадмия и свинца // Журнал аналитической
химии. -1994. -Т. 49.- № 5. -С. 477-480.
. Лосев
В.Н. , Дидух С.Л., Буйко Е.В. , Метелица С.И., Трофимчук А.К. Применение
кремнезема, модифицированного полигексаметиленгуанидом и
8-оксихинолин-5-сульфокислотой, для концентрирования и
сорбионно-атомно-эмиссионного определения металлов в природных водах.//
Аналитика и контроль. -2009.- Т. 13.- № 1.-С.33-39.
. Денискин
А.В., Волкова Г.В. , Метелица С.И. Синтез и исследование сорбентов на основе
диоксида кремния для сорбионно-атомно-эмиссионного определения цветных металлов
в природных водах. // Молодые ученые в решении актуальных проблем науки.
Сборник статей студентов, аспирантов и молодых ученых по итогам Всероссийской
научно-практической конференции, посвященной 80-летию Сибирского
государственного технологического университета. - 2010 г. - Том 2 -С.208-213.
. Первова
И.Г., Маслакова Т.И., Скорых Т.В., Мельник Т.А., Липунов И.Н. Сорбционно-аналитические
свойства минеральных сорбентов с иммобилизованными гетарилформазановыми
группировками.// Сорбционные и хроматографические процессы.- 2009. -Т. 9. -
Вып. 3 - С.383-390.
. Яблоков
В.Е., Ищенко Н.В., Алексеев С.А.Сорбционное концентрирование ионов кадмия и
свинца в виде комплексов с унитиолом на поверхности силикагеля,
модифицированного группами четвертичной аммониевой соли. // Журнал
аналитической химии. - 2013. - Т.68. - №3. - С.224-229.
. Запорожец
О.А., Цюкало Л.Е. Тест-определение свинца и цинка в воде с использованием
иммобилизованного на кремнеземе ксиленового оранжевого. // Журнал аналитической
химии. - 2004. - Т.59. - №4. - С.434-439.
. Г.В.
Лисичкин, А.Ю. Фадеев, А.А. Сердан, П.Н. Нестеренко, П.Г. Мингелев, Д.Б. Фурман
химия привитых поверхностных соединений М:Физматлит 2003 592.
. Иммобилизация
аналитических реагентов на поверхности носителей О.А. Запорожец, О.М., Гавер,
В.В. Сухан. Успехи химии 66 (7) 1997 702-712.
. Золотов
Ю.А. Основы аналитической химии. Кн.1. Общие вопросы. Методы разделения. // М.:
Высш. шк. - 2002. - С. - 351.
. Жуховицкий
А.А. Физическая химия // М.: Металлургия. - 2001. - С 687.
. Москвин
Л.Н., Родинков О.В. Методы разделения и концентрирования в аналитической
химии// Долгопрудный Изд. Дом Интеллект - 2011.
55. Тарасова
Н. П., Кузнецов В. А., Сметанников Ю. В., Малков А. В., Додонова А. А. Задачи и
вопросы по химии окружающей среды.// М.: Мир, 2002. - С.368 .
56. Preparation
of artificial seawater the oceans their physics, chemistry, and general
biology. // University of California press. - 2004. - P. - 186