Отработка методики изучения кинетических зависимостей диффузионной проницаемости мембран при их контакте с фосфат-содержащими сточными водами
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное
образовательное учреждение высшего профессионального образования
"КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ"
(ФГБОУ ВПО «КубГУ»)
Кафедра физической химии
КУРСОВАЯ РАБОТА
ОТРАБОТКА МЕТОДИКИ ИЗУЧЕНИЯ
КИНЕТИЧЕСКИХ ЗАВИСИМОСТЕЙ ДИФФУЗИОННОЙ ПРОНИЦАЕМОСТИ МЕМБРАН ПРИ ИХ КОНТАКТЕ С
ФОСФАТ-СОДЕРЖАЩИМИ СТОЧНЫМИ ВОДАМИ
Краснодар 2015
Реферат
Курсовая работа содержит 32 страницы, 10рисунков, 3 таблицы, 11 литературных
источников.
ДИФФУЗИОННАЯ ПРОНИЦАЕМОСТЬ, ПРОМЫШЛЕННЫЕ АНИОНООБМЕННЫЕ МЕМБРАНЫ,
РАСТВОРЫ ФОСФАТОВ, ГИДРОТАРТРАТОВ, ГИДРОКАРБОНАТОВ
В качестве объектов исследования были выбраны гетерогенные мембраны
имеющие разный состав фиксированных групп и AMX-SB и FTAM-EDI, которая показывала наилучшие результаты по
электропроводности. В качестве рабочих растворов были выбраны следующие
растворы: гидрокарбонат натрия, который не вступает в реакции протолиза и будет
выступать в роли стандарта т.к. поведение мембран в данном растворе хорошо
изучено. Раствор NaH2PO4, который склонен к реакциям протолиза.
Целью работы было исследования транспортных характеристик мембран в
растворах амфолитов.
Получены концентрационные зависимости диффузионной проницаемости FTAM-EDI, AMX-SB. Произведено сравнение
концентрационных зависимости диффузионной проницаемости АОМ в растворах
электролитов , вступающих и не вступающих в реакции протолиза.
Показано, что эти зависимости имеют различный
вид: соотношение мольных долей диффундирующих через мембрану частиц зависит от
концентрации раствора с отдающей стороны мембраны
ВВЕДЕНИЕ
Техносферная опасность - совокупность производственных, социальных и
природных опасностей, ведущих к разрушению техносферы. Кроме того, вне
зависимости от сферы и режима работы, оказывается влияние негативных сил на
человека. В данном случае, под «безопасностью» предполагается способность
человека противостоять негативным факторам. Специалисты этого направления
следят за перспективами технологий защиты человека и природы от последствий
промышленной деятельности. Еще несколько лет назад мы говорили об охране труда.
Сейчас управление техносферной безопасностью предполагает знание не только
инструкций и правил по технике безопасности, но и экологического законодательства,
мировых стандартов относительно охраны окружающей среды.
Одним из вызов современности является
постоянное улучшение ситуации в окружающей среде, связанные с поступлением
вредных отравляющих веществ. В последнее время особо остро стоит вопрос с
поступлением фосфатов, в связи с развитием винодеятельной промышленности на
Кубани, а также с продуктами, остающимися в результате переработки вина. Данные
продукты содержат тартраты. Мембранные методы являются весьма перспективными
для решения этой проблемы.
Проблему с поступлением в природную среду тартратов, фосфатов и других
веществ, относящихся к классу амфолитов можно решить с использованием
мембранных технологий. Для этого необходимо знать, как изменяются свойства
ионообменных мембран, когда они находятся в контакте с данными веществами.
Одной из важнейших характеристик является диффузионная проницаемость. До
настоящего времени основной способ измерения считался, измерение в хлориде
натрия, а в случае более сложных веществ нам необходим иной способ. В результате
чего появляется необходимость измерить диффузионную проницаемость, но в данном
случае остается вопрос как производить расчет концентраций отдельных
компонентов фосфатов с принимающей стороны раствора.
Целью работы является отработка методики изучения кинетической
зависимости диффузионной проницаемости мембран при их контакте с
фосфат-содержащими сточными водами.
Задачей работы является разработка алгоритма расчета концентраций
отдельных компонентов фосфатов в тракте с принимающей стороны мембраны.
1. АНАЛИТИЧЕСКИЙ ОБЗОР
Мы живем в бурное время. Исключив все социальные процессы, можно смело
утверждать, что техника и технологии определяют нашу жизнь. Конечно, до
описанных фантастами миров, в которых роль человека - лишь наблюдать и
философствовать, а всем обеспечением существования заняты машины и механизмы,
нам еще далеко. Но понятие "техносферная безопасность" уже не из
фантастических романов. Наша среда обитания, которую принято называть
техносферой, несет множество опасностей как человеку, так и природе. В первую
очередь это определяется наличием сложнейших промышленных комплексов, неполадки
в работе которых могут привести к экологическим катастрофам. Техносферная
опасность - совокупность производственных, социальных и природных опасностей,
ведущих к разрушению техносферы. Кроме того, вне зависимости от сферы и режима
работы, оказывается влияние негативных сил на человека. В данном случае, под
«безопасностью» предполагается способность человека противостоять негативным
факторам. Специалисты этого направления следят за перспективами технологий
защиты человека и природы от последствий промышленной деятельности. Еще
несколько лет назад мы говорили об охране труда. Сейчас управление техносферной
безопасностью предполагает знание не только инструкций и правил по технике
безопасности, но и экологического законодательства, мировых стандартов
относительно охраны окружающей среды.
.1 Фосфаты
Фосфа́ты - соли фосфорных кислот, например ортофосфат калия K3PO4.
Различают ортофосфаты и конденсированные фосфаты, содержащие более одного атома
P, образующие связи P-O-P.
У всех ортофосфатов есть свойство: безводные соли стабильны при
нагревании до температуры плавления, которая для разных солей колеблется в
диапазоне от 830°C(у фосфата свинца) до 1605°C(у фосфата бария). Фосфаты в
основном плохо растворимы, в отличие от дигидрофосфатов. Растворимы только
фосфаты калия, натрия и аммония. Фосфаты обладают общими свойствами солей:
Взаимодействуют с сильными кислотами (они превращают нерастворимый фосфат в
растворимый дигидрофосфат):
 (1)
(1)
Взаимодействуют с другими растворимыми солями:
 (2)
(2)
При нагревании выше 2000C° разлагаются на оксиды:
 (3)
(3)
Фосфаты являются питательными веществами, и имеют важное значение для
человека, животных и растений. Они имеют важные функции в ключевых
биохимических процессах, таких как метаболизм. Наше тело состоит из многих
фосфорсодержащих соединений, которые играют важную роль в генетическом
материале, клеточных мембранах , зубах и костях , человеческих энергетических
системах и клеточных сигнальных системах , которые регулируют разнообразные
функции от кислотно-щелочного баланса в организме до гормональных реакций .
Кроме того , растения также нуждаются в фосфоре и фосфорсодержащих соединениях,
которые являются жизненно важными для фотосинтеза. Также фосфаты это природные
питательные вещества, необходимые для роста растений, и являются наиболее
устойчивыми соединениями фосфора, доставляемыми к корням растений. При выборе
удобрения содержание фосфора является одним из ключевых моментов, наряду с
уровнем азота ( для роста и озеленения ) и калия ( для устойчивости к засухе и
болезням ). Высоко растворимые в воде фосфаты аммония и соли калия фосфата
могут быть смешаны с другими источниками азота и калия или других веществ для
удовлетворения конкретных потребностей в удобрении. Также они выступают в
качестве ключевого ингредиента во многих чистящих и моющих средствах. Они имеют
несколько функций, обеспечивающих свойства, которые повышают эффективность
различных продуктов данного типа. Фосфаты помогают удалить ионы любой
твердости, присутствующие в воде (такие как кальций, магний или железо), а
также позволяют другим компонентам в процессе очистки работать более
эффективно. Также фосфаты помогают удалить частицы грязи с очищаемой
поверхности, через суспензию мелких частиц для эффективного удаления при
полоскании. Благодаря возможности фосфатов буферизации , компоненты почвы или
средств очистки предотвращаются от сдвига их рН уровня, который может уменьшить
его оптимальную эффективность при очистке. Фосфаты имеют три преимущества:
применение фосфатов подготавливает воду или очищаемую поверхность, образуя
ловушку и удерживая грязь или масла, таким образом, что они становятся легко
смываемыми при полоскании.
.2 Гидрокарбонаты
Гидрокарбонаты - кислые соли угольной кислоты H2CO3. Формула аниона:
HCO3-. Устаревшие названия гидрокарбонатов: кислый углекислый, двууглекислый,
бикарбонаты. Гидрокарбонаты щелочных металлов в воде растворимы. Также в воде
хорошо растворимы гидрокарбонаты щелочноземельных металлов, в отличие от
карбонатов. При нагревании гидрокарбонаты разлагаются на соответствующий
карбонат, воду и углекислый газ:
Гидролиз гидрокарбонат-иона происходит по схеме:
 (4)
(4)
В итоге раствор гидрокарбонатов имеет щелочную реакцию.
Реагирует со щелочами:
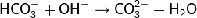 (5)
(5)
С кислотами:
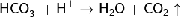 (6)
(6)
Гидрокарбонаты в большом количестве содержатся в питьевой воде.
Соответственно изменению свойств воды при кипячении различают временную и
постоянную жесткость. Первая называется карбонатной жесткостью; она состоит из
разлагающихся при кипячении гидрокарбонатов кальция и магния. Постоянную
жесткость называют также некарбонатной, она вызывается наличием сульфатов
кальция и магния и подобных соединений. Карбонатная и некарбонатная жесткость
вместе дают общую жесткость.
В организме гидрокарбонаты выполняют важную физиологическую роль, являясь
буферными веществами, регулирующими постоянство реакции крови. Нормативы
рекомендуют концентрацию гидрокарбонатов в питьевой воде в диапазоне 30-400
мг/дм3.
.3 Гидротартрат калия
Гидротартрат калия - органическое соединение, кислая соль калия и винной
кислоты с формулой KC4H5O6, бесцветные кристаллы, слабо растворяется в воде,
имеет оптические изомеры. Входит в состав пищевой добавки Е336, которая
используется в пищевых продуктах в качестве антиоксиданта, подкислителя,
регулятора кислотности, эмульгатора, стабилизирует окраску продуктов, усиливает
действие антиоксидантов. Также он применяется в фармакологии и в химическом
анализе.
.4 Мембранные системы водоподготовки
Мембранные системы водоподготовки, промышленное освоение которых началось
примерно с 1985 года, в настоящее время применяются практически во всех
отраслях, потребляющих очищенную воду. Первые искусственные мембраны были
изготовлены в XIX веке из обработанной в азотной кислоте клетчатки (целлюлозы)
- сырья, которое является ничем иным как оболочками растительных клеток, то
есть природными мембранами. Из нитрата целлюлозы научились делать целлулоид, а
позднее целлофан, но с обнаруженной у них микропористостью активно боролись,
так как хотели получить в первую очередь защитные материалы, непроницаемые для
воздуха и влаги. И только в 1960 году Лоэбом и Соурираджаном была изобретена
мембрана из другого вида модифицированной целлюлозы - ацетата, которая была уже
пригодна для практического применения. Широкое внедрение мембранных процессов в
практику стало возможно благодаря развитию науки о полимерах и использованию
синтетических полимерных мембран. Мембраны, как и другие фильтрующие материалы,
можно рассматривать как полупроницаемые среды: они пропускают воду, но не
пропускают, точнее, хуже пропускают некоторые примеси. Однако если обычное
фильтрование применяют для удаления из воды относительно крупных образований -
дисперсных и крупных коллоидных примесей, то мембранные технологии - для
извлечения мелких коллоидных частиц, а также растворенных соединений. Для этого
мембраны должны иметь поры очень малого размера. Движущей силой, заставляющей
жидкость проникать через препятствие в виде тонкой перегородки, может быть: а)
приложенное давление; б) разница концентраций растворенных веществ; в) разница
температур по обе стороны перегородки; г) электродвижущая сила. В этой части мы
ограничимся рассмотрением баромембранных явлений - процессов разделения под
действием давления. Основное отличие мембран от обычных фильтрующих сред
состоит в том, что они тонкие, и удаляемые примеси задерживаются не в объеме, а
только на поверхности мембраны. Грязеемкость поверхности, очевидно, гораздо
меньше, чем у объема. Казалось бы, мембрана должна из-за этого очень быстро
засориться и перестать пропускать воду. Так бы оно и было, если бы в мембранном
фильтре не происходило постоянного самоочищения мембраны. Для этого применяется
так называемая «тангенциальная» схема движения воды в аппарате, при которой
собирают воду с обеих сторон мембраны: одна часть потока проходит через
мембрану и образует фильтрат (или пермеат), то есть очищенную воду, а другую
направляют вдоль поверхности мембраны, чтобы смывать задержанные примеси и
удалять их из зоны фильтрации. Эта часть потока называется концентратом или
ретентатом, и обычно ее либо сбрасывают в дренаж, либо (например, при очистке
гальванических стоков) отводят для дальнейшей обработки и выделения нужных
компонентов. Таким образом, узел мембранной фильтрации имеет один вход и два
выхода, и часть воды постоянно расходуется на очистку мембраны. (В
двухступенчатых мембранных установках концентрат второй ступени может быть
значительно чище, чем исходная вода, поэтому его можно использовать, подавая
снова на вход установки. Таким способом добиваются снижения расхода воды. С
точки зрения технологических возможностей различают мембраны для
ультрафильтрации, нанофильтрации и обратного осмоса. В этом ряду размер пор
уменьшается, а рабочее давление растет.
Ультрафильтрационные мембраны имеют наиболее крупные поры диаметром от 1
до 0,05 микрон (1 мкм=10-6 м) и работают обычно при давлениях 2-5 бар. Они
применяются, например, для доочистки питьевой водопроводной воды от коллоидных
и высокомолекулярных загрязнений, если не требуется корректировка ее солевого
состава.
Нанофильтрационные элементы (поры 5-50 нм, или 0,05-0,005 мкм) используют
для умягчения воды с повышенной жесткостью, для удаления ионов тяжелых металлов
и хлороорганики. Одновалентные ионы, такие как Na+, K+,
Cl-, NO3- задерживаются слабо - в среднем не
более 10-30%. Рабочее давление нанофильтрации обычно не превышает 5-7 бар.
Обратноосмотические мембраны имеют поры диаметром менее 10 нанометров
(менее 0,01 мкм), работают при давлениях до 100 бар и позволяют осуществлять
глубокое обессоливание, или деминерализацию. Обратный осмос применяют для
получения сверхчистой воды для производственных нужд, а также для опреснения
морской и солоноватых подземных вод, причем степень обессоливания
(селективность) составляет обычно не менее 92-97%. Мембраны могут иметь
различную геометрическую форму: трубчатые, половолоконные и плоские. Трубчатые
мембраны представляют собой трубки диаметром от нескольких миллиметров до 1-2
см, изготовленные из пористого материала, например керамики. При этом они могут
быть симметричными или асимметричными. Симметричная мембрана имеет одинаковую
пористость по всему объему материала. У асимметричной же трубки на одной из
поверхностей - наружной или внутренней - при изготовлении формируют тонкий слой
такого же или другого материала с гораздо большей плотностью. Этот слой и
является работающим, так как именно он определяет задерживающую способность
мембраны. Более крупнопористый материал играет роль подложки-носителя с
дренажными свойствами. Подача очищаемой воды осуществляется со стороны рабочей
поверхности. Мембраны в виде полых волокон (Hollow Fibre) тоже имеют трубчатую
форму, но их диаметр составляет обычно от 0,1 до 0,5 мм. Из-за такого малого
размера в единицу объема фильтровального аппарата можно поместить огромное
количество волокон, и их суммарная рабочая поверхность будет в десятки и даже
сотни раз выше, чем у трубчатых мембран большого диаметра (см. табл.). Имея
развитую рабочую поверхность, половолоконные фильтры обладают и гораздо
большей, по сравнению с трубчатыми, производительностью при прочих равных
условиях - давлении, размере пор и т. д. Однако это преимущество имеет и
оборотную сторону: из-за того, что движение очищаемой жидкости вдоль рабочей
поверхности каждого волокна трудно контролировать и регулировать, волоконная
мембрана имеет склонность к загрязнению, а очистка ее поверхности крайне
затруднена. Поэтому половолоконные фильтры создают больше проблем при
эксплуатации, требуют тщательной предварительной очистки подаваемой на обработку
воды. Кроме того, обладая самой высокой плотностью упаковки, волокна имеют и
самый толстый рабочий слой мембраны (относительно всей толщины стенки), поэтому
их пропускная способность в пересчете на единицу рабочей поверхности может
уступать другим мембранам.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
.1 Объекты исследований
В качестве объектов исследования выбраны
серийно выпускаемые гомогенная (AMX-SB) и
гетерогенная (FTAM-EDI)
анионообменные мембраны, которые представляются перспективными для
использования в электродиализных процессах переработки фосфат-, карбонат- и
тартрат- содержащих растворов. Равновесные характеристики этих мембран
представлены в таблице. 1.
Таблица 1 - Объекты исследования
|
Мембрана
|
Производитель
|
Фиксированные группы
|
Толщина,микроны в 0,02М растворе
NaCl
|
|
FTAM-EDI
|
Fumatech, Германия
|
-N+(CH3)3
|
560±10
|
|
AMX-SB
|
Аstom, Япония
|
-N+(CH3)3
|
545±10
|
2.2 Методика исследования диффузионной
проницаемости мембран
Диффузионная проницаемость мембран
исследована с использованием проточной ячейки, которая позволяет контролировать
толщину диффузионного слоя. Эта методика базируется на следующих теоретических
представлениях.
Диффузионные процессы происходят в мембранной системе как процессы
направленного перераспределения вещества под действием градиента химического
потенциала, а в простейшем случае - градиента концентрации.
Используем стационарный метод, при котором поток растворенного вещества
не зависит ни от времени, ни от координаты.
Выбранный экспериментальный метод исследования явления диффузии основан
на применении первого закона Фика:
y = -D dc/dx (8)
где y - поток вещества;- коэффициент
диффузии;
С - концентрация;
ф - время.
Схема экспериментальной установки приведена на рисунке 1. Перед началом
эксперимента проводим солевую подготовку мембраны. Выставляем скорость
протекания жидкости с дистиллированной водой, с нашим раствором. Далее отмываем
электроды pH метра и кондуктометра
соответственно. Далее проводим измерения электропроводности и pH. После проведенных измерений, отмываем
электроды от раствора. Также промываем емкость с дистиллированной водой.
Выливаем воду из ячейки с мембраной. Погружаем наши электроды в емкость с
дистиллированной водой (6). Далее берем вспомогательную емкость (6) и в момент
ее наполнения дистиллированной водой, используя секундомер, проводим измерения.
Проток жидкости в камерах ячейки (1) обеспечивается разностью гидростатических
давлений между устройствами ввода раствора в ячейку (1), и вспомогательной
емкостью (6), а также емкостью (5), в которую помещена погружная
кондуктометрическая ячейка, соединенная с кондуктометром Эксперт-001(8). В
контур емкости (5) перед каждым экспериментом заливают 100 мл дистиллированной
воды с сопротивлением не менее 400 кОм см. И с помощью насоса прокачивают
раствор из емкости (5) через ячейку в цикле. Из емкости (6) в ячейку подают
концентрированный раствор соли. Объем раствора в контуре емкости (6) составляет
5 л.

- экспериментальная ячейка; 2 - исследуемая мембрана; 3 - камера с дистиллированной
водой; 4 - камера с раствором электролита; 5 - емкость с дистиллированной
водой; 6 - емкость с раствором электролита; 7 - насосы; 8 - кондуктометр; 9 -
кондуктометрическая ячейка; 10,11,12,13-шланги.
Рисунок 1- Схема установки для измерения коэффициента диффузионной
проницаемости мембран
Для того, чтобы поддерживать постоянное
гидростатическое давление в течение эксперимента, трубка, соединяющая
устройство вывода концентрированного раствора из ячейки (1) зафиксирована в
крышке емкости с концентрированным раствором (6). Значения скорости протока
регулируются насосами (7). Концентрацию раствора в контуре емкости (6)
контролируют перед началом и после окончания каждого эксперимента. В процессе
эксперимента концентрацию раствора в емкости (5) непрерывно регистрируют через заданные промежутки времени с
использованием кондуктометрической ячейки (9) и кондуктометра (10) и с помощью
ПК строят зависимость приращения концентрации электролита в контуре емкости (5)
от времени проведения эксперимента.
Получаемая зависимость непрерывно обрабатывается методом наименьших
квадратов.
В случае растворов NaCl
расчёт концентрации ионов нетрудно рассчитать по значениям электропроводности и
pH раствора. Для таких расчётов
используют втрое приближение теории Дебая-Гюккеля и закон Кальрауша.
Найденные по уравнению регрессии значения 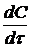 подставляют в уравнение для
определения интегрального коэффициента диффузионной проницаемости
подставляют в уравнение для
определения интегрального коэффициента диффузионной проницаемости
 , (9)
, (9)
где dМБ - толщина мембраны;
S
-площадь контактирующая с раствором поверхности;
 - объем дистиллированной воды (или более разбавленного
раствора электролита).
- объем дистиллированной воды (или более разбавленного
раствора электролита).
В емкости (5) с принимающей стороны мембраны,  , т.е. концентрации раствора в
емкости (6) с отдающей стороны мембраны., т.к. концентрация раствора в емкости
(5) близка к нулю в начальный момент времени.
, т.е. концентрации раствора в
емкости (6) с отдающей стороны мембраны., т.к. концентрация раствора в емкости
(5) близка к нулю в начальный момент времени.
Гидрокарбонат натрия (NaHCO3), является
универсальным абсорбентом; присутствует в природных и сточных водах.
Гидрокарбонат- и карбонат- ионы являются неотъемлемой частью минерального
состава вод мирового океана, поверхностных и артезианских пресных вод,
применяются в пищевой, металлургической, химической промышленности, в медицине
и в быту.
Дигидрофосфат натрия (NaH2PO4) входит в
состав большинства коммунальных стоков, сточных вод химических производств и
буферных растворов для разделения протеинов, аминокислот и продуктов
биохимического синтеза. Гидрофосфат- и дигидрофосфат ионы входят в большинство
буферных растворов. Эти растворы нередко добавляют в перерабатываемую смесь для
поддержания заданного значения pH при фракционировании белков и аминокислот.
Они широко применяются в качестве влагоудерживающих добавок при производстве
колбасных изделий в пищевой промышленности, а также химической промышленности и
медицине.
Дигидрофосфат натрия (NaH2PO4). Анион дигидрофосфата имеет структурную формулу:

Для растворов ортофосфорной кислоты и её анионов характерны реакции
протолиза (23-28) с константами ионизации при 25°С:

 (10)
(10)
 (11)
(11)

 (12)
(12)
 (13)
(13)

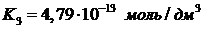 (14)
(14)
 (15)
(15)
Согласно константам химического равновесия уравнений (10-15), равенство
концентраций ортофосфорной кислоты H3PO4 и иона дигидрофосфата H2PO4- наблюдается при значении pH = 2.16
(рисунок 4). Равенство концентраций ионов дигидрофосфата H2PO4- и гидрофосфата HPO42- имеет место при значении pH = 7.21.
Равенство концентраций ионов гидрофосфата HPO42- и фосфата PO43- достигается при значении pH = 12.32.
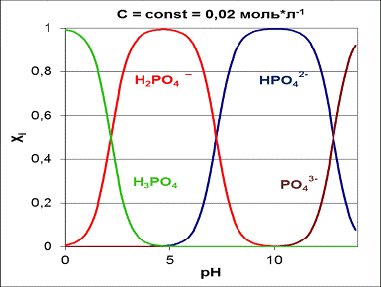
Рисунок 4 - Содержание в растворе H3PO4 и ионов Н2PO4-, HPО42-,
PO43- (в мольных долях Xi) в зависимости от рН раствора
Максимальные, близкие к 100% количества H3PO4, H2PO4-, HPO42-, PO43- содержатся в растворе при значениях pH, равных соответственно
0.5, 5.0, 10.0, 14.0. Промежуточным значениям pH соответствует смесь этих анионов [8]. Соли фосфорной кислоты
хорошо растворимы в воде (таблица 1).
Таблица 1 − Растворимость солей ортофосфорной кислоты в воде (г/
100г насыщ.р-ра) при различных температурах
|
t,єС
|
Na3PO4
|
Na2HPO4
|
NaH2PO4
|
|
0
|
4.28
|
1.66
|
36.5
|
|
10
|
7.30
|
4.19
|
41.1
|
|
20
|
10.8
|
7.51
|
46.0
|
|
25
|
12.6
|
10.6
|
48.7
|
|
30
|
14.1
|
16.3
|
51.5
|
|
40
|
16.6
|
35.6
|
57.9
|
|
50
|
22.9
|
44.6
|
61.7
|
|
60
|
28.4
|
45.2
|
62.3
|
|
70
|
32.4
|
65.9
|
|
80
|
37.6
|
48.8
|
68.7
|
Гидрокарбонат натрия (NaНСО3). Карбонат- и гидрокарбонат- ионы
имеют следующие структурные формулы, соответственно:


Для угольной кислоты и её анионов характерны следующие реакции протолиза
[43] с константами
протолитических реакций при 25°С:

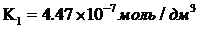 (16)
(16)
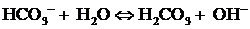 (17)
(17)

 (18)
(18)
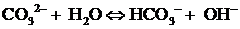 (19)
(19)
Согласно расчётам, сделанным с использованием констант химического
равновесия (уравнения (29-32), [10]), равенству концентраций угольной кислоты
CO2*H2O и иона гидрокарбоната HCO3- соответствует
значение pH = 6.35 (рисунок 5). Равенство концентраций иона
гидрокарбоната HCO3- и иона карбоната CO32-
достигается при значении pH = 10.31. В максимальных количествах, близких к
100%, CO2*H2O, HCO3-, CO32-
будут находиться в растворе при значениях pH, равных соответственно 4.0, 8.4,
12.6.
Протолиз - обратимый процесс, поэтому сдвиг pH раствора влечет за собой
изменение соотношения концентраций ионных форм и молекул.

Рисунок 5 - Содержание в растворе СО2 и ионов НСО-,
СО32- (в мольных долях Xi) в зависимости от рН раствора
В новой модификации микрогетерогенной модели было учтено протекание
реакций протолиза при взаимодействии мембраны с раствором амфолита, так же было
учтено влияние доннановского исключения продукта этих реакций.
Данная модель реализована в виде программы для компьютера, которая
позволяет рассчитывать концентраций отдельных ионов, удельную
электропроводность гелевой фазы, pH мембраны и раствора.
Таблица 3 − Растворимость солей угольной кислоты в воде (г/100гнасыщ.
р-ра) при различных температурах
|
t,єС
|
Na2CO3
|
NaHCO3
|
|
0
|
6.44
|
6.48
|
|
10
|
10.8
|
7.59
|
|
20
|
17.9
|
8.73
|
|
25
|
23.5
|
9.32
|
|
30
|
28.7
|
9.91
|
|
40
|
32.8
|
11.1
|
|
50
|
32.2
|
12.4
|
|
60
|
31.7
|
13.7
|
|
70
|
31.3
|
15.0
|
|
80
|
31.1
|
16.4
|
|
90
|
30.9
|
17.7
|
|
100
|
30.9
|
19.1
|
В модифицированной микрогетерогенной модели принимается что:
электронейтральный раствор, содержащийся в центральных частях крупных
пор, аналогичен внешнему раствору;
анионообменная мембрана содержит только сильноосновные фиксированные
группы (которые не участвуют в реакциях протолиза и не вступают во
взаимодействие с амфолитами);
во внутреннем и внешнем растворах имеют место реакции протолиза амфолита;
часть продуктов реакций протолиза удаляется из мембраны вследствие
доннановского исключения ко-ионов.
учитывается зависимость объемной доли электронейтрального раствора в
мембране от концентрации.
В случае фосфат- содержащих растворов задача усложняется.
Рассмотрим математический аппарат модели, на примере анионообменной
мембраны, уравновешенной с раствором дигидрофосфата натрия (NaH2PO4). В данной системе учитывается возможность протекания
следующих групп реакций: реакции диссоциации фосфорной кислоты по первой ,
второй и третьей ступеням и реакция диссоциации воды.
 (20)
(20)
 (21)
(21)
 (22)
(22)
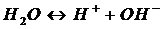 (23)
(23)
В первую группу этой системы будут входить уравнения, описывающие
равновесие в растворе:
 (24)
(24)
 (25)
(25)
 (26)
(26)
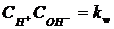 (27)
(27)
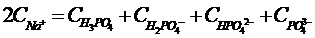 (28)
(28)
 (29)
(29)
Из уравнения (24):
 (30)
(30)
Из уравнения (25):
 (31)
(31)
Из уравнения (26):
 (32)
(32)
Из уравнения (27):
 (33)
(33)
Из уравнений (28), (30), (31), (32):
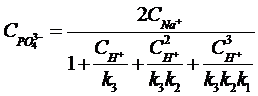 (34)
(34)
где Сi - концентрация компонента i;1, k2 и
k3 - константы диссоциации фосфорной кислоты по первой, второй и
третей ступеням;w − ионное произведение воды.
Во вторую группу данной системы будут входить уравнения описывающие
равновесие в гелевой фазе мембраны:
 (35)
(35)
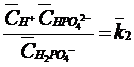 (36)
(36)
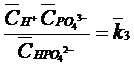 (37)
(37)
 (38)
(38)
 (39)
(39)
Объемные концентрации противоионов и ко-ионов связаны соотношением
Доннана:
 (40)
(40)
 (41)
(41)
Из уравнения (41)
 (42)
(42)
Из уравнения (30):
 (43)
(43)
Из уравнения (31):
 (44)
(44)
Из уравнения (31):
 (45)
(45)
Их уравнения (45):
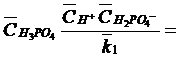 (46)
(46)
В данных графиках нам известно: СH+ , k
Необходимо определить: СHА- , СА2- , СH2А , Ск+
Уравнение Кольрауша:
 (47)
(47)
Уравнение электронейтральности:
 +
+ +
+ (48)
(48)
Аналогичным образом производятся расчёты для карбонат- и тартрат-
содержащих растворов.
Данная модель ионных равновесий реализована в виде программы (рисунок 8),
позволяющей рассчитывать концентрации ионов по зависимостям рН (рисунок 6) и
удельной электропроводности растворов (рисунок 7) от времени с момента начала
эксперимента.

Рисунок 6- Зависимость pH от
времени с момента начала эксперимента

Рисунок 7- Зависимость удельной электропроводности от времени с начала
эксперимента

Рисунок 8 - Интерфейс программы для расчёта концентраций отдельных
компонентов тартрат-содержащего раствора по значениям его pH и электропроводности
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
.1 Результаты расчета концентраций отдельных компонентов
На рисунке 9 представлены результаты расчета концентраций отдельных
компонентов тартрат-содержащего раствора.

Рисунок 9 - Результаты расчета концентраций отдельных компонентов
тартрат-содержащего раствора в случае, когда мембрана контактирует с 0,02 М
раствором KHT
Из полученных данных следует, что в первый момент времени с момента
начала эксперимента преобладающей формой являются двухзарядные ионы. Затем
стремительно нарастает концентрация однозарядных ионов. Кинетическая
зависимость этих ионов хорошо описывается линейным уравнением. Зависимости для
других ионов носят более сложный характер.
Рассчитанные по этим и аналогичным зависимостям диффузионные потоки,
полученные при разных концентрациях тартрата калия в тракте с отдающей стороны
мембраны представлены на рисунке 10.
.2 Зависимость диффузионных потоков HT-(а), T2- (б), H2T(с)
через мембрану AMX-SB от концентрации контактирующего с
ней раствора KHT
На рисунке 10 представлена зависимость диффузионных потоков от
концентрации контактирующего с ней раствора.
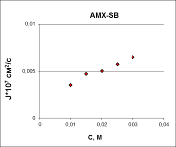 а
а  б
б

в
Рисунок 10 - Зависимость диффузионных потоков HT-(а), T2- (б), H2T(с)
через мембрану AMX-SB от концентрации контактирующего с
ней раствора KHT
Из полученных зависимостей следует, что с увеличением концентрации
раствора гидротартрата калия с отдающей стороны мембраны, диффузионный поток
ионов в однозарядной форме стремительно нарастает. Вместе с тем, практически во
всем исследованном диапазоне концентраций потоки двухзарядных тартрат-ионов и
молекулярной формы практически не зависят от концентрации. В очень разбавленном
щ.щ1М растворе эти потоки уменьшаются. Причина наблюдаемого явления пока не
ясна. Чтобы решить эту проблему, требуются дополнительные исследования.
мембрана ортофосфорный электропроводность
ЗАКЛЮЧЕНИЕ
Предложен способ определения концентраций
каждого из компонентов фосфат содержащего раствора, в тракте экспериментальной
ячейки с принимающей стороны мембраны. Этот способ включает в себя измерение
электропроводности и pH раствора и расчёт
отдельных концентраций анионов и молекулярной формы ортофосфорной кислоты с
использованием уравнений химического равновесия.
Аналогичный алгоритм определения отдельных
компонентов раствора применен для изучения транспортных характеристик мембран в
растворах гидротартрата калия. Получены концентрационные зависимости
диффузионных потоков одно-, двух- зарядных ионов тартратов и молекулярной формы
винной кислоты.
Показано, что эти зависимости имеют различный
вид: соотношение мольных долей диффундирующих через мембрану частиц зависит от
концентрации раствора с отдающей стороны мембраны.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1 Габриелян, О.С. / Химия 9. / О.С. Габриелян - М.:
Вентана-Граф, 2010. - С. 287.
Хомченко, Г.П. / Химия для поступающих в вузы. / Г.П.
Хомченко - М.: Высшая школа, 1994. - С. 447.
http://dic.academic.ru/dic.nsf/bse/145551/Фосфаты
Кнунянц, И.Л. / Химическая энциклопедия. / И. Л. Кнунянц -
М.: Большая Российская Энциклопедия, 1992. - 639 с\.
http://allencyclopedia.ru/17882
Кнунянц, И.Л. / Химическая энциклопедия / И.Л. Кнунянц - М.:
Советская энциклопедия, 1988. - Т. 1. - 623 с.
8 Koga, Y. / Ultrasonic velocity and absorption
studies in aqueous electrolytes; in: Solution Thermodynamics and Its
Application to Aqueous Solutions: A Differential Approach. / Y. Koga -
Amsterdam: Elsevier. - 2007. P. 521
9 Roques, H. / Fondements thйoriques du
traitment chimique des eaux / H. Roques- Paris: Technique et Documentation
-Lavoisier. - 1990. - V. 1, 2. - P. 904
10 Волков, А.И. / Большой химический справочник / А.И.
Волков, И.М.Жарский. - М.: Современная школа. - 2005. - 608с.- ISBN985-
-04-7.
Карпенко, Л.В. / Сравнительное изучение методов
определения удельной электропроводности ионообменных мембран / Л.В. Карпенко, О.А.
Демина, Г.А. Дворкина, С.Б. Паршиков, К. Ларше, Н.П. Березина // Электрохимия.
- 2001. - Т. 37, № 3. - С. 328-335.