Методы определения гафния
ФЕДЕРАЛЬНОЕ
АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО
ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«АЛТАЙСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Химический
факультет
Кафедра
аналитической химии
Курсовая
работа
МЕТОДЫ
ОПРЕДЕЛЕНИЯ ГАФНИЯ
Выполнила студентка
Панченко Наталья Сергеевна
Барнаул 2015
Содержание
Введение
. Методы определения гафния
.1 Характеристика и свойства
элемента
.2 Спектрофотометрические методы
анализа
.2.1 Ализариновый метод
.2.2 Определения гафния с арсеназо
.2.3 Определение гафния с помощью
ксиленового орнажевого
.2.4 Определение гафния с помощью
пирокатехинового фиолетового
.2.5 Определение гафния с помощью
кверцетина
.2.6 Определение гафния с помощью
морина
.2.7 Сравнение реагентов по
чувствительности
.3 Электрохимические методы анализа
.3.1 Амперометрическое определение
гафния
. Определение гафния
спектрофотометрическим методом анализа
.1 Фотометрическое определение
содержание гафния(IV)
с помощью ксиленолового оранжевого
.2 Обсуждение результатов
Заключение
Библиографический список
Введение
В современной химии существует много различных
методов исследования химических соединений, веществ и материалов. В настоящее
время все большее значение для объективной идентификации и количественного
определения веществ, приобретают физико-химические методы исследования. Важное
практическое значение имеют методы, основанные на исследовании испускания и
поглощения электромагнитного излучения в различных областях спектра. К ним
относится спектроскопия (например, люминесцентный анализ, спектральный анализ,
нефелометрия и турбидиметрия и др.). Так же к важным физико-химическим методам
относятся электрохимические методы, использующие измерение электрических
свойств вещества (кондуктометрия, кулонометрия, потенциометрия и т.д.).
Физико-химические методы анализа имеют ряд преимуществ перед классическими
химическими методами. Они основаны на использовании как физических, так и
химических свойств веществ и в большинстве случаев отличаются экспрессностью,
избирательностью, высокой чувствительностью и возможностью автоматизации.
В данной работе рассмотрены физико-химические
методы анализа определения гафния. В практической части этой работы для
определения элемента использован спектрофотометрический метод анализа.
Целью моей работы является определение гафния
спектрофотометри-ческим методом анализа.
Предметом исследования является гафний.
Задачи: - Изучить литературу и сделать краткий
оброз методик;
Выбрать методику определения;
Провести практическую работу;
Оценить полученные результаты и сделать выводы.
1. Методы определения гафния
гафний спектрофотометрический
реагент электрохимический
Близость химических свойств циркония и гафния во
многом определяет специфику аналитических методов определения последнего. Для
количественного определения гафния особое значение приобретают физические
методы (рентгеноспектральные, спектральные и др.). Химические и
физико-химические методы применяются в меньшей степени, так как в этом случае
необходимо предварительное отделение гафния от сопутствующих элементов, в том
числе и от циркония, что связано с большими трудностям из-за сходства их
химических свойств. Оба они имеют высокую степень гидролиза, склонность к
комплексообразованию, а так же их ионные радиусы практически равны.
.1 Характеристика и свойства элемента
Гафний - химический элемент подгруппы титана IV
группы периодической системы элементов Д.И. Менделеева, имеющий порядковый
номер 72.
Он был открыт в 1923 г., т.е. на 134 года позже,
чем ближайший и более распространенный его аналог - цирконий, с которым он
ассоциируется в природе. Цирконий был открыт в 1789 г, вплоть до 1922 г. не
было известно, что цирконий и его соединения всегда содержат небольшие
количества химического элемента с атомным номером 72. Существование этого
элемента было предсказано Д.И. Менделеевым еще в 1870 г. На основании
электронной теории строения атомов Н. Бор предсказал важнейшие свойства гафния.
В 1922 г. Г. Хевеши и Д. Костер при рентгеноспектральном обследовании
норвежских и гренландских цирконов обнаружили новые рентгеновские линии,
которые совпали с характерными линиями, вычисленными для элемента с порядковым
номером 72. Г. Хевеши и Д. Костер в 1923 г. объявили об открытии элемента 72 и
назвали его гафнием, в честь города, в котором было совершено это открытие. В
первые годы после открытия гафния были синтезированы многие его соединения и
изучены их физико-химические свойства, а также методы отделения гафния от
циркония. [1]
В природе гафний встречается исключительно в
виде соединений. Содержание гафния в земной коре составляет 4*10-4%,
т.е. больше содержания висмута, ниобия и ряда других элементов. Гафний
принадлежит к типичным рассеянным элементам. Он всегда сопутствует цирконию и
не образует собственных минералов. Как правило, гафний внедряется в
кристаллическую решетку циркониевых минералов. В большинстве минералов
содержание гафния колеблется от 1-2 до 6-7%, иногда оно значительно меньше и
составляет 0,1-0,2%, а в некоторых разновидностях циркона повышается до 17-24%.
Атомный вес гафния по углеродной шкале 178,49.
Природный гафний состоит из смеси шести устойчивых изотопов [2]: Hf 174,
Hi176, Hf177, Hf178, Hf179 и Hf180.
В последнее время получено большое число радиоактивных изотопов гафния с
массовыми числами 170, 171, 172, 173, 175, 181, 183. Из трех пригодных для
индикаторных целей изотопов гафния (Hf172, Hf175 и Hf181)
наиболее доступен Hf181 (период полураспада 46 дней), который
сравнительно легко получить.
Гафний - металл серебристо-серого цвета, в
компактном состоянии похожий на сталь. Высокочистый гафний обладает высокой
пластичностью, сохраняющийся даже при температуре жидкого азота. На физические
свойства гафния существенно влияют содержащиеся в нем примеси [3]. Значения
таких физических характеристик, как точка плавления, плотность, удельное электросопротивление
и других, в значительной степени зависят от чистоты исследуемых образцов.
Гафний по химическим свойствам похож на цирконий, это объясняется сходством
строения внешних электронных оболочек и близостью размеров атомов циркония и
гафния. Валентность циркония и гафния может быть равна 2, 3 либо 4, причем
устойчивость состояний увеличивается с повышением валентности. Соединения двух-
и трехвалентных циркония и гафния известны, но они малоустойчивы и обладают
сильными восстановительными свойствами. Характерная валентность циркония и
гафния +4.
Гафний, так же как и цирконий, обладает высокой
коррозионной стойкостью. Вода, соляная, азотная и разбавленная серная кислоты,
растворы щелочей практически не действуют на гафний даже при нагревании. Но он
легко растворяется в H2F2 и смеси НС1 и HN03,
при высоких температурах энергично соединяется с кислородом, азотом, водородом,
галогенами, серой, углеродом, кремнием и бором, образуя с последними
тугоплавкие соединения. Основные свойства увеличиваются в ряду Ti<Zr<Hf<Th;
гафний обладает несколько более основными свойствами, чем цирконий. Оба
элемента в водных растворах характеризуются высокой степенью гидролиза,
склонностью к образованию полимеров и к комплексообразованию.[4]
.2 Спектрофотометричекие методы анализа
Спектрофотометрические методы определения гафния
основаны на образовании его ионами окрашенных соединений с различными
органическими реагентами.
Реагенты в основном относятся к трем группам
органических красителей: трифенилметановым соединениям, азосоединениям и
оксикетоновым красителям.
Особенно характерны как реагенты для гафния
азосоединения с сочетанием таких группировок, как остаток мышьяковой кислоты
-As03H2 и группы ОН в орто-положении к азогруппе
(арсеназо I, арсеназо III и др.):

А также трифенилметановые красители:
ксиленоловый оранжевый, метилтимоловый синий, пирокатехиновый фиолетовый и др.
Из фотометрических методов следует
отдать предпочтение методам с применением ксиленолового оранжевого и арсеназо
III, позволяющим с большой точностью и чувствительностью определять малые
количества гафния в любых материалах и в различных средах, а также методу с
применением пирокатехинового фиолетового. В солянокислой среде с успехом могут
быть применены также арсеназо I и ализарин S.
.2.1 Ализариновый метод
Определение гафния с ализарином S
(натриевая соль 1,2-диоксиантрахинон-З-сульфокислоты) рекомендуется проводить в
растворах 0,2-0,3-н. соляной, хлорной или азотной кислот при 510-560 нм. В этих
растворах закон Бугера - Ламберта - Бера соблюдается до 10 мкг/мл. Углубление
окраски на холоду при такой кислотности протекает очень медленно, что иногда
приводит к невоспроизводимым результатам. Для ускорения процесса рекомендуется
предварительный нагрев раствора ализаринового комплекса гафния с высокой
кислотностью (1,5-3,5-н.). Для устранения влияния некоторых примесей Н. С.
Полуэктов и Л. И. Кононенко предложили проводить фотометрирование при
контрольном растворе, содержащем анализируемый объект, реактив и комплексон III.
Последний в определенных условиях связывает гафний в растворимый бесцветный
комплекс, не изменяя окраски других, присутствующих в растворе, ионов металлов.
Гафний с ализарином S образуют соединения состава 1:1:
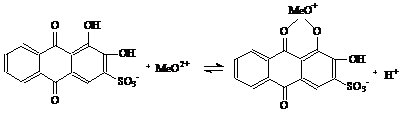
константа диссоциации равна 2,3* 10-7.
В менее кислых растворах (pH 1-2,5) образуется второй комплекс с отношением
гафния к ализарину S 1:2; его log Ку = 10,2. Растворы этого
соединения подчиняются закону Бугера - Ламберта - Бера при концентрации гафния
от 0,79 до 35,6 мг/л. Ализариновый метод позволяет определять НfO2 в смеси
окислов с точностью ±2%.
.2.2 Определение гафния с арсеназо
о-Оксиазосоединения, содержащие
арсоногруппу, осаждают в кислой среде некоторые металлы, в том числе и гафний,
при этом происходит резкое изменение окраски реактива. Для фотометрического
определения гафния применяют арсеназо I и арсеназо III. Наличие остатка
мышьяковой кислоты в молекуле арсеназо увеличивает скорость протекания реакции.
Углубление окраски после смешения, растворов происходит практически мгновенно и
полностью, что делает результаты более надежными, чем в случае ализарина S.
Арсеназо I синтезировал и предложил
В.И. Кузнецов для определения циркония и гафния. Арсеназо I в нейтральных и
кислых водных растворах имеет розовую окраску, в присутствии гафния -
фиолетовую. Анализ проводят [5] в растворах, содержащих, кроме определяемых
элементов, 0,1-0,25 моль/л НС1 в присутствии желатины (0,5 мг/мл) при 570 нм.
Закон Бугера - Ламберта - Бера соблюдается до концентрации 8 мкг/мл. При
наличии в растворе примесей (Ti, Та, Nb), мешающих определению, рекомендуется
применять раствор сравнения, приготовленный из анализируемой пробы с арсеназо I
и комплексоном III.
Гафниевый комплекс с арсеназо I
менее прочен, чем циркониевый, поэтому с увеличением кислотности раствора,
когда подавляется диссоциация реактива, степень образования комплекса гафния
снижается больше, чем циркония. Так, в растворе, содержащем 1-н. НС1, гафний
почти не реагирует с арсеназо I (оптическая плотность раствора в 19 раз меньше,
чем в 0,25-н НС1).
Реактив арсеназо III - 1,8-диосинафт
алин-3,6-дисульфокислота-2, 7-бис-[(азо-1)-2-фениларсоновая кислота]:

образует с катионами металлов более
прочные соединения, чем арсеназо I, что позволяет определять гафний в
сильнокислых растворах (от 1 до 11-н. НС1), в которых реакция протекает с
высокой избирательностью. Кроме того, в таких условиях практически отсутствуют
процессы гидролиза и образования полиядерных катионов гафния, что обеспечивает
высокую стабильность и хорошую воспроизводимость результатов. Состав комплексов
зависит от кислотности среды и соотношения реагирующих компонентов. В 1-н. НС1
отношение Me: арсеназо III в гафниевом комплексе равно 2: 3 (по-видимому, смесь
соединений состава 1: 1 и 1: 2), в 4-н. НС1 - 1:2 [6].
По данным С.В. Елинсона и Н.А.
Мирзояна [6], максимум оптической плотности соединений обоих металлов
устанавливается при 1-н. НС1. С увеличением кислотности до 4-н. оптическая
плотность гафниевого комплекса резко падает.
Определение малых количеств гафния
(от 5 до 50 мкг в 50 мл) в отсутствие циркония с арсеназо III рекомендуют
проводить в 1-н. НС1. В случае ультрамалых количеств гафния для увеличения
чувствительности определение следует проводить в 6- или 9-н. НС1 [7].
1.2.3 Определение гафния с помощью
ксиленолового оранжевого
.2.4 Определение гафния с помощью
пирокатехинового фиолетового
Пирокатехиновый фиолетовый (ПКФ)
образует с гафнием окрашенные соединения с максимумом поглощения при 625-655
нм. Определение рекомендуется проводить в 4-н. серной кислоте [8]. Предложен
экстракционно-фотометрический метод определения гафния в сталях, сплавах и
различных металлах.
Он включает экстрагирование гафния
три-н-октилфосфиноксидом, реэкстракцию 7-н. азотной кислотой и фотометрирование
водно-этанольного раствора комплексов с ПКФ при 655 нм. Молярный коэффициент
поглощения комплекса гафния с ПКФ равен приблизительно 40000.
.2.5 Определение гафния с помощью
кверцетина
Кверцетин (3,5,7,3',
4'-пентаоксифлавон), испытанный как реактив для колориметрического определения
циркония, рекомендован и для определения гафния, которое основано на том, что
комплекс циркония с кверцетином значительно легче разлагается перекисью
водорода, чем гафниевый.
В растворе, содержащем 9 моль/л
хлорной кислоты и 2,5% этанола, комплекс гафния с кверцетином сильно
флуоресцирует при λ возбуждения
340 нм; максимум флуоресценции наблюдается при 505 нм. Интенсивность
флуоресценции пропорциональна содержанию гафния от 1 до 20 мкг при концентрации
кверцетина 1,5*10-5 моль/л.
Кверцетинсульфокислота или её
натриевая соль образуют с гафнием желтый комплекс состава 1:1 с максимумом
поглощения при 420 нм. Молярный коэффициент светопоглощения гафниевого
соединения в 0,2-н. НС1 равен 2,67*104. Спектрофотометрическое
определение гафния проводят в растворах, содержащих от 1до 30 мкг гафния,
0,2-0,5-н. НС1 и 2,23*104 моль/л кверцетина.
.2.6 Определение гафния с помощью
морина
Морин (3,5, 7, 2',
4'-пентаоксифлавон) образует с гафнием окрашенный комплекс состава 1:2 с
молярным коэффициентом поглощения 6,22*104 при 420 нм. Определение
гафния при помощи морина проводится в растворе, содержащем 66% воды, 30% ацетон
и 4% этанола, при концентрации 0,5 моль/л НС1 и 2,64*104 моль/л
морина. Закон Бугера - Ламберта - Бера соблюдается при содержании гафния 1-40
мкг в 50 мл.
Исследование комплексообразования
гафния с морином в солянокислых и сернокислых средах и показало, что в
сернокислых растворах чувствительность флуоресцентного определения гафния
составляет 5 мкг в 1 л раствора.
.2.7 Сравнение реагентов по
чувствительности
Таб. 1 Сравнительные характеристики
реагентов.
|
Реагент
|
Условия
|
Состав
комплекса
|
λкомп., нм
|
∆λ, нм
|
𝜀
|
|
Ализарин
S
|
0,2-0,3
н. HCl, HClO4, HNO3
|
1:1
|
510-560
|
100-150
|
7000
|
|
Арсеназо
I
|
0,1
-0,25 М HCl
|
1:1
|
570
|
60
|
9700
|
|
Арсеназо
III
|
1-11
н. НС1
|
при
1 н. НС1 2: 3 при 4 н. НС1 1:2
|
при
1 н. НС1 665 при 9 н. 625
|
при
1н.130
при
4 н.90
|
при
1н. НС1 13600 при 9н. 95000
|
|
Ксиленоловый
оранжевый
|
0,5-1,0
н. HClO4 0,5 М НС1
|
1:1
|
540
|
100
|
48700
|
|
Пирокатехи
новый фиолетовый
|
4
н. H2SO4
|
1:1
|
655
|
205
|
40000
|
|
Кверцетин
|
0,2-0,5
М НС1
|
1:1
|
420
|
60
|
26700
|
|
Морин
|
0,5
М НС1
|
1:2
|
420
|
70
|
62200
|
Из фотометрических методов следует отдать
предпочтение методам с применением ализарина S,
арсеназо I, арсеназо III, ксиленолового оранжевого, пирокатехинового
фиолетового, кверцетина и морина. Эти реагенты образуют с ионами гафния
сравнительно прочные окрашенные комплексы, а интенсивность их окраски мало
меняется при небольших колебаниях кислотности. Самыми чувствительными
реактивами по отношению к гафнию является арсеназо III и ксиленоловый
оранжевый. В практической части работы определение гафния проведено с помощью
ксиленолового оранжевого.
.3 Электрохимические методы анализа
.3.1 Амперометрическое определение гафния
Амперометрическое определение гафния в
растворах, не содержащих циркония, возможно при помощи купферона и при помощи
тартразина и флавазина. Титрование проводят по току восстановления купферона на
ртутном капающем электроде при -0,65 В (Нас. КЭ) на фоне 1 н. серной кислоты.
По-видимому, можно заменить ртутный электрод платиновым, проводя титрование по
току окисления купферона при +0,8 (Нас. КЭ), тогда отпадает необходимость
удаления растворенного кислорода воздуха, которое необходимо при работе с
ртутным электродом. Состав осадка купфероната гафния отвечает формуле Нf(Купф)4.
Второй метод заключается в титровании
тартразином или флавазином, также образующими осадки с гафнием. Рекомендуется
титровать при рН=1-1,5 с ртутным капающим электродом при 1,8 В (Нас. КЭ) и 70
°С. Кислород необходимо удалять. Хотя этот метод предложен для определения
малых количеств гафния (от 0,3 до 2 мг), что является положительной, его
стороной, он все же, надо полагать, весьма неудобен для практического
использования.
Простой и удобный метод определения гафния
заключается в титровании его раствором ЭДТА в сильнокислой среде (серная
кислота, pH = 0,4-0,8), в которой большинство катионов не образует
комплексонатов. Титруют на установке с танталовым электродом при +1,2 В (Нас.
КЭ) Определяемое количество гафния - от 1 до 40 мг в титруемом объеме [9].
2. Определение гафния спектрофотометрическим
методом анализа
Гафний схож по свойствам с цирконием и является
полным его аналогом. Его можно определять теми же методами, что и цирконий,
поэтому в практической части работы вместо гафния за определяемый металл взят
цирконий.
.1 Фотометрическое определение содержание
гафния(IV) с помощью ксиленолового оранжевого
Сущность методики
Аппаратура
Колориметр фотоэлектрический КФК-2.
Кюветы стеклянные, 0,300 см.
Посуда и реактивы
Пипетки градуированные вместимостью 1,00, 5,00 и
10,00 мл.
Колбы мерные вместимостью 50,00 мл, 100,00 мл,
1,00 л.
Цилиндр мерный вместимостью 20 мл.
Стакан химический вместимостью 100 мл.
Навеска оксихлорид циркония 0,1 г.
Серная кислота, 0,5 моль/л раствор.
Ксиленоловый оранжевый, водный раствор 1мг/мл.
Ход работы
Ход работы включает следующие этапы:
) Приготовление растворов циркония.
) Построение градуировочного графика.
) Анализ раствора с неизвестной концентрацией
циркония.
) Расчет результатов определения.
) Приготовление растворов циркония.
Стандартный раствор циркония, содержащий 1
мг/мл: 0,1 г оксихлорид циркония помещают в жаростойкий стакан и растворяют при
нагревании в 3 мл концентрированной серной кислоте в присутствии 0,3 г
сернокислого аммония. Полученный раствор переводят в мерную колбу вместимостью
100 мл и доводят до метки водой (конечная кислотность раствора ~ 0,5 моль/л по
серной кислоте).
Раствор циркония рабочий, содержащий 10 мкг/мл
циркония, готовят в день употребления разбавлением стандартного раствора серной
кислотой 0,5 моль/л в 100 раз.
) Построение градуировочного графика.
В мерные колбы вместимостью 50 мл вводят от 0,0
до 6,0 мл рабочего раствора циркония с интервалом 1мл. Во все колбы добавляют
до 20 мл серной кислоты 0,5 моль/л, по 2,5 мл раствора ксиленолового
оранжевого, перемешивая после добавления каждого реактива, доводят до метки
водой и снова перемешивают. В одну из колб приливают все реактивы за
исключением циркония (нулевой раствор). Через 30 мин (окрашенные растворы
устойчивы 7-8 ч) измеряют оптическую плотность растворов на
фотоэлектроколориметре при λmax
= 540 нм в кювет с толщиной поглощающего свет слоя 30 мм по отношению к
нулевому раствору. По полученным данным строят градуировочный график в
координатах: значение оптической плотности - концентрация циркония. Отдельные
точки графика проверяют одновременно с проведением анализа проб.
) Анализ раствора с неизвестной концентрацией
циркония.
Для определения циркония в две мерные колбы
вместимостью 50 мл отбирают равные аликвотные части раствора, разбавляют до 20
мл серной кислотой 0,5 моль/л. Затем в обе колбы приливают по 2,5 мл раствора
ксиленолового оранжевого, доводят до метки водой и перемешивают. Через 30 мин
измеряют оптическую плотность раствора относительно нулевого раствора на
фотоэлектроколориметре при λmax
= 540 нм в кювете с толщиной поглощающего свет слоя 30 мм.
) Расчет результатов определения.
.2 Обсуждение результатов
Концентрацию рабочего раствора 10мкг/мл
пересчитаем на колбу 50 мл, получим 500мкг/50 мл.
Предварительные расчеты концентраций в
зависимости от аликвоты:
Таб. 2 Результаты измерений оптической плотности
растворов циркония с ксиленоловым оранжевым.
|
Номер
колбы
|
Объем
аликвоты рабочего раствора, мл
|
Концентрация
циркония в 50 мл раствора, мкг
|
Оптическая
плотность раствора
|
Концентрация
циркония, мкг/мл
|
|
1
|
1,00
|
10,0
|
0,030
|
0,20
|
|
2
|
2,00
|
20,0
|
0,070
|
0,40
|
|
3
|
3,00
|
30,0
|
0,120
|
0,60
|
|
4
|
4,00
|
40,0
|
0,150
|
0,80
|
|
5
|
5,00
|
50,0
|
0,180
|
1,00
|
|
6
|
6,00
|
60,0
|
0,230
|
1,20
|
Расчет уравнения градуировочного графика методом
МНК.
Уравнение в общем виде выглядит так:
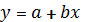
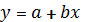 .
.
Таб. 3. Вычисления коэффициентов
регрессии.
|
i
|
xi
|
yi
|
y2i
|
xi
yi
|
|
1
|
0,20
|
0,03
|
0,04
|
0,0009
|
0,006
|
|
2
|
0,40
|
0,07
|
0,16
|
0,0049
|
0,028
|
|
3
|
0,60
|
0,120
|
0,36
|
0,0144
|
0,072
|
|
4
|
0,80
|
0,150
|
0,64
|
0,0225
|
0,120
|
|
5
|
1,00
|
0,180
|
1,00
|
0,0324
|
0,180
|
|
Σ
|
4,20
|
0,780
|
3,64
|
0,1280
|
0,682
|
Коэффициенты уравнения рассчитываются по
формулам:

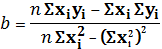


Искомое уравнение: 

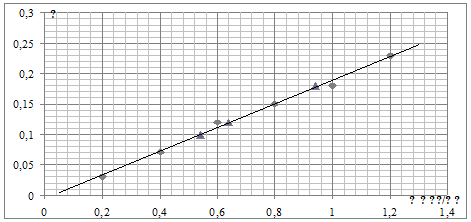
Рис. 1 Зависимость оптической
плотности от концентрации Zr (IV).
Таб. 4. Результаты измерений
оптической плотности анализируемого раствора циркония с ксиленоловым оранжевым.
|
Номер
колбы
|
Объем
аликвоты анализируемого раствора, мл
|
Концентрация
циркония, мкг/мл
|
Оптическая
плотность раствора
|
|
1
|
3,00
|
0,54
|
0,10
|
|
2
|
4,00
|
0,64
|
0,12
|
|
3
|
5,00
|
0,94
|
0,18
|
Вычисляем массу циркония(IV) (m, мг) в
анализируемом растворе:


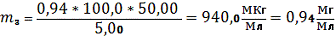
Таб. 5. Статистическая обработка результатов
анализа.
|
m, мг/мл
|
d,
мг/мл
|
S, мг/мл
|
ɛ,
мг/мл
|
  , мг/млSr, % , мг/млSr, %
|
|
|
0,90
|
0,02
|
0,0004
|
0,07
|
0,2
|
0,9±0,2
|
8%
|
|
0,80
|
0,08
|
0,0064
|
|
|
|
|
|
0,94
|
0,06
|
0,0036
|
|
|
|
|
|
  = 0,88 = 0,88
|
|
|
|
|
|
|
Заключение
При написании курсовой работы были изучены
физико-химические методы определения гафния. Для его количественного
определения особое значение приобретают спектрофотометрические методы анализа,
основанные на способности гафния образовывать окрашенные соединения со многими
органическими веществами. Фотометрические методы являются более быстрыми и
удобными для определения малых содержаний гафния в различных соединениях.
Электрохимические методы применяются в меньшей
степени, так как гафний в некоторых методах является не активным элементом и не
восстанавливается на катоде, но применяют косвенные методы для его определения.
Проведя фотометрическое определение
содержание гафния(IV) с помощью ксиленолового оранжевого, была определена масса
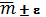
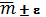 = (0,9±0,2) мг
= (0,9±0,2) мг
Библиографический список
1. Ластмен Б., Керз Ф. Металлургия
циркония. - М.: Издательство иностранной литературы, 1959. - 419 с.
. Несмеянов, А. В. Лапицкий, Н. П.
Руденко Н.П.. Получение радиоактивных изотопов. - М.: Госхимиздат, 1954. - 192
с.
. Миллер Г.Л. Цирконий. - М.:
Издательство иностранной литературы, 1955. - 392 с.
. Елинсон С.В., Петров К.И.
Аналитическая химия Циркония и Гафния. - М.: изд. «Наука», 1965. - 241 с.
5. Кононенко Л.И., Лауэр Р.С.,
Полуэктов Н.С. - Укр. хим. журн., 1959. - №25. - с. 633
. Елинсон С.В., Мирзоян Н.А. Методы
получения химических реактивов и препаратов. - Заводск. лаборатория, 1961. -
№27. - с. 798
. Шека И.А., Карлышева К.Ф. Химия
Гафния. - Киев: изд. «Наукова думка», 1973. - 458 с.
. Владимирова Л.М., Ягодин Г.А.,
Чекмарев А. М. - Журн. анал. хим., 1967, 22, 1345
. Сонгина О.А., Захаров В.А.
Амперометрическое титрование. - 3-е изд., перераб. - М.: Химия, 1979. - 304 с.