Контроль качества лекарственных средств, содержащих барбитураты
СОДЕРЖАНИЕ
Введение
Глава 1. Органические вещества класса барбитуратов
1.1 Структура
строения барбитуратов синтез и свойства барбитуратов
Глава 2. Контроль качества лекарственных средств, содержащих
барбитураты
2.1 Общие
методы определения подлинности лекарственных средств, содержащих барбитураты
.2 Испытание
на чистоту лекарственных средств, содержащих барбитуратов
.3 Общие
методы количественного определения барбитуратов
.4 Хранение и
применение барбитуратов
Заключение
Список литературы
ВВЕДЕНИЕ
Барбитураты - группа лекарственных веществ, производных барбитуровой
кислоты, обладающих снотворным, противосудорожным и наркотическим действием,
обусловленным угнетающим влиянием на центральную нервную систему.
Барбитураты вошли в медицинскую практику в начале двадцатого века. Более
чем 2500 барбитуратов были синтезированы и на пике их популярности около 50
видов продавались для употребления. На сегодня всего лишь около дюжины из них
принимаются.
Барбитураты - снотворные лекарства, к которым при длительном применении
возникает привыкание. В последние годы стали предметом повышенного интереса
токсикоманов.
В медицине наиболее широко используются следующие из них - барбитал,
барбамил, фенобарбитал (также называемый люминалом) и этаминал - натрий.
Злоупотребление барбитуратами характерно для больных алкоголизмом и опиоманией.
Это может быть связано с тем, что склонность к приему барбитуратов наследуется
по тому же механизму, что и склонность к потреблению алкоголя и опиатов.
Помимо своего основного лекарственного эффекта, барбитураты вызывают
слабую эйфорию.
Это их свойство все больше и больше привлекает людей, злоупотребляющих
снотворными, и в конце концов становиться для них самоцелью. Не догадываясь в
большинстве своем об опасности бесконтрольного приема барбитуратов, они могут
попасть в физическую зависимость от них.
А выражаться эта зависимость может в форме цепкого абстинентного
синдрома. При сильной передозировке барбитуратов (более 4-6 г за прием)
возможны смертельные исходы вследствие паралича дыхательного центра и развития
комы. Следует учитывать, что при слишком частом приеме барбитуратов их дозы
суммируются, что создает серьёзную угрозу для здоровья даже при приёме
относительно невысоких разовых доз.
Действие барбитуратов противоположно действию амфетаминов: они подавляют
центральную нервную систему. В малых дозах они действуют как транквилизаторы, а
в больших они снотворные. Сон с барбитуратами - ненормальный сон, т.к. они
подавляют все виды нормальной активности во время сна.
Продолжительный прием снотворных ведет к полному психологическому сдвигу,
т.к. у разума не остается пути реализовать себя. Барбитураты вызывают
склонность к суициду.
Барбитураты - это седативное лекарство. Обычно их прописывают как
снотворные, но сейчас их использование с этой целью почти полностью прекращено,
хотя более слабые представители этой группы, такие как фенобарбитал, могут все
еще использоваться для лечения эпилепсии. И тем не менее, барбитураты время от
времени появляются.
Обычно в виде: натрия амитала - как правило, ярко синие капсулы,
содержащие 60 мг лекарства, секонала - оранжевые капсулы по 50 мг и, наконец,
туинал, представляющий собой смесь из 50 мг амитала и 50 мг секонала, который,
что неудивительно, выпускается в наполовину оранжевых, наполовину синих капсулах.
Кто бы не был ответственен за дизайн этих капсул, он несомненно обладал
способностями к продаже препаратов опиатникам и ипохондрикам.
В связи с этим изучение свойств барбитуратов является очень актуальным.
Целью курсовой работы является изучение контроля качества лекарственных
средств, содержащих барбитураты. Для достижения поставленной цели перед нами
были предопределены следующие задачи:
изучить структуру строения барбитуратов синтез и свойства барбитуратов
изучить синтез и свойства барбитуратов
изучить общие методы определения подлинности лекарственных средств,
содержащих барбитураты
рассмотреть методы определения на чистоту лекарственных средств,
содержащих барбитуратов
определить общие методы количественного определения барбитуратов
- хранение и применение барбитуратов.
ГЛАВА 1. ОРГАНИЧЕСКИЕ ВЕЩЕСТВА КЛАССА БАРБИТУРАТОВ
.1 Структура строения барбитуратов синтез и свойства барбитуратов
Производные барбитуровой кислоты, или циклические уреиды, в отличие от
ациклических уреидов представляют собой продукты взаимодействия полного амида
угольной кислоты (мочевины) с производными малоновой кислоты:
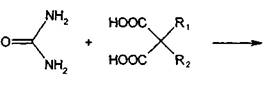

Поскольку в результате конденсации образуется замкнутая циклическая
система с двумя атомами азота (в положения 1 и 3), то барбитураты рассматривают
как производные пиримидина.
Снотворное действие барбитуратов впервые обнаружено в начале XX в. Э.
Фишером и Ф. Мерингом. В 1904 г. Э. Фишером получен барбитал. В последующие
годы было синтезировано большое число барбитуратов и установлен ряд
закономерностей между их химической структурой и действием на организм.
Структура молекул обусловливает особенности химических свойств
барбитуратов. Производные барбитуровой кислоты способны проявлять лактим-лактамную
таутомерию (за счет водородов имидных групп):
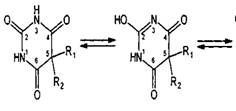

Лактимная или аци-форма обусловливает кислотный характер производных
барбитуровой кислоты. В присутствии гидроксид-ионов они диссоциируют как
кислоты и образуют соли с металлами:
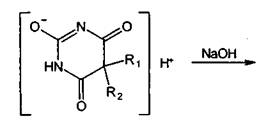
Применяемые в медицинской практике производные барбитуровой кислоты можно
разделить на две группы: барбитураты (лактамная форма) и натриевые соли
барбитуратов (лактимная форма). Общие формулы могут быть представлены следующим
образом:
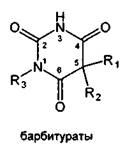
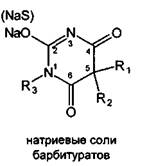
Указанная структура натриевых солей была подтверждена в результате
исследований ИК-спектров этих соединений. Барбитураты - барбитал, фенобарбитал,
бензобарбитал (бензонал) и натриевые соли - барбитал-натрий,
гексобарбитал-натрий (гексенал), тиопентал-натрий различаются по характеру
радикалов R1, R2 и R3. Для получения натриевых солей соответствующие
барбитураты растворяют в эквивалентном количестве гидрокеида натрия (спиртовой
раствор), а затем натриевую соль осаждают эфиром.
По свойствам барбитураты и их натриевые соли отличаются между собой.
Барбитураты представляют собой белые кристаллические порошки без запаха.
Они практически нерастворимы или очень мало растворимы в воде (барбитал - мало
растворим), растворимы или умеренно растворимы в этаноле и эфире (фенобарбитал
- легко растворим в этаноле). Водные и спиртовые растворы барбитуратов имеют
кислую реакцию. Барбитал - мало, фенобарбитал - умеренно, а бензобарбитал легко
растворим в хлороформе. Барбитураты легко растворимы в растворах щелочей.
Натриевые соли барбитуратов (гексобарбитала и тиопентала) представляют
собой белые мелкокристаллические порошки или сухую пористую массу
(тиопеитал-натрий желтоватого цвета со своеобразным запахом). Они
гигроскопичны, легко растворимы или очень легко растворимы в воде и этаноле,
практически нерастворимы в эфире. Водные растворы натриевых солей барбитуратов
имеют щелочную реакцию (рН 9,0-11,0).
Действие барбитуратов противоположно действию амфетаминов: они подавляют
центральную нервную систему. В малых дозах они действуют как транквилизаторы, а
в больших они снотворные. Сон с барбитуратами - ненормальный сон, т.к. они
подавляют все виды нормальной активности во время сна. Продолжительный прием
снотворных ведет к полному психологическому сдвигу, т.к. у разума не остается
пути реализовать себя. Барбитураты вызывают склонность к суициду.
Барбитураты - это седативное лекарство. Обычно их прописывают как
снотворные, но сейчас их использование с этой целью почти полностью прекращено,
хотя более слабые представители этой группы, такие как фенобарбитал, могут все
еще использоваться для лечения эпилепсии. И тем не менее, барбитураты время от
времени появляются. Обычно в виде: натрия амитала - как правило, ярко синие
капсулы, содержащие 60 мг лекарства, секонала - оранжевые капсулы по 50 мг и,
наконец, туинал, представляющий собой смесь из 50 мг амитала и 50 мг секонала,
который, что неудивительно, выпускается в наполовину оранжевых, наполовину
синих капсулах. Кто бы не был ответственен за дизайн этих капсул, он несомненно
обладал способностями к продаже препаратов опиатникам и ипохондрикам.
ГЛАВА 2. КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ, СОДЕРЖАЩИХ БАРБИТУРАТЫ
.1 Общие методы определения подлинности лекарственных средств, содержащих
барбитураты
Подлинность барбитуратов можно установить по ИК-спектрам. ФС рекомендует
этот метод для идентификации бензобарбитала, МФ - для фенобарбитала и
тиопентала-натрия. ИК-спектры, снятые после прессования в таблетках с бромидом
калия в области 4000-400 см-1, должны иметь полное совпадение полос поглощения
с прилагаемым к ФС рисунком спектра или со спектром сравнения.
УФ-спектры барбитуратов в области 220-280 нм имеют максимумы и минимумы
поглощения, используемые для идентификации. Раствор фенобарбитала в этаноле
после добавления буферного раствора с рН 10 имеет максимум поглощения при 240
нм и минимум - при 224 нм. Бензобарбитал (раствор в этаноле и 0,1 М растворе
хлороводородной кислоты) в области 220-350 нм имеет максимум при 257 нм и
минимум при 230 нм. Отношение оптических плотностей бензобарбитала в максимуме
к минимуму составляет 2,2. Барбитал и его натриевая соль имеют максимум при
239-240 нм.
Для обнаружения барбитуратов Парри (1924) предложил реакцию, основанную
на взаимодействии этих веществ с солями кобальта и аммиаком. Позднее другие
исследователи аммиак заменили изопропиламином. При взаимодействии барбитуратов
с изопропиламином и солями кобальта образуются внутрикомплексные соединения:
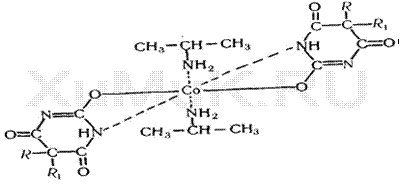

барбитурат
синтез лекарственный подлинность
К 2 мл хлороформного раствора исследуемого вещества прибавляют 0,3 мл 1
%-го раствора ацетата кобальта в безводном этиловом спирте и 1 мл 5 %-го
раствора изопропиламина в этиловом спирте. При наличии барбитуратов появляется
фиолетовое окрашивание. Вместо этилового спирта можно использовать метиловый
спирт.
Для испытания барбитуратов и их натриевых солей используют химические
реакции, основанные на соле- и комплексообразовании с солями тяжелых металлов,
сплавлении со щелочами, окислении, нейтрализации натриевых солей, обнаружении
ионов натрия и функциональных групп.
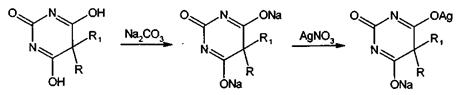
Производные барбитуровой кислоты образуют нерастворимые соли с ионами
серебра, ртути (II), меди (II), кобальта (II). Эта реакция происходит только с
ионизированной формой, поэтому кислотную форму барбитурата предварительно
необходимо перевести в ионную. Однако при этом нельзя допускать избытка щелочи,
так как он при последующем выполнении реакции приведет к образованию гидроксидов
металлов. Поэтому более целесообразно выполнять эту реакцию в смеси растворов
гидрокарбоната и карбоната натрия. Барбитуровая кислота по своему химическому
строению принадлежит к циклическим уреидам и, являясь производным малоновой
кислоты, может рассматриваться как малонилмочевина. Синтез барбитуровой кислоты
осуществляется по реакции:


При взаимодействии барбитуратов с пиридином и солями меди образуются
труднорастворимые комплексные соединения.
Под влиянием пиридина происходят енолизация и частичная ионизация барбитуратов.
Пиридин с ионами меди образует положительно заряженный комплексный ион [Cu(Py)]
2+.
При взаимодействии комплекса пиридина с ионами меди и ионизированными
молекулами барбитуратов образуется внутрикомплексное соединение:


Минеральные кислоты разлагают это соединение.
Осадки, образующиеся при взаимодействии барбитуратов с солями меди и
пиридином, могут быть аморфными и кристаллическими. Выполняется реакция
следующим образом: на предметное стекло наносят несколько капель раствора
исследуемого вещества в хлороформе и выпаривают досуха. К сухому остатку
прибавляют 2 капли 10 %-го раствора аммиака и 1-2 капли реактива (раствор
сульфата меди в аммиаке и пиридине). При наличии барбитуратов через 10-15 мин
появляются кристаллические или аморфные осадки.
Все барбитураты и их натриевые соли образуют с ионом кобальта комплексные
соединения, окрашенные в сине-фиолетовый цвет (в присутствии хлорида кальция).
Цветная реакция с раствором сульфата меди (II) позволяет отличать производные
барбитуровой кислоты друг от друга.
Для идентификации барбитуратов могут быть использованы реакции
образования моно- и дизамещенных комплексов с солями меди (II) в присутствии
пиридина. Комплексы имеют лиловую окраску.
Однозамещенная серебряная соль при добавлении избытка нитрата серебра
превращается в нерастворимую двузамещенную серебряную соль:
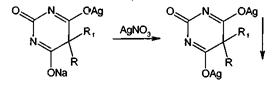
Гексобарбитал-натрий и бензобарбитал, содержащие заместители в положении
1, образуют только однозамещенные соли серебра.
Барбитураты могут быть обнаружены с помощью общих цветных реакций на
производные пиримидина, основанных на их окислении. При взаимодействии с
концентрированной серной кислотой и 1-2 каплями раствора дихромата калия
появляется стойкое зеленое окрашивание. Если вместо дихромата калия взять
раствор ванадата аммония, то после нагревания на водяной бане раствор
приобретает травянисто-зеленое окрашивание, переходящее в голубое. При
сплавлении барбитурата с резорцином и концентрированной серной кислотой,
последующем охлаждении и подщелачивании раствором гидроксида натрия возникает
зеленая флуоресценция.
Отличающиеся по окраске продукты конденсаций образуют барбитураты и их
натриевые соли с альдегидами: формальдегидом в присутствии концентрированной
серной кислоты; с раствором и-диметиламинобензальдегида в концентрированной
серной кислоте.
При использовании в качестве реактива ванилина в присутствии
концентрированной серной кислоты после кипячения появляется вишневое
окрашивание, переходящее в сине-фиолетовое:


Барбитураты и их натриевые соли можно идентифицировать сплавлением с
едкими щелочами, так как они при этом разрушаются с выделением аммиака:

При последующем подкислении хлороводородной кислотой
выделяется диоксид углерода и ощущается запах соответствующей жирной кислоты.


Для натриевых солей барбитуратов выполняют испытание,
основанное на нейтрализации растворов разведенной хлороводородной кислотой.
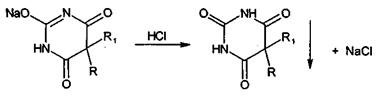
Выпавший осадок барбитурата отфильтровывают, промывают водой,
сушат и определяют температуру плавления. В гексобарбитале-натрии устанавливают
наличие диметилциклогексилбарбитуровой кислоты (143-147°С), а в
тиопентале-натрии -5-(1-метилбутил-5-этил)-2-тиобарбитуровой кислоты
(156-161°С).
Кроме того, обнаруживают ион натрия (по окраске пламени).
Для отличия барбитуратов друг от друга могут быть использованы реакции на
функциональные группы, имеющиеся в их молекулах в положениях 1 и 5. Так,
фенильный радикал в фенобарбитале обнаруживают по образованию нитросоединений,
окрашенных в желтый цвет. Реакция происходит после прибавления
концентрированных азотной и серной кислот. Появление желтого окрашивания
обусловлено образованием м-нитропроизводного фенобарбитала:
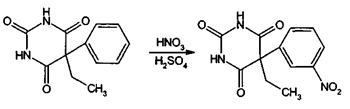
Эту реакцию дает также бензобарбитал.
Подлинность фенобарбитала можно установить по образованию соли с ионом
ртути (II) в щелочной среде. Образуется белый осадок, растворимый в избытке
раствора аммиака. Фенобарбитал дает цветную реакцию с нитритом натрия в
присутствии серной кислоты. При нагревании на водяной бане в течение 10 мин
появляется оранжево-желтое с коричневым оттенком окрашивание. Специфичной для
бензобарбитала является реакция с хлоридом железа (III). Предварительно его
взбалтывают в течение 1-2 мин с 0,1 М раствором гидроксида натрия и фильтруют.
Образующийся при гидролизе бензобарбитала бензоат-ион переходит в фильтрат. Он
образует с ионом железа (III) розовато-желтый осадок.

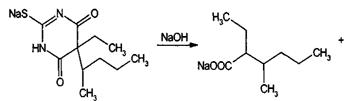
Тиопентал-натрий, содержащий атом серы в молекуле, при нагревании в
присутствии гидроксида натрия и ацетата свинца образует черный осадок сульфида
свинца.
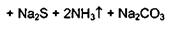
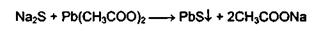
.2 Испытание на чистоту лекарственных средств, содержащих барбитуратов
При испытании на чистоту барбитала обнаруживают примесь
этилбарбитуровой кислоты, а в фенобарбитале - примесь фенилбарбитуровой
кислоты. Поскольку обе эти кислоты проявляют более сильные кислотные свойства,
чем соответствующие барбитураты, их примесь легко обнаружить потенциометрически
по значению рН суспензии барбитала с водой (5,0-6,0) или иным методом.
Посторонние примеси (ФС) в бензобарбитале устанавливают методом ТСХ на
пластинках Силуфол УФ-254 в системе растворителей хлороформ-ацетон. В УФ-свете
должно появиться только одно пятно.
Методом ТСХ выполняют испытание на наличие посторонних
примесей в тиопентале-натрии (МФ). При испытание чистоты натриевых солей
барбитуровой кислоты устанавливают предельное содержание примеси свободной
щелочи, метилового спирта и др.
2.3 Общие методы количественного определения барбитуратов
Барбитураты количественно определяют методом нейтрализации в среде
неводных растворителей. Навески растворяют в нейтрализованном диметилформамиде
или смеси диметилформамида и бензола (барбитал). Диметилформамид используют в
качестве растворителя при титровании более сильных кислот (рКа 7,3-7,8),
например барбитала, фенобарбитала. Титруют 0,1 М раствором гидроксида натрия (в
смеси метанола и бензола), используя индикатор тимоловый синий Диметилформамид,
являясь основным растворителем, присоединяет протон, усиливая при этом
кислотные свойства барбитуратов.
При последующем титровании гидроксидом натрия выделяются диметилформамид,
вода и ион натрия. Последний с анионом барбитурата образует натриевую соль:

Для количественного определения барбитуратов, изолированных из
биологического материала животного происхождения (кровь, моча, внутренние
органы трупа), наиболее перспективным является спектрофотометрический метод.
Спектрофотометрический метод требует сравнительно высокой чистоты исследуемого
вещества. Такую степень чистоты обеспечивает хроматография в тонком слое
силикагеля КСК
Спектрофотометрическое определение барбитуратов основано на способности
барбитуратов к кето-энольной или амидоимидольной таутометрии: при рН 2,0 барбитурат
находится в растворе в виде кетонной (неионизированной) формы, не обладающей в
пределах длин волн (λ) 200-300 нм специфической абсорбцией. При рН
10,0 образуется моноимидольная форма, в гетероциклическом ядре возникает
двойная связь, способная к поглощению в ультрафиолетовой области спектра.
Поглощение наблюдается при λ = 240 нм. При рН 13,0 и выше в растворе
присутствует диимидольная форма с двумя двойными связями в кольце. Максимум
абсорбции наблюдается при λ=255-260 нм.
Для определения барбитуратов рекомендованы: методы прямого
спектрофотометрирования при рН 10,0 и λ = 240 нм и два варианта дифференциального
метода: при рН 10,0-рН 2,0 и λ = =239 нм при исследовании внутренних
органов трупа и при рН 13,0-рН 10,0 и λ = 260 нм при исследованиях крови и мочи.
Дифференциальные варианты спектрофотометрического определения дают более
надежные результаты, так как здесь в значительной степени исключается влияние
посторонних веществ, экстрагируемых хлороформом из кислого раствора вместе с
барбитуратами. Для расчета содержания барбитурата пользуются калибровочным
графиком или, что лучше, значениями удельного показателя поглощения. Удельный
показатель поглощения E11%CM вычисляется по формуле:
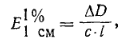

де D-оптическая плотность; ∆D>=ДрН10-ДрН2 или ДрН1З- ДрН10; С -
концентрация вещества в процентах; l - толщина поглощающего слоя в сантиметрах.
Отсюда
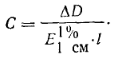

В сочетании с хроматографией спектрофотометрический метод является
достаточно специфичным, быстрым, чувствительным. Определяются микрограммовые
количества барбитуратов.
В. И. Попова на основе метода Маттесона и Гольта разработала
применительно к химико-токсикологическому анализу метод фотометрического
определения барбитала, фенобарбитала и барбамила. В основу методики положена
реакция барбитуратов с раствором ацетата кобальта в СН3ОН в присутствии
изопропиламина в СН3ОН. Определяются миллиграммовые количества перечисленных
барбитуратов.
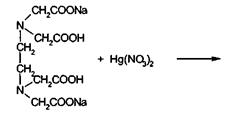
Реакцию взаимодействия производных барбитуровой кислоты с ионом ртути
(II), в результате которой образуются нерастворимые в воде соединения,
используют для меркуриметрического определения, сочетая его с
комплексонометрией. Кислотные формы барбитуратов растворяют в этаноле,
натриевые соли - в воде, добавляют 10%-ный раствор ацетата натрия и избыток 0,1
М раствора нитрата ртути (II). Осадок барбитурата ртути (II) отфильтровывают, а
в фильтрате комплексонометрическим методом (титрант 0,05 М раствор трилона Б,
индикатор ксиленоловый оранжевый) в присутствии гексаметилентетрамина
оттитровывают избыток нитрата ртути (II).
В основе меркуриметрического определения лежит реакция между
барбитуратом и нитратом ртути (II):


При комплексонометрическом титровании избытка нитрата ртути (II)
раствором трилона Б (ЭДТА) образуется комплексное соединение ртути:
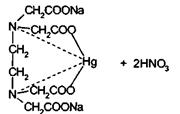
Точку эквивалентности устанавливают по изменению окраски
индикатора.
Количественное определение барбитуратов и их натриевых солей можно
выполнить и аргентометрическим методом, основанным на образовании одно- и
двузамешенных солей серебра.
Натриевые соли барбитуратов имеют в водных растворах щелочную реакцию (рН
9-11). Их титруют в водной среде 0,1 М раствором хлороводородной кислоты
(индикатор метиловый оранжевый). Процесс основан на гидролизе и нейтрализации
образовавшегося гидроксида натрия:
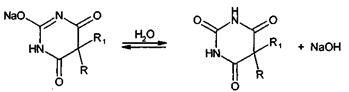

Параллельно выполняют контрольный опыт, чтобы учесть возможную примесь
свободной щелочи.
Барбитураты и их натриевые соли можно также количественно определить
гравиметрическим методом, осаждая или извлекая кислотные формы барбитуратов.
Натриевые соли предварительно переводят в кислотные формы. В качестве
экстрагентов используют эфир или хлороформ, который затем отгоняют, остаток
сушат и взвешивают. Указанный гравиметрический метод рекомендован ФС для
количественного определения тиопентала натрия. Он основан на многократном
извлечении хлороформом (после подкисления хлороводородной кислотой)
5-(1-метилбутил)-5-этил-2-тиобарбитуровой кислоты. После отгонки хлороформа и
высушивания этой кислоты должно быть 84,0-87,0% (в пересчете на сухое
вещество). По МФ хлороформные извлечения выпаривают досуха (на водяной бане) и
остаток растворяют в диметилформамиде. Затем титруют, используя в качестве
титранта 0,1 М раствор метилата лития (индикатор тимоловый синий). Кроме того,
в тиопентале-натрии устанавливают содержание карбоната натрия (10,0-11,0%)
путем титрования 0,1 М раствором хлороводородной кислоты (индикатор метиловый
красный). Тиопентал-натрий можно определить йодхлорометрическим методом,
основанным на окислении серы избытком 0,25 М раствора йодмонохлорида при
температуре 80-90°С. Для количественной оценки барбитуратов и их натриевых
солей используют спектрофотометрическое определение в области 239-240 нм.
Растворителями при этом служат боратный буферный раствор с рН 10 (барбитал,
гексобарбитал-натрий) или 1%-ный раствор аммиака (фенобарбитал). В указанных
условиях барбитал имеет максимум поглощения при 240 нм (550), барбитал-натрий
при 239 нм (500), фенобарбитал при 240 нм (440), гексобарбитал-натрий при 224
нм (340). тиопентал-натрий при 255 нм (363), 305 нм (825) и 239 нм (488). В
скобках указана величина удельного показателя поглощения, по которой
рассчитывают содержание барбитурата. Разработана унифицированная методика
спектрофотометрического определения фенобарбитала в таблетках при длине волны
240 нм (растворитель боратный буферный раствор с рН 9,6-9,8). В аналогичных
условиях, но при 257 нм определяют бензобарбитал. Известны многочисленные
методики фотометрического определения барбитуратов в лекарственных формах,
основанные на рассмотренных выше цветных реакциях.
2.4 Хранение и применение барбитуратов
Барбитураты и их натриевые соли хранят по списку Б в хорошо
укупоренной таре. Фенобарбитал и бензобарбитал следует хранить в банках из
темного стекла, в защищенном от света месте. Гексобарбитал-натрий и
тиопентал-натрий хранят в стеклянных флаконах по 0,5-1,0 г, герметически
закрытых резиновыми пробками, обжатыми алюминиевыми колпачками, в сухом,
прохладном, защищенном от света месте. Такие условия хранения необходимы, так
как эти соли барбитуратов вводят внутривенно, а под влиянием света и кислорода
воздуха они постепенно разлагаются.
Частные реакции на барбитураты определяются главным образом
характером радикалов. Так, например, барбитураты, имеющие в качестве одного из
радикалов фенильное ядро (фенобарбитал) или циклогексениловое кольцо (гексенал)
при нагревании с формалином и концентрированной серной кислотой образуют розовое
колечко на границе двух сред (фенобарбитал) или буровато-красное колечко с
зеленоватой флюоресценцией (гексенал). Эта реакция рекомендуется ГФ X для
Подтверждения подлинности этих препаратов.
Производные барбитуровой кислоты применяют как успокаивающие
и снотворные средства. Бензобарбитал назначают в качестве
противоэпилептического средства. Барбитал назначают внутрь перед сном по
0,25-0,5 г; фенобарбитал - с той же целью по 0,1-0,2 г. Гексобарбитал-натрий (в
виде 1-2%-ных растворов) и тиопентал-натрий (2,0-2,5%-ные растворы) применяют
для вводного наркоза внутривенно.
Выпускаются барбитураты в порошке и таблетках. Гексенал - в
стеклянных флаконах (1 г), герметически закрытых резиновыми пробками, обжатыми
алюминиевыми колпачками. Растворы гексенала для внутривенного наркоза готовят
на физиологическом растворе в асептических условиях непосредственно перед
употреблением.
Хранить следует в хорошо укупоренной таре. Гигроскопичные
препараты - в сухом, прохладном, защищенном от света месте. Все барбитураты относятся
к списку Б.
Барбитураты при длительном приеме и повышенных дозах могут
вызвать отравление, поэтому применение их должно контролироваться врачом.
Долгое время медицина не располагала достаточно эффективными лекарственными
средствами для борьбы с отравлениями барбитуратами. Обычно для этой цели
использовали стимуляторы центральной нервной системы - стрихнин и др.
Впоследствии было установлено, что специфическим антагонистом
барбитуратов является 2-метил-2-этилглутаримид, который получил название бемегрид.
Препарат является фармакопейным.
ЗАКЛЮЧЕНИЕ
Барбитуровая кислота представляет собой циклический уреид - продукт
конденсации мочевины с двухосновной малоновой кислотой. Она обладает кислыми
свойствами за счет водородов метиленовой (=СН2) и имидных групп (=NH), которые
могут замешаться на металлы с образованием солей. Барбитуровая кислота
существует в двух таутомерных формах.
Барбитуровая кислота сама не является лекарственным препаратом, но она
интересна тем, что может давать огромное: число производных, большинство из
которых получаются за счет замещения водородов метиленовой группы различными
радикалами.
В связи с этим получено огромное число терапевтически активных
лекарственных препаратов, главным образом снотворного действия. Некоторые
барбитураты наряду со снотворным эффектом проявляют противосудорожное действие
(фенобарбитал), другие применяются как наркотические средства (гексенал).
Поскольку барбитураты отличаются друг от друга в основном характером
радикалов, а остальная часть молекулы у них одинакова, то они имеют много
общего как в способах получения, так и в физических, химических свойствах и
методах анализа.
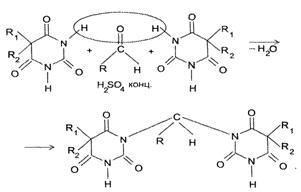
Общий принцип метода получения барбитуратов сводится к конденсации
мочевины с диэтиловым эфиром диалкилмалоновой кислоты. Малоновую кислоту в виде
эфира берут потому, что свободная кислота может легко декарбоксилироваться, и
циклический уреид может не образоваться.
Предварительно в диэтиловый эфир малоновой кислоты вводят соответствующие
радикалы одним из химических методов органической химии, например действием
металлического натрия и сооответствующего бромистого алкила.
Барбитураты могут вступать в реакцию с солями тяжелых металлов (AgNО3,
CuSО4, СоС13 и др.) с образованием комплексов.
С раствором нитрата кобальта Co(NО3)2 в присутствии хлорида кальция все
барбитураты образуют комплекс, окрашенный в сине-фиолетовый цвет. Поэтому эта
реакция является общей для всех барбитуратов и является фармакопейной.
Реакция сплавления барбитуратов с твердой щелочью также является общей
реакцией, так как независимо от характера барбитурата продуктами разложения
являются аммиак, карбонат натрия и Na-соль диалкилуксусной кислоты. При
подкислении реакционной смеси выделяются пузырьки газа (СО2) и ощущается запах
диалкилуксусной кислоты.
В зависимости от характера радикала для каждого барбитурата могут быть
различные варианты синтеза.
Барбитураты - мелкокристаллические белые порошки. Кислые формы
барбитуратов (барбитал, фенобарбитал) мало растворимы в воде, но растворимы в
органических растворителях, растворах щелочей и карбонатов. Барбитураты-соли
хорошо растворимы в воде.
Со щелочами барбитураты образуют только однозамещенные соли.
Двузамещенные соли настолько легко гидролизуются, что практически не
существуют.
ГФ X рекомендует для отличия одного барбитурата от другого реакции с
солями тяжелых металлов: с сульфатом меди в присутствии гидрокарбонатного
буфера (смесь Na2CO3 и NaHCO3 в определенных соотношениях). При этом в
зависимости от индивидуальности барбитурата цвет образующегося комплекса бывает
различный.
Индивидуальность барбитуратов-кислот определяется по их температуре
плавления, которая вполне определенна для каждого барбитурата.
Натриевые соли барбитуратов (гексенал, барбамил, барбитал-натрий,
этаминал-натрий) при действии минеральных кислот выделяют кислые формы
соответствующих барбитуратов, которые выпадают в осадок. После высушивания
осадка определяют температуру плавления соответствующей кислоты.
Методы количественного определения барбитуратов основаны на нх химических
свойствах.
Поскольку барбитураты проявляют кислые свойства, а натриевые соли их
легко гидролизуются с образованием щелочи, основным методом их количественного
определения является метод нейтрализации.
Барбитураты-соли (барбитал-натрий, этаминал-натрий, барбамил, гексенал)
титруются кислотой по метиловому оранжевому или метиловому красному в
присутствии эфира, извлекающего образовавшуюся в процессе титрования кислоту.
Барбитураты - кислоты (барбитал, фенобарбитал) количественно определяют
методом кислотно-основного титрования в неводных средах, поскольку их константа
диссоциации в водных растворах мала, и они являются слабыми кислотами.
Титрантом в этом случае служит 0,1 и. раствор гидроксида натрия в смеси
метанола и бензола или метилат натрия. Неводным растворителем является диметилформамид
индикатором служит тимоловый синий или фенолфталеин. Метод фармакопейный.
Физиологическая активность барбитуратов тесно связана с химической
структурой их молекул и обусловлена главным образом характером радикалов.
При написании курсовой работы мы достигли поставленной цели: изучить
контроль качества лекарственных средств, содержащих барбитураты. Для достижения
поставленной цели нами были решены следующие задачи:
изучили структуру строения барбитуратов синтез и свойства барбитуратов
изучили синтез и свойства барбитуратов
изучили общие методы определения подлинности лекарственных средств,
содержащих барбитураты
рассмотрели методы определения на чистоту лекарственных средств,
содержащих барбитуратов
определили общие методы количественного определения барбитуратов
изучили хранение и применение барбитуратов.
СПИСОК ЛИТЕРАТУРЫ
1. Мелентьева
Г. А., Антонова Л. А. Фармацевтическая химия. -- М.: Медицина, 1985.- 480 с.
.
Фармацевтическая химия: Учеб. пособие / Под ред. Л.П.Арзамасцева. - М.:
ГЭОТАР-МЕД, 2004. - 640 с.
3.
Логинова Н. В., Полозов Г. И. Введение в фармацевтическую химию: Учеб. пособие
- Мн.: БГУ, 2003.-250 с.
.
Гетероциклические лекарственные вещества. Учебное пособие по фармацевтической
химии / Д.В. Крыльский, А.И. Сливкин. - Воронеж: Воронежский государственный
университет, 2007. - 234 с.
.
Глущенко Н. Н. Фармацевтическая химия: Учебник для студ. сред. проф. учеб.
заведений / Н. Н. Глущенко, Т. В. Плетенева, В. А. Попков; Под ред. Т. В.
Плетеневой. - М.: Издательский центр «Академия», 2004. - 384 с.
.
Беликов В.Г. Фармацевтическая химия. В 2 частях. Часть 1. Общая
фармацевтическая химия: Учеб. для фармац. ин-тов и фак. мед. ин-тов. - М.:
Высш. шк., 1993. - 432 с.
7. Крамаренко
В.Ф. Токсикологическая химия. - Киев: Высшая школа, 1989. - 447 с.