Материалы литий-ионных аккумуляторов
Курсовая
работа
Материалы
литий-ионных аккумуляторов
Содержание
Введение
. Общие
сведения
. Электролиты
3. Материалы
положительного электрода
3.1 Общие
требования к материалам
.2 Слоистые
материалы
.3 Материалы
с каркасными структурами
.4 Методы
синтеза оксидных материалов положительного электрода
. Материалы
отрицательного электрода
. Сепараторы и конструкции аккумуляторов
Заключение
Список
рекомендуемой литературы
Введение
Литий-ионные аккумуляторы - это относительно новый вид химических
источников тока, быстро завоевавший мировой рынок. Множество людей носит их
постоянно в своих мобильных телефонах. Совершенствование известных и разработка
новых материалов для подобных устройств составляют одну из важнейших задач
современной химии, причём центральное место здесь занимают твёрдые материалы с
подвижными ионами для электродов и электролитов - основной объект ионики
твёрдого тела.
1. Общие сведения
Всякий химический источник тока (ХИТ) состоит из отрицательного
электрода, содержащего восстановитель, положительного электрода, содержащего
окислитель, и разделяющего их электролита. Чтобы избежать короткого замыкания
при сближении электродов, в ячейках с жидким электролитом используют ещё
пористый сепаратор. Сразу следует уточнить терминологию. Отрицательный электрод
ХИТ часто называют анодом, а положительный - катодом. В случае первичного (не
перезаряжаемого) ХИТ это не вызывает путаницы. Но в аккумуляторе, т.е.
вторичном (перезаряжаемом) ХИТ, положительный электрод является катодом только при
разряде, когда на нём происходит восстановление; при заряде там происходит
окисление, и он становится анодом. Поэтому часто употребляемое в литературе
сочетание "катодные материалы аккумуляторов" неточно, и далее будет
использоваться более строгое, хотя и длинное, название "материалы
положительного электрода". Кроме того, гальванические элементы часто
неправильно называют батареями (batteries), хотя это слово обозначает набор из
нескольких однотипных элементов.
Литий - уникальный элемент для ХИТ. Во-первых, это самый сильный
восстановитель по отношению к важнейшим окислителям: кислороду, азоту, фтору и
их соединениям. Количественно это выражается самым низким электродным
потенциалом (табл. 1). Конечно, в неводных растворах цифры несколько иные, чем
указано в табл. 1, но соотношение сохраняется. Это обеспечивает элементам с
литиевым электродом самую высокую эдс.
Таблица 1 Сравнительная характеристика некоторых восстановителей
|
Металл
|
Li
|
Na
|
K
|
Zn
|
Pb
|
|
Стандартный электродный
потенциал в водных растворах при 25°С, В
|
-3,03
|
-2,71
|
-2,93
|
-0,76
|
-0,13
|
|
Электрохимический
эквивалент M/Z, г/моль
|
6,9
|
23
|
39
|
33
|
104
|
Во-вторых, у лития один из самых низких электрохимических эквивалентов
(табл. 1). Это обеспечивает большую удельную ёмкость - количество
электричества, запасаемое в расчёте на единицу массы. В этом отношении с литием
может конкурировать водород, у которого эквивалент ещё меньше, но, если учесть
сложности хранения водорода (массу баллонов со сжатым газом или аппаратуры для
жидкого водорода или интерметаллических соединений, поглощающих водород), то
преимущества водорода уже не столь очевидны.
Сочетание двух указанных особенностей лития позволяет запасать рекордно
высокую удельную энергию (энергию в расчёте на единицу массы устройства). Это
особенно важно для портативной техники и для транспорта - для питания не только
бортовой аппаратуры и зажигания (где до сих пор используются свинцовые
аккумуляторы), но и электромотора, идущего на смену тепловым двигателям,
работающим на углеводородном топливе. Однако применение крупных источников
сдерживается их высокой ценой, и пока нашли широкое применение только
миниатюрные источники тока для питания сотовых телефонов, портативных
компьютеров, фотоаппаратов и других мобильных устройств.
Первоначальная концепция литиевого аккумулятора предусматривала
отрицательный электрод из чистого лития и положительный электрод, содержащий
твёрдую фазу, в структуру которой может обратимо внедряться литий, например,
TiS2, V6O13 или MoO3. Однако у литиевого электрода обнаружились недостатки. Металлический
литий, выделяющийся при зарядке аккумулятора, обычно не ложится гладким слоем
на поверхность электрода, а растёт в виде дендритов. Это объясняется тем, что
любой выступ на электроде ближе к противоположному электроду и потому быстрее
наращивается. Дендриты могут дорасти до противоположного электрода и вызвать
короткое замыкание; они имеют большую поверхность, быстро корродируют в
электролите и могут отделиться. Поэтому на смену аккумулятору с электродом из
лития пришёл литий-ионный аккумулятор (Li-ion battery, rocking chair battery,
shuttle-cock battery). В таком аккумуляторе вместо чистого лития используется
его соединение, где литий связан слабо, и потому его электродный потенциал,
хоть и выше, чем у чистого лития, но ненамного. Конечно, при этом масса
электрода сильно возрастает и снижается удельная ёмкость, зато не образуются
дендриты и коррозионная стойкость выше. Таким образом, считается, что в
литий-ионном аккумуляторе оба электрода являются фазами внедрения лития, но с
сильно отличающимися потенциалами, и в обоих электродах литий находится в
ионной форме (отсюда и название). С кристаллохимической точки зрения это не
всегда верно: некоторые из материалов отрицательного электрода являются
интерметаллическими соединениями, где термин "внедрение" неприменим,
а катионная роль лития сомнительна.
Литий-ионный аккумулятор собирают в разряженном состоянии. При его
зарядке литий извлекается из положительного электрода (например, из LiCoO2) и
внедряется в отрицательный (например, в углерод), а при разряде идёт обратный
процесс. Первые литий-ионные аккумуляторы были выпущены фирмой "Сони"
в 1990 г., и сведения о них можно найти лишь в относительно новой литературе. В
настоящее время количество литий-ионных аккумуляторов в мире - миллиарды штук,
а годовой объём продаж - миллиарды долларов. Большую часть рынка контролируют
японские и корейские фирмы. Совершенствование технологии аккумуляторов,
модифицирование известных и разработка принципиально новых материалов для них
составляют одну из важнейших задач современной химии, и этому посвящены тысячи
научных статей и патентов, а данная работа - лишь краткое введение в проблему.
Далее нужно изучать обзоры [1-7] и оригинальную литературу. Ниже перечислены
важнейшие характеристики, которые желательно улучшать.
Цена. Нужно упростить технологию и перейти на более дешёвые компоненты.
Зарядное и разрядное напряжение. При бесконечно медленных (равновесных)
процессах эти величины совпадают с эдс, но реально есть поляризация электродов,
поэтому зарядное напряжение повышается, а разрядное - понижается, и тем
сильнее, чем выше плотность тока. Естественно, нужно стремиться к уменьшению
поляризации: к повышению разрядного напряжения, тогда как зарядное не должно
быть настолько высоким, чтобы вызывать разрушение электролита или коррозию
деталей конструкции. Если на аноде и катоде - только фазы постоянного состава,
и меняется лишь их количество, то эдс - величина постоянная. Если же это фазы
переменного состава (более типичный случай), то эдс зависит от состава.
Желательно, чтобы эта зависимость была слабой, чтобы разрядное напряжение было
приблизительно постоянным.
Режим заряда-разряда. Как отмечено выше, при высоких плотностях тока
усиливается поляризация электродов; кроме того, возрастает опасность их
необратимой порчи. Поэтому важная характеристика - максимальная плотность тока,
которую можно получить без существенного снижения характеристик. Строго говоря,
плотность тока - это отношение силы тока к эффективной площади электрода. Но в
электродах, состоящих из порошков, площадь поверхности частиц трудно объективно
оценить, поэтому вместо неё подставляют либо видимую площадь электродной
пластины, либо массу активного вещества, и тогда выражают плотность тока в
амперах на грамм. В англоязычной литературе используется также понятие "C
rate" - степень разряда за 1 час. Например, 0,5C rate означает такую
плотность тока, при которой за час элемент разряжается наполовину.
Удельная ёмкость. Её выражают в ампер-часах на килограмм или на литр,
где, в зависимости от контекста, подразумеваются масса и объём либо всего
аккумулятора, либо данной его части (например, положительного электрода).
Поскольку кулон - это ампер-секунда, 1 А-ч = 3600 Кл.
Удельная энергия - произведение удельной ёмкости на среднее разрядное
напряжение; выражается в ватт-часах на килограмм или на литр. 1 Вт-ч = 3600 Дж.
Удельная мощность - мощность на единицу массы (или объёма). Её можно
оценить, умножая разрядную плотность тока (в амперах на килограмм или литр) на
соответствующее напряжение. При некоторой плотности тока она может иметь
максимум.
Циклируемость. При многократных зарядах-разрядах может происходить
постепенное ухудшение характеристик - из-за накопления дефектов структуры,
ухудшения контактов вследствие объёмных изменений и т.п. Поэтому важно, сколько
циклов может выдержать устройство до отказа или существенной потери ёмкости,
если разряжать и заряжать его при некоторой типичной плотности тока.
2. Электролиты
Электролиты для литий-ионных аккумуляторов должны быть одновременно
устойчивы к сильным восстановителям и сильным окислителям, выдерживать зарядные
напряжения до 5 В, быть недорогими и безопасными. Использование водных или
спиртовых растворов исключено, т.к. неизбежна реакция вытеснения водорода
литием. Рассматриваются три типа электролитов: жидкие растворы солей лития в
апротонных растворителях, твёрдые электролиты и так называемые "твёрдые
полимерные электролиты".
В качестве апротонных, т.е. не содержащих групп OH и NH, растворителей в
них обычно используются смеси эфиров, как сложных, так и простых. Индивидуальные
растворители редки, т.к. не позволяют обеспечить многочисленные и зачастую
противоречивые требования, например, высокую диэлектрическую проницаемость,
низкую вязкость, низкую температуру плавления и высокую температуру кипения. Из
сложных эфиров наиболее популярны карбонаты, которые, восстанавливаясь при
первом контакте с литием, образуют на отрицательном электроде тонкий
ионпроводящий слой карбоната лития, предотвращающий дальнейшее восстановление,
но не мешающий работе элемента. Некоторые из двух десятков применяемых
компонентов растворителей перечислены в табл. 2.
Апротонные
растворители обычно менее полярны, чем вода, поэтому и растворимость, и степень
диссоциации солей в них значительно ниже. Чтобы обеспечить достаточную
растворимость, выбираются соли лития с очень крупными однозарядными анионами, у
которых кристаллические фазы малоустойчивы из-за большого количества
анион-анионных контактов: перхлорат LiClO4, тетрафтороборат LiBF4,
гексафторофосфат LiPF6, гексафтороарсенат LiAsF6, трифторметилсульфонат
(трифлат) CF3SO3Li, бис-оксалатоборат LiB(C2O4)2 (LiBOB). По той же причине эти
соли очень гигроскопичны, и полное обезвоживание электролитов - непростая
задача.
Таблица 2.
Наиболее распространённые компоненты апротонных растворителей литиевых электролитов
|
Название и условное
обозначение
|
Формула
|
Т. пл., °С
|
Т. кип., °С
|
Вязкость, спуаз (25°С)
|
Диэлектрич. проницаемость
|
Т. вспышки, °С
|
|
этиленкарбонат (EC)
|
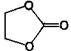 36,42481,90 (40°С)90160 36,42481,90 (40°С)90160
|
|
|
|
|
|
|
пропиленкарбонат (PC)
|
 -492422,5365132 -492422,5365132
|
|
|
|
|
|
|
g-бутиролактон (gBL)
|
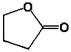 -432041,733997 -432041,733997
|
|
|
|
|
|
|
диметилкарбонат (DMC)
|
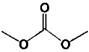 4,6910,59 (20°С)3,118 4,6910,59 (20°С)3,118
|
|
|
|
|
|
|
диэтилкарбонат (DEC)
|
 -741260,752,831 -741260,752,831
|
|
|
|
|
|
|
этилметилкарбонат (EMC)
|
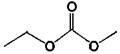 -531100,653,0 -531100,653,0
|
 -84770,456,0-3 -84770,456,0-3
|
|
|
|
|
|
|
тетрагидрофуран (THF)
|
 -109660,467,4-17 -109660,467,4-17
|
|
|
|
|
|
Готовые электролиты должны тщательно предохраняться от влаги. Она не только
реагирует с литием, но и гидролизует комплексные фториды, а образующийся HF
реагирует с материалами положительного электрода и превращает карбонатный слой
на отрицательном электроде в изолирующий слой LiF. Ещё одна проблема, связанная
с LiPF6 - его низкая термическая устойчивость - он заметно разлагается уже при
70°С, а такая температура вполне может
развиться в аккумуляторе при большой силе разрядного тока. Тем не менее, он
остаётся наиболее употребительным солевым компонентом.
Готовые электролиты выпускаются рядом фирм. Один из наиболее популярных
составов - одномолярный раствор гексафторофосфата лития в смеси этиленкарбоната
с диметилкарбонатом, имеющий при комнатной температуре удельную
электропроводность около 0,01 См/см.
Как видно из табл. 2, этиленкарбонат имеет самую высокую диэлектрическую
проницаемость (выше, чем у воды!), что благоприятствует растворимости солей, а
также высокую температуру вспышки, что уменьшает пожароопасность. Но, с другой
стороны, у него неприемлемо высокие температура плавления и вязкость, поэтому
сам по себе он использоваться не может, и его разбавляют другими эфирами.
В настоящее время уже известны керамические литиевые электролиты, по
проводимости не уступающие жидким апротонным электролитам. Это, в частности,
семейство катиондефицитных сложных оксидов типа перовскита, например,
La2/3-xLi3xTiO3 (рис. 1).
При x<1/6 часть катионных позиций вакантна, и по ним могут
перескакивать катионы лития. Катионы упорядочены послойно, поэтому
предполагается двумерная проводимость Безусловным достоинством таких материалов
является их химическая и термическая стойкость. Они не замерзают, не
испаряются, не вытекают, не взаимодействуют с материалами положительного
электрода, не вызывают коррозии лития и не пропускают дендритов, поэтому отпадает
необходимость в углеродных и других матрицах: для отрицательного электрода
можно использовать чистый литий, а для положительного - окислитель, изначально
не содержащий лития, например, V6O13, куда литий внедряется при разряде.
Некоторые авторы, привыкшие к тому, что электролит - обязательно жидкий,
рассматривают такие материалы не как электролиты, а как сепараторы. Но
серьёзной проблемой таких материалов остаётся обеспечение надёжного контакта
твёрдого электролита с твёрдыми электродами.
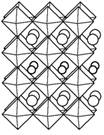
Рисунок 1.
Кристаллическая структура Li0,2La0,6TiO3
Октаэдры TiO6 соединяются вершинами в трёхмерный каркас. Более крупные
шарики - катионы лантана с небольшим замещением на литий, а более мелкие,
обведённые жирнее - это позиции, где преобладает литий. (J.L. Fourquet et al.
J. Solid State Chem. 1996. V. 127. P. 283).
"Твёрдые полимерные электролиты" - это на самом деле вязкие
переохлаждённые растворы солей лития в расплавленных органических полимерах,
например, в полиэтиленоксиде. Они, в отличие от керамических, пластичны,
обеспечивают лучший контакт и гибкость. Как и керамические, они заменяют собой
сепаратор и могут использоваться в контакте с металлическим литием, но имеют
низкую проводимость и термодинамически неустойчивы, склонны к кристаллизации.
Поэтому широкое практическое применение в литий-ионных аккумуляторах пока
получили лишь жидкие электролиты. Однако исследования в области альтернативных
электролитов (керамических, полимерных, композиционных) интенсивно
продолжаются.
3. Материалы положительного электрода
.1 Общие требования к материалам
Поскольку аккумулятор собирается в разряженном состоянии, материал
положительного электрода должен содержать литий, способный к обратимому
извлечению. Для этого нужны следующие условия:
а) материал должен содержать элемент, способный обратимо окисляться в
исходной позиции, и исходная структура при извлечении лития не должна
разрушаться;
б) материал на всех стадиях заряда-разряда должен иметь достаточно
высокую электронную и литий-ионную проводимость; меньшая из них будет
лимитировать кинетику переноса лития из глубины зерна твёрдой фазы на
поверхность контакта с электролитом и обратно, а значит - и плотность тока;
в) если есть серьёзные кинетические затруднения, указанные в п. (б),
желателен малый размер частиц твёрдой фазы;
г) изменения размеров частиц при извлечении и внедрении лития должны быть
небольшими, иначе в электродной массе могут возникнуть механические напряжения,
ведущие к растрескиванию и нарушению контакта;
д) электродный потенциал окислительно-восстановительной системы,
упомянутой в п. (а), желательно иметь в диапазоне 3,0-4,5 В относительно лития;
меньшие значения не обеспечивают высокой удельной энергии и мощности, а большие
не позволяют заряжать аккумулятор без разложения электролита;
е) электрохимический эквивалент, т.е. масса материала в расчёте на моль
извлекаемого лития, должен быть небольшим, чтобы обеспечить высокую удельную
ёмкость и удельную энергию;
ж) материал должен быть простым в изготовлении и не содержать дорогих
компонентов.
Условие (а) предполагает содержание d-элемента в пониженной степени
окисления. Конечно, переменные степени окисления бывают и у p-элементов, но у
них эти степени окисления сильно отличаются координационными предпочтениями
(из-за большой разницы в радиусах и наличия стереохимически активной
неподелённой пары у неполновалентного катиона), и вряд ли возможно окисление,
например, Pb2+ в Pb4+ или Sb3+ в Sb5+ при сохранении исходной координации.
Сосуществование в одной фазе катионов d-элемента в разных степенях
окисления обычно обеспечивает электронную проводимость полупроводникового или
даже металлического типа (условие б), если эти катионы размещены достаточно
близко. Однако возможны случаи, когда окисленная и восстановленная формы
образуют разные фазы. Если окисленная фаза лишена d-электронов, она может стать
диэлектриком, и тогда после извлечения лития из наружного слоя зерна возникает
изолирующая прослойка, и литий из внутренней части зерна перестаёт извлекаться.
При невысокой электронной проводимости материала к нему подмешивают сажу, но
она обеспечивает контакт лишь с поверхностью и не может повлиять на транспорт
внутри зерна.
Для обеспечения литий-ионной проводимости (вторая часть условия б)
позиции лития в структуре должны сообщаться между собой через достаточно
широкие проходы, образуя непрерывную систему. Поскольку литий - небольшой
катион, проходы для его миграции есть почти всегда, и если содержание лития
достаточно велико (условие е), то позиции лития обычно сообщаются хотя бы в
одном измерении (но лучше в двух или трёх).
При обсуждении условия (г) следует учесть, что окисление катиона
d-элемента ведёт к уменьшению радиуса и сжатию структуры, но одновременное
образование литиевых вакансий ведёт к расширению из-за отталкивания анионов, окружающих
вакансию. Эти эффекты могут частично или полностью компенсировать друг друга,
но следует учитывать возможную анизотропию: в ряде случаев (например, в
слоистых структурах) расширение в одном направлении сопровождается сжатием в
другом, и механические напряжения возникают, даже если объём не меняется.
В соответствии с условиями (д), (е) и (ж), наибольший интерес
представляют окислительно-восстановительные системы на основе d-элементов
четвёртого периода: V3+/V4+, V4+/V5+, Cr3+/Cr4+, Mn2+/Mn3+, Mn3+/Mn4+,
Fe2+/Fe3+, Fe3+/Fe4+, Co2+/Co3+, Co3+/Co4+, Ni2+/Ni3+, Ni3+/Ni4+, Cu2+/Cu3+, но
не всегда эти системы удовлетворяют условию сохранения исходной координации.
Октаэдрическая координация более или менее характерна для всех перечисленных
катионов, но некоторые из них (Cu2+, высокоспиновый Mn3+, низкоспиновые Co2+ и
Ni3+) склонны к сильным искажениям октаэдра вследствие эффекта Яна-Теллера,
тогда как для соседней степени окисления того же элемента это несвойственно;
Co2+ и особенно Mn2+ часто встречаются в тетраэдрической координации, а для
более окисленных форм она неустойчива. Поэтому, например, тетраэдрически
координированный Mn2+ в мягких условиях не окисляется, а в жёстких - окисляется
с разрушением структуры, тогда как в октаэдрической координации Mn2+ окисляется
очень легко.
Условие (д) - появление в структуре сильного окислителя - практически
исключает из рассмотрения сульфиды, хлориды, бромиды, нитриды, которые легко
окисляются и несовместимы с такими окислителями. Остаются фториды и оксиды, из
них реально рассматривались до сих пор только оксиды, вероятно, из-за большей
жёсткости структур.
Таблица 3. Цены реактивов в крупной расфасовке из каталога фирмы Merck
1992/93 г.
|
Реактив
|
Fe
|
MnO2
|
Cr2O3
|
CuO
|
NiO
|
V2O5
|
CoO
|
|
Цена, DM/кг
|
10
|
20
|
36
|
114
|
132
|
300
|
310
|
В таблице 3 сравниваются цены исходных веществ. К сожалению, они взяты из
старого источника, и с тех пор могли измениться, но всё же соотношение они
отражают приблизительно правильно. Поскольку кобальтовое сырьё, наиболее
употребительное для литий-ионных аккумуляторов, было самым дорогим ещё до
возникновения повышенного спроса на него (см. табл. 3), вряд ли оно подешевело
за истекшие годы. Наиболее экономичными, несомненно, будут соединения железа и
марганца, если они смогут удовлетворить остальным условиям.
Ниже материалы классифицируются по связности жёсткого остова (той части,
которая остаётся после полного удаления лития) на слоистые
(двумерно-бесконечные) и каркасные (трёхмерно-бесконечные). При близкой
прочности связей первые обычно обеспечивают большую свободу перемещения лития,
но, будучи менее жёсткими, они легче разрушаются или перестраиваются при
циклировании.
.2 Слоистые материалы
Сюда относится LiCoO2, который с 1990 г. по настоящее время является
основой положительных электродов литий-ионных аккумуляторов. В его
кристаллической структуре (рис. 1) все компоненты - в октаэдрической
координации.
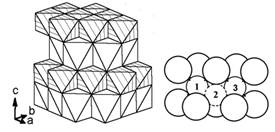
Рисунок 2. Кристаллическая структура LiCoO2: слева - полиэдрическое
изображение (кобальт в заштрихованных октаэдрах, литий в белых), справа -
шаростержневое изображение одного литиевого слоя (1 и 3 - нормальные позиции
лития, 2 - междоузельная тетраэдрическая позиция на пути из 1 в 3)
Эта структура - производная от структуры поваренной соли, где
перпендикулярно оси третьего порядка чередуются литиевые и кобальтовые слои. В
результате она уже не кубическая, а ромбоэдрическая; на рис. 2 она показана в
гексагональной системе координат. Элементарная ячейка включает по три литиевых
и кобальтовых слоя, но на рис. 2 слева показаны лишь два. Это очень
распространённый структурный тип, его обычно называют "тип α-NaFeO2",
или O3, где буква O
означает октаэдрическую координацию низкозарядного катиона, а цифра - число
слоёв в элементарной ячейке. Для лития, кроме октаэдрической координации,
возможна также тетраэдрическая (см. ниже T1 и T2), а для более крупных катионов
натрия и калия - также призматическая (P2 и P3).
При зарядке аккумулятора часть лития извлекается, а остов окисляется с
образованием Li1-xCoO2. Традиционное химическое рассмотрение предполагает, что
при этом х катионов кобальта переходят из степени окисления 3+ в степень
окисления 4+, хотя есть данные, что электронные дырки локализуются
преимущественно на кислороде. Так или иначе, и Co4+, и O1- - очень сильные
окислители, этим определяются высокие зарядные и разрядные напряжения.
Благодаря существованию кобальта в смешанной степени окисления, Li1-xCoO2 имеет
высокую электронную проводимость полупроводникового или даже металлического
типа, в зависимости от величины x. А благодаря достаточно широким для лития
треугольным проходам из октаэдра в октаэдр через промежуточный тетраэдр (рис.
2) достигается достаточно высокая литий-ионная проводимость в двух измерениях,
особенно когда часть лития извлечена и возникли вакансии.
Из-за высокой стоимости соединений кобальта было много попыток
использовать аналоги LiMO2 с другими M = Mn, Fe, Ni. У LiFeO2 структура типа O3
метастабильна и получается только ионным обменом из NaFeO2 (впервые - на
кафедре общей и неорганической химии РГУ), но не прямым синтезом. Однако
окисление Fe(3+)®Fe(4+)
требует неприемлемо высокого напряжения, и этот материал сейчас рассматривается
лишь для использования в отрицательном электроде, куда литий внедряется с
восстановлением Fe(3+)®Fe(2+).
Соединения Mn(3+) и Ni(3+) из-за эффекта Яна-Теллера имеют моноклинно
искажённую структуру типа О3, а при окислении искажение снимается и возникают
изменения размеров, что нежелательно. Кроме того, LiMnO2 при синтезе на воздухе
неустойчив и окисляется в смесь Li2MnO3+LiMn2O4. Однако очень перспективными
сейчас считаются двойные и особенно тройные твёрдые растворы вокруг состава
Li(Co1/3Ni1/3Mn1/3)O2, где искажение отсутствует в результате разбавления и
перераспределения степеней окисления (очевидно, сочетание Mn4+ + Ni2+ более
стабильно, чем Mn3+ + Ni3+). В качестве примера на рис. 3 приведены
зарядно-разрядные кривые чистого LiNiO2 и одного из тройных твёрдых растворов.
Для кристаллохимического рассмотрения, по абсциссе следовало бы отложить
величину х, но авторы оригинальной работы отложили связанную с ней
характеристику - электрохимическую ёмкость. Пересчитайте её в х самостоятельно.
Из рис. 3 видно, что при небольшой плотности тока твёрдый раствор циклируется
удовлетворительно (по крайней мере в первых циклах), и напряжения
заряда-разряда практически совпадают, т.е. поляризация несущественна.

Рисунок 3. Зарядно-разрядные кривые LiNiO2 и твёрдого раствора на его
основе между 2,5 и 4,3 В относительно лития при плотности тока 0,1 мА/см2
и 22°С (J.K. Ngala et al. J. Mater. Chem.
2004. V. 14. P. 214)
Интересной особенностью LiNiO2 является способность не только к
извлечению, но и к внедрению лития с образованием Li2NiO2. В структуре О3 все
межслоевые октаэдры (белые на рис. 2 слева) заселены, и для лишнего лития вроде
бы нет места. Однако в плотноупакованных структурах число тетраэдрических
пустот вдвое больше числа октаэдрических, поэтому возможно внедрение
избыточного лития с переходом всех катионов лития из октаэдрических в
тетраэдрические пустоты. Из рис. 2 видно, что в структуре О3 эти тетраэдры
имеют общие грани с заштрихованными октаэдрами, содержащими высокозарядный
катион, что делает неустойчивой такую упаковку с заполненными тетраэдрами.
Поэтому при внедрении избыточного лития слои смещаются с образованием
однослойной структуры T1, где общих граней уже нет.
Опубликовано огромное число работ, посвященных модифицированию
электродных материалов типа О3 различными добавками, как изоморфно замещающими
переходный металл, так и образующими самостоятельную фазу. Однако вносимые ими
изменения в свойства не очень значительны, и вполне могут объясняться
различиями не только в составах, но и в технологии, размере частиц и методах
испытаний. У всех фаз типа О3 есть два общих недостатка.
Во-первых, при х®1,
т.е. при извлечении большей части лития, структура теряет стабильность из-за
взаимного отталкивания сближенных одноимённо заряженных кислородных слоёв.
Поэтому не рекомендуется извлекать больше половины лития, что снижает ёмкость
по сравнению с теоретической. При зарядке аккумуляторов, во избежание порчи,
должно быть ограничение по напряжению.
Во-вторых, при многократном циклировании часть высокозарядных катионов
переходит из своих "законных" слоёв в литиевые. Тем самым частично
снимается указанное выше отталкивание слоёв, но зато они сближаются (т.к.
трёхзарядные катионы значительно мельче катиона лития) и ухудшаются условия
диффузии лития.
Первое затруднение преодолевается при замене оксидов сульфидами, т.к.
эффективный заряд аниона серы значительно ниже, а радиус больше. В частности,
слоистая структура TiS2 стабильна сама по себе, вовсе без лития в межслоевом
пространстве. Но, как указано выше, сульфиды не дают достаточно высокого
напряжения.
Второе затруднение преодолевается при отказе от структуры О3 и замене её
структурами O2, T2 или T6. Они состоят из таких же кислородно-октаэдрических
слоёв, как и О3, но, в отличие от О3, октаэдры соседних слоев находятся не в
одинаковой ориентации и связаны не трансляцией (рис. 2), а зеркальной
плоскостью и (или) винтовой осью, или плоскостью скользящего отражения. Такие
структуры с литием термодинамически неустойчивы (но устойчивы кинетически) и
получаются не прямым высокотемпературным синтезом, а ионным обменом из
натриевых соединений с призматической координацией.
На рис. 4 слева показана структура Р2, например, NaxCoO2, где x»0.6-0.8. Сравнение с рис. 2
показывает, что один из заштрихованных слоёв - в той же ориентации, а другой -
в противоположной. При ионном обмене в расплаве нитрата лития или в кипящем метанольном
растворе галогенида лития натрий замещается литием. Но для лития призматическая
координация невозможна, т.к. анионы слишком сильно сближены. Поэтому слои
сдвигаются так, чтобы обеспечить литию октаэдрическую координацию, даже ценой
объединения одной грани с октаэдром высокозарядного катиона. В полученной
структуре О2 при циклировании катионы переходного металла уже не переходят в
литиевые позиции, т.к. тогда были бы аномально сближены два высокозарядных
катиона.
Если в натрий-кобальтовой бронзе заменить кобальт на сочетание разных
элементов с сильно отличающимися степенями окисления, то получаются усложнённые
варианты структуры Р2 с упорядочением гетеровалентных катионов (рис. 5 слева).
При ионном обмене на литий они также перестраиваются скольжением слоёв, но
теперь уже в структуру Т2 (рис. 5 справа), которая тоже эффективно циклируется
в аккумуляторе. Изначальное содержание лития там меньше, чем в LiCoO2, но его,
по-видимому, можно не только извлекать (окисляя Ni2+), но и внедрять
(восстанавливая Mn4+).

Рисунок 4. Превращение NaxCoO2 типа P2 (слева) в LiCoO2 типа O2 (справа)
путём сдвига слоёв при ионном обмене. В заштрихованных октаэдрах Co, в призмах
Na, в белых октаэдрах Li (C. Delmas et al., Mater. Res. Bull. 1982. V. 17.
P.117)
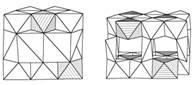
Рисунок 5. Превращение Na2NiMn2O6 - упорядоченного варианта типа P2
(слева) в Li2NiMn2O6 типа T2 (справа) путём сдвига слоёв при ионном обмене. В
белых октаэдрах Mn, в заштрихованных октаэдрах Ni, в призмах Na, в тетраэдрах
Li (J.M. Paulsen et al. Chem. Mater. 2000. V. 12. P. 2257)
.3 Материалы с каркасными структурами
Они ещё более разнообразны, чем слоистые, но здесь будут рассмотрены лишь
два структурных семейства, которые считаются наиболее перспективными, хотя до
коммерческого применения пока не доведены.O4 имеет кубическую структуру типа
шпинели MgAl2O4 (рис. 6). Она, как и структура О3, основана на трехслойной
плотнейшей упаковке анионов (что, кстати, приводит к большому сходству порошковых
рентгенограмм), но способ заселения пустот иной: Li+ находится в тетраэдрах, а
Mn3+ и Mn4+ - в октаэдрах, причём не наблюдается макроскопического
ян-теллеровского искажения, характерного для Mn3+, вероятно, из-за
делокализации электронов между катионами марганца.
Рисунок 6. Кристаллическая структура LiMn2O4
В заштрихованных октаэдрах Mn, в белых тетраэдрах Li. Чтобы легче увидеть
сходство со структурой О3, ось третьего порядка куба ориентирована вертикально
Путь миграции лития во многом подобен показанному на рис. 2: из занятого
тетраэдра через треугольную грань в междоузельный октаэдр и далее через такую
же грань в следующий тетраэдр. Трёхмерно-связанная структура шпинели допускает
варьирование содержания лития в очень широких пределах без перестроек и
разрушения - от полного извлечения лития до состава Mn2O4 (l-MnO2) до внедрения второго катиона
лития: Li2Mn2O4. В последнем случае катионы лития перемещаются в октаэдры, и
получается упорядоченный вариант структуры NaCl, сохраняющий симметрию
структуры шпинели.
Группа соединений LiMPO4 (M2+ = Mn, Fe, Co, Ni) имеет структуру типа
оливина (Mg,Fe)2SiO4. Их кристаллические структуры ромбической симметрии (рис.
7) построены из тетраэдров PO4 и октаэдров FeO6, соединённых вершинами и
рёбрами. Катионы лития занимают октаэдры, связанные через пустые тетраэдры лишь
в одном измерении, что, конечно, несколько стесняет свободу их перемещения
(если в некоторых местах катионы Li+ и M2+ поменяются местами, то канал
миграции будет блокирован). Кроме того, электронная проводимость этих фаз очень
мала, т.к. расстояние М-М увеличено по сравнению с ранее рассмотренными
структурами: октаэдры МО6 соединяются вершинами, а не рёбрами. Однако
существенно повысить проводимость удаётся благодаря легированию и созданию на
поверхности зёрен углеродного слоя при синтезе. В результате LiFePO4 хорошо
проявил себя при циклировании в ячейке с литиевым электродом (рис. 8) и,
безусловно, заслуживает внимания.
литий ионный аккумулятор электрод
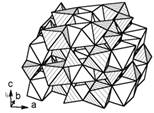
Рисунок 7. Кристаллическая структура LiFePO4.
В заштрихованных тетраэдрах - фосфор, в заштрихованных октаэдрах -
железо, в белых октаэдрах - литий.
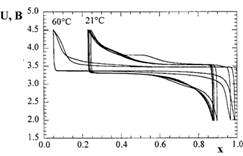
Рисунок 8. Зарядно-разрядные кривые LixFePO4 при плотности тока 1 мА/см2.
Указано напряжение относительно литиевого электрода.
.4 Методы синтеза оксидных материалов положительного электрода
Все методы синтеза включают высокотемпературную стадию. Как показано
выше, некоторые материалы получают низкотемпературным ионным обменом натрия на
литий, но исходный натрийсодержащий сложный оксид всё равно должен быть получен
при высоких температурах. Конкретные температуры синтеза варьируют в широких
пределах (400-1000°С)
в зависимости от типа материала, исходного сырья, способа смешения компонентов.
Если используются механические смеси оксидов с карбонатом лития, то реакция
идёт путём диффузии реагентов через слой продукта и требует высоких температур.
Температуры существенно снижаются, если вместо оксидов использовать соединения,
которые при термическом разложении дают активные формы оксидов: гидроксиды,
нитраты, ацетаты, оксалаты, цитраты и т.п., особенно если все реагенты
предварительно смешаны в одной жидкой фазе (водном растворе или расплаве).
Повышение температуры способствует более полному протеканию реакций, но
одновременно растёт размер кристаллов, что обычно нежелательно. Кроме того,
температура влияет на дефектную структуру (в особенности важна возможность
обмена позициями между катионами лития и переходного металла) и на степень
окисления переходного металла: при очень высоких температурах высокие степени
окисления (Co3+, Ni3+, Mn4+) дестабилизируются. Надёжных исходных реагентов с
такими степенями окисления нет, поэтому для их получения требуется окислительная
атмосфера. Например, в системе кобальт-кислород высшим оксидом является не
Co2O3, а Co3O4, но в присутствии щелочных компонентов на воздухе
стабилизируются степени окисления 3+ и выше:
Co3O4 + Na2CO3 + 0,5 O2 ® 3 Na2/3CoO2 + CO2;O4 + 1,5 Li2CO3 + 0,25 O2 ® 3 LiCoO2 + 1,5 CO2.
Для синтеза LiMnO2 нужна инертная атмосфера, а для синтеза LixFePO4 с
железом (2+) - восстановительная, т.к. устойчивыми исходными оксидами являются
Fe2O3 или Fe3O4, но не FeO. Однако в сильно восстановительной атмосфере
водорода или СО железо восстанавливается до металла, поэтому активность
кислорода в системе нужно строго контролировать. Один из вариантов - синтез в
присутствии органических добавок (например, сахарозы), которые не только
переводят железо в степень окисления 2+, но и оставляют тончайший углеродный
слой, обеспечивающий электронную проводимость. По другим данным, высокую
проводимость обеспечивает продукт глубокого восстановления Fe2P. Следовательно,
большую роль должны играть количество восстановителя и длительность процесса,
чтобы фосфат не восстановился до фосфида полностью.
4. Материалы отрицательного электрода
Очевидно, что наилучшим материалом для изготовления литиевого
аккумулятора является металлический литий. К сожалению, сочетание высокой
активность этого металла с особыми свойствами пассивной пленки, формирующейся
на его поверхности, порождают пока что неразрешимую проблему эффективной
циклируемости металлического лития. При зарядке аккумулятора, когда на
отрицательном электроде происходит разряд катионов Li+ и образование осадка
металлического лития, последний, в значительной части, формируется не на
границе "металлический литий - пассивная пленка", а на поверхности
самой пленки. Частицы свежеосажденного лития инкапсулируются, покрываясь
свежеобразованной пленкой продуктов химического взаимодействия с компонентами
раствора, и теряют электрический контакт с металлом электрода. Кроме того,
формирующийся осадок имеет нежелательную "древовидную" (дендритную)
структуру, обладает высокой пирофорностью. В результате значительная часть
свежеосажденного лития уже не участвует в производстве электроэнергии в
последующем разрядном цикле.
Попытки решить проблему обратимого циклирования лития можно условно
разделить на три основных направления.
Первое - поиск растворителей и электролитов, позволяющих получать при
циклировании компактные осадки лития со 100% выходом по току. Как уже
отмечалось ранее, основной причиной, приводящей к низкому качеству осадка,
является пассивация поверхности электроосаждаемого лития за счет взаимодействия
с компонентами раствора. Подбор растворителей и электролитов, позволяющих
уменьшить пассивацию, может способствовать улучшению свойств осадка. Вместе с
тем, уменьшение пассивации лития вызывает усиление его коррозии при хранении
аккумулятора, что ведет к "замене" проблемы циклирования на проблему
сохранности ЛИТ.
Второе направление исследований, так или иначе, связано с попыткой
создания защитного слоя с особыми свойствами на границе литий-электролит.
Защищая литий от коррозии, такой слой не должен препятствовать образованию
высококачественного осадка металла на своей внутренней границе (то есть на
поверхности металла). Интересные результаты в этой области исследований
получены, например, при нанесении на поверхность электрода полимерных покрытий,
препятствующих непосредственному контакту лития с электролитом и улучшающих
качество осадка на границе Li/полимер. Тем не менее, сохранение хорошей адгезии
полимера к литию в процессе чередующегося растворения-формирования слоев металла
на этой границе представляется проблематичным. В отличии от естественной
пассивирующей пленки, самопроизвольно формирующейся на поверхности лития и
изменяющей свои свойства при изменении потенциала электрода, такой слой в
значительной степени является статическим, не обновляемым образованием.
Следовательно, его свойства не имеют обратной связи с изменяющимися
характеристиками электрода.
С высоты сегодняшнего дня ясно, что наиболее продуктивным и перспективным
путем решения проблемы циклируемости лития оказалось использование вместо
чистого металла литийсодержащих материалов, способных к его обратимой
электрохимической абсорбции и десорбции в ходе зарядно-разрядных циклов.
Нахождение лития внутри материала матрицы препятствует его взаимодействию с компонентами
электролита. Наряду с высокой степенью обратимости интеркаляции, эффективные
матрицы должны обеспечивать достаточную скорость внедрения и растворения лития,
иметь высокую абсорбционную емкость. При этом нежелательно повышение
интенсивности взаимодействия лития с материалом электрода, снижающее активность
лития и, следовательно, повышающее значение равновесного (по ионам лития)
потенциала электрода. К очевидным недостаткам замены чистого лития
литийсодержащим материалом относится повышение массы электрода, а,
следовательно, снижение его теоретической удельной энергии и мощности.
Фактически, использование подобных материалов является компромиссом между
высокой удельной энергией и длительным сроком службы литиевых аккумуляторов:
ухудшение энергетических характеристик должно быть скомпенсировано повышением
количества эффективных зарядно-разрядных циклов.
По характеру взаимодействия с литием можно выделить два основных типа
материалов-хозяев:
й - материалы, не претерпевающие фазовых превращений, а, значит, и
существенной трансформации кристаллической решетки при
интеркаляции-деинтеркаляции лития;
й - материалы, образующие с литием соединения со структурой, отличной от
структуры "свободной" матрицы.
Характерными представителями 1й группы являются графитизированные
углеродные материалы со слоистой структурой. В настоящее время такие материалы
используются в промышленно производимых литий-ионных аккумуляторах и
по-прежнему продолжают совершенствоваться научным сообществом. Пионером
производства литий-ионных аккумуляторов с литийуглеродным анодом стала в начале
90х годов корпорация Sony (Япония). Лучшие образцы графитизированного углерода
позволяют обратимо интеркалировать литий до состава LiC6. При этом атомы лития
размещаются в межслоевом пространстве графита, в результате чего изменение
объема материала в процессах интеркаляции-деинтеркаляции лития не превышает
30%.
Ко второму типу материалов-хозяев относятся некоторые металлические и
неметаллические электроды, образующие с литием интерметаллические соединения. К
наиболее перспективным, с точки зрения возможного использования их литиевых
сплавов в ХИТ, в разное время были отнесены такие материалы, как Si, Sn, Sb,
Al, Ge, Pb, Bi, Sb, Zn, Cd.
Сопоставление некоторых важнейших характеристик интеркаляционных материалов
(до и после интеркаляции лития), определяющих возможность их использования во
вторичных ЛИТ (рис. 1.4), позволяет теоретически оценить достоинства и
недостатки каждого типа материалов.
В целом, по величинам теоретического удельного заряда (рис. 1.4а),
плотности заряда (рис.1.4б) и диапазону рабочих плотностей тока литиевые сплавы
превосходят литированный графит LiC6. При этом указанные параметры сплавов,
конечно же, уступают таковым для чистого лития. Рабочий диапазон потенциалов
внедрения лития (потенциалов литийсодержащих фаз) для большинства сплавов
больше и положительнее (по отношению к Li+/Li электроду), чем для LiC6.

Удельный заряд (а), плотность заряда (б), диапазон рабочих потенциалов
(в) и стандартизированные объемы (г) литированных анодных материалов
перезаряжаемых литиевых источников тока. Li4- фактически необходимое количество
лития.
Это означает, что для батарей с LiC6 анодом теоретически достижимо более
высокое разрядное напряжение и некоторые другие энергетические характеристики.
С другой стороны, близость потенциала LiC6 к потенциалу чистого лития может
обусловливать его повышенную реакционную способность по сравнению со сплавами.
Возможно, это является одной из причин соинтеркаляции молекул растворителя в
структуру графитизированных материалов. Использование "углеродных"
электродов ограничивается также и невысокими значениями рабочих плотностей
тока, в то время как литийсодержащие сплавы позволяют производить заряд и
разряд анода при значительно более высокой плотности тока. Наиболее серьезным
недостатком сплавов по сравнению с литированным графитом является значительное
изменение объема металла в процессе внедрения (или растворения) лития,
приблизительно составляющее от 100% для LiAl до 300% для Li22Si5. Столь
существенное изменение объема при образовании сплавов LixM, имеющих выраженный
ионный характер (фазы Зинтла: Lix+Mx-) может быть обусловлено существенным
увеличением размеров атомов металла при получении отрицательного заряда в ходе
интеркаляции лития: M0 +xē ↔Mx-. Следствием резких объемных изменений
являются возникающие в процессе заряда-разряда механические напряжения,
приводящие, в свою очередь, к деградации рабочего слоя сплава и потере контакта
между частицами активного вещества. Интенсивность деградации зависит и от
состава электролита (природы растворителя): формирование поверхностной пленки
продуктов взаимодействия компонентов электролита, проникающего в трещины
литиевого сплава, может в большей или меньшей степени ухудшать условия контакта
и способствовать дальнейшему развитию трещин. Тем не менее, отметим, что
кремний и его соединения продолжают оставаться (и исследоваться) весьма
перспективными материалами для отрицательных электродов литий-ионных
аккумуляторов нового типа.
Вышеприведенные примеры касаются, главным образом, относительно простых
по составу интеркаляционных "матриц". В действительности, в качестве
перспективных материалов отрицательного электрода ЛИА предлагается использовать
и весьма разнообразные неорганические материалы сложного состава. Так,
например, важным событием в области практического изготовления литиевых
аккумуляторов стал коммерческий выпуск литий-ионных батарей с отрицательным
электродом из аморфного композита на основе олова, произведенный в середине 90х
годов корпорацией Fuji Photo Film Celltec Co. (Япония). По удельной энергии и
плотности энергии эти аккумуляторы превзошли существовавшие на тот момент
литий-ионные батареи корпорации Sony с анодом на основе литированного графита,
хотя и были позднее сняты с производства, уступив конкурентам по совокупности
характеристик. Упомянутый оловосодержащий композиционный оксид соответствовал
составу SnB0.56P0.40Al0.42O3.6 и представлял собой стеклообразную массу,
получаемую спеканием смеси SnO, B2O3, SnP2O7 и Al2O3 при 1100 оС. При внедрении
лития происходило формирование дисперсных включений интерметаллических
соединений системы литий-олово, в то время как остальные компоненты (или
продукты их превращения) формировали электропроводную матрицу, окружающую эти
включения. Отметим, что поведение SnO как "абсорбента" лития
существенно отличается от поведения диоксидов переходных металлов MoO2, TiO2,
WO2: в первом зарядном цикле происходит восстановление SnO до металлического
олова с параллельным образованием li2O. Последующее циклирование связано уже с
обратимым взаимодействием лития с металлическим оловом, в то время как частицы
Li2O и соединений B, P, Al, входящих в состав композита, не играют заметной
роли в поглощении лития. Как уже отмечалось выше, последние образуют стеклообразную
матрицу, играющую роль решетки, стабилизирующей микроструктуру композита, в том
числе микрочастицы олова.
Попытки получения композитов, сочетающих аморфный поглотитель лития и
образующий пространственную решетку материал, продолжаются и в настоящее время.
При этом основное внимание уделяется поиску материалов с малыми величинами
необратимой потери заряда. В качестве подобных систем исследованы, например,
интерметаллические соединения олова и железа Sn2Fe, SnFe, Sn2Fe3 и Sn3Fe5,
которые при внедрении лития образуют LixSn и свободное Fe, формирующее
пространственную решетку. Подобно олову в "композиционном оксиде" или
интерметаллидном электроде SnSb, удаление лития из SnxFeyLiz сплава приводит к
восстановлению структуры исходного материала - SnxFey.
Важным фактором, обусловливающим морфологическую стабильность
композиционных материалов при циклировании лития, является высокая степень
дисперсности частиц реагента. Проведенные Бесенхардом (Besenhard) с сотр.
исследования показали, что уменьшение размера частиц реагента (Sn, SnSb и
SnAgn) от 2000-4000 нм до 200-400 нм позволяет увеличить количество эффективных
зарядно-разрядных циклов в десятки раз. Чем меньше размер литийсодержащих
фазовых включений, тем меньше возникающие механические напряжения и выше
устойчивость структуры матрицы к деградации. К сожалению, возможность
достижения столь малой степени дисперсности частиц реагента, которая может
обеспечить требуемую стабильность циклирования, остается открытым.
Наряду с интерметаллическими соединениями и сложными оксидами олова в
качестве перспективных материалов ЛИА исследуются и другие инеорганические
соединения: фосфаты и оксалаты олова, фосфиды кобальта и марганца, нитриды
молибдена, марганца, цинка, кобальта, железа и ряда других металлов, а также некоторые
бинарные и смешанные оксиды переходных металлов. Примером перспективного оксида
является шпинель состава Li4Ti5O12, о возможности использования которой в
качестве "матрицы" для внедрения лития сообщили в 1995 году японские
исследователи. Исходное распределение катионов в этом соединении -
(Li)8а[Li1/3Ti5/3]16dO4 изменяется на [Li2]16c[Li1/3Ti5/3]16dO4 в результате
интеркаляции 1 атома лития в расчете на формульную единицу Li4Ti5O12. Этот
процесс сопровождается незначительными изменениями параметров элементарной
ячейки, что обусловливает высокую стабильность при циклировании лития.
Зарядно-разрядные кривые тонкопленочного электрода на основе Li4Ti5O12
характеризуются продолжительным (емкость около 150 мАч/г) плато при потенциале
1,5 В, которое воспроизводится в течение не менее 100 циклов. Предполагается,
что совершенствование методов синтеза и вариация состава подобных соединений
позволит улучшить их зарядно-разрядные характеристики и повысить стабильность.
Несмотря на активный поиск вариантов использования неуглеродных матриц в
литийионных аккумуляторах, продолжающийся в настоящее время, практически все
коммерчески производимые аккумуляторы изготовляются с использованием
отрицательного электрода на основе углерода или углеродных композитов. Некоторые
обнадеживающие результаты, касающиеся применения новых неуглеродных
композиционных "материалов-хранителей" лития в качестве основы
отрицательного электрода, определяются наличием у подобных материалов следующей
совокупности характеристик (свойств):
·
приемлемые
интеркаляционная емкость по литию и потенциал "заряженного"
электрода;
·
малый размер
частиц абсорбента лития;
·
обратимость
взаимодействия реагента с литием;
·
присутствие в
композиции разных типов материалов, в первую очередь реагента и инактивной
матрицы, играющих свою роль в процессе взаимодействия с литием и обеспечении
морфологической устойчивости системы;
·
сохранение
фазового разделения компонентов системы в процессе циклирования лития.
5. Сепараторы
и конструкции аккумуляторов
Чтобы уменьшить внутреннее сопротивление ХИТ и сделать его компактным,
его электроды должны быть как можно ближе друг к другу.
А чтобы при этом не произошло короткого замыкания, между ними помещается
сепаратор, т.е. мембрана, проницаемая для ионов: либо пористая, пропитываемая
жидким электролитом, либо сама обладающая литий-ионной проводимостью.
Сепаратор должен:
быть электронным изолятором;
оказывать минимальное сопротивление движению ионов, т.е. быть тонким и
пористым, при этом однородным по толщине;
иметь механическую прочность, т.е. быть не слишком тонким;
препятствовать проникновению через поры твёрдых частиц электродных
материалов;
быть химически стойким по отношению к электродным материалам - сильным
восстановителям и окислителям;
хорошо смачиваться электролитом;
быть гибким для использования в элементах со спиральной намоткой;
быть недорогим.
Эти требования во многом противоречивы, и приходится искать компромиссные
решения.
Наиболее употребительными в литий-ионных аккумуляторах являются
микропористые мембраны из полиэтилена и полипропилена толщиной менее 30 мкм, с
размером пор 0,03-0,1 мкм и объёмной долей пор 30-50%. Для предотвращения
взрыва при перегреве литий-ионного аккумулятора желательно, чтобы при
превышении допустимой температуры поры закрывались при сохранении механической
прочности. С этой целью используются трёхслойные мембраны
полиэтилен-полипропилен-полиэтилен.
Около 135°С
полиэтилен оплавляется и закрывает поры, а полипропилен, температура плавления
которого на 30° выше,
сохраняется в твёрдом состоянии.
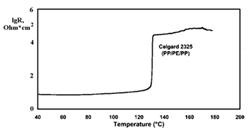
Рисунок. Температурная зависимость электросопротивления трёхслойного
сепаратора марки Celgard (пропитанного электролитом)
Наиболее типичная конструкция цилиндрических и призматических (в форме
параллелепипеда) аккумуляторов предусматривает наложение четырёх тонких лент:
сепаратора, алюминиевой фольги с наклеенным материалом положительного
электрода, сепаратора и медной фольги с наклеенным материалом отрицательного
электрода. Большую роль при этом играет связующее. Оно должно обеспечить
одновременно электрический контакт и хорошее сцепление порошков с фольгой,
чтобы они не осыпались при наматывании, и при этом быть устойчивым к жидкому
электролиту. Эту четырёхслойную ленту сматывают в спираль, помещают в корпус,
заливают электролитом и герметизируют.
Заключение
Из проведённого рассмотрения следует, что создание эффективного
устройства - это комплексная материаловедческая проблема на стыке
неорганической химии, кристаллохимии, химии твёрдого тела, электрохимии, физической
химии неводных растворов, металловедения, органической химии и химии
высокомолекулярных соединений.
Список рекомендуемой литературы
1.
Tarascon J.-M. Issues and challenges facing rechargeable lithium batteries [Текст] /J.-M. Tarascon, M. Armand //
Nature. - 2011. - V. 414. - P. 359-367.
2. Львов А.Л.
Литиевые химические источники тока [Текст] / А.Л. Львов // Соросовский
образовательный журнал. - 2011. - Т. 7. - №3. - С. 45-51.
. Скундин
А.М. Современное состояние и перспективы развития исследований литиевых
аккумуляторов [Текст] / А.М. Скундин, О.Н. Ефимов, О.В. Ярмоленко // Успехи
химии. - 2012. - Т. 71. - №4. - С. 378-398.
4.
Xu K. Nonaqueous Liquid Electrolytes for Lithium-Based Rechargeable Batteries [Текст] / K. Xu // Chem. Rev. - 2004. - V.
104. - P. 4303-4417.
.
Whittingham M.S. Lithium Batteries and Cathode Materials [Текст] / M.S. Whittingham // Chem. Rev. - 2004. - V. 104. - P.
4271-4301.
. Скундин
А.М. Литий-ионные аккумуляторы: современное состояние, проблемы и перспективы
// Электрохимическая энергетика, 2011, т. 1, с. 5-15.
7. Кедринский
И.А., Дмитриенко В.Е., Грудянов И.И. Литиевые источники тока. М.: Энергоиздат, 2012, 247 c.
8.
Lithium Batteries: Science and Technology / Editors: Glocham-Abbas Nazri and
Gianfranco Pistoia, Kluwer Academic Publishers, New York, 2004, 708 p.
.
Jose L. Tirado, Inorganic materials for the negative electrode of lithium-ion
batteries: state of the art and future prospects // Materials Science and
Engineering, 2003, R40, pp. 103-136.
.
Arora P. Battery Separators [Текст]
/ P. Arora, Z. Zhang // Chem. Rev. - 2004. - V. 104. - P. 4419-4462.
.
Long J.W. Three-Dimensional Battery Architectures [Текст] / J.W. Long, B. Dunn, D.R. Rolison,
H.S. White // Chem. Rev.
- 2004. - V. 104. - P. 4463-4492