Азобарвники: дифенілкарбазид, дифенілкарбазон, ПАР, реагенти типу арсеназо і торон
Міністерство
освіти і науки України
Східноєвропейський
національний університет імені Лесі Українки
Кафедра
аналітичної хімії та екотехнологій
Реферат
на
тему:
Азобарвники:
дифенілкарбазид, дифенілкарбазон, ПАР, реагенти типу арсеназо і торон
З
дисципліни "Органічні реагенти в аналізі"
Луцьк
2015
Вступ
Азобарвники є самою численною і
найбільш важливою групою органічних барвників, які дають всю гаму кольорів -
від жовтого до чорного. Вони складають майже третину всього
виробництва барвників, а за кількістю марок стоять на першому місці серед решти
класів барвників.
Азобарвники вигідно відрізняються від інших груп
доступністю сировини, нескладною технологією фарбування, різноманітністю
властивостей і кольорів і, нарешті, порівняно невисокою вартістю. Основними
користувачами азобарвників є такі важливі галузі промисловості, як текстильна,
поліграфічна, лакофарбувальна і т.д. Ними можна фарбувати всі види природних,
штучних і синтетичних волокон, пластмас, шкіри, паперу, гумових виробів і т.д.
Для одержання більшості азобарвників
використовуються дві послідовні реакції: діазотування первинних ароматичних
амінів (діазоскладових) і азосполучення (сполучення одержаної діазонієвої солі
з азоскладовими (ароматичними і гетероароматичними сполуками, що містять ЕД
замісники) [1].
1. Дифенілкарбазид
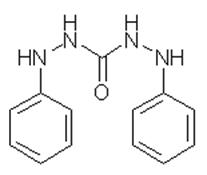
Мал. 1. Структурна формула
дифенілкарбазиду.
Властивості. Дифенілкарбазид (мал.
1) - безбарвна кристалічна речовина, на повітрі окислюється і набуває розового
кольору і ще скоріше змінює колір у розчині; температура плавлення - 172-173°С;
розкладається при температурі кипіння. Легко розчинний в гарячому спирті і
бензолі, гірше в ефірі. Дуже важко розчиняється в гарячій воді і нерозчинний в
холодній. Легко розчинний в лугах.
Реактив:
) Розчин 1 г дифенілкарбазиду в 100
мл 95%-го спирту.
) Для реакцій на катіони: розчин 0,1
г дифенілкарбазиду в 100 мл 50%-го спирту.
) Для колориметричного визначення
CrO42-: розчин 0,5 г дифенілкарбазиду в 10 мл льодяної
оцтової кислоти розбавляють 90 мл
%-ного спирту.
) Для реакції на ртуть: насичений
розчин дифенілкарбазиду в 95%-ному спирті насичують NH4CNS і
добавляють декілька кристаликів KI.
) Індикатор в меркурометрії: насичений розчин
дифенілкарбазиду в 95%-ному спирті залишають на декілька днів, поки він не
забарвиться в червоний колір.
) Індикаторний папір: фільтрувальний
папір змочують свіжоприготовленим розчином дифенілкарбазиду (реактив 1) і
висушують.
Аналітичне застосування
дифенілкарбазиду
Якісні реакції:
. Якісні реакції на Cd2+.
Установлено, що взаємодія в лужному середовищі дифенілкарбазиду із Cd2+
приводить до утворення продукту, який має червоне забарвлення. Наявність
нітрогрупи активує водень діазоаміногрупи, робить його більш рухомим і,
відповідно, більш схильним до утворення солей Кадмію.
Розбираючи механізм цієї реакції,
варто відмітити, що діазоаміносполуки утворюють два роди солей - що
відповідають анти- і син-формі. Солі син-форми в більшості випадків забарвленні
в червоний колір; їм приписують внутрішньокомплексну сполуку (мал. 2).

Мал. 2. Комплекс дифенілкарбазиду з
кадмієм.
2. Якісні реакції на Cr3+,
CrO42-. Використовується електрографічний метод.
. Якісні реакції на Cu2+.
Дифенілкарбазид, що містить групу атомів:

є специфічним реактивом на Cu2+
(реакція протікає в аміачному середовищі). В цьому випадку дифенілкарбазид
функціонує як двохосновна кислота і утворює з Cu2+ важкорозчинні у
воді солі (мал. 3), забарвленні в зелений колір.
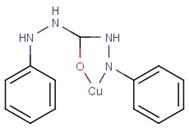
Мал. 3. Комплекс дифенілкарбазиду з
мідю.
. Якісні реакції на Fe2+.
Механізм взаємодії дифенілкарбазиду із солями Fe2+ аналогічний
механізму взаємодії цього реагенту із солями міді. Внаслідок взаємодії
утворюються солі (мал. 4), забарвленні в характерний синій колір.
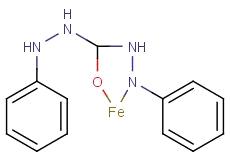
Мал. 4. Комплекс дифенілкарбазиду із
залізом.
. Якісні реакції на Hg2+.
Використовується капельний метод.
. Якісні реакції на Mg2+.
Дифенілкарбазид в лужному середовищі адсорбується утвореним гідроксидом магнію,
забарвлюючи розчин в синій колір. Утворюється розчинна у воді сіль (мал. 5).
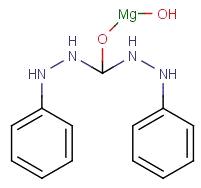
Мал. 5. Комплекс дифенілкарбазиду з
магнієм.
. Якісні реакції на Mo.
. Якісні реакції на Pb2+.
. Якісні реакції на V4+
[3].
Кількісне визначення
1. Визначення
Cl-. Для визначення іону Cl- використовується ртутний
комплекс дифенілкарбазиду. Кількісно хлорид-іон визначають за масою утвореного
осаду хлориду ртуті (ІІ).
2. Визначення
хрому. Визначення проводять за рахунок утворення важкорозчинної комплексної
солі дифенілкарбазиду із хромом.
3. Визначення
ртуті. Визначення проводять за рахунок утворення важкорозчинної комплексної
солі дифенілкарбазиду із ртуттю.
4. Визначення
Pb2+. Визначення проводять колориметричним методом. Дифенілкарбазид
зі свинцем утворює комплексну сполуку, яка здатна поглинати світло при довжині
хвилі 578 нм.
5. В
якості індикатора. Дифенілкарбазид використовується в кількісному аналізі в
якості індикатора при визначенні наступних елементів: Hg,
V, Fe,
Ch, In,
Cd, Zn,
деякі сульфати.
2. Дифенілкарбазон

Мал. 6. Структурна формула
дифенілкарбазону.
Властивості. Дифенілкарбазон (мал.
6) - оранжевий кристалічний порошок. Плавиться з розкладом при 156-158°С. Легко
розчиняється у спирті, хлороформі і бензолі. Важче розчинний у ефірі.
Нерозчинний у воді.
Реактив. Розчин 1 г дифенілкарбазону
в 100 мл 95%-ного спирту [2].
Аналітичне застосування
дифенілкарбазону
Якісні реакції:
1. Якісна реакція на Cr.
Утворення комплексної малорозчинної солі темно-коричневого кольору (мал. 7).
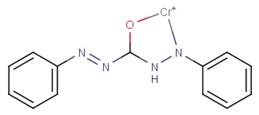
Мал. 7. Комплекс дифенілкарбазону з
хромом.
2. Якісна реакція на V.
Механізм взаємодії аналогічний до попереднього (утворення комплексної солі
фіолетового забарвлення) [3].
Кількісне визначення
1. Визначення Ag. Визначення
проводять за рахунок утворення важкорозчинної комплексної солі дифенілкарбазону
зі сріблом (мал. 8).

Мал. 8. Комплекс дифенілкарбазону зі
сріблом.
2. Визначення Hg (в присутності
двох металів).
3. Визначення Pb.
Визначення проводять за рахунок утворення важкорозчинної комплексної солі
дифенілкарбазону зі свинцем.
. В якості індикатора.
Дифенілкарбазон використовується в кількісному аналізі в якості індикатора при
визначенні наступних іонів: Ag+, Ni2+,
Hg2+,
Pb2+,
Zn2+,
Br-,
I-,
CN-
[2].
Мал. 9. Структурна формула
1-(2-піридилазо)-2-резорцину (ПАР).
В якості аналітичних реагентів
широко використовують відносно прості моноазосполуки, які, однак, по
ефективності аналітичної дії не поступаються більш складно побудованим
сполукам. Це - реагенти на основі похідних фенолу і аніліну. Цей порівняно
новий клас органічних реагентів - піридинових азосполук - знаходить все більше
значення в аналітичному застосуванні. Серед них 1-(2-піридилазо)-2-резорцин
(ПАР) є найбільш вивченим (Мал. 9). На сьогодні розроблені методи
фотометричного і комплексонометричного визначення близько 30 елементів з ПАР.
ПАР - дуже чутливий реагент на Nb: молярний коефіцієнт поглинання складає від
25·103 до 35·103 в залежності від умов визначення. Також
за допомогою ПАР можна визначити такі елементи - Ta, Co,
Pd, In,
Ga, Cu,
Zn, Cd,
Tl, Sc,
Th, Pb,
Bi, U
і деякі рідкоземельні елементи.
. Реагенти типу арсеназо і торон
Одним з найважливіших класів
органічних реагентів, які застосовуються в неорганічному аналізі, є азосполуки.
Серед них безсумнівний інтерес складає група реагентів, де азоскладова -
хромотропова кислота. Це моноазотозаміщенні - арсеназо І і аналоги та арсеназо
ІІІ і аналоги. Остання група реагентів найбільш численна і до цього часу
знайшла широке практичне застосування. Всього синтезовано більше ста реагентів
цієї групи; серед них крім арсеназо ІІІ широко використовуються сульфохлорфенол
С, хлорфосфоназо ІІІ, арсеназо М, нітхромазо, сульнітрофенол М, ортаніловий К,
ортаніловий С, пікрамін М та інші.
Область аналітичного застосування
реагентів різноманітна. Сполуки цієї групи (в тому числі полімерні аналоги)
застосовуються в якості основних чи допоміжних реагентів для осадження
елементів, різних варіантів їх концентрування і розділення, екстракції і
визначення. Фотометрія основна область аналітичного застосування реагентів.
Більш як із 40 елементами реагенти цієї групи дають кольорові реакції, для 15
елементів розроблені кількісні методи фотометричного визначення в різних
матеріалах. Частіше за все реагенти застосовуються для фотометричного
визначення U, Th, Zr, Hf, Sc,
Pa, Np,
Pu, Nb,
Pd, SO42-,
Mo, Cu,
V, Ca,
Sr, Ba,
Al, Ga,
In.
Крім чисто практичного інтересу
вивчення реагентів групи арсеназо, або ж 2,7-бісазозаміщених хромотропової
кислоти, відкриває додаткові можливості для розробки теорії дії органічних
реагентів. Дійсно, систематичне вивчення більшого числа сполук, що мають
подібну структуру і відрізняються положенням і природою замісників, позволяє
зробити певні висновки про механізм комплексоутворення, природи кольорових
реакцій, зв’язку між структурою реагенту, природою і положенням замісників і
основними аналітичними властивостями реагенту.
Можна відмітити, що далеко не всі
аспекти теорії дії реагентів цієї групи вирішенні. Багато із них являються
дискусійними.
На сьогоднішній день відомі
фотометричні методи аналізу, із застосуванням органічних реагентів типу
арсеназо. Як відомо, існує деяка межа чутливості: молярний коефіцієнт
поглинання ε для
продукту реакції складає приблизно 2·105. Таке значення ε
при
відповідній довжині хвилі мають інтенсивно забарвленні органічні реагенти.
Таким чином, межа чутливості досягає 10-6 - 10-7 М
визначуваного елемента (у випадку використання стандартних фотометрів).
Спектрофотометрія - основна область
застосування реагентів типу арсеназо і торон. Можна відмітити дві особливості,
характерні для кольорових реакцій реагентів цього типу з елементами. Перша -
властивість утворювати досить стійкі комплекси. Це дозволяє працювати в сильно
кислих розчинах, де відсутній гідроліз і не утворюються повільно реагуючі
багатоядерні гідроксо-іони елементів; відтворюваність результатів і надійність
визначення різко збільшується, відпадає необхідність ретельно підтримувати рН,
техніка роботи спрощується; вплив аніонів зводиться до мінімуму. Все це
дозволило розробити деякі автоматичні схеми визначення елементів, придатних для
контролю виробництва, наприклад UO22+ із арсеназо ІІІ.
Друга особливість реагентів цієї
групи - висока чутливість кольорових реакцій з елементами. Для багатьох
комплексних сполук молярний коефіцієнт поглинання досягає (80-120)·103,
а для деяких - (160-180) ·103. висока чутливість пов’язана як з
характером спектрів поглинання комплексу і реагенту, так і зі значною стійкістю
утворених комплексів, що дозволяє повністю пов’язати елемент навіть при
великому розбавленні.
Важлива характеристика кольорових
реакцій - їх контрастність, яка у звичайному випадку визначається різницею ∆λ
між
максимумами спектрів поглинання продуктів реакції і реагенту. Для реагентів
цієї групи ∆λ складає
від 30 нм до 125 нм, а в деяких випадках навіть 160 нм.
Отримання азосполук використовується
також в якості металоиндикаторів при комплексонометричних визначеннях
елементів. Як відомо, повинно існувати деяке відношення між стійкістю
комплексів елемента з металоіндикатором і зі застосованим комплексоутворювачем.
Шляхом заміни одного із радикалів R2 2,7-бісазозаміщених
хромотропної кислоти (при збереженні кольорової реакції для даного елемента, що
визначається природою радикалу R1) можна отримати реагенти, що
утворюють комплекси, які сильно відрізняються між собою за стійкістю.
Арсеназо ІІІ

Мал. 10. Структурна формула арсеназо
ІІІ в сильнокислому (І), слабкокислому (ІІ) і лужному (ІІІ) середовищах.
Арсеназо ІІІ - бісазосполука на
основі хромотропної і о-амінофеніларсонової кислот. Реагент застосовується у
вигляді суміші вільної сульфокислоти і її натрієвих солей і являє собою
темно-червоний порошок, який помірно розчиняється у воді або кислотах, добре
розчиняється в бікарбонаті натрію і соді, не розчиняється в ацетоні, спирті,
ефірі і в розчині NaCl.
Реагент, отриманий у вигляді
кислоти, розчиняється у деяких органічних розчинниках.
У сухому вигляді, в нейтральних,
кислих і слабо лужних розчинах, вільних від сильних окисників і відновників,
арсеназо ІІІ може зберігатися без зміни властивостей довгий час (до декількох
років).
Забарвлення водних розчинів реагенту
залежить від рН середовища (мал.10). При кислому середовищі в межах рН від 4 до
10 н. HCl,
тобто в умовах визначення більшості елементів, забарвлення розчинів реагенту
рожеве або червоно-малинове в залежності від концентрації, при рН=5 і вище -
фіолетове або синє, в концентрованій H2SO4
- зелене.
Арсеназо ІІІ не є специфічним
реагентом для окремих елементів і застосовується для визначення більш як 25
елементів. Основні аналітичні характеристики кольорових реакцій наведені в
таблиці 1. Необхідна вибірковість в кожному окремому випадку забезпечується
відповідними умовами роботи: установленням високої кислотності для
багатозарядних катіонів - Pa, Zr,
Hf, UIV,
PuIV,
NpIV,
Th; використанням
екстракційно-фотометричних прийомів аналізу для UO22+. На
мал. 11 видно, що для багатозарядних катіонів оптимальне значення рН реакцій
суттєво зміщені в кислу область. На мал. 12 і 13 наведені спектри поглинання
комплексів арсеназо ІІІ з деякими елементами. Як видно, вони різко зміщені в
довгохвильову область у порівнянні зі спектром реагенту. В таблиці 2 наведені
деякі спектральні характеристики реакцій торію з реагентами групи арсеназо -
торон.
Таблиця 1. Кольорові реакції
арсеназо ІІІ
|
Елемент або іон
|
Забарвлення комплексу
|
λмакс
комплексу, нм
|
Область взаємодії
|
ε·103
|
|
Th Zr Hf NpIV PuIV
Pa UIV UO22+ Sc Y
Ce
La
Pd
Са Pb
|
Зелений Зелений Зелений Зелений
Зелений
Синій
Зелений Зелений Фіолетовий
Зелений
Зелений Зелений Синій Синій Синій
|
665 665 665 665 670 660 670 665 675 665 665
665 600 665 665
|
0,1 - 10 н. HCl
0,2 - 11 н. HCl
0,2 - 11 н. HCl 0,1 - 10 н. HNO3 0,1 - 10 н. HNO3 1 - 10
н. HCl
або
H2SO4 0,1
- 10 н. HCl
рН = 1-4 рН = 1-4 рН = 3-4 рН = 3-4 рН = 3-4 рН = 2-4 рН = 4-7 рН = 4-5
|
130
120 95 125 136 22 130 53 15 55 63 64 16 10 10
|

Мал. 11. Вплив рН на розвиток
забарвлення комплексів арсеназо ІІІ з елементами. λ
= 665 нм.
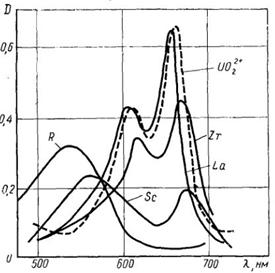
Мал. 12. Спектри поглинання арсеназо
ІІІ і продуктів його реакцій з елементами.
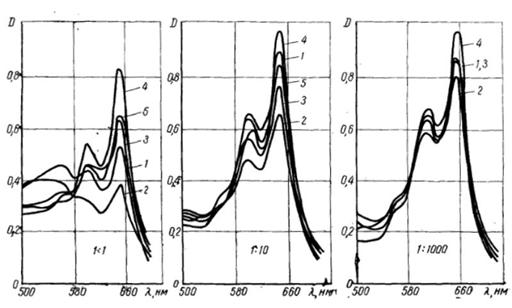
Мал. 13. Спектри поглинання арсеназо
ІІІ ( [R]
= 1,8·10-5 М) і продуктів його рекцій з UO22+
при рН = 2 і відповідностях Ме : R
= 1:1, 1:10, 1:1000 у водному (1) і водно-спиртовому середовищах (2 -
метиловий, 3 - етиловий, 4 - бутиловий, 5 - аліловий спирти).
Таблиця 2. Деякі спектрофотометричні
характеристики реагентів класу арсеназо - торон і їх комплексів з торієм.
|
Реагент
|
λмакс,
нм
|
∆λ, нм
|
λопт,
нм
|
ε комп-лексу,103
|
εMeR/
εR
при λопт
|
|
реагент
|
комплекс
|
|
|
|
|
|
Арсеназо І Торон І Арсеназо ІІ Торон ІІ
Арсеназо ІІІ
|
500 475 510 480 540
|
555 505 550 520 665
|
55 30 40 40 125
|
580 545 600 560 665
|
23 10 20 10 130
|
100 10 12 4 100
|
Арсеназо М
Арсеназо М - порошок темно-червоного
кольору, добре розчинний у воді, в слабкокислих і лужних середовищах.
Арсеназо М є чутливим реагентом на
рідкоземельні елементи. Ітрій, лантан і лантаноїди утворюють з арсеназо М
комплекси синьо-зеленого кольору, скандій і мідь - синього (забарвлення
реагента в слабокислих розчинах - малинове).
Крім рідкоземельних елементів
арсеназо М взаємодіє і з іншими елементами: Bi
(pH = 1-3), Zr
i Hf
(pH = 0,5-1,5), Mg
(pH = 6-8), Al
(pH = 3-6), Zn
(pH = 4-6), Cd
(pH = 3-5), Ga,
In, Mn,
Ni i
Ru (pH
= 5-7), VO2+
(pH = 3-5). Із цих
даних видно, що при умовах визначення рідкоземельних елементів ( рН = 3-4) із
арсеназо М взаємодіють багато елементів, які при визначенні рідкоземельних
елементів повинні бути вилучені або замасковані. В той же час арсеназо М може
представляти самостійний інтерес для фотометричного визначення Cu, Ca, Sc, Pb і
деяких інших елементів.
Сульфохлорфенол С
Реагент являє собою темно-червоний
порошок, помірно (до 0,25%) розчинний у воді, добре - в лугах і слабкорозчинний
у сильно кислих водних розчинах і органічних розчинниках. Реагент і його водні
розчини при відсутності сильних окисників і відновників стійкі на повітрі
невизначено довгий час.
При комплексоутворенні з елементами
червоно-фіолетове забарвлення реагенту переходить в синє; при цьому
спостерігаються різні відтінки, в залежності від природи елемента, його
концентрації і умов проведення реакції. Для легкогідролізуючих елементів - Nb,
Zr i
Hf - забарвлення розвивається
в сильнокислих середовищах, для інших - в області рН = 2-5. Таким чином,
найбільш вибірковими реакціями сульфохлорфенолу С з Nb,
Zr i
Hf, при цьому інші
елементи не заважають визначенню.
Найширше застосування
сульфохлорфенол С знайшов для визначення Nb, з яким взаємодіє в HCl-, HNO3-,
HClO3- і навіть H2SO4-середовищах.
Розроблені методики визначення Nb в сплавах на основі Zr, легованих сталях,
розчинах важкого складу. Реагент також застосовується для визначення Zr, Sc,
Mo, дає чутливі реакції з Al, Ga, In, Be, V, Cu. В таблиці 3 наведені деякі
основні спектрофотометричні дані, що характеризують ці реакції. У вигляді
вільної кислоти або дифенілгуагідних солей реагенті його комплекси з елементами
розчиняються у вищих спиртах, що є основою екстракційно-фотометричних методів
визначення Nb, Zr, Pu, Sc.
Таблиця 3. Кольорові реакції
сульфохлорфенолу С з елементами.
|
Елемент
|
рН
|
λмакс
комп-лексу, нм
|
∆λ, нм
|
λопт,
нм
|
ε комп-лексу, 103
|
|
область взаємодії
|
|
|
|
|
|
Nb Zr Hf Sc Mo Cu Be VO2+
Al Ga In
|
0,1 - 3 н.
HCl
0,1 - 3н. HCl
0,1 - 2 н. HCl
2,5 - 4,0 0,5 - 3 5 - 0,5 н. HCl 6 - 7 2,5
- 5,0 2,5 - 5,0 2,5 - 5,0 2,0 - 6,0
|
1 н. HCl 0,5 н. HCl
0,5 н. HCl
2,2 0,25 н. H2SO4
3,5 6,3
3,5 3,5 3,0 3,5
|
610, 645 640 640 630 600 670, 630 660 620 600
(660) 620 (660) 640
|
50, 85 80 80 70 40 110, 70 100 60 40 (100) 60
(100) 80
|
650 640 640 650 650 670 670 640 660 660 660
|
33 50 46 12 13 49 35 30 34 41 40
|
Сульфохлорфенол М
Цей перспективний реагент - аналог
сульфохлорфенолу С - представляє інтерес для фотометричного визначення перш за
все Pb, Nb, Pu, потім Al, Ga, In, Cu, Zr, VIV і в меншій мірі Sc i
La. Основні спектрофотометричні характеристики кольорових реакцій наведені в
таблиці 4. Властивості реагента: кислотна іонізація, протонування,
комплексоутворення з елементами.
|
Елемент
|
Область взаємодії
|
λмакс комплексу,
нм
|
∆λ, нм
|
ε комплексу, 103
|
|
Pd Nb Pu Ga Al In Cu VO2+
Zr La
|
4 н. - рН=4 (HClO4
i H2SO4) 0,5 - 6 н.
HCl
0,1 - 3 н.
HCl
i HNO3 рН = 3-4 рН = 3,5-5 рН = 3,5-5 рН = 2-3,5 рН =
3-4 0,5 - 1 н. HCl рН = 4,5-5
|
620 620 600 630 630 640 620 600 620 640
|
80 80 60 90 90 100 80 50 80 100
|
86 53 45 55 51 49 43 42 50 3,5
|
Торон І
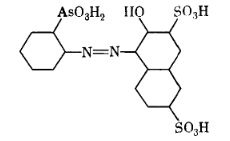
Мал. 14. Торон І.
Серед реагентів на основі Р-солі
найбільш відомий синтезований В.І. Кузнецовим торон І - цінний фотометричний
реагент на торій (мал. 14).
За чутливістю кольорових реакцій
реагенти групи торон дещо поступаються реагентам групи арсеназо. Однак
внаслідок деякого упрощення функціонально-аналітичного угрупування і можливості
проводити визначення в більш кислих середовищах число елементів, що взаємодіють
з тороном І, обмежено, тобто торон І - більш вибірковий реагент, ніж арсеназо
І.
Найбільше застосування торон І
знайшов при визначенні Th. Достатньо зручні умови визначення (кисле середовище,
рН = 0,7-1,2) забезпечує хорошу відтворюваність і вибірковість методу.
Визначенню торію не заважають більш як 100-1000-кратні кількості рідкоземельних
та інших елементів. Із тороном І описані також методи фотометричного визначення
Pu, Np, U, Zr, Be, Li і методи комплексонометричного визначення Th, U, Bi, F-,
SO42-.
В деяких випадках застосування
торону І виявляється корисним при екстракційно-фотометричному визначенні різних
елементів, а також їх розділення. Це пояснюється відносно хорошим
екстрагуванням реагенту і його комплексів з елементами вищими спиртами у
вигляді дифенілгуанідинових солей.
Торон ІІ
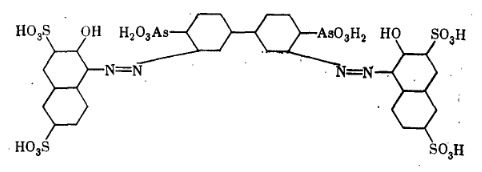
Мал. 15. Торон ІІ.
Представляє інтерес подвоєний аналог
торона І - торон ІІ (мал. 15). Особливість торона ІІ - його властивість
утворювати з елементами стійкі комплексні сполуки, які не розпадаються навіть у
сильнокислих розчинах. Реагент застосовується для визначення Th, Zr і деяких
рідкоземельних елементів.
Принцип подвоєння молекул реагентів
або функціонально-аналітичних груп в одній молекулі для покращення аналітичних
характеристик реагентів неодноразово використовувався в аналітичній практиці.
Видно, тут варто розрізняти два крайніх випадки, які визначають механізм
відповідного аналітичного ефекту.
Перший випадок - два залишки
реагенту, що входять до складу подвоєного реагенту, або два аналітичних центра
знаходяться в різних спряжених системах, не взаємодіючих або слабо взаємодіючих
між собою. Вплив одного залишку реагенту на інший приводить до зміщення
максимуму спектру мало що на 10 - 15 нм. Торон ІІ відноситься до подвійних
реагентів такого типу. Обидві половини симетричної молекули торона ІІ в
реакціях комплексоутворення діють як самостійні молекули відповідних
моноазосполук.
Другий випадок - подвоєння
функціональної групи при одночасній сильній взаємодії між ними; обидві групи
входять в склад єдиної спряженої системи. Властивості отриманого реагенту, як
правило, значно відрізняються від властивостей відповідного реагенту з однією
функціональною групою [4].
дифенілкарбазид
дифенілкарбазон арсеназо торон
Список використаної літератури
1. Венгржановський В.А.
Хімічна технологія опоряджувальних матеріалів. (Хімія барвників): Навчальний
посібник. - Хмельницький: ХНУ, 2004. - 199 с.
2. Кульберг Л.М. Синтезы
органических реактивов для неорганического анализа. - М.: ГНТИХЛ, 1947. - 164
с.
3. Кульберг Л.М. Органические
реактивы в аналитической химии. - М.: ГНТИХЛ, 1950. - 262 с.
. Саввин С.Б. Органические
реагенты группы арсеназо ІІІ. - М.: "Атомиздат", 1971. - 350 с.