Биохимия иммунной системы
КУРСОВАЯ РАБОТА
на тему:
биохимия иммунной системы
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
Глава 1. ОСНОВНЫЕ ПОНЯТИЯ ОБ ИММУННОЙ СИСТЕМЕ ОРГАНИЗМА
.1 Понятие иммунитета. Неспецифический и специфический
иммунитет
.2 Органы иммунной системы
.3 Клетки и медиаторы иммунной системы
.4 Иммунный ответ как основная реакция иммунной системы
.5 Иммунопрофилактика. Вакцинация
Глава 2. ОСНОВЫ ВОЗРАСТНОЙ ИММУНОЛОГИИ
.1 Возрастные особенности иммунитета. Критические периоды
становления иммунной системы
.2 Трансплантационный иммунитет
2.3
Изменения В- и Т-клеток на основании опытов с мышами
.4
Иммунная компетентность и аутоиммунные заболевания
.5
Попытки коррекции иммунной функции.
ЗАКЛЮЧЕНИЕ
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
ПРИЛОЖЕНИЯ
ВВЕДЕНИЕ
В сложном многоклеточном организме наряду с
пищеварительной, выделительной, нервной, двигательной, гормональной,
репродуктивной и другими системами существует еще одна. Ее можно назвать
«системой самообороны организма» - иммунитет. Иммунная система - сложный
механизм, созданный природой за долгие годы эволюции человеческого организма.
Она призвана давать жесткие и молниеносные ответы на внешние угрозы. Под
влиянием плохой экологии и стрессов иммунитет человека начинается снижаться.
Поэтому человек должен знать о своем иммунитете как можно больше.
Актуальность темы. В последние годы медики отмечают
постоянный рост числа инфекционно-воспалительных заболеваний. Проблема
актуальна, заболевания склонны переходить в хронические с периодическими
рецидивами, базовая терапия малоэффективна. Повышение числа аллергических и
аутоиммунных заболеваний, злокачественных новообразований, вирусных инфекций
приводит к увеличению смертности и инвалидности. Отрицательно на здоровье
человека сказываются разные социальные, экологические и медицинские манипуляции,
и в первую очередь идет угнетение иммунной системы и возникновение вторичных
иммунодефицитов.
Иммунная система - «барьер», который создают органы для совместной защиты
организма от заболеваний.
Основные функции иммунной системы человека - уничтожение болезнетворных
организмов, инородного тела, ядовитого вещества или переродившейся клетки
самого организма.
Цель данной работы: ознакомление со структурой и основными функциями
иммунной системы организма и наблюдение влияния возрастных изменений организма на
лимфатическую систему.
Задачи работы:
) Ознакомление с литературными источниками по данной теме;
) Рассмотрение основных понятий об иммунной системе;
) Изучение особенностей строения и функций иммунной системы;
) Изучение и наблюдение влияния возрастных изменений организма на
иммунную систему.
Объектом изучения в данной работе является сама иммунная система.
Предмет изучения данной курсовой работы: биохимические основы иммунитета
и влияние возрастных факторов на функциональность иммунной системы.
Практическое значение данной работы заключается в возможности применения
рассмотренных и изученных данных в практической и клинической иммунологии.
Глава 1. ОСНОВНЫЕ ПОНЯТИЯ ОБ ИММУННОЙ СИСТЕМЕ ОРГАНИЗМА
.1 Понятие иммунитета. Неспецифический
(врожденный) и специфический (приобретенный) иммунитет
Под иммунитетом понимают способность организма
сопротивляться инфекциям. Эта способность возникает в результате присутствия
циркулирующих в крови специальных клеток - антител и лейкоцитов. Иммунитет
изначально рассматривали, как универсальную способность противостоять
инфекционным заболеваниям. Позднее под иммунитетом стали понимать совокупность
функций организма, направленных на защиту его от всего генетически чуждого. Это
могут быть не только бактерии, вирусы, паразиты, аллергены, но при определенных
условиях и собственные клетки организма, например, когда они перерождаются в
раковые или стареют, а также в процессе мутации.
Защита организма осуществляется с помощью двух систем
- неспецифического (врожденного, естественного) и специфического
(приобретенного) иммунитета (приложение А.1).
Неспецифический иммунитет - это врожденное свойство
организма противостоять отдельным негативным факторам, в том числе и некоторым
возбудителям. Выступает как первая линия защиты и как заключительная ее стадия.
Система врожденного иммунитета действует на основе воспаления и фагоцитоза. В
этом случае распознаются и удаляются инородные тела без учета их индивидуальной
специфики. Поэтому такой иммунитет называют неспецифическим. Фактором неспецифического
иммунитета могут быть бактериолизин, лизоцим, фагоцитоз - пожирание и
разрушение инородных тел макрофагами и лейкоцитами и т. д. Эта система
реагирует только на корпускулярные агенты (микроорганизмы) и на токсические
вещества, разрушающие клетки и ткани [1].
Главными клеточными компонентами неспецифического
иммунитета являются фагоциты - клетки, способные поглощать бактерии,
простейших, другие клетки и их остатки. К фагоцитам относятся лейкоциты и
макрофаги. Лейкоциты содержатся в крови, а макрофаги - в тканях. Растворимая
часть неспецифического иммунитета представлена комплексом белков [2].
Специфический
иммунитет организм приобретает в течение жизни в результате «столкновения» с
конкретными возбудителями заболеваний. Он возник в эволюции позже и означает
распознавание самых тонких различий между чужеродными агентами. Система
приобретенного иммунитета выполняет промежуточные функции специфического
распознавания и запоминания чужеродного агента и подключения мощных средств
врожденного иммунитета на заключительном этапе процесса. Для удобства такие
чужеродные молекулы назвали антигенами.
Клеточными носителями специфического иммунитета
являются лимфоциты, а растворимыми - иммуноглобулины. в своей основе они имеют
сложную молекулу, состоящую из белковой и углеводной частей. Эти клетки крови
распознают чужеродные макромолекулы и реагируют на них либо непосредственно,
либо выработкой защитных белковых молекул.
Различают активный и пассивный специфический
иммунитет. Активный может возникать после перенесения инфекционного заболевания
или введения в организм вакцины. Пассивный специфический иммунитет возникает
при передаче готовых антител от матери к плоду через плаценту или с грудным
молоком, обеспечивая в течение нескольких месяцев невосприимчивость новорожденных
к некоторым инфекционным заболеваниям. Такой иммунитет можно создать и
искусственно, вводя в организм иммунные сыворотки, содержащие антитела против
соответствующих микробов или токсинов.
Специфический иммунитет также разделяют на клеточный
(T-лимфоциты) и гуморальный (антитела, продуцируемые B-лимфоцитами).
Характерные особенности специфического иммунитета:
. Специфичность ответа реализуется через синтез
антител и формирование клонов лимфоцитов, способных взаимодействовать только с
одной из множества антигенных чужеродных детерминант.
. Индуцибельность. В условиях нормы выраженность и
функциональная активность клона лимфоцитов незначительны. Специфические
антитела либо полностью отсутствуют, либо их количество крайне мало. В то же
время контакт организма с антигеном провоцирует как усиленную продукцию
соответствующих антител, так и нарастание, и функциональное созревание
специфического клона клеток.
. Способность сохранять память о первой встрече с
антигеном [3].
1.2 Органы иммунной системы
Хотя клетки, выполняющие иммунологические функции, рассеяны по всему
организму, к иммунной системе, относятся лишь лимфоидные органы и лимфоидные
скопления, т.е. органы и структурные образования, основу которых составляют
лимфоциты. Лимфоидные органы разделяют на центральные (первичные) и
периферические (вторичные).
К центральным (первичным) органам иммунной системы человека относятся
тимус (вилочковая железа), костный мозг. В них происходит антигензависимая
дифференцировка лимфоцитов из стволовых клеток, их селекция в отношении
аутореактивности и созревание.
Тимус (вилочковая железа) представляет собой лимфоэпителиальный орган. Он
состоит из множества мелких долек, в которых различают корковый и мозговой
слои. Корковый слой заполнен лимфоцитами, на которые воздействуют «тимические
факторы», выделяемые эпителиальными клетками этого слоя. Лимфоциты коркового
слоя различны по размеру. Большие лимфоциты находятся преимущественно во
внешней зоне коры, где они продолжают пролиферировать. Во внутренней зоне коры
сосредоточено множество малых лимфоцитов, несущих Т-клеточные антигены. В
мозговом слое содержится меньшее количество, но уже зрелых Т-лимфоцитов,
покидающих вилочковую железу и включающихся в циркуляцию. В вилочковой железе
существует барьер между циркулирующей кровью и корковым слоем, аналогичный
гематоэнцефалическому барьеру, вследствие чего в контакт с антигеном вступают
только клетки мозгового слоя (приложение А.2) [4].
Костный мозг. У взрослого человека он заполняет ячейки губчатого вещества
в плоских (лопатка, кости таза и др.) и губчатых костях (грудина, позвонки и
др.), а также концевые участки трубчатых костей (кости плеча, предплечья и
др.).
Основное назначение костного мозга - продукция клеток крови и лимфоцитов.
Развитие клеточных элементов костного мозга начинается от полипотентной
стволовой кроветворной клетки (СКК), которая дает начало шести росткам
дифференцировки:
) мегакарноцитарному (образование тромбоцитов);
) эритроидному (формирование эритроцитов);
) гранулоцитарному (образование базофилов, эозинофилов, нейтрофилов);
) моноцитарно-макрофагальному (образование моноцитов);
) Т-клеточному (формирование предшественника Т-клеток);
) В-клеточному (полное формирование В-клеток).
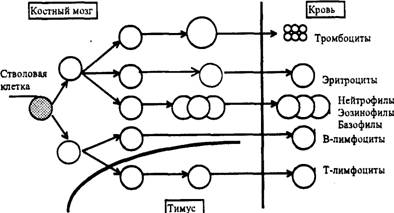
Рис. 1.1. Дифференцирование стволовой клетки костного мозга
К периферическим органам иммунной системы относятся селезенка,
лимфатические узлы, различные лимфатические узелки (ткани). В них в основном
развивается иммунный ответ.
Селезенка - крупный орган, расположенный в верней левой части брюшины.
Снаружи орган окружен соединительнотканной капсулой, от которой внутрь отходят
поддерживающие перегородки - трабекулы. Характерная черта строения селезенки:
наличие двух гистологически различающихся участков - красной и белой пульпы.
Белая пульпа - скопление лимфоцитов вокруг эксцентрично расположенного
артериального канала. Красная пульпа - место локализации эритроцитов,
макрофагов, мегакариоцитов, гранулоцитов и лимфоцитов (перемещающихся из белой
пульпы) [2]. Наибольший иммунологический интерес представляют белая пульпа и
пограничная область между белой и красной пульпой. Здесь расположены
Т-лимфоциты (вокруг артериол образуют периартериальные муфты) и В-лимфоциты
(входят в состав зародышевых центров пограничной, маргинальной зоны).

Рис. 1.2. Структура селезенки
Лимфатические узлы являются частью иммунной системы и служат своеобразным
фильтром для антигенов, т. е. любых чужеродных или потенциально опасных
веществ, переносимых лимфой. Скопление лимфатических узлов отмечается,
например, в паховой области, подмышечных впадинах, за ушной раковиной. Действие
иммунных механизмов базируется на реакциях двух типов - клеточных и
гуморальных.
Клеточные реакции обеспечивают защиту организма от внутриклеточных и
грибных инфекций, внутриклеточных паразитов и опухолевых клеток, а гуморальные
направлены, прежде всего, против внеклеточных бактерий и вирусов. В клеточных
реакциях участвуют Т-клетки, а в гуморальных - В-клетки. Кроме лимфоцитов в
иммунных реакциях участвуют вспомогательные клетки: макрофаги, моноциты.
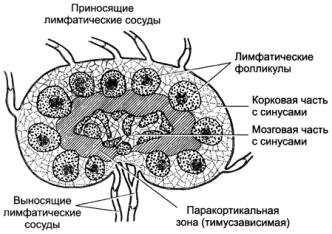
Рис. 1.3. Строение лимфатических узлов
иммунный система реакция заболевание
Лимфоидная ткань. Организм содержит значительное количество «свободной»,
не заключенной в соединительнотканную капсулу лимфоидной ткани, которая
катализируется в стенках желудочно-кишечного, респираторного и урогенитального
трактов. Ее называют лимфоидной тканью, связанной со слизистыми оболочками. Она
представлена либо в виде диффузной инфильтрации, либо в форме узелковых
скоплений, лишенных замкнутого соединительнотканного футляра. Представителями
такой лимфоидной ткани являются миндалины, пейеровы бляшки, аппендикс [5].
Миндалины (скопление лимфоидной ткани в области зева) первыми улавливают
различных возбудителей болезней, тем самым защищая организм от инфекционных
заболеваний. Лимфоциты в миндалинах находятся в фолликулах и межфолликулярном
пространстве. В миндалинах преобладают В-лимфоциты с повышенной долей клеток,
несущих мембранный IgA(приложение
А.3).
Аппендикс представляет собой почти сплошной конгломерат фолликулов,
окружающих просвет отростка.
Лимфоидные (пейеровы) бляшки представляют собой овальные узелковые
скопления лимфоидной ткани, располагающиеся в толще слизистой оболочки и
подслизистой основе тонкой кишки. Лимфоциты этих образований представлены и Т-,
и В-клетками. Кроме того в слизистой находятся фагоцитирующие клетки, которые
поглощают патогены, оказавшиеся на эпителиальной слизистой поверхности просвета
кишечника. Пейеровы бляшки обеспечивают защиту ЖКТ от возбудителей болезней
(приложение А.4) [6].
1.3 Клетки и медиаторы иммунной системы
Клетки иммунной системы. Сюда относятся около десяти
клеточных типов, различающихся происхождением, структурой и функциями.
Центральное место в иммунных механизмах отведено лимфоцитам. Однако немало
значительных функций выполняют и нелимфоидные клетки.

Рис. 1.4. Основные элементы иммунной системы
Лимфоциты. Антигенная специфичность иммунных процессов
определяется участием в них лимфоцитов, характерной особенностью которых
является присутствие на их поверхности рецепторов для распознавания антигена. В
отсутствие контакта с чужеродными субстанциями лимфоциты - это покоящиеся
клетки, их метаболическая активность минимальна. Они представляют собой
округлые клетки диаметром 7-9 мкм с круглым или бобовидным ядром и узкой
цитоплазмой, бедной цитоплазматическими гранулами. Являются почти бездействующими
носителями рецепторов для распознавания антигенов, и лишь после связывания
антигенов происходит активация лимфоцитов, приводящая к их дифференцировке в
эффекторные и регуляторные клетки иммунной системы [5]. Различают Т-лимфоциты и
В-лимфоциты.
В-лимфоциты. Каждая В-клетка генетически
запрограммирована на синтез поверхностного рецептора, специфичного к одному
определенному антигену. Встретив и распознав антиген, В-клетки размножаются и
дифференцируются в плазматические клетки, которые образуют и выделяют в
растворимой форме большие количества таких рецепторных молекул, называемых
антителами. Антитела представляют собой крупные гликопротеины и содержатся в
крови и тканевой жидкости. Благодаря своей идентичности исходным рецепторным
молекулам они взаимодействуют с тем антигеном, который первоначально
активировал В-клетки.
Т-лимфоциты. Имеется несколько субпопуляций Т-клеток с
различными функциями. Одни взаимодействуют с В-клетками, помогая их
размножению, созреванию и образованию антител. Другие взаимодействуют с
макрофагами, способствуя разрушению локализованных в них микроорганизмов. Эти
субпопуляции Т-клеток названы хелперными (Тх). Третья субпопуляция осуществляет
разрушение клеток организма, зараженных вирусами или иными патогенными
микробами - цитотоксические Т-лимфоциты (Тц). Распознавание антигена Т-клетками
происходит только, когда он презентирован на поверхности других клеток в
комплексе с молекулами МНС. В распознавании участвует специфичный к антигену
Т-клеточный рецептор (ТкР), сходный с той поверхностной молекулой Ig, которая у В-клеток служит
антигенсвязывающим рецептором. Функции воздействия на другие клетки Т-лимфоциты
осуществляют путем выделения растворимых белков - цитокинов или путем прямых
межклеточных контактов [7].

Рис. 1.5. Основные функции лимфоцитов
Нелимфоидные
клетки. Фагоциты - клетки иммунной системы, которые занимаются защитой
организма, поглощая вредные чужеродные бактерии, частицы, а также погибающие и
мертвые клетки. Процесс такого поглощения называется фагоцитозом. Фагоциты
подразделяют на «непрофессиональные» и «профессиональные» в зависимости от их
способности защищать организм. К последним относятся тучные клетки
<#"874359.files/image006.jpg">
Рис 1.6. Схема иммунного ответа
1.5 Иммунопрофилактика. Вакцинация
Иммунологические принципы реализуются в профилактике инфекционных
заболеваний и иммунозависимой патологии в форме вакцинации. Наиболее длительную
и богатую историю имеет вакцинация с целью предупреждения инфекционных
заболеваний.
Вакцинация. Принцип вакцинации основан на двух ключевых характеристиках
приобретенного иммунитета, а именно на иммунологической специфичности и
иммунной памяти. Благодаря клеткам памяти иммунная система способна гораздо
сильнее отвечать на повторную встречу с данным антигеном. Такой вторичный ответ
развивается быстрее и более эффективен, чем первичный.
Вакцинами называют препараты, предназначенные для формирования
иммунологической памяти и протективного иммунитета к антигенам возбудителей,
минуя стадию инфекционного заболевания. Вакцинацией называют способ создания
протективного иммунитета с помощью вакцин (приложение А.7) [7].
При создании вакцины необходимо так изменить сам микроб (его токсин),
чтобы они стали безвредными, но при этом не потеряли антигенности. Это
возможно, поскольку антитела и Т-клетки распознают отдельные участки антигенов,
эпитопы, а не целый микроорганизм или токсин.
Рассмотрим, например, вакцинацию против дифтерии.
Бактерия - возбудитель дифтерии образует токсин, разрушающий многие, в том
числе мышечные клетки. Этот токсин можно модифицировать путем обработки
формальдегидом так, что он, сохранив эпитопы, утратит свою токсичность;
полученный анатоксин используется как дифтерийная вакцина.
Другой подход состоит в том, что инфекционный агент
(например, вирус полиомиелита) аттенуируют (ослабляют) настолько, что он
утрачивает патогенность, сохранив антигенность.

Рис. 1.7. Принцип вакцинации дифтерийным анатоксином
Глава 2. ОСНОВЫ ВОЗРАСТНОЙ ИММУНОЛОГИИ
.1 Возрастные особенности иммунитета. Критические периоды
становления иммунной системы
В онтогенезе иммунной системы человека отчетливо
различаются несколько периодов.
Таблица 2.1.
Периоды онтогенеза иммунной системы человека
|
Период
|
Характеристика
|
Сроки
|
|
1
|
Закладка первичных органов и начальная дифференциация
клеток иммунной системы
|
6 недель - 9 месяцев (эмбрион-плод)
|
|
2
|
Совершенствование и формирование зрелой иммунной системы
|
С момента рождения до 16-18 лет
|
|
3
|
Зрелость, максимальная функциональная активность иммунной
системы
|
От 16-18 лет до 55-60 лет
|
|
4
|
Старение, снижение функций иммунной системы
|
После 55-60 лет
|
Кроме того, у детей и женщин время от времени
закономерно возникают критические состояния, которые связаны либо с первичными
морфофункциональными изменениями в иммунной системе, либо с резкой перестройкой
эндокринной и других систем целостного организма.
Внутриутробный период. С 6-8 недели развития плода
начинается закладка и дифференцировка основных органов и клеток иммунной
системы. В иммунной системе женщины в период беременности происходят
существенные физиологические изменения. Имплантация оплодотворенной яйцеклетки
в матке и развитие эмбриона недостаточно объяснена с иммунологических позиций,
т.к. в их составе присутствуют чужеродные антигены (антигены отца,
эмбриональные антигены). Но полного уничтожения сперматозоидов или блокирования
имплантации не наблюдается. Этому дают несколько объяснений.
. Факторы местной защиты слизистых женских половых
органов (секреторные IgА, лизоцим) умеренно реагируют на мужские половые
клетки.
. Факторы системной иммунореактивности - сывороточные
антитела и Т-киллеры - малоэффективны из-за относительной изолированности
женских половых путей от общего кровотока.
. В семенной жидкости мужчин содержатся вещества,
ингибирующие иммунные реакции.
Толерантность в период беременности обусловлена также:
. Трофобласт, как плацентарный барьер, изолирует
кровоток плода от кровотока матери.
. Плацента и плод синтезируют вещества, подавляющие
реакции отторжение плода.
. В организме беременной женщины происходит
перестройка цитокиновой регуляции иммунных процессов и запускается избирательная
супрессия реакции против чужеродных антигенов плода.
. Плацента ограждает плод от проникновения В- и
Т-лимфоцитов матери на ранних этапах развития эмбриона. При этом материнские
антитела класса IgG свободно проникают через плаценту. Антитела всех других классов
такой способностью не обладают.
Особенно активный трасплацентарный транспорт
материнских иммуноглобулинов происходит в конце срока беременности. Поэтому в
крови доношенных новорожденных очень высокий уровень IgG. У недоношенных
новорожденных этот показатель ниже. Вместе с тем еще на внутриутробной стадии
развития организма иммунная система реагирует на чужеродные антигены -
бактериальные, вирусные и другие - усиленным синтезом преимущественно
IgM-антител.
Второй период развития иммунной системы характеризуется
дальнейшим постепенным ее совершенствованием под воздействием разнообразных
факторов внешней и внутренней среды организма.
В иммунной системе детей, от момента рождения до
периода зрелости, закономерно происходят критические морфофункциональные
сдвиги. Эти этапные моменты в онтогенезе иммунной системы совпадают с
переходными периодами общего развития детского организма [10].
критический период - период новорожденности. Он
характеризуется:
· Слабой резистентностью к
условнопатогенной, гноеродной, грамотрицательной микрофлоре;
· Склонностью к генерализации
гнойно-воспалительных процессов, возникновению септических состояний;
· Высокой чувствительностью к вирусным
инфекциям;
критический период - 3-6-й месяцы жизни. В этот период
наиболее выражено транзиторное снижение уровня иммуноглобулинов в сыворотке
крови. Иммунный ответ носит в основном первичный характер без сохранения
иммунной памяти. Вакцинация не несет за собой формирование иммунной памяти, а
только ревакцинация.
Таблица 2.2
Возрастные особенности иммунитета во второй
критический период
|
Возрастные особенности
|
Клиническое значение
|
|
1. Созхраняется супрессивная направленность иммунных
реакций при лимфоцитозе
|
Супрессируются реакции аутоагрессии при разнообразных
антигенных перегрузках
|
|
2. Существенное снижение IgG (за счет катаболизма АТ, полученных от матери)
|
Ослабление пассивного гуморального иммунитета
|
|
3. С 3-месячного возраста повышается синтез секреторного IgA, но сохраняется недостаточность
местного иммунитета до 4 лет
|
Высокая чувствительность к респираторным вирусным
инфекциям. Начинаются рецидивирующие ОРВИ, бронхиты, пневмонии
|
|
4. Наиболее низкие уровни всех классов сывороточных
иммуноглобулинов
|
Физиологическая гипоиммуноглобулинемия
|
|
5. Низкая спос-сть к синтезу интерферона
|
Частые ОРВИ
|
|
6. На большинство АГ развивается первичный иммунный ответ с
синтезом IgM без формирования иммунной памяти
|
Атипично протекают корь, коклюш (не оставляя иммунитета).
Вирус гепатита В редко вызывает желтушную форму, чаще служит причиной
акродерматита - синдрома Джанотти
|
|
7. Фагоцитоз остается незавершенным
|
Нарушено формирование полноценного иммунного ответа
|
критический период - 2-й - 3-й год жизни. Значительное
расширение контактов ребенка обуславливает повышение частоты инфекционных
заболеваний, что приводит к декомпенсации незрелых иммунных механизмов и
манифестации аномалий иммунитета.
Таблица 2.3
Возрастные особенности иммунитета в третий критический
период
|
Возрастные особенности
|
Клиническое значение
|
|
1. Сохраняется первичный характер иммунного ответа
|
Ребенок плохо адаптируется к детским коллективам
|
|
2. Сохраняется дефицит IgG2 и IgG4
|
Сохраняется чувствительность к вирусным инфекциям, палочке
инфлюэнци. Созревает гуморальный иммунитет
|
|
3. Повышается чувствительность В-лимфоцитов к
интерлейкинам, активируется хелперная функция
|
Повышается антигенная нагрузка, проявляются фенотипические
аномалии иммунитета
|
|
4. Незрелость иммунных процессов в слизистых оболочках
|
Частые заболевания ЛОР-органов
|
критический период - 4-й - 6-й год жизни. Завершается
период становления приобретенного иммунитета. Заболевания верхних дыхательных
путей имеют склонность к хроническому или рецидивирующему течению в связи с
недостаточностью местного иммунитета у некоторых детей.
Таблица 2.4.
Возрастные особенности иммунитета в четвертый
критический период
|
Возрастные особенности
|
Клиническое значение
|
|
1. Происходит второй перекрест содержания лимфоцитов и
нейтрофилов
|
Происходит усовершенствование иммунного ответа
|
|
2. Формируется вторичный иммунный ответ на большинство АГ
|
Формируется иммунная память согласно жизненному опыту
каждого ребенка
|
|
3. Повышается иммунорегуляторный индекс
|
Уменьшается супрессивная направленность иммунной реакции
|
|
4. Уменьшается число В-лимфоцитов, уровень IgM достигает нормы взрослого
|
Увеличивается эффективность иммунного ответа
|
|
5. Концентрация секреторного IgA значительно ниже, чем у взрослых
|
Сохраняется недостаточность иммунитета слизистых (учащение
рецидивирующих заболеваний носоглотки)
|
|
6. Физиологическое повышение уровня IgE
|
Проявление иммунопатологии
|
критический период - 12-13 лет. В этот период начинают
активно функционировать половые железы, поэтому отмечаются половые различия в
иммунном статусе [11].
Таблица 2.5.
Возрастные особенности иммунитета в пятый критический
период
|
Возрастные особенности
|
Клиническое значение
|
|
1. Уменьшение массы лимфоидных органов
|
Устраняются признаки лимфатизма
|
|
2. У мальчиков - стимуляция секреции половых гормонов
(андрогенов), которые подавляют клеточный иммунитет
|
Повышается чувствительность к микобактериям туберкулеза и
др. инфекциям, от которого защищают Т-клетки. Облегчается течение
аллергических и аутоиммунных заболеваний
|
|
3. У девочек неустановившееся соотношение эстрогенов и
прогестерона приводит к снижению супрессивной функции клеточного звена
иммунитета
|
Утяжеляется течение аллергических и аутоиммунных
заболеваний
|
Период старения. С возрастом у большинства лиц после
55-60 лет наблюдается постепенное, все более глубокое угнетение иммунитета.
Скорость этого процесса имеет сугубо индивидуальный характер.
Доказано, что абсолютное количество Т- и В-клеток при
этом не снижается, однако изменяется их функциональная активность. У лиц
старческого возраста (после 80 лет) особенно страдают функции Т-системы иммунитета
(способность распознавания аллоантигенов макрофагами и лимфоцитами, угнетена
активность хелперных Т-клеток, извращена супрессорная функция иммунной
системы). Весьма вероятен дисбаланс в системе цитокиновой регуляции иммунных
реакций
В связи с разбалансировкой системы физиологической
иммунорегуляции при старении возрастает частота злокачественных образований и
аутоиммунных нарушений.
Ко всему прочему, из-за снижения активности
метаболических процессов в фагоцитах и других клетках, ответственных за функцию
неспецифической антиинфекционной реактивности, у пожилых лиц учащаются
хронические и вялотекущие бактериальные, вирусные и грибковые инфекции.
Таким образом, типичные болезни старческого возраста
непосредственно связаны с подавлением иммунореактивности вследствие глубоких
изменений в популяционной структуре Т-клеток и их функций, а также из-за
снижения активности клеток, участвующих в реализации неспецифических клеточных
и гуморальных реакций.
2.2 Трансплантационный
иммунитет
Трансплантацией называют пересадку тканей или органов,
хирургически изъятых из одного организма (донора), во внутреннюю среду другого
организма (реципиента).
Если трансплантацию делают между генетически
чужеродными организмами одного вида, то ее называют аллотрансплантацией (антигены
тканей - аллоантигенами, реакцию иммунной системы - ответом на аллоантигены);
от разных видов - ксеногенная; пересадка от самого реципиента -
аутотрансплантация.
С иммунологической точки зрения трансплантат содержит
- собственные клетки органа донора с чужим МНС I (чужеродный белок, который при
слущивании распознается дендритными клетками реципиента и рецептор, с которым
СD8 лимфоциты реципиента могут взаимодействовать как с измененным своим) и
дендритные клетки донора с чужим МНСI.
Трансплантационная реакция сочетает некоторые черты
цитотоксической и воспалительной форм клеточного иммунного ответа. Она
реализуется с участием двух видов Т-лимфоцитов.
Афферентное звено иммунного ответа на аллотрансплантат
состоит из двух параллельных путей, приводящих к активации Т-лимфоцитов.
Известен феномен «клеток-пассажиров»: для того, чтобы
аллогенный трансплантат был распознан иммунной системой хозяина, в нем должны
присутствовать клетки костномозгового происхождения, при искусственном
вымывании которых трансплантат утрачивает иммуногенность.
Т-клетки могут распознавать молекулы МНС с помощью
двух разных механизмов - прямого и непрямого, опосредованного через презентацию
аутологичными АПК.

Рис. 2.1. Виды распознавания молекул МНС
Прямое распознавание МНС-антигенов чаще реализуется
при активации второго типа Т-клеток: T-клетка непосредственно взаимодействует с
аллогенной молекулой МНС. Источником антигенного сигнала служит клетка-пассажир
- аллогенная дендритная клетка (представляет молекулу МНС класса I Т-лимфоциту
реципиента). Полагают, что в этом процессе основную роль играет распознавание
не антигенного пептида, а особенностей структуры молекулы МНС, отличающейся от
МНС хозяина[15].
Формирующиеся эффекторные Т-клетки обоих типов (Thl-клетки
и цитототоксические Т-лимфоциты) поступают в циркуляцию и в результате
экспрессии на их поверхности хемокиновых рецепторов, мигрируют в очаги
воспаления, всегда сопутствующего трансплантации, и инициируют реакции,
приводящие к отторжению ткани. Наибольшую роль в отторжении трансплантата
играют антигены МНС II класса, вызывающие преимущественно Т-клеточный
иммунитет.
Наряду с этими антигенспецифическими клетками в
трансплантат мигрируют естественные киллеры (обусловлено отсутствием на клетках
мишенях сингенных молекул МНС I), воспалительные клетки (макрофаги).
Цитотоксические клетки обоих типов осуществляют
цитолиз по перфориновому и Fas-зависимому механизмам.
Отторжение трансплантата с клинической точки зрения
бывает:
) сверхострое - на операционном столе или вскоре после
операции. При этом развивается окклюзия кровеносных сосудов, связывающих
трансплантат с телом. Это случается, если организм реципиента уже был
иммунизирован антигенами донора или антигенами, перекрестно реагирующими с
антигенами донора, и у реципиента в крови есть достаточное количество антител к
тканевым антигенам стенок сосудов или клеток крови донора. Эти антитела
немедленно «садятся» на стенки сосудов трансплантата, активируют комплемент и
систему коагуляции крови, что влечет за собой быстрый тромбоз сосудов и
отключение органа.
) острое- в течение первых месяцев после пересадки.
Это нормальный первичный иммунный ответ на трансплантат при отсутствии
медикаментозной иммуносупрессии. В деструкцию трансплантата могут быть
вовлечены все известные эффекторные механизмы иммунного воспаления.
) отсроченное - по механизмам аналогично острому, но
только в результате эффективной иммуносупрессии индукция иммунного ответа
откладывается на несколько лет.
2.3 Изменения Т- и В-клеток на основании опытов с мышами
Для изучения причин снижения иммунной функции были
использованы методы «in vivo» и «in vitro».
Метод «in vivo» включает введение суспензии клеток
селезенки мыши-донора сингенному реципиенту, чья иммунная система разрушена
облучением или иммунодепрессантами. В методе оценивается способность клеток
селезенки молодых и старых доноров формировать колониеобразующие единицы в
селезенке реципиента (рис 2.2).
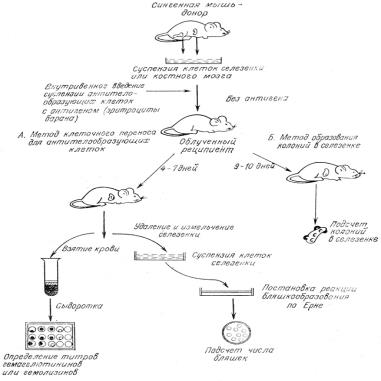
Рис. 2.2. Схема метода клеточного переноса для исследования
образования антител и стволовых клеток
При использовании другого метода in vivo клетки
селезенки мыши-донора помещают вместе с антигеном в диффузионную камеру,
которую имплантируют под кожу облученной мыши-реципиента и затем определяют у
нее титр антител. Такие исследования проводят с целью установить, вызвано ли
снижение иммунной функции изменениями окружения лимфоидных клеток или
внутренними изменениями в самих клетках.
Функцию В-клеток в период старения определяют по
уровню и скорости продукции Ig, вызванной антигеном. Уровень циркулирующих
естественных иммуноглобулинов человека снижается с возрастом вскоре после
инволюции тимуса, так же как и уровень тимозина. У грызунов в старости
снижается первичный иммунный ответ на антиген. Титр антител после введения
антигена падает с возрастом, как у мышей, так и у человека (рис. 2.3). Это
указывает на то, что функция хелперных Т-клеток или их число после инволюции
тимуса может снижаться, что в свою очередь влияет на функцию В-клеток [12].

Рис. 2.3. Снижение титров естественных антител к
флагеллину Salmonella с возрастом и увеличение частоты антиядерных факторов у
людей обоих полов
Исследования Прайса и Макинодана показывают, что для максимальной
стимуляции образования иммуноглобулина старым мышам требуется в 10 раз больше
антигена (эритроциты барана) по сравнению с молодыми. Степень реакции, т. е.
число антителообразующих клеток, у молодых мышей также больше (в 25 раз). Это
может быть обусловлено одной или несколькими следующими причинами:
а) при старении изменяется ткань селезенки и, следовательно, окружение
иммунокомпетентных клеток;
б) способность В- и Т-клеток старых животных распознавать антиген
снижается за счет внутренних изменений в самих клетках;
в) снижается абсолютное число В- и Т-лимфоцитов;
г) увеличивается число Т-супрессоров;
д) снижается функциональная активность В- и Т-клеток, чувствительных к
антигену [12].
С возрастом число В-клеток в селезенке не изменяется. Об этом
свидетельствует постоянное содержание а) клеток, несущих иммуноглобулиновые
рецепторы, б) клеток, реагирующих на Т-независимый антиген, в) клеток,
чувствительных к анти-В-реагентам. У человека число циркулирующих В-клеток, а
также скорость их пролиферации после стимуляции митогеном не меняются. Однако
не исключено, что изменениям подвержены субпопуляции В-клеток.
Число стволовых В- и Т-клеток, которые преимущественно локализованы в
костном мозгу не снижается. Стволовые клетки костного мозга делятся в течение
всей жизни. Гемопоэтическая активность стволовых клеток также не уменьшается с
возрастом. Однако нарушается нормальная скорость образования лимфоцитов и
клеток крови; это обнаруживается по уменьшению продукции В-клеток после
трансплантации костного мозга старого донора молодым тимэктомированным или
облученным сингенным реципиентам.
Функция Т-клеток оценивается по замедленной кожной чувствительности,
реакции трансплантата против хозяина, цитотоксичности, реакции на митогены и
активности лимфокинов. Некоторые авторы показали, что иммунокомпетентность
Т-клеток по реакции замедленной кожной чувствительности с возрастом снижается,
так же как и способность мышей отторгать трансплантаты тканей. Это особенно
заметно у короткоживущих мышей, склонных к аутоиммунным заболеваниям, но не
столь выражено у долгоживущих мышей.
Пролиферативная активность Т-клеток после стимуляции митогенами in vitro
у мышей всех линий с увеличением возраста ощутимо снижается. Вместе с тем их
цитотоксичность уменьшается незначительно, тогда как кооперативная или
регуляторная роль Т-хелперов в образовании иммуноглобулинов В-клетками,
особенно по отношению к чужеродным эритроцитам, снижается существенно[13].
2.4 Аутоиммунные заболевания. Рак
В
норме иммунный ответ развивается лишь на чужеродные или измененные собственные
антигены. Старение <#"874359.files/image011.gif">
На рисунке показана структура тимуса: Слева - клеточный состав и
организация различных зон тимуса, справа - стадии развития клеток и основные
процессы, приуроченные к изображенным зонам тимуса. К - капсула; Т - трабекула;
ЭК - эпителиальная клетка; Тб - бластная форма тимоцита (субкапсулярные
бласты); Тц - малый тимоцит; Мф - макрофаг; ДК - дендритная клетка; ТГ - тельце
Гассаля.
Приложение А.3
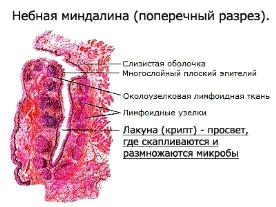
Приложение А.4

Приложение А.5

Исключительно важную роль, как в процессах активации фагоцитов, так и в
реализации их кислородзависимой бактерицидной функции играют активные формы
кислорода (АФК) и оксида азота, образующиеся в процессе кислородного или
дыхательного взрыва. Взаимодействие NADPH с молекулой кислорода при участии
NADPH-оксидазы приводит к генерации супероксид аниона (О2-), из которого с
участием ионов водорода образуются потенциально токсичные для бактерий
гидроксильные радикалы (ОН), перекись водорода (Н2О2) и синглетный кислород
(1О2). Этот процесс начинается спонтанно, после образования фагосомы и перед ее
слиянием с лизосомой. Наиболее выраженный бактерицидный эффект реализуется в
фаголизосомах. Образование Н2О2происходит спонтанно и при участии
супероксиддисмутазы. Фермент миелопероксидаза обеспечивает образование
гипохлорида из Н2О2 с участием ионов галогенов. Оксид азота (NO) образуется в
результате расщепления аргинина до цитруллина и катализируется NO-синтазой.
Продукцию АФК фагоцитарными клетками определяют методом хемилюминесценции
(ХЛ). Как известно, ХЛ-сверхслабое свечение усиливается люминофорами: люминолом
и люцигенином. Люминол позволяет идентифицировать образование перекиси водорода
и гипохлорной кислоты, люцигенин - супероксидного радикала. При взаимодействии
с АФК люминофоры переходят в возбужденное состояние и при возвращении в
исходное испускают квант света, который регистрируется хемилюминометром.
Имеются данные о корреляции между выработкой АФК и киллингом бактерий фагоцитами.
Приложение А.6


Мембранные маркеры моноцитов, макрофагов и дендритных клеток.
Мон/Мф - моноциты и макрофаги; ДК - дендритные клетки, а - одной
звездочкой помечены маркеры, свойственные только моноцитам, двумя - только
макрофагам; б - одной звездочкой помечены маркеры, свойственные только клеткам
Лангерганса, двумя - интердигитальным клеткам.
Приложение А.7
|
Тип вакцины
|
Характеристика
|
Примеры
|
|
Живые ослабленные
|
Вирулентность снижена культивированием или пассированием в
неадекватных условиях. Эффективны, но сохраняют опасность реверсии
|
Вакцины против оспы, краснухи, кори, полиомиелита (Сэбина),
герпеса, БЦЖ
|
|
Убитые
|
Патогены для вакцин убивают различными способами
(формалином и т.д.). Менее эффективны, чем живые
|
Вакцины против бешенства, тифа, холеры, полиомиелита
(Солка), коклюша
|
|
Антитоксические
|
Токсоид (инактивированный токсин) в сочетание с адъювантом
|
Вакцины против дифтерии, столбняка
|
|
Синтетические
|
Синтетический эпитоп конъюгируется с иммуногенным носителем
или адъювантом
|
Вакцины против сальмонеллёза, йерсиниоза, ящура, гриппа
|
|
Рекомбинантные
|
Основаны на использовании методов молекулярной генетики.
Выделенный ген протективного антигена вводят в безопасный вектор. Гены вирулентности
удаляют с сохранением протективных генов и т.д
|
Вакцины против гриппа, герпеса, везикупярного стоматита и
т.д.
|
|
ДНК-вакцины
|
Плазмида, содержащая ген протективного антигена, вводится в
мышцу, где экспрессируется
|
Вакцины против гепатита В
|
|
Идиотипические
|
Вместо антигена используют антиидиотипическяе антитела,
воспроизводящие конфигурацию эпитопа
|
Экспериментальные вакцины
|
|
Конъюгированные
|
Белки инфекционного агента (полученные разными методами)
конъюгируются с иммуностимулятором контролируемой структуры
|
Вакцины против гриппа
|