Сравнение методов измерения деформируемости эритроцита
МОСКОВСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИМЕНИ
М.В. ЛОМОНОСОВА
ФИЗИЧЕКИЙ
ФАКУЛЬТЕТ
КАФЕДРА
ОБЩЕЙ ФИЗИКИ И ВОЛНОВЫХ ПРОЦЕССОВ
Курсовая
работа
СРАВНЕНИЕ
МЕТОДОВ ИЗМЕРЕНИЯ ДЕФОРМИРУЕМОСТИ ЭРИТРОЦИТА
Москва,
2016 г.
Содержание
Введение
Цели и задачи
Теоретический обзор
Методы измерения деформируемости эритроцитов
Заключение
Список литературы
Введение
Кровь чрезвычайно чувствительна
к патологическим состояниям организма человека, её микрореологические свойства
меняются. Это объясняет интерес учёных к изучению клеток крови. Эта
чувствительность открывает возможность диагностирования заболеваний по
средством изучения крови человека.
Эритроцит (от греч. эритрос -
красный) - двояковогнутая дискообразная клетка крови, основной функцией которой
является перенос газов крови. Зрелый эритроцит человека имеет диаметр 7 - 8 мкм
и толщину 2,2 мкм по краям и в центре 1 мкм, объем 85-90 мкм3, площадь
поверхности 145 мкм2. Дисковидная двояковогнутая форма эритроцита увеличивает
общую поверхность клетки в 1,7 раз по сравнению с поверхностью шара такого же
объема[1]. Изображение эритроцитов представлено на рисунке 1.
Цельная кровь является
аномальной, неньютоновской жидкостью, так как её поведение в области малых
скоростей сдвига не подчиняется закону Ньютона. Вязкость крови убывает по мере
увеличения градиента скорости сдвига (от 0 до 200 с-1), а затем
становится практически неизменной, асимптотической (Рис.2).

Рис. 1. Нормальные эритроциты.
Изображение получено в электронном микроскопе (реконструкция)[1]
Рис. 2. Зависимость вязкости
крови от скорости сдвига[2]
Во время движения крови по
сосудам эритроцит постоянно находятся в деформированном состоянии, форма
эритроцитов значительно меняется. Особенно существенные изменения формы
эритроцитов наблюдаются в капиллярах, некоторые капилляры имеют диаметр около 2
и менее мкм. Прижизненная микроскопия показала, что эритроциты, движущиеся в
капилляре, подвергаются значительным деформациям, приобретая при этом
разнообразные формы. Вытянутый эритроцит располагается в капилляре вдоль его
оси, при этом вращение его мембраны прекращается, но деформация типа растяжения
возрастает. В сдвиговом потоке эритроцит испытывают два типа кинематического
поведения: вращение и стабильную ориентацию с удлинением. Нормальные эритроциты
способны значительно деформироваться, не меняя при этом своего объёма и площади
поверхности. Эта особенность движения эритроцита в потоке имеет чрезвычайно
важное значение для поддержания оптимальности процессов диффузии газов[2].
Среди известных методов
исследования деформируемости эритроцитов наибольшее распространение получили
микропипеточные, фильтрационные и дифракционные. Известны и другие методы,
получившие меньшее распространение.
Цели и задачи
Сделать обзор существующих
методов измерения деформируемости эритроцитов.
Теоретический обзор
Свойства и строение эритроцитов
Цельная человеческая кровь
состоит из плазмы и клеток крови, при этом объём плазмы составляет
приблизительно 57%, а объём клеток - 43%. Плазма крови содержит около 90% воды
и 10% белков (гемоглобин, альбумин, глобулины и т.д.). Концентрация гемоглобина
в цельной крови находится между 134 и 173 г/л. Объёмная доля клеток в цельной
крови носит название гематокрита. Клетки крови составляют 99% эритроцитов и 1%
лейкоцитов и тромбоцитов. Поскольку плазма крови содержит 10% белков, её
показатель преломления несколько выше, чем показатель преломления воды. Из
величин объёмных долей различных клеток крови и поглощающих свойств гемоглобина
становится ясно, что оптика цельной крови при нормальных физиологических
условиях определяется главным образом, свойствами эритроцитов и плазмы
крови[3]. Эритроциты поглощают синий и зелёный свет, пропускают и рассеивают
красный свет.
Деформируемость эритроцита
является одной из основных его свойств. В капилляре при вытягивании эритроцита
контур сечения его диска в поперечной плоскости уменьшается более чем в два
раза, а в продольной, наоборот, растягивается во столько же раз. В сосудистом
русле эритроциты перемещаются в плазме крови не хаотично, а в постоянном
вращательном движении, совершая вокруг своей оси до 90 об/сек в вытянутом
состоянии. Такое поведение присуще только безъядерным эритроцитам человека и
млекопитающих, которые являются уникальными клетками крови, идеально
приспособленными для максимального связывания кислорода и поступления его из
капилляров в ткани. Особенно велико значение деформируемости эритроцитов для
микроциркуляции на отдельных ее участках, когда диаметр кровеносных сосудов
меньше размеров статического эритроцита. Прохождение этих клеток через
капилляры определяется их способностью к деформации[2].
Изображение деформированного и
недеформированного эритроцитов представлено на рисунке 3.
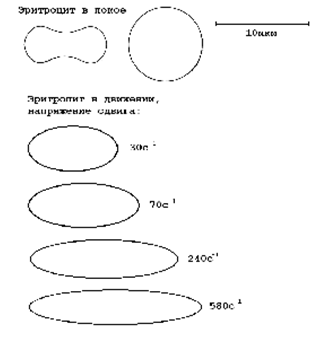
Рис. 3. Изменения дискоидной
формы эритроцитов при его деформации, возникающей при различных напряжениях
сдвига[2]
эритроцит
деформация кровь сдвиг
Многократная деформация не
наносит ущерба выполнению эритроцитами своих функций благодаря специфической
структуре мембраны. Мембрана эритроцитов представляет собой пластичную
молекулярную мозаику из белков, липо- и гликопротеинов и, возможно, чисто
липидных участков; толщина мембраны клетки - 10 нм. Клеточную стенку эритроцита
условно разделяют на четыре слоя. Наружный слой, образован гликопротеинами.
Средние два слоя клеточной стенки эритроцита образуют липидную мембрану.
Внутренний слой мембраны состоит из белков, с которыми связаны молекулы
гликолитических ферментов, гемоглобина и белков, формирующих цитоскелет.
Большая часть мембранных белков располагается на внутренней
(цитоплазматической) стороне мембраны и образует сеть филаментов (актиновых и
промежуточных) [1]. Прочность мембраны обеспечивается подмембранной сеткой из
длинных и относительно гибких нитей белков спектрина и актина (рис. 4), тогда
как содержимое цитоплазмы (раствор гемоглобина) ведет себя подобно жидкости, не
препятствуя деформациям.
С течением времени снижется
эластичность стенки эритроцита и происходят необратимые изменения. Изменяется
диаметр, на стенке могут появляться наросты и т.п. Различные деформации
эритроцитов изображены на рисунке 5.

Рис. 4. Молекулы спектрина
формируют гексагональную сетку, которая прикреплена к молекулам анкирина
(эллипсы). Волнистыми линиями условно показана тенденция к образованию
спектриновыми молекулами клубков[5]

Рис. 5. Примеры деформации
эритроцитов[4]
Методы измерения
деформируемости эритроцитов
Пропускание эритроцитарной
суспензии сквозь искусственный капилляр малого диаметра, или продавливание
заданного объема суспензии через микропористый фильтр (метод фильтруемости)
относятся к косвенным методам.
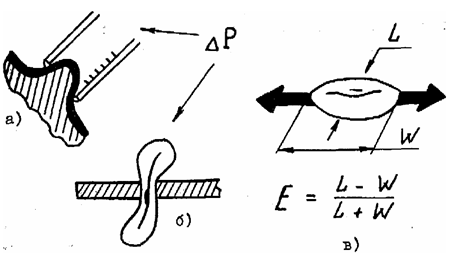
Рис. 6. Методы измерения
деформируемости эритроцитов: а) втягивание мембраны в микропипетку; б)
протискивание через микропоры; в) растяжение эритроцита в сдвиговом потоке[4]
Минимальный диаметр трубки, по
которому может проходить эритроцит человека, легко принимающий форму цилиндра,
составляет 3 мкм, а гидравлическое сопротивление при этом почти не превышает
сопротивления чистой плазмы. Регистрируемыми параметрами, определяющими
деформируемость эритроцитов, является скорость фильтрации, время полуфильтрации
и другие, называемые показателями фильтруемости. Достоинствами косвенных
методов является то, что непосредственно из измерений определяется способность
клеток "протискиваться" по капиллярам периферийной кровеносной
системы и, тем самым, оценивается способность эритроцитов снабжать ткани и
органы кислородом. Благодаря существенному упрощению измерительной аппаратуры,
косвенные методы до сих пор применяются в некоторых медицинских центрах и
исследовательских лабораториях, занимающихся проблемами реологии крови.
Недостатком этих методов является затруднённость интерпертации результатов и их
связь с деформацией конкретных клеточных структур в данных измерениях.
Наблюдается сильная зависимость от объёма клетки, её формы, распределения
эритроцитов по размерам. Кроме того, часто происходит засорение пор
слабодеформируемыми эритроцитами. Все перечисленные способы определения
деформируемости эритроцитов являются контактными, что сопряжено с риском
неконтролируемых клеточных изменений и искажения результатов.
Например, при оседании
эритроцитов на несиликонизированную стеклянную подложку возможно спонтанное
изменение формы клетки: дискоцит через некоторое время превращается в сферу с
шипиками на поверхности (сфероэхиноцит). В микропипеточном методе на входе в микропипетку
может происходить компрессия мембраны на кромке и даже проскальзывание. При
протаскивании клеток через капилляры и микропоры может происходить
трансформация формы эритроцитов. Таким образом, в перечисленных методах имеет
место нефизиологический характер силового воздействия на клетки и условий
наблюдения клеточной реакции[5].
Следующий метод так же
относится к контактным методам, однако он влияет на клетки крови куда меньше.
Атомно-силовой микроскопия (АСМ) представляет собой метод, используемый в
количественной оценке микродеформации в той или иной части биоматериала. Его
главное преимущество по сравнению с другими методами является сочетание
сканирования с высоким разрешением с наноиндентированием.
Эритроцит, прикрепленный к
предметному стеклу, помещают на платформе инвертированного светового
микроскопа. Зонд АСМ приводится в движение к образцу или от образца с помощью
пьезоэлектрического керамического позиционера. Кончик вступает в контакт с
клеткой в то время как кантилевер служит мягкой пружиной, так как силы,
действующие между наконечником и поверхностью отклоняют кантилевер. Его
отклонение может быть записано множеством способов: один из них включает в себя
оптическую систему, состоящую из лазерного диода и позиционно-чувствительного
детектора (рис.7). Система устроена таким образом, что движения кончика АСМ
порядка 0,1 нм может быть достоверно измерено. Сила (F), действующая между
атомами наконечника и атомами образцов приводит к отклонению кантилевера на
значение d в соответствии с
законом Гука:
F = k × dx,
где k
пружины кантилевера постоянная.
Степень микродеформации
определяется путем сравнения с измерением, выполняемым по отношению к твердой
поверхности, для которой значение деформации незначительно (например, защитное
стекло, слюда и т.д.)[4]. Кантилевер - устоявшееся название наиболее
распространенной в сканирующей атомно-силовой микроскопии конструкции
микромеханического зонда.

Рис. 7. Атомная силовая
микроскопия. Лазерный луч сфокусирован на кантилевере, отражаясь детектируется
светочувствительным элементом[4]
Сложная лазерная техника
включает в себя так называемые оптические пинцеты. Один экспериментальный
вариант включает в себя эритроцит с двумя микрогранулами, прикрепленными к
диаметрально противоположным концам клетки с одном из гранул, прикрепленной к
стеклу. Другой шарик в ловушке в нескольких микрометрах над поверхностью стекла
с использованием лазерного луча. Длина волны 1064 нм выбрана так, чтобы свести
к минимуму поглощение водой и гемоглобином, чтобы избежать возможного
повреждения уловленных эритроцитов при нагревании. Диэлектрические свойства
гранул и их высокий коэффициент преломления производят отклонение лазерного
луча. Свет дополнительно записывают с помощью диодов, и интенсивность
электрического тока с диодов содержит информацию о положении шарика. Оператор
перемещает стекло с гранулой, чтобы удлинить клетку. Максимальное растяжение
получается, когда гранула меняет своё прежнее положение (выходит из ловушки).
Действие повторяется при прогрессивно возрастающей мощности лазерного
излучения. Цель состоит в том, чтобы получить корреляцию между длинной и
короткой осями растянутой клетки и множеством значений силы, которая
ответственна за удлинение. Сила, однако, не может быть непосредственно измерена
и специалисты в области прикладной математики и компьютерного моделирования
калибруют линейную зависимость между мощностью лазера и силой для этой системы
по шкале от нескольких единиц до нескольких сотен пН.
Эктацитометры являются инструментами,
используемыми в реологических исследованиях и построенными на основе
инвертированного светового микроскопа. Схема эктацитометра изображена на
рисунке 8. Они используют лазерно-дифракционный анализ эритроцитов при
различных напряжениях. Основные составляющие: CCD-видеокамера,
экран и узкий канал. Так же установка включает компьютер. Диодный лазер (650
нм, 5 мВт) и CCD-камера
необходимы для получения лазерной дифракционной картины. Дифракционная картина
анализируется специальной программой и индекс удлинения определяются при
соответствующих напряжениях сдвига (0-35 Па). Длина и ширина канала выбраны
так, что потери на трение являются доминирующими потерями в системе. Перед
измерением нам известны атмосферное давление и объём вакуумной камеры, подсоединённой
к каналу.
Канал ведёт к ёмкости,
содержащей образец крови, имеющий открытый доступ к атмосферному давлению
Типовые испытания проводят следующим образом: в момент времени T = 0, вакуумная
камера и канал соединяются. Это позволяет жидкости протекать через канал в
собирающую камеру, под действием перепада давления. Когда перепад давления
исчезает, кровь перестает течь. В то время как кровь течет через канал,
лазерный луч, излучаемый диодом проходит через кровь и дифрагирует на
эритроцитах. Дифракционная картина проецируется на экран и захватывается
CCD-видеокамерой, которая связана с компьютером.
В то время как разность
давлений снижается, эритроциты постепенно изменяться от вытянутого эллипсоида
до своей нормальной формы. Индекс удлинения в качестве меры деформируемости
эритроцитов определяется по кривой на дифракционной картине с помощью
программы, определяющей эллипс. Стоит отметить, что дифракционная картина
ориентирована перпендикулярно направлению удлинения клетки. На основе геометрии
эллипсоидального рисунка дифракции, индекс удлинение рассчитывается по формуле:
EI = (L - W) / (L + W),
где L и W длина и ширина
дифракционной картины. Как правило, требуется примерно 2 минуты для разности
давлений, чтобы достичь асимптоты. Время для завершения должно варьироваться в
зависимости от типа жидкости и размеров канала. Начальное давление в вакуумной
камере было выбрано, чтобы произвести максимальное сдвиговое напряжение около
35 Па.
Если требуется увеличение до
более высокого сдвигового напряжения, начальное давление вакуума легко может
быть снижено. Существенной особенностью данного способа является использование
одноразового элемента, включающего канал. Одноразовый элемент может быть
выполнен из различных материалов, включая стекло, кремний и т.д. Использование
одноразового элемента устраняет трудоемкий процесс промывки после проведения
измерений. Однако, процесс промывки не даёт использовать эктацитометр в
клинических условиях. Текущий эктацитометр с устранением этой проблемы может
быть непосредственно использован в клинических условиях[6].

Подготовленные образцы крови
подвергаются воздействию глутаральдегида, чтобы имитировать менее деформируемые
эритроциты, при заболевании диабетом (рис. 9).

Рис. 9. Дифракционная картина
при различных сдвиговых напряжениях для четырех различных образцов крови
(разная концентрация глутаральдегида)[6]

Рис. 10. Зависимость индекса
удлинения от сдвигового напряжения для трёх конструкций эктацитометров, с
различным содержанием глутаральдегида[7]
Помимо описанной выше,
существуют и другие конструкции эктацитометров (Рис. 10).
LORCA -
Laser-assisted Optical Rotational Cell Analyzer. Суспензия
эритроцитов загружается в узкий зазор между двумя коаксиальными стеклянными
цилиндрами. Лазерный луч направляется через образец и дифракционная картина
деформированных клеток захватывается CCD-камерой
и анализируется с помощью микрокомпьютера. Значения индекса удлинения были
измерены при девяти сдвиговых напряжениях: 0.3-75 Па.SSD (Myrenne GmbH,
Roetgen, Германия) использует два параллельных, прозрачных круглых диска,
разделенных зазором 0,5 мм. Нижний диск находится в неподвижном состоянии, а
верхний вращается с восьмью различными заранее определенными скоростями для
генерации восьми уровней сдвигового напряжения. Поляризованный лазерный луч
направляется через образец, перпендикулярно дискам, геометрию дифракционной
картины на противоположной стороне исследуют с помощью четырех
светочувствительных диодов, расположенных в форме квадрата. Средняя длина и
ширина дифракционной картины определяется из интенсивностей света, записанных
диодной матрицей с использованием калибровочного коэффициента, а показатель
удлинения рассчитывается, как описано выше. Заданные скорости вращения верхнего
диска дают диапазон сдвигового напряжения 0.3-75 Па. Прибор не контролирует
температуру, но помещен в коробку с регулируемой температурой[7].
Дифракционный метод является
бесконтактным, а значит имеет наименьшее влияние на клетки крови. Кроме того,
он позволяет определить удлинение клетки с высокой точностью. Так же этот метод
определяет среднюю деформируемость для большого количества клеток.
Заключение
Технический прогресс двух
десятилетий привёл к тому, что поле гемореологии исследуется все глубже и
глубже. В моей работе были описаны свойства красных кровяных клеток крови
(эритроцитов) и различные методы измерения деформируемости эритроцитов. Каждый
метод имеет свои преимущества и недостатки, однако, дифракционный метод на мой
взгляд является наиболее оптимальным для клинических исследований.
Список литературы
1. В.
В. Мороз <http://www.reanimatology.com/index.php/rmt/search?authors=%25D0%2592.%20%25D0%2592%20%25D0%259C%25D0%25BE%25D1%2580%25D0%25BE%25D0%25B7>,
А. М. Голубев
<http://www.reanimatology.com/index.php/rmt/search?authors=%25D0%2590.%20%25D0%259C%20%25D0%2593%25D0%25BE%25D0%25BB%25D1%2583%25D0%25B1%25D0%25B5%25D0%25B2>,
А. В. Афанасьев
<http://www.reanimatology.com/index.php/rmt/search?authors=%25D0%2590.%20%25D0%2592.%20%25D0%2590%25D1%2584%25D0%25B0%25D0%25BD%25D0%25B0%25D1%2581%25D1%258C%25D0%25B5%25D0%25B2>,
А. Н. Кузовлев <http://www.reanimatology.com/index.php/rmt/search?authors=%25D0%2590.%20%25D0%259D%20%25D0%259A%25D1%2583%25D0%25B7%25D0%25BE%25D0%25B2%25D0%25BB%25D0%25B5%25D0%25B2>,
В. А. Сергунова
<http://www.reanimatology.com/index.php/rmt/search?authors=%25D0%2592.%20%25D0%2590.%20%25D0%25A1%25D0%25B5%25D1%2580%25D0%25B3%25D1%2583%25D0%25BD%25D0%25BE%25D0%25B2%25D0%25B0>,
О. Е. Гудкова
<http://www.reanimatology.com/index.php/rmt/search?authors=%25D0%259E.%20%25D0%2595.%20%25D0%2593%25D1%2583%25D0%25B4%25D0%25BA%25D0%25BE%25D0%25B2%25D0%25B0>,
А. М. Черныш
<http://www.reanimatology.com/index.php/rmt/search?authors=%25D0%2590.%20%25D0%259C.%20%25D0%25A7%25D0%25B5%25D1%2580%25D0%25BD%25D1%258B%25D1%2588>,
«Строение и функция эритроцита в норме и при критических состояниях», Общая
реаниматология, 2012 г.
. В.
В. Зинчук, «Деформируемость эритроцитов: физиологические аспекты», Успехи
физиологических наук, 2001 г.
. В.
В. Тучин, А. Н. Ярославская, А. В. Приезжев, Х. Родригез, И. В. Ярославский, Г.
Баттарби, «Оптическая биомедицинская диагностика», Физматлит, 2007 г.
4. M. Musielak, «Red blood
cell-deformability measurement: Review of techniques», Biosensors and
Bioelectronics, 2009 г.
5. Свербиль
В. П., Захаров С. Д., «Эритроциты в сдвиговом потоке: механизмы
деформируемости, методы измерений, медицинские применения»
6. Sehyun Shin, Yunhee Ku,
Myung-Su Park, Joo-Hee Jang, Jang-Soo Suh, «Rapid cell-deformability sensing
system based on slit-flow laser diffractometry with decreasing pressure
differential», Clinical Hemorheology and Microcirculation, 2004 г.
7. Oguz K. Baskurt, M.R.
Hardeman, Mehmet Uyuklu, Pinar Ulker, Melike Cengiz, Norbert Nemeth, Sehyun
Shin, Tamas Alexy and Herbert J. Meiselman, «Comparison of three commercially
available ektacytometers with different shearing geometries», 2009 г.