Т-лимфоциты. Принципы клеточного иммунитета
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
КУРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
(ГБОУ ВПО КГМУ МИНЗДРАВА РОССИЙСКОЙ ФЕДЕРАЦИИ)
Биотехнологический факультет
Кафедра биологической химии
САМОСТОЯТЕЛЬНАЯ
РАБОТА
по
дисциплине «Основы биохимии»
Т-лимфоциты.
Принципы клеточного иммунитета
Выполнил: ст-т 2 курса 1 гр. биотех.
факультет
Стёпин А.И.
Проверила: к.б.н., доцент Рагулина
В.А.
Курск - 2016
Введение
Иммунитет - невосприимчивость организма к
инфекционному началу или какому-либо инородному веществу.
Иммунитет обусловлен совокупностью всех тех
наследственно полученных и индивидуально приобретённых организмом
приспособлений, которые препятствуют проникновению и размножению микробов,
вирусов и других патогенных агентов и действию выделяемых ими продуктов.
Иммунологическая защита может быть направлена не только на патогенные агенты и
выделяемые ими продукты. Любое вещество, являющееся антигеном, например
чужеродный для организма белок, вызывает иммунологические реакции, с помощью
которых это вещество тем или иным путём удаляется из организма.
Эволюция формировала систему иммунитета около
500 млн. лет. Этот шедевр природы восхищает нас красотой гармонии и
целесообразностью. Настойчивое любопытство ученых разных специальностей
раскрыло перед нами закономерности ее функционирования и создало в последние
110 лет науку «Медицинская иммунология».
Каждый год приносит открытия в этой бурно
развивающейся области медицины.
Антигены - вещества, которые воспринимаются
организмом как чужеродные и вызывают специфический иммунный ответ. Способны
взаимодействовать с клетками иммунной системы и антителами. Попадание антигенов
в организм может привести к формированию иммунитета, иммунологической
толерантности или аллергии. Свойствами антигенов обладают белки, и другие
макромолекулы. Термин «антиген» употребляют и по отношению к бактериям,
вирусам, целым органам (при трансплантации), содержащим антиген. Определение
природы антигена используется в диагностике инфекционных болезней, при
переливании крови, пересадках органов и тканей. Антигены также применяют для
создания вакцин и сывороток.
Антитела - белки (иммуноглобулины) плазмы крови
человека и теплокровных животных, образующиеся при попадании в организм
различных антигенов и способные специфически связываться с этими антигенами.
Защищают организм от инфекционных заболеваний: взаимодействуя с
микроорганизмами, препятствуют их размножению или нейтрализуют выделяемые ими
токсины.
Все патогенные агенты и вещества антигенной
природы нарушают постоянство внутренней среды организма. При уравновешивании
этого нарушения организм использует весь комплекс своих механизмов,
направленных на поддержание постоянства внутренней среды. Иммунологические
механизмы являются частью этого комплекса. Иммунным оказывается тот организм,
механизмы которого или вообще не позволяют нарушить постоянство его внутренней
среды или позволяют быстро ликвидировать это нарушение. Таким образом,
иммунитет является состоянием невосприимчивости, обусловленным совокупностью
процессов, направленных на восстановление постоянства внутренней среды
организма, нарушенного патогенными агентами и веществами антигенной природы.
Невосприимчивость организма к инфекции может быть
обусловлена не только его иммунологической реактивностью, но и другими
механизмами. Например, кислотность желудочного сока может предохранить от
заражения через рот некоторыми бактериями, и организм с большей кислотностью
желудочного сока оказывается более защищённым от них, чем организм с меньшей
кислотностью. В тех случаях, когда защита обусловлена не иммунологическим
механизмом, говорят о резистентности организма. Не всегда можно провести чёткую
грань между иммунитетом и резистентностью. Например, изменения в устойчивости
организма к инфекции, наступающие в результате утомления или охлаждения, в
большей степени обусловлены изменением физиологических констант организма, чем
факторов иммунологической защиты. Эта грань более отчётлива в явлениях приобретённого
иммунитета, отличающихся высокой специфичностью, отсутствующей в явлениях
резистентности.
Глава 1.Иммунитет
иммунитет микробиологический регуляция клетка
1.1 Формы иммунитета
Иммунитет многообразен по своему происхождению,
проявлению, механизму и ряду других особенностей, в силу чего существует
классификация различных иммунологических явлений в виде определённых форм
иммунитета. По происхождениюразличают иммунитет естественный, врождённый, и
иммунитет приобретённый.
Естественный иммунитет - невосприимчивость,
обусловленная врождёнными биологическими особенностями, присущими данному виду
животных или человеку. Это видовой признак, передающийся по наследству, подобно
любому другому морфологическому или биологическому признаку вида. Примерами
подобной формы невосприимчивости может служить иммунитет человека к чуме собак
или многих животных к кори. Он наблюдается как у одного итого же животного ко
многим инфекционным агентам, например у рогатого скота к чуме собак, к птичьей
чуме, к гриппу, так и у разных животных к одному и тому же инфекционному агенту
(например, к гонокку иммунны все животные).
Напряжённость естественного иммунитета очень
высока. Обычно его считают абсолютным, так как в подавляющем большинстве
случаев естественный иммунитет не удаётся нарушить заражением даже громадными
количествами вполне вирулентного материала. Однако известны и многочисленные
исключения, свидетельствующие об относительности естественного иммунитета. Так,
цыплёнка удаётся заразить сибирской язвой, если искусственно понизить
температуру его тела (в норме 41- 420 ) до температуры являющейся оптимальной
для развития сибиреязвенного микроба (370 ). Можно также заразить столбняком
естественно иммунную к нему лягушку, если искусственно поднять температуру её
тела. Естественный иммунитет в некоторых случаях может быть снижен действием
ионизирующей радиации и созданием иммунологической толерантности. В некоторых
случаях отсутствие заболевания ещё не свидетельствует об отсутствии инфекции.
Учение о скрытой инфекции позволяет различить иммунитет к заболеванию и
иммунитет к микробу. В ряде случаев заболевание не возникает вследствие того,
что попавший в организм микроб в нём не размножается и погибает, в других
случаях заболевание не наступает, несмотря на то, что проникший в организм
микроб или вирус в нём размножается. Эти последние случаи, имеющие место при
скрытых инфекциях у естественно иммунных организмов,также свидетельствуют об
относительности естественного иммунитета. Естественный иммунитет присущ не
тольконевосприимчивым организмам. Восприимчивые организмы также обладают
некоторым, хотя и слабо выраженным, иммунитетом, доказательством чего является
то обстоятельство, что восприимчивый организм заболевает только при контакте с
инфекционной дозой микробов. Если же в организм попадает меньшая доза, то эти
микробы погибают, и заболевание не наступает. Следовательно, и восприимчивый
организм имеет некоторую степень естественного иммунитета. Этот «естественный
иммунитет восприимчивых» имеет большое практическое значение. Доза микробов,
меньшая инфекционной, не вызывая заболевания может обусловить появление
приобретённого иммунитета, показателем чего является образование антител.
Подобным образом и происходит постепенная повозрастная иммунизация населения к
некоторым инфекциям. Эти процессы хорошо изучены при дифтерии.
Количество отрицательных реакций Шика резко
увеличивается с возрастом, что обусловлено контактом населения с дифтерийным
микробом. Заболевания дифтерией имеют место в гораздо меньшем числе случаев, и
только небольшая часть лиц пожилого возраста (от 60 до 70 лет), имеющих в крови
антитоксин, когда-либо болела дифтерией. Без наличия известной степени
иммунитета к дифтерии у маленьких детей всякая доза дифтерийных бактерий
вызывала бы у них заболевание, и возрастной неприметной иммунизации у населения
не было бы. Подобное же положение существует при кори, которой переболевает
почти 100% всех людей. При полиомиелите наблюдается сдвиг в другую сторону:
переболевает незначительное число детей, но почти все люди уже к 20-25 годам
имеют антитела к возбудителю и, следовательно, имели с ним контакт. Таким
образом, само понятие восприимчивости, являющееся синонимом отсутствия
иммунитета, является относительным. Можно говорить о восприимчивости только к
определённым дозам инфекции. Вместе с тем это понятие - чисто физиологическое,
ибо восприимчивость обусловлена именно физиологическим аппаратом организма,
возникшим в результате эволюционного процесса.[5]
Приобретённый иммунитет вырабатывается
организмом в течение его индивидуальной жизни либо путём перенесения
соответствующего заболевания (естественно приобретённый иммунитет), либо путём
вакцинации (искусственно приобретенный иммунитет). Различают также активно и
пассивно приобретённый иммунитет. Активно приобретённый иммунитет возникает
либо естественно, при перенесении инфекции, либо искусственно, при вакцинации
живыми или мёртвыми микробами или их продуктами. И в том, и в другом случае
организм, приобретающий невосприимчивость, сам участвует в её создании и
вырабатывает ряд защитных факторов, носящих название противотел. Например,
после заболевания человека холерой его сыворотка приобретает способность
убивать холерных микробов, при иммунизации лошади дифтерийным токсином её
сыворотка приобретает способность нейтрализовать этот токсин благодаря
образованию в организме лошади антитоксина. Если сыворотку, содержащую уже
образовавшийся антитоксин, ввести животному или человеку, предварительно не
получившему токсина, таким путём можно воспроизвести пассивный иммунитет,
обусловленный антитоксином, который не был активно выработан организмом,
получившим сыворотку, но пассивно получен им вместе с введённой сывороткой.
Активно приобретённый иммунитет, особенно
естественно приобретённый, устанавливаясь через недели после заболевания или
иммунизации, в большинстве случаев держится долго - годами и десятилетиями;
иногда он остаётся на всю жизнь (например, иммунитет при кори). Однако по
наследству он не передаётся. Ряд работ, устанавливающих наследственную передачу
приобретённого иммунитета, не получил подтверждения. Вместе с тем способность
вырабатывать активный иммунитет, несомненно, является видовым признаком,
присущим организму, подобно восприимчивости или естественному иммунитету.
Пассивно приобретённый иммунитет устанавливается очень быстро, обычно через
несколько часов после введения иммунной сыворотки, но держится очень недолго и
исчезает по мере исчезновения введённых в организм антител. Это имеет место
чаще всего уже через несколько недель. Приобретённый иммунитет во всех своих
формах чаще всего является относительным и, несмотря на значительную
напряжённость, в некоторых случаях он может быть преодолён большими дозами
заражаемого материала, хотя течение инфекции будет при этом более лёгким.
Иммунитет может быть направлен либо против микробов, либо против образуемых ими
продуктов, в частности токсинов; поэтому различают антимикробный иммунитет, при
котором микроб лишён возможности развиваться в организме, убивающем его своими
защитными факторами, и антитоксический иммунитет, при котором микроб может
существовать в организме, но заболевания не наступает, так как иммунный
организм нейтрализует токсины микроба.
Особой формой приобретённого иммунитета является
так называемый инфекционный иммунитет. Эта форма иммунитета обусловлена не
перенесением инфекции, а наличием её в организме и существует только до тех
пор, пока организм инфицирован. Моргенрот (1920), наблюдавший у заражённых
стрептококками мышей подобную форму, назвал её депрессионными иммунитетом.
Мыши, заражённые небольшими дозами стрептококка, не умирали, но заболевали
хронической инфекцией; однако они оказывались устойчивыми к дополнительному
заражению смертельной дозой стрептококка, от которой умирали здоровые
контрольные мыши. Иммунитет такого же характера развивается при туберкулёзе и некоторых
других инфекциях. Инфекционный иммунитет называют также нестерильным, то есть
не освобождающим организм от инфекции, в отличие от других так называемых
стерильных форм иммунитета, при которых организм освобождается от инфекционного
начала. Однако такая стерилизация не всегда имеет место, так как и в случаях
приобретённого иммунитета, организм долгое время может быть носителем микроба
или вируса и, следовательно, быть не «стерильным» в отношении перенесённой
инфекции.[19]
Различная иммунологическая реактивность
отдельных тканей и органов организма и несоответствие во многих случаях между
наличием иммунитета и присутствием антител послужили основой для построения
теории местного иммунитета А. М. Безредки(1925). Согласно этой теории, местный
иммунитет возникает независимо от общего иммунитета и не связан с антителами.
Чувствительными к инфекции являются только определённые ткани (например, к
сибирской язве чувствительна только кожа) и поэтому их иммунизация приводит к
общему иммунитету организма. Отсюда предложение иммунизировать кожу против
кожных инфекций, кишечник против кишечных инфекций. Большой экспериментальный
материал, полученный при изучении этого вопроса, показал, что местного
иммунитета, как зависящего от всего организма явления не существует и что во
всех случаях местная иммунизация сопровождается возникновением общего
иммунитета с образованием антител. Вместе с тем было установлено, что местная
иммунизация может быть в некоторых случаях целесообразной благодаря
особенностям иммунологической реакции тех или других тканей.[6]
1.2 Органы иммунитета
К органам иммунитета относится комплекс
взаимосвязанных органов: вилочковая железа (тимус), костный мозг, лимфатические
узлы, лимфоидная ткань селезенки, кишечника, соединительная ткань, а также система
кровеносных и лимфатических сосудов. Функциональное значение этого
лимфо-миелоидного комплекса - обеспечение кроветворения, т.е. размножение,
развитие и созревание клеток крови в организме человека в результате
последовательных изменений. Это многостадийный процесс специализации клеток.
В миелоидной ткани костного мозга образуются
эритроциты, гранулоциты, тромбоциты. Формирование клеток иммунной системы
происходит в лимфоидной ткани. Т-лимфоциты образуются в вилочковой железе,
В-лимфоциты - в красном костном мозге. Лимфоциты также образуются в селезенке,
лимфатических узлах, лимфоидных фолликулах, по ходу пищеварительного и
дыхательного трактов.
Вилочковая железа (тимус) - центральный орган
иммунной системы. Она расположена в верхней части грудной клетки за грудиной.
Этот орган состоит из двух больших долей, каждая из которых включает в себя
более мелкие дольки. Каждая долька состоит из коркового и мозгового вещества. В
корковом веществе происходит образование Т-лимфоцитов, которые затем мигрируют
в мозговое вещество, а потом переносятся в периферические лимфоидные органы -
лимфатические узлы, селезенку.
Костный мозг заполняет полости костей у
позвоночных. Различают красный костный мозг, в котором преобладает миелоидная
ткань. Она является основным органом кроветворения и сохраняется в течение
жизни в ребрах, грудине, в костях черепа, таза, позвонках. С возрастом красный
костный мозг заменяется желтым. В состав красного мозга входят стволовые
кроветворные клетки, а основу его составляет ретикулярная ткань.
Лимфатический узел представляет собой
образование, расположенное обычно в месте слияния крупных лимфатических
сосудов. Лимфоидная ткань делится на корковый и мозговой слои. В корковом слое
находятся фолликулы, в части которых образуются зародышевые центры,
образующиеся в ответ на проникновение в орган антигена.
Селезенка расположена в брюшной полости. Этот
орган выполняет функцию кроветворения, участвуя в защитных реакциях организма.
Селезенка является депо крови. Она относится к периферическим органам иммунной
системы. Снаружи она покрыта соединительной тканью, а внутри делится
перегородками. В теле селезенки различают белую (место локализации лимфоцитов)
и красную (состоит из ретикуло - капиллярных петель, пространство между
которыми заполнено кровью, где преобладают эритроциты) пульпу. Белая пульпа
заполнена Т - и В-лимфоцитами, проникающими сюда из центральных органов
иммунной системы. Лимфоидная ткань селезенки участвует в лимфоидных реакциях
гуморального типа[7]
1.3 Механизмы
иммунитета
Механизмы иммунитета схематически можно
разделить на следующие группы: кожные и слизистые барьеры; воспаление,
фагоцитоз, ретикуло-эндотелиальная система; барьерная функция лимфатической
ткани; гуморальные факторы; реактивность клеток организма.
Кожные и слизистые барьеры. Кожа непроходима для
большинства бактерий. Все воздействия, способствующие повышению проницаемости
кожи, понижают её устойчивость к инфекции, а все воздействия, понижающие её
проницаемость, действуют в обратном направлении. Однако кожа является не только
механическим барьером для микробов. Она обладает также стерилизующими
свойствами, и микробы, попавшие на кожу, быстро погибают. Арнольд (1930) и
другие учёные наблюдали, что чудесная палочка, помещённая на здоровую кожу
человека, исчезает настолько быстро, что через 10 минут может быть обнаружено
только 10%, а через 20 минут - 1% всего помещённого на кожу количества
бактерий; через 30 минут чудесную палочку уже вообще нельзя было обнаружить.
Кишечная и брюшнотифозная палочки исчезали через 10 минут. Установлено, что
бактерицидное действие кожи связано со степенью её чистоты. Стерилизующее
действие кожи обнаруживается лишь в отношении тех видов микробов, которые
приходят с ней в соприкосновение сравнительно редко или вовсе с ней не
встречаются. Оно ничтожно в отношении микробов, являющихся частыми обитателями
кожи, например жёлтого стафилококка. Есть основания полагать, что бактерицидные
свойства кожи главным образом обусловлены содержанием в отделяемом потовых и
сальных желез молочной и жирных кислот. Было показано, что эфирные алкогольные
экстракты кожи, содержащие жирные кислоты и мыла, обладают заметным
бактерицидным действием в отношении стрептококка, палочек дифтерии и кишечных
бактерий, в то время как солевые лишены или почти лишены этого свойства.[19]
Слизистые оболочки также являются защитным
барьером организма в отношении микробов, причём эта защита обусловлена не
только механическими функциями. Высокая кислотность желудочного сока, а также
наличие в нём слюны, обладающей бактерицидными свойствами, препятствуют
размножению бактерий. Слизистая оболочка кишечника, содержащего громадное
количество бактерий, обладает резко выраженными бактерицидными свойствами.
Бактерицидное действие отделяемого слизистых оболочек связано также с наличием
в этом отделяемом особого вещества - лизоцима. Лизоцим содержится в слезах,
мокроте, слюне, плазме и сыворотке крови, лейкоцитах, в курином белке, в икре
рыб. В наибольшей концентрации лизоцим найден в слезах и хрящах. Лизоцим не был
обнаружен в спинномозговой жидкости, в мозгу, кале и поте. Лизоцим растворяет
не только живых, но и мёртвых микробов. Кроме сапрофитов, он действует и на
некоторых патогенных микробов (гонококк, сибиреязвенную бациллу), несколько
подавляя их рост и вызывая частичное растворение. Лизоцим не оказывает
какого-либо действия на изученные в этом отношении вирусы. Наиболее
показательной является роль лизоцима в иммунитете роговицы, а также полостей
рта, глотки и носа. Роговица - ткань, крайне чувствительная к инфекции,
непосредственно соприкасается с громадным количеством микробов воздуха, в том
числе и с такими, которые могут вызвать в ней нагноения (стафилококки,
пневмококки). Однако эти заболевания роговицы сравнительно редки, что можно
объяснить высокой бактерицидностью слёз, постоянно омывающих роговицу, и
содержанием в них лизоцима. Благодаря высокому содержанию лизоцима в слюне
необычно быстро заживают всякие раны во рту. Если бы такая же раневая
поверхность, какая возникает, например, при экстракции зуба, была в какой-либо
другой области организма, заражение было бы не минуемо. Однако во рту, несмотря
на наличие в нём громадного количества микробов, этого не происходит.
Бактерицидность слюны делает понятным распространённый у всех животных инстинкт
вылизывания языком. Таким вылизыванием достигается не только механическое
удаление инфекта, но и внесение в рану бактерицидного агента. При этом к
внесённым в рану микробам из полости рта животные оказываются менее
восприимчивыми, чем к постороннему инфекту. Физиологическая функция лизоцима до
сих пор остаётся не изученной.
Защитная роль кожи и слизистых оболочек
обн6аруживается при изучении сравнительной летальности восприимчивых животных,
заражённых через кожу или слизистые оболочки и минуя этот барьер. Кроме
лизоцима в тканях и жидкостях обнаружены и другие бактерицидные вещества.[5]
Бактерицидные свойства молока были подробно
изучены Уилсоном и Розенблюмом (1952). Особый фактор, названный лактенином,
бактерицидный в отношении гемолитического стрептококка, был найден в молоке
людей, коров и овец. Лактенин сохраняется при пастеризации, но разрушается при
t0 800 и выше.[7]
Все эти малоисследованные вещества (Лактенин,
полипептид и др.) не являются бактерицидными в прямом смысле этого слова,
убивающими бактерийную клетку путём деструкции её протоплазмы. Они подавляют
размножение микробов, по-видимому, воздействуя на их обмен, подобно
антибиотикам.
В некоторых случаях наличие в тканях тех или
других элементов, образующихся в процессе обмена веществ, может препятствовать
размножению некоторых микробов или способствовать ему. Известно, например, что
незначительные концентрации железа создают оптимальные условия для продукции
токсина некоторыми штаммами дифтерийных микробов и что содержание железа в
дифтерийных плёнках у человека может быть значительно меньше этого оптимума.
Поэтому только немногие штаммы могут вызывать тяжёлое заболевание у человека
при наличии соответствующей концентрации железа. [6]
1.4 Регуляция
иммунитета
Интенсивность иммунного ответа во многом
определяется состоянием нервной и эндокринной систем. Установлено, что
раздражение различных подкорковых структур (таламус, гипоталамус, серый бугор)
может сопровождаться как усилением, так и торможением иммунной реакции на
введение антигенов. Показано, что возбуждение симпатического отдела автономной
(вегетативной) нервной системы, как и введение адреналина, усиливает фагоцитоз
и интенсивность иммунного ответа. Повышение тонуса парасимпатического отдела
вегетативной нервной системы приводит к противоположным реакциям.[3]
Стресс, а также депрессии угнетают иммунитет,
что сопровождается не только повышенной восприимчивостью к различным
заболеваниям, но и создает благоприятные условия для развития злокачественных
новообразований.
За последние годы установлено, что гипофиз и
эпифиз с помощью особых пептидных биорегуляторов, получивших наименование
«цитомедины», контролируют деятельность тимуса. Передняя доля гипофиза является
регулятором преимущественно клеточного, а задняя - гуморального иммунитета.[5]
1.5 Иммунная
регуляторная система
В последнее время высказано предположение, что
существует не две системы регуляции (нервная и гуморальная), а три (нервная,
гуморальная и иммунная). Иммунокомпетентные клетки способны вмешиваться в
морфогенез, а также регулировать течение физиологических функций. Особенно
важная роль в регуляции физиологических функций принадлежит интерлейкинам,
которые являются «семьей молекул на все случаи жизни», так как вмешиваются во
все физиологические процессы, протекающие в организме.
Иммунная система является регулятором гомеостаза.
Эта функция осуществляется за счет выработки аутоантител, связывающих активные
ферменты, факторы свертывания крови и избыток гормонов.[3]
Иммунологическая реакция, с одной стороны,
является неотъемлемой частью гуморальной, так как большинство физиологических и
биохимических процессов осуществляется при непосредственном участии гуморальных
посредников. Однако нередко иммунологическая реакция носит прицельный характер
и тем самым напоминает нервную. Лимфоциты и моноциты, а также другие клетки,
принимающие участие в иммунном ответе, отдают гуморальный посредник
непосредственно органу-мишени. Отсюда предложение назвать иммунологическую
регуляцию клеточно-гуморальной. Учет регуляторных функций иммунной системы
позволяет врачам различных специальностей по-новому подойти к решению многих
проблем клинической медицины.[18]
Барьерная функция лимфатической ткани. Микроб,
проникший через кожные и слизистые барьеры. В подавляющем большинстве случаев
попадает в лимфатические узлы. Гемолитический стрептококк, введённый в
лимфатический сосуд, ведущий к лимфатическому узлу, в значительном количестве
задерживается в этом узле и почти не обнаруживается в отходящем сосуде.
Аналогичные результаты были получены в опытах с многими другими микробами при
введении их под кожу, в лёгкие и в кишечник. Но при введении бактерий в полость
брюшины наблюдалось очень быстрое появление их в токе крови. Наблюдения над
распространением в организме бактерий, введённых под кожу, показывают, что
лимфатические узлы являются барьером, препятствующим проникновению бактерий в
организм. Барьерная функция лимфатических узлов возрастает при иммунизации.
Этот вопрос был подробно изучен В.М.Берманом (1948) и другими исследователями.
Они установили, что при заражении экспериментальных животных брюшным тифом,
дизентерией, туберкулёзом, бруцеллезом и холерой лимфатические узлы, эндотелий
сосудов и клетки ретикуло-эндотелиальной системы обладают в иммунном организме
резко выраженной способностью препятствовать проникновению бактерий в организм.
Способность лимфатической ткани препятствовать проникновению микробов внутрь
организма называют барьер-фиксирующей функцией. Некоторые бактерии, которые
задерживаются лимфатическими узлами, размножаются в них. Так, наблюдения
Х.Х.Планельса (1950) показали, что брюшнотифозные микробы энергично
размножаются в лимфатических узлах, проникая в лимфоциты и образуя колонии в их
ядрах. Барьерная функция лимфатических узлов в известной степени связана с
воспалительным процессом, вызываемым проникшими бактериями.[5]
Иммунологическая реактивность - способность
организма отвечать на антигенное размножение - изменяется под влиянием
различных факторов, а также с возрастом. Новорожденные животные обладают резко
пониженной иммунологической реактивностью, чем объясняется их повышенная восприимчивость
ко многим инфекциям. Изменения реактивности организма, наступающие с возрастом
в отношении способности образовывать антитела, были отмечены ещё
И.И.Мечниковым.
В 1897 году он наблюдал, что взрослые крокодилы
вырабатывали тетанический антитоксин в значительно большей концентрации, чем
молодые. В последующем многие авторы наблюдали отсутствие антител или резкое
снижение их образования у новорожденных животных и повышение этой способности у
взрослых особей. Так, например, у кроликов с возрастом наблюдается усиление
продукции антител в отношении многих антигенов (к лошадиной сыворотке, бараньим
эритроцитам, тифозной вакцине).[6]
Более выраженная способность у взрослых животных
к иммунизации была показана также в опытахна крысах с трипаносомами, на мышах с
вирусами энцефаломиелита и бешенства и в других аналогичных случаях. Вместе с
тем отмечалось, что способность продуцировать антитела у старых кроликов
выражена в меньшей степени, чем у кроликов среднего возраста. Способность к
фагоцитозу также резко снижена у новорожденных. По-видимому, во всех этих
случаях имеет место первичная пониженная реактивность, связанная с биохимизмом
клеток новорожденных. Ещё резко более выраженная пониженная реактивность имеет
место в эмбриональной жизни. У развивающегося куриного эмбриона антитела или
совсем не образуются или образуются в незначительном титре. Вместе с этим в
эмбрионах размножаются многие инфекционные агенты, к которым не восприимчивы
взрослые животные. Это размножение настолько интенсивно, что куриные эмбрионы
широко используются для получения культур вирусов. В куриных эмбрионах
размножаются и многочисленные бактерии. В последнее время накопились
экспериментальные материалы, указывающие на наличие в эмбриональной жизни
особой иммунологической реактивности.[3]
Глава 2.Т-ЛИМФОЦИТЫ.
Принципы клеточного иммунитета
.1 Т-лимфоциты
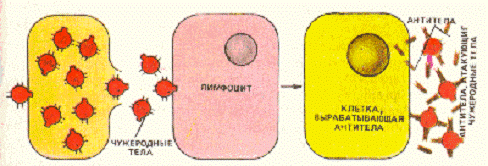
Ответ на структуру чужеродного вещества,
антиген, осуществляемый клетками иммунной системы, лимфоцитами бывает
различного типа.За клеточный иммунитет ответственны Т - лимфоциты (Т - клетки).
Эти иммунные клетки названы так из-за тимуса, в котором они подвергаются
основным стадиям своей дифференциации (школа Т-клеток). Активность Т-клеток
направлена против зараженной вирусом клетки организма, а также на защиту от
грибов и паразитов. Т-Клетки принимают активное участие в процессе отторжения
чужеродной ткани и помогают в формировании гуморального иммунного ответа. По
своей функции они делятся на цитотоксические Т-клетки - Т-киллеры (на схеме
зеленого цвета) и клетки-помощники - Т-хелперы (на схеме голубого цвета).В свою
очередь гуморальный иммунный ответ направлен на активацию В-лимфоцитов
(В-клетки, на схеме светло-коричневый цвет), которые созревают в костном мозге
в отличие от Т-клеток тимуса. В-Клетки несут на своей поверхности антитела) и
выделяют их в плазму. Антитела обладают способностью специфически связывать
соответствующие антигены. Связывание антител с антигенами - решающее звено в
системе защиты организма от внеклеточных вирусов и бактерий. В результате
такого связывания последние опознаются как инородные тела и в дальнейшем
уничтожаются.
"Память" иммунной системы представлена
так называемыми "клетками памяти". Эти наиболее долгоживущие клетки
существуют для каждого типа иммунных клеток.[12]
Проникший в организм вирус эндоцитируется
макрофагами и затем частично разрушается в эндоплазматическом ретикулуме. В
результате образуются чужеродные фрагменты, которые экспонируются на клеточной
поверхности макрофагов. Эти фрагменты «презентируются» специальной группой
мембранных белков. Комплекс из вирусного фрагмента и белка главного комплекса
гистосовместимости [ГКГС (МНС)] распознается и связывается Т-клетками с помощью
специфических (Т-клеточных) рецепторов. Среди огромного числа Т-клеток только
немногие обладают подходящим рецептором. Связывание приводит к активации этих
Т-клеток и появлению их селективных копий. В активации Т-клеток участвуют
различные гормоноподобные сигнальные белки, интерлейкины. Эти белки
секретируются теми клетками иммунной системы, которые активируются при связывании
с Т-клетками. Так, активированные макрофаги с презентируемым вирусным
фрагментом секретируют IL-1, а Т-клетки продуцируют IL-2, который стимулирует
их собственное клональное копирование и репликацию Т-хелперных клеток.
Клонированные и активированные Т-клетки
осуществляют различные функции в зависимости от их типа. Цитотоксические
Т-клетки способны узнавать и связывать те клетки организма, которые
инфицированы вирусами и на своих рецепторах ГКГС несут фрагменты вируса.
Цитотоксические Т-клетки секретируют перфорин - белок, который делает
проницаемой мембрану связанной инфицированной клетки, что и приводит к ее
лизису.
Т-Хелперы, напротив, связываются с В-клетками,
которые презентируют на своей поверхности фрагменты вируса, связанные с белком
ГКГС. Это ведет к селективному клонированию индивидуальных В-клеток и их
массированной пролиферации, интерлейкин стимулирует созревание В-клеток -
превращение в плазматические клетки, способные синтезировать и секретировать
антитела. [15]
2.2 Развитие,
дифференцировка
Важную роль в их развитии играет тимус.
Дифференцировка Т-лимфоцитов начинается уже в период эмбрионального развития. В
вилочковой железе создается особое микроокружение за счет тимического эпителия,
влияющее на дифференцировку Т-лимфоцитов.
Процесс пролиферации лимфоцитов в вилочковой
железе протекает очень интенсивно, но не все клетки мигрируют из вилочковой
железы в виде Т-лимфоцитов: большинство из них там же погибает. Полагают, что
причиной их гибели служит присоединение антигена к антигенспецифическому
рецептору этих клеток. В вилочковой железе нет чужеродных антигенов, вот почему
этот механизм может служить для удаления Т-лимфоцитов, способных реагировать с
аутоструктурами организма, т.е. защищать его от аутоиммунных реакций.
Специфическое взаимодействие с антигеном служит началом процесса
дифференцировки в зрелые и долгоживущие клетки, составляющие большую часть
рециркулирующих Т-лимфоцитов.
Т-лимфоцит, аналогично В-лимфоциту, несет на
своей поверхности специфические рецепторы для распознавания антигенов.
Структурная основа процесса узнавания антигена до сих пор неизвестна.[13]
У всех иммунокомпетентных Т-лимфоцитов
антигенный рецептор нековалентно, но достаточно прочно связан в комплекс с
молекулой Т3, состоящей из пяти пептидных цепей, которая участвует в передаче
сигнала от узнающего антиген гетеродимера внутрь клетки. Таким образом,
рецептор Т-лимфоцитов представляет собой комплекс, образованный гетеродимером и
Т3 (или СД3). [16]
2.3 Субпопуляции
Т-лимфоцитов, их функции
Периферические Т-клетки подразделяются на
различные субпопуляции, значительный прогресс изучения которых произошел с
помощью техники моноклональных антител.
Т-хелперы (помощники, индукторы) -
запрограммированы индуцировать размножение и (или) дифференцировку клеток
других типов. Например, они индуцируют секрецию антител В-лимфоцитами и
стимулируют моноциты, тучные клетки и предшественники Т-киллеров к участию в
клеточных иммунных реакциях. Т-хелперы активируют эффекторные, а Т-индукторы -
регуляторные клетки, хотя различие между ними оказывается искусственным. Эта
субпопуляция активируется антигенами, ассоциируемыми с продуктами генов МНС
класса II - молекулами класса II, представленными преимущественно на
поверхности В-клеток и макрофагов.
Существует как минимум три класса Т-хелперов:
. Т-хелперы, узнающие МНС. Они обладают
специфичностью к антигену, презентированному в комплексе со своими молекулами
МНС класса II. Эти клетки пролиферируют в ответ на комплекс
"антиген+молекулы МНС класса II", а также индуцируют пролиферацию
В-клеток, связавших данный антиген и имеющих на своей поверхности молекулы МНС
II класса, а также дифференцировку этих В-клеток до антителообразующих клеток;
. Т-хелперы, узнающие иммуноглобулины. Некоторые
Т-хелперы обладают специфичностью как к антигенам, так и к собственным
идиотипическим детерминантам. Они активируют В-клетки, имеющие такие же
идиотипические детерминанты. Эти же Т-клетки узнают собственные идиотипы в
комплексе со своими молекулами МНС класса II и, возможно, могут активировать
В-клетки в отсутствие антигена и других Т-клеток. Физиологическая роль этих
клеток точно неизвестна;
. Т-хелперы, секретирующие лимфокины. Часть
Т-клеток осуществляет свою "хелперную" функцию через освобождение
"дальнодействующих" факторов - ИЛ-2 и фактора, замещающего Т-клетки.
Эти факторы называются лимфокинами. Они активируют или способствуют активации
других Т- или В-клеток, узнавая антиген в комплексе с собственными белками МНС
класса II. Эти же клетки могут индуцировать реакции гиперчувствительности
замедленного типа.[14]
2.4 Т-индукторы
супрессии - Т-клетки, индуцирующие превращение других Т-клеток в Т-супрессоры
Супрессорные Т-клетки. Клетки генетически
запрограммированные для супрессорной активности, отвечают преимущественно на
продукты генов МНС класса I. В настоящее время описано большое количество
супрессорных Т-клеток, имеющих отличительные особенности:
Супрессорные эффекторные Т-клетки связывают
антиген и секретируют факторы, инактивирующие Т-хелперы;(supressor T cells) -
это антигенсвязывающий, несущий идиотип эффекторный Т-супрессор, вызывающий
супрессию реакций ГЗТ;
Т-супрессоры, узнающие молекулы (продукту) МНС
класса II и предотвращающие пролиферацию клеток в ответ на антиген или
супрессирующий секрецию антител антигенсвязывающими В-клетками;
Т-супрессоры, узнающие идиотип и связывающиеся с
ним и тем самым супрессирующие секрецию антител В-клетками, несущие
соответствующие антигенные детерминанты.
Цитотоксические Т-клетки или Т-киллеры. Они
узнают антиген в комплексе с собственными МНС-молекулами класса I. Описаны
также Т-киллеры, специфические к МНС-молекулам класса II. Они секретируют
цитотоксические лимфокины.
Контрсупрессорные Т-клетки. Они предотвращают
инактивацию Т-хелперов и Т-индукторов супрессорными эффекторными Т-клетками. Об
этих клетках известно немного: они специфичны по отношению к антигену и играют
важную роль в развитию иммунологической памяти при активной супрессии.
В целом, сейчас выделяют уже более 10 типов
Т-клеток, а в будущем предстоит обнаружить еще большее их разнообразие. Однако
в любом случае следует помнить о том, что у различных классов Т-клеток антиген
узнают разные рецепторные молекулы. Используя современные методы
биохимического, серологического и молекулярно-генетического анализа
клонированных популяций Т-клеток, можно выявить различия между этими
рецепторными молекулами.[17]
2.5 Т-клеточный рецептор
Несмотря на то, что Т- и В-клетки довольно легко
идентифицировать по поверхностным маркерам (Т3 или CD3 на Т-клетках и
поверхностные Ig на В-клетках), следует иметь также представление о наиболее
важных дифференцировочных антигенах Т-лимфоцитов человека. Важнейшими из них
являются:
. CD2 (от англ. Claster of differentiation -
кластер дифференцировки) - это антиген, обнаруживаемый на всех зрелых
периферических Т-лимфоцитах (идентичен "рецептору эритроцитов
барана", именно он обеспечивает образование розеток с эритроцитами барана
- методика выявления Т-клеток). CD2 принимает участие в процессе
неспецифической активации Т-клеток, что играет важную роль при созревании
клеток в тимусе, т.к. пролиферация тимоцитов индуцируется до начала экспрессии
специфического антигенного процесса.
. CD3 - это мембраносвязанный белковый комплекс,
состоящий из пяти гликопротеинов, связанный с антигенспецифическим рецептором
(Ti). Этот комплекс "CD3+Ti" и представляет собой
антигенспецифический Т-клеточный рецептор периферических Т-лимфоцитов человека.
Связывание антигена, ассоциированного с детерминантами МНС, является
специфическим сигналом для активации зрелой Т-клетки. При этом CD3 участвует в
передаче сигнала внутрь клетки. Непосредственным результатом связывания антигена
с рецептором является поступление в клетку ионов Са2+.
. CD4 - антиген гликопротеиновой природы,
который экспрессирует примерно на 2/3 периферических Т-лимфоцитов. На этапе
созревания клеток в тимусе CD4 экспрессируется всеми клетками, а в ходе их дифференцировки
сохраняется только на субпопуляции, переставшей экспрессировать CD8-антиген. В
периферической крови примерно 5% клеток несут одновременно маркеры CD4 и CD8.
Зрелые CD4+-Т-клетки включают Т-лимфоциты, функционально характеризуемые как
хелперы и индукторы. При контакте Т-лимфоцитов (Ti/h - индукторов хелперов) с
антигенпрезентирующей клеткой CD4 выступает в роли специфического места
связывания детерминант белковых молекул МНС класса II. Особое значение имеет
факт связывание молекулой CD4 оболочечных белков вируса иммунодефицита человека
- возбудителя СПИД, что в результате эндоцитоза приводит к проникновению вируса
внутрь клеток субпопуляции Ti/h.
. CD8 - антиген, который экспрессируется
примерно на 1/3 периферических Т-клеток, созревающих из CD4+/CD8+-Т-лимфоцитов.
Субпопуляция CD8+-Т-клеток включает цитотоксические и супрессорные Т-лимфоциты.
При контакте с клеткой-мишенью CD8 выступает в роли рецептора неполиморфных
детерминант белков МНС класса I.
. Антиген CD45R присутствует примерно на 50% Т-клеток
(он экспрессируется также В-клетками и моноцитами). Клетки CD4+/CD45R
идентифицированы как индукторы супрессоров, что дает возможность косвенно
определять также функционально активные индукторы хелперов.
. Антиген CD25 - гликопротеин, идентифицированный
как низкоаффинный рецептор к интерлейкину-2 (IL-2). Совместно с белком 75К
антиген CD25 образует высокоаффинный рецептор ИЛ-2. CD25 экспрессируется на
активированных Т-лимфоцитах.[16]
Регуляторные Т-клетки удерживают иммунную
систему организма от нападения на собственные ткани. Их использование позволит
лечить самые разные заболевания и, возможно, решить проблему отторжения
трансплантированных органов.
«Тяжелейший аутотоксикоз» - такой термин был
введен около ста лет назад известным немецким врачом-бактериологом Паулем
Эрлихом для описания патологического состояния, при котором иммунная система
человека «атакует» его же собственные органы и ткани. Эрлих полагал, что с
биологической точки зрения в аутоиммунности (еще одно введенное им определение)
нет ничего абсурдного, когда она находится под строжайшим контролем. Однако
медицинское сообщество не приняло столь неоднозначной идеи. В самом деле, зачем
природе встраивать в организм человека механизм, способный разрушать своего
носителя?Однако врачи время от времени сталкивались с заболеваниями, которые
попадали под концепцию Эрлиха. Среди них рассеянный склероз, инсулинозависимый
диабет, ревматоидный артрит. Выяснилось, что у подобных больных обычно нарушена
функция особых лейкоцитов, известных как CD4+-T-лимфоциты (они названы так
потому, что созревают в тимусе - железе, расположенной в грудной клетке чуть
выше сердца, и несут на своей поверхности молекулы гликопротеина CD4). В норме
они играют роль «старших офицеров», которые отдают команду другим клеткам иммунной
системы к наступлению на вторгшихся в организм врагов - болезнетворных
микроорганизмов, но иногда направляют оружие против органов и тканей
собственного тела.
Эрлих оказался прав и в другом: недавно
идентифицированы клетки, специализирующиеся на возвращении на путь истинный
вышедшей из повиновения иммунной системы. Они получили название регуляторных
Т-клеток. Будучи частью популяции CD4+-T-клеток, они поддерживают мир и
согласие между иммунной системой и организмом. Кроме того, выяснилось, что им свойственна
не только миротворческая функция: они также влияют на реакцию иммунной системы
на проникшие в организм инфекционные агенты, опухолевые клетки,
трансплантированные органы, клетки плода при наступлении беременности и т. д.
Если удастся выяснить, как они выполняют свои обязанности, и почему их работа
иногда дает сбой, исследователи получат возможность контролировать деятельность
этих регуляторов и при необходимости подавлять иммунную активность.
Исследователи обнаружили, что для обеспечения
самотолерантности (способности удерживать иммунную систему в рамках)
принимается множество мер предосторожности. Первая линия обороны, во всяком
случае, в том, что касается Т-клеток, располагается в тимусе. Здесь созревшие
Т-клетки проходят серьезный «курс обучения» и настраиваются на крайне слабую
реакцию на здоровые клетки организма-хозяина. Клетки, не поддающиеся
«дрессировке», отбраковываются. Однако ни одна система не застрахована от
ошибок, и некоторое количество аутоагресивных Т-клеток ускользает от контроля.
Попадая в кровоток и лимфу, они создают угрозу запуска аутоиммунной
реакции.[18]
2.6 История открытия
регуляторных Т-клеток
В 1969 г. Ясуаки Нисидзука (Yasuaki Nishizuka) и
Тэруе Сакакура (Teruyo Sakakura) из японского Центра по исследованию рака в г.
Нагоя обнаружили, что удаление тимуса у новорожденных мышат женского пола
приводит к серьезным последствиям - разрушению яичников. Вначале ученые
предположили, что тимус секретирует гормоны, необходимые для развития и
сохранения данных органов. Однако позже выяснилось, что ткани яичников у мышат,
лишенных тимуса, буквально наводнены иммунными клетками, что свидетельствовало
о наличии аутоиммунного заболевания, возникшего в результате выхода из строя
какого-то регуляторного механизма. Стоило ввести грызунам нормальные Т-клетки,
как болезнь отступала. Все указывало на то, что в популяции Т-клеток имеется
система самоконтроля.
В начале 1970-х гг. аналогичные результаты в
ходе опытов на взрослых крысах получил ^ Джон Пенхейл (John Penhale) из
Эдинбургского университета, а Ричард Гершон (Richard Gershon) из Йельского
университета впервые предположил, что существует некая группа Т-клеток,
способных подавлять иммунную реакцию, в том числе и направленную против тканей
собственного организма. Гипотетические клетки были названы супрессорными, но в
то время никто не мог найти объяснения их поведению.
Основные надежды возлагались на обнаружение
особых структур на поверхности Т-клеток - маркеров, по которым супрессорные
Т-клетки можно было бы отличить от других составляющих иммунной системы.
Начиная с середины 1980-х гг. многие молекулы были испробованы на роль
потенциального маркера. В конце концов в 1995 г. один из нас (Сакагути)
обнаружил таковой - им оказалась молекула, названная CD25. Когда у мышей были
удалены CD4+-T-клетки, несущие данный маркер, иммунной атаке подверглось сразу
несколько органов: желудок, половые, слюнные, щитовидная и поджелудочная
железы. К ним устремились лейкоциты и разрушили их.[19]
2.7 Как работают
регуляторные Т-клетки
Механизм подавления аутоиммунной активности
клетками T-reg остается загадкой. По-видимому, они способны воздействовать на
самые разные клети иммунной системы, блокируя их амплификацию и такие процессы,
как секреция сигнальных молекул - цитокинов. Специалисты склонны думать также,
что T-reg-клетки активируются прямым межклеточным взаимодействием. Во всем
остальном картина остается неясной.[1]
2.8 Механизм
самотолерантности
Александр Руденски с коллегами из Вашингтонского
университета и группа Фреда Рамсдела из компании CellTech R&D в шт.
Вашингтон независимо друг от друга получили результаты, приподнимающие завесу
тайны над образованием и механизмом действия T-reg. Обнаружилось, что они
содержат в необычайно большом количестве специфические молекулы под названием Foxp3,
которые служат одним из факторов транскрипции, регулирующих работу определенных
генов и тем самым - синтез кодируемых ими белков. Изменение экспрессии любого
клеточного гена может повлиять на функционирование всей клетки. Что касается
действия фактора Foxp3, то он, по-видимому, перенастраивает клеточные гены
таким образом, что Т-клетки превращаются в T-reg. В действительности, введение
Foxp3 в обычные Т-клетки приводит к тому, что они приобретают такую же
способность к иммуносупрессии, как и исходно полноценные T-reg-клетки,
образовавшиеся в тимусе. Недавно выяснилось, что мыши, относящиеся к широко
используемой лабораторной линии Scurfy, синтезируют только неактивную,
мутантную форму белка Foxp3, но в их организме нет и следа T-reg. Иммунная
система у таких животных расшатана до предела, они страдают от множественных
воспалений различных органов и рано погибают.
Имеются ли какие-либо данные о том, что человеку
также необходимы T-reg-клетки? И есть ли они в нашем организме? Исследователи
выяснили, что молекулярные особенности, характерные для T-reg-грызунов, присущи
также некой субпопуляции Т-клеток человека. На поверхности данных клеток
присутствуют молекулы CD25, а внутри содержится необычайно много белка Foxp3.
Они обладают иммуносупрессивными свойствами - по крайней мере, таковы
результаты опытов in vitro.Как T-reg-клетки подавляют аутоиммунную реакцию?
Лучшим свидетельством того, что данные клетки жизненно важны и для нас, служит
следующее наблюдение. Существует редкое генетическое заболевание под названием
IPEX (Immune dysregulation, Polyendocrinopathy, Enteropathy, X-linked
syndrome), которое связано с мутацией в одном из генов Х-хромосомы и поражает
младенцев мужского пола (в отличие от девочек, они наследуют только одну
Х-хромосому и потому не могут синтезировать вторую, нормальную копию
соответствующего белка). Его следствием становится аутоиммунная реакция,
влекущая за собой поражение многих органов и смерть в младенчестве. Как
выяснилось недавно, данная мутация локализована в том самом гене, который кодирует
белок Foxp3. Таким образом, IPEX - это аутоиммунное заболевание человека,
аналогичное таковому у мышей линии Scurfy.
В 1990-х гг. Фиона Паури из DNAX,
исследовательского института в Пало-Альто, шт. Калифорния, проводила
эксперименты по введению популяции Т-клеток, обедненной T-reg, мышам с
нефункционирующей иммунной системой. В одной из серий экспериментов у животных
развилось острое воспаление кишечника. Но аберрантная иммунная реакция была
направлена в первую очередь не на клетки самого органа.
В кишечнике как грызунов, так и человека
присутствует множество микроорганизмов. Нередко их число превышает триллион на
каждый грамм ткани. Большинство из них не только безвредны, но даже необходимы:
они улучшают пищеварение и вытесняют патогенные бактерии (например,
сальмонеллы), которые в противном случае заселили бы кишечник. В норме иммунная
система никак не реагирует на присутствие полезных, хотя и чужеродных тел. Но у
мышей, которые использовала в своих опытах Паури, все было не так. Введенные
иммунные клетки атаковали не только микроорганизмы, но и стенки кишечника
реципиента. Однако при инъекции клеток T-reg подобных проблем не возникало. И
если бы последние вводились вместе с другими Т-клетками с самого начала, то
никакого воспалительного процесса в кишечнике не возникло бы. Подводя итоги,
можно сказать, что иммунная система представляет собой спусковой механизм,
готовый в любую минуту атаковать микрофлору кишечника, и сдерживают ее только
T-reg-клетки.[14]
Ответ иммунной системы на болезнетворные чужеродные
агенты может контролироваться аналогичным образом. С одной стороны,
T-reg-клетки способны блокировать слишком сильную реакцию, с другой -
предотвращать уничтожение какого-нибудь инородного тела, позволяя ему
существовать в организме хозяина. Есть свидетельство того, например, что
невозможность полностью уничтожить обитающую в желудке бактерию Helicobactor
pilori, вызывающую язвенную болезнь, связана с «умиротворяющим» действием
T-reg-клеток на иммунную систему.[18]
Работы Дэвида Сакса и его коллег из Национальных
институтов здоровья проиллюстрировали всю сложность данной ситуации. Дело в
том, что, по мнению авторов, неполное уничтожение в организме патогенов имеет
положительную сторону. Был поставлен следующий опыт: мышей инфицировали
безопасными для них паразитами. Даже если иммунная система животных была
здорова, в их организме оставалось небольшое число микроорганизмов, и тогда
повторная инфекция получала достойный отпор. Если же популяция Т-клеток была
бедна клетками T-reg, то паразиты уничтожались все до одного, однако при
повторном заражении иммунная реакция была столь слабой, будто организм грызунов
никогда прежде с этими паразитами не встречался. T-reg-клетки, по-видимому,
улучшают иммунологическую память, которая обеспечивает невосприимчивость
организма к повторным заражениям и лежит в основе действия вакцин.
Есть указания и на то, что клетки T-reg
способствуют нормальному (с иммунологической точки зрения) протеканию
беременности, которая всегда оказывается вызовом иммунной системе. Поскольку плод
наследует от матери только половину генов, а вторую получает от отца, он
генетически не идентичен матери и по существу может считаться имплантированным
органом. От отторжения плод защищает целый ряд механизмов, функционирующих в
трофобласте (плацентарной ткани, соединяющей зародыш со стенкой матки).
Трофобласт - не просто физиологический барьер для содержащихся в материнской
крови веществ, вредных для плода: в нем продуцируются
молекулы-иммуносупрессанты.
При беременности иммунная система будущей матери
претерпевает изменения. Есть данные, что у женщин с таким аутоиммунным
заболеванием, как рассеянный склероз, в период беременности T-reg-клетки
проявляют большую активность. Недавно получены дополнительные данные: Александр
Бетц (Alexander Betz) из Кембриджского университета обнаружил, что у беременных
мышей повышено число материнских клеток T-reg. Причем у генетически
модифицированных особей, не имеющих T-reg, при вынашивании потомства
наблюдается массовое проникновение иммунных клеток через плацентарный барьер.
Есть основания полагать, что причиной спонтанных абортов у некоторых женщин
оказывается низкая активность T-reg-клеток.[14]
2.9 Использование
регуляторных Т-клеток в медицине
Итак, T-reg-клетки являются мощным природным
регулятором иммунной системы. Научившись влиять на его работу, мы сможем лечить
различные заболевания. Ожидать немедленного практического внедрения подобного
способа борьбы с недугами, конечно, не приходится, но имеющиеся данные
позволяют надеяться, что введение в организм самих T-reg-клеток или препаратов,
воздействующих на их активность, уже в скором времени сможет облегчить
состояние некоторых больных.
Речь идет, прежде всего, об аутоиммунных
заболеваниях. Возможно, с помощью T-reg-клеток удастся справиться также с
разными видами аллергии. А легкость, с которой клетки T-reg «усмиряют» иммунную
систему, предполагает, что они могут стать незаменимыми при операциях по
пересадке органов.[16]
Будущее трансплантологии.
Альтернативный метод мог бы состоять в
избирательном устранении определенных компонентов из популяции T-reg-клеток для
подавления нежелательной иммуносупресии и, следовательно, для усиления реакции,
направленной на нужную мишень. Оптимальным было бы удаление только тех
T-reg-клеток, которые блокируют специфическую иммунную реакцию. Такая стратегия
может быть незаменима в борьбе с инфекционными заболеваниями, при которых
иммунная система, предоставленная самой себе, часто действует не совсем
адекватно, например, при туберкулезе и СПИДе.
Уменьшение активности T-reg-клеток можно было бы
использовать и при лечении онкологии. Компоненты иммунной системы, циркулируя в
крови и лимфе, бдительно следят за появлением в организме клеток,
превратившихся в раковые. Они распознают их по определенным морфологическим
признакам и причисляют к чужеродным агентам. Мешая «патрульным» клеткам
иммунной системы выполнять работу, T-reg поневоле способствуют образованию и
росту опухоли. При некоторых онкологических заболеваниях пораженные клетки даже
помогают в этом клеткам T-reg: они секретируют сигнальные молекулы, способные
привлекать T-reg и инициировать превращение не-T-reg в T-reg. По наблюдениям
некоторых врачей, у больных раком аномально высоко содержание активных
T-reg-клеток как в крови, так и в самой опухоли.[17]
Технические трудности.
До сих пор не было никаких попыток создать
препараты, увеличивающие или уменьшающие численность популяции T-reg-клеток
непосредственно в организме человека. Любые средства, которые можно было бы
использовать, должны обладать способностью влиять только на те субпопуляции
T-reg-клеток, которые играют роль в развитии конкретного заболевания. Но как
распознать такие клетки, специалисты пока не знают.
Подавление активности или уничтожение для
усиления иммунной реакции (рак кожи (меланома), яичников, почек):
Токсин присоединяют к интерлейкину-2, который
обеспечивает его проникновение в T-reg-клетку. Вводят моноклональные антитела,
способные уничтожать T-reg-клетки или блокировать их проникновение в опухоль.
Пролиферация в организме пациента для подавления
иммунной реакции (рассеянный склероз, псориаз, болезнь Крона, инсулинозависимый
сахарный диабет):
Готовят вакцину, содержащую компоненты
Т-клеточного рецептора, с тем, чтобы стимулировать пролиферацию T-reg-клеток.
Пролиферация in vitro и введение в организм
пациента (реакция «трансплантат против хозяина», при которой иммунные клетки
пересаженного костного мозга атакуют ткани реципиента):
Культивируют T-reg-клетки донора со
специфическими антителами и факторами роста. Вводят образовавшуюся популяцию
T-reg-клеток до пересадки костного мозга или во время нее (чтобы предотвратить
отторжение) или при угрозе возникновения реакции «трансплантат против
хозяина»[10]
2.10 Клеточный
иммунитет
Клеточный иммунитет опосредуется клетками
специфической и неспецифической защиты: специфические - Т-лимфо-циты хелперы
(СД 4 +) и специфические клетки-киллеры - цитотоксические СД8+ Т-лимфоциты. Это
наиболее специализированные клетки, уничтожающие вирионы, а также пораженные
вирусом клетки. Неспецифические - это макрофаги и ЕК-к летки.
Функция факторов клеточного иммунитета связана с
подавлением репликации вируса, миграцией и удержанием макрофагов, лимфоцитов и
воспалительных клеток в очаге воспаления.Кроме того, компоненты клеточного
иммунитета вызывают лизис инфицированных клеток и высвобождают внутриклеточный
вирус для последующей нейтрализации антителами, а также оказывают влияние на
соседние нормальные клетки, предупреждая их инфицирование (выработка
интерферонов приводит к повышению синтеза MHC-I, С 2 и С4 компонентов
комплемента, лимфотоксина и других).Прямая цитотоксичность обусловлена
непосредственным контактом Т-киллеров с поверхностью инфицированных клеток,
распознаваемых благодаря наличию у них вирусспецифи-ческих мембранных
антигенов.
Специальные исследования состояния клеточного иммунитета
у больных рецидивирующим герпесом показали его неполноценность и в
межрецидивном периоде. Активность клеточного иммунитета является определяющим
фактором в предупреждении развития заболевания, а также выздоровлении организма
в процессе данной инфекции. Значение клеточного иммунитета в резистентности
отчетливо заметно у лиц с врожденным дефектом Т-системы иммунитета, при
тимус-томии, облучении, тяжелых вторичных иммунодефицитных состояниях (СПИД,
онкопатология), иммуносупрессивной лекарственной терапии и т. п.
Т-клеточное звено представлено двумя основными
субпопуляциями лимфоцитов - СД 4 + (в периферической крови составляют 2/3
Т-клеток) и СД8+ TCR+ (T-cell receptor - Т-клеточный рецептор).[17]
По современным представлениям, СД 4 + Т-клетки
человека могут быть разделены на два основных функциональных фенотипа (по
аналогии с мышиными Т-хелперами): Т-хелперы 1 типа (ТЫ, Т-клетки воспаления) и
Т-хелперы 2 тип а( Тп2, собственно Т-хелперы) . Ряд исследователей выделяют
ТпЗ-клетки, которые были впервые описаны у мышей с экспериментальным
аутоиммунным энцефаломиелитом при оральной презентации антигена: показано, что
эти клетки преимущественно образуют трансформирующий фактор роста р
(ТФРр-TGFp), который является мощным ингибитором Thl-клеток при местном воспалении,
в частности в мозге больных мышей, что лежит в основе наблюдающейся картины
регресса основных признаков воспаления.
Основным критерием разделения Т-хелперов
является их участие в индукции преимущественно клеточного (ТЫ) или гуморального
(Th2) иммунного ответа. Определяющим в индукции того или иного класса Th-клеток
является некая комбинация молекул ко-активации, экспонируемых антиген
презентирующей клеткой, и цитокиновый сигнал, получаемый Т-хелпером. [10]
Важным звеном персистентных вирусных инфекций
является снижение факторов специфической и неспецифической иммунологической
реактивности организма. Предположение о супрессивном действии вирусных инфекций
на иммунитет было высказано в начале нашего века. Использование современных
методов молекулярной иммунологии для изучения особенностей развития
иммунодефицитных состояний при вирусных инфекциях позволило выделить 4 основных
механизма формирования иммуносупрессии. Прямое действие полной или абортивной
репродукции вируса на структурную и функциональную полноценность лимфоцитов:
вирусы группы герпеса на Т- , В-лимфоциты, макрофаги, ЕК-клетки. В результате
такого влияния вируса может определяться в части случаев полное разрушение
(лизис) лимфоцита либо снижение его функциональной активности вплоть до полной
ее утраты. Некоторые вирусы оказывают описанное выше действие на все типы
лимфоцитов, другие разновидности вирусов (ВПГ, ВИЧ и других) - лишь на
определенные субпопуляции лимфоцитов, Важно, что у лиц с ИД С при ГИ имеется
двойной иммунодефицит (ГИ в сочетании с онкозаболеванием, СПИДом и прочее),
очевидно, вследствие синергизма иммуносупрессив-ных факторов:
Угнетающее воздействие на иммунную систему
растворимых факторов (вирусного или клеточного происхождения), освобождающихся
из поврежденных клеток.
Результат инфицирования и повреждения клеток,
ответ ственных за фагоцитоз, вирусами, поражающими макрофаги (ВПГ, ЦМВ, ВГЧ-б,
ВИЧ, полиовирус, оспенная вакцина, денге и другие).
Дисбаланс регуляции иммунной системы как
следствие развития любого из трех указанных выше механизмов иммуносупрессии.
Представляют интерес новые данные об иммунодепрессив-ном действии ВПГ:
Второй белок - белок ЮР 47 производится в очень
раннюю фазу репликации ВПГ, который, очевидно, связываясь с одним из ТАР белков
(это белки, ассоциированные с транспортом процессированного антигена),
предотвращает вновь синтезированные молекулы HLA I от созревания в
эндоплазматическом ретикулуме, т. е. нагрузке молекулы HLAI вирусными
пептидами.Таким образом, сниженная экспрессия HLAI на инфицированной клетке
приводит к менее напряженному анти-ВПГ специфическому СД8-ответу.
ВПГ подавляет функцию макрофагов.Часть Т- и
В-клеток после начальной активации, происходящей под влиянием антигена, не
дифференцируется дальше а длительно сохраняется в организме, обеспечивая так
называемую иммунологическую память. В результате при повторном попадании
антигена в организм в нем развивается более быстрый и интенсивный вторичный
иммунный ответ в отличие от первичного ответа, описанного ранее.
Имеется достаточное число сообщений о нарушениях
иммунологической реактивности при разных клинических формах ЦМВИ. Так, при
обследовании 18 взрослых больных, у 14 из которых диагностировали синдром
инфекционного мо-нонуклеоза, а у 4 - функциональные нарушения печени, у всех
больных выявляли угнетение реакции лимфоцитов на конка-навалин А, митоген
лаконоса и на такие распространенные антигены, как туберкулин, кандидин,
антигены вируса эпидемического паротита и простого герпеса. Однако
полиферативный ответ на ФГА не был изменен. Иммуносупрессия сохранялась в
течение 50 дней после выявления клинических симптомов болезни, и уровень
активности лимфоцитов не достигал исходного даже через 250 суток. В связи с
этим авторы говорят о наличии связи угнетения функции лимфоцитов с повышением
чувствительности реконвалесцентов к гетерологичным инфекционным агентам. Наряду
с этим лимфоциты больных и реконвалесцентов четко реагировали на ЦМВ человека
in vitro с последующим формированием вирусспецифических цитотокси-ческих
Т-лимфоцитов.[15]
ЦМВИ (Цитомегаловирусная инфекция) может играть
важную роль в патогенезе иммунологической недостаточности. Вирусы из группы
герпеса относятся к числу патогенов, способных индуцировать ГЗТ,
морфологическая картина которой характеризуется лимфоидно-макрофа-гальной
инфильтрацией органа или ткани. Иммунный ответ при вирусных инфекциях направлен
не только против свободных вирусов, циркулирующих в крови или в других
жидкостях, но и против зараженных клеток хозяина.
Как отмечалось, в противовирусной защите организма
участвуют четыре системы клеток: цитотоксические Т-лимфо-циты, ЕК-клетки,
макрофаги и В-лимфоциты (и плазмациты). В опытах на мышах было показано, что
ЦМВ обладает высокой патогенностью для мышей-сосунков. При заражении взрослых
животных летальность существенно снижена. Вирус выделяют до 8 дней из печени,
где развиваются очаговые некрозы. Он сохраняется пожизненно и в слюнных железах
инфицированных особей. Показана способность ЦМВ инфицировать В-клетки,
Т-лимфоциты и макрофаги, а также неиденти-фицированные мононуклеарные клетки в
селезенке мышей. Отмечена супрессия на фоне индукции первичного, но не
вторичного иммунного ответа на ВЭБ, а также констатировано угнетение
пролиферативной активности лимфоцитов, которое коррелировало с тяжестью
клинических симптомов. Наибольшей чувствительностью к ЦМВ обладают мыши, в
крови кото-рых обнаружен дефект естественных киллеров. Существованием дефекта в
клеточном звене иммунитета объясняют длительную персистенцию ЦМВ в присутствии
специфических антител.

При работе с культурой периферических
мононуклеарных клеток крови человека добавление ЦМВ сопровождалось подавлением
цитотоксической функции ЕК только в том случае когда в культуре периферических
мононуклеарных клеток находились моноциты. Таким образом, было установлено, что
развитие одного из типов супрессии, обусловленной ЦМВ, реализуется через
моноциты. Накапливаются данные о прямом действии ЦМВ на регуляторные Т-клетки,
что ведет к нарушению синтеза и способности взаимодействовать с ИЛ~2. На
большее значение клеточного иммунитета в возникновении ЦМВИ указывали Г. И.
Савицкий и др. (1984). Они выявили корреляцию между экскрецией ЦМВ и
показателями клеточного иммунитета: около 1% здоровых взрослых выделяют ЦМВ с
мочой. Показано, что такого рода латентная инфекция наблюдается у людей, в
организме которых имеется дефект клеточного звена иммунитета.
Описанные наблюдения у взрослых ЦМВИ, выявленной
морфологическими методами, свидетельствуют о полиорганных поражениях при этом
заболевании. В настоящее время ЦМВИ отнесена к группе инфекций, являющихся
индикаторами иммунологической недостаточности. На основании изложенного можно
считать, что особенности распространения ЦМВИ среди взрослых объясняются
отсутствием у них характерного для детей раннего возраста периода
физиологической иммунологической недостаточности, связанного с созреванием
органов иммуногенеза. ЦМВИ у взрослых встречается преимущественно как позднее
осложнение злокачественных опухолей, хронических воспалительных процессов, а
также у больных после трансплантации органов или гемотрансфу-зий , приема
цитостатических и кортикостероидных препаратов. Указанные факторы не только
вызывают реактивацию латентной инфекции, но и повышают чувствительность тканей
к экзогенному заражению ЦМВ. В этих условиях ЦМВИ может быть второй болезнью,
обуславливающей летальный исход. В настоящее время стало очевидным, что
вирусные инфекции сопровождаются существенными нарушениями регуляции иммунного
ответа, в основе которых лежат повреждения системы интерлейкинов. Эти
повреждения могут быть двоякими. В одних случаях нарушается (обычно -
подавляется, реже - усиливается) способность инфицированных иммунокомпетен-тных
клеток синтезировать интерлейкины ; в других - меняется реакция клеток-мишеней
на интерлейкины.
Показана возможность размножения ЦМВ в Т- и
В-лимфо цитах, а также в макрофагах человека. Так, инфекционный ЦМВ может быть
выделен из клеток крови у больных с выраженной клиникой инфекционного
мононуклеоза и пациентов в стадии реконвалесценции. Вирусную РНК обнаруживали в
Т-хелперах и СД8+ клетках в отдаленные сроки реконвалесценции. Следовательно,
не только клетки ММС, но и Т-лимфоци-ты могут выступать в качестве резервуара
вируса, в котором он оказывается защищенным от эффекторных механизмов иммунной
гибели хозяина. Представляет интерес информация о тропизме вирусов к разным
клеткам иммунной системы. Эти данные говорят о том, что все рассматриваемые
вирусы вступают в прямое взаимодействие с иммунокомпетентными клетками хозяина.
Функции зараженных вирусом клеток нарушаются избирательно, а не по принципу все
или ничего.
Следует отметить, что иммуносупрессивным
действием обладают крупные иммунные комплексы. Они повреждают способность
макрофагов и неитрофилов фагоцитировать и выделять продукты окисления. Мелкие
комплексы, образующиеся при избытке антигена или антител, иммуномодулирующим
действием не обладают. Таким образом, ЦМВИ и иммунологическая недостаточность -
проблемы взаимосвязанные и взаимообусловленные.[17]
В последнее время в литературе сформировалось
понятие о вирусиндуцированной антигеннеспецифической иммуномо-дуляции (ВАИ),
под которой понимают явление, характеризующееся тем, что иммунная система
зараженного организма меняет характер (в количественном плане) ответа на
неродственные - по отношению к инфекционному агенту - антигены. Эти изменения
выявляются как при экспериментах in vivo, так и in vitro. Они проявляются в
виде антигеннеспецифической супрессии или усиления. ВАИ является обязательным
компонентом патогенеза любой экспериментальной инфекции и вирусного заболевания
человека. Вирусиндуцированная супрессия иммунного ответа или его усиление
затрагивает реакцию хозяина на различные патогенные микроорганизмы (вирусы,
бактерии, грибы или простейшие), поэтому ВАИ должна учитываться при изучении
классических проявлений болезней вирусной этиологии и при
сероэпидемиологическом анализе.
ВАИ нарушает механизмы иммунологического
надзора, что может привести к развитию онкологических заболеваний. ВАИ лежит в
основе ряда иммунопатологических процессов, таких как образование иммунных
комплексов, запуск аутоиммунного ответа и т. д. С ВАИ связывают повреждающее
действие различных вакцинных препаратов. Исследование ВАИ открывает перспективу
для создания нового подхода к терапии вирусных инфекций - разработке метода
коррекции вируеиндуцирован-ных вторичных иммунодефицитных состояний, что должно
привести к предупреждению или смягчению иммунопатологических реакций и
профилактике вторичных инфекций, вызываемых неродственными возбудителями.
Заключение
Учение об и иммунитете имеет не только
познавательное, прикладное значение. Зарождалось оно как сугубо практическая
необходимость, поэтому практический аспект учения развивался опережающими
темпами. В настоящее время борьба с инфекционными заболеваниями немыслима без
специфической диагностики, профилактики болезней и специфической терапии
животных.Знание механизмов повреждающего действия микробов, прежде всего,
повысило эффективность микробиологической диагностики. Выяснение ведущих
факторов патогенности микробов позволяет правильно отобрать, быстро и точно
исследовать материал. Например, диагноз на стахиоботриотоксикоз,
фузариотоксикоз, ботулизм и другие подобные болезни устанавливают по наличию в
кормах экзотоксина возбудителей. Диагноз септических болезней, обусловленных
наличием у микробов инвазивных факторов, определяют, исследуя кровенаполненные
органы. И, наоборот, локальные процессы, вызванные микрофлорой с неразвитыми
инвазивными свойствами, диагностируют непосредственным обнаружением
возбудителей в пораженной ткани. При этом учитывают выраженный тропизм, то есть
избирательное отношение возбудителей к определенным тканям хозяина.В ряде
случаев четкое знание факторов патогенности определяет направление исследований
патологического материала. Например, обнаружение капсул у палочковидного
микроба и корд-фактора у мико-бактерий ориентирует на выявление возбудителей
сибирской язвы и туберкулеза млекопитающих соответственно. Наличие у
микроорганизмов антигенных детерминант, отражающих их патогенность,
используется для производства диагностических биологических препаратов, или
диагностикумов.
Список литературы
1. Воробьева
А.А. Медицинская микробиология, вирусология и иммунология (2006), стр. 197
2. Плехова
Н.Г. Журнал Микробиология, 2006г., №6, стр.89-96
. Галактионов
В.Г. Эволюционная иммунология: Учеб. пособие. - М.: ИКЦ «Академкнига», 2005. -
408 с. - 2000 экз
. Краткая
медицинская энциклопедия / гл. ред. Б.В.Петровский. - издание второе. - М.:
«Советская энциклопедия», 1989.
. Поздеев
О.К. Медицинская микробиология. - М.: ГЭОТАР-МЕД, 2001.
. Семёнов
Э.В. Физиология и анатомия. - М.: Редакция газеты "Московская
правда", 1997 - 470 с.
. Клиническая
иммунопатология: Д. К. Новиков, П. Д. Новиков - Санкт-Петербург, Медицинская
литература, 2009 г.- 466 с.
. Современный
взгляд на вирусные гепатиты: В. В. Малеев, Т. В. Сологуб, Ф. И. Ершов, М. Г.
Романцов - Москва, Миклош, 2010 г.- 168 с.
. Абелев
Г.И. Основы иммунитета. - “Соросовский Образовательный журнал”, 1996г., №5, С.
. Грунтенко
Е.В. Иммунитет. За и против. - М., “Знание”, 1982г., С.208.
. Ройт
А. Основы иммунологии. М., “Мир”, 1991г., С.328.
. Фрейдлин
И.С. Цитокины и межклеточные контакты в
. противоинфекционной
защите организма. - “Соросовский Образовательный журнал”,1996г, №7, С. 19-25.
. Броиз
Б.Д. Т-лимфоциты и их рецепторы в иммунологическом использовании. - М.: Наука,
1987. - 471 с.
. Лозовой
В.П., Шерин С.М. Структурно-функциональная организация иммунной системы. -
Новосибирск, 1981. - 225 с.
. Петров
Р.В. Иммунология. - М.: Медицина, 1982. - 366 с