|
М, тыс. Дальтон
|
Т, % М, тыс.
|
|
10-40
|
15-20
|
|
40-100
|
10-15
|
|
100-300
|
5-10
|
|
>300
|
5
|
Ориентировочно о характере различия электрофоретических
подвижностей двух белков в данных условиях разделения можно судить в том
случае, когда известны их молекулярные массы и изоэлектрические точки, а также
содержание в них ионогенных аминокислот.
Электрофоретическая подвижность молекул в ПААГ зависит от
молекулярных масс белков и концентрации ПААГ. Подвижность биополимеров,
находящихся в геле, пропорциональна подвижности в свободной жидкости.
Подвижность определяется отношением суммарного заряда макромолекулы к ее массе.
По силе трения молекулы о гель, а также по размерам пор определяют молекулярные
массы белков.
Электрофорез проводят в буферной системе - рабочем буфере. От
pH буфера, в котором находится белок, зависит суммарный заряд молекулы, а
значит и отношение массы к заряду. Наилучшее разделение проводится при наиболее
различных зарядов всех белков в смеси, для обеспечения разности зарядов белков
выбирают величину pH буфера максимально удалённую от изоэлектрических точек
всех белков. Разделение белков с кислым значением pH следует проводить в
слабощелочном буфере, при котором разделение будет проходить от катода к аноду.
При разделении щелочных белков наоборот, следует выбрать буфер с слабокислым
значением pH и их миграция будет проходить от анода к катоду.
При выборе буфера также следует учитывать его
электропроводную способность и электрофоретическую подвижность его ионов. Ионы
буфера под действием электрического тока могут мигрировать в одном направлении
с разделяемыми макромолекулами. Качество разделения улучшается, если для
щелочных белков использовать трисовый буфер, а для кислых белков -
барбитуратный буфер.
Трение молекулы о гель может происходить в зависимости от ее
молекулярной массы, но на трение может влиять другой фактор. Например,
конфигурация молекулы белка. Белки, образующие глобулы, которые не подвержены
распаду и присоединению к ним новых молекул, называются глобулярными белками,
их размеры зависят от плотности упаковки полипептидных цепей в глобулы. Все
глобулы взаимодействуют с ПААГ практически одинаково, в отличие от фибриллярных
белков, которые изменяют свою структуру при взаимодействии с гелем, что
помогает им легче пройти между нитями ПААГ. Поэтому чтобы белковые структуры
вели себя одинаково при миграции, применяют метод распрямления молекулы
полипептидной цепи, то есть разрушение связей в белке, до первичной структуры.
При применении этого метода более точно определяется молекулярная масса белка.
Для разрушения связей в белке его перед электрофорезом обрабатывают детергентом
- додецилсульфатом натрия, и нагревают до 100°С. Такую методику впервые
предложил Лэммли [22]. Гидрофобными частями детергент присоединяется к
гидрофобным радикалам аминокислот в полипептидной цепи. Данное взаимодействие изменяет
конформацию белков. Денатурированный под действием детергентов белок обычно
остаётся в растворённом виде, так как гидрофильные части денатурирующего
вещества удерживают его в растворе и белок приобретает отрицательный заряд.
Полипептидная цепочка белка распрямляется из-за электрического отталкивания
остатков серной кислоты, расположенных на поверхности белка.
Как уже говорилось, белки способны слипаться, образовывая
новые большие молекулы, такой процесс называется агрегацией и может привести к
образованию таких соединений как димеры или тримеры молекул. Они будут
проявляться отдельно от основной молекулы белка, давая дополнительные полосы.
Такой эффект может происходить за счет сохранения водородных связей в
структуре. Для предотвращения этого можно использовать мочевину, под действие
которой разрушаются в основном нековалентные связи, такие как гидрофобные
взаимодействия и водородные связи. Мочевина образует водородные связи с амино -
и карбонильными группами пептидного остова и некоторыми функциональными
группами радикалов аминокислот, в результате чего происходит разрыв связей,
участвующих в формировании вторичной и третичной структуры нативных белков, и
образование новых связей с мочевиной.
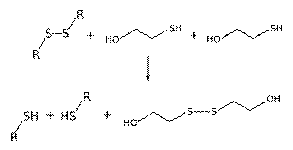
Для разрушения дисульфидных мостиков в структуре белка используют
меркаптоэтанол, который также предотвращает окисление белкового препарата, так
как при окислении происходит образование дисульфидных связей:

Разрушение дисульфидных связей происходит из-за
восстанавливающего действия меркаптоэтанола на дисульфидные мостики между
аминокислотными остатками в молекуле белка:
Во время проведения электрофореза сами белки увидеть нельзя,
поэтому для визуализации процесса используют красители, которые добавляют в
смесь белков перед проведением электрофореза. Обычно подбирают такой краситель,
который не взаимодействует с белком и несет электрический заряд с таким же
знаком. Под действием электрического тока краситель также двигается в
электрическом поле, однако он не должен значительно опережать миграцию
исследуемых белков в ПААГ. Скорость миграции молекул красителя должна быть
немного выше, чем наивысшая скорость миграции макромолекул. Для белков
заряженных отрицательно, а также денатурированных при помощи додецилсульфата
натрия, часто применяют краситель, имеющий отрицательных заряд - бромфеноловый
синий.
Основной физический принцип метода разделения белковой смеси
при помощи электрофореза заключается в том, что макромолекулы, которые
необходимо подвергать разделению, имеют суммарный электрический заряд за счет
нахождения на поверхности разнозаряженных зон [23]. На заряд может влиять
значение pH среды, в которой содержатся макромолекулы. Если создать такие
условия, что через буферный раствор, находящийся между изолированными стеклами,
пропускать электрический ток, то будет образовываться градиент напряжения и в
буферном растворе установится электрическое поле. Под действием электрического
поля макромолекулы перемещаются к катоду или аноду, в зависимости от суммарного
заряда, которым обладает молекула. От того какой размер самой молекулы и каким
зарядом она обладает, будет зависеть скорость миграции в электрическом поле.
При столкновении молекул с нитями геля, их подвижность замедляется. Вследствие
торможения молекул и происходить разделение. Исходный набор макромолекул
разделяется на зоны, в которых содержаться молекулы, имеющие одинаковый размер
и заряд. В процессе проведения электрофореза эти зоны распределяются по длине
геля.
9.
Изоэлектрическое фокусирование
Метод изоэлектрического фокусирования основан на
электрофоретическом разделение белков под действием электрического поля в
градиенте рН [24]. Разделение происходит в соответствии с их изоэлектрическими
точками, которыми обладают каждые заряженные биополимеры, что увеличивает
специфичность данного метода. При достижении белком изоэлектрической точки в
градиенте рН его суммарный заряд становится равным нулю и он перестает
перемещаться в электрическом поле. Изоэлектрическая точка белка может меняться в
зависимости от действия на него различных факторов, так как при изменении
условий среды происходит модификация его структуры. В процессе проведения
изофокусирования молекулы белка, находясь в кислой или щелочной среде, меняют
свой заряд и двигаются по направлению к катоду или аноду под действием
электрического поля, пока не становятся нейтрально заряженными.
В результате электрофоретического разделения исследуемого
вещества может происходить диффузия белковых молекул из зоны фокусирования, но,
попадая в более кислую или щелочную среду, молекулы белка будут терять
нейтральность и под действием электрического поля снова возвращаться в зону
изоэлектрической точки. Если молекула положительна заряжена при условиях pH
среды, в которой она находится, то она мигрирует в сторону катода, где значение
pH выше. В процессе миграции происходит депротонирование аминогрупп и
карбоксилов молекулы, в результате чего положительный заряд уменьшается, а
отрицательный возрастает. Скорость миграции при этом уменьшается, пока молекула
не достигнет таких изменений заряда на поверхности, что станет нейтрально
заряженной, миграция при этом прекращается (Рис. 3).
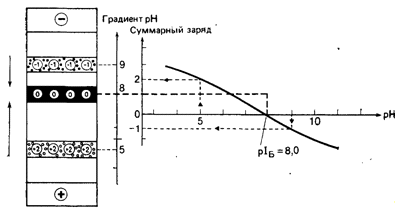
Рис. 3. Эффект фокусирования при ИЭФ, молекулы белка с pI 8,0
[25].
Для создания градиента рН применяют полимерные буферные
вещества, которые имеют положительные и отрицательные заряды и свои
изоэлектрические точки. Эти буферные вещества являются смесью синтетических
полиаминополикарбоновых кислот, называемых амфолинами (амфолитами). Они находятся
в диапазоне изоэлектрических точек (рI) от 3,0 до 10,0 единиц рН. Смесь
амфолитов помещают в стабилизационную среду и подают напряжение, в результате
распределения амфолинов создается градиент, в котором рН увеличивается в
направлении от анода (+) к катоду (-).
Отрицательный электрод притягивает положительные частицы и
отталкивает отрицательные, а положительный наоборот будет притягивать
отрицательные частицы. Катод окружен сильнощелочным раствором, таким как едкий
натрий и называется католит. Анод находится в среде сильнокислого раствора -
анолит. Промежуток между ними будет заполнен нейтральным электролитом.
Для эффективного разделения большое значение имеет подбор
католита и анолита. Чтобы предотвратить разрушение амфолитов при
соприкосновении с электродами, положительный электрод защищают с помощью
кислоты, а отрицательный электрод - щелочью. Значение pH католита и анолита
должны превышать крайние значения применяемой смеси амфолитов.
В качестве анолита часто используется слабая кислота, которая
при диссоциации дает положительно заряженный протон водорода и отрицательный
анион. В результате диффузии кислота попадает в рабочий канал, где происходит
ионизация кислоты, так как она попадает в раствор с более высоким значением pH.
Анионы, образуемые в процессе ионизации, переходят обратно в кислую среду, а
протоны взаимодействуют с амфолитами. Вследствие таких взаимодействий амфолиты
заряжаются положительным зарядом и начинают движение в среду с более щелочным
значением pH. В щелочной среде амфолиты становятся нейтрально заряжены, а
протоны взаимодействуют со следующими амфолитами. За счет всех произошедших
взаимодействий возникает слабый ток, и протоны перемещаются от анода к катоду,
а гидроксил-ионы, получаемые диссоциацией щелочи, двигаются по направлению от
катода к аноду. Сила тока также будет зависеть от области pH, при которой
используются амфолиты, и от значения pKa кислоты (анолита) и основания
(католита).
На рис.4 изображена колонка для изоэлектрического
фокусирования, где верхний сосуд 3 предназначен для кислотного буфера, в
который помещен электролит 4, а нижний сосуд 8 - для щелочного буферного
раствора, с помещенным в раствор электролитом 6. Нижний буферный раствор также
содержит сахарозу для поддержания градиента и предотвращения вытеснения из
рабочего канала 1 раствора глицерина в градиенте, содержащего амфолины и
препарат, через диализный мешок 7. Так как в процессе фокусирования может
происходить нагревание рабочей области из-за электрического тока, то иногда
применяют охлаждающую рубашку 2.
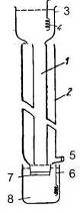
Рис. 4. Колонка для аналитического изофокусирования белков
[26].
-рабочий объем; 2-охлаждающая рубашка; 3-верхний электродный
сосуд для кислотного буфера; 4,6-электроды; 5-сифон; 7-диализный мешок; 8 -
нижний электродный сосуд для щелочного буфера.
Градиент для проведения изоэлектрического фокусирования может
быть как искусственным, так и естественным [27]. Искусственным называется
градиент pH, который образован вследствие диффузии неамфолитных буферов в
электрическом поле [28]. Градиенты такого типа не устойчивы, они часто
изменяются при диффузии и миграции ионов. Создавать стабильный искусственный
градиент pH можно за счет изменений концентраций кислотных и щелочных буферов
при проведении изофокусирования. Градиент стабилизируется за счет буферных
растворов [29]. Однако при использовании этого метода распределение идет очень
долго.
Формирование естественного градиента pH происходит под
действием электрического поля и при отсутствии конвекции молекул. Большую
устойчивость системе при формировании такого градиента придает наличие
амфолитов, которые под действием тока распределяются по принципу от анода к
катоду с возрастанием pH. Так как каждый амфолит обладает определенной буферной
емкостью, то в зависимости от этого будет прекращать миграцию в определенной
точке и создавать градиент pH. Градиент также зависит от электропроводности
амфолита, который находится в изоэлектрической точке. Устойчивость такого
градиента зависит от действия на него таких факторов, как конвекция и диффузия.
Во избежание этого в системе поддерживается постоянное напряжение, которое
предотвращает перегревание и конвекцию. Также антиконвекционной средой служит
сахароза, в градиенте плотности которой можно проводить фракционирование.
Сахароза способствует стабилизации раствора, в котором проходит
изофокусирование белков. Однако содержащиеся сахароза или глицерин, которые
используются для создания градиентной плотности, так же как содержащаяся
мочевина, которую используют для лучшего растворения белкового осадка, могут
оказывать влияние на величину изоэлектрической точки белка [30]. Присутствие в
генно-инженерных продуктах, а также некоторых высокоочищенных
биотехнологических препаратов солей в высоких концентрациях (более 0,1 М) может
искажать градиент рН и форму сфокусированных белков. Для нейтрализации этого
эффекта образцы лучше готовить в деионизованной воде или растворе глицина.
Для индикации изоэлектрического равновесия при фокусировании
применяют окрашенные маркеры. Также их применяют для визуализации и определения
развития градиентов pH. В качестве маркеров могут быть использованы окрашенные
белки.
Экспериментальная
часть
1. Реагенты и
прочие материалы
Ацетатный буфер (рН 3,6-5,6).
Растворы:
Раствор А (0,5 н. раствор СН3СООН). Влить 30 мл
ледяной уксусной кислоты в мерную колбу на 1 л и довести до метки
дистиллированной водой. Раствор Б (0,5 н. раствор CH3COONa).
Поместить 68г соли CH3COONa в мерную колбу на 1 л, растворить соль в
дистиллированной воде и довести раствор до метки.
Слить растворы А и Б в количествах
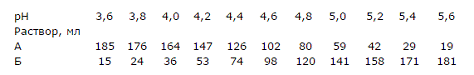
Как исходные растворы, так и сами буферные смеси могут
храниться длительное время при 8оС.
Буфер А (pH=5,5, 50мМ раствор CH3COONa): Поместить
навески 8,2г соли ацетата натрия и 720г мочевины ("Calbiochem", США)
в колбу на 2л, растворить в деионизированной воде и довести раствор до метки.
Хранится при температуре 4-8 оС. При таких условиях хранения может
быть пригоден для использования длительное время.
Трис-буфер (рН 7,2 - 9,0).
Растворы:
Раствор А (0,2М раствор трис (гидроксиметил) аминометана).
Навеску 24,3 г соли трис (гидроксиметил) аминометана поместить в мерную колбу
на 1л, растворить и довести до метки дистиллированной водой;
Раствор Б (0,1н. НСl) Влить 100мл 1н раствора HCl в мерную колбу
на 1л на 1/3 заполненную дистиллированной водой, довести дистиллированной водой
до метки.
Слить указанные количества растворов А и Б и долить до 100 мл
деионизированной водой.
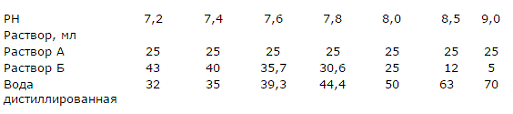
Как исходные растворы, так и сами буферные смеси могут
храниться длительное время при 8оС.
Буфер Трис-HCl (1M pH=7,85)
Навеску 60,5 г трис (гидроксиметил) аминометана
("Sigma", США), растворить в 400 мл деионизированной воды в мерной
колбе на 500 мл. Скорректировать значение рН с помощью концентрированной HCl до
7,85 на универсальном ионометре ЭВ-74 (СССР). Довести раствор деионизированной
водой до объема 500 мл. Хранить при температуре 4-8 оС. При таких
условиях хранения раствор может быть пригоден для использования длительное
время.
Буфер 1: 1M Трис-HCl (pH 7.85)
Буфер 1’: 0,1 М Трис-HCl (pH 7,85); 0,1M KCl; 10% глицирин;
2% меркаптоэтанол (M=78,13 г/моль, "Ferak Berlin", Германия); 1/100
раствора ингибитора протеаз.
Буфер 2: 1,5M Трис-HCl (pH 8,8)
Буфер 3: 50мМ Трис-HCl (pH 7,85)
Буфер 4: 100мМ Трис-HCl (pH 7,8)
Раствор ингибитора протеаз: одну таблетку Protease Inhibitor
Cocktails Mini, EDTA-free ("Roche Life Science", США) растворить в
10мл деионизированной воды.
% раствор SDS (додецилсульфата натрия): навеску 5г растворить
в 50мл дистиллированной воды.
,05% раствор бромфенолового синего: навеску 50мг растворить в
100мл дистиллированной воды.
Полиакриламидный гель
30 % раствор АА-МБА: навески 29,1 г акриламида (АА) и
0,9 г метилен-бис-акриламида (МБА) поместить в мерную колбу вместимостью 100
мл, растворить в 70 мл деионизированной воды, довести объем раствора
деионизированной водой до метки. Раствор может храниться в течение нескольких
недель при охлаждении до 8оС.
Раствор для приготовления 10% разделяющего геля:
Для получения 10% разделяющего геля к полученному раствору
добавить:
,23 мл ТЭМЭД (Тетраметилэтилендиамин);
мкл 10% ПСА (Персульфат аммония)
Растор для приготовления 3% концентрирующего
геля:
Влить 10мл АА-МБА в мерный сосуд, добавить 15мл 0,5M буфера
Трис-HCl (pH 6,8) и 240мкл 10% SDS, довести раствор до метки 60 мл
дистиллированной воды. Раствор может храниться в течение нескольких недель при
охлаждении до 8оС.
Для получения 3% концентрирующего геля к полученному раствору
добавить:
мкл ТЭМЭД;
мкл 10%ПСА
Буфер Sample: Смешать 2мл 1.5M буфера Трис-HCl (рН
6,8), 2.5мл 5% раствора глицина ("Sigma", США), 2мл меркаптоэтанола,
20мл 10% SDS, 1мл 0,05% бромфенолового синего, в мерной колбе вместимостью
50мл, довести деионизированной водой до метки. Хранить при температуре
комнатной температуре. При данных условиях хранения буфер может быть пригоден
для использования длительное время.
Электродный буфер х1
Навеску 6 г трис (гидроксиметил) аминометана и 28,8г раствора
глицерина растворить в 1л деионизированной воды, добавить 2мл 10% SDS и довести
раствор до объема 2л. pH раствора устанавливается 8.3-8.4 Хранить при
температуре комнатной температуре, раствор может быть пригоден для
использования длительное время.
Буфер (х4) для переноса белков на
нитроцеллюлозную мембрану
В нагретый до растворения кристаллов 2М глицина раствор,
объемом 770мл, добавить навеску 24г трис (гидроксиметил) аминометана, прилить
200мл этанола. Полученный раствор разбавить и довести до метки 2л
деионизированной водой. Хранить при комнатной температуре. При таких условиях
хранения, раствор может быть пригоден для использования длительное время.
Буфера х1 для переноса белков на нитроцеллюлозную
мембрану
Из приготовленного 4х буфера для переноса белков на
нитроцеллюлозную мембрану отмерить 1л и добавить к нему 800мл этанола. Довести
раствор деионизированной водой до метки 4л. Хранить при комнатной температуре.
При таких условиях хранения буфер может быть пригоден для использования
длительное время.
Трис-солевой буфер (TBS)
Навески 122 г трис (гидроксиметил) аминометана и 180 г NaCl
поместить в мерную колбу на 1л, растворить и довести до объема 1л
дистиллированной водой. Скорректировать значение рН с помощью концентрированной
HCl до 8,4. В полученный раствор добавить 10 мл Tween 20 (полиоксиэтилен
сорбитанмонолаурат) ("Ferak", Германия). Хранить раствор при
температуре - 20оС. При таких условиях хранения раствор может быть
пригоден для использования длительное время.
2. Растворы
для изоэлектрического фокусирования
Растворы для создания градиента:
Нижний (30%): В мерный сосуд вместимостью 10 мл влить 3мл
глицерина, 5мл 8М раствора мочевины, 100мкл раствора смеси ингибиторов протеаз,
500 мкл амфолинов (pH 3,5-10 "GE Healtcare", Sweden) и довести до
метки 1,4 мл препарата, приготовленного для исследования.
Верхний (5%): В мерный сосуд вместимостью 10 мл влить 0,5 мл
глицерина, 5мл 8М раствора мочевины, 100мкл раствора смеси ингибиторов протеаз,
500 мкл амфолинов и довести до метки 4 мл препарата.
Буферные растворы:
Нижний раствор pH 10: 30% сахароза, 4М мочевина, 0,02М NaOH.
К навескам 150г сахарозы и 120г мочевины добавить 0,6 мл
16,4M NaOH и разбавить 230мл деионизированной воды. Получившийся объем раствора
400мл.
Верхний раствор pH 2,0: H3PO4 10мМ.
Влить 210 мкл H3PO4 в мерный стакан
вместимостью 500мл, разбавить и довести деионизированной водой до метки 400мл.
3. Методы
исследования
Получение
биологического материала
Охлажденных лягушек Rana tempraria и Xenopus laevis
умерщвляли перерезанием шейного позвонка. Промывали дистиллированной водой и
70% спиртом. Препарировали лягушек и снимали кожу, а также извлекали нервы и
мозг. Кожу отмывали в буфере 1, затем выдерживали в двукратном объеме уксусной
кислоты в течение 20 часов или более, по мере необходимости материала, при t
4-8 оC. Нервы и мозг лягушек Rana tempraria и Xenopus laevis
содержали для каждого вида в отдельных пробирках в 70% уксусной кислоте.
Также в качестве биологического материала брали головастиков
на 39-40 стадиях развития, содержали в формалине. Препарировали, вынимали
внутренности. Тело и хвост, составляющие материала для исследования, промывали
в 50 мл деионизированной воды, к которой добавляли 1/100 раствора ингибитора
протеаз.
Гомогенизация
Далее гомогенизировали кожу в 70% уксусной кислоте в
гомогенизаторе MPW-309 ("Universal Laboratory AID type" Польша) с
вращающимися лезвиями в течение 5 минут. Размельчение производится при скорости
вращения ножей 5000 об/мин. Центрифугировали 10 минут при 3000 об/мин на
центрифуге K23 ("Heinz Janetzki" Германия). Супернатант отделяли и
использовали в дальнейшей работе.
Для таких материалов как, нервы, мозг лягушек и головастиков,
использовали гомогенизатор Поттера-Эльвейема. Гомогенизацию нервов и мозга
проводили в ледяной бане в двукратном объеме 70% уксусной кислоты, а
гомогенизацию головастиков в двукратном объеме буфера 1’, с помощью вращающегося
тефлонового пестика, в стеклянном гомогенизаторе. Для гомогенизации
потребовалось 100 движений пестика. После чего, полученный гомогенат
центрифугировали для отделения супернатанта. Гомогенат мозга и нервов
центрифугировали 10 минут при 10000 об/мин, а гомогенат головастиков при 4000
об/мин 20 мин
Полученный после центрифугирования осадок отделяли и
суспендировали в двукратном объёме 70% уксусной кислоты и буфере 1’., а затем
центрифугировали ("ELMI" Латвия) 15 мин при 13 тыс. об/мин.
Полученные после центрифугирования супернатанты объединяли,
осаждали 1,5 объёма 4М сульфата аммония и оставляли на 20 часов при 4-8 оС.
Выпавший осадок отдели на центрифуге CM-50 при 13 тыс. об/мин 15 мин. и
использовали в дальнейшем. Осадок смеси белков, полученных из мозга и нервов,
анализировали методом Вестерн-блот, а осадок смеси белков, полученных из
головастиков, разделяли методом изоэлектрического фокусирования.
Диализ
Для проведения диализа использовали супернатант, полученный
после гомогенизации кожи, добавляли к нему равный объем буфера А и помещали
полученный раствор в диализный мешок длинной 20см, шириной 150мм и с размером
пор 0,2 мкм. Диализовали против 2л буфера А, при постоянном перемешивании, при
t 8 oC, в течение 20 часов.
При использовании методики, которой пользовались в
дальнейшем, к супернатанту добавляли равный объем буфера 3 и проводили диализ
при тех же условиях против буфера 3.
Ионообменная
хроматография
Подготовка смолы КМ-целлюлозы (Whatman, Англия)
г смолы с емкостью 0,4-0,7 мэкв/г супендировали в 5-кратном
объеме воды и оставляли для набухания на 30 минут, затем декантировали от воды
и заливали смолу 0,5 М раствором NaOH (500мл) на 15 минут. После чего
декантировали ионообменник от раствора щелочи и промывали смолу
дистиллированной водой до установления слабощелочного раствора pH 8.
Суспендировали КМ-целлюлозу в растворе 0,5М HCl (500 мл) 15 минут. После чего
декантировали целлюлозу от раствора кислоты и промывали её дистиллированной
водой до значения pH 5,0. Затем несколько раз промывали смолу 0,05М ацетатным
буфером А по 15 минут и оставляли храниться в буфере А до использования при t 8оС.
Подготовка смолы ДЭАЭ-целлюлозы проходила по такой же
технологии, сначала смолу обрабатывали раствором HCl, а затем растворами NaOH и
NaCl. После чего несколько раз промывали смолу в буфере 2 по 15 минут и
оставляли храниться в буфере 2 до использования при t 8оС.
После подготовки ионообменной смолы использовали batch-метод
(метод групповой обработки) для проведения ионообменной хроматографии. Для
этого супернатант, полученный после гомогенизации кожи, смешивали со смолой и
инкубировали. После инкубации в течение 20 мин смолу отделяли
центрифугированием при 2500 об/мин в течение 5 минут. Отделенную смолу
обрабатывали следующим образом.
КМ - целлюлозу, после проведения инообменной хроматографии,
промывали равным объемом буфера А, после чего декантировал смолу от буфера и
проводили элюцию 0,3 М NaCl. Элюат использовали в дальнейшем в работе.
При использовании ДЭАЭ-целлюлозы проводили ионообменную
хроматографию по такой же технологии, как было описано выше, при использовании
буферной системы 2.
Изоэлектрическое
фокусирование
Отбирали Ѕ часть объема от осадка, полученного после
осаждения сульфатом аммония супернатанта, из материала головастиков. Растворяли
осадок в минимальном объеме 8М раствора мочевины. Получившийся препарат
доводили деионизированной водой до 5,4 мл и добавляли в него 20 мкл голубых
маркеров "Ferments" (США), которые содержат смесь белков с известными
массами. В 30% раствор для создания градиента для доведения раствора до метки
10мл добавляли 1,4 мл препарата.5% раствор для создания градиента доводили до
метки 10 мл, добавлением 4мл препарата.
Градиент плотности создавали с помощью двухкамерного
смесителя. В одну камеру помещали раствор с 5% содержанием глицерина, а другую
раствор с 30% содержанием глицерина. Создавали градиент глицерина в трубке для
изоэлектрического фокусирования. Более концентрированный раствор наслаивается
на анодный электролит. Концентрация глицерина уменьшалась вверх по трубке.
Поверх градиента наслаивали 1мл красителя 0,05% раствора бромфенолового синего.
Заполняли верхний электродный сосуд 10мМ раствором H3PO4.
Нижний сосуд заполняется раствором 30% сахарозы, 4М мочевины, 0,02М NaOH.
Проводили фокусирование под действием электрического тока,
исходящего из электродов, помещенных в растворы, в верхний раствор - анод, а в
нижний - катод. Фокусировали в течении 3-х часов при токе 200В и 20 мА первые
два часа и при токе 250В и 25 мА - один час.
После чего убирали верхний раствор и отбирали пробы по 1мл в
отдельные пробирки и измеряли уровень pH, при помощи лакмусовых бумажек. Пробы,
в которых pH начинает меняться в сторону слабокислого значения, затем
нейтрального и щелочного, отбирали для дальнейшего осаждения и анализа методом
Вестерн-блот.
Высаливание
Элюаты, полученные после ионообменной хроматографии,
концентрировали, добавлением 1,5 объема 4М сульфата аммония
("Реахим", СССР), выдерживали раствор при t 4 oC в течение
20 часов. Выпавший после этого осадок центрифугировали на центрифуге K23
("Heinz Janetzki", Германия) в течение 20 минут при 3500 об/мин.
Осадок декантировали от сульфатного супернатанта и анализировали его при помощи
метода Вестерн-блот.
В случае использовании в качестве материала нервов лягушек, в
супернатант, полученный после гомогенизации и отделенный на центрифуге, сразу
добавляли сульфат аммония и выдерживали раствор при t 8 оС в течение
суток. Выпавший осадок отделяли центрифугированием в течение 10 минут при 10000
об/мин. и использовали в дальнейшем для анализа.
Высаливание смеси белков, полученных из головастиков,
проводили 1,5 объемами 4М сульфата аммония, после изоэлектрического
фокусирования. Осадок также декантировали от сульфатного супернатанта и
анализировали при помощи метода Вестерн-блот.
Подготовка
пробы для проведения электрофореза
Из осажденных сульфотом аммония смесей белков, отбирали пробу
образца для электрофореза. Для этого растворяли осадок в минимальном количестве
воды и добавляли 1/5 объема пятикратного буфера Sample, содержащего додецилсульфат
натрия. Грели раствор на водяной бане при 100 оC, 5 минут.
Центрифугировали на центрифуге MPW-310 (Польша) при 8 тыс. об/мин 5 мин.
Полученный супернатант помещали в камеру для анализирования.
Вестерн-блот
анализ
Разделение
белков методом электрофореза в полиакриламидном геле.
Вертикальный диск-электрофорез проводили по методу Леммли в
денатурирующих условиях в ПААГ и использовали прибор Стадиера. В перевёрнутую
П-образную рамку вставляли два стекла, герметично закрепляли с помощью
резиновых прокладок. Второе стекло устанавливается на спейсеры, которые
определяют толщину геля и оставляют зазор между основанием рамки и стеклом.
Закреплялось второе стекло при помощи двух коротких прокладок от основания
рамки, по боковым стенкам, к верхней части рамки и одной длинной, по всему
периметру П-образной рамки. Последняя прокладка в дальнейшем извлекается после
полимеризации геля, так что полимеризованный гель у основания рамки в
оставленном с помощью спейсеров зазоре будет контактировать с электродным
буфером. Заливая между закрепленными стеклами гель, образуется вертикальная
пластина.
Из раствора для приготовления 10% разделяющего геля, отбирали
20 мл. В отобранный объем добавляли 122,8 мкл PSA и 34 мкл TEMED. Заливали
разделяющий гель между двумя стеклами, сверху наслаивали 1мл воды. Вначале
граница между гелем и водой исчезает, но затем вновь появляется, что указывает
на окончание процесса полимеризации. Удаляли воду с поверхности геля.
Из раствора для приготовления 3% концентрирующего геля,
отбирали 10 мл и добавляли 122,8 мкл PSA и 34 мкл TEMED. Заливали
концентрирующий гель между двумя стеклами сверху полимеризованного разделяющего
геля. На каждой пластине вели электрофорез сразу нескольких препаратов, для
этого в ходе полимеризации на верхнем крае геля формировали ряд одинаковых
углублений прямоугольной формы, куда затем и вносили различные препараты. Для
этого, в еще не заполимеризовавшийся гель, вставляли "гребенку" такой
же толщины что и между стеклами. Прямоугольные зубцы гребенки формируют карманы
для препаратов.
Прибор Стадиера для вертикального электрофореза состоит из
верхнего и нижнего электродных резервуаров прямоугольной формы, между которыми
закрепляется рамка с гелем. В месте совмещения двух резервуаров с рамкой должно
быть осуществлено уплотнение, препятствующее вытеканию буфера. В оба резервуара
помещены электроды из платиновой проволоки.
Помещали рамку с гелем в электрофоретическую камеру. В камеру
для электрофореза наливали необходимое количество 1х электродным буфером, чтобы
вертикально закрепленный гель находился под слоем буферного раствора. В первую
лунку помещали 5мкл маркера "Ferments" (США), смесь белков с
известными массами, и 4 мкл рекомбинантного белка Vent-2, искусственно
синтезированного на основе клонированной последовательности ДНК, которая
кодируют белок Xvent-2, растворенная 1/500 часть в 1мл буфера Sample. В
остальные лунки помещали по 23 мкл пробы исследуемых веществ.
Под действием электрического тока исходящего из электродов,
помещенных в электродный буфер х1, проводили разделение белков от катода к
аноду при силе тока 55мА и напряжении 100В.
Для визуализации результатов электрофореза проводили перенос
белков на нитроцеллюлозную мембрану, с последующим окрашиванием белков на
мембране.
Перенос
белков на нитроцеллюлозную мембрану
ПААГ извлекали из электрофоретической камеры, удаляли
концентрирующий гель и промывали дистиллированной водой от излишнего количества
SDS, содержащегося в геле. Извлечённый из стекла гель переносили на стопку
фильтровальной бумаги Whatman 3мм, смоченной в х1 буфере для переноса на
нитроцеллюлозную мембрану. Нитроцеллюлозную мембрану с порами 0,2 мкм
("Sigma", США) перед использованием пропитывали в (х1) буфере для
переноса не менее 15 минут. После чего помещали мембрану поверх геля. На
мембрану помещали фильтровальную бумагу и удаляли пузыри воздуха между
мембраной и гелем, плотно прижимая гель к мембране. Плотно прижатую конструкцию
закрепляли и помещали в (х1) буфер для переноса.
Использовали прибор для переноса, в которой вертикально
помещали гель с мембраной, заполняли прибор (х1) буфером для переноса, и
проводили электрофорез в перпендикулярном направлении. Переход белков
осуществлялся от геля, со стороны которого находился катод, к мембране, со
стороны которой находился анод. Перенос проводили 2 часа при силе тока 100 А и
напряжении 12,5 В, или оставляли на ночь при напряжении 2.5 В
Иммунноокрашивание
После переноса на мембрану, белки на мембране окрашивали в
течение 5 минут в 0,2% растворе красителя Ponceau S, приготовленном на основе
3% ТХУ (трихлоруксусной кислоты). Затем промывали мембрану от красителя 2-3
раза дистиллированной водой и фотографировали результат.
Затем мембрану оставляли на час в растворе 5% сухого молока
"Milch" (Германия), сделанного на основе TBS (Трис-солевой буфер).
Использованный раствор молока сливали в пробирку и хранили при температуре 8оС.
Данный раствор молока может быть повторно использован для последующих опытов и
пригоден для использования длительное время.
Мембрану после обработки раствором молока обрабатывали при
постоянном перемешивании в течение 1,5 часов коньюгатом пероксидазы хрена с
антителами против белка Xvent-2, разведенных 1/500 в 10 мл TBS.
После обработки сливали коньюгат и отмывали мембрану 4 раза
10 мл TBS по 15 минут. Для визуализации исследуемого белка на мембране
проводили взаимодействие пераксидазы хрена с однокомпонентным субстратом
тетраметилбензидина (ТМБ) (США) в течение получаса и детектировали окраску.
Затем промывали мембрану дистиллированной водой и фотографировали мембрану с
окрашенными полосками белка.
Результаты
работы и их обсуждение
В предыдущих работах в лаборатории "Регуляции биосинтеза
белка" Института биохимии им.А. Н Баха РАН Ворониной А.С. и Пшенниковой
Е.С. было показано, что белок Xvent-2 есть и на поздних стадиях эмбриогенеза.
Методами иммуноокрашивания зародышей белок Xvent-2 обнаруживается в мигрирующих
мультипотентных клетках нервного гребня головастиков [31]. Это стволовые
мигрирующие клетки, дающие, как известно, начало нервным клеткам и пигментным
клеткам кожи. Известно, что клетки нервного гребня активно мигрируют на большие
расстояния и являются родоначальниками следующих клеток:
) нейронов и вспомогательных глиальных клеток сенсорной,
симпатической и парасимпатической нервной системы;
) синтезирующих адреналин хромаффинных клеток надпочечников;
) содержащих пигмент клеток эпидермиса;
) скелетных и соединительно-тканных компонентов головы.
Следовательно, клетки нервного гребня в дальнейшем развитии
помогают в образовании во взрослой особи клеток нервов, мозга, а также клеток кожного
покрова, что подтверждается исследованием различных органов и тканей лягушки
вида Xenopus laevis (шпорцевая лягушка), проведенном Ворониной А.С. и
Пшенниковой Е. С.
Анализ белкового спектра из разных тканей взрослых лягушек
выявил подобный белок только в мозге и в коже как показано на рисунке 5.
Однако окрашиваются ли в этом случае антитела именно белок
Xvent-2 или какой то другой белок, со сходным эпитопом (тот участок белка, на
который образуются антитела при иммунизации), остается неясным. Поэтому встала
задача выделить этот белок в чистом виде из зародышей, на поздних стадиях
развития, кожи или нервной ткани взрослых лягушек и идентифицировать его
методом масс-спектроскопии.
В нашем исследовании по изучению белка Xvent-2 были также
использованы лягушки вида Rana tempraria (травяная лягушка), которые более
доступны, так как их среда обитания находится в средней полосе, в отличие от
Xenopus laevis, которые обитают в Центральной и Южной Африке.
а-Окраска Ponceau S, б-иммуноокрашивание.
Поскольку до проведённой нами работы никто не выделял белок
Xvent-2 из взрослых особей лягушек, то перед нами встала задача подобрать
наиболее эффективный способ выделения белка из биологического материала, а
также способ его очистки от содержащихся примесей.
Первоначально для выделения белка использовали стандартную
методику, в которой осуществляется разрушение тканей в уксусной кислоте и
использование для дальнейшего изучения супернатанта, полученного после
центрифугирования. Супернатант содержит растворенные белки и далее проходит
очистку методом ионообменной хроматографии.
Белки необходимо выделить из клеток, для этого нужно
гомогенизировать биологический материал для создания однородной физически
стабильной смеси, в которой улучшается взаимодействие клеток с реагентами и
происходит разрушения клеточных оболочек. Первоначально для гомогенизации
использовали метод заморозки кожи лягушек в жидком азоте и растирание с помощью
фарфоровой ступки и пестика до порошкообразного состояния материала. Но данный
метод оказался малоэффективным для большого количества материала. Поэтому было
принято решение применить другой способ гомогенизации кожи - с помощью
вращающихся ножей (гомогенизатора Уорринга).
Кожу гомогенизировали в 5,0М уксусной кислоте на холоду с
добавлением 6М мочевины для лучшего растворения белка. Недиссоциированная
уксусная кислота, вследствие своей липофильности, лучше проникает внутрь через
стенку клетки и денатурирует клеточную стенку. При гомогенизации вращающимися
ножами разрушается клеточная стенка и извлекаются органеллы клетки. Для разделения
органелл использовали метод центрифугирования. Белки хорошо растворимы и
остаются в растворе, называемом супернатант, в то время как более тяжелые
органеллы оседают под действием центробежных сил.
К супернатанту добавляли ацетатный буфер А с мочевиной,
благодаря которому уксусная кислота переходит в ацетат натрия и pH среды
устанавливается равным 5,5. Также ацетатный буфер следует использовать для
катионообменников, так как в нем буферным компонентом служат анионы кислотного
остатка, наличие которых предотвращает изменение ионных сил в растворе.
Изменение ионных сил может отрицательно сказываться на эффективности
ионообменной хроматографии, так как может происходить изменение структуры
сорбента. Также изменение ионных сил может вызвать денатурацию белка или мешать
связыванию белка с ионообменником. Поэтому для проведения ионообменной
хроматографии с катионообменником КМ-целлюлозой был выбран ацетатный буфер.
Также при нейтральном значении pH карбоксиметильная группа целлюлозы
ионизирована и превращается в карбоксилат CH2OCH2COOЇ,
вследствие чего КM-целлюлоза имеет отрицательный заряд и является слабым
обменником катиона. Заряд белка зависит от числа и типа ионизированных групп,
расположенных на поверхности белка. Остатки цепей некоторых аминокислот имеют заряды.
Например, остаток лизина, имеет положительно заряженную группу, а глутаминовые
остатки заряжены отрицательно. Вся молекула белка имеет общий суммарный заряд
за счет преобладающих групп на поверхности белка, с помощью которых и
происходит связывание белка с целлюлозой.
Была проведена очистка супернатанта методом ионообменной
хроматографии на КМ-целлюлозе. Фракции белков элюировали со смолы раствором
NaCl, с помощью которого белки, связанные с катионообменником, вытесняются со
смолы, так как происходит замена положительно заряженных групп белков,
связавшихся с карбоксиметиловыми группами целлюлозы, на положительно заряженные
ионы натрия. Первоначально было проведено исследование по подбору наиболее
эффективной концентрации NaCl для элюции белков со смолы. Для этого увеличивали
концентрацию от 0,1М до 0,4М с шагом 0,1. Полученные в результате элюирования
фракции белков осаждали равным объемом 4М сульфата аммония и анализировали
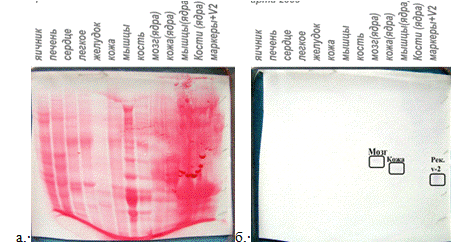
полученные осадки при помощи метода Вестерн-блот (Рис.6, дорожки 11-14). Не осевшие
в этих условиях белки элюатов осаждали повторно 1.5 объемами 4М сульфата
аммония, однако анализ полученных осадков методом Вестерн-блот показал
отсутствие белков в осадке (рис.6, дорожки 21-24). Анализ супернатантов после
осаждения 1.5-кратным объемом 4М сульфата аммония также показал, что в растворе
белков нет (рис.6, дорожка 25).

а. Окраска белка Ponceau S б.
Иммуноокрашивание
Рис. 6. Вестерн-блот фракций, полученных после
ионообменной хроматографии на КМ-целлюлозе белков из кожи.
М-маркер, рекомбинантный белок Xvent-2
-14 фракции собранные после элюции связавшегося
белка возрастающими концентрациями NaCl.
-24 - фракции, осажденные большим объемом
сульфата натрия.
-объединенная фракция
Положение рекомбинантного белка Xvent-2 должно проявляться в
области 45 кДа. Иммуноокрашивание в нашем опыте (рис.6) приводило к проявлению
белка в осадках из 11 и 12 элюатов как в виде мономеров в районе 45 кДа, так и
в виде димеров в области 80-100 кДа. Это связано с тем, что высокая
концентрация белков в в анализируемой пробе может привести к их осаждению или
образованию агрегатов: димерных, тримерных и более крупных белковых комплексов,
которые могут давать дополнительные полосы. Агрегация происходит, в основном,
за счет водородных связей [23].
В специальном опыте было оценено, весь ли белок Xvent-2
сорбируется на СМ-целлюлозе (рисунок 7). Были проанализированы фракция
исключения (не сорбировавшийся белок) (трек 1), белок элюированный со смолы
0,3М NaCl (трек 2). Элюат осаждали 1 объем 4М сульфата аммония. Анализировали
смесь белоков фракции исключения, вновь посаженную на новую порцию СМ-целлюлозы
и элюированную 0,3М NaCl. Элюат осаждали равным объемом 4М сульфата аммония
(трек 3), а затем еще раз осаждали полутора объемами сульфата аммония (трек 4).
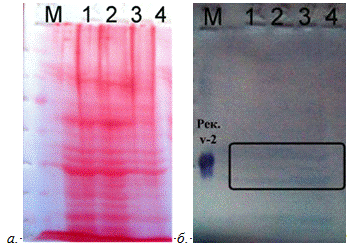
а. Окраска белка Ponceau S б. Иммуноокрашивание
Рис.7. Анализ при помощи Вестерн-блота фракций не
связавшихся с СМ-целлюлозой.
М-маркер, рекомбинантный белок Xvent-2
-фракция исключения, собранная после связывания
белка со смолой.
- фракция, собранная после элюции 0,3 М NaCl.
-фракция содержит белки, не связавшиеся с
СМ-целлюлозой, которые вновь осаждали на свежую порцию CM-целлюлозы.
-переосажденная фракция 3.
Положение рекомбинантного белка Xvent-2 проявляется во всех
пробах в области 45 кДа, это доказывает то, что большое количество исследуемого
белка не связывается со смолой. При очистке смеси белков на СМ-целлюлозе
получаются большие потери исследуемого белка, так как не хватает емкости сорбента
для удержания всех белков на СМ-целлюлозе, соответственно и исследуемого тоже.
При проведении опыта с большим количеством сорбента получали маленькие
концентрации белка, так как происходило его сильное разбавления, из-за
увеличения объема NaCl для элюирования. Полученный объем элюата не удавалась
сконцентрировать также эффективно, как это можно сделать с меньшими объемами.
Было принято решение о проведение очистки белка на
диэтиламиноэтиловой-целлюлозе. Данный вид целлюлозы содержит группу несущую положительный
заряд в нейтральной среде и является слабым анионообменником. Исследуемый белок
содержит также и отрицательные группы, то есть имеет возможность связываться с
ДЭАЭ-целлюлозой в среде ацетатного буфера. Для сравнения эффективности целлюлоз
проводили одновременно очистку супернатанта и фракции исключения на
КМ-целлюлозе и ДЭАЭ-целлюлозе. Фракцию исключения, в которой содержатся белки,
не связавшиеся с целлюлозой, с ДЭАЭ-целлюлозы и КМ-целлолозы осаждали равным
объемом 4М сульфата аммония. В то время как элюаты с обеих смол, полученные
после элюции 0,3М NaCl, осаждали полутора объемами 4М сульфата аммония.
На рис. 8 приведены результаты анализа методом Вестерн-блот
фракций исключения с СМ-целлюлозы и ДЭАЭ-целлюлозы, а также элюатов с этих
смол.
а. 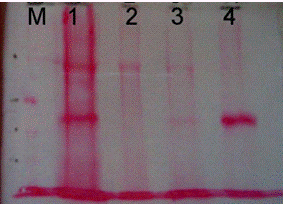
б. 
Рис. 8
Вестерн-блот фракций с СМ-целлюлозы и
ДЭАЭ-целлюлозы.
а. Окраска белка Ponceau S,
б-иммуноокрашивание.
М-маркер, рекомбинантный белок Xvent-2
- фракция содержит белки, не связавшиеся с
CM-целлюлозой.
- содержат белки, не связавшиеся с
DEAE-целлюлозой.
- фракция собранная после элюции с CM -
целлюлозы.
- фракция собранная после элюции с DEAE -
целлюлозы.
Положение рекомбинантного белка Xvent-2 проявляется в области
45 кДа. Проявление исследуемого белка происходит во второй и третьей фракциях,
в области 55кДа. Из чего можно сделать выводы, что белок частично связывается с
СМ-целлюлозой, а при взаимодействии с ДЭАЭ-целлюлозой белок Xvent2 теряется,
либо не сорбируется. Также есть вероятность что на ДЭАЭ-целлюлозе белок может
сорбироваться, но взаимодействует с сорбентом и не поддаётся элюированию.
Из-за высокой потери исследуемого белка при очистки методом
ионообменной хроматографии, данный метод посчитали не эффективным для нашего
исследования. Было принято решение использовать другие методы очистки.
Одним из таких методов является диализ, для очистки смеси
белков от примесей низкомолекулярных примесей содержащихся в супернатанте.
Метод основан на том, что молекулы белка из-за размеров не могут проходить
через полупроницаемые мембраны, в то время как низкомолекулярные вещества
равномерно распределяются между объемом, ограниченным мембраной, и окружающим
раствором. После многократной замены внешнего раствора состав среды в диализном
мешочке (концентрация солей, величина pH) будет тот же, что и в окружающем
растворе.
Из супернатанта, взятого после гомогенизации кожи и
отделенного от осадка, отбирали пробу для проведения анализа (трек 1).
Остальной раствор супернатанта разделяли на две части. Одну часть осаждали 1\2
объемами сульфата аммония, а затем разбавляли равным объемом буфера А и
диализовали против буфера А (трек 2). Другую часть супернатанта осаждали равным
объемом 4М сульфата аммония, из этого раствора отбирали пробу для анализа (трек
3), а остальной раствор разбавляли равным объемом буфера А и диализовали против
буфера А (трек 4).
Результаты анализа методом Вестерн-блот, после проведения
диализа показаны на рисунке 9
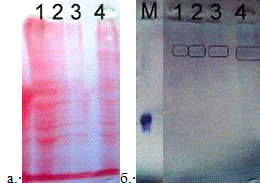
Рис. 9
Вестерн-блот полученных фракций белков после
очистки диализом.
а. Окраска белка Ponceau S,
б-иммуноокрашивание.
М-маркер, рекомбинантный белок Xvent-2
-супернатант, содержащий белки после
гомогенизации.
-супернатант, осажденный и диализованный.
- супернатант, осажденный.
- супернатант, осажденный и диализованный.
Положение рекомбинантного белка Xvent-2 проявляется в области
45 кДа. При проведении Вестерн-блота после очистки методом диализа супернатанта
в ацетатном буфере, получили результаты, в которых белок проявился в пробах с 1
по 4 только в области димеров 80-100 кДа. Данные результаты показывают,
что в исследуемом белке сохраняются водородные связи, что не является критичным
для нашего исследования, так как основная цель является идентифицировать белок
методом масс-спектроскопии. Для этого метода не мешает наличие водородных
связей и может быть определена структура димеров исследуемого белка, что
подтвердит присутствие белка Xvent-2.
Был сделан вывод о том, что если проводить диализ сразу после
гомогенизации в уксусной кислоте, то происходит сильное увеличение объема
суспензии в диализном мешке. Так как это уменьшает концентрацию белка, то белок
из большого объема сложнее выделить и сконцентрировать. В дальнейшем решили
использовать для очистки осаждение белка с помощью трис (оксиметил)
аминометана, добавление которого в сухом виде позволяло постепенно повышать
значение pH до значения, при котором целевой белок осаждается, без
значительного увеличения объема, при котором происходить сильное разбавление
белка в растворе.
При реакции с кислотой трис (оксиметил) аминометан создает
буферную систему pH от 7,0 до 9,0, что позволяет избавиться от кислой среды в
супернатанте, где содержится уксусная кислота, которая может помешать
проведению Вестерн-блот анализа.
Для исследования, при каком значении pH выпадает в осадок
исследуемый белок Xvent-2, было проведено последовательное осаждения при
увеличении значения pH от кислого к нейтральному и слабощелочному. После
каждого последовательного увеличения pH раствор осаждали и отделяли выпавший
осадок. Остальной раствор осаждали дальше. После отделения осадка при значении
pH 7,5, раствор осаждали 4М сульфатом аммония и также анализировали выпавший
осадок.
Результаты анализа методом Вестерн-блот, фракций с разными
значениями pH показаны на рисунке 10.
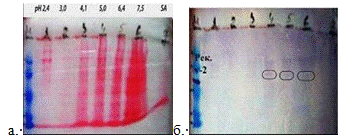
Рис. 10
Вестерн-блот полученных при осаждении белков из
кожи при помощи ступенчатого увеличения значения pH.
а. Окраска белка Ponceau S,
б-иммуноокрашивание.
М-маркер, рекомбинантный белок Xvent-2
-6 осадки собранные последовательным увеличением
значения pH
-осажденный белок, не выпавший при
последовательном увеличении значения pH.
По результатам проведённого анализа можем наблюдать, что
выпадение белка в основном происходит в области значений pH равных от 4.1 до
7.5 Положение рекомбинантного белка Xvent-2 проявляется в области 45 кДа, при
анализе белок проявляются в области 50 кДа, что соответствует значению
исследуемого белка Xvent-2.
Так как белок Xvent-2 находили на поздних стадих развития
головастиков, то было принято решение проводить исследование с выделением белка
также и из головастиков на 39-40 стадии развития. Препарировали головастиков,
вынимали внутренности, чтобы было как можно меньше примесей, в виде ферментов
содержащихся в желудочнокишечном тракте головастиков. Тело и хвост промывали в
воде с ингибитором протеаз, для предотвращения разрушения белка ферментами.
Далее для приготовления гомогената использовали гомогенизатор
Поттера-Эльвейема. Гомогенизировали в буфере трис-HCl (pH 7,85), содержащий KCl
для поддержания ионной силы раствора, глицирин для создания физиологической
среды, меркаптоэтанол, который денатурирует белки благодаря восстановлению в
них дисульфидных связей, ингибиторы протеаз для предотвращения полного распада
белков под действием ферментов, способных разрушить белки. Осаждали сульфатом
аммония. Для лучшей очистки белка от примесей, а также для отделения от другой
белков находящихся в растворе и концентрировании исследуемого белка проводили
изофокусирование, при котором белки разделяются в соответствии со своими
изоэлектрическими точками. Для лучшего растворения осадка, полученного при
осаждении, использовали раствор мочевины и добавляли к нему раствор с голубыми
маркерами, для определения места фокусирования белков из растворенного осадка.
Разделение происходит в градиенте рН, который создается за счет разной
концентрации глицерина и увеличивается в направлении от анода (+) к катоду (-).
На разделение зон pH сильно влияют амфолины, смеси синтетических
полиаминополикарбоновых кислот, имеющих изоэлектрические точки в диапазоне от
3,0 до 10,0 единиц рН.
Распределение градиента идет от наиболее щелочного значения
pH внизу электрофорезной трубки, к наиболее кислому значению pH вверху трубки
фракции, что подтверждает кислое значение pH в фракциях с 1-9. В соответствии с
чем, были отобраны пробы 10-20, с нейтральным и щелочным значением pH. После
проведения изофокусирования пробы были изучены методом Вестерн-блот (рис. 12).

Рис. 12
Вестерн-блот полученных белков из головастиков
лягушек.
М-маркер, рекомбинантный белок Xvent-2
Пробы после проведения электрического
изофокусирования:
а. Окраска белка Ponceau S,
б-иммуноокрашивание.
Положение рекомбинантного белка Xvent-2 проявляется в области
45 кДа, исследуемый белок также проявляется в области рекомбинантного
белка. По результатам данного исследования подтверждаем, что белок Xvent-2
содержится в головастиках лягушек на более поздних стадиях развития. При данных
условиях обработки материала изоэлектрическая точка белка имеет значение
соответствующее pH 7,5, так как только в пробе 15 проявляется белок в области
50 кDa. Метод изоэлектрического фокусирования может использоваться в дальнейших
опытах для того, чтобы максимально сконцентрировать, очистить и выделить белок
Xvent-2.
Как было написано ранее, белок Xvent-2 в организмах взрослых
особей
может содержаться также в клетках нервных тканей. В опытах,
описанных ранее, эксперименты проводили на коже лягушек. Однако нервы также
могут содержать белок, но объем материала, взятого для исследования, был
значительно меньше, чем в работах с кожей. Нервная ткань легче поддаётся
гомогенизации, чем кожа, поэтому для гомогенизации применяли гомогенизатор
Поттера-Эльвейема. Гомогенизировали в уксусной кислоте. Супертант помещали в
буфер трис-HCl (pH 7,85), который был использован в предыдущем опыте.
Высаливали белки полутора объемами сульфата аммония и растворяли осадок в
буфере Sample для электрофореза. Результаты, полученные при проведении анализа
методом Вестерн-блот белков из нервов, представлены на рисунке 11.

Рис.11
Вестерн-блот полученных белков из нервов в буфере
трис-HCl pH 7,85.
Рек. V-2 - рекомбинантный белок Vent-2
М-маркер,
-Нерв и мозг лягушки Rana tempraria.
а. Окраска белка Ponceau S,
б-иммуноокрашивание.
Положение рекомбинантного белка Xvent-2 проявляется в области
45 кДа, а так как исследуемый белок также проявляется в области рекомбинантного
белка, из этого следует, что в нервах содержится белок Xvent-2. Более яркая
окраска в данном опыте показывает большее наличие белка Xvent-2 в нервах, так
как при выделении из кожи мы наблюли слабую окраску.
Выводы
1. Белок Xvent-2 содержится в коже и нервах взрослых особей
лягушек, а также в головастиках на поздних стадиях развития.
. Кожа является более легко доступным материалом, чем нервная
ткань, однако выделение целевого белка из кожи затруднено вследствие содержания
в коже большого количества других белков.
. Разработан метод выделения Xvent-2, который заключается в
лучшем осаждении белковой смеси при pH 7,5, очистке и концентрирование методом
изофокусирования, с последующем осаждением сульфатом аммония и анализ белков
методом Вестерн-блот.
Для дальнейшего изучения белка Xvent-2 необходимо получить
микрограммовое количество чистого белка и идентифицировать его методом масс-спектроскопии.
Список
литературы
1. Кемп
П., Армс К. Введение в биологию/ Пер. с англ. - М: Мир, 1988. - 671 с.
2. Воронина
А.С. Трансляционная регуляция в раннем развитии. // Успехи биологии. Химии. -
2002. - Т.42. - с.139-160.
. Onichtchouk
D., Gawantka V., Dosch R.,Delius H., Hirschfeld K., Blumenstock C., Niehrs C.
The Xvent-2 homeobox gene is part of the BMP-4 signalling parthway controlling
dorsoventral patterning of Xenopus mesoderm. // Development. - 1996. - V.122. -
с.3045-3053.
. Воронина
А.С., Пшенникова Е.С. Выявление фактора транскрипции Xvent-2 в раннем развитии
Xenopus laevis. // Молекулярная биология. - 2008. - Т.42, №6. - с.1012 - 1017.
. Биохимия:
Учеб. для вузов, Под ред.Е.С. Северина., М.: ГЭОТАР-Медиа. - 2003. - 779 с.
. Srere
P. A. The infrastructure of mitochondrial matrix. // Trends Biochem Sci. -
1980. - V.5. - p.120-121.
. Tanford
C. The hydrophobic effect: Formation of micelles and biological membranes. //
2nd ed, Wiley-Interscience, New York. - 1980. - 233 p.
. Van
de Berg L., Rose D. Effect of freezing on the pH and composition of solution
and potassium phosphate solition: The reciprocal system KH2PO4
- Na2HPO4-H2O. // Arch Biochem Biophys.
- 1959. - V.81. p.319-329.
. Orii
Y., Morita M, Measurement of pH of frozen buffer solution by using pH
indicators. // J Biochem. - 1977. - V.81. - p.163-168.
. Малер
Г., Кордес Ю. Основы биологической химии. М.: Мир. - 1970. - 568 с.
. Бокштейн
Б.С. Атомы блуждают по кристаллу. М.: Наука. - 1984. - 208с.
. Сова
В.В., Кусайкин М.И. Методическое пособие к практическим занятиям по очистке
белков. - Владивосток: Изд-во Дальневост. ун-та, 2006. - 42 с.
. Остерман
Л.А. Хроматография белков и нуклеиновых кислот. М.: Наука, 1985. - 536с.
. Scopes
R. K. Techniques for protein purification in the life sciences. // Elsevie
North-Holland, Amsterdam. - 1978. - V.101 - p.1 - 42.
. Scopes
R. K. Quantitative studies of ion-exchange and affinity elution chromatography
of enzymes. // Anal Biochem - 1981. - V.114. - p.8-18.
. Кабанов
В.А. Энциклопедия полимеров. Т.3, М., "Советская энциклопедия",
1997.1152 стр. с илл.
. Самсонов
Г.В., Тростянская Е.Б., Елькин Г.Э. Ионный обмен. Сорбция органических веществ.
"Наука”, Л., 1969, 333 с.
. Гордон
А., Форд Р. Спутник химика. М.: "Мир", 1976.401 с.
. Скоупс
Р. Методы очисткибелков: Пер. с англ. - М.: Мир, 1985. - 384 с., ил.
. McKenzie
H. A., Dawson R. M. C. pH and buffers and physiological media. In: Data for
biochemical research (Dawson R. M. C., Eliott D. C., eds.) // Oxford University
Press, London. - 1969. - p.475-508.
. Perrin
D. D., Dempsey B. Buffers for pH and metal ion control // Chapman and Hall,
London, - 1974. - V.87. - p.211.
. Laemmli
U. K. Cleavage of Structural Proteins during the Assembly of the Head of
Bacteriophage T4. // Nature. - 1970. - V.227. - P.680 - 685.
. Остерман
Л.А. Методы исследования белков и нуклеиновых кислот: Электрофорез и
ультрацентрифугирование (практическое пособие). М.: Наука, 1981.288 с.
. Остерман
Л.А. Исследование биологических макромолекул электрофокусированием
иммуноэлектрофорезом и радиоизотопными методами. М.: Наука. - 1983.304 с.
. Ригетти
П. Изоэлектрическое фокусирование: Теория, методы и применение. Пер. с англ. -
М.: Мир., 1986. - 398 с., ил.
. Троицкий
Г.В., Ажинский Г.Ю. Изоэлектрическое фокусирование белков в самоорганизующехся
и искусственных pH-градиентах. - Киев: Наук. думка, 1984. - 220с.
. Svensson
H. Acta Chem. // Scand. - 1961. - V.15. - p.325-341.
. Kolin
A. Glick D. In: Metods of Biochemical Analysis. // Wiley, Interscience. New
York. - 1958. - V.6. - p.259-288.
. Ажицкий
Г.Ю., Троицкий Г.В. Изоэлектрическое фокусирование в искусственном градиенте
pH. - В кн.: Электрофоретические методы анализа белков. Новосибирск: Наука,
1981, с.23-33.
. Ригли
К.В. Электрофокусирование белков. В кн.: Новые методы анализа аминокислот,
пептидов и белков. М.: Мир, 1974, с.297-340.
. Pshennikova
E., Goncharenko A., Voronina A. The Xvent2 protein expression in multipotent
cells of the neural crest in Xenopus laevis and Rana temporaria tadpole. //
July-September 2014. - Vol.4 (3) - p.180-187.