Открытия, связанные с ролью хромосом в наследственности
МИНОБРНАУКИ
РОССИИ
ФЕДЕРАЛЬНОЕ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ
ВЫСШЕГО
ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
"БАШКИРСКИЙ
ГОСУДАРСТВЕННЫЙ ПЕДАГОГИЧЕСКИЙ
УНИВЕРСИТЕТ
ИМ.М.АКМУЛЛЫ"
ЕСТЕСТВЕННО-ГЕОГРАФИЧЕСКИЙ
ФАКУЛЬТЕТ
КУРСОВАЯ
РАБОТА
по
дисциплине "Генетика и селекция"
Открытия,
связанные с ролью хромосом в наследственности
Уфа
2015
Содержание
Введение
. Биография Т.Х. Моргана
. Эксперимент
. Методы исследования ИПСТ
.1 Перепрограммирование соматических
клеток
.2 Подтверждение принципа
использования ИПСК
.3 Перепрограммирование полностью
дифференцированных В-клеток в ИПСК
.4 Перепрограммирование клеток
печени и желудка мышей
.5 Подходы к репрограммированию
дифференцированных клеток к плюрипотентному состоянию
. Метод переноса ядра соматической
клетки в ооцит
Заключение
Выводы
Список литературы
наследственность изменчивость
стволовой клетка
Введение
Наша жизнь напрямую связана с передачей
наследственной информации в ряду поколений. Это возможно благодаря передачи
хромосом, в которых линейно или в определённой последовательности расположены
гены. Способность к воспроизведению с изменением - это одно из основных свойств
биологических систем. Главной структурой, с которой связано явление
наследственности, является клеточное ядро, а если быть точнее - содержащиеся в
нем хромосомы. В хромосомах, которые состоят из белков и нуклеиновых кислот,
материалом элементарных наследственных единиц - генов, оказались нуклеиновые
кислоты. Главная роль у ДНК, в которой генетическая информация записывается при
помощи азотистых оснований - тимина, гуанина, цитозина и аденина. В результате
учение о гене стало трактоваться не только с позиций генетики и цитологии, но и
с позиций физико-химического анализа внутреннего строения молекул ДНК. Связь между
поколениями организмов осуществляется через одну клетку для высших форм, как
правило, через оплодотворенное яйцо Наследование признаков, основой которого
служит преемственность типа обмена веществ, возможно лишь потому что в клетках
имеются определенные структуры, удваивающиеся при каждом клеточном делении.
Огромным числом наблюдений и опытов было показано, что эти структуры - в первую
очередь хромосомы клеточного ядра. Установлено, что каждый вид растений и
животных характеризуется определенным числом хромосом, причем в пределах рода
или более крупных систематических единиц это число в ряде случаев изменяется от
вида к виду. Форма и величина отдельных хромосом также очень типичны для
наборов хромосом разных видов, и, чем ближе родственные отношения между отдельными
видами, тем больше сходства в комплексах их хромосомных наборов. Это
подтверждено бесчисленным количеством наблюдений, что позволило сформулировать
закон о постоянстве числа и формы отдельных хромосом у каждого вида растений и
животных.
Генетика по праву может считаться одной из самых
важных областей биологии. На протяжении тысячелетий человек пользовался
генетическими методами для улучшения домашних животных и возделываемых
растений, не имея представления о механизмах, лежащих в основе этих методов.
Судя по разнообразным археологическим данным, уже 6000 лет назад люди понимали,
что некоторые физические признаки могут передаваться от одного поколения
другому. Отбирая определенные организмы из природных популяций и скрещивая их
между собой, человек создавал улучшенные сорта растений и породы животных,
обладавшие нужными ему свойствами. Однако лишь в XX в. ученые стали осознавать
в полной мере важность законов наследственности и ее механизмов. Хотя успехи
микроскопии позволили установить, что наследственные признаки передаются из
поколения в поколение через сперматозоиды и яйцеклетки, оставалось неясным,
каким образом мельчайшие частицы протоплазмы могут нести в себе
"задатки" того огромного множества признаков, из которых слагается
каждый отдельный организм. Наследственность заключается в способности
организмов передавать особенности строения, функции, развития своему потомству.
Наследственность обеспечивает преемственность между поколениями и обуславливает
существование видов. Кроме того, выделяют понятие наследования, подразумевая
конкретный способ передачи наследственной информации в ряду поколений, который
может быть различен в зависимости от форм размножения, локализации генов в
хромосомах и т.п. В основе наследственности лежат структурные и функциональные
возможности генетической информации клеток. Хромосомная теория
наследственности, теория, согласно которой хромосомы, заключенные в ядре
клетки, являются носителями генов и представляют собой материальную основу
наследственности.
Важным событием было открытие законов Менделя. В
1900 г. законы Менделя были переоткрыты независимо друг от друга другими
учёными - Г. де Фризом в Голландии, К. Корренсом в Германии и Э. Чермаком в
Австрии. Далее настало время важных открытий и построение различных теоретических
моделей. За относительно короткий срок (20-30 лет) в учении о наследственности
был накоплен колоссальный эмпирический и теоретический материал. Особенно
большую роль сыграла хромосомная теория наследственности, разработанная в
1910-1915 гг. в трудах А. Вейсмана, Т. Моргана, А. Стертеванта, Г.Дж. Меллера и
др. Она строилась на следующих исходных абстракциях: хромосома состоит из
генов; гены расположены на хромосоме в линейном порядке; ген - неделимая
корпускула наследственности; в мутациях ген изменяется как целое. Эта теория
была первой обстоятельной попыткой теоретической конкретизации идей, заложенных
в законах Менделя. Первые 30 лет XX в. прошли под знаком борьбы представителей
различных концепций наследственности.
Целью работы является изучить процесс
формирования хромосомной теории, изучить саму теорию хромосомной
наследственности. Узнать, что называют сцепленным наследованием, неполным
сцеплением генов, кроссинговером, наследованием, сцепленным с полом.
Задачи
.Изучить биографию Томаса Ханта Моргана.
.Изучить эксперимент на мухе дрозофиле для
исследования явления наследственности и изменчивости видов.
.Рассмотреть методы исследования.
.Подробно разобрать и изучить предположения о
сцеплении генов.
. Биография
Томас Хант Морган (англ. Thomas Hunt Morgan; 25
сентября 1866, Лексингтон - 4 декабря 1945, Пасадина) - американский биолог,
один из основоположников генетики, председатель Шестого Международного
конгресса по генетике в Итаке, Нью-Йорк (1932). Лауреат Нобелевской премии по
физиологии и медицине 1933 года "За открытия, связанные с ролью хромосом в
наследственности"
Томас Хант Морган родился 25 сентября 1866,
Лексингтон, штат Кентукки. С раннего возраста начал интересоваться
естествознанием и точными науками. Позже он 2 летних сезона проводил геологические
и биологические поиски в горах Кентукки, так как работал в Геологической службе
США.
В 1886 году Морган закончил университет Кентукки
и в 1887 поступает в университет Джонса Гопкенса, который оканчивает в 1890
году, получив степень доктора философии за исследования по эмбриологии морских
пауков.
В 1888 году он начинает работу в Вудс-Хоуле.
Летом этого же года стал трудиться на государственной станции рыболовства.
В 25 лет он является профессором Женского
колледжа в Брин-Море.
В 1897 году его избрали на должность одного из
одним из попечителей станции Вудс-Хоул. Тогда же на станции он знакомится с
биологом Вильсоном из университета в Чикаго. Благодаря его совету в 1904 году
Морган занял профессорскую кафедру в Колумбийском университете.
Генетикой Морган заинтересовался впервые в 1900
году, когда внимание всего научного мира было приковано к работам Грегора
Менделя о наследовании признаков у гороха, которые он опубликовал в 1886 году.
Мендель доказал,что признаки наследуются по математическим закономерностям,
которые говорят о раздельной независимой жизни каждого признака.
В 1902 г. американский биолог Уильям С. Саттон
высказал предположение, что гипотетические "факторы" Менделя -
единицы наследственности, которые сейчас называются генами генами, -находятся
внутри или на поверхности структур клеточного ядра, - в хромосомах. Но чётких
доказательств хромосомной теории не было. Морган считал, что хромосомы не
являются носителями наследственности, а представляют собой продукты ранних
стадий развития. Также он предпочитал теорию голландского ботаника Гуго де
Фриза, считавшего, что новый вид образуется в результате мутаций.
До 1910 года Морган скорее мог считаться
антименделистом. В том же году ученый начал изучат.
Свои генетические эксперименты Морган проводил
на плодовых мушках Drosophila melanogaster.
В ходе исследований, среди подопытных мушек,
Морган с учениками, случайно обнаружили одну белоглазую и решили воспроизвести
эту генетическую особенность в одном из последующих поколений мушек. Для этого
понадобилось вырастить и изучить миллионы дрозофил, прежде чем Моргану и его
коллеги по Колумбийскому университету удалось вновь вырастить белоглазую муху.
Множество экспериментов, которые проводили с
дрозофилой, позволилио морганистам начертить карты, с помощью которых можно
определить где в хромосоме находится тот или иной ген. Это дало возможность
предположить, что в хромосомах любых растений и животных каждый ген находится в
строго определенном положении.
Морган обосновал хромосомную теорию
наследственности; установленные им закономерности расположения генов в
хромосомах способствовали выяснению цитологических механизмов законов Менделя и
разработке генетических основ теории естественного отбора.
В 1933 году Морган получил Нобелевскую премию по
физиологии и медицине "за открытия, связанные с ролью хромосом в
наследственности". Так же он был обладателем медали Дарвина (1924г.) и
медали Копли Лондонского королевского общества (1939г.). Был избран членом
Лондонского королевского общества, Национальной академии наук, Американского
философского общества, Американской ассоциации развития науки, Американского
общества натуралистов и Генетического общества Америки.
В 1928 году перешёл в Калифорнийский
технологический институт (Калтех) в Пасадене, и организовал новый биологический
отдел. Вместе с ним в новое учреждение перешли несколько его бывших студентов и
сотрудников, что позволило ему собрать прекрасный коллектив исследователей,
которые принесли славу институту в области экспериментальной биологии. После
чего многие из учеников Моргана были удостоены Нобелевской премии.
В этом институте Морган проработал до самой
своей смерти. 4 декабря 1945 года Томас Хант Морган умер в Пасадене от
желудочного кровотечения.
Выдающийся учёный исследователь оставил после
себя ряд научных работ, давших толчок в развитии, генетики. Важнейшими из них
считают: "Регенерация" (1901г.), "Экспериментальная
зоология", "Наследственность и пол" (1913г.), "Критика
теории эволюции", "Физические основы наследственности" (1932г.),
"Генетика дрозофильной мухи" (совместно с Бриджесом и Стертевантом),
"Теория гена" (1932г.).
2. Эксперимент
Морган проводил свои опыты на небольшой плодовой
мушке дрозофиле (Drosophila melanogaster). В природе она в массе разводится на
опавших и прелых фруктах, из-за чего и получила свое название. Размеры
дрозофилы не превышают 2-2,5 мм, а весит она около 1 мг. Дрозофила легко
разводится в лабораторных условиях. Развитие от яйца до взрослого насекомого
завершается в течение примерно двух недель. При этом численность потомства от
одной пары может достигать нескольких сотен особей. Кроме того, в соматических
клетках дрозофилы содержится всего четыре пары хромосом. У самок хромосомы
первой пары совершенно одинаковые, а у самцов - разные. Вытянутая половая
хромосома, присутствующая у самок в двойном числе, а у самцов в единственном,
получила название X-хромосомы, а изогнутая хромосома, присутствующая только у
самцов, - Y-хромосомы. Эти хромосомы получили название половых. Хромосомы 2-ой
- 4-ой пар у самцов и самок совершенно одинаковые и называются соматическими,
или аутосомами. Все эти особенности сделали дрозофилу излюбленным и очень
удобным объектом лабораторных исследований.

Стадии развития и кариотипы самца и самки
дрозофилы
При постановке опытов Морган использовал чистые
линии дрозофил. Для этого он сразу же после вылета мух из куколок отделял
самцов от самок. Дело в том, что в течение 6-8 часов после вылупления дрозофилы
неспособны к оплодотворению, т. е. в этот период являются девственными. В
первые 2-3 часа после вылета крылья мух остаются не расправленными, а тело -
светлым, что также служит свидетельством их девственности. Самка отличается от
самца бóльшими
размерами и заостренным на вершине брюшком. У самцов вершинные сегменты брюшка
округлены и слиты между собой, из-за чего кажутся темными. Вылетевших мух
вытряхивают на стекло, после чего отделяют самок от самцов при помощи мягкой
кисточки, помещая их в разные часовые стекла, а затем - в пробирки. В
дальнейшем из 3-5 отобранных девственных самцов и 3-5 девственных самок
формируют родительское поколение. Мух помещают в пробирку с питательной средой
для личинок на 3-5 суток. По истечении этого времени мух удаляют из пробирки.
Из отложенных яиц развивается следующее поколение дрозофил. Контролируя в ряду
поколений проявление необходимого признака, выводят чистую линию.
Для приготовления питательной среды для личинок
берут 700 см3 воды, 9 г агара, 75 г пекарских дрожжей, 25 г
сахарного песку и 25 г манной крупы. Этого количества хватает, чтобы заполнить
100 пробирок объемом 10 см3. В алюминиевую плошку помещают порцию
агара и добавляют к ней необходимый объем холодной воды. Плошку ставят на
газовую горелку и при периодическом помешивании доводят до кипения. В кипящий
раствор добавляют измельченные дрожжи и снова доводят до кипения, после чего,
постоянно помешивая, кипятят на слабом огне еще 40 минут. По мере выкипания
раствор доливают горячей водой до первоначального объема. Затем добавляют
сахарный песок и манную крупу, постоянно помешивая. Раствор вновь доводят до
кипения и кипятят еще 15 минут. После окончания варки полученную питательную
среду охлаждают до 60-70 °С и разливают в пробирки через воронку. После полного
охлаждения среды в пробирках производят ее засев, смазывая ее поверхность
дрожжами. Для этого берут свежие пекарские дрожжи, разводят их в
дистиллированной воде. По консистенции взвесь дрожжей должна напоминать молоко.
При помощи кисточки полученная взвесь тонким слоем наносят на среду в
пробирках, равномерно распределяя по ее поверхность. Подготовленные пробирки с
питательной средой закрывают ватными пробками. Приготовленную таким образом
питательную среду можно использовать в течение1-2 суток.
В одной из серии опытов Морган использовал
чистые линии дрозофил с красными и белыми глазами. Каждая линия разводилась в
чистоте, т. е. потомки первой всегда были красноглазыми, а второй -
белоглазыми. При скрещивании красноглазых и белоглазых мух их соотношение в
потомстве не всегда соответствовало закономерностям, установленным Менделем.

Модель 1. Опыты Т. Х. Моргана
При скрещивании красноглазых самок и белоглазыми
самцами все гибридные особи в первом поколении были с красными глазами. Таким
образом, красные глаза являлись доминантным признаком, а наблюдаемая картина
соответствовала менделеевским закономерностям. При скрещивании гибридов первого
поколения между собой ¾ потомства
имело красные глаза, а ¼ - белые.
На первый взгляд, это также подтверждало результаты, полученные Менделем.
Однако во втором поколении гибридов все самки были красноглазыми, тогда как
среди самцов половина имело красные глаза, а половина - белые. И это уже не
совпадало с закономерностями наследования признака, установленными Менделем.
При скрещивании между собой гибридных мух из второго поколения оказалось, что
все самцы разводились в чистоте, то есть красноглазые были носителями только
гена красноглазости, а белоглазые - только гена белоглазости. Красноглазые
самки разделились на две группы. Одни из них давали исключительно красноглазое
потомство, тогда как в потомстве других у половины самцов были красные глаза, а
у половины - белые.
3. Методы исследования ИПСТ
.1 Перепрограммирование соматических клеток
Стержневой метод перепрограммирования
(см.рисунок 6.) для получения iPS-клеток - использование вирусных векторов. В
генетический аппарат клетки включается чужеродная ДНК вируса или бактериофага и
синтезирует "свой" белок с помощью её обменных механизмов [3].
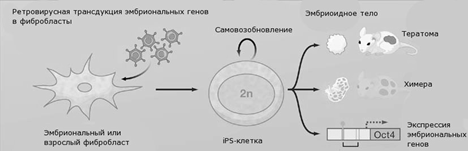
Рис.6. Схема перепрограммирования соматических
клеток[3].
.2 Подтверждение принципа использования ИПСК
Используемые системы вирусной трансфекции
встраивают гены в случайном месте в геном клетки хозяина. Это является задачей,
которую необходимо решить для клинического применения ИПСК, так как полученные
клетки могут оказаться подверженными раковым заболеваниям. Поэтому члены обоих
исследовательских групп считают необходимым найти другой способ введения генов
в клетку [3].

Рис.7. Подтверждение принципа использования
ИПСК[3].
.3 Перепрограммирование полностью
дифференцированных В-клеток в ИПСК
Без использования яйцеклеток полностью
дифференцированные В-клетки могут быть перепрограммированы в состояние, близкое
к эмбриональным стволовым клеткам (ЭСК) [4].
В-клетки - клетки иммунной системы,
связывающиеся со специфическими антигенами, такими как белки вирусов, бактерий
или микроорганизмов. В геноме В-клеток в отличие от фибробластов имеются
специфические участки ДНК, которые при терминальной дифференцировке
вырезаются[10].
Чтобы ускорить репрограммирование зрелых
В-клеток, необходим еще один фактор
CCAAT/enhancer-binding-protein-a(C/EBPa).Полученные из зрелых и незрелых
В-клеток ИПСК, также как и репрограммированные фибробласты, могут быть использованы
для создания мышей. В геноме мышей, полученных из репрограммированных зрелых
В-клеток, отсутствуют те же фрагменты ДНК, что и в геноме зрелых
В-лимфоцитов(Рис.8). Этот факт доказывает, что исследователям удалось успешно
репрограммировать терминально дифференцированные клетки[3].
По мнению исследователей, подобная методика в
будущем позволит переносить сложные генетические заболевания человека в чашки
Петри для последующего изучения и поиска терапии. Все это позволит человеку еще
ближе подойти к решению глобальной проблемы старения[12].
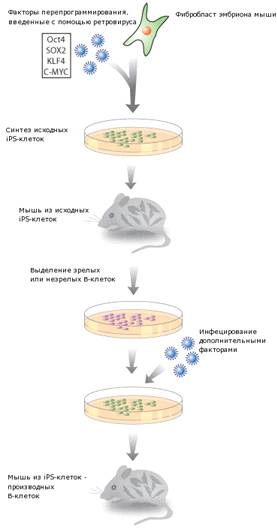
Рис.8.Схема перепрограммирования полностью
дифференцированных В-клеток в iPS-клетки[4].
.4 Перепрограммирование клеток печени и желудка
мышей
Группа Яманаки перепрограммировала мышиные
клетки печени (см.рисунок 9) и эпителиальные клетки желудка. Развитие опухоли,
содержащей все типы клеток эмбриональных листков, и экспрессия генов,
ассоциированных со стволовыми клетками, доказывает, что получены новые виды
индуцированных плюрипотентных клеток. Обратная полимеразная цепная реакция
показала, что ИПСК печени и желудка переносят, сравнимые с эмбриональными
стволовыми клетками количества эндогенных Oct3/4 и Sox2[4].
Японские ученые использовали тот же набор генов
(Oct3/4, Sox2, Klf4 и c-Myc), однако, когда c-Myc был исключен, эффективность
индуцирования понизилась совсем не так сильно, как в случае фибробластов.
Данным методом было показано, что место встраивания в ДНК генов, которые несут
ретровирусные векторы, не имеет принципиального значения[4].
Через 2 месяца после имплантации, ученые
обнаружили рост уровня человеческих печеночных белков у мышей, что
свидетельствовало об активном росте пересаженных клеток. А 9 месяцев спустя
рост клеток продолжался, и не было никаких признаков его замедления. Таким
образом, ученые уверены, что им удалось обнаружить факторы, позволяющие
проводить успешную регенерацию поврежденной или даже недееспособной печени[10].
Получение iPS-клеток огромным шагом вперед в получении ИПСК, так как количество
случаев возникновения опухолей у мышей, которым вводились эти клетки, заметно
уменьшилось. Все это говорит о том, что со временем будут получены
пациент-специфичные iPS-клетки. Данные клетки будут использоваться в
терапевтических целях для восстановления поврежденных тканей, и они не будут
вызывать рак у пациента. Все это приблизит человека еще на несколько шагов
кпобеде над старением [4].

Рис.9. Клетки печени мыши[4].
.5 Подходы к репрограммированию
дифференцированных клеток к плюрипотентному состоянию
Существует множество подходов к
репрограммированию дифференцированных клеток в плюрипотентное состояние. Данные
методы описаны в таблице с учетом их результатов и недостатков (Таблица 1).
Таблица 1.Репрограммирование дифференцированных
клеток.
|
Описание
метода
|
Результаты
репрограммирования
|
Недостатки
|
|
Перенос
ядра соматической клетки в эуклеироновый ооцит или яйцеклетку
|
Происходит
репрограммирование ядра соматической клетки в ооците, в результате
развивается целый организм
|
Низкая
эффективность. Нарушение развития у клонированных животных. Этические и
правовые ограничения.
|
|
Слияние
ЭСК и дифференцированных клеток
|
Гибриды
дифференцированных клеток и ЭСК демонстрируют все свойства плюрипотентных
клеток
|
Клеточные
гибриды не имеют нормального диплоидного набора хромосом
|
|
Пермобилизация
дифференцированных клеток и обработка белковым экстрактом из плюрепотентных
клеток
|
Обработанные
клетки экспрессируют ряд генов, характерных плюрипотентным клеткам, и могут
дифференцироваться в разные типы клеток
|
Репрограммированные
клетки демонстрируют только отдельные свойства плюрипотентных клеток
|
|
Спонтанное
репрограммирование региональных стволовых клеток к плюрипотентному состоянию
(например, клеток костного мозга)при их культивировании в условиях для
поддержания ЭСК
|
Прошедшие
репрограммирование клетки плюрипотентны, однако по своим свойствам(
морфология, патерн экспрессии генов) сильно отличаются от ЭСК
|
Низкая
эффективность
|
|
Репрограммирование
дифференцированных клеток с помощью внедрения в них вирусных векторов,
экспрессирующих гены Oct4,
Sox2, Klf4,
c-Myc
|
Соматические
клетки возвращаются в плюрипотентное состояние и по своим свойствам
становятся сходны с ЭСК
|
Инсерционный
мутагенез при интеграции вирусов. Реактивация трансгенов, в том числе и онкогена
c-Myc
|
. Метод переноса ядра соматической клетки в
ооцит
Перепрограммирование клетки впервые было
осуществлено с помощью переноса ядра. Таким методом была получена зигота , из
которой развилась известная овечка Долли. Ядро зрелой клетки пересадили в
неоплодотворенный ооцит (яйцеклетку). Благодаря этому методу стало широко
развиваться клонирование. Во всех лабораториях, изучающих стволовые клетки,
используется метод переноса ядра[4].

Рисунок 8. Схема метода переноса ядра[12] .
Методика получения ИПСТ
.Первоначально осуществляют забор требующихся
клеток у пациента.
. В ооцит помещают ядро из клетки пациента, из
которого заранее удалили ядро.
. Полученная гибридная клетка развивается до
стадии бластоцисты.
. Затем бластоциста культивируется.
. Полученные эмбриональные клетки размножаются.
.После направленной дифференцировки исследуемые
(или необходимые для терапевтического использования) клеточные ростки
изолируются.
.После они вводятся пациенту, у которого исходно
брали клетки.
Полученные клетки генетически идентичны клеткам
донора. Таким образом, возможно выращивание необходимых тканей и органов. В
этой области ведутся интенсивные разработки. Перспективность этой технологии
очень высока. На данный момент осуществляются разработки по выращиванию
искусственных органов, которые можно будет пересаживать человеку. Это реальный
путь к продлению жизни и лечению тяжелых заболеваний [10].
Заключение
Открытие того, что можно вернуть в
плюрипотентное состояние зрелые дифференцированные клетки стало поворотным в
биологии развития, эмбриологии и всей молекулярной биологии.
Синъе Яманаки сумел обернуть развитие назад
настолько, что обычная соматическая клетка стала аналогична клетке внутренней
массы бластоцисты, ранней стадии развития зародыша. Это дает право надеяться на
то, что можно заставить клетку перейти из одного дифференцированного состояния
в другое, не принимая во внимание плюрипотентность.
Индуцированные плюрипотентные стволовые клетки
имеют ряд незаменимых преимуществ по сравнению с эмбриональными стволовыми
клетками для использования в клеточной терапии.
Терапевтический потенциал ИПСК был
продемонстрирован в лечении серповидно-клеточной анемии у мышей. В ходе
эксперимента были получены ИПСК, в которых заменили дефектный ген гемоглобина
на нормальный. Данные трансплантаты прижились и стали дифференцироваться в
здоровые эритроциты с нормальным гемоглобином.
Таким образом, индуцированные плюрипотентные
стволовые клетки могут найти применение в лечении заболеваний человека. На
данный момент речь об их использовании пока не идет. Для того, чтобы внедрить
данный метод в медицину необходимо усовершенствовать методы получения ИПСК и
добиться безопасной трансплантации клеток в организм.
В настоящий момент ИПСК являются одной из самых
перспективных моделей для фундаментальных исследований процессов раннего
эмбрионального развития, механизмов дифференцировки, проявления
плюрипотентности и репрограммирования.
Выводы
.На основе экспериментов можно ускорить процесс
получения стволовых клеток путем погружения их в кислоту.
.Стволовые клетки можно репрограммировать в
любую ткань.
.Благодаря этой новейшей обработке можно
усовершенствовать технологию и сделать ее более быстрой, дешевой и безопасной.
.Данное открытие в будущем поможет предпринять
методы борьбы с раком, а также с генетическими заболеваниями.
Список литературы
. Л.Аксенова. Успехи
регенеративной биологии.//Наука и жизнь,№12, 2012,С.32-37
. А.И.Шевченко, С.П.Медведев,
Н.А.Мазурок, С.М.Закиян. Индуцированные плюрипотентные стволовые клетки//
Генетика, 2009, том 45,№2, С.160-168
. Журнал Биомолекула
[Электронный ресурс]: http://biomolecula.ru
. Журнал Микокомпас
[Электронный ресурс]: http://moikompas.ru
. Журнал Люди и Медицина
[Электронный ресурс]: http://www.peoples.ru
. Нобелевские лауреаты
[Электронный ресурс]: http://www.nobelprize.org
. Нобелевские лауреаты
[Электронный ресурс]:http://www.nobeliatorg.ru
. Журнал Nature
[Электронный ресурс]:http://www.nature.com
. Журнал Sceins
[Электронный ресурс]: http://www.sciencedirect.com
11. Gurdon J.B. (1962). The
developmental capacity of nuclei taken from intestinal epithelium cells of
feeding tadpoles.J. Embryol. Exp. Morphol. 10, 622-640
. Onder T.T., Daley G.Q.
(2012). New lessons learned from disease modeling with induced pluripotent stem
cells. Curr.Opin.Genet. Dev. doi: 10.1016/j.gde.2012.05.005