Микроклональное размножение хризантемы сорта 'Земба' методом органогенеза каллусной ткани
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИИ
Федеральное государственное бюджетное
образовательное учреждение
высшего профессионального образования
ТВЕРСКОЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Биологический факультет
Кафедра биомедицины
Микроклональное размножение
хризантемы сорта Земба методом органогенеза каллусной ткани
Дипломная работа
Пылёва Марина
Павловна
Научный
руководитель:
Костюк Н.В.,
к.б.н, доцент
Тверь
2014
Оглавление
ВВЕДЕНИЕ
. МИКРОКЛОНАЛЬНОЕ РАЗМНОЖЕНИЕ РАСТЕНИЙ
.1 Общая характеристика каллусных клеток
.2 Этапы микроклонального размножения растений
.3 Классификация методов микроклонального размножения
.4 Факторы, влияющие на процесс микроклонального размножения
. БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ХРИЗАНТЕМЫ
.1 Ботаническое описание
.2 Успехи микроклонального размножения хризантемы
. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
.1 Объект исследования
.2 Стерилизация посадочного материала
.3 Индукция каллуссогеназа
. РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
.1 Подбор оптимальных условий стерилизации растительного
материала
.2 Каллусогенез на эксплантах различной локализации
.3 Влияние фитогормонов на органогенез в культуре in vitro
. ВЫВОДЫ
. СПИСОК ЛИТЕРАТУРЫ
. ПРИЛОЖЕНИЕ
Введение
Хризантема является одной из наиболее популярных декоративно-цветочных
культур. Их выращивают не только для срезки. В последние годы все большее
распространение получили горшечные формы. Во многих странах хризантемы
выращивают круглогодично и считают одной из самых рентабельных культур.
Значительный вред хризантемам причиняют вирусные болезни, резко снижающие
урожайность и качество продукции. Наиболее эффективным методом освобождения от
вирусной инфекции является метод культуры апикальных меристем. Этот метод
является также способом массового размножения, значительно превосходящим
традиционное вегетативное размножение по выходу конечной продукции. Используя
клональное микроразмножение, можно за год получить от одного эксплантата 1010
растений вместо 104 при традиционном подходе. Важно, что растения-регенеранты,
как правило, идентичны материнским растениям, не теряют своих сортовых
признаков.
К недостаткам культуры апикальных меристем следует отнести необходимость
целенаправленного выращивания материнских растений и ограниченное число апексов
на нем. Преодолеть эту проблему в значительной мере позволяет использование
другого способа микроклонального размножения, а именно, индукции морфогенеза в
каллусной ткани. Причем каллус может быть получен практически из любых частей
растения, в том числе и из материала, считающегося отходами работы флористов -
листья, стебли, лепестки.
Сортовое многообразие хризантем в значительной степени проявляется на
уровни тотипотентности клеток и регенерационном потенциале, что вызывает
необходимость дифференцированного подхода к применению и совершенствованию
технологии клонального микроразмножения для каждого изучаемого генотипа.
Цель работы: отработка технологии микроклонального размножения кустовой
хризантемы сорта Зембла.
Задачи:
1. Подобрать оптимальные условия стерилизации
растительного материала.
2. Определить зависимость каллусогенеза от
локализации экспланта в материнском растении.
. Выявить оптимальное сочетание фитогормонов
для индукции каллусогенеза.
. Оценить влияние фитогормонов на органогенез в
культуре in vitro.
1. Микроклональное размножение
растений
Микроклональное размножение - это выращивание в пробирке на специальной
питательной среде из частей растения-донора полноценных дочерних растений,
которые затем адаптируют к обычным климатическим условиям. Этот метод,
несомненно, имеет ряд преимуществ перед существующими традиционными способами
размножения. Во-первых, все получаемые клоны - абсолютные генетические копии
исходного «родительского» растения, освобожденные от вирусов. Во-вторых, от
одного растения-донора возможно получить огромное количество потомков.
В-третьих, растения быстрее развиваются и переходят к репродуктивной фазе, что
имеет значение для селекции. Кроме того, в лабораториях такую работу можно
проводить круглый год и значительно экономить посадочные площади. Важно, что
процесс выращивания также возможно автоматизировать и внедрять в промышленных
масштабах (Егорова, 2003).
Термин "клон" был предложен в 1903 году Уэбстером (от
греческого klon - черенок или побег, пригодный для размножения растений). В
соответствии с научной терминологией клонирование подразумевает получение
идентичных организмов из единичных клеток. Этот метод имеет ряд преимуществ
перед существующими традиционными способами размножения:
- получение генетически однородного посадочного материала;
- освобождение растений от вирусов за счет использования
меристемной культуры;
- высокий коэффициент размножения (105 - 106 - для травянистых,
цветочных растений, 104 - 105 - для кустарниковых древесных растений и 104 -
для хвойных);
- сокращение продолжительности селекционного процесса;
- ускорение перехода растений от ювенильной к репродуктивной
фазе развития;
- размножение растений, трудно размножаемых традиционными
способами;
- возможность проведения работ в течение всего года;
- возможность автоматизации процесса выращивания.
Пионером клонального микроразмножения считается французский ученый Жан
Морель, который в 50-х годах двадцатого века получил первые растения -
регенеранты орхидей. В это время техника культивирования апикальных меристем in
vitro была уже хорошо разработана. Как правило, исследователи в качестве
первичного экспланта использовали верхушечные меристемы травянистых растений:
гвоздики, хризантемы, подсолнечника, гороха, кукурузы и т.д. В нашей стране
работы по микроклональному размножению были начаты в 30-х годах в лаборатории
культуры тканей и морфогенеза Института физиологии растений имени К.А.
Тимирязева РАН. Под руководством Р.Г. Бутенко были изучены условия
микроразмножения картофеля, сахарной свеклы, гвоздики, герберы и других
растений и предложены промышленные технологии. В дальнейшем исследования по
клональному микроразмножению охватили и древесные растения (Микроклональное…
2011).
Первые работы по культуре тканей древесных растений были связаны с именем
Готре, который показал, что камбиальные ткани некоторых растений способны к
каллусогенезу in vitro. Но первые растения - регенеранты осины, доведенные до
почвенной культуры, были получены лишь в середине 60-х годов Матесом.
Культивирование тканей хвойных пород in vitro долгое время редко использовалось
как объект исследования. Это было связано со специфическими трудностями
культивирования тканей, изолированных из растения. Известно, что древесные, и
особенно хвойные растения характеризуются медленным ростом, трудно укореняются,
содержат большое количество вторичных соединений (фенолы, терпены и так далее),
которые в изолированных тканях активируются. Окисленные фенолы обычно
ингибируют деление и рост клеток, что ведет к гибели первичного экспланта или
уменьшению способности тканей древесных растений к регенерации адвентивных
почек, которая с возрастом растения-донора исчезает практически полностью. В
настоящее время, несмотря на перечисленные трудности, насчитывается более 200
видов древесных растений из 40 семейств, которые были размножены in vitro
(каштан, дуб, береза, клен, сосна, ель, секвойя и другие).
Области применения микроклонального размножения разнообразны, и имеют
тенденции к их постоянному расширению. Это в первую очередь относится к
размножению in vitro взрослых древесных пород, особенно хвойных и использованию
техники in vitro для сохранения редких и исчезающих видов лекарственных
растений (Микроклональное… 2011).
1.1 Общая характеристика каллусных клеток
Каллусом называют недифференцированные клетки, являющиеся тотипотентными
и способными поэтому дать начало целому растению. Являются объектом
генетической инженерии. В биологии растений каллусом называют также клетки,
образующиеся на раневой поверхности растения в виде опробковевающей ткани,
которая возникает в результате деления пограничных с раной клеток. Каллусная
ткань способствует зарастанию ран, срастанию прививок и так далее (Получение…
2011).
Каллусная клетка имеет цикл развития такой же как у всех других клеток:
деление, растяжение, дифференцировку, старение и отмирание. Дифференцировка
каллусных клеток - вторичная. Рост каллусных тканей подчиняется общим
закономерностям. Кривая роста каллусных тканей имеет характер S-образной кривой (ростовая кривая
Сакса) и включает 5 фаз, длительность которых зависит от вида растения (рис.
1).
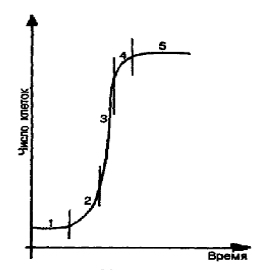
Рис. 1. Ростовая кривая Сакса
Первая фаза - латентная, или лаг-фаза, заключается в подготовке клеток к
делениям.
Вторая - фаза экспоненциального роста (логарифмическая). В это время
митотическая активность небольшая, рост идет с ускорением, масса каллуса
увеличивается.
Третья фаза - линейная, характеризуется постоянной скоростью роста
каллусной массы.
Четвертая - фаза замедленного роста, во время которой интенсивность
деления клеток резко снижается.
Во время пятой фазы - стационарной - масса каллуса не увеличивается, так
как начавшееся отмирание клеток еще компенсируется за счет их деления. Далее
следует отмирание каллуса (Егорова, 2003).
Культивируемые in vitro каллусные клетки сохраняют многие
физиолого-биохимические особенности, присущие нормальным клеткам, входящим в
состав растительного организма. Каллусные клетки сохраняют способность к
синтезу вторичных метаболитов, устойчивость к высоким, низким температурам и
осмотически активным веществам, к засолению. Каллусным тканям присуща также
фотопериодическая реакция, что связано с сохранением активности фитохрома.
Вместе с этим каллусные клетки обладают отдельными свойствами, отличающими их
от нормальных клеток. У них появляются специфические белки и уменьшается количество
белков, которые характерны для фотосинтезирующих клеток листа, либо вообще
исчезают. Каллус и каллусные клетки отличаются значительной генетической
гетерогенностью и физиологической асинхронностью.
Физиологическая асинхронность характеризуется тем, что в одно и то же
время ростового цикла одни клетки делятся, другие растут, третьи находятся в
стадии физиологической зрелости, четвертые стареют. Однако общее
физиологическое состояние оценивается асинхронной популяции оценивается по
состоянию преобладающего числа клеток.
Причины асинхронности популяции клеток in vitro различны. Одной из причин
асинхронности популяции может быть особенности вида, сорта, генотипа
индивидуального растения и экспланта, выбранных для получения первичного
каллуса. Асинхронность популяции может быть вызвана также стрессами
культивирования, в частности неоптимальной средой для данного типа клеток.
Изменение баланса эндогенных гормонов в течение цикла выращивания и
концентрации экзогенных гормонов в среде, физические факторы, такие как свет,
температура, аэрация, также могут влиять на физиологическое состояние клеток.
И, наконец, причина асинхронности популяции может быть связана с генетической
гетерогенностью клеток и клонов.
Генетическая гетерогенность - нестабильность генома. Из известных причин
этого можно выделить следующие:
. Обычно клетки экспланта выходят из митотического цикла в G1-фазе. Таким
образом, деление клеток экспланта связано с синтезом ДНК в необычных для клеток
экспланта условиях, что может привести к аномалиям митоза.
. Условия in vitro, в которых культивируется эксплант и возникает
первичный каллус при перепрограммировании клетки первых делениях каллуса, могут
быть аномальными.
. Мутагенное действие экзогенных гормонов и стимуляторов.
. Длительное субкультивирование каллусных культур, приводящее к
накоплению в популяции генетически измененных клеток и клонов.
В результате действия перечисленных факторов популяция клеток может иметь
в своем составе полиплоидные, моноплоидные и анеуплоидные клетки, а также
клетки с хромосомными аберрациями.
После периода перестройки наступает период стабилизации генома популяции.
Процесс стабилизации кариотипа разных штаммов клеток, полученных либо от
первичного каллуса, либо от разных эксплантов и трансплантов, обычно требует
около 5-6 субкультивирований при обязательном сохранении неизменных условий
выращивания. В процессе генетических изменений в клетках растений происходит их
адаптация к измененным условиям. После 5-6 пересадок стабилизация кариотипа
завершается и цитогенетическая характеристика популяции в константных условиях
выращивания бывает сравнительно устойчивой.
Следует особо отметить, что генетическую гетерогенность клеток любой
популяции не следует рассматривать как недостаток, более того, это, как
правило, необходимое условие ее существования, основа адаптационных
возможностей популяции (Биотехнология… 2011).
Каллусная ткань, выращиваемая поверхностным способом, представляет собой
аморфную массу тонкостенных паренхимных клеток, не имеющую строго определенной
анатомической структуры. Цвет массы может быть белым, желтоватым, зеленым,
красным. В зависимости от происхождения и условий выращивания каллусные ткани
бывают (Урманцева, 1988):
- рыхлые, сильно оводненные, легко распадающиеся на отдельные
клетки;
- средней плотности, с хорошо выраженными меристематическими
очагами;
- плотные, с зонами редуцированного камбия и сосудов. Как правило,
в длительной культуре на средах, содержащих ауксины, каллусные ткани теряют
пигментацию и становятся рыхлыми.
В цикле выращивания каллусной ткани клетки после ряда делений приступают
к росту растяжением, дифференцируются как зрелая каллусная ткань и деградируют.
Для того, чтобы не произошло старения, утраты способности к делению и
дальнейшему росту, а также отмирания каллусных клеток, первичный каллус
переносят на свежую питательную среду через 28-30 дней, то есть проводят
пассирование или субкультивирование каллусной ткани.
Неорганизованно растущая каллусная ткань характеризуется тремя типами
клеток: мелкими, средними и крупными. При пассировании ткани на среду,
содержащую индукторы органогенеза, мелкие клетки приступают к делению и
формируют меристематические очаги. Деление клеток меристематического очага
приводит либо к формированию почек и последующему развитию из них побегов
(геммогенез), либо к ризогенезу.
Каллусы с высоким морфогенетическим потенциалом обычно матовые,
компактные, структурированные, имеют зеленые хлорофиллсодержащие участки,
которые представляют собой зоны морфогенеза. Впоследствии там формируются
побеги или растения-регенеранты. В культуре также встречаются каллусы рыхлые,
не имеющие глобулярного характера. Такие каллусы либо совсем не способны к
органогенезу, либо формируют только корни. Появление корней свидетельствует о
сдвиге гормонального баланса в сторону ауксинов, что препятствует образованию
побегов. Эти каллусы могут остаться ризогенными, и регенерировать из них
растения не удастся (Баев,1984).
1.2 Этапы микроклонального размножения растений
микроклональный размножение хризантема каллусный
Процесс клонального микроразмножения можно разделить на 4 этапа:
1) Выбор растения-донора, изолирование эксплантов и получение хорошо
растущей стерильной культуры.
2) Собственно микроразмножение, когда достигается получение
максимального количества меристематических клонов.
) Укоренение размноженных побегов с последующей адаптацией их к
почвенным условиям, а при необходимости депонирование растений-регенерантов при
пониженной температуре (+2оС, +10оС).
) Выращивание растений в условиях теплицы и подготовка их к
реализации или посадке в поле.
Для культивирования тканей на каждом из четырех этапов требуется
применение определенного состава питательной среды.
На первом этапе необходимо добиться получения хорошо растущей стерильной
культуры. В тех случаях, когда трудно получить исходную стерильную культуру
экспланта, рекомендуется вводить в состав питательной среды антибиотики
(тетрациклин, бензилпенициллин и др.) в концентрации 100-200 мг/л. Это в первую
очередь относится к древесным растениям, у которых наблюдается тенденция к
накоплению внутренней инфекции.
На первом этапе, как правило, используют среду, содержащую минеральные
соли по рецепту Мурасига и Скуга, а также различные биологически активные
вещества и стимуляторы роста (ауксины, цитокинины) в различных сочетаниях в
зависимости от объекта. В тех случаях, когда наблюдается ингибирование роста
первичного экспланта, за счет выделения им в питательную среду токсичных
веществ (фенолов, терпенов и других вторичных соединений), снять его можно,
используя антиоксиданты. Это возможно двумя способами: либо омывкой экспланта
слабым его раствором в течение 4-24 ч, либо непосредственным добавлением в
питательную среду. В качестве антиоксидантов используют: аскорбиновую кислоту
(1 мг/л), глютатион (4-5 мг/л), дитиотриэтол (1-3 мг/л), диэтилдитиокарбомат
(2-5 мг/л), поливинилпирролидон (5000-10000 мг/л). В некоторых случаях
целесообразно добавлять в питательную среду адсорбент - древесный
активированный уголь в концентрации 0,5-1%. Продолжительность первого этапа
может колебаться от 1 до 2 месяцев, в результате которого наблюдается рост
меристематических тканей и формирование первичных побегов.
Второй этап - собственно микроразмножение. На этом этапе необходимо
добиться получения максимального количества мериклонов, учитывая при этом, что
с увеличением субкультивирований увеличивается число растений-регенерантов с
ненормальной морфологией и возможно наблюдать образование растений-мутантов.
Как и на первом этапе, используют питательную среду по рецепту Мурасига и
Скуга, содержащую различные биологически активные вещества, а также регуляторы
роста. Основную роль при подборе оптимальных условий культивирования эксплантов
играют соотношение и концентрация внесенных в питательную среду цитокининов и
ауксинов. Из цитокининов наиболее часто используют БАП в концентрациях от 1 до
10 мг/л, а из ауксинов - ИУК и НУК в концентрациях до 0,5 мг/л.
При долгом культивировании растительных тканей на питательных средах с
повышенным содержанием цитокининов (5-10 мг/л) происходит постепенное
накопление их в тканях выше необходимого физиологического уровня, что приводит
к появлению токсического действия и формированию растений с измененной
морфологией. Вместе с тем, возможно наблюдать такие нежелательные для
клонального микроразмножения эффекты, как подавление пролиферации пазушных
меристем, образование витрифицированных (оводненных) побегов и уменьшение
способности растений к укоренению. Отрицательное действие цитокининов возможно
преодолеть, по данным Н.В. Катаевой и Р.Г. Бутенко, путем использования
питательных сред с минимальной концентрацией цитокининов, обеспечивающих
стабильный коэффициент микроразмножения, или путем чередования циклов
культивирования на средах с низким и высоким уровнем фитогормонов.
Последующие этапы - укоренение микропобегов, их последующая адаптация к
почвенным условиям и высадка в поле являются наиболее трудоемкими этапами, от
которых зависит успех клонального микроразмножения. На третьем этапе, как
правило, меняют основной состав среды: уменьшают в два, а иногда и в четыре
раза концентрацию минеральных солей по рецепту Мурасига и Скуга или заменяют ее
средой Уайта, уменьшают количество сахара до 0,5-1% и полностью исключают
цитокинины, оставляя один лишь ауксин. В качестве стимулятора корнеобразования
используют β-индолил-3-масляную кислоту (ИМК), ИУК или НУК (Загоскина,
2009).
Укоренение микропобегов проводят двумя способами:
) выдерживание микропобегов в течение нескольких часов (2-24 ч) в
стерильном концентрированном растворе ауксина (20-50 мг/л) и последующее их
культивирование на агаризованной среде без гормонов или непосредственно в
подходящем почвенном субстрате (импульсная обработка);
) непосредственное культивирование микропобегов в течение 3-4 недель на
питательной среде, содержащей ауксин в невысоких концентрациях (1-5 мг/л в
зависимости от исследуемого объекта). В последнее время предложен метод
укоренения пробирочных растений в условиях гидропоники. Этот метод позволяет
значительно упростить этап укоренения и одновременно получать растения,
адаптированные к естественным условиям. Для картофеля возможно использовать
безсубстратную гидропонику для получения мини-клубней. Затенение нижней части
культуральных сосудов плотной черной материей или добавление в питательную
среду активированного угля способствует укоренению микропобегов.
Пересадка растений-регенерантов в субстрат является ответственным этапом,
завершающим процесс клонального микроразмножения. Наиболее благоприятное время
для пересадки пробирочных растений - весна или начало лета.
Растения с двумя-тремя листьями и хорошо развитой корневой системой
осторожно вынимают из колб или пробирок пинцетом с длинными концами или
специальным крючком. Корни отмывают от остатков агара и высаживают в почвенный
субстрат, предварительно простерилизованный при 85-90° С в течение 1-2 ч. Для
большинства растений в качестве субстратов используют торф, песок (3:1); торф,
дерновую почву, перлит (1:1:1); торф, песок, перлит (1:1:1). Исключение
составляют семейство орхидных, для которых готовят субстрат, состоящий из
сфагнового мха, смеси торфа, листьев бука или дуба, сосновой коры (1:1:1).
Приготовленным заранее почвенным субстратом заполняют пикировочные ящики или
торфяные горшочки, в которых выращивают растения-регенеранты. Горшочки с
растениями помещают в теплицы с регулируемым температурным режимом (20-22° С),
освещенностью не более 5 тыс. лк и влажностью 65-90%. Для лучшего роста
растений создают условия искусственного тумана. В тех случаях, когда нет
возможности создать такие условия, горшочки с растениями накрывают стеклянными
банками или полиэтиленовыми пакетами, которые постепенно открывают до полной
адаптации растений.
Через 20-30 дней после посадки хорошо укоренившиеся растения
подкармливают растворами минеральных солей Кнудсона, Мурасига и Скуга,
Чеснокова, Кнопа (в зависимости от вида растений) или комплексным минеральным
удобрением. По мере роста растений их рассаживают в большие емкости со свежим субстратом.
Дальнейшее выращивание акклиматизированных растений соответствует принятой
агротехнике выращивания для каждого индивидуального вида растений.
Процесс адаптации пробирочных растений к почвенным условиям является
наиболее дорогостоящей и трудоемкой операцией. Нередко после пересадки растений
в почву наблюдается остановка в росте, опадение листьев и гибель растений. Эти
явления связаны, в первую очередь, с тем, что у пробирочных растений нарушена
деятельность устьичного аппарата, вследствие чего происходит потеря большого
количества воды. Во-вторых, у некоторых растений в условиях in vitro не
происходит образования корневых волосков, что приводит, в свою очередь, к
нарушению поглощения воды и минеральных солей из почвы. Поэтому целесообразно
на третьем или четвертом этапах клонального микроразмножения применять
искусственную микоризацию растений (для микотрофных), учитывая их положительную
роль в снабжении растений минеральными и органическими питательными веществами,
водой, биологически активными веществами, а также в защите растений от
патогенов.
Индийскими учеными предложен простой метод предотвращения быстрого
обезвоживания листьев растений, выращенных in vitro, во время их пересадки в
полевые условия. Метод заключается в том, что листья в течение всего
акклиматизационного периода следует опрыскивать 50%-ным водным раствором
глицерина или смесью парафина, или жира в диэтиловом эфире (1:1). Применение
этого метода помогает избежать длинных и затруднительных процессов закаливания
пробирочных растений и обеспечивает 100%-ную их приживаемость (Бутенко, 1987).
1.3 Классификация методов микроклонального размножения
Существует много методов клонального микроразмножения, а также различных
их классификаций. В основе клонального микроразмножения лежит явление тотипотентности,
то есть способности растения структурно и функционально восстанавливаться из
части, органа или отдельной клетки. Тотипотентность проявляется в клетках,
называемых меристемоидами - морфогенетически компетентными клетками, которые
отвечают на индукторы дифференцировки и состав сред образованием побегов,
корней, зародыша. Их отличает крупное ядро, густая цитоплазма и небольшая
вакуоль. Такие активно делящиеся клетки расположены в недифференцированной
ткани верхушечных (апикальных) меристем, а также меристем пазушных и спящих
почек, стебля и т.п.
Образование меристематических тканей может быть индуцировано в культуре
in vitro из специализированных тканей. В этом случае возникают добавочные
меристематические ткани (процесс дедифференциации) в виде точек роста или
соматических эмбриоидов. В дальнейшем происходит регенерация из
меристематических тканей по пути органогенеза или соматического эмбриогенеза.
Добавочные меристемы формируются непосредственно в родительской ткани, из
промежуточного каллуса или клеток суспензионных культур.
Существующие методы клонального микроразмножения можно классифицировать в
зависимости от типа меристематической ткани, используемой для регенерации, а
также особенностей протекания процесса регенерации на три основных подхода:
. Активация развития уже существующих в растениях меристем (апекс стебля,
пазушные и спящие почки стебля);
. Индукция образования новых стеблевых почек или эмбриоидов
непосредственно на тканях экспланта
. Возникновение почек или эмбриоидов из первичного и пересадочного
каллуса, суспензионной культуры клеток или протопластов.
Принципиальное отличие второго и третьего подходов от первого заключается
в образовании новых меристематических зон среди специализированных клеток в
результате процесса дедифференциации. Первый подход является наиболее
естественным и предпочтительным, поскольку в нем участвуют уже сформировавшиеся
меристемы, особенностью которых является генетическая стабильность. При
использовании в качестве эксплантов дифференцированных тканей растений,
образующих адвентивные почки или эмбриоиды, вероятность появления мутантных
форм возрастает. Особенностью третьего подхода является образование почек или
эмбриоидов через стадию каллуса, суспензионной культуры или протопластов, что
еще более повышает возможность возникновения мутаций.
Активация развития уже существующих в растениях меристем является
основным методом клонального микроразмножения. Метод основан на снятии эффекта
апикального доминирования. При удалении верхушечной точки роста в пазушных
почках возрастает концентрация цитокининов, снижается концентрация ауксинов,
индуцируется клеточное деление и рост пазушных почек. Снять эффект апикального
доминирования также можно путем добавления в питательную среду цитокининов
(6-БАП, кинетин, зеатин). Под воздействием цитокининов происходит также
реювенилизация, то есть омоложение тканей. Такие ткани обладают большей
способностью к активному росту и регенерации побегов и корней.
Эксплантами для введения в культуру in vitro при этом методе служат апикальные
меристемы или кончики побегов после их стерилизации. Апикальные меристемы
используются с целью оздоровления посадочного материала от вирусной,
бактериальной и грибной инфекции. Если проблема вирусов не является актуальной,
целесообразно использовать кончики побегов. Следует иметь в виду, что чем
больше размер экспланта, тем больше вероятность его успешной пролиферации в
культуре in vitro. Однако при этом повышается и опасность инфицирования среды.
Р. Пиерик (1987) предлагает выделять метод однопочковых черенков и метод
придаточных почек. Первый не требует применения цитокининов и успешно
используется для культуры картофеля, томатов, огурцов и других культур. Второй
основан на добавлении в состав среды цитокининов и применяется для размножения
декоративных (гербера, гвоздика, розы и других), плодовых (яблоня, груша,
вишня, слива и других), ягодных (земляника, смородина, малина, ежевика и
других), лесных (береза, тополь, туя, можжевельник) растений.
Второй метод клонального микроразмножения - индукция образования новых
стеблевых почек или эмбриоидов непосредственного на тканях экспланта. Он
включает ряд процессов: дедифференциацию специализированных клеток, клеточное
деление и образование новых меристем, образование и развитие органов. Процесс
этот может происходить по пути органогенеза или соматического эмбриогенеза.
Эксплант для прямого органогенеза или соматического эмбриогенеза может быть
вычленен из многих органов растения (листа, стебля, зародыша, семядолей, чешуй
и донца луковиц, корней, апикальных или пазушных меристем). По мнению Р.
Пиерик, процесс образования адвентивных побегов лучше происходит в молодых
частях растения (зародыши, проростки) или после реювенилизации тканей. Важную
роль при этом играют углеводы, а гиббереллины и абсцизовая кислота его
ингибируют. Процесс образования адвентивных побегов из тканей листа in vitro
известен у 350 видов растений. Двудольные растения образуют почки на листьях
чаще, чем однодольные (Микроклональное… 2011).
Важным фактором является соотношение эндогенных регуляторов роста в
экспланте и экзогенных - в питательной среде. Некоторые растения (например,
цикорий) не требуют для образования адвентивных побегов ни ауксинов, ни
цитокининов. Для большинства растений, образующих адвентивные побеги,
необходимо наличие цитокининов, которому должно предшествовать наличие
ауксинов. Как правило, для таких растений необходима высокая концентрация
цитокининов и низкая - ауксинов (бегония, цветная капуста и др.). Для отдельных
растений (лилия, гиацинт) достаточно наличия в среде только экзогенных
ауксинов. В некоторых случаях возникают эмбриоиды. Такой путь характерен для
моркови, льна, рапса. Образование адвентивных почек на сегментах листьев и
чешуй чаще всего происходит из эпидермиса.
Адвентивные побеги получены при культивировании сегментов листьев,
соцветий и цветочных почек таких двудольных растений как гербера, сенполия,
бегония, маргаритка, каладиум и др; сегментов гипокотиля, семядолей, листьев -
у представителей рода Вrassica (капуста кочанная, цветная, брюссельская, листовая,
брокколи); из сегментов корней - у петунии. Достигнуты успехи в клональном
микроразмножении однодольных растений на основе получения адвентивных почек у
представителей семейств Liliaceae, Amaryllidaceae, Iridaceae (фрезия,
гиппеаструм, амариллис, гиацинт, нарцисс, гладиолусы, лилии, тюльпаны и др.).
Эксплантами в этом случае служили луковичные чешуи, сегменты донца луковицы,
листья. Третий метод клонального микроразмножения - возникновение почек или
эмбриоидов из первичного и пересадочного каллуса, суспензионной культуры клеток
или протопластов. Главная его особенность в том, что меристематические ткани
возникают в результате непрямого органогенеза или соматического эмбриогенеза.
Этому предшествует дедифференциация специализированных соматических тканей
экспланта, в качестве которого могут быть использованы практически любые органы
растения (корни, стебли, листья, цветки и др.). Главная проблема, возникающая
при клональном микроразмножении таким образом - возможные мутации (изменение
уровня плоидности, хромосомные аберрации, генные мутации и др.) в культуре
тканей, в связи с этим существуют два основных требования при использовании
такой технологии.
. Генетическая стабильность, т.е. полученный в результате размножения
материал должен быть идентичен стартовому.
. При повторном пассировании каллуса способность его к регенерации не
должна быть потеряна.
Образование адвентивных побегов возможно при преобладании концентрации
цитокининов над концентрацией ауксинов. Для успешного использования каллуса при
клональном микроразмножении растений необходимы два важных условия: а) каллус
должен содержать генетически стабильные меристематические ткани; б) каллус
должен обеспечивать получение большого числа регенерантов. Имеются сведения о
получении регенерантов из каллуса у хризантем, фрезии, томатов, лилий и других
культур. Второй возможный путь регенерации из дедифференцированных клеток
экспланта- соматический эмбриогенез. В этом случае среди клеток каллуса
возникают индуцированные эмбриогенно детерминированные клетки. Они отличаются
малым размером, плотным содержанием цитоплазмы, большим ядром и малым размером
вакуоли. Пиерик (1987) обобщил сведения ряда авторов об условиях , необходимых
для успешного соматического эмбриогенеза.
. Высокая концентрация ауксинов для индукции образования эмбриогенных
клеток. Для дальнейшего развития эмбриоидов концентрация ауксинов в среде
должна быть уменьшена или они должны быть полностью исключены из состава среды;
. Гиббереллин и этилен обычно ингибируют эмбриогенез;
. Эмбриогенезу должна предшествовать ювенилизация тканей;
. Уменьшение содержания аммонийного азота в среде является важным
фактором эмбриогенеза, наличие калия способствует эмбриогенезу, а высокая
концентрация кальция ингибирует этот процесс. Образованию эмбриоидов способствует
высокая концентрация солей в среде;
.Обычно свет способствует эмбриогенезу, однако для некоторых видов этот
процесс может протекать при слабой освещенности и в темноте.;
.Высокая температура обычно благоприятна для соматического эмбриогенеза;
некоторые растения (особенно в культуре пыльников) требуют холодового шока для
образования эмбриоидов;
. Оптимальная концентрация сахарозы 2-3 %.
Соматический эмбриогенез редко используется в практике микроклонального
размножения в связи высокой вероятностью мутаций, трудностью метода,
возможностью потери способности к регенерации при длительном пассировании
каллуса. Его применяют для тех культур, где не отмечено повышение мутабильности
(например, масличная пальма).
Возможно получение адвентивных побегов или эмбриоидов через стадию
каллуса из одиночных клеток (суспензионная культура, культура протопластов).
Получены положительные результаты в этом направлении у табака, моркови, спаржи
и других культур. Проводятся исследования по разработке массового соматического
эмбриогенеза с целью получения искусственных семян. Соматические эмбриоиды, в
отличие от семян, полученных после оплодотворения из зиготы не имеют запаса
питательных веществ. С этой целью эмбриоиды помещают в специальные полоски или
капсулы с запасом питательных веществ. Возможен также посев искусственных семян
в грунт с током жидкости. После разработки экономически оправданных технологий
посева таким способом в перспективе можно будет размножать уникальные генотипы.
Особую значимость такие технологии могут приобрести для размножения растений,
не образующихся семян, а также растений, у которых половое размножение
затруднено (стерильные формы при получении гетерозисных гибридов и др.).
Кроме того, в некоторых случаях он является единственно возможным способом
размножения растений в культуре тканей. Через каллусную культуру успешно
размножаются сахарная свекла, злаковые, представители рода Brassica,
подсолнечник и другие культуры (Глеба, 1981).
1.4 Факторы, влияющие на процесс микроклонального размножения
На эффективность микроклонального размножения влияет масса факторов
различной природы. Это физиологические особенности вводимого в культуру
растения, химические и физические условия культивирования. Наиболее важным
моментом является выбор материнского растения и экспланта.
При выборе материнского растения необходимо учитывать его
физиологические, сортовые и видовые особенности. Исходные растения должны быть
здоровы, не поражены грибными, бактериальными и вирусными болезнями. Кроме
того, они должны находится в состоянии интенсивного роста (выход из фазы покоя
и переход к активному росту). Луковицы, корневища и клубни в состоянии покоя
непригодны, перед введением в культуру их предварительно обрабатывают высокими
или низкими температурами. Способность к размножению также детерминирована
генетически. Например, земляника размножается всеми способами, облепиха - ни
одним, хотя в природе черенкуется. Двудольные обладают большей регенерационной
способностью, чем однодольные и древесные (Факторы… 2011).
При выборе экспланта необходимо учитывать его возраст, строение и
происхождение. Для обеспечения максимальной стабильности клонируемого
материала, во избежание появления аномальных растений в качестве экспланта
желательно использовать молодые, слабодифференцированные ткани. Кроме того,
экспланты от ювенильных растений лучше укореняются, чем от зрелых, особенно это
касается древесных пород. Лучше всего использовать кончики стеблей, пазушные
почки, зародыши, молодые листья, черенки, соцветия, чешую луковиц, то есть
экспланты, содержащие меристемы. Опыты с эмбрионами кукурузы, проведенные
Грином и Филипсом в 1975 году, показали, что при извлечении эмбрионов из зрелых
семян они образуют каллус и корни. Если же изолировать их через 2 - 3 недели
после опыления, то образуются и каллус, и растения. Вероятно, это связано с
разворачиванием генетической программы в онтогенезе растения. Следует отметить,
что не всегда молодые ткани являются удачным объектом для размножения. У
эхеверии на эксплантах из молодых листьев возникают только корни, из старых -
только побеги, из средних по возрасту - и побеги, и корни. Чем меньше размер
экспланта, тем меньше его регенерационная способность. С другой стороны, в
крупном экспланте увеличивается возможность появления в его клетках вирусов и
других патогенов, что препятствует оздоровлению тканей.
Длительность культивирования также влияет на эффективность
микроразмножения. Физиологическое состояние экспланта меняется в течение
пассажей, при длительном культивировании частота укореняемости побегов возрастает.
Возможно, что при этом эксплант приобретает признаки ювенильности, что ведет к
повышению его морфогенетического потенциала.
Стерилизация. Успех введения в культуру часто определяется эффективностью
стерилизации. Выбор стерилизующего агента определяется особенностями экспланта.
Для нежных тканей концентрация стерилизующего агента должна бать снижена, чтобы
сохранить жизнеспособность экспланта. Часто внутреннее заражение исходных
эксплантов бывает намного сильнее, чем поверхностное, поэтому экспланты предварительно
обрабатывают фунгицидами и антибиотиками против грибной и бактериальной
инфекций. Хорошие результаты дает обработка растений бензоатом натрия.
При культивировании in vitro соблюдают определенные правила асептики в
ламинар-боксе. В этом случае асептика достигается подачей профильтрованного
стерильного воздуха, направленного из ламинар-бокса наружу, на работающего.
Чистую посуду, предварительно завернутую в бумагу или фольгу, стерилизуют
сухим жаром в сушильном шкафу при температуре 160 градусов в течение 1,5-2
часа.
Инструменты перед работой стерилизуют спиртом.
Растительные ткани сами по себе могут служить серьезным источником заражения,
так как на их поверхности всегда находится эпифитная микрофлора. Поэтому
необходима поверхностная стерилизация, которую проводят следующим образом.
Предварительно часть растения, которая необходима для работы, промывают водой с
мылом и ополаскивают проточной водой. Затем растительный материал стерилизуют в
растворах дезинфицирующих веществ (спирт, хлорамин). После выдерживания в
дезинфицирующих растворах части растения несколько раз несколько раз промывают
в дистиллированной воде.
Питательные среды. В зависимости от вида растений необходимо испытывать
как твердые, так и жидкие питательные среды. Иногда жидкие среды имеют
преимущество, так как обеспечивают большую подвижность трофических элементов.
Например, при размножении роз более успешным было культивирование побегов на
двухслойной питательной среде: нижний слой - агаризованный, верхний - жидкий.
На эффективность размножения могут также влиять расположение экспланта
(горизонтальное или вертикальное), тип пробок (ватные, пластмассовые,
стеклянные, металлические и так далее), а также соотношение объема эксплантов и
количества питательной среды для оптимального освещения и газообмена
эксплантов.
Состав питательной среды необходимо подбирать для каждого вида растений.
На клональное микроразмножение влияют гормоны, минеральные соли, витамины и
углеводы. При микроразмножении in vitro часто используют среды Мурасиге и
Скуга, Линсмайера и Скуга, Шенка и Хильдебрандта, Нича, Гамборга, Хеллера и
другие. Обычно используют среду Мурасиге-Скуга, которая содержит много
неорганического азота, что стимулирует процессы органогенеза и соматического
эмбриогенеза. Вообще вопрос оптимального соотношения NH4 : NO3 остается
открытым, так как универсального рецепта для всех видов растений нет. В
качестве источника углеродного питания используют различные углеводы типа
сахарозы, глюкозы, фруктозы, галактозы. Разные культуры требуют различной
концентрации углеводов на разных этапах клонального микроразмножения.
При приготовлении твердых питательных сред для поверхностного выращивания
каллусных тканей используют очищенный агар-агар - полисахарид, получаемый из
морских водорослей.
Среда Мурасиге и Скуга - самая универсальная. Она пригодна для
образования каллусов, поддержания неорганизованного каллусного роста, индукции
морфогенеза у большинства двудольных растений. Так, изменение соотношения
ауксина и кинетина приводит к образованию либо корней (преобладание ауксина),
либо стеблевых культур (преобладание кинетина).
Среда Гамборга и Эвелега хорошо подходит для культивирования клеток и
тканей бобовых растений и злаков; среда Уайта обеспечивает укоренение побегов и
нормальный рост стебля после регенерации; среда Нича и Нич пригодна для
индукции андрогенеза в культуре пыльников (Питательные… 2011)
Образование и рост каллусной ткани контролируется фитогормонами типа
ауксинов и цитокининов. Под действием ауксинов происходит дедифференцировка, а
под влиянием цитокининов - интенсивное деление, в результате которого
образуется ткань.
Спонтанное образование каллусной ткани в природе мы можем наблюдать на
месте повреждения. Каллусные клетки затягивают рану, а впоследствии
дифференцируются в утраченные ткани растения. Например, когда вы черенкуете
розы или другие древесные растения, то на месте нижнего среза, погруженного в
воду вырастает мозолеобразое образование - каллус, из которого затем
формируются корни, происходит укоренение черенка. Очень часто каллус
формируется на поврежденных корнеплодах моркови (особенно в месте среза
листьев), на черешках кочанов капусты.
Каллусную ткань также можно получить на искусственных питательных средах,
включающих фитогормоны, используя фрагменты самых разных частей растения:
стеблей, корней, тканей клубня, листьев, зародышей, семядолей и т.д. Такие
фрагменты называются эксплантами (Микроклональное… 2011).
К физическим факторам выращивания относятся температура и условия
освещения. Большинство каллусных тканей могут расти в условиях слабого
освещения или в темноте, так как не способны фотосинтезировать. Вместе с тем
свет может выступать как фактор, обеспечивающий морфогенез и активирующий
процессы вторичного синтеза. Высокая интенсивность света может вызывать хлорозы
и задерживать развитие, но при переносе в почву эти растения чувствуют себя
лучше и растут энергичнее. Спектральный состав также играет немаловажную роль.
Некоторые исследователи указывают на синий свет как основной компонент
морфогенеза. Красный свет стимулирует образование почек у табака, у салата -
образование побегов, у березы - укоренение. В работах Т.Н. Константиновой с
соавторами (1987) показано, что синий свет усиливает закладку вегетативных
почек у побегов табака в условиях in vitro , а красный стимулирует развитие
цветочных почек. Однако при добавлении цитокининов и ауксинов в различной
концентрации соотношение процессов дифференциации цветочных и вегетативных
почек меняется, в некоторых случаях наблюдается даже противоположный эффект. В
исследованиях Р. А. Карначук и Е. С. Гвоздевой (1998) наибольший выход
морфогенных каллусов пшеницы, формирующих растения и побеги, отмечен на зеленом
свету. Важное значение играет также сочетание спектрального состава света и
гормональных факторов среды (Константинова, 1988).
Температура культивирования обычно варьирует в интервале 22 - 26оС днем и
18 - 22оС ночью. В некоторых случаях понижение температуры ведет к повышению
эффективности размножения. Для повышения коэффициента размножения необходимо
каждому виду с учетом его естественного ареала произрастания подбирать
индивидуальные условия культивирования. Относительная влажность воздуха - 65 -
70% (Бекер, 1990).
Таким образом, микроклональное размножение зависит от многих факторов
внешней среды, и действие их не всегда хорошо известно. Поэтому при введении в
культуру нового вида растений необходимо прежде всего тщательно изучить влияние
физических факторов на рост и физиологические характеристики этой культуры.
2. Биологические особенности хризантемы
.1 Ботаническое описание
Систематическое положение:
Царство: Растения
Отдел: Покрытосеменные
Класс: Двудольные
Порядок: Астроцветные
Семейство: Астровые
Род: Хризантема
Растения однолетние и многолетние, травянистые или полукустарники. Стебли
голые или опушенные. Листья расположены в очередном порядке, простые, цельные,
зазубренные, выемчатые или рассеченные, различные по величине и форме,
опушенные или нет, преимущественно светло-зеленые. Цветки мелкие, собраны в
соцветие - корзинку, у некоторых видов крупную, состоящую, как правило, из
трубчатых желтых цветков в середине и краевых - язычковых, разнообразно
окрашенных и обычно расположенных однорядно, у многих гибридных сортов они
располагаются многорядно и образуют так называемое "махровое"
соцветие. Плод семянка без опушения (Хризантема… 2011).

Рис. 2. Хризантема (Chrysanthemum)
Хризантемы сегодня входят в список наиболее популярных цветочных культур,
которые распространены по всему миру. Для потребителя предлагаются как
срезочные, так и горшечные, садовые и тепличные растения. По объему продаж
хризантемы уступают только розам. Более чем за 2000-летнию историю культуры создано
около 7000 сортов хризантем, часть из которых используют в кулинарии, в
фармацевтической промышленности, а также в качестве инсектицидов.
В настоящее время существует много различных сортов хризантем
отечественной и зарубежной селекции, которые являются перспективными для
использования их в озеленении, особенно в южных районах Российской Федерации.
Для выращивания в средней полосе европейской части России предпочтение отдают
финским, немецким, английским, голландским и местным сортам; французские и китайские
используют на юге.
Выращивание хризантем часто связано с физиологическими проблемами.
Например, культивирование растений в условиях ограниченного пространства
питания часто приводит к угнетению роста, нарушению образования бутонов и
развитию дегенеративных цветков, поражению листьев. Данные физиологические
отклонения могут привести к гибели растения (Хризантема… 2011).
В связи с тем, что хризантемы размножают в основном вегетативно, в их
искусственных популяциях происходит существенное накопление различных
заболеваний. Наибольший урон наносят в этом случае вирусные заболевания,
которые не поддаются химическому контролю. Распространение вирусов диктует
необходимость постоянно поддерживать высокий уровень агрофона, а также вести
активную селекционную работу, позволяющую проводить быструю смену сортов.
Частично эта проблема может решаться за счет размножения безвирусного материала
в культуре тканей и клеток растений in vitro.
Среди болезней хризантем особенно деструктивными являются грибные
заболевания. Из них наибольшую опасность представляют разные пятнистости,
например черная пятнистость, белая пятнистость (мильдью), а также ржавчинные
грибы, стеблевые гнили, корневые гнили, вертициллез и др. Эти заболевания
особенно сильно проявляются при нарушении условий выращивания - на тяжелых
почвах и при избыточном их увлажнении, при повышенной влажности воздуха и
плохой вентиляции, низких температурах и т.д. Существенный урон хризантемам
наносят также бактериальные заболевания, из которых наиболее опасными являются
бактериальная гниль стеблей, вызываемая бактерией псевдомонас цикории,
бактериальное увядание, вызываемое эрвинией хризантеми, и бактериальный рак,
вызываемый агробактериумом тумефациенс. Борьба с бактериальными заболеваниями
представляет серьезные трудности, так как большинство доступных химических
препаратов имеет противогрибную активность. Обычно рекомендации сводятся к
уничтожению пораженного растения и жесткой дезинфекции места, где оно росло.
Хризантемы часто поражаются многими оранжерейными вредителями. Серьезную
проблему могут представлять листовые и корневые нематоды, но при соблюдении
правил агротехники эта проблема решаема. Листовые нематоды обычно
распространяются при использовании на черенки зараженных маточников, а корневые
- при плохой стерилизации почвы. Химические методы борьбы с ними мало
эффективны. Признаком поражения нематодой является почернение нижних листьев.
При обнаружении этой болезни больные растения сжигают, хризантемы на этом месте
не сажают несколько лет.
Хризантемы активно поражаются несколькими видами тлей, которые являются
также переносчиками вирусов. Современные препараты позволяют легко
контролировать распространение этого вредителя. Серьезную опасность для этой
культуры представляют листовые минеры, бороться с ними возможно путем
интенсивной обработки химическими препаратами. Трипсы, клещи и белокрылка также
часто поражают хризантемы, и борьба с ними требует существенных усилий.
Для хризантем, выращиваемых в открытом грунте, серьезную опасность
представляют слизни, тли, минирующие моли и уховертки.
Болезненное состояние хризантем часто бывает связано с физиологическими
проблемами. Интенсивный рост в условиях ограниченного пространства питания
(особенно при выращивании в горшках) часто приводит к разным дефицитам, что
выражается в угнетении роста растений, поражении листьев и их гибели, нарушении
образования бутонов и развитии дегенеративных цветков. Сбалансированное питание
растений позволяет легко решать эти проблемы. Увядшие листья - признак
недостаточного полива. Короткий период цветения может свидетельствовать о том,
что окружающая температура чересчур высока для растения: при температуре +20°С
- +25°С соцветия быстро распускаются и увядают. Если на купленном кусте
хризантем не раскрываются бутоны, то чаще всего это происходит от того, что
растение после покупки было помещено в плохо освещенное место.
Итак, так как хризантема достаточно легко поддающееся инфицированию
растение, лучшим способом его размножения является микроклональное размножение
(Болезни… 2011).
2.2 Успехи микроклонального размножения хризантемы
Вегетативное размножение хризантем связано с существенным накоплением в
их искусственных популяциях различных заболеваний. Основной урон цветочной
продукции наносят в этом случае вирусные заболевания, которые не поддаются
химическому контролю. Наибольшее распространение в растениях хризантем получил
В вирус хризантем (ВВХ), который приводит к снижению качества товарной
продукции и привлекательности для покупателя. По прогнозам ученых в XXI веке
роль вирусных заболеваний будет возрастать, поэтому обнаружение, идентификация,
изучение строения и экспрессии генома вирусов, а также получение оздоровленного
посадочного материала является актуальной проблемой не только для цветоводства,
но и для всего растениеводства.
Оптимизирована методика диагностики ВВХ, включающая протокол выделения
РНК, набор праймеров и условия метода PCR. Выявлены сорта (Помпон сиреневый и
Лучистая), способные подавлять влияние В вируса хризантем. Установлена степень
гомологии между штаммом ВВХ, распространенным на территории Главного
Ботанического сада, и штаммами Chail и Bangalore, которая составила 94%-95%
соответственно. В результате проведенных экспериментов усовершенствована
технология клонального микроразмножения хризантем, позволяющая получать до 100
тыс. растений в год с одного узла независимо от сроков введения в культуру in
vitro. Выявлено, что распространение В вируса хризантем в пробирочных растениях
неравномерное, причем максимальная его концентрация отмечается в нижних ярусах
растений.
Проведенные исследования показали, что использование в качестве
транспланта при клональном микроразмножении хризантем только верхней части
пробирочных растений (максимально 2 междоузлия) возможно получать более
качественный посадочный материал за счет снижения нагрузки вируса на целое
растение или осуществлять оздоровление посадочного материала.
Практическая ценность исследований. Полученные данные свидетельствуют о
том, что подобранная методика по идентификации ВВХ может быть применена для
тестирования различных сортов хризантем на наличие вируса у растений разного
происхождения. Обнаружены два сорта (Помпон сиреневый, Лучистая), способные
подавлять влияние В вируса хризантем, которые являются перспективными для
дальнейшего их применения в селекционном процессе. Усовершенствованная
технология клонального микроразмножения хризантем направлена на повышение
эффективности их производства. Разработанная схема получения оздоровленных
растений хризантем может быть применена для производства качественного посадочного
материала, а также при проведении селекционных работ (Гранда, 2009).
Исследования культуры тканей хризантемы были впервые проведены Морелем и
Мартином в 1952 году. После этих опытов метод верхушечной меристемы стали
применять с целью оздоровления растений, зараженных вирусами. В настоящее время
метод культуры изолированных тканей растений нашел широкое применение не только
для получения безвирусных растений, но и для быстрого размножения сортов, у
которых при семенном размножении не получается стабильного по декоративным
качествам потомства, а также с целью получения от исходных сортов растений с
сортовыми отклонениями. Возникновение сортов при этом обусловлено мутагенным
действием регуляторов роста, которые могут вызывать поли-плоидизацию растущих
каллусных клеток. Для этого используют не только апикальную меристему растений,
но и части листьев, цветоносов, цветков (пыльники, цветоложе).
Для выращивания изолированных тканей требуется
определенный микроклимат в культивационных помещениях, стерильность всех инструментов
и питательных сред, система контроля за качеством получаемого материала
(вирусная стерильность, сохранение сорта).
Выращивание изолированных тканей делят на четыре
этапа:
) эксплантация (вычленение) исходной ткани растения;
на этом этапе необходимо получить свободную от видимой инфекции ткань, добиться
ее выживания и быстрого роста;
) собственно микроразмножение, при котором нужно
обеспечить увеличение количества микрочеренков;
) укоренение полученных микропобегов и сохранение их в
прохладном помещении;
) закаливание растений, повышение их устойчивости к
внешней среде.
Метод выращивания изолированных тканей включает:
приготовление и стерилизацию питательной среды;
подготовку и стерилизацию растительного материала и
оборудования на этапе вычленения тканей;
изоляцию и посадку кусочков тканей на питательную
среду;
выращивание ткани в термостатированных условиях
(получение растений-регенератов, или vitro-растений);
пересадку растений в оранжерейные субстраты и
выращивание из них маточных растений в условиях, исключающих возможность
вирусного инфицирования;
проверку растений на наличие вирусных заболеваний и
отбор здоровых растений;
получение здорового посадочного материала от здоровых
маточников.
Развитие кусочка ткани на среде может происходить
двумя путями:
)непосредственно образуется проросток и из него
растеньице;
)образуется каллус, который затем пересаживают
(пассируют) на другую среду, где он дает начало побегам.
Развитие растительной ткани в пробирках зависит от
разных причин: размеров выделенной апикальной меристемы, соотношения в
питательной среде регуляторов роста и условий, в которых находятся растения.
Для получения растений-регенератов важно обеспечить
последовательность прохождения фаз органогенеза. Первая фаза органогенеза -
переход недифференцированной растущей ткани к образованию регенерационной
меристемы и закладке стеблевых точек роста. Эта фаза обеспечивается
преобладанием в среде цитокининов над соединениями с ауксиновой активностью.
Вторая фаза органогенеза - переход возникших образований к активному
формированию побегов и корней. Для этой фазы необходима среда с относительно
низким количеством (по сравнению со средой Мурасиге-Скуга) минеральных солей и
содержанием веществ к ауксиновой активностью. Отбор соответствующей питательной
среды для прохождения первой и второй фаз органогенеза - наиболее сложная и
важная задача. Для каждого вида, а иногда и сорта эту задачу решают отдельно,
что служит причиной многообразия питательных сред.
В основном работы по микроклональному размножению хризантемы проводятся с
использованием в качестве эксплантов листовых пластинок и стеблей. Для
образования каллуса фрагменты листовых пластинок и стеблей сажают на
питательную среду Мурасиге - Скуга в присутствии гормонов 2,4-Д и кинетина.
Через 5-10 дней наблюдается видимая пролиферация на поверхности эксплантов. А
через 2 недели образуется темно-коричневый, непрозрачный, компактный каллус.
При перенесении этого каллуса на среду Мурасиге-Скуга с содержанием гормонов 2
мг / л Кинетина и 0,2 мг / л 2,4-Д начинают прорастать побеги. Через 30 дней на
среде образуются зеленые побеги и корни.
Было замечено, что через несколько недель у каллусной культуры
замедляется рост и наблюдаются признаки старения. Старение является результатом
истощения питательных веществ, торможения питательных диффузии, испарение
сопровождается увеличением концентрации некоторых компонентов среды, накопление
метаболитов, некоторые из которых могут быть токсичными. Поэтому необходимо
пересаживать каллус и образующиеся проростки через каждые 4 недели.
Таким образом, необходимо эмпирически подбирать оптимальные условия для
процесса каллусогенеза и органогенеза хризантем из-за множества индуцирующих
факторов, подбирая их под сортовые особенности растения и характер экспланта
(Микроклональное… 2012).
3. Материалы и методы исследования
Исследование проводилось на базе кафедры биомедицины Тверского
государственного университета в период 2011-2012 гг.
3.1 Объект исследования
Объектом исследования служила хризантема кустовая сорта Зембла (Zembla). Входит в состав семейства
Сложноцветные (астровые). Родина - Юго-Восточная Азия. Это растение,
распространенное в культуре открытого грунта, но можно выращивать и в комнатных
условиях. Окраска хризантемы этого сорта может быть разнообразной, но для данной
работе были взяты растения с белыми цветками. Цветки, как правило, имеют слегка
зеленоватые лепестки в центре соцветия. Соцветия хризантем сорта Зембла
представляют собой корзинки, довольно крупные по размерам, и могут достигать от
5 до 7 сантиметров в диаметре. Чаще всего сейчас в цветочные магазины
поставляются хризантемы Зембла с тремя раскрывшимися цветками на ветке, длина
которой до 70 сантиметров. Эти цветы имеют упругие и весьма крепкие стебли
(Хризантема… 2012).

Рис. 3. Хризантема кустовая Зембла
3.2 Стерилизация посадочного материала
В качестве исходного материала использовались стебли,
листья и лепестки. Стебли растения предварительно разрезали на фрагменты. Части
растения промывали в мыльном растворе, ополаскивали водопроводной, а затем
дистиллированной водой. Растительный материал на коротко время (20 с - 1 мин)
помещали в этанол, а затем в раствор хлорного отбеливателя «Белизна» (в
разведении 1:10). Остатки стерилизующего раствора смывали в ходе троекратного
промывания стерильной дистиллированной водой (каждый раз по 10 минут).
3.3 Индукция каллуссогеназа
Материалы, необходимые для работы (инструменты, чашки Петри, стаканчики),
перед посадкой стерилизовали в сушильном шкафу при 120о С в течение часа. Все
работы с биологическим материалом проводили в ламинар-боксе.
Стерильные фрагменты стебля, листья и лепестки помещали на стерильную
керамическую плитку и фрагментировали стерильным скальпелем. Для стимуляции
каллусогененза на поверхности эксплантов делали насечки, так как механическое
повреждение является важным условием для дедифференциации клеток. Экспланты
помещали в чашки Петри со средой Мурасиге-Скуга (см. Приложение), содержащей
фитогормоны. В работе использовали цитокинины: бензиламинопурин (БАП), кинетин,
ауксины: β-индолилуксусная кислота (ИУК), a-нафтилуксуснаякислота (НУК) и
2,4-дихлорфеноксиуксусная кислота (2,4-Д). Для предотвращения высыхания
питательной среды чашки Петри заворачивали в пищевую пленку и помещали в
термостат при температуре 25 0С. Экспланты регулярно просматривали, фиксировали
образования каллуса. После фиксации небольшого количества каллуса чашки
выставляли на свет. При необходимости экспланты переносили на свежую
питательную среду с тем же или иным сочетанием гормонов.
4. Результаты собственных исследований и их обсуждение
.1 Подбор оптимальных условий стерилизации растительного материала
Процесс микроклонального размножения должен проводиться в специально
оборудованной лаборатории с высокой степенью стерильности. Кроме того, и сам
растительный материал должен быть стерильным. Получение стерильного исходного
материала является сложной задачей, так как поверхностные ткани органов
растений заражены эпифитными бактериями, грибами и их спорами. При
недостаточной стерилизации происходит заражение материала микроорганизмами,
губительными для культуры. В то же время, нельзя создавать жесткие условия
стерилизации, чтобы ткани растительного материала остались жизнеспособными для
образования каллусной ткани. Обычно режим стерилизации устанавливают
экспериментально для каждого объекта. Подбор оптимальных условий стерилизации
посадочного материала стал первой экспериментальной задачей.
Предварительно подготовленные лепестки хризантемы делили на равные порции
и помещали в различные стаканчики. Растительный материал выдерживали
фиксированное время в этаноле (96%), а потом в растворе хлорного отбеливателя
«Белизна» (разведение 1:10). После этого посадочный материал троекратно
промывали стерильной дистиллированной водой, фрагментировали и помещали на
питательную среду Мурасиге-Скуга с добавлением гормонов НУК (1 мг/л) и БАП (5
мг/л). Чашки Петри помещали в термостат и выдерживали в темноте при температуре
25 0С в течение недели. Оценивали жизнеспособность растительных эксплантов и
рост контаминантной микрофлоры.
Таблица 1
Влияние условий стерилизации на каллусогенез
Время стерилизации
|
n
|
Контаминация
|
Конаминантная микрофлора
|
Каллусогенез
|
|
этанол, с
|
«Белизна» мин
|
|
на 3 день
|
на 8 день
|
бактерии
|
грибы
|
|
|
1
|
20
|
10
|
9
|
+
|
+
|
_
|
+
|
Интенсивный
|
|
2
|
60
|
10
|
9
|
_
|
+
|
_
|
+
|
Интенсивный
|
|
3
|
20
|
12
|
9
|
_
|
_
|
_
|
_
|
Незначительный
|
|
4
|
60
|
12
|
9
|
_
|
_
|
_
|
_
|
Незначительный
|
Как видно из табл. 1, при всех апробированных условиях стерилизации
экспланты сохраняли жизнеспособность. Самые мягкие из использованных условий
(этанол - 20 с, хлорный отбеливатель - 10 мин) не давал приемлемых результатов.
Обильная контаминация наблюдалась уже через несколько дней. Хорошее
антимикробное действие демонстрировала экспозиция растительного материала в
хлорном отбеливателе в течение 12 минут. Однако при этом рост каллусных клеток
был незначительным. Поэтому было принято решение проводить стерилизацию в
режиме этанол - 60 с, хлорный отбеливатель - 10 мин, усилив предварительную
обработку детергентом.
4.2 Каллусогенез на эксплантах различной локализации
Обязательным условием дедифференцировки растительной клетки и превращения
ее в каллусную является присутствие в питательной среде фитогормонов - ауксинов
и цитокининов. Показано, что ауксины активируют СDK-протеинкиназы клеточного
цикла (cyclinedependentkinases), а цитокинины - соответствующие циклины.
Комплекс СDK-циклин необходим для запуска клеточного деления.
Характерно, действие одного и того же гормона в разных культуральных
системах может приводить к неодинаковой реакции клеток. Результаты во многом
зависят от содержания в ткани эндогенных гормонов, который в свою очередь
определяется физиолого-биохимическими особенностями органов растений.
На следующем этапе эксперимента оценивали каллусогенную активность
эксплантов, изолированных из разных частей растения. В работе использовали
лепестки, листья и фрагменты стебля. Стерильные экспланты помещали на
питательную среду Мурасиге-Скуга, содержащую различные фитогормоны: ауксины - β-индолилуксусная кислота (ИУК), a-нафтилуксусная кислота (НУК) и
2,4-дихлорфеноксиуксусная кислота (2,4-Д); цитокинины - бензиламинопурин (БАП),
кинетин. Сочетание гормонов и соотношение ауксин/цитокинин варьировало в
широких пределах (табл. 2).
Было замечено, что каллусная ткань лучше всего образуется на фрагментах
лепестков присутствии соотношений гормонов НУК 1 мг/л+БАП 5 мг/л. Там шло
обильное и более быстрое, чем в других чашках, разрастание каллусной ткани. На
фрагментах стебля и листьев каллус был в незначительных количествах и
образовывался очень медленно. А в чашке, где был только гормон ИУК, каллус не
образовался ни на одном экспланте, в отличие от 2,4-Д, обладающего большим
каллусогенным действием.
Во всех случаях каллус был желтого цвета, плотный, неоводненный (рис. 4).
На чашке с оптимальным соотношением гормонов отмечались появление
меристематических очагов. При перемещении чашек на свет в течение нескольких
дней каллус принимал зеленую окраску, что указывало на переход клеток к
процессу фотосинтеза. Свет также стимулировал побегообразование (рис. 5).
Таблица 2
Влияние фитогормонов на каллусогенез эксплантов, выделенных из разных
частей растения
|
Фрагмент растения
|
Условия
|
Число повторов
|
Среднее число каллусовых
очагов на 1 экспланте
|
Локализация каллуса на
экспланте
|
Каллусогенез
|
|
Лепестки
|
5мг/л БАП + 1мг/л НУК
|
15
|
7
|
На месте надреза и у
основания лепестка
|
Интенсивный
|
|
2 мг/л 2,4-Д
|
14
|
3
|
Незначительный
|
|
1 мг/л БАП + 4 мг/л ИУК
|
13
|
3
|
На срезе
|
Незначительный
|
|
5 мг/л ИУК
|
15
|
_
|
-
|
-
|
|
5 мг/л кинетин + 2 мг/л
2,4-Д
|
13
|
2
|
На срезе
|
Незначительный
|
|
Листья
|
1 мг/л БАП + 4 мг/л ИУК
|
17
|
2
|
На срезе
|
Незначительный
|
|
5 мг/л ИУК
|
14
|
-
|
-
|
-
|
|
5 мг/л кинетин + 2 мг/л
2,4-Д
|
15
|
1
|
На срезе
|
Незначительный
|
|
Стебли
|
2 мг/л 2,4-Д
|
13
|
2
|
На срезе
|
Незначительный
|
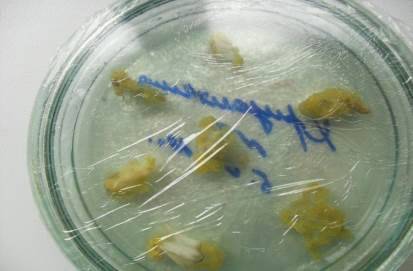
Рис. 4. Каллус на лепестках хризантемы среда Мурасиге-Скуга с добавление
гормонов 5мг/л БАП + 1мг/л НУК

Рис. 5. Фотосинтезирующий каллус и микропобеги на лепестках хризантемы
4.3 Влияние фитогормонов на органогенез в культуре in vitro
Процесс органогеназа in vitro зависит от многих факторов: состава
питательной среды, соотношения фитогормонов, температуры, освещения и других.
На следующем этапе эксперимента оценивали влияние фитогормонов на морфогенез
каллусной ткани. Для этого каллус, полученный в ходе предыдущего этапа
пересаживали на свежие питательные среды, различающиеся соотношением НУК/БАП
(табл. 3). Образцы выдерживали при естественном освещении и температуре 20-22
0С.
Таблица 3
Влияние количественной вариации фитогормонов на органогенез и
сопутствующий ему каллусогенез
|
Условия
|
Среднее количество
микропобегов на экспланте
|
Синхронность роста
микропобегов
|
Ризогенез
|
Сопутствующий рост каллуса
|
Цвет каллуса
|
|
5 мг/л БАП + 1 мг/л НУК
|
9
|
Синхронно
|
-
|
Интенсивный
|
Светло-зеленый
|
|
5 мг/л БАП + 2 мг/л НУК
|
4
|
Асинхронно
|
-
|
Интенсивный
|
Светло-зеленый
|
|
7 мг/л БАП + 1 мг/л НУК
|
11
|
Синхронно
|
-
|
Интенсивный
|
Светло-зеленый
|
Во всех случаях сохранялось заметный рост каллусной массы и наблюдалось
побегообразование. Однако при высоком содержании цитокининов развитие
многочисленных побегов шло синхронно (рис. 6) При снижении его количества число
микропобегов сокращалось, их развитие шло асинхронно (рис. 7). Ризогенез нигде
на зафиксирован.
Рис.6. Синхронный рост микропобегов на среде с высоким содержанием БАП

Рис. 7. Асинхронных рост микропобегов на среде со сниженным содержанием
БАП
Полученные результаты открывают перспективы для разработки подходов
массового микроклонального размножения хризантемы сорта Земба путем
органогенеза каллусной ткани. Исследования требуют продолжения.
5. Выводы
1. Удовлетворительные результаты стерилизации тканей хризантемы
обеспечивает последовательная обработка растительного материала этанолом (60 с)
и хлорным отбеливателем «Белизна» (10 мин).
2. Каллус может образовываться на эксплантах любой локализации, но
интенсивнее всего идет на лепестках хризантемы.
. Оптимальное соотношение гормонов для индукции каллусогеназа на
лепестка хризантемы: НУК 1 мг/л + БАП 5 мг/л.
. Соотношение БАП/НУК в диапазоне от 7/1 до 5/2 поддерживает
побегообразование. При высоком содержании цитокинина синхронно развиваются
множественные микропобеги, при снижении его количества происходит асинхронный
рост одиночных микропобегов.
6. Список литературы
1. Бекер
М.Е., Лиепиньш Г.К., Райпулис Е.П. Биотехнология. - М.: Агропромиздат, 1990
. Биотехнология./
Под ред. А.А. Баева. - М.: 1984
. Биотехнология
сельскохозяйственных растений. - М.: Агропромиздат, 1987
. Бовелл
Г.П., Вуд К.Р. Биотехнология растений: культура клеток/ Пер. с англ. В.И.
Негрука. - М.: Агропромиздат, 1989
. Бутенко
Р.Г. и др. Клеточная инженерия. - М.: Высшая школа, 1987
. Валиханова
Г. Ж. Биотехнология растений. - Алматы: Конжык, 1996
. Валиханова
Г.Ж., Рахимбаев И.Р. Культура клеток и биотехнология растений. Учебное пособие.
- Алма-Ата: издательство КазГУ, 1989
. Высоцкий
В.А. Клональное микроразмножение растений. // Культура клеток растений и
биотехнология. - М.: Наука, 1986
. Глеба
Ю.Ю. Гибридизация соматических клеток растений. // Культура клеток растений. -
М.: Наука, 1981
. Гранда
Харамильо Роберто Карлос. Идентификация В вируса хризантем и создание in vitro оздоровленного посадочного материала.-2009
. Егорова
Т.А., Клунова С.М., Живухина Е.А. Основы биотехнологии. - М.: Издательский
центр «Академия», 2003
. Загоскина
Н.В., Назаренко Л.В. Биотехнология: теория и практика. - М.: Оникс, 2009
. Катаева
Н.В., Бутенко Р.Г. Клональное микроразмножение растений. - М.: Наука, 1983
. Константинова
Т.Н., Аксенова Н.П., Сергеева Л.И., Чайлахян М.Х. Взаимное влияние света и
гормонов на регуляцию морфогенетических процессов в культуре in vitro. //
Физиология растений. 1998. Т. 34, № 4
. Методы
клеточной биотехнологии растений. - Киев, 1987
. Сассон
А. Биотехнология: свершения и надежды. - М.: Мир, 1987
. Уайт
Ф.Р. Культура растительных тканей. - М.: Иностранная литература. 1949
. Урманцева
В.В. Культивирование каллусных тканей на твердых средах. // Методы
культивирования клеток. - Л.: Наука, 1988
. Шевелуха
В.С., Калашникова Е.А., Дегтярев С.В. Сельскохозяйственная биотехнология. - М.:
Высшая школа, 1998
. [Электрон.
Ресурс] Режим доступа: http://biox.ru/articles/biotehnologiya-kultury-kallusa
. [Электрон.
Ресурс] Режим доступа: http//www.biotechnolog.ru/pcell
. [Электрон.
Ресурс] Режим доступа: http://agronomiy.ru
. [Электрон.
Ресурс] Режим доступа: http://dic.academic.ru
. [Электрон.
Ресурс] Режим доступа: http://grapecare.ru
. [Электрон.
Ресурс] Режим доступа: http://herba.msu.ru
. [Электрон.
Ресурс] Режим доступа: http://lakmiras.narod.ru
. [Электрон.
Ресурс] Режим доступа: http://practice.biotechnolog.ru
. [Электрон.
Ресурс] Режим доступа: http://ru.wikipedia.org
. [Электрон.
Ресурс] Режим доступа: http://sadovnikonline.ru
. [Электрон.
Ресурс] Режим доступа: http://www.biotechnolog.ru
. [Электрон.
Ресурс] Режим доступа: http://www.lepestok.kharkov.ua
. [Электрон.
Ресурс] Режим доступа: http://www.lplod.ru
7. Приложение
Среда
Мурасиге-Скуга
|
Компоненты
|
Концентрация вещества
|
Объем маточного р-ра, мл
для приготовления 1 литра среды
|
|
1. Маточный раствор
макросолей (г на 1 л маточного раствора)
|
|
NH4NO3
|
33
|
50
|
|
KNO3
|
38
|
|
|
MgSO4 * 7H2O или
|
7,4
|
|
|
MgSO4 безводный
|
3,6
|
|
|
KH2PO4
|
3,4
|
|
|
2. Кальций (г на 1 л
маточного раствора
|
|
CaCl2 * 2H2O или
|
8,8
|
50
|
|
CaCl2 безводный
|
6,65
|
|
|
3. Маточный раствор
микросолей (мг на 100 мл маточного раствора)
|
|
KJ
|
83
|
1
|
|
H3BO3
|
620
|
|
|
MnSO4 * 5H2O или
|
2410
|
|
|
MnSO4 * 4H2O
|
|
|
ZnSO4 * 7H2O
|
860
|
|
|
Na2MoO4 * 2H2O
|
25
|
|
|
CuSO4 * 5H2О
|
2,5
|
|
|
CoCl2 * 6H2O
|
2,5
|
|
|
4. Хелатный раствор
железа(мг на 100 мл маточного раствора)
|
|
FeSO4 * 7H2O
|
557
|
5
|
|
Na2ЭДТА * 2H2O
|
745
|
|
|
5. Витамины и органические
вещества
|
|
Мезоинозит
|
|
|
|
Никотиновая кислота
|
|
|
|
Пиридоксин-HCl
|
|
|
|
Тиамин-HCl
|
|
|
|
Глицин
|
|
|
|
6. Добавлять в виде порошка
в среду перед варкой:
|
|
Сахароза
|
|
30 г
|
|
Агар-агар
|
|
7 г
|
|
рН готовой среды - 5.6-5.8
|
|
|