Принцип действия аккумуляторов
Министерство
сельского хозяйства Российской Федерации
Федеральное
государственное бюджетное образовательное учреждение Высшего профессионального
образования
Мичуринский
государственный аграрный университет
Кафедра
математики, физики и технологических дисциплин
Реферат
По
дисциплине: «Физика»
По теме:
«Принцип действия аккумуляторов»
Выполнил:
Студент 2 курса
Инженерного ф-та
Группы ИОБ 23 АЭЛ
Каширин Юрий Александрович
Проверил: ст. преподаватель
Брижанский Л. В.
Мичуринск-Наукоград,2015
Введение
Электри́ческий аккумуля́тор -
источник тока
<https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D0%B8%D1%81%D1%82%D0%BE%D1%87%D0%BD%D0%B8%D0%BA_%D1%82%D0%BE%D0%BA%D0%B0>
многоразового действия, основная специфика которого заключается в обратимости
внутренних химических процессов, что обеспечивает его многократное циклическое
использование (через заряд-разряд) для накопления энергии и автономного
электропитания различных электротехнических устройств и оборудования, а также
для обеспечения резервных источников энергии в медицине, производстве и в
других сферах
История создания электрического
аккумулятора
Первым кто открыл возможность получения тока иным, чем
электризация трением, способом был итальянский ученный Луиджи Гальвани
(1737-1798). Однажды он заметил, что лапка мёртвой лягушки пришла в движение
при соприкосновении с её нервом стального скальпеля. Это открытие заставило
Гальвани поставить ряд опытов для обнаружения причины возникновения
электрического тока.
В основе принципа действия различных типов
аккумуляторов лежит явление электролиза, где используется его важное свойство -
обратимость. Электролиз - изменение химического состава раствора при
прохождении через него электрического тока, обусловленное потерей или
присоединением электронов ионами.
Аккумулятор - прибор для накопления электрической
энергии с целью её дальнейшего использования.
Аккумулятор можно изготовить аналогично
гальваническому элементу, использовав для этой цели две свинцовые пластины,
погруженные в раствор содержащий одну часть серной кислоты на пять частей воды.
Для зарядки аккумулятора соединяют последовательно два таких элемента и
амперметр и пропускают через них ток.
Как только через аккумулятор начинает идти ток, возле
катода возникают пузырьки водорода. На аноде, как следовало ожидать,
освобождается кислород. Однако его выделением дело не ограничивается. Пластина
анода постепенно приобретает темно-коричневый цвет вследствие образования на ее
поверхности перекиси свинца (PbO2 )за счет того, что некоторое
количество кислорода соединяется химически с материалом пластины. При
образовании PbO2 ток зарядки падает, указывая на возрастание
сопротивления аккумулятора. Когда аккумулятор зарядится полностью,
присоединяемый к нему вольтметр покажет напряжение несколько более 2 вольт.
В сущности, процесс зарядки состоит в том, что две
одинаковые вначале пластины аккумулятора вследствие электролиза становятся
разными; одна из них, по-прежнему остаётся свинцовой (-), а материал другой
превращается в перекись свинца (+). [1]
Химические реакции в аккумуляторе протекают следующим
образом (в процессе зарядки реакции идут слева направо, при разрядке - в
обратном направлении):
Зарядка →
← Разрядка
Благодаря внутреннему низкому сопротивлению
аккумуляторов можно получать очень сильные токи.
Батарею постоянно следует поддерживать в заряженном
состоянии частой подзарядкой, даже если она не находится в работе. Зажимы
батареи необходимо содержать в чистоте и смазывать вазелином для предотвращения
коррозии. Ни в коем случае нельзя допускать замерзания батарей.
Основное применение аккумуляторные батареи имеют для
запуска двигателей автомобилей и других машин. Так же их можно использовать как
временные источники электроэнергии в отдаленных от населенных пунктов местах.
При этом не следует забывать, что аккумуляторы нужно поддерживать в заряженном
состоянии (энергия солнца например). В автомобилях будущего аккумуляторы
планируется использовать для питания экологически чистых электромоторов.[2]
Типы Аккумуляторов
Свинцовые аккумуляторы (Pb).
Герметизированные свинцово-кислотные аккумуляторы

Рис. 1 Свинцово-кислотный аккумулятор Delta
DTM 1233 L.
Первый работоспособный свинцово-кислотный аккумулятор
был изобретен в 1859 г. французским ученым Гастоном Планте. Конструкция
аккумулятора представляла собой электроды из листового свинца, разделенные
сепараторами из полотна, которые были свернуты в спираль и помещены в сосуд с
10 % раствором серной кислоты. Недостатком первых свинцово-кислотных
аккумуляторов была их невысокая емкость. Поначалу для ее увеличения проводили
большое число циклов заряда-разряда. Для достижения существенных результатов
требовалось до двух лет таких тренировок. Причина недостатка была явной -
конструкция пластин. Поэтому дальнейшее совершенствование конструкции
свинцово-кислотных аккумуляторов было сосредоточено на совершенствование
конструкции используемых в них пластин и сепараторов.
В 1880 г. К. Фор предложил методику изготовления
намазных электродов путем нанесения на пластины окислов свинца. Такая
конструкция электродов позволила значительно повысить емкость аккумуляторов. А
в 1881 г. Э. Фолькмар предложил применять в качестве электродов намазную
решетку. В том же году ученому Селлону был выдан патент на технологию
изготовления решеток из сплава свинца и сурьмы.
Первоначально практическое использование
свинцово-кислотных аккумуляторов было затруднено из-за отсутствия зарядных
устройств - для заряда применяли первичные элементы конструкции Бунзена. То
есть химический источник тока заряжался от другого химического источника -
батареи гальванических элементов. Положение кардинально поменялось с появлением
недорогих генераторов постоянного тока.
Именно свинцово-кислотные батареи первыми в мире из
аккумуляторных батарей нашли коммерческое применение. К 1890 году во многих
промышленно развитых странах был освоен их серийный выпуск. В 1900 году
немецкая фирма Varta произвела первые стартерные аккумуляторы для автомобилей.
В 70-х годах XX века были созданы необслуживаемые
свинцово-кислотные аккумуляторные батареи, способные работать в любом
положении. Жидкий электролит в них сменили гелиевым или адсорбированным
(впитанным) сепараторами электролитом, батареи герметизировали, а для отвода
газов, выделяющихся при заряде или разряде, установили клапаны. Строго говоря,
абсолютная герметизация свинцово-кислотных аккумуляторов не может быть
достигнута, так как нельзя обеспечить полную рекомбинацию кислорода и водорода,
которые выделяются в них при заряде и хранении. Но специальными мерами
выделение газов и потери воды в процессе эксплуатации удается свести к
минимуму.
Были разработаны новые конструкции пластин на базе
медно-кальциевых сплавов, покрытых оксидом свинца, а также на основе титановых,
алюминиевых и медных решеток.
Свинцовые аккумуляторы являются наиболее
распространенными среди всех существующих в настоящее время химических
источников тока. Их масштабное производство определяется как относительно
низкой ценой, обусловленной сравнительной не дефицитностью исходных материалов,
так и разработкой разных вариантов этих аккумуляторов, отвечающих требованиям
широкого круга потребителей.
Реагентами в свинцовых аккумуляторах служат диоксид
свинца (PbO2) и свинец (Pb), электролитом - раствор серной кислоты. Они также
называются свинцово-кислотными аккумуляторами. Их разделяют на четыре основные
группы; стартерные, стационарные, тяговые и портативные (герметизированные).
Наиболее распространенные из свинцовых аккумуляторов - стартерные аккумуляторы,
предназначены для запуска двигателей внутреннего сгорания и энергообеспечения
устройств машин. В последние годы в основном используются аккумуляторы, не
требующие ухода. К недостаткам относят невысокие удельную энергию и наработку,
плохую сохранность заряда, выделение водорода.
Стационарные аккумуляторы используются в энергетике,
на телефонных станциях, в телекоммуникационных системах, в качестве аварийного
источника тока и т.д. Обычно они работают в режиме непрерывного подзаряда.
Относятся к недорогим аккумуляторам.
Тяговые аккумуляторы предназначены для
электроснабжения электрокаров, подъемников, шахтных электровозов,
электромобилей и других машин. Действуют в режимах глубокого разряда, имеют
большой ресурс и низкую стоимость.
Портативные (герметизированные) свинцовые аккумуляторы
используются для питания приборов, инструмента, аварийного освещения. К их
достоинствам относятся более низкая стоимость по сравнению со стоимостью других
портативных аккумулторов, широкий интервал рабочих температур. Недостатками
кислотных аккумуляторов являются невозможность хранения в разряженном
состоянии, трудность изготовления аккумуляторов малых размеров.
Активные вещества аккумулятора сосредоточены в
электролите и положительных и отрицательных электродах, а совокупность этих
веществ называется электрохимической системой. В свинцово-кислотных
аккумуляторных батареях электролитом является раствор серной кислоты (H2SO4),
активным веществом положительных пластин - двуокись свинца (PbO2),
отрицательных пластин - свинец (Pb).
Принцип действия свинцово-кислотных
аккумуляторов
Основные процессы, проходящие на электродах, описывают
реакции: На отрицательном электроде:
+ HSO4- → PbSO4
+ H+ + 2e- (разряд) PbSO4 + H+ +
2e- → Pb + HSO4- (заряд)
На положительном электроде:
2 + HSO4- + 3H+ + 2e- →
PbSO4 + 2H2O (разряд) PbSO4 + 2H2O →
PbO2 + HSO4- + 3H+ + 2e-
(заряд)
Суммарная реакция в свинцовом аккумуляторе имеет вид:
2 + Pb + 2H2SO4 → 2PbSO4
+ 2H2O (разряд) 2PbSO4 + 2H2O → PbO2
+ Pb + 2H2SO4 (заряд)
Таким образом, при разряде свинцового аккумулятора на
обоих электродах формируется малорастворимый сульфат свинца (двойная
сульфатация) и происходит сильное разбавление серной кислоты.
Напряжение разомкнутой цепи заряженного аккумулятора
равно 2,05-2,15 В, в зависимости от концентрации серной кислоты. При разряде по
мере разбавления электролита напряжение разомкнутой цепи аккумулятора
понижается и после полного разряда становится равным 1,95-2,03 В.
При заряде свинцово-кислотного аккумулятора, как и в
других аккумуляторах с водным электролитом, имеют место побочные реакции
выделения газов. Выделение водорода начинается при полном заряжении
отрицательного электрода. Кислород начинает выделяться гораздо раньше: в
обычных условиях заряда при 50-80% заряженности (в зависимости от тока заряда),
а при температуре 0 °С уже после заряда на 30-40 %. Вследствие этого отдача
положительного электрода по емкости составляет 85-90 %. Для получения полной
разрядной емкости при заряде аккумулятору должен быть обеспечен перезаряд на
10-20 %. Этот перезаряд сопровождается существенным выделением водорода на
отрицательном электроде и кислорода - на положительном.
Выделение водорода имеет место и при хранении
заряженного свинцово-кислотного аккумулятора. Саморазряд его определяется
преимущественно скоростью растворения свинца согласно реакции:
+ H2SO4 → PbSO4
+ H2
Скорость этого процесса зависит от температуры, объема
электролита и его концентрации, но более всего от чистоты компонентов. В
отсутствие примесей реакция протекает медленно из-за большого перенапряжения
выделения водорода на свинце. Но на практике, на поверхности свинцового
электрода всегда много примесей, среди которых наибольшее влияние оказывает
сурьма, количество которой в сплаве для решеток и токоведущих деталей доходит
до 6 %.
На положительном электроде может также самопроизвольно
проходить реакция восстановления диоксида свинца:
PbO2 + H2SO4
→ PbSO4 + 1/2O2 + H2O
в результате которой выделяется кислород, но скорость
ее незначительна.
В процессе эксплуатации саморазряд аккумулятора может
увеличиваться из-за образования дендритных мостиков из металлического свинца.
Потери емкости свежеизготовленного аккумулятора за счет саморазряда как правило
не превышают 2-3 % в месяц. Но при эксплуатации они быстро увеличиваются.[3]
Особенности герметизированного
свинцово-кислотного аккумулятора
Главные проблемы при создании герметичного варианта
свинцово-кислотного аккумулятора связаны с необходимостью обеспечения условий
для уменьшения газовыделения и содействия рекомбинации выделяющегося газа. При
создании герметизированного аккумулятора, который в обычных условиях
эксплуатации не требовал бы доливки воды в электролит в течение всего срока
службы и не выделял бы газов, был предпринят ряд мер:
. В аккумуляторе применяется иммобилизированный
(обездвиженный) электролит, который сохраняет высокую электропроводность серной
кислоты. Небольшое его количество позволяет обеспечить лучший транспорт
кислорода от положительного электрода к отрицательному и высокий уровень его
рекомбинации.
При одном методе иммобилизации электролита для его
загущивания применяется силикагель (SiO2), который обладает высокой
пластичностью и заполняет и электроды, и сепаратор. Благодаря своей вязкости он
хорошо удерживается в порах и способствует эффективному использованию активных
веществ электродов. Транспортировка кислорода обеспечивается по трещинам,
которые появляются при усадке твердеющего электролита.
При другом методе иммобилизации применяется сепаратор
из стекловолокна с высокой объемной пористостью и хорошей смачиваемостью в
растворе серной кислоты. Такой сепаратор не только осуществляет функцию
разделения электродов, но и благодаря тонкой структуре волокон обеспечивает
удержание электролита в порах и высокую скорость переноса кислорода. Применение
стекловолокнистого сепаратора и плотная сборка блока электродов способствуют
также уменьшению оплывания активной массы положительного электрода и разбухания
губчатого свинца на отрицательном.
. Для снижения вероятности выделения водорода
свинцово-сурьмяные сплавы токоведущих решеток заменяются другими,
обеспечивающими более высокое перенапряжение выделения водорода. Применяются
сплавы свинца с кальцием (до 0,1 % Ca), иногда легированного алюминием, сплавы
свинца с оловом (0,5-2,5 % Sn), которые имеют неплохие литейные характеристики,
и другие.
. В отрицательный электрод закладывается емкость
больше, чем в положительный. В данном случае при полном заряде положительного
электрода оставшаяся недозаряженной часть активной массы отрицательного
электрода практически исключает вероятность разряда ионов водорода. Кислород, выделяющийся
на диоксиде свинца, достигает отрицательного электрода и окисляет губчатый
свинец до оксида свинца, который в кислотном электролите переходит в сульфат
свинца PbSO4 и воду. Следовательно, условия для герметизации
аккумулятора улучшаются: газы не выделяются и вода не испаряется.
Снижению газовыделения способствуют и рекомендуемые
для герметизированных аккумуляторов режимы заряда, при которых ток понижается
по мере их заряжения.
И все-таки все реализованные варианты безуходного
свинцово-кислотного аккумулятора оснащены клапаном, который время от времени
открывается для сброса излишнего количества газа, главным образом водорода.
Именно поэтому аккумулятор называется не герметичным, а герметизированным.
Герметизированные свинцово-кислотные аккумуляторные
батареи емкостью до 10-20 Ач применяются как источники питания для
разнообразной портативной аппаратуры и инструментов в тех случаях, когда масса
не является определяющим критерием для выбора источника тока, а также в
системах бесперебойного питания, телекоммуникаций, информационных системах, для
аварийного оборудования и т.д., где они работают в буферном режиме. Схема
строения простейшего свинцово- кислотного аккумулятора представлена на рисунке
2. [4]

Рис 2. Свинцовые аккумуляторы. а)
свинцовый аккумулятор-блок аккумуляторной батареи; б) схема автомобильной
батареи.
Никель-кадмиевые аккумуляторы
(Ni-Cd).

Рис 3. Никель кадмиевый аккумулятор в быту
Щелочные никель-кадмиевые аккумуляторы (Ni-Cd) были
изобретены еще в 1899 г. Вальдмаром Юнгнером. Однако материалы для производства
таких аккумуляторов стоили дороже материалов для производства аккумуляторов
других типов, и поэтому в то время широкого использования они не нашли. Только
в 1932 г. была разработана технология нанесения активного материала пластин
путем осаждения на губчатый (пористый) покрытый никелем электрод. А в 1947 г.
стали известны работы над созданием герметичных никель-кадмиевых аккумуляторов,
в которых была осуществлена возможность рекомбинации газов, выделявшихся в
процессе заряда, без их отвода. Конечным результатом этих разработок и стало
появление герметичных никель-кадмиевых аккумуляторных батарей, используемых и в
настоящее время.Cd аккумуляторы любят быстрый заряд, медленный разряд до
состояния полного разряда и подзарядку импульсами тока, в то время как батареи
других типов предпочитают частичный разряд и умеренные токи нагрузки. Это тип
аккумуляторов, которые способны работать в самых жестких условиях.
Для никель-кадмиевых аккумуляторов крайне необходим
полный периодический разряд: если его не делать, на пластинах элементов
формируются крупные кристаллы, значительно снижающие их емкость (так называемый
"эффект памяти").
Реагентами в никель-кадмиевых аккумуляторах служат
гидроксид никеля и кадмий, электролитом - раствор КОН, поэтому они именуются
щелочными аккумуляторами. Существуют три основных вида никель-кадмиевых
аккумуляторов: негерметичные с ламельными (ламельные аккумуляторы) и спеченными
электродами (безламельные аккумуляторы) и герметичные. Наиболее дешевые
ламельные никель-кадмиевые аккумуляторы характеризуются плоской разрядной
кривой, высокими ресурсом и прочностью, но не низкой удельной энергией.
Удельная энергия, скорость разряда Ni-Cd аккумуляторов со спеченными
электродами выше, они работоспособны при низких температурах, но дороже,
характеризуются эффектом памяти и способностью к тепловому разгону.
Применяются никель-кадмиевые аккумуляторы для питания
шахтных электровозов, подъемников, стационарного оборудования, средств связи и
электронных приборов, для запуска дизелей и авиационных двигателей и т.п.
Герметичные Ni-Cd аккумуляторы характеризуются
горизонтальной разрядной кривой, высокими скоростями разряда и способностью
действовать при низких температурах, но они дороже герметизированных свинцовых
аккумуляторов и характеризуются эффектом памяти. Применялись для питания
портативной аппаратуры (сотовых телефонов, магнитофонов, компьютеров и т.д.),
бытовых приборов, игрушек и т.д. Недостатком никель-кадмиевых аккумуляторов
является применение токсичного кадмия. [5]
Преимущества Ni-Cd аккумуляторных
батарей
возможность быстрого и простого заряда, даже после
длительного хранения аккумулятора;
большое количество циклов заряд/разряд: при правильной
эксплуатации - более 1000 циклов;
хорошая нагрузочная способность и возможность эксплуатации
при низких температурах;
продолжительные сроки хранения при любой степени
заряда;
сохранение стандартной емкости при низких
температурах;
наибольшая приспособленность для использования в
жестких условиях эксплуатации;
низкая стоимость;
Недостатки Ni-Cd аккумуляторных
батарей:
относительно низкая по сравнению с другими типами
аккумуляторных батарей энергетическая плотность;
присущий этим аккумуляторам эффект памяти и
необходимость проведения периодических работ по его устранению;
токсичность применяемых материалов, что отрицательно
сказывается на экологии, и некоторые страны ограничивают использование
аккумуляторов этого типа;
относительно высокий саморазряд - после хранения
необходим цикл заряда.
Основные электрохимические процессы
Ni-Cd аккумулятора
Основной процесс, происходящий на положительном
оксидно-никелевом электроде в цикле заряда-разряда аккумуляторов, описывается
следующим образом:
(OH)2 + OH- → NiOOH + H2O
+ e- (заряд) NiOOH + H2O + e- → Ni(OH)2
+ OH- (разряд)
На отрицательном кадмиевом электроде аккумулятора
проходит реакция:
(OH)2 + 2e- → Cd + 2OH-
(заряд) Cd + 2OH- → Cd(OH)2 + 2e-
(разряд)
Общая реакция в Ni-Cd аккумуляторе имеет вид:
Ni(OH)2 + Cd(OH)2 → 2NiOOH
+ Cd + 2H2O (заряд) 2NiOOH + Cd + 2H2O → 2Ni(OH)2
+ Cd(OH)2 (разряд)
При перезаряде никель-кадмиевых аккумуляторов на
положительном электроде идет побочный процесс выделения кислорода:
OH- → 1/2O2 + H2O
+ 2e- (перезаряд) [6]
Кислород сквозь пористый сепаратор достигает
отрицательного электрода и восстанавливается на нем:
/2O2 + Cd + H2O → Cd(OH)2
(перезаряд)
Последняя реакция воплощает в жизнь замкнутый
кислородный цикл и обеспечивает стабилизацию давления в герметичном
никель-кадмиевом аккумуляторе при его перезаряде. Нужно отметить, что давление
в аккумуляторе определяется не только скоростями протекания указанных реакций,
но, главным образом, скоростью доставки кислорода от положительного электрода к
отрицательному. Так же, при перезаряде отрицательного кадмиевого электрода
может иметь место реакция выделения водорода:
H2O + e- → OH-
+ 1/2H2
который окисляется на оксидно-никелевом электроде в
соответствии с реакцией:
+ 1/2H2 → Ni(OH)2
Реакция образования водорода опасна для герметичного
аккумулятора, так как она может привести к накоплению водорода из-за низкой скорости
реакции его поглощения. Для того чтобы в стандартной ситуации, условий для
протекания реакции выделения водорода не возникало, в герметичном аккумуляторе
емкость отрицательного электрода объемно заметно превосходит емкость
положительного. Поэтому емкость герметичного никель-кадмиевого аккумулятора
определяется емкостью его положительного оксидно-никелевого электрода.[7]
Механизмы электродных реакций Ni-Cd
аккумулятора
Положительный электрод. Исходный гидроксид никеля может
существовать в двух формах: α- и β-Ni(OH)2, отличающихся степенью гидратации и плотностью. В
разряженном электроде могут присутствовать обе формы Ni(OH)2. При
заряде β-Ni(OH)2 переходит в β-NiOOH (при небольших изменениях
кристаллической решетки вещества). На последней стадии заряда может
образовываться γ-NiOOH. Соотношение β- и γ-фаз NiOOH зависит от условий заряда. γ-Фаза образуется при больших скоростях
заряда и/или при существенных перезарядах. Ее образование приводит к коренной
перестройке структуры оксидов. Плотность β-NiOOH равна 4,15 г/см3,
плотность γ-NiOOH - 3,85 г/см3, поэтому при существенном перезаряде
при образовании оксидов высшей валентности объем активной массы
оксидно-никелевого электрода изменяется.
Электрохимическое поведение двух форм гидроксида
никеля также различное. Заряд γ-NiOOH протекает с меньшей эффективностью,
а коэффициент использования по току ниже, чем у β-NiOOH. Разрядный потенциал γ-NiOOH ниже на 50 мВ. Но при хранении его
саморазряд в 2 раза медленнее.
Для обеспечения большего ресурса следует вести заряд с
небольшим перезарядом до образования β-NiOOH, который обеспечивает малые объемные
изменения электрода в цикле заряда-разряда.
Отрицательный электрод. В новых герметичных никель-кадмиевых
аккумуляторах емкость кадмиевого электрода обычно выше емкости
оксидно-никелевого электрода на 20-70%. Поэтому потенциал кадмиевого электрода
в цикле заряда-разряда аккумулятора может считаться неизменным.
Электрические характеристики
никель-кадмиевого аккумулятора
Номинальное напряжение герметичных Ni-Cd аккумуляторов
- 1,2 В. Номинальный (стандартный) режим заряда никель-кадмиевого аккумулятора
- током 0,1 С в течение 16 ч. Номинальный режим разряда никель-кадмиевого
аккумулятора - током 0,2 С до напряжения 1 В.
Стандартный вид разрядных характеристик герметичных
цилиндрических никель-кадмиевых аккумуляторов при разных режимах показан на
рисунке 4.
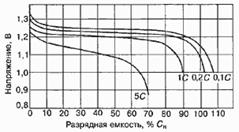
Рис.4. Разрядные характеристика
никель-кадмиевого аккумулятора (Ni-Cd) при различных токах разряда.
Работоспособность аккумуляторов также отображается в
кривых зависимости разрядной емкости от температуры и токов нагрузки (рисунок 5
и 6). [8]
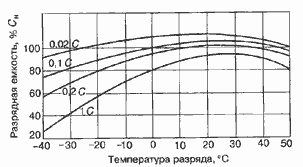
Рис.5. Разрядная характеристика
никель-кадмиевого аккумулятора (Ni-Cd)
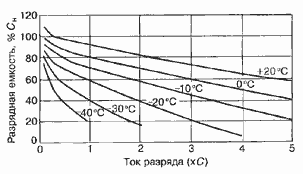
Рис.6. Разрядная характеристика
никель-кадмиевого аккумулятора (Ni-Cd)
Никель-водородные аккумуляторы
Отрицательным электродом служит пористый
газодиффузионный электрод с платиновым катализатором, на котором обратимо
реагирует газообразный водород. Характеризуются высокой удельной энергией и
очень высоким ресурсом, но значительным саморазрядом и очень дороги.
Применялись в космической технике. [11]
Литий-ионные (Li-ion) аккумуляторы

Рис 7. Li-ion аккумулятор 18650
Наиболее часто в мобильных устройствах (ноутбуки,
мобильные телефоны, КПК и другие) применяют литий-ионные (Li-ion) аккумуляторы.
Рис 7. Это связано с их преимуществами по сравнению с широко использовавшимися
ранее никель-металлгидридными (Ni-MH) и никель-кадмиевыми (Ni-Cd)
аккумуляторами.
У Li-ion аккумуляторов значительно лучшие параметры.
Однако следует учитывать, что Ni-Cd аккумуляторы имеют одно важное достоинство:
способность обеспечивать большие токи разряда. Это свойство не является критически
важным при питании ноутбуков или сотовых телефонов (где доля Li-ion доходит до
80% и их доля становится все больше и больше), но существует достаточно много
устройств, потребляющих большие токи, например всевозможные электроинструменты,
электробритвы и т.п. До сих пор эти устройства являлись вотчиной почти
исключительно Ni-Cd аккумуляторов. Однако в настоящее время, особенно в связи с
ограничением применения кадмия в соответствии с директивой RoHS, резко
активизировались исследования по созданию бескадмиевых аккумуляторов с большим
разрядным током.
Первичные элементы ("батарейки") с литиевым
анодом появились в начале 70-х годов 20 века и быстро нашли применение
благодаря большой удельной энергии и другим достоинствам. Таким образом, было
осуществлено давнее стремление создать химический источник тока с наиболее
активным восстановителем - щелочным металлом, что позволило резко повысить как
рабочее напряжение аккумулятора, так и его удельную энергию. Если разработка
первичных элементов с литиевым анодом увенчалась сравнительно быстрым успехом и
такие элементы прочно заняли свое место как источники питания портативной
аппаратуры, то создание литиевых аккумуляторов натолкнулось на принципиальные
трудности, преодоление которых потребовало более 20 лет.
После множества испытаний в течение 1980-х годов
выяснилось, что проблема литиевых аккумуляторов закручена вокруг литиевых
электродов. Точнее, вокруг активности лития: процессы, происходившие при
эксплуатации, в конце концов, приводили к бурной реакция, получившей название
"вентиляция с выбросом пламени". В 1991 г. на заводы-изготовители
было отозвано большое количество литиевых аккумуляторных батарей, которые
впервые использовали в качестве источника питания мобильных телефонов. Причина
- при разговоре, когда потребляемый ток максимален, из аккумуляторной батареи
происходил выброс пламени, обжигавший лицо пользователю мобильного телефона.
Из-за свойственной металлическому литию
нестабильности, особенно в процессе заряда, исследования сдвинулись в область
создания аккумулятора без применения Li, но с использованием его ионов. Хотя
литий-ионные аккумуляторы обеспечивают незначительно меньшую энергетическую
плотность, чем литиевые аккумуляторы, тем не менее Li-ion аккумуляторы
безопасны при обеспечении правильных режимов заряда и разряда. [11]
Химические процессы Li-ion
аккумуляторов
Революцию в развитии перезаряжаемых литиевых
аккумуляторов произвело сообщение о том, что в Японии разработаны аккумуляторы
с отрицательным электродом из углеродных материалов. Углерод оказался весьма
удобной матрицей для интеркаляции лития.
Для того чтобы напряжение аккумулятора было достаточно
большим, японские исследователи использовали в качестве активного материала
положительного электрода оксиды кобальта. Литерованный оксид кобальта имеет
потенциал около 4 В относительно литиевого электрода, поэтому рабочее
напряжение Li-ion аккумулятора имеет характерное значение 3 В и выше.
При разряде Li-ion аккумулятора происходят
деинтеркаляция лития из углеродного материала (на отрицательном электроде) и
интеркаляция лития в оксид (на положительном электроде). При заряде
аккумулятора процессы идут в обратном направлении. Следовательно, во всей
системе отсутствует металлический (нуль-валентный) литий, а процессы разряда и
заряда сводятся к переносу ионов лития с одного электрода на другой. Поэтому
такие аккумуляторы получили название "литий-ионных", или
аккумуляторов типа кресла-качалки.
Процессы на отрицательном электроде
Li-ion аккумулятора
Углеродная матрица, применяемая в качестве анода,
может иметь упорядоченную слоистую структуру, как у природного или
синтетического графита, неупорядоченную аморфную или частично упорядоченную
(кокс, пиролизный или мезофазный углерод, сажа и др.). Ионы лития при внедрении
раздвигают слои углеродной матрицы и располагаются между ними, образуя
интеркалаты разнообразных структур. Удельный объем углеродных материалов в
процессе интеркаляции-деинтеркаляции ионов лития меняется незначительно.
Кроме углеродных материалов в качестве матрицы
отрицательного электрода изучаются структуры на основе олова, серебра и их
сплавов, сульфиды олова, фосфориды кобальта, композиты углерода с наночастицами
кремния.
Процессы на положительном электроде
Li-ion аккумулятора
Если в первичных литиевых элементах применяются
разнообразные активные материалы для положительного электрода, то в литиевых
аккумуляторах выбор материала положительного электрода ограничен. Положительные
электроды литий-ионных аккумуляторов создаются исключительно из литированных
оксидов кобальта или никеля и из литий-марганцевых шпинелей.
В настоящее время в качестве катодных материалов все
чаще применяются материалы на основе смешанных оксидов или фосфатов. Показано,
что с катодами из смешанных оксидов достигаются наилучшие характеристики
аккумулятора. Осваиваются и технологии покрытий поверхности катодов
тонкодисперсными оксидами.
При заряде Li-ion аккумулятора происходят реакции: на
положительных пластинах:
LiCoO2 → Li1-xCoO2
+ xLi+ + xe-
на отрицательных пластинах:
С + xLi+ + xe- → CLix
При разряде происходят обратные реакции. Процесс
заряда демонстрируется рисунком 8. [4]
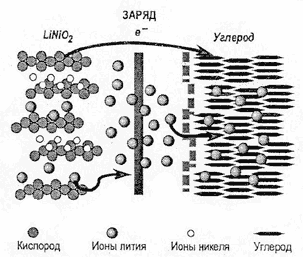
Рис.8. Процесс заряда литий-ионного
(Li-ion) аккумулятора
Конструкция Li-ion аккумуляторов
Конструктивно Li-ion аккумуляторы, как и щелочные
(Ni-Cd, Ni-MH), производятся в цилиндрическом и призматическом вариантах. В
цилиндрических аккумуляторах свернутый в виде рулона пакет электродов и
сепаратора помешен в стальной или алюминиевый корпус, с которым соединен
отрицательный электрод. Положительный полюс аккумулятора выведен через изолятор
на крышку (рис. 9). Призматические аккумуляторы производятся складыванием
прямоугольных пластин друг на друга. Призматические аккумуляторы обеспечивают более
плотную упаковку в аккумуляторной батарее, но в них труднее, чем в
цилиндрических, поддерживать сжимающие усилия на электроды. В некоторых
призматических аккумуляторах применяется рулонная сборка пакета электродов,
который скручивается в эллиптическую спираль (рис. 10). Это позволяет
объединить достоинства двух описанных выше модификаций конструкции.
Характеристики Li-ion аккумуляторов
Современные Li-ion аккумуляторы имеют высокие удельные
характеристики: 100-180 Втч/кг и 250-400 Втч/л. Рабочее напряжение - 3,5-3,7 В.
Если еще несколько лет назад разработчики считали
достижимой емкость Li-ion аккумуляторов не выше нескольких ампер-часов, то
сейчас большинство причин, ограничивающих увеличение емкости, преодолено и
многие производители стали выпускать аккумуляторы емкостью в сотни ампер-часов.
Современные малогабаритные аккумуляторы работоспособны
при токах разряда до 2 С, мощные - до 10-20С. Интервал рабочих температур: от
-20 до +60 °С. Однако многие производители уже разработали аккумуляторы, работоспособные
при -40 °С. Возможно расширение температурного интервала в область более
высоких температур.
Саморазряд Li-ion аккумуляторов составляет 4-6 % за
первый месяц, затем - существенно меньше: за 12 месяцев аккумуляторы теряют
10-20% запасенной емкости. Потери емкости у Li-ion аккумуляторов в несколько
раз меньше, чем у никель-кадмиевых аккумуляторов, как при 20 °С, так и при 40
°С. Ресурс-500-1000 циклов.

Рис.9. Устройство литий-ионного (Li-ion)
аккумулятора
Рис.10. Устройство призматического
литий-ионного (Li-ion) аккумулятора с рулонной скруткой электродов
Литий-полимерные аккумуляторы
(Li-pol)

Рис 11. Аккумулятор литий-полимерный1400mAh
3S 25C Traxxas.
Анодом служит углеродистый материал, в который
обратимо внедряются ионы лития. Активными материалами положительных электродов
являются оксиды ванадия, кобальта или марганца. Электролитом является или
раствор соли лития в неводных апротонных растворителях, заключенный в
микропористую полимерную матрицу, или полимер (полиакрилонитрил,
полиметилметакрилат, поливинилхлорид либо другие), пластифицированный раствором
соли лития в апротонном растворителе (гель-полимерный электролит). По сравнению
с литий-ионными аккумуляторами литий-полимерные аккумуляторы имеют более
высокие удельную энергию и ресурс и лучшую безопасность. Применяются для
питания портативных электронных устройств. Пример на рис 11.
В основе идеи литий-полимерного аккумулятора (Li-pol)
лежит открытое явление перехода некоторых полимеров в полупроводниковое
состояние в результате внедрения в них ионов электролита. Проводимость
полимеров при этом увеличивается более чем на порядок. Усилия исследователей
были направлены на поиск полимерных электролитов как для литий-ионных
аккумуляторов, так и для аккумуляторов с металлическим литием, теоретически
возможная плотность энергии которых в несколько раз больше, чем у литий-ионных
аккумуляторов.
К настоящему времени разработаны и серийно изготавливаются
литиевые источники тока с электролитами, которые могут быть подразделены на три
группы: - сухие полимерные электролиты (чаще всего на базе полиэтиленоксида, в
который вводятся различные соли Li); - гель-полимерные гомогенные электролиты, которые
образуются при внедрении в полимер (или смесь полимеров) с солями Li
пластификатора-растворителя; - неводные растворы солей Li, сорбированные в
микропористой полимерной матрице.
По сравнению с жидкими электролитами в литий-ионных
аккумуляторах, полимерные электролиты имеют меньшую ионную проводимость,
которая к тому же понижается при температуре ниже нуля. Поэтому проблема
разработок Li-pol аккумуляторов состояла не только в поиске иммобилизированного
электролита с достаточно высокой проводимостью, совместимого с электродными
материалами, но и в расширении температурного диапазона Li-pol аккумуляторов.
Современные литий-полимерные аккумуляторы обеспечивают
удельные характеристики, сравнимые с характеристиками литий-ионных
аккумуляторов. Благодаря отсутствию жидкого электролита они более безопасны в
использовании, чем перезаряжаемые литиевые источники тока. Li-pol аккумуляторы
компактны и могут быть выполнены в любой конфигурации. Их контейнер может быть
выполнен из металлизированного полимера.
Рабочие плотности тока, однако, незначительны, и
электрические характеристики Li-pol аккумуляторов заметно ухудшаются при
понижении температуры из-за кристаллизации полимера.
С гель-полимерным электролитом разрабатывают
аккумуляторы и литий-ионные, и с металлическим анодом. Достигнутые довольно
большие плотности тока и расширение температурного интервала работы позволяют
использовать такие аккумуляторы для широкого круга портативной аппаратуры,
сотовых телефонов, ноутбуков, цифровой фото-техники и т.д.
Аккумуляторы с гель-полимерным электролитом производят
многие компании во всем мире. Электродные материалы, рецептуры электролита и
технологии изготовления Li-pol аккумуляторов разных компаний значительно
различаются. Их характеристики также разнообразны.
Все разработчики отмечают, что на качество Li-pol
аккумуляторов и стабильность их работы сильно воздействует однородность
полимера, на которую оказывают влияние как соотношение компонентов электролита,
так и температура полимеризации.
Учитывая, что уже реально показаны возможности
создания литий-полимерных аккумуляторов в широком диапазоне емкостей, и тот
факт, что при всех стандартных тестах на безопасность использования (перезаряд,
форсированный разряд, короткое замыкание, вибрация, раздавливание и протыкание
гвоздем) Li-pol аккумуляторы имеют существенно более высокие показатели по
сравнению с литий-ионными аккумуляторами с жидким электролитом. Перспективы
серьезного расширения производства Li-pol аккумуляторов и использования их в
самых разнообразных областях техники не вызывают сомнений.
С появлением элементов литий-полимерных аккумуляторных
батарей толщиной всего в 1 мм перед конструкторами электонных устройств
открылись новые возможности в отношении конечной формы и размеров новой
аппаратуры. Были убраны многие ограничения касательно микроминиатюризации
радиоэлектронных устройств.
Иногда для снижения внутреннего сопротивления Li-pol
батарей, используют добавку гелиевого электролита. Большинство литий-полимерных
батарей, применяемых для питания мобильных телефонов, на самом деле являются
гибридными, представляющими собой нечто среднее между литий-ионными и
литий-полимерными аккумуляторами, и в них используется гелиевый электролит.
Какая же разница между литий-ионными и
литий-полимерными аккумуляторными батареями с гелиевым электролитом? Хотя их
характеристики и близки, в литий-полимерных батареях вместо сепараторов
используется твердый электролит. Добавленный в них гелиевый электролит
предназначен просто для улучшения ионообменных процессов и, таким образом, для
понижения внутреннего сопротивления.
Были проведены сравнительные испытания на безопасность
двух типов призматических литий-ионных аккумуляторов: с жидким и
гель-полимерным электролитами (см. таблицу). При этом не принималось особых мер
обеспечения безопасности аккумуляторов. Аккумуляторы испытывались проколом
иглой, нагревом до 200 °С, коротким замыканием и очень высоким перезарядом (до
600 %). Как следует из таблицы, безопасность литий-ионных аккумуляторов с
полимерным электролитом гораздо выше безопасности аккумуляторов с жидким
электролитом.
Результаты испытаний аккумуляторов на
безопасность
|
Вид испытаний
|
Аккумулятор с гель-полимерным электролитом
|
Аккумулятор с житким электролитом
|
|
Прокол иглой
|
Не было изменений
|
Взрыв, дым, протечка электролита, повышение температуры до
250°С
|
|
Нагрев до 200°С
|
Не было изменений
|
Взрыв, протечка электролита
|
|
Ток короткого замыкания
|
Не было изменений
|
Протечка электролита, повышение температуры на 100°С
|
|
Перезаряд (600%)
|
Вздутие
|
Взрыв, протечка электролита, повышение температуры на 100°С
|
Заряд литий-полимерных аккумуляторов
Процесс заряда литий-полимерных аккумуляторных батарей
подобен заряду литий-ионных аккумуляторных батарей. Литий-полимерные батареи с
гелевым электролитом чаще всего классифицируют как литий-ионные, и их процессы
заряда аналогичны.
В настоящее время большая часть литий-ионных
аккумуляторов коммерческого назначения на самом деле представляет собой
литий-полимерные аккумуляторы с гелиевым электролитом, и литий-полимерные
батареи с сухим электролитом постепенно будут ими вытеснены.
Характеристики аккумуляторов
Среднее разрядное напряжение аккумуляторов находится в
широком диапазоне от 1,25В у никель-кадмиевых аккумуляторов до 3,5В у литиевых
аккумуляторов. С повышением скорости разряда емкость аккумуляторов уменьшается
(см. рисунок 12), причем в минимальной степени у Ni-Cd и Ni-MH аккумуляторов.
Емкость также снижается при понижении температуры. Наибольшое снижение емкости
при низких температурах наблюдается у никель-железных аккумуляторов и
минимальное снижение - у никель-кадмиевых со спеченными электродами и у
свинцовых аккумуляторов. Высокую удельную мощность можно получить от
никель-кадмиевых аккумуляторов, свинцовых (стартерных и герметизированных),
никель-цинковых и серебряно-цинковых аккумуляторов. Невысокую удельную мощность
имеют никель-железные аккумуляторы. Удельная массовая энергия минимальна у
свинцовых аккумуляторов и максимальна у литиевых аккумуляторов. Наибольшую
наработку имеют никель-водородные аккумуляторы, низким ресурсом характеризуются
серебряно-цинковые и никель-цинковые аккумуляторы. Следует отметить, что по
мере циклирования уменьшаются емкость, напряжение и соответственно удельная
энергия аккумуляторов, причем скорости понижения удельной энергии у разных
аккумуляторов существенно различаются. В наименьшей степени снижаются емкость и
энергия при циклировании Ni-Cd аккумуляторов. Наработка зависит от многих
причин и прежде всего от глубины разряда. Наиболее высокая скорость саморазряда
отмечается у никель-водородных и никель-железных аккумуляторов, наименьшая - у
серебряно-кадмиевых и серебряно-цинковых аккумуляторов. К наиболее дешевым
принадлежат свинцовые аккумуляторы, к наиболее дорогим - никель-водородные,
серебряно-кадмиевые и серебряно-цинковые аккумуляторы.
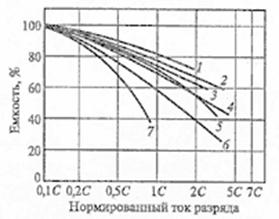
Рис.12 Влияние тока разряда на емкость
отдаваемую аккумулятором: 1-никель-кадмиевые аккумуляторы со спеченным
электродом и никель-металлгидридные аккумуляторы, 2-серебрянно-цинковые
аккумуляторы, 3- никель-кадмиевые аккумуляторы с ламельным электродом,
4-никель-цинковые аккумуляторы, 5-литий-инные аккумуляторы, 6-свинцовые
аккумуляторы, 7-никель-железные аккумуляторы.[12]
Заключение
Электричество
уже третье столетие служит потребностям человека. Люди работают, отдыхают,
готовят пищу, путешествуют, учатся и все это благодаря электричеству. Человек
научился не только получать электроэнергию искусственным путем, но и собирать
ее в хранилище. При этом, даже не замечая эти хранилища в повседневной жизни.
Ежедневно используя накопители электрической энергии батарейки и аккумуляторы.
И те и другие автономные источники тока. Отличие лишь в том, что батарейки
одноразового использования, а аккумуляторы способны многократно отдавать
накопленную энергию. За последние 200 лет человечество совершило большой
скачек в получении и накоплении энергии. Трудно представить мегаполис без
источника автономного электропитания - аккумулятора. Возможно в недалеком
будущем дома, освящения, парковки, магазины - все, что потребляет энергию,
будет работать от аккумуляторов. Самым востребованным изобретением в наши дни
являются аккумуляторы
<http://www.36volt.ru/category/akkumuljatory-promyshlennye/>, их значение
сложно переоценить. Устройство для накопления энергии и дальнейшего его
использования, говоря техническим языком это автономный источник тока.
Электрохимический принцип работы, которого был открыт еще в начале 19 века.
Гастон Планте в 1959 году собрал первый в мире аккумулятор со свинцовой
пластиной, по размеру он был с небольшую комнату. Современные аккумуляторы это
многократно уменьшенные копии аккумуляторов Планте. Свинцовая основа
используется и сегодня, например, в автомобильных аккумуляторах их называют
пусковыми или стартерными.
электрический аккумулятор литий полимерный
Список
использованной литературы
1) Л.Эллиот, У.Уилкокс, Физика, Москва 1963, ГИФМЛ, стр. 495/
2) О.Кабардин, Физика, справочные материалы, Москва 1991,
) Кромптон Т. Вторичные источники тока. - М.: Мир, 1985. - 301с.
) Лазаров Д. Электрон и химические процессы: Пер. с болг. - Л.: Химия,
1987. - 128с.
) Шпак И.Г. Химические источники тока. - Саратов: СГТУ, 2003. - 95с.
) Курзуков Н.И. Ягнятинсий В.М. Аккумуляторные батареи. Краткий
справочник. - М.: За рулем, 2006. - 88с.
) Марочек В.И. Пасынки энергетики. - М.: Знание, 1981. - 64 с
) Кромптон Т. Первичные источники тока. - М.: Мир, 1986. - 326с.
) Арзуманян Н., Микаэлян А., Данелян А. Топливные элементы - вчера,
сегодня, завтра. //Альтернативная энергетика и экология. - 2005. - №10. -
с.65-68
) Афанасьев К. Топливные элементы - батарейки будущего. // Радиолюбитель.
- 2005. - №2. - с.26-29
12) Войнаровский П. Д.
<https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B9%D0%BD%D0%B0%D1%80%D0%BE%D0%B2%D1%81%D0%BA%D0%B8%D0%B9,_%D0%9F%D0%B0%D0%B2%D0%B5%D0%BB_%D0%94%D0%BC%D0%B8%D1%82%D1%80%D0%B8%D0%B5%D0%B2%D0%B8%D1%87>,.
Электрические аккумуляторы
<https://ru.wikisource.org/wiki/%D0%AD%D0%A1%D0%91%D0%95/%D0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5_%D0%B0%D0%BA%D0%BA%D1%83%D0%BC%D1%83%D0%BB%D1%8F%D1%82%D0%BE%D1%80%D1%8B>
// Энциклопедический словарь Брокгауза и Ефрона
<https://ru.wikipedia.org/wiki/%D0%AD%D0%BD%D1%86%D0%B8%D0%BA%D0%BB%D0%BE%D0%BF%D0%B5%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%81%D0%BB%D0%BE%D0%B2%D0%B0%D1%80%D1%8C_%D0%91%D1%80%D0%BE%D0%BA%D0%B3%D0%B0%D1%83%D0%B7%D0%B0_%D0%B8_%D0%95%D1%84%D1%80%D0%BE%D0%BD%D0%B0>
: в 86 т. (82 т. и 4 доп.). - СПб., 1890-1907.