Исследование ферментативного гидролиза лигноцеллюлозных материалов из недревесного растительного сырья
ПОЯСНИТЕЛЬНАЯ
ЗАПИСКА К ДИПЛОМНОЙ РАБОТЕ
по
дисциплине: «Теоретические основы биотехнологии»
Исследование
ферментативного гидролиза лигноцеллюлозных материалов из недревесного
растительного сырья
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
. АНАЛИТИЧЕСКИЙ ОБЗОР
1.1 Характеристика целлюлозы и ее
производных
.2 Характеристика сырья
.3 Применение целлюлозы
.4 Ферментативный гидролиз
лигноцеллюлозных материалов
.5 Факторы, влияющие на
ферментативный гидролиз ЛЦМ
.6 Ферменты, участвующие в
биоконверсии ЛЦМ
.7 Обоснование выбора направления
исследования
. МАТЕРИАЛЫ И МЕТОДЫ
.1 Основные показатели используемых
материалов
.2 Основные характеристики
вспомогательных материалов
.2.1 Вода дистиллированная
.2.2 Кислота соляная
.2.3 Спирт этиловый
.2.4 Гидроокись натрия
.2.5 Кислота уксусная
.2.6 Хлорное железо
.2.7 Ацетат натрия
.2.8 3,5 - динитросалициловая
кислота
.2.9 Виннокислый калий-натрий
.3 Приготовление реактивов
.3.1 Приготовление раствора орсина
.3.2 Приготовление ацетатного буфера
.3.3 Приготовление реактива на основе
3,5 - динитросалициловой кислоты
.3.4 Приготовление 17,5 %-го
раствора гидроксида натрия
.3.5 Приготовление 9,5 %-го раствора
гидроксида натрия
.4 Методики анализов
.4.1 Методика определения
концентрации редуцирующих веществ в пересчете на глюкозу на спектрофотометре
Unico UV-2804
.4.2 Методика определения массовой
доли пентозанов
.4.3 Методика определения влажности
.4.4 Определение содержания
альфа-целлюлозы весовым методом
.5 Характеристика ферментных
препаратов
. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
.1 Ферментативный гидролиз ЛЦМ в
ацетатном буфере и в водной среде
.2 Зависимость ФГ от концентрации
субстрата
.3 Зависимость эффективности ФГ от
условий перемешивания
.4 Зависимость ФГ от сырья для
получения ЛЦМ
.5 Реакционная способность к
ферментации ЛЦМ плодовых оболочек овса разными ферментными препаратами
.6 Зависимость эффективности ФГ от
способа подготовки ЛЦМ
. БЕЗОПАСНОСТЬ ЖИЗНЕДЕЯТЕЛЬНОСТИ
.1 Требования охраны труда
.2 Требования охраны труда перед
началом работы
.3 Требования охраны труда во время
работы
.4 Техника безопасности на
производстве
.5 Уничтожение отходов
5. МЕТРОЛОГИЯ И СТАНДАРТИЗАЦИЯ
5.1 Перечень нормативной
документации
ЗАКЛЮЧЕНИЕ
ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
ВВЕДЕНИЕ
Ферментативный гидролиз лигноцеллюлозных материалов в раствор сахаров
является важнейшим этапом в технологии биоэтанола. Растительное сырье,
используемое в качестве источника энергии, является возобновляемым ресурсом с
практически неисчерпаемым запасом, что делает его альтернативой ископаемому топливу,
а этанол, получаемый биохимическим путем из того же растительного сырья,
представляет собой практическую альтернативу бензину [1].
Современные технологи позволяют использовать для производства биоэтанола
практически любое сахаро- и крахмалосодержащее сырье: сахарный тростник,
сахарную свеклу, картофель, кукурузу, пшеницу, ячмень, рожь и т.д. Проблема
использования целлюлозосодержащего сырья для производства биоэтанола остаётся
нерешенной.
Одними из нетрадиционных источников целлюлозы, используемых в ИПХЭТ СО
РАН, являются мискантус и плодовые оболочки овса. Их объединяет следующее:
недревесное происхождение, общедоступность, легкая возобновляемость. ПОО
представляет собой одну часть растения, предназначенная для сохранения семени
злака - зерно, а мискантус представлен всеми надземными частями растений -
стеблем, листьями и т.д. [2].
Ферментативный гидролиз целлюлозы является перспективным процессом,
обладающим, в отличие от кислотно-катализируемого гидролиза, рядом преимуществ:
меньшие энергозатраты, мягкие условия протекания процесса, более высокий выход
сахаров и отсутствие токсичных отходов.
Целью дипломной работы является исследование
ферментативного гидролиза (ФГ) лигноцеллюлозных материалов (ЛЦМ) из
недревесного растительного сырья. Для достижения данной цели были поставлены
следующие задачи:
1 изучить ферментативный гидролиз ЛЦМ в ацетатном буфере и в водной
среде;
показать зависимость ФГ от концентрации субстрата;
исследовать зависимость эффективности ФГ от условий перемешивания;
установить зависимость ФГ от сырья для получения ЛЦМ;
изучить реакционную способность к ферментации ЛЦМ плодовых оболочек овса
разными ферментными препаратами;
установить зависимость эффективности ФГ от способа подготовки ЛЦМ.
. АНАЛИТИЧЕСКИЙ ОБЗОР
1.1 Характеристика целлюлозы и ее производных
Как известно, основной структурной единицей растения является клетка,
которая состоит из стенки, протопласта и вакуоли. Отличительный признак
растительной клетки - целлюлозная стенка. Она хорошо оформлена, очень прочна и
сохраняется после отмирания протопласта. Клеточная стенка включает тонкий
внутренний выстилающий слой (третичную стенку), содержащую целлюлозу и
гемицеллюлозу, широкую вторичную стенку, состоящую из целлюлозы, лигнина и
гемицеллюлоз, и первичную стенку.
По современным представлениям, макромолекулы целлюлозы образуют длинные,
не имеющие разветвлений, упругие нити, состоящие из остатков глюкопиранозы,
соединенных β- глюкозидными связями в положении 1 - 4.
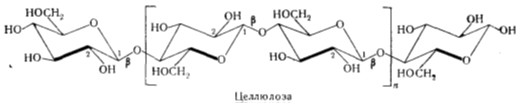
Рисунок 1 - Строение целлюлозы
Характер взаимного расположения макромолекул целлюлозы в природным и
искусственных волокнах и пленках оказывает существенное влияние на их
прочность, растяжимость, эластичность, гигроскопичность, реакционную
способность, растворимость, склонность к мокрому разлому, прокрашиваемость и
многие другие свойства [3].
Как известно, основной структурной единицей растения является клетка. Она
состоит из стенки, протопласта и вакуоли. Отличительный признак растительной
клетки - целлюлозная стенка. Она хорошо оформлена, очень прочна и сохраняется
после отмирания протопласта. Клеточная стенка включает тонкий внутренний
выстилающий слой (третичную стенку), содержащую целлюлозу и гемицеллюлозу,
широкую вторичную стенку, состоящую из целлюлозы, лигнина и гемицеллюлоз, и
первичную стенку. Первичные стенки соседних клеток (волокон) соединены между
собой коензивным межклеточным веществом, или срединной пластиной. Имеются
указания на содержание в ней метилового эфира полигалактуроной кислоты,
гемицеллюлоз и белка. В период роста клетки срединная пластинка на 2/3 состоит
из пектиновых веществ. Затем происходит сильная лигнификация межклеточного
вещества, и оно приобретает устойчивость к различным механическим, химическим и
энзиматическим воздействиям [4].
В первичной стенке, имеющей толщину около 0,1 мкм, микрофибриллы
целлюлозы занимают 1/3 объема. Они переплетаются между собой, образуя сетчатую
систему. Микрофибриллы погружены в аморфный матрикс, который составляет
основную массу этой оболочки. В период роста клетки он состоит из гемицеллюлоз
и пектиновых веществ. Позднее основная часть вещества матрикса (до 70 %)
замещается находящимся в аморфном состоянии лигнином. Далее следует целлюлоза,
гемицеллюлоза и пектиновые вещества. В аморфном участке микрофибриллы, лигнин и
гемицеллюлоза могут проникать между макромолекулами целлюлозы.
Компоненты, входящие в состав первичной клеточной стенки, можно условно
разделить на четыре группы [5]: структурные, представленные целлюлозой;
компоненты матрикса стенки - гемицеллюлозы, пектины, белки, липиды;
инкрустирующие стенку - лигнин и суберин; откладывающиеся на её поверхности -
кутин и воск. Кроме того, клеточные стенки могут содержать значительное
количество минеральных веществ: силикатов и карбонатов кальция.
Вторичная клеточная стенка хлопкового и древесного волокна, основным
компонентом которого является целлюлоза, состоит из множества концентрических
слоев, которые в результате определенных химических и физических воздействий
распадаются на микрофибриллы. Вторичный слой определяет форму клетки,
механические свойства ткани, и микрофибриллы в нем расположены параллельно.
Толщина третичной стенки (включая внутренние слои вторичной стенки) не
более 70…80 нм. Лигнина в ней больше, чем во вторичной стенки, и химически она
более устойчива. Микрофибриллы целлюлозы здесь расположены под углом друг к
другу в виде пучков диаметром 2…3 нм [6].
Состав и строение древесины различных пород разнятся вследствие
морфологической неоднородности структур. Так, хвойная древесина отличается от
лиственных пород. Генетически обусловленный состав полисахаридов клеточной
стенки постоянен внутри одного вида [7].
Целлюлоза и ее производные характеризуются повышенной скелетной
жесткостью. На структуру и реакционную способность целлюлозы большое влияние
оказывают водородные связи. Специфика морфологической структуры целлюлозы
определяется в первую очередь ее функцией в клеточной стенке. Мембраной
растительной клетки целлюлоза выделяется в виде плотно упакованных фибрилл,
образующих подобие кристаллической решетки. Фибриллы, обеспечивающие
прочностные свойства клетки, находятся в сложном взаимодействии с аморфным
матриксом других полисахаридов и веществами белковой природы. В результате
создается мощная структурная упаковка.
Целлюлоза - очень прочное соединение, способное сохраняться без
изменения.
Она не растворяется в воде даже при кипячении, не переваривается в
желудке многих животных, нерастворима во многих кислотах и щелочах. Она
растворяется лишь в аммиачных растворах солей меди.
При воздействии на целлюлозу концентрированных растворов щелочи
изменяются ее химические, физико-химические и структурные свойства: отмечается
интенсивное набухание, изменяется степень кристалличности. Высокомолекулярная
фракция целлюлозы, нерастворимая в 17,5 %-ной NaOH, называется α-целлюлозой. Хлопок состоит из α- целлюлозы, а другие растения и
древесина содержат главным образом β-целлюлозы, растворимые в
концентрированном растворе щелочи.
Целлюлоза представляет собой наиболее высокомолекулярный полисахарид,
линейный β-1,4-глюкан с видовой специфичностью степени
полимеризации. Химический состав целлюлозы соответствует формуле (C6H10O5)n. Элементарным звеном макромолекулы
является ангидро-D-глюкоза, которая
содержит три гидроксильные группы у 2, 3 и 6-го атомов углерода. Однако по
данным инфракрасного и рентгеноструктурного анализа, элементарной единицей
целлюлозы является ангидроцеллобиоза, а не ангидроглюкоза. Таким образом, хотя
в химическом отношении целлюлоза представляет собой линейный полимер β-D-глюкопиранозы, целлобиоза является главным промежуточным
продуктом расщепления целлюлозы целлюлолитическими и бактериальными ферментными
системами. Целлобиоза, целлотриоза и целлотетраоза растворимы в воде.
Целлюлозные молекулы со степенью полимеризации более 6000 считаются
нерастворимыми, что обусловлено наличием водородных связей между целлюлозными
молекулами. Такие водородные связи в целлюлозе имеются между глюкозными
остатками в самой цепи глюкана и между цепями [2].
Элементарные звенья макромолекул целлюлозы (ангидро-D-глюкопираноза) соединены между собой
β-гликозидной связью. Целлобиоза -
продукт неполного гидролитического расщепления макромолекул. В гидролизатах
также могут быть обнаружены целлотриоза и целлотетраоза. При полном гидролизе
целлюлозы образуется D-(+)-глюкоза.
Элементарные волокна целлюлозы состоят из множества линейных макромолекул с
поперечным сечением до 0,7 нм. Полагают, что макромолекула целлюлозы состоит из
большого числа остатков D-глюкопиранозы
в конформации кресла, соединенных β-1,4-гликозидными связями. Различные химические
и физические воздействия, однако, способствуют переходу звеньев в другую
конформацию. Участки целлюлозы с высокой степенью упорядоченности называются
кристаллическими, а участки с беспорядочной ориентацией - аморфными. Аморфная
целлюлоза имеет более рыхлую структуру и поэтому более доступна для кислоты или
ферментов.
Существуют различные мнения относительно числа целлюлозных молекул в
кристаллических участках и способа их организации. Целлюлозные молекулы
образуют элементарные фибриллы посредством водородных связей. Эти фибриллы в
свою очередь образуют микрофибриллы, и затем волокна. Волокнистую структуру
целлюлозы можно наблюдать в микроскоп.
Число гликозидных связей, доступных действию ферментов, в большей степени
зависит от степени набухания целлюлозы. Увеличение степени набухания
достигается за счет механической и физической предобработки, такой, как
пропаривание, размалывание, обработка ультразвуком. Минеральные кислоты и
щелочи в высоких концентрациях увеличивают набухание всего волокна, так как они
способны разрывать водородные связи и проникать в кристаллические участки.
Одним из основных факторов, определяющих свойства целлюлозы и других
высокомолекулярных полисахаридов, является надмолекулярная структура. Цепи
молекул целлюлозы объединяются в пучки - мицеллы. Максимальный диаметр одной
молекулы целлюлозы 0,8 нм. Эти молекулы образуют элементарные мицеллы с
максимальным диаметром 10 нм. Элементарные мицеллы объединяются в пучки,
называемые микрофибриллами, которые имеют ширину 25 нм и содержат до 2000
молекул целлюлозы. Микрофибриллы объединяются в волокна - макрофибриллы шириной
0,4 мкм, они содержат 5000000 молекул целлюлозы. В волокнах вторичной оболочки
200 млн. молекул целлюлозы. Стенки клеток различаются главным образом
расположением микрофибрилл. Различают параллельную ориентацию микрофибрилл по
отношению к оси клетки и продольно-поперечную или беспорядочную ориентацию.
Свойства целлюлозы определяются не столько взаимным расположением
макромолекул, сколько строением и взаимным расположением элементов
надмолекулярной структуры. Особенности организации древесной целлюлозы,
обусловленные наличием водородных связей между целлюлозой и гемицеллюлозой,
делает ее менее доступной для целлюлолитических ферментов. Гемицеллюлозы
выполняют структурные функции, участвуя в формировании скелета растений, играют
роль запасных веществ, используемых в процессе обмена. Компонентом растительной
клетки наряду с целлюлозой и гемицеллюлозой является лигнин. Этот полимер с
трехмерной структурой построен в основном из фенилпропановых групп древесины. В
естественных условиях лигнин как таковой не существует и структурно связан с
полисахаридами. Лигнин делает целлюлозу и гемицеллюлозу плохо перевариваемыми
[1].
Помимо соединений полисахаридной природы и лигнина растительные ткани
обычно содержат эфиры, белки, могут также включать смолы, воск, терпены и
другие органические соединения, которые адсорбируются как на поверхности
целлюлозных микрофибрилл, так и включаются внутрь. Несмотря на всю сложность и
низкую реактивность целлюлозосодержащих материалов, в природных условиях
макромолекулы, входящие в состав растительной клеточной стенки, расщепляются
благодаря действию специфических ферментов микроорганизмов, главным из которых
являются целлюлолитические и лигнолитические.
При рассмотрении вопросов биоконверсии лигноцеллюлозных растительных
субстратов в белок и другие продукты, а также энзиматического осахаривания
целлюлозы не всегда в должной мере принимаются во внимание особенности строения
того или иного субстрата, наличие нежелательных компонентов не только в виде
лигнина, но и в виде пектиновых и других веществ. Однако именно особенности
строения субстрата существенно влияют на эффективность биотрансформации.
Применение ферментных препаратов для гидролиза крахмала и лигноцелюлозы
позволяет сохранить пищевую ценность крахмалопродуктов, избежать появление
примесей. Благодаря специфичности ферментов метод ферментативного гидролиза
дает возможность регулировать углеводный состав крахмалопродуктов [7].
1.2 Характеристика сырья
Растительная биомасса (фитомасса) образуется в результате
фотосинтетической деятельности растений. Исходными веществами при биосинтезе
растительных тканей является диоксид углерода, поступающий из воздуха, и вода,
подводящая к листьям главным образом из почвы через корневую систему растений.
В процессе фотосинтеза растения выделяют в атмосферу кислород. Практически весь
кислород воздуха имеет растительное происхождение.
Таким образом, помимо образования биомассы фотосинтетическая деятельность
растений обеспечивает стабильность состава атмосферы, условия и возможность
существования жизни на Земле. Использование биомассы растений для технических
целей должно проводиться на научной основе без нарушения экологического
равновесия в природе [8].
Целлюлоза содержится в каждом растении, однако далеко не каждое из них
пригодно для промышленного извлечения из него целлюлозы. Промышленное значение
в производстве целлюлозы приобрели растения немногих видов. Из хвойных
древесных пород наибольшее применение имеют ель, сосна, пихта, из лиственных -
тополь разных видов, осина, берёза, бук и некоторые другие. Из не древесного
сырья используется солома злаковых культур - овса, ржи, пшеницы, ячменя, риса,
кукурузы и т.п.
К не древесному сырью относятся также хлопок, лен, конопля, джут и
другие, используемые преимущественно в текстильной промышленности. Из хлопка
благодаря высокому содержанию в нем целлюлозы может быть получена несложными
методами наиболее чистая целлюлоза, применяемая для химической переработки.
Древесина - самое распространенное сырьё, однако, получение из него целлюлозы
требует более сложного технологического процесса [9].
Многолетние травянистые растения такие, как мискантус китайский (Miscanthus
sinensis), получивший популярность, как растение для декора садов ещё в
1935 году, а в 1994 году о нём заговорили, как о перспективном
высокоэнергетическом растении для производства топлива [9] и шелуха овса могут
быть также успешно использованы для получения высококачественных целлюлоз [10].
Вид растения Мискантус пришел из тропиков и субтропиков, но различные
виды находят во многих климатических регионах Восточной Азии, а теперь также в
Европе и Северной Америке, где он сначала служил декором (из Японии в 1930-х),
а после стал перспективным энергетическим растением в виду его превосходной
продуктивности, быстрого роста и высокой устойчивости к заболеваниям. Мискантус
представляет собой высокое корневищное растение, принадлежащее семейству
злаковых, с механизмом фотосинтеза С4. В виду своей многолетней природы и высокой
продуктивности, этот вид является привлекательным источником биомассы.
Мискантус обладает высокой продуктивностью, то есть возможностью получать
высокие урожаи ежегодно (вплоть до 30 тонн/га/год сухого вещества на плантациях
южной Европы), а также возможностью служить хорошим источником биомассы для
твердых топлив и строительных материалов в виде ДСП. К тому же, химическое
совершенствование процессом «Органосолв» фракционирования его основных
компонентов (целлюлоза, гемицеллюлоза, лигнин) возможно использование некоторых
из них при производстве метилцеллюлозы, карбоксиметилцеллюлозы, клеящих
веществ, этанола и активированного углерода, наряду с прочими продуктами. Эти
результаты открывают многообещающие перспективы для комплексного использования
Мискантуса [11].
Согласно [12] мискантус имеет следующий средний химический состав (%
сухого вещества): зола - 5,7; вещества, экстрагируемые холодной водой - 6,3;
вещества, экстрагируемые горячей водой - 9,6; вещества, экстрагируемые 1 %-м
NaOH - 44,9; вещества, экстрагируемые толуолом/этанолом - 3,2; общее количество
сахаров - 65,9; лигнин - 23,6.
Плодовые оболочки злаков являются широко распространенным недревесным
целлюлозосодержащим сырьем в сельскохозяйственных регионах. Содержание
целлюлозы в них достигает 47 %. В ИПХЭТ СО РАН активно проводятся исследования
по применению плодовых оболочек овса в качестве перспективного ЦСС.
ПОО являются отходом производства крупы. К достоинствам этого вида ЦСС
можно отнести их концентрирование на перерабатывающих предприятиях, низкую
стоимость и небольшой размер частиц, что позволяет использовать их для
выделения целлюлозы без предварительного измельчения.
1.3 Применение целлюлозы
Одним из наиболее важных факторов, определяющих развитие большинства
отраслей промышленности, является устойчивая сырьевая база, и в частности
углеродсодержащее сырье: нефть, каменный уголь и природный газ. Образование
запасов этих природных ресурсов происходило в течение геологических периодов,
по продолжительности сравнимых с продолжительностью существования самой Земли.
Расходование же сырья идет всевозрастающими темпами, что делает весьма
актуальным решение проблемы поиска альтернативных источников углеродсодержащего
сырья. Однако эта проблема успешно решена самой природой. В результате биохимических
процессов фотосинтеза различные наземные и водные растения из углекислого газа
и воды продуцируют до 400 млрд. т в год сухой биомассы, аккумулируя в тканях
огромное количество углерода, и являются, таким образом, источником непрерывно
возобновляемого углеродсодержащего сырья. Наибольший интерес среди продуктов
фотосинтеза растений на протяжении всего времени существования человеческой
цивилизации привлекала целлюлоза, ежегодный прирост количества которой
составляет около 100 млрд. т. Целлюлозные материалы занимают видное место в
удовлетворении потребностей человека: природные целлюлозные волокна (прежде
всего хлопок, лен и другие лубяные волокна) и сегодня являются существенной
частью в балансе сырья для текстильной промышленности. Хлопковая и древесная
целлюлоза широко применяются для изготовления бумаги и картона, искусственных
волокон, некоторых пластмасс и лаков, эмульгаторов и загустителей для нефтяной,
текстильной, пищевой, фармацевтической и других отраслей промышленности.
Целлюлоза и ее производные широко используются во многих отраслях
промышленности (текстильной, целлюлозно-бумажной, искусственных волокон,
пищевой, фармацевтической и др.) [13].
Целлюлозу и целлюлозосодержащее сырье используют для получения эфиров
целлюлозы, в частности, карбоксиметилцеллюлозы, которая может найти применение
в некоторых отраслях промышленности и, в частности, нефтегазодобывающей [14], а
также в производстве композитных материалов [15]. Широкие возможности
использования целлюлозы определяются особенностями химического строения,
структуры и свойств этого природного полимера [13].
1.4 Ферментативный гидролиз лигноцеллюлозных
материалов
Промышленные производства этилового спирта на основе ферментативного
гидролиза целлюлозы реализованы в США, Японии, Великобритании и др. странах
мира. Суть способа, предложенного американскими исследователями, состоит в том,
что целлюлозосодержащее - древесину, хлопчатобумажные ткани, рисовую и
пшеничную солому, бумагу измельчают и осахаривают культуральной жидкостью
микроорганизмов Trichoderma viride или Trichoderma reesei. Полученный раствор глюкозы
сбраживают с образованием спирта, используя дрожжи Saccharomyces cerevisiae, Pichia или Rhizopus javanikus. Способ предусматривает присутствие в ферментационной среде целлюлазы,
участвующей в превращении целлюлозы в глюкозу, и микроорганизма, образующего
этанол из глюкозы. Исследование процесса ферментативного гидролиза целлюлозы
фильтратами культуральной жидкости Trichoderma viride показало, что процесс
ферментативного гидролиза наиболее активно протекает при T = 45…50  , следовательно, целесообразно
использование термофильных штаммов микроорганизмов. Было установлено, что выход
этанола зависит от концентрации фермента, активности отдельных компонентов целлюлазного
комплекса и концентрации целлюлозы. Присутствие целлюлаз не подавляет
накопление этанола в ферментационной среде, а увеличение концентрации фермента
повышает его выход.
, следовательно, целесообразно
использование термофильных штаммов микроорганизмов. Было установлено, что выход
этанола зависит от концентрации фермента, активности отдельных компонентов целлюлазного
комплекса и концентрации целлюлозы. Присутствие целлюлаз не подавляет
накопление этанола в ферментационной среде, а увеличение концентрации фермента
повышает его выход.
При рассмотрении вопросов биоконверсии лигноцеллюлозных растительных
субстратов в белок и другие продукты, а также энзиматического осахаривания
целлюлозы не всегда в должной мере принимаются во внимание особенности строения
того или иного субстрата, наличие нежелательных компонентов не только в виде
лигнина, но и в виде пектиновых и других веществ. Однако именно особенности
строения субстрата существенно влияют на эффективность биотрансформации [7].
В работе [16] анализируются технологии, касающиеся кислотного и
ферментативного гидролиза целлюлозы и гемицеллюлозы в мономерные сахара для
последующего получения этилового спирта. Подчеркивается, что разрушение
целлюлозы и гемицеллюлозы кислотным гидролизом или обработкой органическими
растворителями требует больших затрат. Возникает проблема удаления кислот из
продуктов и регенерации растворителей.
Применение ферментных препаратов для гидролиза крахмала и лигноцеллюлозы
позволяет сохранить пищевую ценность крахмалопродуктов, избежать появления
примесей. Благодаря специфичности ферментов метод ферментативного гидролиза
дает возможность регулировать углеводный состав крахмалопродуктов [17].
Предложен способ [18] получения этилового спирта, по которому
растительное сырье, содержащее лигноцеллюлозу, подвергают двухстадийному
ферментативному гидролизу с раздельным отбором гексозной и пентозной фракций,
используя при сбраживании разные группы микроорганизмов. Гексозную фракцию
направляют на сбраживание дрожжевыми микроорганизмами Saccharomyces serevisiae, а пентозную ферментируют в
присутствии штамма дрожжей, взятых из ряда Pachysolen tannophillus, Candida shenatal при Т = 30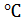 , рН = 4,3. Далее культуральные
жидкости предлагается соединить и направить на перегонку и ректификацию.
Описанный способ позволяет обеспечить комплексную переработку
целлюлозосодержащего субстрата. Однако отмечается, что ферментолиз
лигноцеллюлозы протекает медленно, что связано с тремя факторами:
, рН = 4,3. Далее культуральные
жидкости предлагается соединить и направить на перегонку и ректификацию.
Описанный способ позволяет обеспечить комплексную переработку
целлюлозосодержащего субстрата. Однако отмечается, что ферментолиз
лигноцеллюлозы протекает медленно, что связано с тремя факторами:
. Целлюлоза в лигноцеллюлозе имеет устойчивую кристаллическую
структуру;
. Лигнин, окружающий целлюлозу создает физический барьер для
ферментов;
. Возможных точек контактов ферментов с целлюлозой немного [7].
Установлено, что целлюлоза в лигноцеллюлозе находится как в виде
кристаллов, так и в виде аморфных компонентов. Аморфные компоненты разрушаются
ферментами быстрее, чем кристаллические, поэтому любые способы, которые
способствуют увеличению содержания аморфной целлюлозы в лигноцеллюлозе,
ускоряют процесс ферментолиза. Лигнин препятствует процессу ферментолиза еще в
большей степени. В связи с этим встает задача предобработки лигноцеллюлозы, которая
сводится к разделению лигноцеллюлозы на лигнин и свободную целлюлозу, к
увеличению поверхности соприкосновения ферментов и целлюлозы, обеспечивая тем
самым значительное ускорение процесса ферментолиза. Все способы предобработки
подразделяются на физические и химические. Физические способы в свою очередь
подразделяются на механические и немеханические [7]. К физическим методам
относятся обработка γ-лучами или потоком электронов, обработка микроволновым
излучением (2400…2500 МГц), нагревание на воздухе или в атмосфере СО2 (100  ), действие ультразвука и т.д.
Облучение высокой энергии приводит к деполимеризации целлюлозы, образованию
радикалов. В результате облучения также уменьшаются размеры частиц ЦСС и имеет
место некоторое разрушение лигнина. Замораживание целлюлозы способствует
уменьшению ее СП, определенному изменению структуры и увеличению поверхности.
Структура целлюлозы разрушается также и при ее нагревании и повышении давления.
Влияние ультразвука на целлюлозу (в водной среде) сопряжено с действием силы
звуковой волны, эффектом ударной волны при схлопывании кавитационных полостей,
с возникновением окислительной термодеструкции. Физические методы обработки
увеличивают реакционную способность ЦСС в 2…5 раз.
), действие ультразвука и т.д.
Облучение высокой энергии приводит к деполимеризации целлюлозы, образованию
радикалов. В результате облучения также уменьшаются размеры частиц ЦСС и имеет
место некоторое разрушение лигнина. Замораживание целлюлозы способствует
уменьшению ее СП, определенному изменению структуры и увеличению поверхности.
Структура целлюлозы разрушается также и при ее нагревании и повышении давления.
Влияние ультразвука на целлюлозу (в водной среде) сопряжено с действием силы
звуковой волны, эффектом ударной волны при схлопывании кавитационных полостей,
с возникновением окислительной термодеструкции. Физические методы обработки
увеличивают реакционную способность ЦСС в 2…5 раз.
Механические методы предобработки ЦСС заключаются в их измельчении на
различных видах мельниц и дробилок, диспергировании на вальцах и т.д.
Измельчают ЦСС как в сухом, так и во влажном виде. Использование механических
методов приводит к разрушению кристаллической структуры целлюлозы, увеличению
поверхности, доступной целлюлолитическим ферментам и, как следствие, к
значительному возрастанию реакционной способности ЦСС (в 10 и более раз) [1].
Наиболее часто применяются химические способы предобработки, с помощью
которых можно не только разделить лигноцеллюлозу на фракции, но провести ее
химическую модификацию [7]. Химические методы предобработки основаны на
способности тех или иных химических соединений растворять лигнин или целлюлозу,
либо приводить к набуханию или разрушению ее структуры. Химические методы
предобработки, основанные на аморфизации или набухании целлюлозы, приводят к
10…15-кратному увеличению ее реакционной способности; делигнификация, паровой
взрыв и другие методы увеличивают реакционную способность в 5…10 раз [1].
Биологические методы предобработки основаны на использовании
лигнолитических микроорганизмов, способных избирательно по отношению к
целлюлозе утилизировать лигнин в качестве источника углерода [19, 20]. Эти
методы предобработки еще недостаточно изучены. К настоящему времени, очевидно,
что они требуют достаточно большого времени (несколько недель) и относительно
эффективны (есть данные, что они увеличивают реакционную способность ЦСС до 10
раз [19]).
Каждый из приведенных методов предобработки имеет достоинства и
недостатки. Основным их плюсом является значительное увеличение реакционной
способности ЦСС. Основным минусом - достаточно высокая стоимость в силу их
материало- и энергоемкости, необходимость использовать специальные
конструкционные материалы, нейтрализовать и регенерировать реагенты и т.д. [1].
Ферментативный способ получения моносахаридов во многом лишен
недостатков, присущих способу, основанному на кислотном гидролизе, поскольку
осуществляется в гораздо более мягких условиях по температуре, давлению и
кислотности среды. Это требует значительно меньших расходов энергии,
предотвращает деструкцию сахаров и образование трудно утилизируемых отходов,
снижающих биологическую ценность гидролизатов. Наконец, следует иметь в виду
возможность решения экологических проблем, связанных с необходимостью создания
биотехнологических методов утилизации отходов и вторичных продуктов
промышленной и сельскохозяйственной переработки растительного сырья.
Важной особенностью процесса ферментативной деструкции целлюлозы и других
полисахаридов является то, что он осуществляется на поверхности нерастворимого
субстрата, причем реакционная способность субстрата является функцией ряда его
физико-химических и структурных свойств, и, как правило, убывает в ходе деструкции
[1].
Специфика в данном случае заключается в том, что субстрат имеет
упорядоченную (кристаллическую) структуру, во многих случаях содержит в своем
составе сопутствующие вещества (в первую очередь лигнина), которые служат
физическим барьером, затрудняющим доступ ферментов к глюкозидным связям. Важную
роль играют размеры поверхности, доступной молекулам ферментов, а также
адсорбционные и диффузионные процессы, предшествующие и сопровождающие
гидролитическое превращение нерастворимых субстратов.
Химические реакции целлюлозы можно разделить на гомогенные и
гетерогенные. В гомогенных реакциях целлюлоза сначала переходит в раствор, а
затем вступает в реакцию. Реакции целлюлозы могут начинаться в гетерогенной
среде и заканчиваться в гомогенной (например, ацетилирование целлюлозы). Однако
большинство реакций целлюлозы, в том числе реакции ферментативного гидролиза,
от начала до конца протекают в гетерогенной среде.
Существует три типа гетерогенных реакций целлюлозы.
. Поверхностные реакции - протекают в аморфных участках
целлюлозного волокна и на поверхности кристаллических участков (в этих зонах
расположено до 25…30 % гидроксильных групп).
. Поверхностно-гетерогенные реакции - их первая стадия протекает
на поверхности кристаллических участков и в аморфной части целлюлозы, а на
второй стадии реагент протекает внутрь кристаллических участков и нарушает их
структуру (участвует 35…50 % гидроксильных групп).
. Молекулярные реакции - характеризуются быстрым проникновением
реагента внутрь кристаллических участков. При этом, в целом, течение реакции
оказывается таким же, как и в случае гомогенной реакции (эти реакции называют
квазигомогенными).
Реакции ферментативного гидролиза относятся к поверхностным, хотя не
исключена возможность их протекания как поверхностно-гетерогенных [1].
Эффективность биохимических процессов в значительной степени зависит от
состава субстрата. Химический состав влияет на доброкачественность
полупродуктов, причем различают химическую доброкачественность по
относительному содержанию целевых продуктов и биологическую
доброкачественность.
В частности, доброкачественность гидролизата по РВ (ДРВ) и по
моносахаридам (ДМС) находят по формулам:
 (1)
(1)
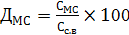 , (2)
, (2)
где СРВ, СМС, Сс.в - соответственно концентрации РВ, суммы моносахаридов
и сухих веществ гидролизата.
Определение доброкачественности полупродуктов проводится при
химико-техническом контроле ксилитного производства и при получении кормового
гидролизного сахара. При биохимической переработке субстратов определения ДРВ
или ДМС недостаточно, так как дрожжи ассимилируют наряду с моносахаридами
содержащиеся в гидролизате органические кислоты и неорганические вещества. В то
же время токсичные ингибиторы биохимических процессов, содержащиеся в следовых
количествах и не оказывающие влияния на величину химической
доброкачественности, могут существенно замедлить или полностью остановить
протекание процессов жизнедеятельности микроорганизмов.
В связи с этим в дрожжевом и спиртовом производстве широко применяют
понятие биологическая доброкачественность. Об относительной биологической
доброкачественности субстратов судят по величине выхода биомассы дрожжей,
этанола или другого целевого продукта в сопоставимых условиях. В качестве
субстрата для сравнения может быть использована синтетическая питательная среда
или очищенный гидролизат с известной характеристикой [8].
1.5 Факторы, влияющие на ферментативный гидролиз
ЦСС
Факторами, влияющими на гидролиз целлюлозосодержащих материалов, являются
концентрация субстрата, способ его предобработки, возможность повторного
использования фермента, температура и рН реакционной среды, продолжительность
воздействия препарата. Многие из этих факторов взаимозависимы, и это делает
весь процесс довольно сложным. В оптимальном случае реакция должна быть быстрой
и полной, с образованием больших концентраций глюкозы без существенной потери
активности фермента [21].
На скорость гидролиза существенно влияют физико-химические и структурные
свойства субстрата: степень упорядоченности структуры, размер поверхности,
доступной для молекул ферментов, степень полимеризации и наличие нецеллюлозных
компонентов (в основном гемицеллюлоз и лигнина). Реакционная способность
природного целлюлозосодержащего сырья при ферментативном гидролизе, как
правило, невелика, поэтому возникает необходимость предварительной обработки
ЦСС с целью увеличения реакционной способности. Смысл предобработки заключается
в разрушении кристаллической структуры целлюлозы и (или) удаление лигнина.
Происходит также увеличение поверхности целлюлозы, что оказывает дополнительное
положительное влияние на скорость гидролиза. Считается, что лигнин образует
физический барьер воздействию ферментами. Некоторые исследователи обнаружили,
что делигнификация биомассы повышает выход моносахаридов, получаемых
ферментативным гидролизом [1].
Есть мнение, что степень кристалличности целлюлозы является главным
фактором, влияющим на ферментативный гидролиз субстрата. Сообщалось, что
снижение кристалличности целлюлозы особенно влияет на начальную скорость
гидролиза целлюлозы целлюлазой. [22].
По другим источникам [23], фактором, определяющим изменение скорости
гидролиза, является не степень кристалличности, а необратимая адсорбция
фермента на субстрате в процессе гидролиза с одновременной потерей
каталитической функции.
Выдвинуто несколько гипотез для объяснения этого вопроса по снижению
скорости, в том числе дезактивации фермента, снижения синергетического эффекта,
изменений реакционной способности субстрата и ингибирования продукта. В условиях
ферментативного гидролиза сила сдвига и термическая неустойчивость ферментов
служат главными причинами дезактивации фермента. Хотя встряхивание в процессе
гидролиза должно приводить к однородной реакции, было обнаружено, что ферменты
дезактивировались под воздействием поверхности раздела воздух - жидкость при
встряхивании или перемешивании.
Так же как и скорость любых химических превращений, скорость
ферментативных реакций зависит от многих факторов. Основными из них являются
следующие - время протекания ферментативной реакции (время инкубации),
температура и рН окружающей среды.
) Время протекания
По мере того, как время инкубации фермента увеличивается, скорость
реакции снижается. Это может происходить по различным причинам, главными из
которых являются: уменьшение концентрации субстрата, увеличение скорости
обратной реакции (в результате накопления продукта), ингибирование фермента
продуктом реакции, денатурация фермента. При кинетических исследованиях
проводят измерения начальной скорости реакции.
) Температура
Согласно правилу Вант-Гоффа для химических реакций повышение температуры
на 10 °С приводит к увеличению скорости реакции в 2…4 раза. Скорость
ферментативной реакции с повышением температуры увеличивается, достигая
максимума при какой-то оптимальной температуре (температурный оптимум
фермента), а затем падает до нуля (рисунок 2 а). Следует заметить, что
температурный коэффициент увеличения скорости для ферментативных реакций
меньше, чем для обычных химических реакций: при увеличении температуры на
каждые 10 °С скорость возрастает не более в два раза.
Снижение скорости реакции до нуля вызвано инактивацией фермента
вследствие денатурации его белковой части. Большинство ферментов инактивируются
при температурах 40…50 °С. Отдельные ферменты инактивируются при температурах,
близких к 0 °С. Высокой термостабильностью отличаются ферменты, являющиеся
гликопротеинами, поскольку углеводный фрагмент придает белку термоустойчивость.
Такие ферменты работают в микроорганизмах, обитающих в горячих источниках.
) рН среды
Изменение рН среды приводит к изменению степени ионизации кислотных и
основных групп как активного центра фермента, так и самого субстрата.
Следовательно, изменение рН влияет на сродство субстрата к активному центру
фермента и на каталитический механизм реакции. Обычно зависимость скорости
ферментативной реакции от рН среды имеет колоколообразную форму (рисунок 2 б),
поскольку для каждого фермента существует свое оптимальное значение рН, при
котором фермент проявляет наибольшую каталитическую активность (оптимум рН
фермента). Значение рН в оптимуме отвечает наилучшему связыванию субстрата
ферментом и наибольшей скорости катализа.

Рисунок 2 - Графики зависимости скорости ферментативной реакции от
температуры (а) и рН среды (б)
Проблема гидролиза является нерешённой, и влияние многих факторов
остаётся неисследованным. Интенсификация ферментативного гидролиза позволит
эффективно использовать колоссальные резервы растений и древесины, образующихся
в процессе фотосинтеза.
1.6 Ферменты, участвующие в биоконверсии ЛЦМ
Ферментативная деструкция целлюлозы происходит, как правило, под
действием не отдельных ферментов, а полиферментных систем (комплексов).
Ферментам, входящим в состав этих систем, присуща определенная специализация:
один из них эффективно гидролизуют «внутренние» гликозидные связи между
моносахаридными остатками, удаленными от концов полисахарида (их называют
эндополимеразы, эндоглюканазы, эндоферменты); другие предпочтительно расщепляют
«внешние» гликозидные связи, находящиеся на концах полисахаридной молекулы
(экзодеполимеразы, экзоглюканазы, экзоферменты). Глюкозидазы осуществляют
гидролиз гликозидных связей ди- и олигосахаридов [24].
Гидролиз целлюлозы осуществляется целлюлазными полиферментными системами.
Целлюлазный комплекс состоит из ферментов четырех типов: эндо-1,4-β-глюканазы, экзо-1,4-β-глюкозидазы и целлобиазы.
Целлюлолитические ферменты относятся к классу карбогидраз, катализирующих
гидролиз О-гликозидной связи, и являются одними из самых распространенных в
природе ферментов; они встречаются в животных организмах, высших и низших
растениях, микроорганизмах [1].
В настоящее время «базовой» моделью действия целлюлазного комплекса
является следующая. Эндоглюканаза гидролизует целлюлозу, осуществляя ее
деполимеризацию, диспергирование и в определенной степени разрушение
кристаллической структуры. Одновременно происходит подготовка субстрата для
действия целлобиогидролазы. Оба этих фермента в качестве растворимого продукта
дают целлобиозу, которая под действием β-глюкозидазы (целлобиазы)
гидролизуется до глюкозы.
Существует модификация «базовой» модели. Предполагается, что
эндоглюконаза расщепляет аморфные участки целлюлозы, далее целлобиогидролаза
гидролизует целлюлозу с повышенной кристалличностью. Следует отметить, что в
большинстве случаев гомогенная целлобиогидролаза гидролизует аморфную
целлюлозу, но не активна по отношению к кристаллической [1]. В работе [25]
описан механизм, предполагающий, что напротив, эндоглюконаза обладает высокой
активностью к кристаллической целлюлозе, но не способна гидролизовать
высокомолекулярные продукты собственного действия.
Характерным свойством, присущим целлюлазному комплексу, явление
синергизма, выражающееся во взаимном увеличении скорости и глубины гидролиза
целлюлозы до конечных (растворимых) продуктов при совместном (одновременном)
действии компонентов целлюлазного комплекса по сравнению с индивидуальным
действием этих компонентов. Синергизм был обнаружен при изучении целлюлазных
комплексов из различных источников [26, 27, 28]. В большинстве случаев
синергизм отмечается между компонентами, принадлежащими определенному
целлюлазному комплексу, однако встречается и перекрестный синергизм между
компонентами, относящимся к комплексам из различных источников [1].
Адсорбция целлюлаз является стадией, предшествующей гидролизу, причем
скорость процесса адсорбции существенно превышает скорость гидролитической
стадии. В количественном отношении адсорбция зависит от относительной
концентрации ферментов и субстрата, структурных параметров целлюлозы и степени
ее набухания в воде, рН, температуры, скорости перемешивания в реакционной
смеси [28]. Адсорбция целлюлолитических ферментов увеличивается с понижением
температуры, не меняется в интервале рН 3,5…5,0, но значительно уменьшается с
увеличением рН до 6…7.
Процесс адсорбции может носить многостадийный характер, когда за быстрой
стадией связывания основного количества фермента наблюдается медленная стадия
адсорбции относительно незначительного количества фермента [28]. Не исключено,
что это обусловлено наличием как обратимого, так и необратимого связывания,
хотя в некоторых работах высказывается предположение, что причины заключаются в
относительно медленном диспергировании целлюлазного субстрата и соответствующем
увеличении его поверхности [1, 29].
Важно подчеркнуть, что целлюллолитические ферменты, обладающие одинаковой
специфической активностью, разделяются на две формы с точки зрения их
адсорбционной способности на целлюлозе: прочно и слабо адсорбирующиеся на ней.
Другими словами, в состав целлюлазного комплекса могут входить прочно и слабо
адсорбирующиеся эндоглюконазы, целлобиогидролазы и т.д. Это приводит к тому,
что при гидролизе целлюлозы часть ферментов действует на субстрат, находясь в
растворе (слабо адсорбирующиеся ферменты), другая часть действует в
адсорбированном состоянии (прочно адсорбирующиеся ферменты). Характерно, что
слабо адсорбирующиеся ферменты не обладают заметной способностью
адсорбироваться на целлюлозе при повторном их смешивании с ней. Напротив, десорбция
прочно адсорбирующихся ферментов невелика и становится заметной только при
достижении значительной глубины гидролиза целлюлозы. Наличие двух форм
целлюлолитических ферментов, отличающихся по адсорбционной способности,
обусловлено, по-видимому, существованием множественных форм ферментов,
обладающих различной адсорбционной способностью [1].
1.7 Обоснование выбора направления исследований
Ферментативный гидролиз целлюлозосодержащего сырья обычно проводят в
ацетатном буфере [30]. Однако уксусная кислота является ингибитором спиртового
брожения, поэтому для получения доброкачественных гидролизатов и, в
последующем, биоэтанола, ФГ следует проводить в водной среде.
В ИПХЭТ СО РАН успешно проведено исследование ФГ технических целлюлоз из
нетрадиционного целлюлозосодержащего сырья в ацетатном буфере, процесс
масштабирован в ферментёре объёмом 11 л и проведён в водной среде [31]. В
данной работе в качестве субстрата был выбран лигноцеллюлозный материал (ЛЦМ),
полученный их плодовых оболочек овса и биомассы Мискантуса китайского
- более многокомпонентный и сложный субстрат, чем техническая целлюлоза.
Целью работы является исследование ферментативного
гидролиза (ФГ) лигноцеллюлозных материалов (ЛЦМ) из недревесного растительного
сырья. Для достижения данной цели были поставлены следующие задачи:
1 изучить ферментативный гидролиз ЛЦМ в ацетатном буфере и в водной
среде;
показать зависимость ФГ от концентрации субстрата;
исследовать зависимость эффективности ФГ от условий перемешивания;
установить зависимость ФГ от сырья для получения ЛЦМ;
изучить реакционную способность к ферментации ЛЦМ плодовых оболочек овса
разными ферментными препаратами;
установить зависимость эффективности ФГ от способа подготовки ЛЦМ.
. МАТЕРИАЛЫ И МЕТОДЫ
2.1 Основные показатели используемого материала
В качестве материалов для проведения ферментативного гидролиза, были
использованы лигноцеллюлозные материалы (ЛЦМ) из плодовых оболочек овса (ПОО) и
Мискантуса китайского (М), полученные методом азотнокислой варки в
лабораторных условиях и на опытном производстве (ОП) ИПХЭТ СО РАН.
Принципиальная технологическая блок-схема получения ЛЦМ:
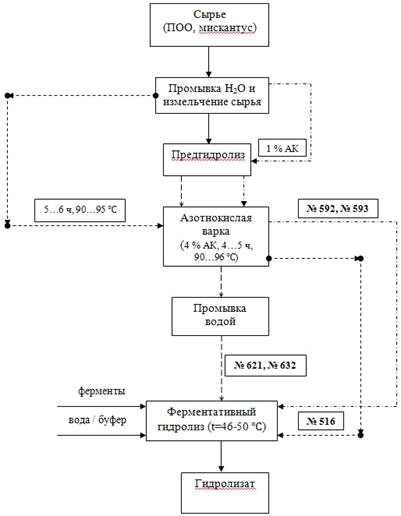
Были использованы следующие субстраты:
. № 516 (ЛЦМ ПОО, получен в лабораторных условиях: промывка водой
+ 4% азотная кислота, 5…6 ч, М = 10, 90…95  );
);
. № 592 ЛЦМ М (получен на ОП-4: предварительный гидролиз 1 %-ным
раствором азотной кислотой с получением целлюлозосодержащего продукта, затем
азотнокислая варка в 4 %-ном растворе азотной кислоты);
. № 593 (ЛЦМ ПОО, полученный на ОП-4: предварительный гидролиз 1
%-ным раствором азотной кислотой с получением целлюлозосодержащего продукта,
затем азотнокислая варка в 4 %-ном растворе азотной кислоты);
. № 621 (ЛЦМ ПОО, получен в лабораторных условиях: промывка водой,
обработка 0,5 % АК при М=15 и температуре 90…96  в течение 2…3 ч, затем обработка 4 %
АК при М=15 и температуре 90…96
в течение 2…3 ч, затем обработка 4 %
АК при М=15 и температуре 90…96  в течение 4…5 ч, затем промывка водой);
в течение 4…5 ч, затем промывка водой);
. № 632 (ЛЦМ М, получен в лабораторных условиях: промывка водой,
обработка 0,5 % АК при М=15 и температуре 90…96  в течение 2…3 ч, затем обработка 4 %
АК при М=15 и температуре 90…96
в течение 2…3 ч, затем обработка 4 %
АК при М=15 и температуре 90…96  в течение 4…5 ч, затем промывка водой).
в течение 4…5 ч, затем промывка водой).
Таблица 1 - Характеристики сырья
|
Характеристики м.д., %* на а.с.с.
|
Номер образца
|
|
№ 516
|
№ 592
|
№ 593
|
№ 621
|
№ 632
|
|
Целлюлоза по Кюршнеру*
|
?
|
88,55
|
79,21
|
93,13
|
88,30
|
|
Влага, %
|
7,0
|
6,2
|
5,1
|
9,8
|
7,5
|
|
Зола*
|
9,85
|
4,75
|
8,19
|
8,68
|
3,84
|
|
Пентозаны*
|
?
|
7,89
|
9,22
|
23,32
|
13,8
|
|
Лигнин*
|
17,35
|
10,82
|
13,78
|
13,05
|
11,83
|
|
α-целлюлоза*
|
73,51
|
86,76
|
79,44
|
80,05
|
80,09
|
.2 Основные характеристики вспомогательных
материалов
.2.1 Вода дистиллированная
Вода дистиллированная (Н2О). Бесцветная прозрачная жидкость без запаха,
вкуса и цвета; хорошо растворима в спирте; М = 18,02; Тпл = 0 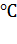 ; Ткип = 100
; Ткип = 100 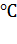 ; ρ = 1 г/см3 [32].
; ρ = 1 г/см3 [32].
2.2.2 Кислота соляная
Соляная кислота (НСl).
Бесцветная жидкость с резким запахом, в воздухе образует белый туман. Сильная
кислота, растворяет большинство металлов с образованием солей и выделением
водорода; очень хорошо растворяется в воде. Сильными окислителями окисляется до
хлора. М = 36,46; Тпл = - 114,2  ; Ткип = - 85,08
; Ткип = - 85,08  ; ρ = 1,184 [32].
; ρ = 1,184 [32].
2.2.3 Спирт этиловый
Спирт этиловый (С2Н5ОН). Бесцветная жидкость с характерным спиртовым
запахом и жгучим вкусом, хорошо растворимая в воде, эфире, хлороформе,
метаноле. М = 46,07; Тпл = - 114,15  ; Ткип = 78,39
; Ткип = 78,39  ; Твсп = 16,1
; Твсп = 16,1  ; Тсвспл = 404
; Тсвспл = 404  ; d420 = 0,7893, nD20 =
1,3611 [32].
; d420 = 0,7893, nD20 =
1,3611 [32].
.2.4 Гидроокись натрия
Гидроокись натрия (NaOH). Бесцветные ромбические кристаллы; М = 40,00;
плотность 2,13 г/см3; Tпл = 320 ºC, Tкип = 1378 ºC. Хорошо растворим в этаноле,
метаноле, глицерине; плохо растворим в диэтиловом эфире, ацетоне [32].
.2.5 Кислота уксусная
Кислота уксусная (СН3СООН). Бесцветная прозрачная жидкость с резким
запахом; Ткип = 117,8 °C; плотность 1,0492 г/см3; Твсп = 38 °C. Температурный
предел взрываемости находится от 35 ºC до 76 ºC [32].
2.2.6 Хлорное железо
Хлорное железо (FeCl3).
Красно-коричневые тригональные кристаллы; М = 162,21; плотность 2,9 г/см3; Tпл
= 307,5 ºC,
Tкип = 315 ºC.
Хорошо растворим в этаноле,
ацетон, диэтиловый эфир [32].
2.2.7 Ацетат натрия
Ацетат натрия (CH3COONa). Бесцветные моноклинные кристаллы;
М = 82,03; плотность 1,528 г/см3; Tпл = 324 ºC. Плохо растворим в этаноле, диэтиловом
эфире [32].
2.2.8 3,5-динитросалициловая кислота
3,5-динитросалициловая кислота (C7H4O7N2).
Кристаллический порошок светло-желтого цвета; М = 228,12; Tпл = 173-174 ºC.
Хорошо растворим в
этаноле, эфире, воде. Обладает общетоксическим действием. ПДК в воздухе - 0,5
мг/м3 [32].
2.2.9 Виннокислый калий-натрий
Виннокислый калий-натрий (KOOC(CHOH)2COONa×4H2O). Бесцветные кристаллы; М = 282,1; Tпл
= 55,6 ºC. Хорошо
растворим в воде.
2.3 Приготовление реактивов
.3.1 Приготовление раствора орсина
Массу (0,400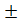 0,025) г орсина растворяют в (9,5
0,025) г орсина растворяют в (9,5 0,05) моль/дм3 (9,5
0,05) моль/дм3 (9,5 0,05) н. растворе соляной кислоты,
добавляют 1 см3 раствора хлорного железа и доводят объем раствора в мерной
колбе вместимостью 1000 см3 до метки (срок хранения три недели) [33].
0,05) н. растворе соляной кислоты,
добавляют 1 см3 раствора хлорного железа и доводят объем раствора в мерной
колбе вместимостью 1000 см3 до метки (срок хранения три недели) [33].
2.3.2 Приготовление ацетатного буфера
29 см3 ледяной уксусной кислоты наливают в мерную колбу вместимостью 500
см3 и доводят объем дистиллированной водой до метки. 41 г ацетата натрия
помещают в мерную колбу вместимостью 500 см3 и доводят объем дистиллированной
водой до метки. Полученные растворы смешивают [34].
2.3.3 Приготовление реактива на основе
3,5-динитросалициловой кислоты
Предварительно готовят раствор натрия гидроокиси массовой доли 10,7 %.
Для этого растворяют 16,05 г гидроокиси натрия в 150 см3 дистиллированной воды.
Полученный раствор охлаждают до комнатной температуры.
Для приготовления реактива динитросалициловой кислоты (ДНС) массовой доли
1,0 % в стакан вместимостью 1 л вносят 10,0 г ДНС и 400 см3 дистиллированной
воды. Перемешивают в течение 25…30 мин при комнатной температуре. Затем
постепенно, при постоянном перемешивании добавляют 150 см3 раствора гидроокиси
натрия. При этом окраска раствора меняется от светло-желтой до ярко-желтой.
Стакан с полученным раствором помещают в водяную баню с температурой (47 +
1)  и постепенно небольшими порциями
добавляют 300 г виннокислого калия-натрия. Перемешивание продолжают при той же
температуре до полного растворения реактива.
и постепенно небольшими порциями
добавляют 300 г виннокислого калия-натрия. Перемешивание продолжают при той же
температуре до полного растворения реактива.
Раствор охлаждают холодной водой до комнатной температуры, переносят в
мерную колбу вместимостью 1 л, доводят объем до метки дистиллированной водой,
при необходимости фильтруют через воронку со стеклянным фильтром.
Приготовленный реактив должен иметь ярко-желтое окрашивание (без красного
оттенка).
Срок хранения раствора в темной бутыли при комнатной температуре - не
более 6 месяцев.
При необходимости (в случае образования осадка) раствор фильтруют через
воронку со стеклянным фильтром [35].
2.3.4 Приготовление 17,5 %-го раствора
гидроксида натрия
Навеску гидроокиси натрия 17,5 г, взвешенную с точностью до 0,01 г,
растворяют в фарфоровом стакане в 82,5 см3 свежепрокипячённой дистиллированной
воды. Полученный раствор переносят в бутыль и отстаивают в течение 10…20 суток
до полного осаждения карбонатов. Прозрачный раствор по окончании времени
отстаивания сливают в другую бутыль, при помощи сифона, не взбалтывая [36].
2.3.5 Приготовление 9,5 %-го раствора гидроксида
натрия
Навеску гидроокиси натрия 9,5 г, взвешенную с точностью до 0,01 г,
растворяют в фарфоровом стакане в 90,5 см3 дистиллированной воды. Раствор
хранят в полиэтиленовых или стеклянных бутылях [36].
2.4 Методики анализов
2.4.1 Методика определения концентрации
редуцирующих веществ в пересчете на глюкозу на спектрофотометре Unico UV-2804
Метод основан на восстановлении редуцирующим сахаром
3,5-динитросалициловой кислоты (желтый цвет) в 3-амино-5-нитросалициловую
(желто-оранжевый цвет). Образовавшуюся 3-амино-5-нитросалициловую кислоту
определяют спектрофотометрически при длине волны 530 нм.
Все моносахариды (глюкоза, фруктоза, ксилоза, арабиноза, галактоза и др.)
и некоторые дисахариды, в том числе целлобиоза, относятся к группе редуцирующих
(восстанавливающих) сахаров, то есть соединений, способных вступать в реакцию
восстановления.
Расчет концентрации редуцирующих веществ осуществляется по калибровочному
графику.
В случае определения концентрации редуцирующих веществ в пересчете на
другой восстанавливающий сахар по нему строится калибровочный график и по этому
графику ведется определение концентрации.
Для спектрофотометрического анализа с учетом чувствительности методики
определения концентрация восстанавливающих сахаров в растворе должна находится
в интервале от 0,2 до 2 г/л. В мерные колбы на 25 см3 пипеткой вносят по 1 см3
испытуемого раствора, при необходимости профильтрованного, и 2 см3 реактива ДНС
и быстро перемешивают. Одновременно готовят контрольную пробу. Для этого к 1
см3 дистиллированной воды добавляют 2 см3 реактива ДНС.
Колбы помещают в кипящую водяную баню и кипятят в течение 5 мин с
точностью, измеряемой по секундомеру или песочным часам. Колбы охлаждают в
холодной воде до комнатной температуры, доводят до метки дистиллированной
водой, тщательно перемешивают и измеряют оптическую плотность растворов на
двухлучевом спектрофотометре UNICO UV - 2804 при
длине волны 530 нм в кюветах с толщиной поглощающего свет слоя 10 мм.
Рабочая зона калибровочного графика лежит в пределах оптической плотности
от 0,15 до 1,5. В случае если оптическая плотность исследуемого раствора меньше
0,15, то берут большее количество раствора, если больше 1,5, то раствор
дополнительно разводят. Это учитывают при расчете истинной концентрации
исследуемого раствора.
Абсолютная погрешность данного метода составляет 0,01725 г/л.
Относительная погрешность 3,45 %.
Сходимость измерений, то есть степень близости друг к другу результатов,
полученных при исследовании одного и того же образца в одной и той же
лаборатории, в небольшой промежуток времени, на одном и том же аппарате, одним
и тем же оператором, с химическими реагентами из одной и той же партии составляет
0,0019 г/л.
2.4.2 Методика определения массовой доли
пентозанов
Навеску целлюлозы помещают в круглодонную колбу. Туда же насыпают 20 г
хлористого натрия и с помощью мерного цилиндра наливают 100 см3 раствора с
массовой долей соляной кислоты 13 %.
Круглодонную колбу помещают в баню с глицерином и присоединяют к
установке. При этом уровень глицерина следует поддерживать на 1,5…2,0 см выше
уровня жидкости в колбе. В глицериновой бане укрепляют термометр. Установку
помещают в вытяжной шкаф.
Сбор дистиллята следует производить в мерный стакан или цилиндр,
помещенный для охлаждения в кристаллизаторе с холодной водой.
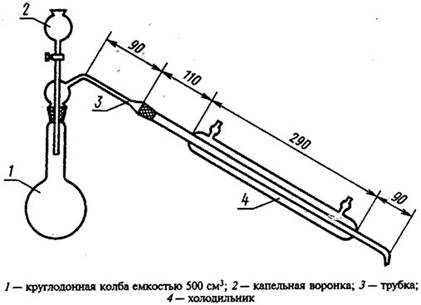
Рисунок 2 - Установка для определения массовой доли пентозанов
Нагревание глицериновой бани регулируется. Температуру глицерина
необходимо поддерживать 164…166  . При этом отгонка дистиллята должна происходить со скоростью
30 см3 в течение 10 мин. После отгонки каждых 30 см3 из капельной воронки в
круглодонную колбу приливают по 30 см3 раствора с массовой долей соляной
кислоты 13 %.
. При этом отгонка дистиллята должна происходить со скоростью
30 см3 в течение 10 мин. После отгонки каждых 30 см3 из капельной воронки в
круглодонную колбу приливают по 30 см3 раствора с массовой долей соляной
кислоты 13 %.
Отгоняют 225 см3 дистиллята.
После окончания отгонки дистиллят из мерного стакана переносят в мерную
колбу вместимостью 250 см3, стакан ополаскивают небольшим количеством раствора
с массовой долей соляной кислоты 13 % и объем в колбе доводят до метки
раствором той же кислоты.
Колбу закрывают пробкой и содержимое в колбе тщательно перемешивают.
После перемешивания отбирают пипеткой 5 см3 раствора и переносят в колбу
вместимостью 100 см3. Туда же пипеткой с помощью резиновой груши вносят 25 см3
раствора орсина, затем колбу закрывают пробкой и содержимое колбы перемешивают
и выдерживают в течение 50 мин при (20±0,5)  .
.
Через 50 мин к содержимому в колбе приливают пипеткой 20 см3 этилового
спирта. После перемешивания содержимое колбы слегка охлаждают и выдерживают при
(20±0,5)  в течение 10…15 мин.
в течение 10…15 мин.
Одновременно таким же способом готовят контрольную пробу, в которой
анализируемый раствор заменяют 5 см3 раствора с массовой долей соляной кислоты
13 %. Выдерживают контрольную пробу вместе с испытуемыми пробами.
Через 10…15 мин после приготовления растворов определяют их оптическую
плотность относительно контрольной пробы на фотоэлектроколориметре с длиной
волны 630 нм (красный фильтр).
Предварительный выбор кювет производят в зависимости от величины
оптической плотности испытуемой пробы. Номинальная величина оптической
плотности должна быть в пределах 0,3…0,5.
Применяют кюветы с толщиной поглощающего света слоя 10, 20 и 50 мм.
По полученной величине оптической плотности, пользуются соответствующим
градуировочным графиком, находят массу пентозанов в пробе.
Массовую долю пентозанов в процентах к абсолютно сухой целлюлозе
вычисляют по формуле:
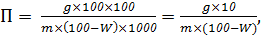 (3)
(3)
где g - масса пентозанов в пробе, мг;
m -
масса навески воздушно-сухой целлюлозы, г;
W -
влажность целлюлозы, %
За результат анализа следует принимать среднее арифметическое результатов
двух параллельных определений, округленное до десятых долей процента.
Расхождение между параллельными определениями при доверительной вероятности Р =
0,95 не должно превышать 0,2 % при массовой доле пентозанов до 3 % и 0,4 % при
массовой доле пентозанов свыше 3 % [33].
2.4.3 Методика определения влажности
Навески сырья не более 3 г помещают в предварительно вымытые, высушенные
и взвешенные стеклянные бюксы. Взвешивание навесок в бюксах производят вместе с
крышками.
Взвешенные бюксы с навесками открывают и помещают вместе с крышками в
сушильный шкаф, предварительно нагретый до 105…110  , и сушат при этой температуре в
течение 2 ч. Вынутые из шкафа бюксы закрывают крышками, ставят на керамическую
плитку или металлический лист и охлаждают не менее 5 мин, а затем в эксикаторе
до комнатной температуры и взвешивают. Все взвешивания производят с
погрешностью не более 0,0002 г.
, и сушат при этой температуре в
течение 2 ч. Вынутые из шкафа бюксы закрывают крышками, ставят на керамическую
плитку или металлический лист и охлаждают не менее 5 мин, а затем в эксикаторе
до комнатной температуры и взвешивают. Все взвешивания производят с
погрешностью не более 0,0002 г.
Влажность w определяют
по формуле:
 ,(4)
,(4)
где
mвл - масса
влаги, г;
mнав - масса навески до высушивания, г;
m - масса
навески после высушивания, г.
Масса
навески до высушивания определяется по формуле:
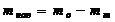 ,(5)
,(5)
где
mо - масса
тигля с навеской, г;
mт - масса тигля, г.
Влажность
определяют параллельно в трех навесках. За окончательный результат принимают
среднее арифметическое трех параллельных определений в пределах допускаемых
расхождений по влажности, которые не должны превышать 0,5 %. Вычисление
результатов анализа производят до второго десятичного знака. Окончательные
результаты округляют до первого десятичного знака.
Допускается
использовать металлические стаканчики с крышкой диаметром 50…60 мм и высотой
30…40 мм, навеску целлюлозы сушить при температуре 130…140  в течение 30 минут, проводить охлаждение в эксикаторе
без термометра [36].
в течение 30 минут, проводить охлаждение в эксикаторе
без термометра [36].
В
ИПХЭТ СО РАН влажность можно определять с помощью анализатора влажности «МВ
23».
2.4.4 Определение содержания альфа-целлюлозы весовым
методом
Из
объединенной пробы воздушно-сухой целлюлозы, разрезанной на кусочки размером 10×10 мм, берут навеску массой около 3 г, взвешенную с
погрешностью не более 0,0002 г, помещают в фарфоровый стакан вместимостью 150
см3 и заливают 45 см3 17,5 %-ного раствора NaOH,
температура которого (20±0,2)  . В
отдельной пробе определяют влажность целлюлозы. Раствор гидроксида натрия
заливают порциями: вначале приливают 15 см3 и осторожно в течение 2...3 минут
размешивают целлюлозу стеклянной палочкой с плоским концом. Затем добавляют
остальную часть раствора (30 см3) и еще равномерно и осторожно размешивают в
течение 1 мин. Стакан со смесью покрывают часовым стеклом и помещают в
термостат с температурой (20±0,2)
. В
отдельной пробе определяют влажность целлюлозы. Раствор гидроксида натрия
заливают порциями: вначале приливают 15 см3 и осторожно в течение 2...3 минут
размешивают целлюлозу стеклянной палочкой с плоским концом. Затем добавляют
остальную часть раствора (30 см3) и еще равномерно и осторожно размешивают в
течение 1 мин. Стакан со смесью покрывают часовым стеклом и помещают в
термостат с температурой (20±0,2)  на 45
мин, считая с начала обработки целлюлозы щелочью.
на 45
мин, считая с начала обработки целлюлозы щелочью.
По
истечении этого времени к массе приливают 45 см3 дистиллированной воды (20±0,2)
 , осторожно перемешивают в течение 1,5 мин и переносят
массу на стеклянный фильтр. Целлюлозную массу равномерно распределяют на
фильтре и отсасывают фильтрат в приёмную колбу. При фильтровании во избежание
потерь волокна фильтрат пропускают дважды через слой волокна. Остаток на
фильтре при слабом вакууме промывают в три приема по 25 см3 9,5 %-ным раствором
NaOH с температурой (20±0,2)
, осторожно перемешивают в течение 1,5 мин и переносят
массу на стеклянный фильтр. Целлюлозную массу равномерно распределяют на
фильтре и отсасывают фильтрат в приёмную колбу. При фильтровании во избежание
потерь волокна фильтрат пропускают дважды через слой волокна. Остаток на
фильтре при слабом вакууме промывают в три приема по 25 см3 9,5 %-ным раствором
NaOH с температурой (20±0,2)  . Каждую новую порцию промывной щелочи прибавляют лишь
после полного отсоса предыдущей порции. Общая продолжительность промывки
щелочью должна быть 2...3 мин. После отсоса щелочи волокно промывают отдельными
порциями дистиллированной воды при температуре 18...20
. Каждую новую порцию промывной щелочи прибавляют лишь
после полного отсоса предыдущей порции. Общая продолжительность промывки
щелочью должна быть 2...3 мин. После отсоса щелочи волокно промывают отдельными
порциями дистиллированной воды при температуре 18...20  с промежуточным отсосом. Промывку ведут до
нейтральной реакции по фенолфталеину. По окончании промывки отсасывание
продолжают до исчезновения капель на кончике воронки при уплотнении палочкой.
Промытый остаток (альфа-целлюлозу) пинцетом переносят в предварительно
высушенный до постоянной массы бюкс и высушивают в сушильном шкафу при
температуре (103±2)
с промежуточным отсосом. Промывку ведут до
нейтральной реакции по фенолфталеину. По окончании промывки отсасывание
продолжают до исчезновения капель на кончике воронки при уплотнении палочкой.
Промытый остаток (альфа-целлюлозу) пинцетом переносят в предварительно
высушенный до постоянной массы бюкс и высушивают в сушильном шкафу при
температуре (103±2)  в течение 6...7 ч до постоянной массы. По окончании
сушки бюкс помещают в эксикатор, охлаждают и взвешивают.
в течение 6...7 ч до постоянной массы. По окончании
сушки бюкс помещают в эксикатор, охлаждают и взвешивают.
Массовую
долю альфа-целлюлозы, % к абсолютно сухой целлюлозе, вычисляют по формуле:
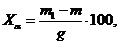 (6)
(6)
где
m - масса пустого бюкса, г;
m1 - масса бюкса
с высушенной альфа-целлюлозой, г;
g - абсолютно
сухая навеска целлюлозы, г.
За
результат испытания принимают среднее арифметическое двух параллельных
определений, округлённое до 0,1 %. Расхождение между двумя параллельными
определениями не должно превышать 0,3 % [37].
.5 Характеристика ферментных препаратов
В качестве катализаторов были использованы препараты «Брюзайм BGX», «Рапидаза CR» (производитель «Polfa Tarchomin Pharmaceutical Works S.A.»,
Польша, для компании «Diadic International Inc.», США) и «ЦеллоЛюкс-А» (производитель ООО ПО
«Сиббиофарм», Россия, г. Бердск). Ферментативные активности препарата грибного
происхождения «ЦеллоЛюкс-А», препарата «Брюзайм BGX» (продуцент Trichoderma longibrachiatum) и
препарата «Рапидаза CR» приведены в
таблице 2.
Таблица 2 - Характеристики ферментных препаратов
|
Наименование препарата
|
Параметры обработки
|
Активность
|
|
температура, 
|
рН
|
|
|
Целлолюкс-А
|
30-70
|
3-7
|
Целлюлазная: 2000±200 ед/г; Ксиланазная: 8000 КС; β-Глюканазная: 1500 β-ГлС;
|
|
Брюзайм BGX
(грибная гемицеллюлаза)
|
30-50
|
3,5-5,5
|
Ксиланазная: 6500+5 % ед КС/см3; β-Глюканазная: 1450+5 % ед β-ГкС/см3; Целлюлазная: 1500 ед.+5 %
ед КМЦ/см3;
|
|
Рапидаза ЦР
|
10-50
|
3,5-5,8
|
Высокоэффективный комплекс гемицеллюлазных и
пектолитических ферментов
|
Препарат «Целлолюкс-А» позиционируется на рынке как целлюлаза для
расщепления некрахмалистых полисахаридов, «Брюзайм BGX» как гемицеллюлаза, «Рапидаза ЦР» - это
пектолитический препарат.
. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Данная работа выполнена в рамках партнерского проекта
фундаментальных исследований № 11, выполняемому ИПХЭТ СО РАН совместно с
организациями УрО РАН «Химическая, механохимическая и ферментативная деструкция
целлюлозосодержащего сырья для получения ценных продуктов».
3.1 Ферментативный гидролиз ЛЦМ в ацетатном
буфере и в водной среде
В ИПХЭТ СО РАН ранее проводились работы по изучению ФГ технических целлюлоз
в ацетатном буфере и в водной среде с последующим сбраживанием полученных
гидролизатов в этанол [38, 39, 40]. Эти исследования носили фундаментальный
характер, так как получение технической целлюлозы достаточно дорого.
Для проведения данного опыта гидролизу подвергались следующие образцы:
ЛЦМ ПОО № 516, ЛЦМ Мискантуса № 592; ЛЦМ ПОО № 593. Их характеристики
представлены в таблице 1. При этом гидролиз каждого образца проводился в
ацетатном буфере (рН 4,7) и в водной среде (активная кислотность регулировалась
с помощью ортофосфорной кислоты и была в пределах 4,7…4,8 ед. рН). Концентрация
субстрата во всех опытах составила 33,3 г/л. В качестве катализаторов
использовалась композиция ферментных препаратов «Целлолюкс - А» и «Брюзайм BGX», внесённых в количестве 0,02 г
фермента на 1 г субстрата в начале ферментации и через 60 часов. Концентрация
редуцирующих веществ определялась спектрофотометрическим способом в пересчёте
на глюкозу. Ферментация продолжалась 72 часа при температуре 50  , в инкубаторе «UNIMAX 1010» с частотой перемешивания 170
мин-1.
, в инкубаторе «UNIMAX 1010» с частотой перемешивания 170
мин-1.
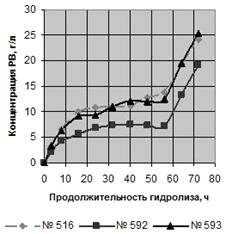
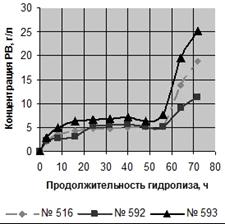
Зависимости концентрации редуцирующих веществ (РВ) от продолжительности
ферментативного гидролиза в ацетатном буфере и в водной среде приведены на
рисунке 2, концентрации редуцирующих веществ в зависимости от продолжительности
гидролиза, а так же их выход по окончании ферментации - в таблице 3.
|
Время гидролиза, ч
|
Концентрация РВ в образцах
|
|
516
|
592
|
593
|
|
Водная среда
|
Ацетатный буфер
|
Водная среда
|
Ацетатный буфер
|
Водная среда
|
Ацетатный буфер
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
3
|
2,1
|
3,1
|
2,1
|
2,2
|
2,8
|
3,3
|
|
12
|
3,6
|
6,5
|
2,8
|
4,4
|
4,8
|
6,4
|
|
20
|
4,2
|
9,9
|
2,9
|
5,6
|
6,3
|
9,1
|
|
28
|
4,7
|
10,9
|
5,2
|
6,8
|
6,6
|
9,4
|
|
36
|
4,7
|
11,0
|
5,5
|
7,4
|
6,7
|
10,9
|
|
44
|
4,9
|
11,3
|
5,5
|
7,6
|
7,0
|
12,2
|
|
52
|
5,0
|
12,8
|
5,1
|
7,3
|
6,2
|
12,0
|
|
60
|
5,1
|
13,8
|
5,0
|
7,2
|
7,6
|
12,5
|
|
64
|
13,8
|
19,3
|
9,0
|
13,3
|
19,5
|
19,5
|
|
72
|
18,8
|
24,2
|
11,4
|
19,2
|
25,1
|
25,4
|
|
Выход РВ, % от массы субстрата
|
56,5
|
72,7
|
34,2
|
57,7
|
75,4
|
76,3
|
 А
А
 Б
Б
Рисунок 2 - Зависимость концентрации РВ от продолжительности
ферментативного гидролиза: А - в ацетатном буфере, Б - в водной среде
Таким образом, во всех образцах гидролиз быстрее шёл в ацетатном буфере,
несмотря на близкие значения активной кислотности. До вторичного внесения
ферментных препаратов, в процессе гидролиза концентрация РВ в ацетатном буфере
всех образцов была примерно в два раза выше, чем в водной среде. Однако только
в образце № 593 после вторичного добавления ферментных препаратов в водной
среде получен выход РВ, аналогичный выходу в ацетатном буфере - 75, 4 и 76,3 %
соответственно.
Следовательно, ФГ ЛЦМ возможно проводить в водной среде и получать выход,
соответствующий выходу РВ в ацетатном буфере. Использование водной среды
позволит получать доброкачественные гидролизаты для дальнейшего сбраживания
[41].
3.2 Зависимость ФГ от концентрации субстрата
Целью данной работы является исследование влияние концентрации субстрата
на ФГ лигноцеллюлозного материала в водной среде.
Характеристики использованных ЛЦМ М № 592 и ЛЦМ ПОО № 593 представлены в
таблице 1. ЛЦМ ПОО характеризуется меньшей массовой долей (МД) целлюлозы и
большей МД пентозанов, являющихся более легко гидролизующимся субстратом. МД
золы в ЛЦМ ПОО в два раза выше, чем в ЛЦМ М.
Гидролиз проводился в водной среде при активной кислотности 4,6…4,8 ед.
рН, которая регулировалась с помощью ортофосфорной кислоты. Опыты проводились
при концентрации субстратов 90,0 и 33,3 г/л. В качестве катализаторов
использовалась композиция ферментных препаратов «Целлолюкс А» и «Брюзайм BGX», внесённых в количестве 0,02 г / 1
г субстрата в начале ферментации и через 60 ч. Ферментация продолжалась 72 ч
при перемешивании на платформе «ПЭ - 6410 М» с частотой 150 мин-1. Температура
гидролиза 50  . Концентрация РВ определялась спектрофотометрическим
способом в пересчёте на глюкозу.
. Концентрация РВ определялась спектрофотометрическим
способом в пересчёте на глюкозу.
Концентрации РВ в зависимости от продолжительности ФГ, так же их выход по
окончании ферментации представлены в таблице 4. Зависимости концентрации РВ от
продолжительности ФГ в водной среде приведены на рисунке 3.
ферментативный гидролиз целлюлоза сырьё
Таблица 4 - Концентрации РВ в зависимости от продолжительности ФГ, так же
их выход по окончании ферментации
|
Продолжительность гидролиза, ч
|
Концентрация РВ в образцах
|
|
ЛЦМ М № 592
|
ЛЦМ ПОО № 593
|
|
90 г/л
|
33,3 г/л
|
90 г/л
|
33,3 г/л
|
|
3
|
4,3
|
2,12
|
7,69
|
2,85
|
|
12
|
8,1
|
2,75
|
16,7
|
4,89
|
|
20
|
8,66
|
2,97
|
19,8
|
6,33
|
|
28
|
15,6
|
5,20
|
20,9
|
6,61
|
|
36
|
17,3
|
5,46
|
21,3
|
6,72
|
|
44
|
19,7
|
5,51
|
25,8
|
7,04
|
|
52
|
20,4
|
5,05
|
26,5
|
6,23
|
|
60
|
21
|
5,02
|
27,9
|
7,66
|
|
64
|
21,2
|
9,04
|
28,08
|
19,5
|
|
72
|
27,5
|
11,4
|
60,2
|
25,1
|
|
Выход РВ, % от массы субстрата
|
30,5
|
34,2
|
66,9
|
75,4
|
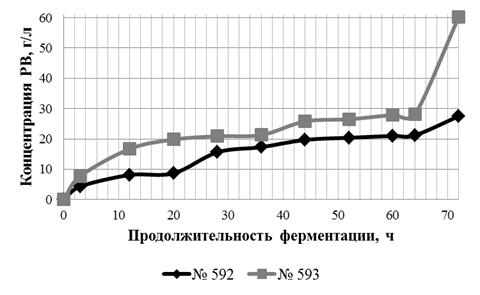
А
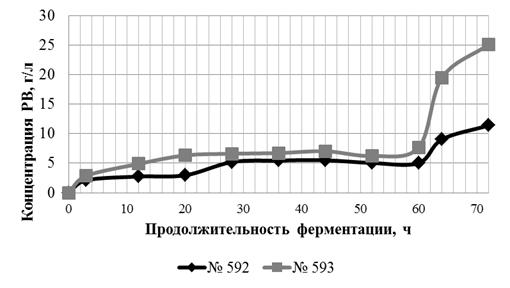
Б
Рисунок 3 - Зависимость концентрации РВ от продолжительности
ферментативного гидролиза ЛЦМ М и ЛЦМ ПОО в водной среде: А - 90 г/л, Б - 33,3
г/л
Из полученных данных следует, что выход для ЛЦМ ПОО с концентраций
субстрата 33,3 г/л в 1,12 раз больше, чем у ЛЦМ ПОО с концентрацией субстрата
90 г/л. То есть, повышение концентрации субстрата снижает эффективность
процесса гидролиза. Для ЛЦМ М такой закономерности нет, выходы находятся примерно
на одном уровне.
Сравнение ферментативного гидролиза ЛЦМ М и ЛЦМ ПОО показывает, что ПОО
гидролизуется полнее. Это можно объяснить природой субстрата и
физико-химическими характеристиками исходных ЛЦМ. ЛЦМ ПОО представляет собой
рыхлую массу, в то время как ЛЦМ М состоит из довольно плотных конгломератов
размером до 1 см. Для получения более высокого выхода РВ при работе с ЛЦМ М
необходимо отработать способы предварительного измельчения субстратов.
Гидролиз ЛЦМ в водной среде был проведён впервые. Для ЛЦМ ПОО получен
неплохой выход РВ. Необходимо продолжить изучение ФГ с целью повышения выхода
РВ и получения концентрированных гидролизатов, пригодных для спиртового
брожения [42].
3.3 Зависимость эффективности ФГ от условий
перемешивания
Целью данной работы являлось исследование влияния перемешивания в ходе
ферментативного гидролиза на его эффективность. В качестве сырья для проведения
работы использовались ЛЦМ М № 592 и ЛЦМ ПОО № 560. Характеристики данных ЛЦМ
представлены в таблице 1.
Гидролиз каждого образца проводился в водной среде при рН 4,6…4,8 ед. рН,
это естественный уровень активной кислотности для суспензии данного субстрата.
Концентрация субстрата во всех опытах составила 90 г/л. В качестве
катализаторов использовалась композиция ферментных препаратов «Целлолюкс - А» и
«Брюзайм BGX», внесённых в количестве 0,02 г / 1
г субстрата. Ферментация проводилась при температуре 50  в течение 60 ч. Были исследованы
следующие режимы перемешивания:
в течение 60 ч. Были исследованы
следующие режимы перемешивания:
А) контроль, в статических условиях;
Б) на перемешивающей платформе «ПЭ - 6410 М» с частотой перемешивания 150
мин-1;
В) на инкубаторе «UNIMAX
1010» с частотой перемешивания 170 мин-1.
Концентрация редуцирующих веществ (РВ) определялась
спектрофотометрическим способом в пересчёте на глюкозу.
Концентрации РВ в зависимости от продолжительности ФГ, так же их выход по
окончании ферментации представлены в таблице 5. Зависимости концентрации РВ от
продолжительности ФГ в статических условиях и при перемешивании приведены на
рисунке 4.
Таблица 5 - Результаты проведения ферментации
|
Время гидролиза, ч
|
Образцы и способы ферментации
|
|
№ 592
|
№ 593
|
|
А
|
Перемешка
|
Инкубатор
|
А
|
Перемешка
|
Инкубатор
|
|
3
|
20,6
|
4,3
|
5,4
|
15,0
|
7,7
|
4,7
|
|
8
|
24,5
|
7,6
|
7,0
|
32,9
|
17,5
|
7,7
|
|
12
|
24,6
|
8,1
|
7,5
|
35,2
|
24,8
|
15,7
|
|
20
|
25,0
|
12,5
|
11,1
|
36,1
|
26,3
|
18,4
|
|
28
|
25,0
|
21,3
|
13,7
|
35,9
|
30,2
|
23,7
|
|
36
|
25,1
|
25,3
|
15,9
|
35,3
|
36,3
|
24,1
|
|
44
|
24,9
|
26,1
|
17,5
|
35,3
|
40,4
|
25,0
|
|
52
|
24,8
|
26,8
|
19,1
|
35,3
|
40,5
|
25,3
|
|
60
|
24,5
|
27,8
|
19,7
|
36,6
|
42,1
|
25,9
|
|
Выход РВ, % от массы субстрата
|
27,2
|
30,8
|
21,8
|
40,6
|
46,7
|
28,7
|
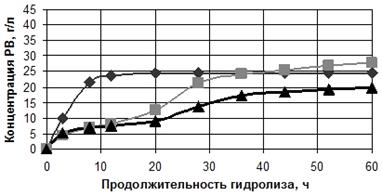
а)
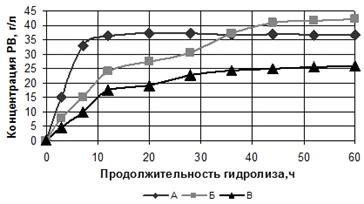
б)
А - контроль, статические условия; Б - частота перемешивания 150 мин-1; В
- частота перемешивания 170 мин-1
Рисунок 4 - Зависимости концентрации РВ от продолжительности ферментативного
гидролиза в зависимости от частоты перемешивания: а) ЛЦМ М; б) ЛЦМ ПОО
Для обоих видов сырья ферментация в статических условиях обеспечивает
более быстрое накопление РВ - уже через 8 часов графики выходят на плато. При
этом концентрация РВ в гидролизатах выше, чем при ферментации в условиях
перемешивания. Однако это не обеспечивает максимального выхода сахаров. При
перемешивании с частотой 150 мин-1 (вариант Б) реакция гидролиза проходит
глубже: через 60 ч для ЛЦМ М выход РВ на 3 г/л выше, чем при ферментации в
статических условиях, для ЛЦМ ПОО - на 6 г/л. Частота перемешивания 170 мин-1
оказывается избыточной для обоих видов субстрата. При таких условиях
концентрация РВ минимальна. Это можно объяснить тем, что лимитирующей стадией
ферментативного гидролиза целлюлозы является присоединение фермента к субстрату
[1].
Сравнение ферментативного гидролиза ЛЦМ М и ЛЦМ ПОО показывает, что ПОО
гидролизуется полнее. Это можно объяснить природой субстрата и
физико-химическими характеристиками исходных ЛЦМ. ЛЦМ ПОО характеризуется
меньшей МД целлюлозы и большей МД пентозанов, являющихся более легко
гидролизующимся субстратом.
В результате проведенной работы можно сделать вывод о целесообразности
первые 8 ч проводить ферментацию без перемешивания, а далее с перемешиванием с
частотой не более 150 мин-1 [43].
3.4 Зависимость ФГ от сырья для получения ЛЦМ
В данной работе в качестве сырья использованы ЛЦМ М № 592 и ЛЦМ ПОО №
593, полученные в одну стадию методом азотнокислой варки в 4 %-ной азотной
кислоте. Характеристика материалов представлена в таблице 1.
Гидролиз проводился в водной среде при активной кислотности 4,6…4,8 ед.
рН, которая регулировалась с помощью ортофосфорной кислоты. Концентрация
субстратов составила 90 г/л. В качестве катализаторов использовалась композиция
ферментных препаратов «Целлолюкс А» и «Брюзайм BGX», внесённых в количестве 0,02 г фермента на 1 г
субстрата в начале ферментации и через 60 ч. Ферментация продолжалась 72 ч при
перемешивании на платформе «ПЭ - 6410 М» с частотой 150 мин-1. Температура
гидролиза 50  . Концентрация РВ определялась спектрофотометрическим
способом в пересчёте на глюкозу.
. Концентрация РВ определялась спектрофотометрическим
способом в пересчёте на глюкозу.
Концентрации РВ в зависимости от продолжительности ФГ, так же их выход по
окончании ферментации представлены в таблице 6. Зависимости концентрации РВ от
продолжительности ФГ в статических условиях и при перемешивании приведены на
рисунке 5.
Таблица 6 - Результаты проведения ферментации
|
Время гидролиза, ч
|
Образцы и способы ферментации
|
|
№ 592
|
№ 593
|
|
3
|
4,3
|
7,7
|
|
8
|
7,6
|
17,5
|
|
12
|
8,1
|
24,8
|
|
20
|
12,5
|
26,3
|
|
28
|
21,3
|
30,2
|
|
36
|
25,3
|
36,3
|
|
44
|
26,1
|
40,4
|
|
52
|
26,8
|
40,5
|
|
60
|
27,1
|
42,1
|
|
72
|
27,8
|
60,2
|
|
Выход РВ, % от массы субстрата
|
30,6
|
66,9
|

Рисунок 5 - Зависимости концентрации РВ от продолжительности
ферментативного гидролиза в зависимости от сырья для получения ЛЦМ.
Выход РВ при ферментации ЛЦМ ПОО № 593 (66,9 %) в 2,2 раза больше, чем у
ЛЦМ М № 592 (30,6 %). При равных условиях получения субстрата и проведения
ферментации это может быть связано, в первую очередь, с природой субстрата, с
большей стойкостью к гидролизу целлюлозы мискантуса. Также различия могут быть
вызваны физико-химическими характеристиками исходных ЛЦМ: большей МД пентозанов
и меньшей МД целлюлозы в ЛЦМ ПОО.
Низкая степень конверсии ЛЦМ в РВ может быть объяснена высокой
концентрацией субстратов, что, как известно, может ингибировать процесс
осахаривания, а также возможной адсорбцией ферментных препаратов на субстрате в
процессе гидролиза и тем самым вывода их из системы [44]. Эта версия
подтверждается увеличением скорости осахаривания после вторичного внесения
ферментных препаратов через 60 ч гидролиза [45].
3.5 Реакционная способность к ферментации ЛЦМ
плодовых оболочек овса разными ферментными препаратами
В данной работе в качестве субстрата использован ЛЦМ ПОО № 593.
Характеристика субстрата представлена в таблице 1.
Для гидролиза сложных субстратов необходимо проводить подбор
мультиэнзимной композиции, так как именно при совместном использовании
ферментные препараты дают наилучший результат.
Целью работы было проведение гидролиза ЛЦМ ПОО различными ферментными
препаратами и обоснование выбора рациональной мультиэнзимной композиции.
Характеристика ферментных препаратов представлена в таблице 2.
Гидролиз проводился в ацетатном буфере при активной кислотности 4,6…4,8
ед. рН. Концентрация субстрата составила 33,3 г/л. Ферментация проводилась при
температуре 50  в течение 72 ч. В качестве катализаторов использовались
следующие композиции ферментных препаратов:
в течение 72 ч. В качестве катализаторов использовались
следующие композиции ферментных препаратов:
А) Целлолюкс - А (0,02 г/1 г субстрата);
Б) Целлолюкс - А и Брюзайм BGX
(по 0,02 г/1 г субстрата);
В) Целлолюкс - А, Брюзайм BGX и
Рапидаза ЦР (по 0,02 г/1 г субстрата);
Г) Целлолюкс - А (0,02 г/1 г субстрата) и Брюзайм BGX (0,2 г/1 г субстрата).
Повторно ферменты внесены через 62 часа гидролиза в тех же пропорциях.
Концентрация РВ определялась спектрофотометрическим способом в пересчёте
на глюкозу.
Концентрации РВ в зависимости от продолжительности ФГ, так же их выход по
окончании ферментации представлены в таблице 7. Зависимости концентрации РВ от
продолжительности ФГ в статических условиях и при перемешивании приведены на
рисунке 6.
Таблица 7 - Результаты проведения ферментации
|
Продолжительность гидролиза, ч
|
Обозначение опыта
|
|
А
|
Б
|
В
|
Г
|
|
16
|
5,4
|
9,3
|
9,6
|
11,7
|
|
24
|
2,9
|
5,9
|
6,6
|
|
32
|
3,9
|
8,2
|
9,0
|
12,3
|
|
40
|
10,9
|
12,8
|
13,9
|
18,9
|
|
52
|
10,7
|
12,7
|
13,6
|
19,5
|
|
62
|
14,7
|
8,9
|
12,0
|
16,4
|
|
72
|
12,1
|
14,0
|
16,6
|
25,4
|
|
Выход РВ, % от массы субстрата
|
36,3
|
42,0
|
49,8
|
76,3
|
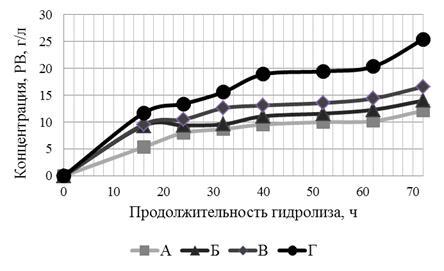
Рисунок 6 - Зависимость концентрации РВ от продолжительности
ферментативного гидролиза
Наименьшую скорость гидролиза обеспечивает ферментный препарат
«Целлолюкс-А» и обеспечивает выход РВ 36,3 %. При совместном использовании
препаратов «Целлолюкс-А» и ««Брюзайм BGX» выход РВ повышается на 6 %, а при введении в систему препарата
«Рапидаза CR» - ещё на 8 %. Повышение
эффективности гидролиза объясняется согласованным действием полиферментной
системы препаратов, обеспечивающей увеличение скорости и глубины гидролиза
целлюлозы и гемицеллюлозы при совместном действии ферментов, а также эффектом
синергизма работы препаратов.
Интересно отметить, что наибольший выход РВ (76,3 %) обеспечивает вариант
Г, в котором использовано два ферментных препарата, но при этом концентрация
препарата «Брюзайм BGX» повышена в 10
раз по сравнению с вариантом Б. Такая концентрация обеспечивает выход РВ почти
в два раза больший, чем в остальных вариантах. Возможно, в процессе гидролиза
происходит необратимая адсорбция ферментных препаратов на ЛЦМ ПОО и тем самым
вывод их из системы. Эта версия подтверждается увеличением скорости гидролиза
для всех вариантов после вторичного внесения ферментных препаратов через 60 ч
гидролиза [46].
3.6 Зависимость эффективности ФГ от способа
подготовки ЛЦМ
В ходе проведения экспериментальной работы, выход РВ после
ферментативного гидролиза был достаточно низок, это может обуславливаться
наличием нитросоединений в ЛЦМ, полученном на опытном производстве: растворы
окрашивались в интенсивный жёлто-коричневый цвет, а фермент адсорбировался на
субстрате.
Для проведения данного опыта использовались ЛЦМ ПОО № 593 и ЛЦМ М № 592,
ЛЦМ ПОО № 621, ЛЦМ М № 632. Характеристики данных материалов представлены в
таблице 1.
Для начала, два образца (№ 592 и № 593) промыли на магнитной мешалке
несколько раз, пока не пропадет желто-коричневая окраска удаляемой воды.
Температура нагрева составила 60  . Активная кислотность после
промывания составила для № 592 - 4,83 ед. рН, для № 593 - 4,67 ед. рН.
. Активная кислотность после
промывания составила для № 592 - 4,83 ед. рН, для № 593 - 4,67 ед. рН.
Образцы № 621 и № 632 получены Золотухиным В.Н. в лабораторных условиях,
тщательно отмыты им от остатков азотной кислоты и сразу переданы на
ферментацию.
Отработаны следующие варианты ферментативного гидролиза:
) ЛЦМ ПОО № 593 получен на опытном производстве ИПХЭТ СО РАН;
) ЛЦМ ПОО № 593 промыт водой до полного удаления окраски;
) ЛЦМ ПОО № 621, получен в лабораторных условиях;
) ЛЦМ мискантуса № 592, получен на опытном производстве ИПХЭТ СО
РАН;
) ЛЦМ мискантуса № 592, промыт водой до полного удаления окраски;
) ЛЦМ мискантуса № 632, получен в лабораторных условиях.
Химический анализ не отличается между субстратами ЛЦМ мискантуса и ЛЦМ
ПОО до и после промывки (№592, №593).
Проводим
ферментативный гидролиз в ацетатном буфере. Концентрация субстрата 33,3 г/л.
Температура гидролиза 46 
 .
Ферментация проводилась на перемешивающей платформе «ПЭ - 6410 М» с частотой
перемешивания 150 мин-1. Ферменты вносили следующим образом: «Целлолюкс - А» -
0,04 г фермента на 1 г субстрата, «Брюзайм» - 0,2 г фермента на 1 г субстрата.
Ферменты вносили только в начале гидролиза.
.
Ферментация проводилась на перемешивающей платформе «ПЭ - 6410 М» с частотой
перемешивания 150 мин-1. Ферменты вносили следующим образом: «Целлолюкс - А» -
0,04 г фермента на 1 г субстрата, «Брюзайм» - 0,2 г фермента на 1 г субстрата.
Ферменты вносили только в начале гидролиза.
Концентрация
РВ определялась спектрофотометрическим способом в пересчёте на глюкозу. Выход РВ
(отношение массы РВ к массе субстрата) рассчитан с учетом коэффициента,
связанного с присоединением молекулы воды к ангидроглюкозным остаткам
соответствующих мономерных звеньев в результате ферментативного гидролиза.
Концентрации
РВ в зависимости от продолжительности ФГ, так же их выход по окончании
ферментации представлены в таблице 8. Зависимости концентрации РВ от
продолжительности ФГ ЛЦМ ПОО и М приведены на рисунке 7.
Таблица
8 - Значение концентрации РВ в процессе гидролиза
|
Продолжительность гидролиза, ч
|
ЛЦМ ПОО
|
ЛЦМ мискантуса
|
|
593
|
593 после промывки
|
621
|
592
|
592 после промывки
|
632
|
|
8
|
9,5
|
9,6
|
13,8
|
5,6
|
11,4
|
17,1
|
|
22
|
11,7
|
17,2
|
22,9
|
6,9
|
16,6
|
22,3
|
|
32
|
12,3
|
16,9
|
24,7
|
7,4
|
19,0
|
22,3
|
|
48
|
18,9
|
19,5
|
25,9
|
9,6
|
19,3
|
22,6
|
|
56
|
19,5
|
22,2
|
26,6
|
12,5
|
25,0
|
28,4
|
|
72
|
19,5
|
24,8
|
26,8
|
13,3
|
25,2
|
29,5
|
|
Эффективность ферментативного гидролиза
|
|
Выход РВ*, % от массы субстрата
|
52,7
|
67,0
|
72,4
|
35,9
|
68,1
|
79,7
|
*Примечание: Надо учитывать коэффициент 0,9 (162 г целлюлозы
ферментируется в 180 г глюкозы). Тогда теоретически, из 33,3 г/л субстрата
может образоваться 37 г/л РВ - это 100%
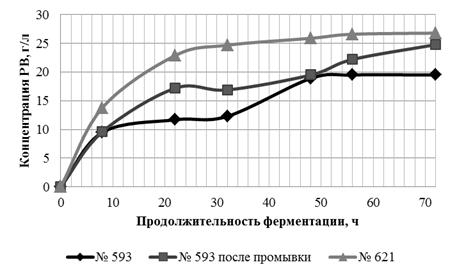
а)
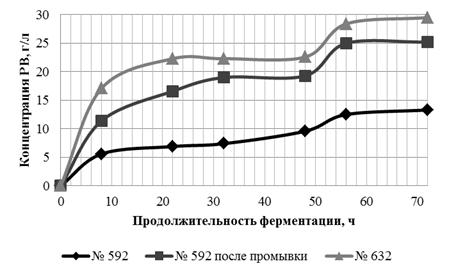
б)
а) лигноцеллюлозный материал ПОО; б) лигноцеллюлозный материал Мискантуса
Рисунок 6 - Зависимость концентрации РВ от продолжительности
ферментативного гидролиза
Промывка ЛЦМ от нитросоединений существенно увеличивает эффективность
ферментативного гидролиза. У мискантуса выход РВ увеличивается в 1,9 раза, а у
ПОО в 1,3 раза. До промывки ЛЦМ М ферментируется хуже, чем ПОО. После промывки
- одинаково. Кроме того, лабораторные образцы ЛЦМ М и ЛЦМ ПОО демонстрируют
достаточно высокие выходы РВ - 79,7 и 72,4 % соответственно.
Предполагается, что в процессе хранения непромытого ЛЦМ медленно
протекают реакции окисления с образованием нитросоединений из
нитрозососоединений. Использование свежеподготовленных образцов ЛЦМ даёт
высокую эффективность ферментативного гидролиза. Поэтому после химической
подготовки сырья к ферментативному гидролизу важно немедленно передавать
субстрат на ферментацию.
Ферментация данных материалов будет продолжена с целью дальнейшего
сбраживания ЛЦМ для получения биоэтанола.
. БЕЗОПАСНОСТЬ ЖИЗНЕДЕЯТЕЛЬНОСТИ
4.1 Требования охраны труда
При выполнении данной работы использовалось следующее оборудование:
электрическая плитка, весы лабораторные, холодильник бытовой, а также
стеклянная и фарфоровая посуда. Все оборудование является стандартным, поэтому
выполняются общие правила при работе с ним. Все необходимые для работы реактивы
использовались в небольших количествах. Кроме того, соблюдались правила при
работе с кислотами и щелочами. Сбросы сточных вод проводились в
хозяйственно-бытовую канализацию.
Операции с кислотами, щелочами, растворителями, пожаро- и взрывоопасными
продуктами, высокими температурами, вакуумом принадлежат к числу опасных и
требуют строгого соблюдения правил проведения работ и правил техники
безопасности. Нарушение этих правил может привести к тяжелым последствиям:
травматизму, пожару, взрыву и т. п. Помещения, где проводятся пожаро- и
взрывоопасные работы, должны иметь средства пожаротушения (огнетушитель, песок,
асбестовое одеяло, вода и др.). Все сотрудники обязаны выполнять требования
должностных инструкций, инструкций по охране труда, правила внутреннего
трудового распорядка (начало и окончание рабочего дня, запрещение курения на
рабочем месте, распития спиртных напитков).
К работе в химической лаборатории допускаются лица, прошедшие медицинское
освидетельствование и инструктаж по технике безопасности в возрасте не младше
18 лет.
Организация работ по технике безопасности в лаборатории и общее
руководство возлагается на руководителя дипломной работы, который следит за
ведением лабораторного журнала. Студенты должны изучить свойства имеющихся в
лаборатории химических веществ и реактивов, используемых для работы. Студенты
не должны уходить с рабочего места при проведении анализа с легко кипящими и
воспламеняющимися веществами, не оставлять без наблюдения нагревательные
приборы. Каждый студент должен заниматься только своей работой.
Запрещается ведение работ без ведома руководителя. Не допускаются к
работе с приборами и оборудованием сотрудники, предварительно не ознакомленные
с правилами работы на них. Запрещается работа с неисправным оборудованием.
Принимать пищу разрешается только в строго определенном месте. Все личные вещи
студентов должны находиться в отведенном для этого месте.
На лабораторных столах не должно быть вещей, не относящихся к выполняемой
в данный момент работе. Вытяжной шкаф нельзя загромождать предметами, не
связанными с выполнением текущей работы. Огнетушители размещают на видных и
легкодоступных местах.
В лаборатории запрещается работать с огнеопасными и взрывоопасными
веществами при зажженных горелках и включенных электронагревательных приборах.
В лаборатории следует работать в халате из хлопчатобумажной ткани, с длинными
рукавами. При необходимости использовать средства индивидуальной защиты
(перчатки, очки и т. п.) При получении травмы пострадавшему нужно оказать
первую медицинскую помощь и обратиться к врачу
По окончании работы в лаборатории проверить, отключены ли приборы от
электрической сети. Вымыть посуду, закрыть кран водопровода.
С лицами, вновь принятыми на работу, переведенными из одного
подразделения в другое, командированными и практикантами проводится вводный
инструктаж заведующим лабораторией с целью ознакомления с общими положениями по
безопасности труда и производственной санитарии, с порядком и правилами
поведения на территории ИПХЭТ СО РАН. Сотрудники Лаборатории № 8 при посещении
огнеопасных производственных подразделений для выполнения работ должны
проходить вводный инструктаж у заведующего Лабораторией № 8 или начальника
участка экзаменуемого. Одновременно выдается удостоверение на право
самостоятельного ведения работ.
В соответствии с ГОСТ 12.1.007-76 по степени воздействия на организм
вещества подразделяются на 4 класса опасности:
ПДК менее 0,1 мг/м3 - чрезвычайно опасные;
ПДК 0,1…1,0 мг/м3 - высокоопасные;
ПДК 1,1…10,0 мг/м3 - умеренно опасные;
ПДК более 10,0 мг/м3 - малоопасные.
В тех случаях, когда проводится работа с неприменяемыми ранее продуктами,
в прописи подробно должны быть указаны токсические свойства этих веществ и
правила работы с ними. При проведении вводного и повторного инструктажа
необходимо рассматривать требования по обеспечению защиты от статического
электричества.
Горючие и взрывоопасные материалы в соответствии с «Правилами защиты от
статического электричества» по уровню чувствительности к электрическому разряду
разделяются на 4 группы:очень высокая - минимальная энергия воспламенения
менее 0,1 мДж;высокая - минимальная энергия воспламенения от 0,1 до 5,0 мДж
(нитроглицерин);средняя - минимальная энергия воспламенения от 5,0 до 20,0 мДж
(октоген);низкая - минимальная энергия воспламенения более 20 мДж.
Минимальная энергия воспламенения вещества (чувствительность к
электрической искре Wmin) представляет собой наименьшую энергию электрического
разряда, достаточного для зажигания данного вещества.
При работе с растворителями, кислотами, щелочами, пожаровзрывоопасными
веществами работник обязан знать свойства продуктов; соблюдать правила личной
гигиены: работать в х/б халате или костюме, х/б белье, тапочках, перчатках,
защитных очках или маске из оргстекла, респираторе. Вся спецодежда, применяемая
для защиты работающих, должна соответствовать нормативным документам. В
лаборатории каждому работнику необходимо знать меры оказания первой помощи при
несчастном случае, изложенные в настоящей инструкции. Во всех случаях после
оказания первой помощи необходимо немедленно вызвать врача по телефону 03,
сообщить руководителю подразделения и главному специалисту по ОТ и ЭБ; в случае
загорания - вызвать пожарную команду по телефону 01. За соблюдение правил
техники безопасности, пожарной безопасности и спец. режима ответственность
несут заведующий лабораторией, непосредственные руководитель и исполнитель
работы. В соответствии с Трудовым кодексом РФ - «Лица, допустившие нарушение
правил техники безопасности, пожарной безопасности и охраны труда, привлекаются
к строгой дисциплинарной ответственности, а в надлежащих случаях и к
уголовной». Каждый сотрудник обязан ежегодно проходить медицинский
профилактический осмотр. Посещение лаборатории посторонними лицами
регламентируется общим положением о пропускном режиме.
4.2 Требования охраны труда перед началом
работы
Организация работы по технике безопасности, пожарной безопасности,
промышленной санитарии, охране труда и общее руководство возлагаются на
заведующего лабораторией. Работы могут проводить лаборанты, техники, инженеры в
соответствии с письменным заданием в рабочем дневнике (для лаборантов и
техников). При выполнении задания особое внимание следует обращать на
соблюдение правил техники безопасности. В случае возникновения неясностей по
выполнению задания необходимо обратиться за разъяснением к руководителю работ.
Работа проводится по плану, утвержденному заведующим лабораторией. Перед
началом работы руководитель обязан составить и записать в рабочую тетрадь
исполнителя (лаборанта, техника) методику проведения опыта с указанием мер по
технике безопасности, под которой он должен расписаться. За технически
грамотное составление прописи руководитель работы несет полную ответственность.
Исполнитель знакомится с заданием под роспись.
При повторном проведении работ в рабочей тетради делается ссылка на
пропись, по которой ведется работа и записываются данные опыта. Запрещается
проведение работ, не указанных в задании и не предусмотренных соответствующими
инструкциями. В каждой комнате должен быть ответственный за соблюдение правил
ТБ и ПБ, назначенный заведующим лабораторией. Рабочая комната, все рабочие
столы, вытяжные шкафы должны содержаться в чистоте и порядке. В помещении не
должно находиться ничего лишнего, захламляющего оборудование. Ежеквартально в
каждой комнате должна проводиться генеральная уборка. Работу в комнатах
лаборатории разрешается проводить только при наличии исправной
приточно-вытяжной вентиляции, исправного оборудования, исправных средств
пожаротушения и связи, индивидуальных средств защиты, аптечки первой помощи.
Все операции, сопровождающиеся выделением вредных газов, паров или
пожаро- и взрывоопасных веществ, а также все работы с легковоспламеняющимися
жидкостями должны проводиться в вытяжных шкафах; створки при работе должны быть
закрыты. В случае необходимости створки следует приподнимать не более чем на
20…30 см так, чтобы в шкафу находились только руки. Количество и скорость
удаляемого из шкафа воздуха регулируется дроссельной заслонкой в зависимости от
плотности загрязненного воздуха. Легкие пары удаляются через прямоугольное
отверстие в верхней части шкафа. Тяжелые пары удаляются через щелевое отверстие
и канал в задней стенке шкафа. Вентиляция должна включаться за 15 мин до начала
работы и отключаться через 15 мин после окончания работы в вытяжном шкафу,
причем до полного проветривания помещения запрещается зажигать источники
открытого огня и включать электроприборы. Выключатели и штепсельные розетки
должны быть расположены вне шкафа. Вести работу в неисправных шкафах
запрещается! Гидрозатворы раковин и приемников должны быть в исправном
состоянии и постоянно заполнены водой.
Химические отходы должны сливаться в специально предназначенные для этой
цели сосуды. Помещать в одну тару несовместимые вещества запрещается! Слив
отходов в канализацию запрещается! Хранение веществ в комнате может
производиться с учетом их свойств и групп совместимости согласно перечню,
подписанному заведующим лабораторией и ответственным за технику безопасности.
Запрещается иметь и применять в лаборатории какие-либо реактивы, продукты без
соответствующих этикеток и надписей на таре с четким указанием их наименования.
Запрещается писать на этикетках названия в виде формул! Обязательно должно быть
указано полное общепринятое название вещества или продукта.
Запрещается хранение в вытяжных шкафах огне- и взрывоопасных веществ при
проведении опасных работ!
Запрещается оставлять без присмотра работающее оборудование, особенно
связанное с нагревом! Стеклянную посуду с кислотами, щелочами, ЛВЖ, ПВОВ и
другими веществами разрешается переносить только в специальных переносках,
выложенных внутри асбестом. Наличие ЛВЖ и горючих жидкостей в рабочей комнате
разрешается в количествах не выше утвержденной нормы.
Исполнитель обязан:
до начала работы проверить наличие инструкций по охране труда, журнала с
заданием; чистоту приборов, приспособлений, рабочего места, посуды; исправность
вентиляции, оборудования; наличие и исправность заземления, разрядника, средств
пожаротушения;
содержать в чистоте и порядке рабочую комнату;
выполнять правила технической и пожарной безопасности;
включить вентиляцию за 15 мин до начала работы, с началом работы
разрешается включать электронагревательные приборы;
работать в соответствующей спецодежде с использованием защитных средств;
знать основные свойства веществ, применяемых в работе;
аккуратно вести записи о проделанной работе в рабочем журнале;
своевременно сдавать на уничтожение отходы растворителей, нестойких
веществ, мусор;
по окончании той или иной операции выключить электроприборы, воду и т.
п.;
перед началом работы снять с себя заряд статического электричества.
4.3 Требования охраны труда во время работы
) Правила работы со стеклянной посудой
Стеклянные трубки небольшого диаметра следует ломать только после надреза
их напильником или специальным ножом для резки стекла; концы трубок для
предохранения от порезов необходимо обернуть полотенцем. Для того, чтобы
облегчить вставку стеклянных трубок в резиновые пробки или резиновые трубки, а
также надевание резиновых трубок на стеклянные трубки или палочки при сборке
приборов, нужно смочить снаружи стеклянную трубку (палочку) и внутренние края
трубки или отверстия у пробки водой, глицерином или вазелиновым маслом. Острые
края стеклянных трубок нужно оплавить или сгладить напильником. При сборке
стеклянных приборов или отдельных частей следует применять эластичные
соединения и прокладки. Особенно тщательная защита приборов и стеклянных
деталей требуется в местах крепления их на металлических кольцах штативов или в
держателях. При вставке стеклянных трубок в просверленную пробку последняя не
должна упираться в ладонь, её следует держать за боковую поверхность. Трубку
нельзя сильно сжимать и держать ее нужно возможно ближе к вставленному в пробку
концу. При вставке пробки в горлышко колбы или другого тонкостенного сосуда
следует держать сосуд за горлышко по возможности ближе к месту установки
пробки, обернув при этом руку полотенцем. Стеклянную посуду (тонкостенные
химические стаканы и колбы) из обычного стекла нельзя нагревать на открытом
огне без асбестовой сетки. Такую посуду нужно осторожно ставить на керамическую
или цементную поверхность. Стеклянные изделия необходимо оберегать от царапин и
следить за тем, чтобы они не лопнули при нагревании. При сборке установки из
посуды на шлифах требуется смазывать шлифы вазелином или вакуум-смазкой,
вазелиновым маслом.
) Правила работы с растворителями
Растворители подразделяются на легковоспламеняющиеся жидкости (ЛВЖ),
горючие и негорючие. К ЛВЖ относятся такие, у которых температура вспышки в
открытом тигле не превышает 61 ºC (эфир, ацетон, этанол и т. д.). К
горючим относятся вещества с Твсп выше 61 ºC (глицерин, диэтиленгликоль,
диметилсульфоксид). К негорючим относятся четыреххлористый углерод, хлороформ.
Растворители, необходимые для работы в лаборатории, должны храниться в прочных,
толстостенных склянках емкостью 1 л, заполненных жидкостями не более чем на 0,8
объема. Хранить растворители в тонкостенной посуде запрещается! Сосуды с
растворителями в соответствии с перечнем и допустимой нормой загрузки помещают
в металлические заземленные ящики, дно которых застелено асбестом. Ящики с
растворителями запрещается располагать на пути выхода из помещения! Запрещается
держать огнеопасные жидкости вблизи отопительных и нагревательных приборов и
мест, где может быть искрение и открытый огонь!
Отработанные растворители запрещается выливать в канализацию, их
необходимо собирать в заземленную металлическую канистру и сдавать на
уничтожение методом сжигания! Помещать в одну тару вещества, которые могут
реагировать между собой, запрещается! Все работы с огнеопасными жидкостями, а
также переливание их разрешается только в вытяжных шкафах при наличии у
работника защитных средств и спецодежды (х/б халат, тапочки, резиновые
перчатки, защитные очки, маски из оргстекла и т. п.). Запрещается использование
одежды из шелковых и шерстяных тканей! Переливание огнеопасных жидкостей при
наличии в комнате включенных нагревательных приборов открытого типа или
спиртовок запрещается! В отдельных случаях, по разрешению ответственного
исполнителя, с горючими нетоксичными растворителями разрешается работать на
лабораторном столе. В этом случае также запрещается работать в комнате со
спиртовкой, электроприбором с открытым обогревом!
Кипячение, перегонка и нагревание легковоспламеняющихся жидкостей
разрешается только на водяной бане или бане с другой безопасной средой,
обогреваемой электроплиткой закрытого типа или электронагревателем. Температура
бани не должна превышать температуру кипения жидкости более, чем на 20  . Запрещается вести перегонку
жидкостей досуха! При вакуумной разгонке легковоспламеняющихся и горючих
жидкостей выключение подогрева производят при температуре жидкости в бане не
менее, чем на 50
. Запрещается вести перегонку
жидкостей досуха! При вакуумной разгонке легковоспламеняющихся и горючих
жидкостей выключение подогрева производят при температуре жидкости в бане не
менее, чем на 50  ниже температуры ее воспламенения. Для предотвращения
кипения с толчками, бурного вскипания и выбросов следует применять «кипелки»
(запаянные с одного конца капилляры, стеклянную вату и другие пористые
материалы). Вводить «кипелки» или другие пористые материалы разрешается только
в холодную жидкость.
ниже температуры ее воспламенения. Для предотвращения
кипения с толчками, бурного вскипания и выбросов следует применять «кипелки»
(запаянные с одного конца капилляры, стеклянную вату и другие пористые
материалы). Вводить «кипелки» или другие пористые материалы разрешается только
в холодную жидкость.
При случайном проливе огнеопасной жидкости и обнаружении утечки паров их
из приборов необходимо выключить все электронагревательные приборы, хорошо
проветрить помещение, собрать пролитый растворитель ветошью (если необходимо в
противогазе) и только после полного проветривания помещения по разрешению
руководителя работы можно вновь включить приборы и возобновить работу. Ветошь
упаковать в парафиновую бумагу и в полиэтиленовую пленку и сдать на
уничтожение.
Запрещается хранить огнеопасные жидкости вместе с неорганическими
кислотами и различными окислителями. В случае использования осушителей для
сушки растворителей необходимо на этикетке указать наименование растворителя и
осушителя. При работе с органическими растворителями необходимо следить, чтобы
они не попали на одежду или халат. Пропитанная растворителем одежда при
воспламенении за несколько секунд может вызвать тяжелые и даже смертельные
ожоги. Запрещается использовать огнеопасные жидкости не по прямому назначению:
для мытья полов, стирки, чистки одежды и др. Общий запас хранящихся в каждом
рабочем помещении огнеопасных жидкостей не должен превышать сменную
потребность. При выполнении работ с большим количеством огнеопасных жидкостей
надлежит получить письменное разрешение руководства, согласованное с пожарной
охраной. Огнеопасные вещества могут находиться на рабочем месте лишь в
количествах, нужных непосредственно для работы.
При загорании растворителей пламя следует гасить:
при загорании жидкостей, смешивающихся с водой (спирт, ацетон),
огнетушителем, водой, песком, асбестовым одеялом;
при загорании жидкостей, не смешивающихся с водой, огнетушителем, песком,
асбестовым одеялом, начиная с периферии. Запрещается применять воду.
ЛВЖ чувствительны к электрической искре, поэтому необходимо соблюдать
меры защиты от статического электричества.
При работе с ЛВЖ и горючими жидкостями запрещается:
- загромождать рабочие столы и вытяжные шкафы посудой с ЛВЖ и ГЖ;
- держать ЛВЖ и ГЖ вблизи нагревательных приборов;
допускать разлив и разбрызгивание ЛВЖ и ГЖ;
выливать в канализацию остатки растворителей;
производить нагревание ЛВЖ и ГЖ непосредственно на огне; нагревание можно
производить только на водяной бане, песчаной бане или на банях с какой-либо
другой безопасной жидкостью.
Перед началом работы с растворителями необходимо ознакомиться с их свойствами
и правилами обращения. Метиловый спирт, дихлорэтан, бензол являются
сильнодействующими ядовитыми веществами (СДЯВ).
На этикетках должны быть отличительные знаки безопасности. СДЯВ,
необходимые для текущей работы, нужно ежедневно по окончании рабочего дня
сдавать ответственному лицу и хранить в запертом и опечатанном шкафу.
Применение их допускается лишь в тех производственных процессах, где они не
могут быть заменены другими, менее токсичными веществами.
Ацетон.
бесцветная легковоспламеняющаяся жидкость, смешивается с водой и
органическими растворителями, Ткип = 56,2  , Твсп = -18
, Твсп = -18  . Взрывоопасные концентрации в смеси
с воздухом (2,55…12,8) %. Наркотик, последовательно поражающий все отделы
центральной нервной системы. При вдыхании в течение длительного времени
накапливается в организме. Медленное выделение из организма увеличивает
возможность хронического отравления. Рекомендуется применение различных мазей
или «биологических перчаток» (как в случае толуола, ксилола). ПДК - 200 мг/м3.
. Взрывоопасные концентрации в смеси
с воздухом (2,55…12,8) %. Наркотик, последовательно поражающий все отделы
центральной нервной системы. При вдыхании в течение длительного времени
накапливается в организме. Медленное выделение из организма увеличивает
возможность хронического отравления. Рекомендуется применение различных мазей
или «биологических перчаток» (как в случае толуола, ксилола). ПДК - 200 мг/м3.
Изопропиловый спирт.
бесцветная легковоспламеняющаяся жидкость с Ткип = 82,4  ,
,
Твсп = 22,5  , смешивается с водой, этиловым спиртом, бензолом. Может
раздражать слизистые оболочки глаз и верхних дыхательных путей, пары могут
повредить сетчатку глаза и зрительный нерв. Наблюдались случаи смертельного
отравления при приеме внутрь более 400 мл. При отравлении необходимы свежий
воздух, покой, согревания, сердечно-сосудистые средства, ингаляции кислорода.
ПДК - 10 мг/м3.
, смешивается с водой, этиловым спиртом, бензолом. Может
раздражать слизистые оболочки глаз и верхних дыхательных путей, пары могут
повредить сетчатку глаза и зрительный нерв. Наблюдались случаи смертельного
отравления при приеме внутрь более 400 мл. При отравлении необходимы свежий
воздух, покой, согревания, сердечно-сосудистые средства, ингаляции кислорода.
ПДК - 10 мг/м3.
Уксусная кислота.
Бесцветная прозрачная жидкость с резким запахом. Ткип = 117,8  . Пары раздражают слизистые оболочки
верхних дыхательных путей, вызывает ожоги кожи. Твсп = 38
. Пары раздражают слизистые оболочки
верхних дыхательных путей, вызывает ожоги кожи. Твсп = 38  , , Тсамовоспл = 454
, , Тсамовоспл = 454  . Температурные пределы взрываемости
35…76
. Температурные пределы взрываемости
35…76  . ПДК в атм. воздухе - 0,06 мг/м3, в
воздухе рабочей зоны - 5 мг/м3.
. ПДК в атм. воздухе - 0,06 мг/м3, в
воздухе рабочей зоны - 5 мг/м3.
) Правила работы с галогенами
К работе с галогенами допускаются сотрудники, прошедшие специальный
инструктаж о мерах безопасной работы с данными веществами с соответствующей
записью в журнале инструктажа. Свободные галогены - ядовитые вещества,
вызывающие сильное раздражение дыхательных путей и слизистых оболочек. Работа с
галогенами выполняется согласно прописи, составленной руководителем работы и
записанной в дневнике исполнителя.
Все работы с галогенами необходимо проводить в вытяжном шкафу в
спецодежде и перчатках. Положение шибера устанавливается таким образом, чтобы
из вытяжного шкафа отсасывались тяжелые пары галогенов. При превышении
концентрации паров предельно допустимой нормы необходимо пользоваться
промышленным фильтрующим противогазом марок «В», «М».
Для обеззараживания воздуха, содержащего пары хлора или брома в помещении
разбрызгивают водный раствор аммиака. Пролитый бром необходимо обезвреживать
раствором соды, щелочи или гипосульфита. Лить аммиак на жидкий бром нельзя,
т.к. при этом бром сильно разбрызгивается!
При отравлении парами брома или хлора необходимо обеспечить больному
чистый воздух, полный покой, согревание тела и как можно больше ингаляцию
кислорода. При явлениях раздражения верхних дыхательных путей - вдыхание
распыленного раствора щелочных растворов (бикарбоната натрия, буры) или аммиака
в виде сильно разбавленного раствора в воде или этиловом спирте. Боль в горле,
вызванная вдыханием паров брома, устраняется приемом внутрь горячего молока.
Глаза, нос и рот следует промыть 2 %-ным раствором соды. При попадании жидкого
брома на кожу необходимо быстро промыть пораженное место несколькими порциями
этилового спирта и смазать мазью от ожогов. Для замещения и выведения брома из
организма - принимать поваренную соль по 10…30 г 4 раза в день.
) Правила работы с кислотами и щелочами
Перед началом работ с кислотами и щелочами необходимо ознакомиться с их
свойствами.
Соляная
кислота.
раствор хлористого водорода в воде, при концентрации 38 %, плотность 1,19
г/см3, с едким запахом. при высоких концентрациях раздражает слизистые оболочки
(особенно носа), вызывает удушье, насморк, кашель; сильных ожогов не вызывает,
при попадании кислоты в глаза - промыть водой, при попадании на кожу -
немедленно обмыть водой в течение 5…10 мин, затем наложить на обожженную
поверхность кашицу из соды.
ПДК - 5 мг/м3.
Серная кислота.
маслянистая, прозрачная, бесцветная жидкость, Ткип = 330  , плотность 1,834 г/см3, с водой
смешивается во всех отношениях, выделяя большое количество тепла.
Концентрированная серная кислота - довольно сильный окислитель. Раздражает и
прижигает слизистые верхних дыхательных путей, поражает легкие. При попадании
на кожу вызывает тяжелые ожоги. При попадании на кожу и слизистые - немедленное
обильное промывание водой. При ожоге накладывают на 1…2 дня повязки с 2…3 %-ным
раствором соды. Используют влажные повязки с риванолом или фурацилином. ПДК - 1
мг/м3.
, плотность 1,834 г/см3, с водой
смешивается во всех отношениях, выделяя большое количество тепла.
Концентрированная серная кислота - довольно сильный окислитель. Раздражает и
прижигает слизистые верхних дыхательных путей, поражает легкие. При попадании
на кожу вызывает тяжелые ожоги. При попадании на кожу и слизистые - немедленное
обильное промывание водой. При ожоге накладывают на 1…2 дня повязки с 2…3 %-ным
раствором соды. Используют влажные повязки с риванолом или фурацилином. ПДК - 1
мг/м3.
Хромовая
смесь.
бесцветная или слегка желтоватая жидкость, Ткип = 83,4  , плотность 1,502 г/см3, пары в 2,2
раза тяжелее воздуха, сильная кислота, действует на все металлы, кроме Au, Pt,
Rh, Ir. Cильный окислитель: солома, опилки и другие пористые
органические материалы при соприкосновении с ней загораются. Дым, содержащий
No2, N2O5 и туман чистой азотной кислоты, раздражает дыхательные пути, может
вызвать разрушение зубов и поражение роговицы глаз. Пары азотной кислоты
приблизительно на 25 % токсичнее, чем NO2. концентрированная азотная кислота
вызывает тяжелые ожоги, разбавленные растворы могут быть причиной экземы. При
ожогах кожи после быстрого обмывания струей воды накладывают спиртовые повязки,
затем применяют лечение, как и в случае ожогов серной кислотой. В отличие от
ожогов серной кислотой ожоги азотной кислоты более опасны, раны заживают хуже,
остаются рубцы. ПДК- 5 мг/м3.
, плотность 1,502 г/см3, пары в 2,2
раза тяжелее воздуха, сильная кислота, действует на все металлы, кроме Au, Pt,
Rh, Ir. Cильный окислитель: солома, опилки и другие пористые
органические материалы при соприкосновении с ней загораются. Дым, содержащий
No2, N2O5 и туман чистой азотной кислоты, раздражает дыхательные пути, может
вызвать разрушение зубов и поражение роговицы глаз. Пары азотной кислоты
приблизительно на 25 % токсичнее, чем NO2. концентрированная азотная кислота
вызывает тяжелые ожоги, разбавленные растворы могут быть причиной экземы. При
ожогах кожи после быстрого обмывания струей воды накладывают спиртовые повязки,
затем применяют лечение, как и в случае ожогов серной кислотой. В отличие от
ожогов серной кислотой ожоги азотной кислоты более опасны, раны заживают хуже,
остаются рубцы. ПДК- 5 мг/м3.
Азотная кислота.
бесцветная или слегка желтоватая жидкость, Ткип = 83,4  , плотность 1,502 г/см3, пары в 2,2
раза тяжелее воздуха, сильная кислота, действует на все металлы, кроме Au, Pt,
Rh, Ir. Cильный окислитель: солома, опилки и другие пористые
органические материалы при соприкосновении с ней загораются. Дым, содержащий
No2, N2O5 и туман чистой азотной кислоты, раздражает дыхательные пути, может
вызвать разрушение зубов и поражение роговицы глаз. Пары азотной кислоты
приблизительно на 25 % токсичнее, чем NO2. концентрированная азотная кислота
вызывает тяжелые ожоги, разбавленные растворы могут быть причиной экземы. При
ожогах кожи после быстрого обмывания струей воды накладывают спиртовые повязки,
затем применяют лечение, как и в случае ожогов серной кислотой. В отличие от
ожогов серной кислотой ожоги азотной кислоты более опасны, раны заживают хуже,
остаются рубцы. ПДК- 5 мг/м3.
, плотность 1,502 г/см3, пары в 2,2
раза тяжелее воздуха, сильная кислота, действует на все металлы, кроме Au, Pt,
Rh, Ir. Cильный окислитель: солома, опилки и другие пористые
органические материалы при соприкосновении с ней загораются. Дым, содержащий
No2, N2O5 и туман чистой азотной кислоты, раздражает дыхательные пути, может
вызвать разрушение зубов и поражение роговицы глаз. Пары азотной кислоты
приблизительно на 25 % токсичнее, чем NO2. концентрированная азотная кислота
вызывает тяжелые ожоги, разбавленные растворы могут быть причиной экземы. При
ожогах кожи после быстрого обмывания струей воды накладывают спиртовые повязки,
затем применяют лечение, как и в случае ожогов серной кислотой. В отличие от
ожогов серной кислотой ожоги азотной кислоты более опасны, раны заживают хуже,
остаются рубцы. ПДК- 5 мг/м3.
Все работы с кислотами, щелочами (приготовление, смешение, переливание)
должны проводиться в вытяжном шкафу и только в фарфоровой или термостойкой
посуде с обязательным применением защитных приспособлений (защитные очки,
маски, резиновые перчатки, фартуки, х/б одежда).
Запрещается переливание кислот, щелочей и других агрессивных жидкостей из
больших емкостей в малые без специальных приспособлений (сифонов и т.п.). При
переливании из одной небольшой емкости в другую надо обязательно пользоваться
воронкой. Запрещается набирать кислоты и щелочи в пипетки ртом, для этой цели
следует применять резиновую грушу.
Запрещается при приготовлении растворов и смесей вливать воду в кислоту
или кислоту с меньшей плотностью в кислоту с большей плотностью. При разливе
кислот на пол жидкость необходимо засыпать песком, затем собрать песок совком,
оставшуюся кислоту нейтрализовать содой и промыть водой.
Запрещается слив кислот и щелочей в канализацию без предварительной
нейтрализации.
Куски твердой щелочи разрешается разбивать только в ступках, завернутых в
плотный материал, брать их разрешается только щипцами. Растворять твердые щелочи
следует путем медленного прибавления их небольшими кусочками к воде при
непрерывном перемешивании и охлаждении. Работающие должны быть в резиновых
перчатках и предохранительных очках. Склянки с кислотами и щелочами переносят
только в специальных переносках, выложенных асбестом. Большие бутыли с
кислотами и щелочами нужно обязательно переносить вдвоем в обрешетке. При мытье
посуды хромовой смесью необходимо не допускать попадания хромовой смеси в
глаза, на кожу, одежду, обувь, т.к. хромовая смесь вызывает сильные ожоги и
может причинить тяжелое хроническое заболевание с омертвлением тканей почти до
костей.
) Правила работы с ртутью
Металлическая ртуть и подавляющее большинство ее соединений ядовиты. Пары
ртути поглощаются деревом, тканями и другими веществами, которые при
последующей десорбции являются источником отравлений. ПДК паров ртути в воздухе
рабочих помещений - 0,01 мг/м3. К работам, связанным с применением ртути или
ртутных приборов и аппаратов, допускаются лица, прошедшие специальный
инструктаж.
В соответствии с инструкцией главной санитарной инспекции СССР,
утвержденной 6.03.69 г. № 780-69, допускается хранить ртуть в небольших
количествах под слоем воды, парафинового масла, глицерина. Работать с ртутью
необходимо в наглухо застегнутом халате, косынке, резиновых перчатках. По
окончании работы, а также перед едой необходимо тщательно мыть руки и лицо
теплой водой с мылом, полоскать рот 0,025 %-ным раствором марганцевокислого
калия.
При работе с ртутью запрещается пользоваться посудой из тонкого стекла!
Запрещается хранение в помещениях лабораторий неиспользуемых или разбитых
аппаратов с ртутью, а также ртуть в открытых сосудах! Переносные ртутные
приборы и аппараты устанавливают на эмалированных или окрашенных масляной
краской противнях. Допускается применение противней, изготовленных из
органического стекла.
Заполнять аппаратуру и приборы ртутью, а также проводить работы,
связанные с нагреванием, промыванием ртути и др., при которых имеется открытая
поверхность ртути, следует только в вытяжном шкафу и на противнях, другие
работы при этом проводить не разрешается. При случайном разливе ртути
необходимо немедленно её собрать. Для этого пользуются вакуум-насосами, которые
соединяют с пипетками или трубками для засасывания ртути через ловушку,
резиновыми грушами, а также медными пластинками и др. Собранную ртуть помещают
в банку с водой. Выливать ртуть в канализацию категорически запрещается! В
дальнейшем в установленном порядке сдают на уничтожение.
Кроме механической очистки поверхности от ртути обязательно применяют
демеркуризацию химическими способами. Наиболее надёжным способом является
демеркуризация 20 %-ным водным раствором хлорного железа из расчёта одно ведро
на 25 м2 площади. Поверхность, покрытую раствором, несколько раз протирают
мягкой кистью или щеткой, смоченной тем же раствором, и оставляют до полного
высыхания на 1…2 суток. После этого поверхность очищают, несколько раз
промывают сначала мыльной, а затем чистой водой.
Периодически, по графику, утвержденному главным инженером, и каждый раз после
демеркуризации должен проводиться анализ воздушной среды на содержание паров
ртути. При наличии в воздухе паров выше допустимой нормы должна быть проведена
повторная демеркуризация рабочих мест и всего помещения. Инвентарь для уборки
помещений, где ведутся работы с ртутью, не может быть использован для уборки
других помещений и должен храниться в нижних отделениях вытяжных шкафов.
6) Правила работы с перекисью водорода
Перекись водорода (30 %-ная) - негорючая пожаровзрывоопасная жидкость,
сильный окислитель. Растворы перекиси водорода могут вызывать ожоги кожи и
глаз, пары перекиси водорода - раздражение слизистых оболочек. При работе
использовать резиновые перчатки, защитные очки. ПДК - 0,3 мг/м3. Класс
опасности 2. Хранится отдельно от органических веществ и растворителей.
7) Правила работы с электроаппаратурой
Используемое электрооборудование должно соответствовать требованиям
устройства и должно находиться в исправном состоянии. В рабочих комнатах
пользоваться открытыми электроплитками запрещается. Электрооборудование должно
быть заземлено. Сушильные шкафы должны иметь регуляторы температуры, поверенные
и паспортизованные. Для каждой комнаты должны быть оформлены разрешения на
пользование электронагревательными приборами и назначены ответственные за пользование
ими.
Контрольно-измерительные приборы, используемые для проведения работ,
должны быть поверены и иметь паспорта. При нарушении системы заземления или
появлении признаков замыкания немедленно отключить электроприборы и вызвать
электрика или отнести прибор на проверку в электроцех. В случае перерыва в
подаче тока всё электрооборудование должно быть немедленно выключено.
В случае загорания проводов или электроприборов их необходимо немедленно
обесточить (отключить щиток) и погасить огонь при помощи углекислотного
огнетушителя или асбестовым одеялом. Запрещается использовать воду и пенный
огнетушитель для тушения установок, находящихся под напряжением.
По окончании работы всё электрооборудование должно быть выключено.
Сотрудник, уходящий последним из комнаты, обязан проверить выключено ли
электрооборудование и освещение, сделать соответствующую запись в журнале
осмотра комнаты.
Устанавливать дополнительные электронагревательные приборы можно только с
разрешения главного инженера и СПЧ-4. Освещение вытяжных шкафов должно
производиться в герметичной или взрывобезопасной арматуре.
Для предупреждения возможности возникновения опасных электрических
разрядов необходимо предусматривать меры защиты:
заземление электрооборудования и коммуникаций;
использование антистатических покрытий (антистатической жидкости);
ношение одежды из х/б тканей;
установка электростатического разрядника на вытяжном шкафу (предназначен
для отвода зарядов статического электричества с человека, через сопротивление
на землю при контакте руки человека с крышкой разрядника).
При эксплуатации электроустановок запрещается:
пользоваться поврежденными розетками;
пользоваться электронагревательными приборами без огнестойких подставок;
применять для целей отопления электронагревательные приборы;
оставлять без присмотра работающее электрооборудование, особенно
связанное с нагревом.
При работе в химической лаборатории применяются следующие
электронагревательные приборы:
- сушильные и вакуум-сушильные шкафы используются для сушки продуктов и
посуды;
- электрокипятильники используются только для нагрева воды.
При работе с электрокипятильниками необходимо соблюдать следующие
правила:
электрокипятильник включать в сеть только после погружения его в воду;
- уровень воды должен находиться между двумя рисками погруженного в воду
кипятильника;
после нагрева воды необходимо предварительно выключить
электрокипятильник, а затем вынуть его из воды;
запрещается опускать руку в нагреваемую воду.
Для нагрева других сред (глицерин, масло, силиконовая жидкость, сплав Вуда
и др.) используются электроплитки закрытого типа. Диаметр бани должен быть не
менее диаметра электроплитки. Для непосредственного нагрева реакционных сред
используются колбонагреватели и воронки для горячего фильтрования.
Малогабаритный нагревательный стол типа «БОЭЦИУС» применяется для определения
температуры плавления и других определений согласно инструкции к прибору.
Прибор для регенерации цеолитов служит для восстановления цеолитов с
помощью продувки их сухим газообразным азотом при температуре 300  .
.
Электроутюг используется для склеивания полиэтиленовых пакетов,
применяемых для технологических нужд. Перед работой с электронагревательными
приборами необходимо ознакомиться с инструкцией к прибору.
8) Правила работы с вакуумом
Работы, проводимые с вакуумом, опасны вследствие того, что при эвакуации
воздуха стеклянный сосуд может лопнуть и осколки могут поранить работающего, а
жидкость обрызгать его. Работа особенно опасна, если в сосуде находятся
вещества, чувствительные к удару. Поэтому вакуумные установки должны
располагаться за щитом или иметь индивидуальные защитные чехлы.
Все сосуды, применяемые для работы с вакуумом, должны быть изготовлены из
толстостенного стекла, должны иметь по возможности равную толщину стенок и при
изготовлении в стеклодувной мастерской должны быть подвергнуты закалке. При
работе с подогретыми растворами разрешается применять только жаропрочную
посуду. Не допускать употребления в работу стеклянных сосудов с трещинами.
Употребляемые в работу колбы Бунзена, вакуум-эксикаторы и другие
одиночные сосуды, из которых предполагается откачивать воздух, предварительно
испытывают на прочность. Для этого сосуд, защищённый щитом или прочной
изолирующей тканью или металлической сеткой, присоединяют к вакуум-насосу и
откачивают воздух из сосуда. Работники должны быть в защитных очках.
Стеклянную вакуум-установку, прибор для перегонки кислот, растворителей,
колонку для вакуум-дистилляции перед началом работы также проверяют на
прочность путём отсоса воздуха при максимальном вакууме, но не более 20 мм. рт.
ст. (остаточное давление), в течение 5 мин и на герметичность (сохранение
постоянства заданного остаточного давления после отключения вакуум-насоса).
Не допускается при вакуумировании прибора отключать вакуум-насос без
предварительного сброса вакуума с помощью воздухонапускного крана, т.к.
вследствие разности давлений воду или масло из вакуум-насоса может выбросить в
прибор. При замене приёмника или при необходимости отбора пробы из приемника
эти операции производят, выключая вакуум из этого приёмника или из всей
системы. Работники должны быть в защитных очках или масках из органического
стекла. Установки, находящиеся под вакуумом, должны быть защищены щитками из
органического стекла или шторками вытяжного шкафа.
Работающий должен быть знаком с основными свойствами перегоняемых веществ
и степенью опасности в обращении. В том случае, если испытанию подвергаются
пожаро- и взрывоопасные вещества, следует соблюдать все правила обращения с
ними.
При перегонке веществ следует соблюдать следующий порядок: собирается
установка с капилляром в перегонной колбе и проверяется система, затем
заливается перегонная жидкость в колбу, подключается вакуум к системе и
постепенно подогревается содержимое перегонной колбы на бане с безопасной
средой; температура бани не должна превышать более, чем на 20  температуру кипения жидкости. При
отгонке растворителей от продуктов, особенно с высокой чувствительностью к
механическим воздействиям, по возможности, следует использовать роторные
испарители. При использовании испарителя ИР-1М с целью повышения надежности
работы и вакуума целесообразно заменить сильфонное уплотнение на сальниковое.
При использовании капилляра при перегонке запрещается проводить отгонку
растворителей досуха. В случае контроля температуры обогреваемой среды с
помощью контактного термометра необходимо перегонку проводить с обязательным
контролем температуры с помощью дополнительного термометра. Порядок окончания
перегонки: отключается нагрев, содержимое колбы охлаждается до комнатной
температуры и только после этого отключается вакуум.
температуру кипения жидкости. При
отгонке растворителей от продуктов, особенно с высокой чувствительностью к
механическим воздействиям, по возможности, следует использовать роторные
испарители. При использовании испарителя ИР-1М с целью повышения надежности
работы и вакуума целесообразно заменить сильфонное уплотнение на сальниковое.
При использовании капилляра при перегонке запрещается проводить отгонку
растворителей досуха. В случае контроля температуры обогреваемой среды с
помощью контактного термометра необходимо перегонку проводить с обязательным
контролем температуры с помощью дополнительного термометра. Порядок окончания
перегонки: отключается нагрев, содержимое колбы охлаждается до комнатной
температуры и только после этого отключается вакуум.
Необходимо помнить, что при вакуумной разгонке горючих и
легковоспламеняющихся жидкостей выключение подогрева производят при температуре
жидкости не менее, чем на 50  ниже температуры их воспламенения.
ниже температуры их воспламенения.
Запрещается пользоваться вакуум-насосом для создания разряжения в
сосудах, в которых выделяются кислые пары и пары растворителей, без
предварительного поглощения этих пapoв в ловушках.
9) Правила работы с лабораторными автоклавами категории «В»
К обслуживанию лабораторных автоклавов допускаются лица, прошедшие
инструктаж по правилам безопасной эксплуатации сосудов, работающих под
давлением.
Эксплуатацию автоклавов необходимо немедленно прекратить при:
повышении давления в сосуде выше разрешенного;
неисправности предохранительного клапана;
обнаружении трещин, течи в резьбовых соединениях;
неисправности манометра.
При обслуживании автоклавов необходимо пользоваться защитными масками или
очками.
4.4 Техника безопасности в аварийных ситуациях
В каждой рабочей комнате распоряжением заведующего лабораторией
назначается ответственное лицо за пожарную безопасность.
Ответственное лицо за пожарную безопасность обязано:
обеспечить исправное содержание и постоянную готовность к действию
имеющихся средств пожаротушения, а также средств пожарной связи;
знать правила обращения и применения первичных средств пожаротушения и
обучать работающих в комнате;
следить за соблюдением противопожарного режима всеми сотрудниками,
работающими в комнате, а также за своевременным выполнением предложенных
противопожарных мероприятий;
не допускать к работе лиц, не прошедших инструктаж по соблюдению мер
пожарной безопасности;
следить за соблюдением правил пожарной безопасности при эксплуатации
электронагревательных приборов;
следить, чтобы перед окончанием работы проводилась уборка комнаты и
рабочих мест; чтобы по окончании работы были выключены приборы, вода;
следить за исправностью приборов, отопления, вентиляции, электроустановок,
электропроводки и принимать меры к устранению обнаруженных неисправностей;
при возникновении пожара сообщить в пожарную часть по телефону 01 или
извещателю и до прибытия пожарной команды принять меры по его ликвидации.
При работе с огне- и взрывоопасными веществами в комнате должно
находиться не менее 2-х человек с целью оказания помощи пострадавшему при
необходимости. Нахождение в комнате одного человека допускается при проведении
неопасных работ, при постоянном контроле заведующего лабораторией. При работе с
взрывоопасными веществами в комнате должно находиться не менее 2-х и не более
3-х человек. Для всех комнат лаборатории должны быть оформлены нормы хранения
горючих и легковоспламеняющихся жидкостей и ПВОВ, согласованные с главным
специалистом по ОТ и ЭБ и СПЧ-4. Нормы хранения должны быть вывешены на видных
местах. Каждая рабочая комната должна быть обеспечена огнетушителем, песком,
асбестовым одеялом, противогазом, аптечкой. Входные двери должны легко
открываться и не загромождаться.
1) Порядок действия при пожаре:
сообщить в пожарную охрану по телефону 01 или извещателю, точно указать
местонахождение загорания, что горит, фамилию передавшего сообщение;
по возможности принять меры к прекращению распространения огня: отключить
вентиляцию, перекрыть воздуховод, отключить электроэнергию;
удалить из помещения горючие и взрывоопасные продукты, горючие жидкости,
газовые баллоны;
приступить к тушению пожара имеющимися средствами;
организовать встречу прибывающих пожарных подразделений;
сообщить о пожаре руководству отдела;
- в случае необходимости вызвать скорую помощь по телефону 03; сотруднику
оказать доврачебную помощь; поставить в известность администрацию и главного
специалиста по ОТ и ЭБ; пострадавшего с сигнальной картой отправить в больницу.
При загорании одежды на человеке:
не позволять человеку бежать;
- постараться закрыть пламя асбестовым одеялом или другим плотным
материалом;
- при необходимости использовать воду;
в случае травмирования оказать меры первой помощи и вызвать скорую помощь
по телефону 03.
Каждый работник должен уметь пользоваться средствами пожаротушения и
знать место их расположения. К средствам пожаротушения относятся: асбестовое
одеяло (хранится вблизи вытяжного шкафа), огнетушитель, песок (могут храниться
в нише), пожарные краны.
В случае необходимости применить пожарный кран для тушения пожара. первый
человек берется за ствол, разматывает пожарный рукав и направляет ствол на очаг
пожара. Второй человек открывает вентиль подачи воды. Не допускается применение
пожарного крана для тушения электроустановок, находящихся под напряжением,
щелочноземельных металлов, растворителей, не смешивающихся с водой.
В случае использования вентильного углекислотного огнетушителя (типа
ОУ-2, ОУ-5 и т.д.) следует:
левой рукой взяться за рукоятку;
огнетушитель снять с кронштейна;
повернуть раструб в направлении огня;
поворотом маховика открыть вентиль.
Выбрасываемую из раструба струю направить на очаг огня, причем:
жидкое горючее (бензин, масло, спирт и т.д.) следует тушить, начиная с
края огня, стремясь перекрыть струей углекислоты поверхность горящей жидкости;
- струю углекислоты к жидким веществам, которые могут быть разбрызганы,
следует подводить к поверхности наклонно;
не следует направлять струю углекислоты в упор на поверхность горящей
жидкости во избежание разбрызгивания ее, что вызовет увеличение объема пожара.
После прекращения пожара поворотом маховика перекрыть вентиль
огнетушителя.
взвешивание вентильного углекислотного огнетушителя проводится раз в три
месяца.
В случае использования клапанного углекислотного огнетушителя следует:
сорвать пломбу, выдернуть чеку;
направить раструб на пламя, нажать на рычаг;
не подводить раструб ближе 1 м до электроустановки и пламени;
проверять массу взвешиванием через 12 месяцев.
с целью предотвращения обморожения запрещается дотрагиваться незащищенной
рукой раструба работающего углекислотного огнетушителя! В углекислотных
огнетушителях в качестве заряда находится под избыточным давлением сжиженный
диоксид углерода. Углекислотные огнетушители предназначены для тушения
различных веществ и материалов, за исключением веществ, горение которых
происходит без доступа воздуха. Могут применяться для тушения электроустановок,
находящихся под напряжением.
Огнетушители порошковые унифицированные типа ОПУ-5, ОПУ-10 предназначены
для тушения загораний жидких, твердых, газообразных веществ и электроустановок,
находящихся под напряжением. Порошковые огнетушителине предназначены для
тушения загораний щелочных и щелочноземельных металлов и других материалов,
горение которых может происходить без доступа воздуха. Огнетушитель состоит из
корпуса, наполненного порошком.
При тушении пожара необходимо:
поднести огнетушитель к месту пожара;
выдернуть опломбированную чеку;
отвести рукоятку запуска от корпуса огнетушителя, связанная с ней игла
запуска вскрывает баллон со сжатым газом, после чего газ через газоотводную
трубку поступает в корпус огнетушителя, заполненного порошком, вспучивает его и
создает требуемое избыточное давление;
направить распылитель на очаг пожара и через 5 с нажать на кнопку
управления прерывистой подачи порошка.
Порошок через насадок под давлением газа выбрасывается наружу. Тушение
необходимо проводить с подветренной стороны с расстояния не менее 2,0…2,5
метра.
После ликвидации пламенного горения и тушения пожара охладить горевшие
материалы водой. Каждый огнетушитель должен быть опломбирован пломбой.
При отсутствии пломбы вес огнетушителя должен быть проверен и его следует
вновь опломбировать.
Каждый огнетушитель должен иметь порядковый номер, нанесенный на корпус
белой краской.
Вновь принятый сотрудник обязан изучить инструкцию к огнетушителю и
пройти обучение по правилам пожарной безопасности в соответствии с объектовой
инструкцией по пожарной безопасности с записью в журнале инструктажа.
При выборе марки противогаза необходимо руководствоваться следующими
рекомендациями:
промышленный фильтрующий противогаз является средством
индивидуальной защиты органов дыхания и зрения от воздействия вредных
газов, паров, дыма и тумана, присутствующих в воздухе;
для защиты органов дыхания от смеси кислых паров и паров органических
веществ следует применять противогазы марок «В», «БКФ» или «Е»;
для защиты органов дыхания от органических паров применяется противогаз
марок «А», «А8», но его нельзя применять для защиты от низкокипящих, плохо
сорбирующихся органических веществ (метан, этилен и т. д.);
для защиты от аммиака, сероводорода и паров органических веществ
используется противогаз марки «КД»;
для защиты от смеси паров ртути и органических веществ следует применять
противогаз марки «Г»;
противогаз марки «М» используется для защиты органов дыхания от следующих
веществ:окись углерода в присутствии
небольших количеств кислых газов, аммиака и смеси сероводорода с аммиаком.
отработанность противогазов по вредным примесям определяется следующим
образом:
для коробок марки «А», «В», «КД», «Е», «БКФ», «А8», «В8», «КД8», «Е8» при
появлении даже незначительного запаха вредного вещества, при этом необходимо
немедленно выйти из отравленной атмосферы и заменить коробку на новую; для
коробок марок «Г», «Г8» по отработанному времени; для коробок марок «СО» и «М»
по привесу коробок;
- на время хранения горловины коробок марок «СО» и «М» должны быть до
отказа завернуты колпачками с резиновыми прокладками;
- горловину коробок марок «А», «В», «Г», «Е», «КД», «БКФ», «А8», «В8»,
«Е8», «Г8», «КД8» закрывают колпачком с резиновой прокладкой, а отверстие в дне
- резиновой пробкой;
при хранении противогазов без употребления более 3-х лет они должны
заменяться.
) Меры первой помощи при поражении электрическим током
При поражении электрическим током необходимо, прежде всего, обесточить
пострадавшего. Для изоляции рук при спасении, в особенности, если необходимо
коснуться частей тела пострадавшего, не покрытых одеждой, надо надеть резиновые
перчатки, сапоги, обмотать руки шарфом или воспользоваться другими подручными
средствами. При этом рекомендуется действовать по возможности одной рукой.
Когда ток проходит в землю через человека, который сжимает в руках один провод,
проще прервать ток, подсунув под ноги доску, фанеру или приподняв ноги. В
случае необходимости надлежит перерубить провод инструментом с изолированной
ручкой. И только после освобождения пострадавшего от действия тока можно
оказать ему помощь:
- если пострадавший находится в сознании, то необходимо обеспечить полный
покой до прибытия врача;
при бессознательном состоянии, но сохранившемся дыхании, создать приток
свежего воздуха, давать нюхать нашатырный спирт, обрызгать водой, растирать и
прогревать тело; и срочно вызвать врача;
- при отсутствии признаков жизни, не теряя времени, приступить к
искусственному дыханию, предварительно освободив пострадавшего от стесняющей
одежды.
Для проведения искусственного дыхания по способу изо рта в рот
оказывающий помощь делает глубокий вдох и затем, плотно прижав свой рот ко рту
пострадавшего (можно через марлю или платок), производит в него выдох. При этом
нос пострадавшего необходимо закрыть щекой или пальцами. Затем оказывающий
помощь откидывается назад и делает новый вдох. В этот период грудная клетка
пострадавшего опускается, и он делает пассивный выдох. Вдувание воздуха следует
производить резко каждые 5…6 с, что соответствует частоте дыхания 12…15 раз в
мин. Контроль за поступлением воздуха в легкие определяется по расширению
грудной клетки при каждом вдувании.
Если после вдувания воздуха грудная клетка не расправляется, необходимо
выдвинуть нижнюю челюсть вперед. При появлении первых слабых вдохов следует
приурочивать проведение искусственного вдоха к моменту начала самостоятельного
вдоха пострадавшего. Искусственное дыхание проводится до восстановления
собственного глубокого и ритмичного дыхания.
) Первая помощь при отравлениях
При работе с ядовитыми веществами бывает необходимо до прибытия скорой
помощи оказать пострадавшему первую помощь и чем скорее она будет оказана, тем
меньше будет последствий отравления. Нет противоядий и других видов помощи,
которые были бы одинаково действенны в любом случае. Но всегда следует
позаботиться об удалении пострадавшего из опасной зоны, освободить от стесняющей
дыхание одежды; остерегаться охлаждения тела. При остановке дыхания следует
применить искусственное дыхание. Очень важно для пострадавшего создать
абсолютный покой, не давать ему делать бесполезных движений. При попадании
ядовитого вещества в жидком или твердом виде внутрь вызвать рвоту.
Случаи отравления бывают разнообразные. Ядовитые вещества могут попадать
в организм через пищеварительный тракт, дыхательные пути и сравнительно редко
через кожу; чаще всего происходит отравление газами. Каждый химик должен быть
знаком с токсическими свойствами тех веществ, с которыми он работает.
) Ожоги и меры первой помощи при ожогах
Ожоги - весьма часто встречающиеся в химических лабораториях
травматические повреждения. Различают ожоги термические, электрические,
химические. Наиболее распространенными в лаборатории являются ожоги термические
и химические.
Термические ожоги по своей тяжести могут быть четырех степеней. Наиболее
тяжелой формой ожога является ожог третьей и четвертой степеней.
Причинами термических ожогов могут быть:
прикосновение голыми руками к раскаленным или сильно нагретым предметам;
загорание легковоспламеняющихся или горючих веществ.
Особо тяжелые последствия могут иметь место, если в результате разрыва
емкости с легковоспламеняющейся жидкостью одежда и тело облиты этой жидкостью,
и она воспламенилась. В этом случае пострадавшего надо повалить на пол и затем
гасить огонь асбестовыми одеялом или другими материалами. После ликвидации
загорания немедленно оказать первую помощь:
снять одежду с обожженных частей тела, если необходимо разрезать ее
ножницами;
обожженную поверхность покрыть сухой антисептической повязкой, не
предпринимая ничего без врача для очистки поверхности ожога от приставших
остатков одежды.
При термических ожогах первой степени необходимо сделать примочки на
обожженное место из свежеприготовленных растворов 2 %-ной питьевой соды или 5
%-ного марганцовокислого калия. Лучшим средством для примочек является 96 %-ный
этиловый спирт! При более тяжелых ожогах необходимо немедленно отправить
пострадавшего в лечебное учреждение.
При химических ожогах, особенно кислотами и щелочами, пораженный участок
кожи быстро промывают большим количеством воды, затем на обожженное место
прикладывают примочку: при ожогах кислотой - из 2 %-ного раствора соды; при
ожогах щелочью - из 1…2 %-ного раствора уксусной кислоты.
При ожогах бромом обожженное место необходимо быстро промыть несколькими
порциями этилового спирта, а затем обратиться в поликлинику.
Очень опасно попадание в глаза щелочи, т.к. происходит взаимодействие с
тканями глаза и проникновение в глубокие слои. Это очень затрудняет, а в ряде
случаев делает невозможным полное удаление щелочи из глаз даже при длительном и
обильном промывании их водой.
Особенно опасны поражения глаз минеральными кислотами - азотной, серной,
соляной. При попадании брызг в глаза их немедленно нужно промыть обильным
количеством воды и затем 3 %-ным раствором бикарбоната натрия.
Способ обезвреживания и уничтожения выбирается в каждом отдельном случае
в зависимости от свойств уничтожаемого вещества и его количества.
Щелочи уничтожаются путем растворения в воде и нейтрализации
разбавленными минеральными кислотами до нейтральной реакции по индикаторной
бумаге с последующим сливом раствора в канализацию.
Растворители сдаются на уничтожение методом сжигания по акту,
утвержденному директором или его заместителем.
Сильнопахнущие вещества из класса аминов (пиридин, диэтиламин, метиламин
и др.) растворяют в воде, нейтрализуют слабой минеральной кислотой и сдают на
уничтожение методом слива на почву. Собирать отходы в полиэтиленовые канистры
допускается при наличии обоснования только с разрешения главного инженера.
Твердые горючие вещества уничтожают методом сжигания [47].
. МЕТРОЛОГИЯ И СТАНДАРТИЗАЦИЯ
5.1 Перечень нормативной документации
Пояснительная записка выполнена в соответствии с требованиями ГОСТ
2.105-95, ГОСТ 2.106-96 и СТП 12 200-04 на листах формата А4 без рамок согласно
ГОСТ 7.32-01, текст согласно ГОСТ 2.004-88, обозначения единиц физических величин
соответствуют ГОСТ 8.417-81. Приложения выполняются на листах формата А4,
допускается выполнять приложение на листах формата А3, А4х3, А4х4, А2 и А1 по
ГОСТ 2.301. Библиографическое описание использованных источников соответствует
ГОСТ 7.1-84 и ГОСТ 7.12-93. Государственные стандарты и технические условия на
химические реактивы, оборудование, посуду использованные в работе, представлены
в таблице 9.
Таблица 9 - Обозначение нормативной документации
|
Обозначение НД
|
Наименование НД
|
|
ГОСТ 6709-72
|
Вода дистиллированная. Технические условия.
|
|
ГОСТ 3769-78
|
Реактивы. Аммоний сернокислый. Технические условия.
|
|
ГОСТ 24363-80
|
Реактивы. Калия гидроокись. Технические условия.
|
|
ГОСТ 3118-77
|
Реактивы. Серная кислота. Технические условия.
|
|
ГОСТ 4232-74
|
Реактивы. Ортофосфорная кислота. Технические условия.
|
|
ГОСТ 12026-76
|
Бумага фильтровальная лабораторная. Технические условия.
|
|
ГОСТ 25336-82
|
Посуда и оборудование лабораторные стеклянные. Типы,
основные параметры и размеры.
|
|
ГОСТ 1770-74
|
Посуда мерная лабораторная стеклянная. Цилиндры, мензурки,
колбы, пробирки. Общие технические условия.
|
|
ГОСТ 19491-74
|
Весы лабораторные. Технические условия.
|
|
ГОСТ 28498-90
|
Термометры жидкостные стеклянные общие технические
требования. Методы испытаний.
|
|
ГОСТ 9147-80
|
Посуда и оборудование лабораторные фарфоровые. Технические
условия
|
|
ГОСТ 8682-93
|
Посуда лабораторная стеклянная. Шлифы конические
взаимозаменяемые
|
ЗАКЛЮЧЕНИЕ
По результатам проведенных исследований можно сделать следующие ВЫВОДЫ.
. Изучен ферментативный гидролиз ЛЦМ в ацетатном буфере и в водной
среде. Гидролиз ЛЦМ в водной среде был проведён впервые. При этом выход РВ в
образце ЛЦМ ПОО № 593 в ацетатном буфере и в водной среде получен аналогичный -
76,3 и 75,4 % соответственно. ФГ мискантуса прошел несколько хуже, чем ПОО: в
буфере выход РВ ниже на 2,2 раза, а в воде на 1,3 раза;
. Показана зависимость ФГ от концентрации субстрата. Установлено,
что повышение концентрации субстрата снижает эффективность процесса гидролиза
плодовых оболочек овса на 1,12 раза. Для ЛЦМ М такой закономерности нет, выходы
РВ при концентрациях 33,3 г/л и 90,0 г/л довольно низкие;
. Исследована зависимость эффективности ФГ от условий
перемешивания. Показано, что при перемешивании с частотой 150 мин-1 реакция
гидролиза проходит глубже, чем при статических условиях. Частота перемешивания
170 мин-1 оказывается избыточной для обоих видов субстрата. Кроме того,
установлено, что целесообразно первые 8 ч проводить ферментацию без
перемешивания, а далее с перемешиванием с частотой не более 150 мин-1;
. Установить зависимость ФГ от сырья для получения ЛЦМ. Выход РВ
при ферментации ЛЦМ ПОО в 2,2 раза больше, чем у ЛЦМ М. Это может быть связано,
с природой субстрата, с физико-химическими характеристиками исходных ЛЦМ:
большей МД пентозанов и меньшей МД целлюлозы в ЛЦМ ПОО;
. Изучена реакционная способность к ферментации ЛЦМ плодовых
оболочек овса разными ферментными препаратами. Установлено, что наименьшую
скорость гидролиза обеспечивает «Целлолюкс-А» с выходом РВ 36,3 %. Наибольший
выход РВ (76,3 %) обеспечивает вариант, в котором использовано два ферментных
препарата, но при этом концентрация препарата «Брюзайм BGX» повышена в 10 раз по сравнению с вариантом, в
котором «Брюзайм BGX» вносили в
количестве 0,02 г/г субстрата;
. Исследована зависимость эффективности ФГ от способа подготовки
ЛЦМ. Промывка ЛЦМ существенно увеличивает эффективность ферментативного
гидролиза. У мискантуса выход РВ увеличивается в 1,9 раза, а у ПОО в 1,3 раза.
Без промывки ЛЦМ М ферментируется хуже (39,9 %), чем ПОО (58,5 %). Кроме того,
лабораторные образцы ЛЦМ М и ЛЦМ ПОО демонстрируют достаточно высокие выходы РВ
- 88,6 и 80,5 % соответственно.
По представленным результатам выполнены следующие публикации:
1. Момот, Т.О. Ферментативный гидролиз лигноцеллюлозного
материала в ацетатном буфере и водной среде / Т.О. Момот, Е.А. Скиба // Химия
биологически активных веществ: тезисы Всероссийской школы-конференции молодых
учёных, аспирантов и студентов с международным участием
"ХимБиоАктив-2012". - Саратов, 2012. - 253-254 с.
2. Момот, Т.О. Зависимость ферментативного гидролиза
лигноцеллюлозных материалов в водной среде от концентрации субстрата / Т.О.
Момот // Биокаталитические технологии и технологии возобновляемых ресурсов в
интересах рационального природопользования: тезисы Международной молодежной
конференции. - Кемерово, 2012 - 142-146 с.
3. Момот, Т.О. Ферментативный гидролиз лигноцеллюлозных
материалов в зависимости от частоты перемешивания / Т.О. Момот, О.В. Байбакова,
Е.А. Скиба // Биокаталитические технологии и технологии возобновляемых ресурсов
в интересах рационального природопользования: тезисы Международной молодежной
конференции. - Кемерово, 2012 - 147-150 с.
4. Момот, Т.О. Осахаривание лигноцеллюлозных материалов из
мискантуса и плодовых оболочек овса / Т.О. Момот, Е.А. Скиба // Достижения и
перспективы развития биотехнологии: тезисы Международной Научной конференции. -
Саранск, 2012 - 143 с.
5. Момот, Т.О. Ферментативный гидролиз лигноцеллюлозных
материалов из плодовых оболочек овса различными ферментными комплексами / Т.О.
Момот, Е.А. Скиба // Химическая технология и биотехнология материалов и
продуктов: тезисы Международной Конференции РХО им. Д.И. Менделеева. - Москва,
2012 - 121-123 с.
6. Момот, Т.О. Некоторые факторы, влияющие на ферментативный
гидролиз целлюлозосодержащего недревесного сырья/ Т.О. Момот, О.В. Байбакова //
Инновационные технологии в области химии и биотехнологии: тезисы Всероссийской
научно-технической конференции. - Уфа, 2012 (в печати)
7. Скиба, Е.А. Лигноцеллюлозный материал из мискантуса -
перпективный субстрат / Е.А. Скиба, Ю.А. Гисматулина, О.В. Байбакова, Т.О.
Момот // Научная дискуссия: вопросы физики, химии, биологии: тезисы
Международной заочной научно-практической конференции. - Москва, 2012 (в
печати)
ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ
АК - азотная кислота;
ЛЦМ - лигноцеллюлозный материал;
М - мискантус;
МД - массовая доля;
НД - нормативные документы;
ОП - опытное производство;
П - пентозаны;
ПОО - плодовые оболочки овса;
РВ - редуцирующие вещества
СП - степень полимеризации;
ТЦ - техническая целлюлоза;
ФГ - ферментативный гидролиз;
ЦСП - целлюлозосодержащий продукт;
ЦСС - целлюлозосодержащее сырье;
ЩД+АК - щелочная делигнификация+азотная кислота;
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Синицын, А.П. Биоконверсия лигноцеллюлозных
материалов / А.П. Синицын, А.В. Гусаков, В. М. Черноглазов: учеб. пособие. М.:
Изд-во МГУ, 2004. 224 с.
. Будаева, В.В. Морфологические особенности
нетрадиционных целлюлоз и получение эфиров / В.В. Будаева, Г.В. Сакович //
Новые достижения в химии и химической технологии растительного сырья: материалы
V Всероссийской конференции 24-26
апреля 2012 г. / под ред. Н.Г. Базарновой, В.И. Маркина. - Барнаул : Изд-во
Алт. ун - та, 2012. - 533 с.
. Шарков, В.И. О строении целлюлозы / В.И. Шарков //
Ферментативное расщепление целлюлозы / отв. ред. А.И.Опарин - Москва: Изд-во
«Наука», 1967. - 113 с.
4. Whitaker J.R. // Enzyme Microbiol. Technol.
1984. V. 6,N 8. P.314 - 343
5. Салматова, Л.С. Физиология растительнрой клетки. Л.,
1983
. Бейнарт, И.И. Клеточная стенка древесины и ее
изменения при химическом воздействии / И.И. Бейнарт, Н.А. Ведерников. - Рига,
1972
. Кухаренко, А.А. Интенсификация микробиологического
синтеза процесса получения этанола из крахмал- и целлюлозосодержащего сырья /
А.А. Кухаренко, А.Ю. Винаров, Т.Е. Сидоренко, А.И. Бояринов. - Москва: ред.
Бюллетеня «Новые технологии», 1999. - 94 с.
. Холькин, Ю.И. Технология гидролизных производств.
Учебник для вузов. - М.: Лесн. пром-сть, 1989. - 496 с.
. Непенин, Н.Н. Технология целлюлозы. Том 1.
Производство сульфитной целлюлозы. М., 1956. - 748 с.
. Золотухин, В.Н. Получение целлюлозы из недревесного
сырья на опытной установке / В.Н. Золотухин, В.В. Будаева, Р.Ю. Митрофанов //
Синтез и разработка технологии компонентов высокоэнергетических составов и
химических продуктов гражданского применения: тезисы докладов
научно-технической конференции, посвященной 50-летию отдела 20 ФГУП «ФНПЦ
«Алтай» (17-18 июня 2010 г., г. Бийск). - Бийск: Изд-во Алт. гос. техн. ун-та,
2010. - 55-57 с.
. J. Agric
Экстрактивные вещества Мiscanthus giganteus: источник ценных фенольных
соединений и стеринов./ Food Chem,
2009, - № 5, Р. - 3626-3631.
12. Jones M.B., Walsh M. Miscanthus for energy and
fibre./ EARTHSCAN. London. Sterling. VA, 2002. - c
13. Гальбрайх, Л.С. Целлюлоза и её производные - М: Химия,
1996. - 10 с.
. Базарнова, Н.Г. Химические превращения целлюлозы в
составе растительного сырья / Н.Г. Базарнова, В.И. Маркин, Е.В. Калюта, И.В.
Микушина, И.Б. Катраков // Химия растительного сырья. - 2014. №3. - 75-84 с.
. Берлин, А.А. // Соросовский Образовательный Журнал.
- 1995. № 1. - 57-65 с.
16. Mullins J.T. Enzymatic hydrolysis and
fermentation of corn for fuel alcohol // Biotechnol and Bioeng. 1985, v.27, N
3, p.321-326
17. Востриков, С.В. Новые аспекты биоконверсии
крахмалсодержащего сырья при производстве спирта / С.В. Востриков, Г.П.
Шуваева, Г.Г. Губкина. - Известия вузов. Пищевая технология № 1, 1998. - 22-24
с.
. Огородникова, Т.Е. Способ получения этанола из
целлюлозосодержащего материала / Т.Е. Огородникова, О.Э. Борохова, И.П.
Михайлова, О.И. Шаповалов // № 9200430/13 Заявл. 3.12.92.
. Головлева, Л.А. Микробная деградация лигнина / Л.А.
Головлева, Х.Г. Ганбаров // Успехи микробиологии. - 1982 Вып. 7, 136-158 с.
. Головлева, Л.А. О микробиологическом разложении
лигнина и возможной роли диоксагеназ в процессе его деструкции / Л.А.
Головлева, Р.Н. Перцова, И. Е. Федечкина и др. // Прикл. биохим. микробиол. -
2010. Т.19 Вып.6. 709-719 с.
. Лобанок, А. Г. Микробный синтез на основе целлюлозы:
Белок и другие ценные продукты / А.Г. Лобанок, В.Г. Бабицкая, Ж.Н.
Богдановская. - Мн.: Наука и техника, 1988.-261 с.
22. Effects of Cellulose Crystallinity,
Hemicellulose, and Lignin on the Enzymatic Hydrolisys of Miscanthus sinensis
to Monosaccharides - Bioscience, Biotechnology and Biochemistry, 72 (3), 805-810,
2008.
. Evaluation of the Factors Affecting Avicel
Reactivity Using Multi-Stage Enzymatic Hydrolysis - Biotechnology and
Bioengineering, Vol. 109, No. 5, May, 2012.
24. Клесов, А.А. Ферментативный катализ. - М.: 1984, Т. 2.
- 216 с.
25. Reese E.T. Degradation of polymeric
carbohydrates by microbial enzymes // The structure, biosynthesis and
degradation of wood. Rec. Adv. in Phytochem. 1997. Vol. 11. P. 311-367
26. Клесов, А.А. Ферментативное превращение целлюлозы /
Итоги науки и техники. Сер. Биотехнол. - М.: 1983, Т. 1. - 63 -150 с.
27. Klyosov, A.A. Conversion of cellulose to
glucose: present state of the art and potential / A.A. Klyosov, M.L.
Rabinowitch // Enzyme Engineering: Future Directions. - N.Y.: 1980, 83-166 p.
28. Клесов, А.А. Ферменты целлюлазного комплекса /
Проблемы биоконверсии растительного сырья. - М.: 1986, 95-136 с.
. Синицын, А.П. Ферментативное получение глюкозы из
целлюлозы: влияние состава композиционного полиферментного целлюлазного
препарата на эффективность гидролиза хлопкового линта / А.П. Синицын, Б.
Наджеми, А.А. Клесов // Полиферментные ситемы / под ред. А.А. Гляжма и др. -
1980, Ч. 1. - 109-145 с.
. Яровенко, В.Л. Справочник по производству спирта.
Сырьё, технология и технохимконтроль / В.Л. Яровенко, Б.А. Устинников, Ю.П.
Богданов, С.И. Громов. - М.: Легкая и пищевая промышленность, 1981. - 336 с.
. Скиба, Е.А. Масштабирование ферментативного
гидролиза технической целлюлозы мискантуса / Е.А. Скиба // Новые достижения в
химии и химической технологии растительного сырья: материалы V Всероссийской конференции, Барнаул,
24-26 апреля 2012
. Рабинович, В.А. Краткий химический справочник / В.А.
Рабинович, З.Я. Хавин. - М.: Химия, 1978. - 392 с.
. ГОСТ 10820-75 Целлюлоза. Метод определения массовой
доли пентозанов. Издание официальное. - М: Изд-во стандартов, 1976. - 7 с.
. Рухлядева, А.П. Методы определения активности
гидролитических ферментов / А.П. Рухдядева. - М.: Легкая и пищевая
промышленность, 1981. - 287 с.
. ГОСТ Р 53046-2008 Препараты ферментные. Методы
определения ферментативной активности целлюлазы. Издание официальное. - М:
Стандартформ, 2009. - 12 с.
. ГОСТ 4517-75 Реактивы. Методы приготовления
вспомогательных реактивов и растворов, применяемых при анализе. Издание
официальное. - М: Стандартформ, 2008. - 35 с.
. ГОСТ 6840 - 78 Целлюлоза. Метод определения
а-целлюлозы. Издание официальное. - М: Изд-во стандартов, 1984. - 4 с.
. Макарова Е.И., Будаева В.В., Митрофанов Р.Ю. //
Ползуновский вестник, 2010. - № 4-1. - С. 192-198.
. Скиба, Е.А. Биоэтанол из мискантуса и отходов злаков
/ Е.А. Скиба, В.В. Будаева, Г.В. Сакович, Е.И. Макарова, И.Н. Павлов // Новые
достижения в химии и химической технологии растительного сырья: материалы V Всероссийской конференции, Барнаул,
24-26 апреля 2012 г. / Под ред. Н.Г. Базарновой, В.И. Маркина. - Барнаул:
Изд-во Алт. ун-та, 2012. - 386-387 с.
. Байбакова, О.В. Влияние биологически активных
веществ на биосинтез этанола на среде ферментативного гидролизата технической
целлюлозы плодовых оболочек овса / О.В. Байбакова, Е.А. Скиба // Химия биологически
активных веществ: тезисы Всероссийской школы-конференции молодых учёных,
аспирантов и студентов с международным участием "ХимБиоАктив-2012". -
Саратов, 2012 - 228-229 с.
. Момот, Т.О. Ферментативный гидролиз
лигноцеллюлозного материала в ацетатном буфере и водной среде / Т.О. Момот,
Е.А. Скиба // Химия биологически активных веществ: тезисы Всероссийской
школы-конференции молодых учёных, аспирантов и студентов с международным
участием "ХимБиоАктив-2012". - Саратов, 2012. - 253-254 с.
. Момот, Т.О. Зависимость ферментативного гидролиза
лигноцеллюлозных материалов в водной среде от концентрации субстрата / Т.О.
Момот // Биокаталитические технологии и технологии возобновляемых ресурсов в
интересах рационального природопользования: тезисы Международной молодежной
конференции. - Кемерово, 2012 - 142-146 с.
. Момот, Т.О. Ферментативный гидролиз лигноцеллюлозных
материалов в зависимости от частоты перемешивания / Т.О. Момот, О.В. Байбакова,
Е.А. Скиба // Биокаталитические технологии и технологии возобновляемых ресурсов
в интересах рационального природопользования: тезисы Международной молодежной
конференции. - Кемерово, 2012 - 147-150 с.
44. Zhiying Yu
Evaluation of the factors affecting avicel reactivity using multi-stage
enzymatic hydrolysis // Biotechnology and Bioengineering
<http://onlinelibrary.wiley.com/journal/10.1002/%28ISSN%291097-0290>,
2012. - V. 109, № 5 - Р. 1131-1139
45. Момот, Т.О. Осахаривание лигноцеллюлозных материалов
из мискантуса и плодовых оболочек овса / Т.О. Момот, Е.А. Скиба // Достижения и
перспективы развития биотехнологии: тезисы Международной Научной конференции. -
Саранск, 2012 - 143 с.
. Момот, Т.О. Ферментативный гидролиз лигноцеллюлозных
материалов из плодовых оболочек овса различными ферментными комплексами / Т.О.
Момот, Е.А. Скиба // Химическая технология и биотехнология материалов и
продуктов: тезисы Международной Конференции РХО им. Д.И. Менделеева. - Москва,
2012 - 121-123 с.
. Общая инструкция по охране труда группы лаборатории
биоконверсии № 8