При
выбранной скорости V счет проводился по времени t от 0 до tmax, при этом
напряжение увеличивалось от 0 до Umax=V tmax. Затем знак V менялся на
противоположный, t уменьшалось от tmax до 2 tmax, напряжение - от Umax
до 0. По результатам расчета определялись границы пассивной зоны (U1, U2) и
напряжение U, соответствующее минимальной плотности тока. Далее по
формуле (8) определялся общий заряд пуска.
Итерационный
процесс (11) оценивался по условию 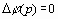 для всех p
для всех p S. При выполнении очередного цикла итераций (11)
для каждого t контролировалось выполнение балансового соотношения по току с
относительной погрешностью 1 %.
S. При выполнении очередного цикла итераций (11)
для каждого t контролировалось выполнение балансового соотношения по току с
относительной погрешностью 1 %.
Для
определения параметров в формулах (5), (6) были использованы данные,
приведенные в [6] для стали 18 % Cr – 8 % Ni в 1N H2SO4 при 250 C. При этом
получены значения параметров: k1=0.04315, k2=17.25, a1=350, a2=0.3, a3=17,
a4=0.3.

Рис.
1. Анодные поляризационные зависимости, построенные по формуле (6) для
скоростей V, В/час: 1 – 720; 2 – 360; 3 – 180; 4 – 90; 5 – 45; 6 – 22,5; 7 –
12; 8 – 6; 9 – 1,6; 10 – 0,4; 11 – 0,025. Точками обозначены экспериментальные
данные для скоростей V, В/час: 720; 360; 12; 6; 1,6; 0,4; 0,025.
На
рис. 1 представлены анодные поляризационные зависимости j(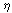 ), построенные по формуле
(6). Сплошной линией выделены кривые, для которых экспериментальные данные [6]
при тех же значениях скорости V нанесены точками. Точки выбраны из трех
участков: 1) участка максимальной плотности тока в области активного
растворения; 2) переходного участка; 3) участка пассивного состояния анода. Из
рисунка видно, что предложенная зависимость (6) качественно согласуется с
экспериментальными данными в исследуемом диапазоне значений скорости развертки
потенциала.
), построенные по формуле
(6). Сплошной линией выделены кривые, для которых экспериментальные данные [6]
при тех же значениях скорости V нанесены точками. Точки выбраны из трех
участков: 1) участка максимальной плотности тока в области активного
растворения; 2) переходного участка; 3) участка пассивного состояния анода. Из
рисунка видно, что предложенная зависимость (6) качественно согласуется с
экспериментальными данными в исследуемом диапазоне значений скорости развертки
потенциала.
Результаты расчетов
Приведем
некоторые результаты численных расчетов пусковых режимов анодной защиты
стального цилиндра, заполненного серной кислотой и защищаемого одним цилиндрическим
катодом (рис. 2).
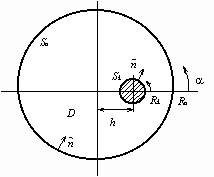
Рис.
2. Схема электрохимической системы. Sa – защищаемая поверхность; Sk –
поверхность катода; Ra, Rk – радиусы анода и катода; h – расстояние между
центрами электродов;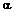 ,
,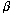 – углы отсчета граничных точек на аноде и
катоде; – нормаль к границе.
– углы отсчета граничных точек на аноде и
катоде; – нормаль к границе.
Радиусы
границ имеют значения: Ra=10 см, Rk=2 см; электропроводность среды 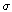 =10 см/м. Расстояние
между центрами границ h изменялось от 0 до 7 см. Напряжение U изменялось от 0
до Umax=2.4 В, затем обратно от Umax до 0.
=10 см/м. Расстояние
между центрами границ h изменялось от 0 до 7 см. Напряжение U изменялось от 0
до Umax=2.4 В, затем обратно от Umax до 0.
На
рис. 3 представлены зависимости потенциала в различных точках анода (а) и
катода (б) от приложенного напряжения при скорости пуска V=36 В/час. Стрелками
указаны решения при прямой и обратной развертке напряжения. На участке
U1<U2<U3 наблюдаются два решения: верхнее соответствует активному
растворению, нижнее - пассивному состоянию анода. Из рисунка видно, что для
достижения пассивного состояния анода (U=U) необходимо вначале
увеличивать напряжение U от 0 до U2 (верхняя ветвь графика), а затем уменьшать
от U2 до U (нижняя ветвь). Волна пассивации перемещается по поверхности
анода от точки 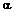 =0
к удаленной точке
=0
к удаленной точке 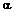 =, при этом защитный потенциал
=, при этом защитный потенциал  возрастает (от линии
1 к линии 4).
возрастает (от линии
1 к линии 4).
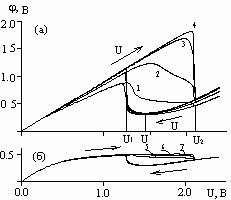
Рис.
3. Зависимость потенциала от приложенного напряжения при h=5 см; V=36 В/час на
аноде (а) при углах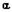 , равных, рад: 1 – 0; 2 –
, равных, рад: 1 – 0; 2 – /3; 3 – 2
/3; 3 – 2 /3; 4 –
/3; 4 – ; и на катоде (б) при углах
; и на катоде (б) при углах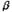 , равных, рад: 5 –
0; 6 –
, равных, рад: 5 –
0; 6 – /2; 7 –
.
/2; 7 –
.
В
табл. 1 приведены параметры пассивной зоны (U1, U2) при различных расстояниях h
между центрами границ. Из таблицы видно, что с увеличением h меняется ширина
пассивной зоны, причем наименьшее значение (0.6) соответствует h=3.
Таблица
1. Интервал пассивной зоны при различных расстояниях h между центрами
электродов
|
h, см.
|
0
|
2
|
3
|
4
|
5
|
6
|
7
|
|
U2-U1, В
|
0.97
|
0.80
|
0.64
|
0.60
|
0.72
|
0.84
|
0.89
|
1.01
|
На
рис. 4 представлены зависимости плотности тока от напряжения в точках
электродов, наименее удаленных друг от друга: (а) – в анодной точке 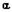 =0, (б) – в катодной
точке
=0, (б) – в катодной
точке 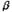 =0 при
различных h.
=0 при
различных h.

Рис.
4. Зависимость анодной (а) и катодной (б) плотности тока от приложенного
напряжения при V = 36 В/час; 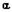 =0,
=0, 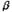 =0; и h, равных, см: 1 – 7; 2 – 5; 3 – 3; 4 – 1.
=0; и h, равных, см: 1 – 7; 2 – 5; 3 – 3; 4 – 1.
Из
рисунка видно, что по мере сближения центров окружностей: 1) напряжение,
соответствующее максимальной плотности тока, увеличивается (от линии 1 к линии
4); 2) напряжение, соответствующее минимальной плотности тока в пассивном
состоянии анода (U1.5), практически не зависит от h; 3) на аноде
максимальная плотность тока не зависит от h и совпадает с критической
плотностью тока на анодной поляризационной кривой; на катоде максимум j растет
(от линии 1 к линии 4).
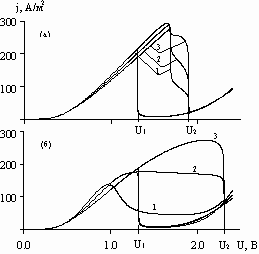
Рис.
5. Зависимость катодной плотности тока от напряжения при V=36 В/час; h, равных,
см: (а) – 3; (б) – 7; и углах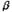 , равных: 1 – 0; 2 –
, равных: 1 – 0; 2 – /2; 3 –
/2; 3 – .
.
На
рис. 5 представлены зависимости плотности тока от напряжения в трех точках
катодной границы при различных h. Из рисунка видно, что при увеличении h: 1)
максимальная плотность тока в точке, наиболее близкой к аноду, падает (линия
1); 2) максимальная плотность тока в наиболее удаленной от анода точке (линия
3) практически не меняется; 3) напряжение U1 (переход анода в активное
состояние при обратной развертке) от h практически не зависит; 4) напряжение U2
(переход анода в пассивное состояние при прямой развертке) - значительно
увеличивается.
Общие
коррозионные потери характеризуются суммарным анодным зарядом. В табл. 2
приведены значения заряда Q, стекающего с анодной поверхности цилиндра
единичной длины при V=36 В/час за время пуска анодной защиты.
Таблица
2. Общий пусковой заряд Q, прошедший через анод при различных h.
|
h, см.
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Q, Кл
|
4730
|
3860
|
3020
|
2810
|
2800
|
2860
|
2950
|
3100
|
Из
таблицы видно, что значение заряда существенно зависит от расположения катода.
Так, например, минимальный заряд (Qmin 2800 Кл) соответствует h4.
Для сравнения отметим, что при скорости V=36 В/час заряд Qmin 9450 Кл
при h2.7. Следовательно, оптимальное расположение катода при заданной
скорости пуска V не является оптимальным при других значениях V.
Список литературы
Улиг
Г.Г., Реви Р.У. Коррозия и борьба с ней. Л.: Химия, 1989. 455 с.
Атанасянц
А.Г. Анодное поведение металлов. М.: Металлургия, 1989. 150 с.
Иванов
В.Т., Глазов Н.П., Макаров В.А. // Итоги науки и техники. Коррозия и защита от
коррозии. М.: ВИНИТИ, 1987. Т. 13. С. 117.
Агафонова
Н.Н., Макаров В.А. // Защита металлов. 1989. Т. 25. С. 531.
Болотнов
А.М., Иванов В.Т. // Электрохимия. 1996. Т. 32. С. 694.
Томашов
Н.Д., Чернова Г.П. Пассивность и защита металлов от коррозии. М.: Наука, 1965.
207 с.
Дамаскин
Б.Б., Петрий О.А. Электрохимия. М.: ВШ, 1987. 295 с.
Багоцкий
В.С. Основы электрохимии. М.: Химия, 1988. 400 с.
Ильин
В.П. Численные методы решения задач электрофизики. М.: Наука, 1985. 334 с.
Для
подготовки данной работы были использованы материалы с сайта http://www.bashedu.ru