Синтез бихромата аммония
Министерство образования и науки
Республики Казахстан.
КАРАГАНДИНСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ ИМЕНИ Е.А. БУКЕТОВА
Кафедра неорганической химии
КУРСОВАЯ РАБОТА
Тема:
Синтез бихромата аммония
Руководитель Шарипова З.М.
Студенты группы ХТОВ-12
Караганды 2010
Содержание
I. Введение
1.1 Историческая справка
1.2 Распространение в природе
1.3 Свойства хрома
1.3.1 Общие сведения
1.3.2 Получение хрома
1.3.3 Физические свойства
1.3.4 Физические свойства хрома
1.3.5 Химические свойства
1.3.6 Применение
1.3.7 Экологические проблемы
II. Характеристика бихромата аммония
2.1 Бихромат аммония
2.1.2 Применение
2.1.3 Токсичность
2.2 Характеристика исходных веществ
2.2.1 Хромный ангедрид
2.2.2 Свойства
2.2.3 Применение
2.2.4 Токсичность
2.2.5 Техника безопасности
2.2.2 Дихромат калия
2.2.2.1 Свойства
2.2.2.2 Получение дихромата калия
2.2.2.3 Применение
2.2.3 Серная кислота
2.2.3.1 Свойства
2.2.3.2 Применение
2.2.3.3 Токсическое действие
2.2.4 Аммиак
2.2.4.1 Свойства
2.2.4.2 Применение
2.2.4.3 Токсическое действие
2.5 Гидросульфат калия
2.5.1 Свойства
III. Практическая часть
3.1 Получение хромового ангидрида
IV Синтез
4.1 Синтез
4.1.1 Список посуды и приборов
4.1.2 Список реактивов
4.1.3 Синтез веществ
4.2 Идентификация
4.2.1 Химический анализ
4.2.2 Физико-химический анализ
Литература
Приложение
I.
Введение
1.1
Историческая справка
В 1766 году петербургский профессор химии И.Г. Леман описал
новый минерал, найденный на Урале на Березовском руднике, в 15 километрах от
Екатеринбурга. Обрабатывая камень соляной кислотой, Леман получил
изумрудно-зеленый раствор, а в образовавшемся белом осадке обнаружил свинец.
Спустя несколько лет, в 1770 году, Березовские рудники описал академик П.С.
Паллас. "Березовские копи, - писал он, - состоят из четырех рудников, которые
разрабатываются с 1752 года. В них наряду с золотом добываются серебро и
свинцовые руды, а также находят замечательный красный свинцовый минерал,
который не был обнаружен больше ни в одном другом руднике России. Эта свинцовая
руда бывает разного цвета (иногда похожего на цвет киновари), тяжелая и
полупрозрачная. Иногда маленькие неправильные пирамидки этого минерала бывают
вкраплены в кварц подобно маленьким рубинам. При размельчении в порошок она
дает красивую желтую краску.". Минерал был назван "сибирским красным
свинцом". Впоследствии за ним закрепилось название "крокоит".
Образец этого минерала был в конце XVIII века привезен
Палласом в Париж. Крокоитом заинтересовался известный французский химик Луи
Никола Воклен. В 1796 году он подверг минерал химическому анализу. "Все
образцы этого вещества, которые имеются в нескольких минералогических кабинетах
Европы, - писал Воклен в своем отчете, - были получены из этого (Березовского)
золотого рудника. Раньше рудник был очень богат этим минералом, однако говорят,
что несколько лет назад запасы минерала в руднике истощились и теперь этот
минерал покупают на вес золота, в особенности, если он желтый. Образцы
минерала, не имеющие правильных очертаний или расколотые на кусочки, годятся
для использования их в живописи, где они ценятся за свою желто-оранжевую
окраску, не изменяющуюся на воздухе. Красивый красный цвет, прозрачность и
кристаллическая форма сибирского красного минерала заставила минералогов
заинтересоваться его природой и местом, где он был найден; большой удельный вес
и сопутствующая ему свинцовая руда, естественно, заставляли предполагать о
наличии свинца в этом минерале. "
В 1797 году Воклен повторил анализ. Растертый в порошок
крокоит он поместил в раствор углекислого калия и прокипятил. В результате
опыта ученый получил углекислый свинец и желтый раствор, в котором содержалась
калиевая соль неизвестной тогда кислоты. При добавлении к раствору ртутной соли
образовывался красный осадок, после реакции со свинцовой солью появлялся желтый
осадок, а введение хлористого олова окрашивало раствор в зеленый цвет. После
осаждения соляной кислотой свинца Воклен выпарил фильтрат, а выделившиеся
красные кристаллы (это был оксид шестивалентного хрома) смешал с углем,
поместил в графитовый тигель и нагрел до высокой температуры. Когда опыт был
закончен, ученый обнаружил в тигле множество серых сросшихся металлических
иголок, весивших в 3 раза меньше, чем исходное вещество. Так впервые был
выделен новый элемент. Один из друзей Воклена предложил ему назвать элемент хромом
(по-гречески "хрома" - окраска) из-за яркого разнообразного цвета его
соединений. Сначала Воклену не понравилось предложенное название, поскольку
открытый им металл имел скромную серую окраску и как будто не оправдывал своего
имени. Но друзья все же сумели уговорить Воклена и, после того как французская
Академия наук по всей форме зарегистрировала его открытие, химики всего мира
внесли слово "хром" в списки известных науке элементов.
В 1854 году удалось получить чистый металлический хром
электролизом водных растворов хлорида хрома. В металлургии, где расход хрома
для легирования сталей очень велик, используют не сам хром, а его сплав с
железом - феррохром. Впервые феррохром был получен в 1820 году восстановлением
смеси оксидов железа и хрома древесным углем в тигле. В 1865 году был выдан
первый патент на хромистую сталь.
1.2
Распространение в природе
Среднее содержание хрома в земной коре 83
г/т, по массе содержание хрома в земной коре составляет 0,035%, в воде морей и
океанов 2´10-5 мг/л. Хром обнаружен на Солнце, звездах и в
метеоритах.
Мировые подтвержденные запасы хромовых руд составляют 1,8
млрд. т. Более 60% сосредоточено в ЮАР. Крупными запасами обладают Зимбабве,
Казахстан Турция, Индия, Бразилия. Руды хрома имеются в Новой Каледонии, на
Кубе, в Греции, Югославии. В то же время такие промышленные страны, как Англия,
Франция, ФРГ, Италия, Швеция, совершенно лишены хромового сырья, а США и Канада
располагают лишь очень бедными рудами. Запасы хромовых руд России сосредоточены
главным образом в группе Сарановских месторождений (Верблюжьегорское,
Алапаевское, Халиловское и др.) на Урале (Пермская область) и составляют 6,4
млн. т. (0,36% от мировых запасов).
Добыча хромовых руд в мире составляет около 12 млн. т. в год,
в том числе 108 тыс. т. в России. Главные производители товарной хромовой руды
- ЮАР, Казахстан, на долю которых приходится более 60% добычи сырья ежегодно.
В Красноярском крае месторождения хрома отсутствуют. Но на
правом берегу р. Енисей, в устье р. Березовой (к югу от устья р. Подкаменная
Тунгуска) есть рудопроявление с выходом пород 1,5´4 м, возраст пород
оценивается в 500 млн. лет. Содержание чистого хрома в руде порядка 42%.
По содержанию Cr2O3 хромовые руды подразделяются на очень богатые
(более 65%), богатые (65-52%), средние (52-45%), бедные (45-30%), убогие
(30-10%). Руды, содержащие более 45% Cr2O3 не требуют обогащения.
Хром встречается в виде соединений
в различных минералах. Наиболее распространен минерал хромит, или хромистый
железняк FeCr204, богатые месторождения которого имеются на Урале и в
Казахстане.
В 1936 году в Казахстане, в районе Актюбинска, были найдены
огромные залежи хромита - основного промышленного сырья для производства
феррохрома. В годы войны на базе этого месторождения был построен Актюбинский
ферросплавный завод, который впоследствии стал крупнейшим предприятием по
выпуску феррохрома и хрома всех марок.
Руды хрома имеются в Турции, Индии, Новой Каледонии, на Кубе,
в Греции, Югославии, некоторых странах Африки. В то же время такие промышленные
страны, как Англия, Франция, ФРГ, Италия, Швеция, Норвегия, совершенно лишены
хромового сырья, а США и Канада располагают лишь очень бедными рудами,
практически не пригодными для производства феррохрома.
1.3 Свойства
хрома
1.3.1 Общие
сведения
Хром Cr - химический элемент VI группы периодической
системы Менделеева, атомный номер 24, атомная масса 51,996, радиус атома
0,0125, радиусы ионов Cr2+ - 0,0084; Cr3+ - 0,0064; Cr4+ - 6,0056.
Имеет четыре стабильных изотопа с атомными массами 50, 52,
53, 54, распространенность которых в природе составляет 4,35%, 83,79%, 9,50%,
2,36%.
Обычно хром проявляет степени окисления +2, +3, +6
(валентности II, III, VI соответственно).

Распределение электронов по энергетическим уровням

Структура атома хрома
1.3.2
Получение хрома
Металлический хром получают
восстановлением оксида хрома (III) при нагревании с алюминием:
Сr2О3 + 2Аl = Аl2О3
+2Сr
Металлический хром получают также
электролизом водных растворов соединений хрома.
1.3.3
Физические свойства
Хром - твердый, довольно тяжелый,
пластичный, ковкий металл серо-стального цвета, плавится при 1878±220С, кипит
при 24690С. Из металлов он самый твердый, его плотность 7,19 г/см3,
т. пл. 1855°С. Природный хром состоит из смеси пяти изотопов с массовыми
числами 50, 52, 53, 54 и 56. Радиоактивные изотопы получены искусственно.
Ничтожные примеси кислорода, азота, углерода резко изменяют
физические свойства хрома, в частности он становится хрупким. Получить хром без
этих примесей очень трудно. Устойчив к коррозии на воздухе и в воде.
Структура кристаллической решетки объемно-центрированная
кубическая.
1.3.4
Физические свойства хрома
|
Параметр
|
Значение
|
|
Плотность при
200C
|
7,19 г/см3
|
|
Температура
плавления
|
1878±220С
|
|
Температура кипения
|
2469-2480 0C
|
|
Теплота
парообразования
|
344,4 кДж/Моль
|
|
Теплопроводность
|
93,7 Вт/ (м´К)
|
|
Температурный
коэффициент линейного расширения
|
6,2´10-6
|
|
Удельное
электрическое сопротивление
|
12,7´10-8Ом´м
|
|
Твердость по
Бринеллю
|
687 МПа
|
|
Удельная магнитная
восприимчивость
|
+4,45´10-8м/кг3
|
Хром обладает всеми характерными свойствами металлов - хорошо
проводит тепло, почти не оказывает сопротивления электрическому току, имеет
присущий большинству металлов блеск. Любопытна одна особенность хрома: при температуре
около 37°С он ведет себя явно "вызывающе" - многие его физические
свойства резко, скачкообразно меняются. В этой температурной точке внутреннее
трение хрома достигает максимума, а модуль упругости падает до минимальных
значений. Так же внезапно изменяются электропроводность, коэффициент линейного
расширения, термоэлектродвижущая сила.
1.3.5
Химические свойства
При небольших температурах хром химически мало активен
(взаимодействует только с фтором). Выше 6000C взаимодействует с
галогенами, серой, азотом, кремнием, бором, углеродом, кислородом.
Взаимодействие с кислородом протекает сначала довольно активно, затем, однако,
резко замедляется, так как поверхность покрывается тонкой чрезвычайно
устойчивой пленкой, препятствующему дальнейшему окислению. Это явление
называется пассивированием. При 12000C пленка начинает
разрушаться, окисление снова идет быстро. При 20000C хром воспламеняется в
кислороде с образованием темно-зеленого оксида Cr2O3.
Хром пассивируется холодными концентрированными H2SO4 и HNO3, однако при сильном
нагревании он растворяется в этих кислотах
2Cr + 6H2SO4 (конц.) = Cr2
(SO4) 3 + 3SO2 + 6H2O+ 6HNO3 (конц.) = Cr (NO3)
3 + 3NO2 + 3H2O
Хром растворяется в разбавленных сильных кислотах (HCl и H2SO4). В этих случаях в
отсутствии воздуха образуются соли Cr2+, а на воздухе - соли Cr3+:
Cr + 2HCl = CrCl2+ H2
Cr + 12HCl +3O2 = 4CrCl3 + 6H2O
Нерастворим в H3PO4, HClO4 благодаря образованию защитной пленки.
На воздухе хром совершенно не изменяется. Поэтому хромом с
помощью электролиза его соединений покрывают - хромируют - стальные изделия для
предохранения их от ржавления и механического износа. Эти же качества хром
придает своим сплавам с железом - хромистым сталям. К ним относится нержавеющая
сталь, содержащая около 12% хрома.
1.3.6 Применение
Основная часть добываемой в мире хромистой руды поступает
сегодня на ферросплавные заводы, где выплавляются различные сорта феррохрома и
металлического хрома.
Хромиты широко используют в огнеупорной промышленности
для изготовления огнеупорного хромитового и хромомагнезитового кирпича. Такой
кирпич химически пассивен, устойчив при температурах выше 22000С,
хорошо выдерживает резкие колебания температур. Магнезитохромитовый кирпич -
отличный огнеупорный материал для футеровки (защитной внутренней облицовки)
мартеновских печей и других металлургических агрегатов. Своды из
хромомагнезитового кирпича выдерживают вдвое больше плавок, чем своды из
упорного кварцевого материала.
Химики используют хромиты для получения бихроматов
калия и натрия, а также хромовых квасцов, которые применяются для дубления
кожи, придающего ей красивый блеск и прочность. Такую кожу называют
"хромом", а сапоги из нее "хромовыми". Растворимые в воде
хроматы натрия и калия применяются в текстильном и кожевенном производстве, как
консерванты древесины (они уничтожают древесные грибки).
Хромовая смесь - сернокислый раствор бихромата калия или
натрия используется для мытья химической посуды в лабораториях. Наиболее часто
применяется раствор содержащей по массе приблизительно 12 частей K2Cr2O7, 70 частей воды и 22
части H2SO4.
Как бы оправдывая свое название, хром принимает деятельное
участие в производстве красителей для стекольной, керамической, текстильной
промышленности. Нерастворимые хроматы некоторых металлов (PbCrO4, ZnCrO4, SrCrO4) - прекрасные
художественные краски. Богатством оттенков - от розово-красного до фиолетового
славится SnCrO4, используемый в живописи по фарфору.
В мире драгоценных камней рубину принадлежит второе место
после алмаза. Технология получения искусственного рубина заключается в
следующем: в оксид алюминия Al2O3 вводят дозированную добавку оксида хрома (III), - ему-то и обязаны
рубиновые кристаллы своим чарующим цветом. Но искусственные рубины ценятся не
только за свои "внешние данные": рожденный с их помощью лазерный луч
способен буквально творить чудеса.
Оксид хрома (III) позволил тракторостроителям значительно
сократить сроки обкатки двигателей. Обычно эта операция, во время которой все
трущиеся детали должны "привыкнуть" друг к другу, продолжалась
довольно долго и это, конечно, не очень устраивало работников тракторных
заводов. Выход из положения был найден, когда удалось разработать новую
топливную присадку, в состав которой вошел оксид хрома (III). Секрет действия
присадки прост: при сгорании топлива образуются мельчайшие абразивные частицы
оксида хрома (III), которые, оседая на внутренних стенках цилиндров и других
подвергающихся трению поверхностях, быстро ликвидируют шероховатости, полируют
и плотно подгоняют детали. Эта присадка в сочетании с новым сортом масла
позволила в 30 раз сократить продолжительность обкатки.
Замена в рабочем слое магнитофонной пленки оксида железа на
частицы оксида хрома (III) позволила резко улучшить качество звучания,
пленка стала надежнее в работе.
Фотоматериалы и лекарства, катализаторы для химических
процессов и металлические покрытия - всюду хром оказывается "при
деле". О хромовых покрытиях следует рассказать подробнее.
1.3.7
Экологические проблемы
(Влияние геологоразведочных работ, добычи и
переработки сырья на окружающую среду)
Хром относится к высоко токсичным веществам. Действие на
живой организм солей хрома сопровождается раздражением кожи или слизистой
оболочки, иногда с образованием язв. Поражают они главным образом верхние
дыхательные пути, легкие и глаза. Оксиды хрома менее токсичны, чем чистый
металл.
Предельно допустимые концентрации оксидов хрома
|
Оксид
|
CrO3
|
|
Разовая в
воздухе населенных мест, мг/м3
|
0,01
|
|
Суточная в
воздухе населенных мест мг/м3
|
0,0015
|
|
В воде для
хозяйственно-питьевого и культурно-бытового водоснабжения, мг/л
|
0,1
|
|
В воде для
рыбохозяйственных целей, мг/л
|
0,1
|
При проведении геологоразведочных работ на хромовые руды не
требуются специальные меры по защите окружающей среды. При добыче хромовых руд
для исключения попадания рудной пыли в воздух населенных пунктов следует
выполнять ряд условий: соблюдение определенного расстояния от населенных
пунктов, орошение дорог в карьерах и в складах добытой руды.
Наиболее значительное нарушение окружающей среды связано с
переработкой хромового сырья, при котором в воздух попадает значительное
количество пыли при сухом долблении и сортировке. При мокром обогащении сточные
воды нуждаются в отчистке от хрома, его оксидов, что исключает сброс сточных
вод в водоемы и требует строительства экранированных шламохранилищ.
бихромат аммоний калий ангидрид
II.
Характеристика бихромата аммония
2.1 Бихромат
аммония
(NH4) 2Cr2O7
Дихромат аммония не образует кристаллогидратов, но
разлагается при нагревании. Это оранжевые кристаллы с плотностью 2,15 г/см3
и растворимостью 35,6 г/100 г воды (при 20°С).
H8Cr2N2O7
|
|
Молекулярная
масса (в а. е. м.):
|
252,06
|
|
Плотность:
|
2,15 (25°C,
г/см3)
|
|
Стандартная
энтальпия образования ΔH (298
К, кДж/моль):
|
1799 (т)
|
Растворимость (в г/100 г или характеристика):
ацетон: не растворим
вода: 18,3 (0°C)
вода: 35,6 (20°C)
вода: 46,5 (30°C)
вода: 58,5 (40°C)
вода: 86,6 (60°C)
вода: 115 (80°C)
вода: 155,6 (100°C)
этанол: растворим
Oсобые свойства у дихромата аммония: он легко разлагается. При
слабом нагревании дихромат аммония (NH4) 2Cr2O7 самовоспламеняется с выбрасыванием искр (этот опыт называют
химическим вулканом) - раскаленных частичек оксида хрома (III) Cr2O3, газообразного азота N2 и паров воды.
Дихромат-анион Cr2O72-построен из двух
хромкислородных тетраэдров с общей вершиной по атому кислорода. Дихроматы
щелочных, щелочноземельных и большинства тяжелых металлов легко растворяются в
воде. Трудно растворимы дихроматы Ag, Т1. Растворы дихроматов имеют кислую
реакцию. Дихроматы менее термически устойчивы по сравнению с хроматами (VI).
Аммоний NH4+ - неорганический катион,
в соединениях играет роль одновалентного металла. При растворении аммиака в
растворах кислот происходит реакция:
3 + H+ = NH4+
2.1.2
Применение
Удобный исходный реагент для получения высокочистого оксида
хрома (III) (стойкий зеленый пигмент и составная часть некоторых катализаторов
и известной смеси для полировки оптики - пасты ГОИ). Кроме того, дихромат
аммония применяется как компонент светочувствительного слоя фотоматериалов и
ряда пиротехнических составов, консервант древесины, окислитель в органическом
синтезе и отбеливатель для жиров, воска и парафина.
Применяются в металлообрабатывающей, кожевенной, текстильной,
химической, лакокрасочной, фармацевтической, керамической, спичечной
промышленности; в фотографии; для протравливания семян и др.
2.1.3
Токсичность
Канцерогенен при вдыхании - Может вызвать наследственное
генетическое повреждение - В сухом виде взрывоопасен - В контакте с горючими
веществами способен к воспламенению - Вреден при попадании на кожный покров -
Вреден при проглатывании (последствия могут быть необратимыми) - Вреден при
вдыхании (последствия необратимы) - Вызывает раздражение дыхательной системы -
Раздражает кожный покров (гипераллерген) - Риск повреждения глаз - Может вызывать
аллергическую реакцию при попадании на кожу
2.2
Характеристика исходных веществ
Процесс получение хромового ангидрида и бихромата аммония
происходит по двум главным уравнениям. Азотная кислота участвует в качестве
очистителя.
K2Cr2O7 + 2H2SO4 = 2CrO3 + 2KHSO4 + H2O
2CrO3 + 2NH3·H2O
= (NH4) 2Cr2O7 + H2O
2.2.1 Хромный
ангедрид
Оксид хрома (VI) СrО3 (трёхокись хрома,
хромовый ангидрид), CrO3 - Хромовый ангидрид ядовит и является очень
сильным окислителем. Представляет собой слабо парамагнитные расплывающиеся на воздухе
красные (с фиолетовым оттенком) бипирамидальные орторомбические призмы с
плотностью 2,80 г/см3 и температурой плавления 1970 (с
легким разложением);
При нагревании выше температуры плавления превращается в
красные пары, хорошо растворим в воде, разлагается при 5500 с
выделением водорода, очень сильный окислитель. При растворении CrO3 в воде образуются сильно
кислые токсичные растворы желтого, оранжевого или красного цвета. Очень
разбавленные водные растворы CrO3 желтого цвета; они содержат двухосновную
хромовую кислоту H2CrO4, устойчивую в нейтральной среде и являющуюся окислителем по
отношению к SO2, H2S, SnCl2, FeSO4 и др. Чем концентрированнее водный раствор хромового ангидрида,
тем более конденсированные кислоты. Окись хрома (VI) энергично окисляет
органические соединения; со спиртами она образует эфиры хромовой кислоты,
способные взрываться.
CrO3 обладает цепочечной
структурой из тетраэдров [CrO4], соединенных ребрами (подобно цепочечным
силикатам). Низкая температура плавления (1870 С) свидетельствует о
заметном ван-дер-ваальсовом вкладе между цепочками.
2.2.2
Свойства
|
Цвет
|
Сингония
|
Пространств.
группа
|
Плотн., г/см3
|
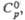 Дж/ (моль x К) Дж/ (моль x К)
|
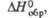 кДж/моль кДж/моль
|
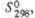 Дж/ (моль x К) Дж/ (моль x К)
|
|
Красный
|
Ромбич.
|
C2cm
|
2,82
|
58
|
-590
|
73,2
|
При давлении 11,5 ГПа и температуре 23°С переходит в другую
модификацию; температура плавления 180-202°С (в зависимости от степени
разложения); заметно испаряется с диссоциацией в парах. Полупроводник.
Малоустойчив, начинает разлагаться уже при комнатной температуре.
При медленном нагревании при 210-270°С образуется
Сr3О8,при 270-300°С - Сr5О12,при
360-540°С - СrО2.
Гигроскопичен, расплывается на воздухе. Хорошо растворим в
воде с образованием хромовых кислот, существующих только в водных растворах;
растворимость 62,49% по массе при 20°С, 65,79% при 80°С. Ниже 102°С
кристаллизуется гидрат СrО3 x 3,5Н2О.
Химические свойства. CrO3 -
кислотный оксид. При его растворении в воде образуется хромовая кислота (при
недостатке CrO3):
3 (недост.) + H2O → H2CrO4,
или дихромовая кислота (при избытке CrO3): 2CrO3
+ H2O → H2Cr2O7.
При взаимодействии CrO3 со щелочами образуются
хроматы:
3 + 2KOH → K2CrO4 + H2O.
При нагревании выше 250°C разлагается с образованием оксида
хрома (III) и кислорода:
CrO3 → 2Cr2O3 + 3O2↑.
Как и все соединения Cr (VI), CrO3 является
сильным окислителем (восстанавливается до Cr2O3).
Например этанол, ацетон и многие другие органические вещества
самовоспламеняются или даже взрываются при контакте с ним (хотя некоторые
справочники указывают "растворим в спирте и эфире"). Окисляет йод,
серу, фосфор, уголь, например:
CrO3 + 3S → 2Cr2O3 +
3SO2↑.
При действии на растворы СrО3 серы, В, С и
некоторых металлов (Mg, Zn, Сu, Сr, Мо и др.) при нагревании происходит
полимеризация с получением хромовых полимеров - от вязкотекучих до
смолоподобных и стекловидных. Полимеры рентгеноаморфны, мол. м.103 -
104. Ионы металлов входят в состав полимера, тогда как неметаллы
большей частью оказывают только каталитическое действие. Смолы обратимо
растворяются в воде. Полимеры, помимо Cr (VI), содержат также Сr (III), Cr (IV) и Cr (V).
2.2.3
Применение
Используется для получения хрома электролизом,
электролитического хромирования, в качестве сильного окислителя, изредка в
пиросоставах.
Применяют также, как окислитель в органической химии (в
производстве изатина, индиго и т.д.).
В смеси с кизельгуром применяется для очистки ацетилена под названием
"эпурит".
Растворы хромового ангидрида (или, чаще, дихромата калия) в
серной кислоте широко используются в лабораторной практике для очистки посуды
от органических загрязнений (хромовая смесь).
2.2.4
Токсичность
Оксид хрома (VI) очень ядовит, как и многие другие соединения
шестивалентного хрома.
Триоксид Сr и хромовые кислоты вызывают тяжелые ожоги кожи,
дерматит, язвы. Могут вызывать желтуху, бронхиальную астму, язву желудка,
поражения почек.
Предельная допустимая концентрация оксидов хрома в атмосфере
воздуха 0,01 мг/м3. Известны соединения с содержанием кислорода
больше, чем в СrO3: пероксиды, представителями которых являются
синие перхромат Cr2 (CF2O10) 3 и
гидропероксид СrО (О2) 2 x Н2О.
2.2.5 Техника
безопасности
Хромовый ангидрид - весьма химически активное вещество,
способен вызвать при соприкосновении с органическими веществами возгорания и
взрывы. При попадании на кожу он вызывает сильнейшие раздражения, экземы и
дерматиты, а также может спровоцировать развитие рака кожи. Весьма опасно вдыхание
паров хромового ангидрида.
Для хранения его применяется стеклянная или пластиковая
герметичная посуда, и исключение контакта с органическими веществами. Работа с
ним требует применения спецодежды и средств индивидуальной защиты.
2.2.2
Дихромат калия
Дихромат калия K2Cr2O7 - оранжево-красные
кристаллы, кристаллогидратов не образует, растворимость при 20° С равна 12,48 г
соли на 100 г воды. Техническое название дихромата калия K2Cr2O7
- хромпик.
.2.2.1
Свойства
|
Цвет
|
Плотность г/см3
|
Температура
плавления
|
DH0обр
кДж/моль
|
DH0пл
кДж/моль
|
S0298
Дж/ (моль. К)
|
|
оранжевый
|
2,69
|
396°С
|
219,7
|
-2061,9
|
36,8
|
291
|
Физические свойства.
Растворимость в воде (г в 100 г): 4,6 (0°С), 15,1 (25°С),
37,7 (50°С).
В этаноле растворяется незначительно. Образует эвтектику Н2О
- К2Сr2О7 (4,30% по массе) с температурой
Химические свойства.
Дихромат калия - сильный окислитель. В кислой среде
восстанавливается до [Сr (Н2О) 6) 3+;
Выше 500°С разлагается на К2СrO4, Сr2О3
и О2.
Водный раствор имеет кислую реакцию: Сr2O72
- + 3Н2O = 2CrO42 - + 2Н3О+.
При действии 6 М галогеноводородных кислот на калия дихромат
образуются триоксогалогенохроматы К [СrХО3] (где X = Сl, Вr, I),
которые при нагревании или увеличении концентрации НХ выделяют галогены; К
[СrСlО3] дает СrO2Сl2.
Калия дихромат взаимодействует с концентрированными НСlO4,
H2SO4 и HNO3, давая полихроматы (К2Сr3О10,
К2Сr4O13 и др.). При нагревании смеси К2Сr2О7
и КСl с концентрированной H2SO4 образуется СrO2Сl2.
Из растворов, содержащих калия дихромат и Н2О2, могут
быть выделены легко взрывающиеся фиолетово-голубые кристаллы К [Сr (ОН) О (О2)
2] *Н2О. В разбавленных подкисленных растворах калия
дихромата, Н2О2 и некоторых органических веществ
образуется синий пероксид [Cr (L) O (O2) 2], где L -
эфир, пиридин и др.
2.2.2.2
Получение дихромата калия
Обменной реакцией в растворе Na2Cr2O7
с КСl, при нагревании до 1000-1300°С смеси (Cr2Fe) O4 и К2СО3
на воздухе с последующим выщелачиванием охлажденного расплава К2Сr2О7
водой; выпариванием водного раствора, содержащего эквимолярные количества К2СО3
(или КОН) и СrO3.
.2.2.3
Применение
Калия дихромат - дубитель в кожевенной промышленности;
протрава в производстве красителей, компонент составов для головок спичек,
пиротехнических составов; компонент сухих электролитов; ингибитор коррозии
металлов и сплавов; протрава для семян. Применяется при производстве
красителей.
Калия дихромат высокотоксичный; брызги его раствора разрушают
кожные покровы, дыхательные пути и хрящевые ткани; Предельная допустимая
концентрация 0,01 мг/м3 (в пересчете на СrО3).
Хроматометрия (точнее - дихроматометрия) - объемный
(титриметрический) метод химического анализа, основанный на применении раствора
K2Cr2O7 определенной концентрации и
позволяющий определить содержание восстановителей и некоторых катионов
металлов.
Смесь равных объемов насыщенного на холоде раствора K2Cr2O7
и концентрированной серной кислоты (хромовая смесь) обладает очень сильным
окислительным действием и применяется в лабораториях для мытья химической
посуды.
2.2.3 Серная
кислота
Серная кислота́ H2SO4
- сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6).
При обычных условиях концентрированная серная кислота - тяжёлая маслянистая
жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой,
так и с серным ангидридом SO3. Если молярное отношение SO3:
H2O < 1, то это водный раствор серной кислоты, если > 1, -
раствор SO3 в серной кислоте (олеум).
|
Брутто-формула
(система Хилла):
|
H2O4S
|
|
Формула в виде
текста
|
H2SO4
|
|
Молекулярная
масса (в а. е. м.):
|
98,07
|
|
Температура
плавления (в°C):
|
10,31
|
|
Температура
кипения (в°C):
|
279,6
|
|
Стандартная
энтальпия образования ΔH (298
К, кДж/моль):
|
-814,2 (ж)
|
|
Стандартная
энергия Гиббса образования ΔG (298 К, кДж/моль):
|
-690,3 (ж)
|
|
Стандартная
энтропия образования S (298 К, Дж/моль·K):
|
156,9 (ж)
|
2.2.3.1
Свойства
Температура кипения водных растворов серной кислоты
повышается с ростом ее концентрации и достигает максимума при содержании 98,3 %
H2SO4.
Растворимость (в г/100 г или характеристика):
вода: смешивается этанол: реагирует 1,005 (0.986%, 20°C,
растворитель - вода) 1,025 (4%, 20°C, растворитель - вода) 1,045 (6.956%, 20°C,
растворитель - вода) 1,065 (9.843%, 20°C, растворитель - вода) 1,08 (11.96%,
20°C, растворитель - вода) 1,11 (16.08%, 20°C, растворитель - вода) 1,135
(19.42%, 20°C, растворитель - вода) 1,215 (29.57%, 20°C, растворитель - вода)
1,26 (35.01%, 20°C, растворитель - вода) 1,27 (36.19%, 20°C, растворитель -
вода) 1,31 (40.82%, 20°C, растворитель - вода) 1,335 (49.62%, 20°C, растворитель
- вода) 1,395 (49.99%, 20°C, растворитель - вода) 1,5 (60.17%, 20°C,
растворитель - вода) 1,61 (69.96%, 20°C, растворитель - вода) 1,725 (79.81%,
20°C, растворитель - вода) 1,815 (90.12%, 20°C, растворитель - вода) 1,835
(95.72%, 20°C, растворитель - вода)
Химические свойства
Серная кислота - довольно сильный окислитель, особенно
при нагревании и в концентрированном виде; окисляет HI и частично HBr до
свободных галогенов, углерод до CO2, S - до SO2, окисляет
многие металлы (Cu, Hg и др.). При этом серная кислота восстанавливается до
SO3, а наиболее сильными восстановителями - до S и H2S. Концентрированная H2SO3
частично восстанавливается H2. Из-за чего не может применяться для его сушки.
Разбавленная H2SO2 взаимодействует со всеми металлами, находящимися в
электрохимическом ряду напряжений левее водорода с его выделением.
Окислительные свойства для разбавленной H₂SO₄ нехарактерны. Серная кислота образует два ряда солей: средние -
сульфаты и кислые - гидросульфаты, а также эфиры. Известны пероксомоносерная
(или кислота Каро) H2SO5 и пероксодисерная H2S2O8
кислоты.
2.2.3.2
Применение
Серную кислоту применяют:
· в производстве минеральных удобрений;
· как электролит в свинцовых аккумуляторах;
· для получения различных минеральных кислот
и солей;
· в производстве химических волокон,
красителей, дымообразующих веществ и взрывчатых веществ;
· в нефтяной, металлообрабатывающей,
текстильной, кожевенной и др. отраслях промышленности;
· в пищевой промышленности -
зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
· в промышленном органическом синтезе в
реакциях:
· дегидратации (получение диэтилового эфира,
сложных эфиров);
· гидратации (этанол из этилена);
· сульфирования (синтетические моющие
средства и промежуточные продукты в производстве красителей);
· алкилирования (получение изооктана,
полиэтиленгликоля, капролактама) и др.
Самый крупный потребитель серной кислоты - производство
минеральных удобрений. На 1 т PO₅ фосфорных удобрений
расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH) SO - 0,75 т серной кислоты.
Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по
производству минеральных удобрений.
.2.3.3
Токсическое действие
Серная кислота и олеум - очень едкие вещества. Они поражают
кожу, слизистые оболочки, дыхательные пути (вызывают химические ожоги). При
вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко -
ларингит, трахеит, бронхит и т.д. ПДК аэрозоля серной кислоты в воздухе рабочей
зоны 1,0 мг/м³, в атмосферном воздухе 0,3 мг/м³ (максимальная разовая) и 0,1 мг/м³ (среднесуточная).
Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин),
смертельная 0,18 мг/л (60 мин). Класс опасности II. Аэрозоль серной кислоты
может образовываться в атмосфере в результате выбросов химических и
металлургических производств, содержащих оксиды S, и выпадать в виде кислотных
дождей
2.2.4 Аммиак
Аммиак - NH3, при нормальных условиях -
бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти
вдвое легче воздуха, ядовит. Растворимость NH3 в воде чрезвычайно велика -
около 1200 объёмов (при 0°C) или 700 объёмов (при 20°C) в объёме воды. Молекула
аммиака имеет вид тетраэдра с атомом азота в вершине. При неспаренных
h-электронах атомы азота участвуют в образовании полярных ковалентных связей с
1s-электронами трёх атомов водорода.
В жидком аммиаке молекулы связаны между собой водородными
связями. Этим объясняется сравнительно высокая температура кипения и высокая
теплота испарения аммиака. Однако прочность этих связей в жидком аммиаке
существенно ниже, чем у воды, поэтому вязкость, например, жидкого аммиака в 7
раз меньше вязкости воды. Промышленный способ получения аммиака основан на
прямом взаимодействии водорода и азота:
2 (г) + 3H2 (г) ↔ 2NH3 (г) +
45,9 кДж
Для получения аммиака в лаборатории используют действие
сильных щелочей на соли аммония:
NH4Cl + NaOH = NH3↑ +
NaCl + H2O.
.2.4.1
Свойства
Физические свойства
|
Брутто-формула
(система Хилла):
|
H3N
|
NH3
|
|
Молекулярная
масса (в а. е. м.):
|
17,03
|
|
Температура
плавления (в°C):
|
-77,75
|
|
Температура
кипения (в°C):
|
-33,42
|
|
Плотность:
|
0,00077 (20°C,
г/см3)
|
|
Стандартная
энтальпия образования ΔH (298
К, кДж/моль):
|
-46,19 (г)
|
|
Стандартная
энергия Гиббса образования ΔG (298 К, кДж/моль):
|
-16,71 (г)
|
|
Стандартная
энтропия образования S (298 К, Дж/моль·K):
|
192,6 (г)
|
Растворимость (в г/100 г или характеристика): ацетон:
растворим вода: 87,5 (0°C) вода: 67,9 (10°C) вода: 52,6 (20°C) вода: 46,2
(25°C) вода: 40,3 (30°C) вода: 30,7 (40°C) вода: 22,9 (50°C) вода: 15,4 (80°C)
вода: 7,4 (100°C) диэтиловый эфир: растворим хлороформ: растворим этанол:
растворим
Химические свойства
Благодаря наличию неподеленной электронной пары во многих
реакциях аммиак выступает как нуклеофил или комплексообразователь.
Так, он присоединяет протон, образуя ион аммония:
3 + H+ → NH4+
Водный раствор аммиака ("нашатырный спирт") имеет
слабощелочную реакцию из-за протекания процесса:
NH3 + H2O → NH4+
+ OH-; Ko=1,8*10−5
Взаимодействуя с кислотами даёт соответствующие соли аммония:
3 + HNO3 → NH4NO3
Аммиак также является очень слабой кислотой (в 10 000 000 000
раз более слабой, чем вода), способен образовывать с металлами соли - амиды.
Соединения, содержащие ионы NH2-,
называются амидами, NH2 - имидами, а N3 - нитридами.
Амиды щелочных металлов получают, действуя на них аммиаком:
NH3 + 2К = 2KNH2 + Н2
Амиды, имиды и нитриды ряда металлов образуются в результате
некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием
металлов в атмосфере азота.
2.2.4.2
Применение
В основном используется для производства азотных удобрений
(нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной
кислоты, соды (по аммиачному методу) и других продуктов химической
промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного
агента (R717)
2.2.4.3
Токсическое действие
По физиологическому действию на организм относится к группе
веществ удушающего и нейротропного действия, способных при ингаляционном поражении
вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак
обладает как местным, так и резорбтивным действием. Пары аммиака сильно
раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы.
Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное
слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю
зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного
аммиака и его растворов с кожей возникает жжение, возможен химический ожог с
пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает
тепло, и при соприкосновении с кожей возникает обморожение различной степени.
Запах аммиака ощущается при концентрации 37 мг/м³. Предельно допустимая
концентрация в воздухе рабочей зоны производственного помещения составляет 20
мг/м³. Следовательно, если чувствуется запах аммиака, то работать без
средств защиты уже опасно. Раздражение зева проявляется при содержании аммиака
в воздухе 280 мг/м³, глаз - 490 мг/м³. При действии в очень высоких концентрациях аммиак вызывает
поражение кожи: 7-14 г/м³ - эритематозный, 21 г/м³ и более - буллёзный дерматит. Токсический отёк лёгких развивается
при воздействии аммиака в течение часа с концентрацией 1,5 г/м³. Кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более быстро приводит к развитию общетоксических эффектов.
Предельно допустимая концентрация аммиака в атмосферном воздухе населённых
пунктов равна: среднесуточная 0,04 мг/м³; максимальная разовая
0,2 мг/м³
2.5
Гидросульфат калия
Бесцветные ромбоэдрические кристаллы, плотностью 2,24-2,61
г/см3. Температурой плавления 210,6°С. Реактив хорошо растворим в
воде, реакция водного раствора кислая (из растворов выкристаллизовывается K2SO4).
При 160-170°С реактив частично начинает переходить в K2SO4
2.5.1
Свойства
|
Брутто-формула
(система Хилла):
|
HKO4S
|
|
Формула в виде текста:
|
KHSO4
|
|
Молекулярная
масса (в а. е. м.):
|
136,16
|
|
Температура
плавления (в°C):
|
210
|
|
Температура
разложения (в°C):
|
300
|
|
Плотность:
|
2,5 (20°C, г/см3)
|
|
Стандартная
энтальпия образования ΔH (298
К, кДж/моль):
|
-1158,1 (т)
|
|
Стандартная
энергия Гиббса образования ΔG (298 К, кДж/моль):
|
-1043,5 (т)
|
Растворимость (в г/100 г или характеристика):
ацетон: не растворим вода: 37 (0°C) вода: 53 (20°C) вода: 70
(40°C) этанол: не растворим
III.
Практическая часть
Методики синтеза.
Дихромат аммония ( (NH4) 2Cr2O7) получают в
промышленности из природного железохромового оксида (хромита).
В лабораториях его получают взаимодействием хромового оксида
с аммиаком.
3.1 Получение
хромового ангидрида
Извлечением из шлама (промышленность); действием воды на
хлористый хромил CrO2Cl2,CrO2Cl2+H2O→ CrO3+2HCl
· обработкой сильно концентрированных
растворов хромата или бихромата калия избытком конц. серной кислотой,
K2CrO4+2H2SO4=
CrO3+2KHSO4+ H2O
· действием HCl на хромат серебра,
· обработкой хроматов PbCrO4, BaCrO4, SrCrO4 серной кислотой,
PbCrO4+ H2SO4=
CrO3+PbSO4+ H2O
действием H2 [SiF6] на K2CrO4,K2CrO4+
H2 [SiF6] = CrO3+ K2 [SiF6]
+ H2O
· обработкой BaCrO4 избытком HNO3:
BaCrO4+2HNO3 = CrO3+
Ba (NO3) 2 + H2O
Происходит выделение красно-оранжевых
кристаллов CrO3 из раствора. Они придают жидкостям красно-бардовый цвет. Для
очистки CrO3 перекристализовывают из водного раствора и сушат при 700С
на пористой пластинке, или при 1000С в сушильном шкафу.
Также хромовый ангидрид может быть получен
при окислении оксида хрома (Ш) озоном или кислородом при повышенном давлении
(12 атм), температуре 460°С в присутствии катализаторов на основе оксидов
серебра, цинка, кадмия и свинца.
После полученные кристаллы CrO3 растворят в определённом
количестве воды 600-700С, раствор охлаждают и приливают
концентрированный раствор аммиака при температуре не более 100С.
Выпавшие из раствора кристаллы являются бихроматом аммония. Которые осушают
вакуумным насосом, после при 1000С в сушильном шкафу.
Вывод: При рассмотрении различных способов получения
бихромата аммония, исходя из количества имеющихся реактивов, и условий работы в
лаборатории, следовало прийти к выводу: что самый удобный и возможный вариант
получения бихромата аммония по уравнениям:
K2Cr2O7 + 2H2SO4
= 2CrO3 + K2SO4 + H2O
CrO3 + 2NH3*H2O
= (NH4) 2Cr2O7 + H2O
IV
Синтез
4.1 Синтез
4.1.1 Список
посуды и приборов
1. колба (1000 мл)
. колба Бунзена
. стеклянная воронка
. кварцевые чашки 2 шт
. химический стакан (1л.)
. химический стакан (0,5л)
. стеклянные лопатки (для перемешивания)
. бюкс
. банка с притертой пробкой
. вакуумный водоструйный насос
. эксикатор (Ca (OCl) 2)
. сушильный шкаф
. плитка
. песочная баня
. водная баня
4.1.2 Список
реактивов
1. Дихромат калия (К2Сг2O7)
- 300 г
2. Серная кислота (конц. H2SO4 пл.1,84) -
570 мл
. Вода дистиллированная
. Азотная кислота ( (ч. д. а., пл.1,40) HNO3)
200-300 мл
. Раствор аммиака (NH3·H2O пл.0,91)
. (Лёд)
4.1.3 Синтез
веществ
Наливаем в колбу емкостью 1л 500 мл воды. Нагреваем колбу с
водой до 75° - 80°С и растворяем в ней 300 г дихромата калия (К2Сг2O7)
при постоянном перемешивании.
Когда вещество растворилось, очень осторожно при перемешивании
добавляем 420 мл серной кислоты (H2SO4 (пл.1,84)). Смесь сильно
разогревается, и после охлаждения выпадают кристаллы CrO3 красно-оранжевого
цвета. Через 6-8 ч раствор сливаем с кристаллов. Для выпадения из маточного
раствора остатков хромного ангидрида, его нагреваем его на водяной бане до
80-90°С и при перемешивании добавляем еще 150 мл H2SO4 (пл.1,84).
Все выпавшие мелкие кристаллы CrO3 растворяем в
минимальном количестве воды. Раствор упариваем до образования толстой пленки
кристаллов и затем медленно охлаждаем. Образовавшиеся крупные кристаллы CrO3
отсасываем на фарфоровой воронке без бумажного фильтра, иначе бумага может
воспламениться.
Для удаления примесей H2SO4 и KHSO4
кристаллы CrO3, не промывая, переносим в банку притертой пробкой и
заливаем их азотной кислотой HNO3 (ч. д. а., пл.1,40) так, чтобы
жидкость полностью покрывала кристаллы, приблизительно 200-300 мл. Время от
времени смесь взбалтываем. Через 10-12 ч кислоту сливаем. (Промывку желательно
было проводить 3 раза, но ограничиваясь во времени, мы провели одну промывку).
Затем кристаллы отсасываем на воронке Бюхнера (без бумажного
фильтра), и сушим (под тягой) в кварцевой чашке на песочной бане при 60-100°С,
часто перемешивая, особенно в конце сушки.
Когда выделение белых паров HNO3 прекратилось,
масса стала темно-красного цвета, сыпучей и сухой, сушку продолжаем в сушильном
шкафу при 100°С, после чего охлаждаем в эксикаторе над Ca (OCl) 2.
Выход составил приблизительно 112 г (54-58%).
Через 12 часов вынимаем кристаллы оксида хрома.
Растворяем 112 г CrO3 в 144 мл воды при 45-50°С. В
стакан, охлаждаемый льдом, помещаем прозрачный раствор, охлаждаем до 8-10°С и
затем добавляем небольшими порциями при непрерывном помешивании раствор аммиака
NH3·H2O (около 60 мл, пл.0,91) до того как индикаторная бумажка не станет
нейтральной, следя за тем, чтобы температура не поднималась выше 15°С. Раствор
охлаждаем до 10°С.
Выпавшие кристаллы отсасываем на воронке Бюхнера, промываем
10-15 мл ледяной воды и сушим при 50°С.
Получили 30 г препарата.
4.2 Идентификация
4.2.1
Химический анализ
Химический анализ
Для идентификации полученного нами вещества мы провели ряд
анализов. А теперь подробнее остановимся на химическом анализе. Для определения
полученного нами вещества нам потребовались следующие реактивы:
. нитрат серебра,
2. гидроксид меди (2)
Нитрат серебра (азотнокислое серебро, АgNO3), бесцветное
твердое соединение. Является самой важной солью серебра, т.к. хорошо растворим
в воде. Широко используется в химическом анализе и т. д
При взаимодействии с дихроматом аммония образует дихромат
серебра.
(NH4) 2Cr2O7 + 2AgNO3 = Ag2Cr2O7 + 2NH4 NO3
Дихромат серебра (Ag2Cr2O7), кристаллический рубиново -
красный порошок, малорастворимый в воде; используется при исполнении
художественных миниатюр.
Гидроксид меди (II) Cu (OH) 2 - вещество голубого цвета. В
растворе аммиака образует устойчивые аммиакаты темно-синего цвета.
Cu (OH) 2 + 4NH4OH
=> [Cu (NH3) 4] (OH) 2 + 4H2O
Для проведения химического анализа возьмем небольшую пробу
исследуемого вещества и растворим ее в воде. Далее полученный раствор разделим
на две части. И теперь непосредственно проведем качественные реакции на
обнаружение в исследуемом растворе ионов аммония и дихромата. Прильем в первую
часть исследуемого раствора небольшое количество нитрата серебра. Ожидаем
выпадение красного осадка.Т. е дихромата серебра. В оставшуюся часть раствора
приливаем гидроксид меди (2). Ожидаем образование устойчивого комплекса
темно-синего цвета, гидроксидтетраамин меди II. Что мы и наблюдали:
Таким образом, проведенный нами химический анализ полностью
идентифицирует состав исследуемого вещества.
4.2.2
Физико-химический анализ
Ренгенфазовый анализ
Полученный образец был исследован методом рентгенофазового
анализа
Проведенный рентгенофазовый анализ показал, был получен
однофазный (NH4) 2Cr2O7, содержащий незначительно
малое количество примесей
Пики соответствующие этому веществу изображены на диаграмме в
приложении.
Литература
1. Ю.В.
Карякин, И.И. Ангелов. Чистые химические вещества. - М.: Высшая школа, 1974. -
с 37, 64
2. Ю.Д.
Третьяков. Неорганическая химия.3 том, книга 1. - М.: Высшая школа, 2007. - с
182, 184, 185.
. #"823139.files/image006.gif">
Ренгенфазовый анализ