Растворимость малорастворимых соединений
Оглавление
Задание на
курсовую работу
1. Общие
сведения
2.
Растворимость осадка малорастворимого соединения в чистой воде
3.
Растворимость осадка малорастворимого соединения в водном растворе, содержащем
в избытке одноименный ион
4.
Растворимость осадка малорастворимого соединения в водном растворе, содержащем
в избытке ионы, не входящие в осадок
5. Влияние
конкурирующих равновесий на растворимость осадков
5.1
Растворимость осадка малорастворимого соединения с учетом протолитических
реакций их ионов
5.2 Растворимость
осадка малорастворимого соединения при наличии в растворе комплексующих агентов
5.3 Расчет
растворимости осадков с учетом одновременного влияния различных факторов
5.4 Расчет
минимальной растворимости осадков
5.4.1
Растворимость осадка, образованного анионом слабой кислоты и катионом слабого
основания
5.4.2 Влияние
комплексообразования на растворимость солей
Практическая
часть
Выводы
Список
литературы
Задание на курсовую работу
. Изложить краткие теоретические сведения по вопросу о равновесии в
насыщенных растворах малорастворимых соединений.
. Проанализировать влияние различных факторов на растворимость
малорастворимых соединений.
.1. Найти растворимость вещества А (см. таблицу заданий по вариантам) в
чистой воде.
.2. Рассмотреть, как меняется растворимость вещества А в водных растворах
вещества В, при изменении концентрации В от 0,1 до 1000 моль/м3 при 298 К. Изобразить
графически зависимость растворимости от ионной силы раствора.
.3. Построить графически зависимость среднеионного коэффициента
активности в растворе В от величины концентрации вещества в указанном (2.2. В
диапазоне концентраций по справочным данным. Сопоставить эти значения с
рассчитанными по теории Дебая-Хюккеля для трех концентраций: 0,0005 моль/л;
0,01 моль/л; 0,12 моль/л.
.4. Рассмотреть влияние гидролиза аниона (катиона) малорастворимой соли С
в водном растворе при изменении рН в диапазоне от 1 до 12.
.5. Найти такую концентрацию вещества Е, когда растворимость
малорастворимой соли D в
водных растворах, содержащих соединение Е (от 10-4 до 1,0 моль/л), будет минимальна.
. На примере моделирования возможной экологической проблемы, связанной с
очисткой сточных вод от ионов тяжелых металлов, сделать выводы о том, влияние
каких факторов, способствует наиболее полному переходу этих ионов в осадок.
растворимость соль ионный
1. Общие сведения
В аналитической и экологической практике часто имеют место случаи, когда
в равновесии находятся две фазы - раствор и осадок малорастворимого соединения.
Такой раствор называется насыщенным раствором малорастворимого соединения.
Количественно состояние водного раствора с малорастворимым соединением можно
описать, используя такой термин, как растворимость.
Растворимость - это концентрация насыщенного раствора. Эту величину
обозначают или s или сн.р.
Ее можно выразить в шкале концентраций: моль/л или г/л.
В водном растворе, насыщенном относительно малорастворимого соединения,
устанавливается одно или несколько равновесий. Например, в насыщенном растворе
малорастворимого соединения MAтв
возможны такие
равновесия
MAтв 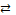
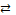 MAр-р (1)
MAр-р (1)
MAр-р ⇄ M+ + A- (2)
Константа первого равновесия (при выражении ее через равновесные
концентрации) имеет вид
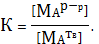
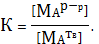 (3)
(3)
Активность чистого твердого вещества постоянная при заданной температуре
и остается такой пока есть твердая фаза. Поскольку концентрация насыщенного
раствора мала, то можно перейти от активностей к концентрациям компонентов.
К1 = K[MAтв] = [MAр-р]. (4)
Константа равновесия второй реакции выразится
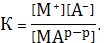
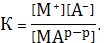 (5)
(5)
Концентрация растворенных молекул малорастворимого вещества очень мала и
поэтому можно предположить, что оно практически нацело диссоциирует на ионы:
(для простоты мы рассматриваем одно-одновалентный тип малорастворимого
соединения). Суммируя оба равновесия, имеем:
MAтв 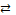
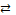 MAр-р = M+ + A-; (6)
MAр-р = M+ + A-; (6)
MAтв ⇄ M+ + A-. (7)
Если перемножить уравнения (4) и (5), то получим произведение двух
констант или произведение растворимости, которое является константой равновесия
суммарной реакции (7).
К1К2=ПРМА=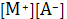
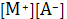 . (8)
. (8)
Следует отметить, что уравнение (8) применимо только насыщенным
растворам, находящимся в равновесии с твердой фазой MAтв.
Уравнением (8) введено такое понятие, которое широко используется при
описании равновесий в водных растворах малорастворимых соединений - как
произведение растворимости. Такое название носит исторический характер. На
современном этапе оно скорее может быть названо - произведение активностей.
Действительно, реакции, описываемой уравнением (7), соответствует закон
химического равновесия, выраженный уравнением:
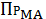
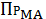 =
=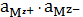
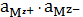 , (9)
, (9)
где
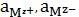
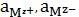 -
активности ионов, равные произведению их концентрации на коэффициент
активности.
-
активности ионов, равные произведению их концентрации на коэффициент
активности.
Активность
иона (например, катиона) может быть найдена как произведение концентрации этого
иона на коэффициент активности +с+г (иногда коэффициент активности
обозначается f+)
а+= c+ г+ . (10)
Поскольку речь идет о равновесии в насыщенном растворе малорастворимого
соединения, то будем обозначать равновесных концентрации ионов в таком виде
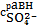
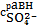 =[
=[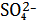
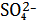 ] . (11)
] . (11)
Несмотря на то, что для экспериментального определения коэффициентов
активности существует много различных прямых и косвенных методов, все они
позволяют определить лишь среднеионный коэффициент активности г± . Уравнение (9) примет вид
ПРМА=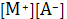
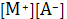 г2±. (12)
г2±. (12)
Теперь запишем уравнение равновесия в водном растворе малорастворимого
соединения в общем виде Mv+Av-
Mv+
Av-тв= Mv+ Av-р-р = v+Mz++v-Az- . (13)
cн.р.
Закон
равновесия: 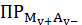
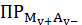 =
=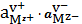
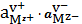 , (14)
, (14)
где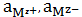
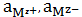 -
равновесные активности ионов в растворе.
-
равновесные активности ионов в растворе.
Словами
этот закон можно сформулировать следующим образом: активности ионов в
насыщенном растворе малорастворимого соединения могут изменяться лишь таким
образом, чтобы их произведение растворимости оставалось постоянным.
ПР
как любая константа равновесия зависит от температуры.
При
экспериментальном определении растворимости, чаще всего проводится химический
анализ для определения концентрации какого-то конкретного иона, а не всей
молекулы. Поэтому, если малорастворимое соединение содержит разное число
анионов и катионов в молекуле (например, - один катион и два аниона), то
обязательно нужно указывать, как определяли растворимость, по какому иону.
Определенную экспериментально по любому иону растворимость соединения нужно
приводить в соответствие с концентрацией насыщенного раствора малорастворимого
соединения cн.р. .
С
учетом (10) уравнение (14) примет вид
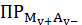
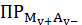 =
=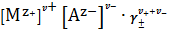
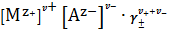 . (15)
. (15)
В выражение (15) входит среднеионный коэффициент активности, который
согласно теории Дебая - Хюккеля зависит от ионной силы раствора, температуры и
других факторов.
По теории Дебая-Хюккеля имеем следующие законы:
Предельный закон Дебая-Хюккеля:
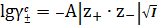
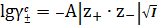 , (16)
, (16)
где
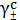
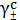 -
среднеионный коэффициент активности электролита, при выражении концентрации в
с- шкале, моль/л ;
-
среднеионный коэффициент активности электролита, при выражении концентрации в
с- шкале, моль/л ; 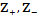
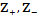 - заряды
ионов.
- заряды
ионов.
A - коэффициент,
который зависит от температуры и диэлектрической проницаемости среды (е) и
согласно теории Дебая-Хюккеля может быть найден:
A = 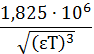
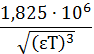 . (17)
. (17)
Причем, если концентрации выражать в моль/л ,то для водных растворов при
298 К А= 0,5093 моль- 0,5 л0,5 .
В уравнение (16) входит также величина, называемая ионной силой раствора
I = 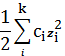
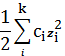 . (18)
. (18)
Уравнение (16) не содержит индивидуальных характеристик иона, оно
справедливо лишь до величины ионной силы 10 -3 моль/л.
Во втором приближении теории авторы учли размеры ионов, и силы
некулоновского происхождения препятствующие сближению одноименно заряженных
частиц. Расширенное уравнение Дебая-Хюккеля имеет вид
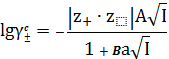
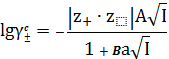 , (19)
, (19)
где величина a - по своему
физическому смыслу соответствует расстоянию, на которое могут сближаться
электрические центры двух ионов, то есть примерно 3·10 -8 см; В - константа,
зависящая от температуры и свойств среды
B = 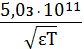
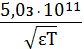 ⋅. (20)
⋅. (20)
Для водных растворов при 298 К В = 1,0393 ·108 моль - 0,5 м 0, 5 .
С учетом значений констант при 298 К для водных растворов имеем:
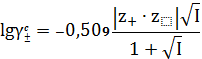
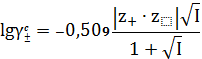 . (21)
. (21)
Это уравнение применяется при значении ионной силы в диапазоне 0,001 <
I < 0,1 моль/л.
При больших значениях ионной силы раствора ( 0,1 < I < 0,5 ) для вычисления
приближенных значений коэффициентов активности ионов при 298 К в водных
растворах используют уравнение, предложенное Дэвисом
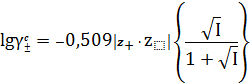
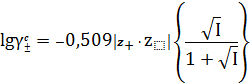 ,. (22)
,. (22)
Из анализа уравнений (16), (21), (22) видно, что среднеионный коэффициент
активности тем меньше, чем больше величина ионной силы раствора.
Преобразуем уравнение (15) к виду, удобному для дальнейшего анализа:
прологарифмируем его и решим относительно концентрации ионов металла:
lg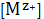
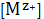 =-
=- 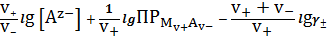
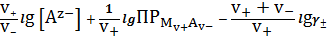 . (23)
. (23)
Насыщенный раствор малорастворимого соединений можно считать предельно
разбавленным, так как концентрация насыщенного раствора очень маленькая,
поэтому можно использовать для определения коэффициентов активности предельный
закон Дебая-Хюккеля.
lg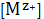
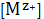 =-
=- 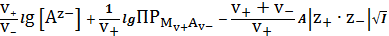
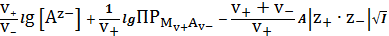 . (24)
. (24)
Из анализа уравнения (24) видно, что концентрация насыщенного раствора
зависит от многих факторов:
температуры;
наличия в воде каких-либо хорошо растворимых веществ, существенно
изменяющих коэффициенты активности;
величины ионной силы раствора;
величины рН раствора, если анион или катион малорастворимого соединения
относятся к слабым электролитам и участвуют в кислотно-основных ионных
равновесиях.
2. Растворимость осадка малорастворимого соединения в чистой воде
Воспользуемся приведенной ранее реакцией в общем виде:
Mv+
Av-тв= Mv+ Av-р-р = v+Mz++v-Az- . (1)
cн.р.
Запишем закон равновесия
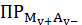
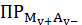 =
=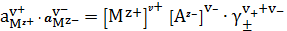
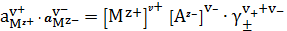 . (2)
. (2)
При отсутствии в воде каких-либо сильных электролитов, можно полагать,
что коэффициенты активности близки к единице, так как концентрация насыщенного
раствора в случае малорастворимого соединения очень мала. Выразим равновесную
концентрацию ионов через концентрацию насыщенного раствора согласно
стехиометрическому уравнению (1)
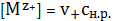
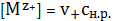 (3)
(3)
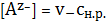
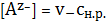 (4)
(4)
Привлекая
(3) и (4) в (2), получим:
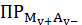
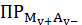 =
= 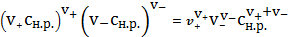
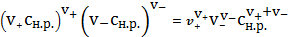 (5)
(5)
Из
уравнения (5) нетрудно выразить концентрацию насыщенного раствора
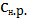
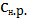 =
=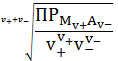
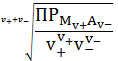 . (6)
. (6)
3. Растворимость осадка малорастворимого соединения в водном растворе,
содержащем в избытке одноименный ион
Влияние одноименного иона предсказывается принципом Ле-Шателье.
Рассмотрим в общем виде влияние на растворимость малорастворимого соединения
одноименного аниона, а затем в примерах и одноименного аниона и одноименного
катиона.
Имеем
систему, представляющую собой водный раствор малорастворимого соединения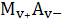
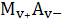 и хорошо
растворимую соль, содержащую такой же анион, например, NaA .
и хорошо
растворимую соль, содержащую такой же анион, например, NaA .
Уравнение
равновесия будет таким же, как и у случае растворимости осадка в чистой воде:
Mv+
Av-тв= Mv+ Av-р-р = v+Mz++v-Az- . (1)
cн.р.
Запишем закон равновесия
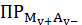
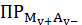 =
=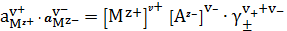
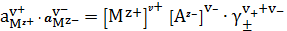 . (2)
. (2)
Допустим,
что активности ионов равны их концентрациям. При значительной концентрации
электролитов в воде это допущение не верно, но для того, чтобы пояснить влияние
на растворимость именно одноименного аниона или катиона, пока примем, что это
допущение справедливо. Равновесные концентрации ионов в растворе с одноименным
электролитом, будут другими, чем в чистой воде:
Если
концентрация катиона может быть выражена также
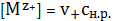
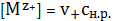 , (3)
, (3)
то концентрация аниона будет определяться концентрацией соли, дающей при
растворении этот анион
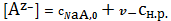
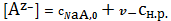 . (4)
. (4)
Обычно концентрацией насыщенного раствора в выражении (4) по сравнению с
концентрацией соли можно пренебречь, тогда
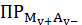
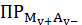 =
= 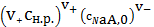
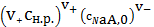 (5)
(5)
Из уравнения (5) нетрудно выразить концентрацию насыщенного раствора:
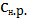
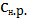 =
=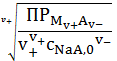
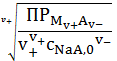 . (6)
. (6)
Из (6) видно, что растворимость малорастворимого соединения в присутствии
в растворе одноименного аниона будет уменьшаться.
4. Растворимость осадка малорастворимого соединения в водном растворе,
содержащем в избытке ионы, не входящие в осадок
Экспериментально установлено, что осадки обычно более растворимы в
растворе электролита, чем в воде (при условии, конечно, что электролит не
содержит одноименных с осадком ионов). В этом случае увеличится ионная сила
раствора, уменьшатся коэффициенты активности и увеличится растворимость
малорастворимого соединения. Влияние электролита на растворимость объясняется
электростатическим притяжением между ионами осадка и противоположно заряженными
посторонними ионами. Такие взаимодействия вызывают сдвиг равновесия реакции
растворения. Математически эти взаимодействия можно учесть, используя такую
формулу произведения растворимости, в которую входят коэффициенты активности.
Формально в выражение закона равновесия для насыщенного раствора
малорастворимого соединения концентрация посторонних электролитов не входит,
поэтому выражение реакции будет таким же:
Mv+
Av-тв= Mv+ Av-р-р = v+Mz++v-Az- . (1)
cн.р.
Запишем закон равновесия
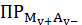
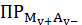 =
=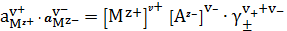
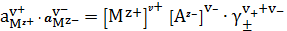 . (2)
. (2)
Растворимость найдется из выражения
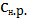
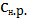 =
=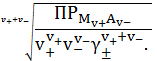
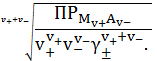 . (3)
. (3)
5. Влияние
конкурирующих равновесий на растворимость осадков
Растворимость осадка увеличивается в присутствии ионов или молекул
веществ, образующих с ионами осадка слабодиссоциирующие соединения или
комплексы. Например, растворимость фторида кальция в кислой среде выше, чем в
нейтральной, поскольку фторид-ион реагирует с ионами водорода. Вследствие этого
в насыщенном растворе фторида кальция устанавливаются два равновесия:
Ca2тв=Са2++2F- (1)
F- + Н2О=HF + OH- (2)
В соответствии с принципом Ле-Шателье добавление кислоты приведет к
увеличению концентрации фтористого водорода. Вызванное этим понижение
концентрации фторид-иона частично компенсируется сдвигом первого равновесия
вправо, в результате чего растворимость осадка возрастает. В качестве примера
соединения, в состав которого входит катион с кислотными свойствами, приведем
иодид висмута. В насыщенном растворе устанавливаются равновесия: BiI3
BiI3тв =Bi+3 + 3I- ; (3)
Bi3++ Н2О = BiOH2++H3O+. (4)
Растворимость иодида висмута в отличие от растворимости фторида кальция с
увеличением кислотности уменьшается.
Другим примером повышения растворимости в присутствии веществ,
реагирующих с ионами осадка, служат равновесия в насыщенном растворе бромистого
серебра с присутствием в этом растворе аммиака.
AgBrтв= Ag++Br-; (5)
Ag+ +2NH3=Ag(NH)2+. (6)
Молекулы аммиака понижают концентрацию ионов серебра в растворе, в
результате чего равновесие реакции растворения сдвигается вправо и
растворимость бромида серебра увеличивается.
Приведенные примеры - растворение фторида кальция или бромида серебра в
присутствии аммиака относятся к часто встречаемым на практике случаям, когда в
водных растворах устанавливаются конкурирующие равновесия. Иногда в
дополнительных равновесиях участвуют и катион и анион осадка. Для определения
растворимости малорастворимого соединения в подобных системах необходимо знать
константы равновесия всех равновесий.
5.1
Растворимость осадка малорастворимого соединения с учетом протолитических
реакций их ионов
.1.1 Растворимость осадка, образованного анионом слабой кислоты
Если анион малорастворимого соединения является анионом слабой кислоты,
то в водном растворе он будет участвовать не только в равновесии с твердым
малорастворимым соединением, но и в равновесии между ионными формами этой
слабой кислоты. То есть будут наблюдаться следующие реакции (рассмотрим для
простоты случай, когда анион - однозарядный):
MAтв = M++А-; (1)
А- +H3О+ = HA + H2О. (2)
Образующийся за счет растворения осадка анион сразу же начинает участвовать
во втором равновесии и его концентрация уменьшается , так как он
перераспределяется и существует в виде двух ионных форм: аниона и
недиссоциированной слабой кислоты.(Удобный способ расчета мольных долей каждой
из этих форм будет приведен при описании примера).
Следовательно, равновесная концентрация аниона малорастворимого
соединения, входящая в выражение ПР, будет уменьшена, она будет учитывать
мольную долю той ионной формы, которая получается при растворении
мало-растворимого соединения:
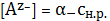
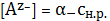 (3)
(3)
Здесь
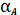
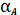 - доля
общей концентрации аниона, находящейся именно в форме А. Для одноосновной
кислоты эта величина найдется
- доля
общей концентрации аниона, находящейся именно в форме А. Для одноосновной
кислоты эта величина найдется

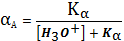
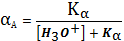 (4)
(4)
где:
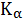
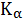 -
константа ионизации слабой кислоты.
-
константа ионизации слабой кислоты.
Закон
равновесия:
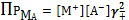
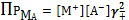 (5)
(5)
Предположим, что коэффициент активности равен 1:
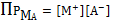
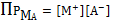 (6)
(6)
Выразим равновесные концентрации ионов:
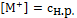
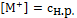 (7)
(7)
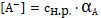
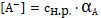 (8)
(8)
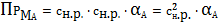
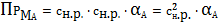 (9)
(9)
Из уравнения (9) нетрудно выразить концентрацию насыщенного раствора:
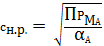
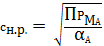 (10)
(10)
Осадки, содержащие анионы - основания ( например, оксалат кальция) или
катионы-кислоты (например, иодид висмута) вносят свой вклад в концентрацию
ионов водорода в водном растворе. Поэтому, если только концентрация ионов
водорода не поддерживается постоянной при помощи какого-либо дополнительного
равновесия, она зависит от растворимости осадка. При расчете растворимости
таких осадков нужно учитывать, какая величина рН устанавливается в растворе.
.1.2 Растворимость осадка, образованного катионом слабого основания
Катионы многих тяжелых металлов действуют как кислоты и подвергаются
гидролизу, что приводит к повышению растворимости осадков, в состав которых они
входят. Рассмотрим простейшие реакции, происходящие при протолизе катиона:
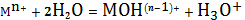
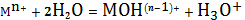 (1)
(1)
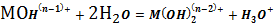
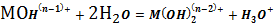 (2)
(2)
Протолиз катиона сопровождается образованием различных гидроксокомплексов
и увеличением растворимости осадка. Если рассматривать константы равновесия
этих реакций как последовательные ступенчатые константы кислотной ионизации
гидратированного катиона n+M, то по аналогии с рассмотренными
ранее долевыми концентрациями ионов можно определить и долевую концентрацию
металла, находящегося в гидратированном состоянии, то есть
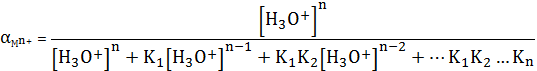
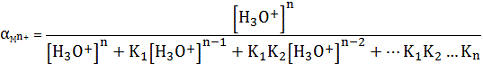 (3)
(3)
где
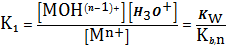
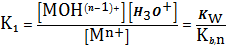 (4)
(4)
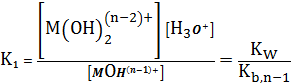
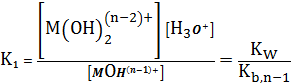 (5)
(5)
где
в свою очередь,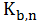
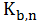 ,
, 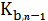
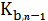 -
ступенчатые константы нестойкости гидроксокомплексов.
-
ступенчатые константы нестойкости гидроксокомплексов.
5.2
Растворимость осадка малорастворимого соединения при наличии в растворе
комплексующих агентов
Если
в растворе есть комплексующий агент, например, 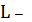
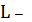 лиганд
(он может иметь заряд, может быть нейтральной частицей. Мы рассмотрим
нейтральную частицу), то возможно образование комплексных соединений,
комплексов по схеме:
лиганд
(он может иметь заряд, может быть нейтральной частицей. Мы рассмотрим
нейтральную частицу), то возможно образование комплексных соединений,
комплексов по схеме:
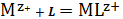
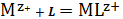
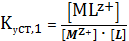
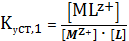 (1)
(1)
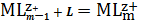
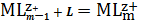
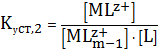
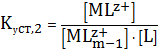 (2)
(2)
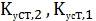
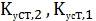 -
ступенчатые константы устойчивости или константы образования комплексных
соединений. Другое обозначение
-
ступенчатые константы устойчивости или константы образования комплексных
соединений. Другое обозначение 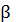
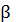
Можно записать полную реакцию:
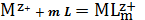
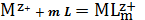
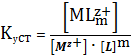
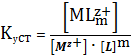 (3)
(3)
Нетрудно
заметить, что
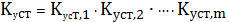
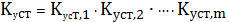 (4)
(4)
Точно также, как мы рассчитывали долю определенной ионной формы при
каком-то значении рН раствора при учете кислотно-основного равновесия, так и
тут необходимо рассчитать долю свободных ионов металла (незакомплексованных),
находящихся не в форме комплекса, а в форме просто ионов при той концентрации
лиганда, которая наблюдается в растворе. То есть если раньше мы задавали рН и
определяли разные доли, то при учете комплексообразования, надо задавать
концентрацию лиганда и определять разные доли комплексов и свободных ионов.
УМБ по катиону металла будет следующим:
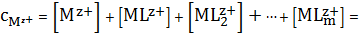
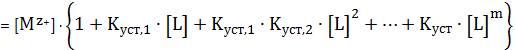
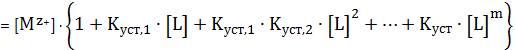 (5)
(5)
В
произведении растворимости учитывается концентрация ионов металла
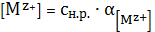
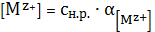 (6)
(6)
Доля ионов металла рассчитывается, как и в распределительных диаграммах в
кислотно-основных равновесиях:
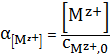
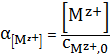 (7)
(7)
Процесс растворения осадка передается уравнением:
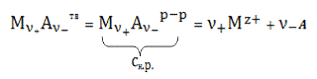 (8)
(8)
Закон равновесия
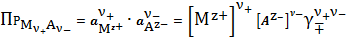
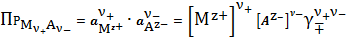 (9)
(9)
Растворимость
найдется из выражения:
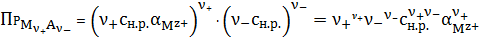
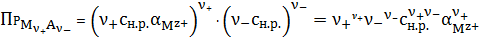 (10)
(10)
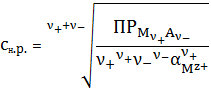
5.3 Расчет
растворимости осадков с учетом одновременного влияния различных факторов
Этот
вопрос является довольно сложным и требует глубокого понимания процессов,
происходящих в водных растворах малорастворимых соединений. Допустим, что
осадок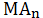
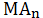 образован анионом слабой кислоты
образован анионом слабой кислоты 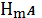
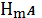 , а
катион осадка образует комплексные ионы как с посторонним реагентом L,
так и с осадителем A. Тогда растворимость осадка будет определяться
суммарным содержанием всех равновесных частиц, содержащих катион осадка [2]:
, а
катион осадка образует комплексные ионы как с посторонним реагентом L,
так и с осадителем A. Тогда растворимость осадка будет определяться
суммарным содержанием всех равновесных частиц, содержащих катион осадка [2]:
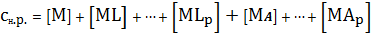
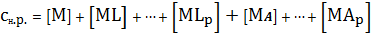 (1)
(1)
Выразим равновесные концентрации комплексных ионов через их константы
устойчивости, а концентрацию ионов металла через произведение растворимости,
получим:
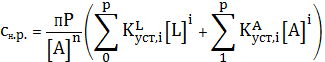
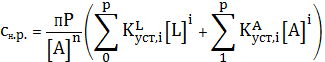 (2)
(2)
.4 Расчет
минимальной растворимости осадков
Уменьшение растворимости осадков, которые не растворяются в избытке
осадителя и в составе которых только один из ионов может участвовать в
сопряженных протолитических равновесиях, обеспечивается введением в насыщенный
раствор соответствующего избытка одноименного иона. Растворимость же осадков
гидроксидов металлов и малорастворимых соединений, у которых катионы и анионы
могут одновременно участвовать в сопряженных протолитических реакциях, зависит
от кислотности раствора и достигает минимального значения при определенном рН.
Наименьшая растворимость осадков в избытке осадителя - комплексанта также
наблюдается при строго определенной его концентрации. Создание условий
,обеспечивающих наименьшую растворимость таких осадков, является важным для
практических экологических и аналитических целей.
.4.1 Растворимость осадка, образованного анионом слабой кислоты и
катионом слабого основания
Иногда малорастворимая соль состоит из аниона слабой кислоты и катиона
слабого основания. Если константы протонирования аниона осадка и
гидроксообразования катиона резко отличаются между собой, то протолиз осадка
практически определяется протолизом того иона, который образует наиболее
прочные соединения.
Растворимость
осадков, катионы и анионы которых одновременно участвуют в сопряженных
протолитических реакциях, зависит от рН насыщенного раствора. В кислых
растворах с уменьшением рН увеличивается протонирование аниона и растворимость
осадка возрастает, в щелочных растворах с повышением рН растворимость осадков
также увеличивается вследствие образования растворимых гидроксокомплексов.
Наименьшая растворимость осадка наблюдается при таком значении рН, при котором,
влияние депротонирования аниона уравновешивается влиянием
гидроксокомплексообразования катиона осадка. Если оценивать растворимость
осадка, привлекая долевые концентрации 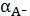
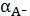 и
и 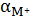
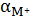 , то
очевидно, что наименьшая растворимость осадка будет наблюдаться при том рН, при
котором будет наибольшим произведение долевых концентраций аниона и катиона.
, то
очевидно, что наименьшая растворимость осадка будет наблюдаться при том рН, при
котором будет наибольшим произведение долевых концентраций аниона и катиона.
Если
растворимость осадка представить в виде функции зависимой от рН, то на зависимости
растворимости этого малорастворимого соединения от величины рН появляется
минимум.
5.4.2 Влияние комплексообразования на растворимость солей
Растворимость многих солей в присутствии общего иона значительно выше,
чем это следует из произведения растворимости. Это обычно обусловлено
образованием комплексов между анионом и катионом соли и обязательно должно быть
учтено в случае, если концентрации аниона высокие.
Практическая часть
1.
Ag2SO4тв, H2O, 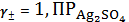
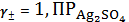 =1, 24∙10-5
=1, 24∙10-5
Ag2SO4тв = 2Ag+ + 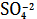
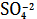
C 2Ag+ =2 SI
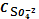
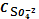 = SI
= SI
ПP Ag2SO4=1,24∙10-5
ПP Ag2SO4=
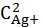
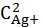 ∙
∙
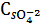
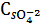 =4
SI3
=4
SI3
SI = 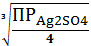
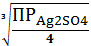 =
0,677(моль/л)
=
0,677(моль/л)
. Ag2SO4тв,
KBr, H2O, ПPAgBr=1,24∙10-5=
2Ag+ + 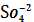
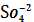 -SII
-SII
KBr = K+ + Br- x2 = C
KBr,0
C Ag+ = 2SII
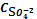
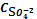 = SII
= SII
C K+ = x2 = C
KBr,0
C Br-= x2 = C
KBr,0
ПPAg2SO4= 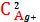
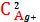 ∙ C Br- ∙ г ±2= 4SII3∙
г ±3
∙ C Br- ∙ г ±2= 4SII3∙
г ±3
SII = 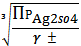
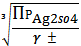
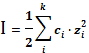
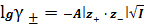
Пример
расчета: (CNaNO3 = 0,0001 моль/л)
SII =
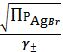
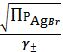 = 7,37
= 7,37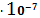
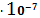 (моль/л)
(моль/л)
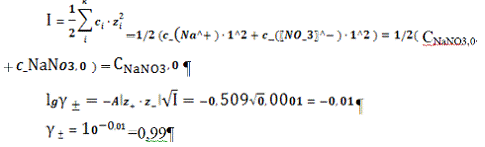
Таблица
1
|
CNaNO3,моль/л
|
I,моль/м3
|
lgг ±
|
г ±
|
SII, моль/л
|
|
0,0001
|
0,0001
|
-0,01
|
0,99
|
7,37 
|
|
0,0005
|
0,0005
|
-0,01
|
0,97
|
7,47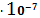 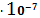
|
|
0,005
|
0,005
|
-0,04
|
0,92
|
7,91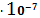 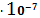
|
|
0,001
|
0,001
|
-0,02
|
0,96
|
7,55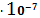 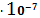
|
|
0,01
|
0,01
|
-0,05
|
0,90
|
8,10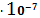 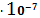
|
|
0,05
|
0,05
|
-0,09
|
0,81
|
9,02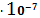 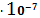
|
|
0,1
|
0,1
|
-0,11
|
0,77
|
9,42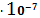 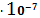
|
|
0,5
|
0,5
|
-0,16
|
0,69
|
1,05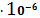 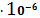
|
|
1
|
1
|
-0,15
|
0,70
|
1,03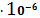 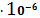
|
Построим график зависимости растворимости от ионной силы
раствора:
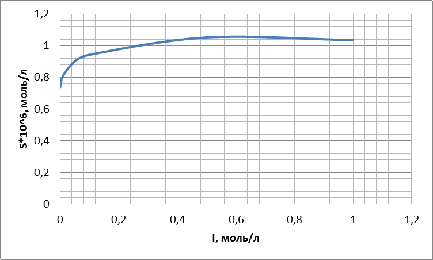
Рисунок
1 - график 
При
повышении концентрации NaNO3 в водном
растворе и, тем самым увеличивая ионную силу раствора, растет растворимость AgBrтв. Начиная с CNaNO3=0,5
моль/л растворимость AgBrТВ падает.
.
В зависимости от ионной силы раствора среднеионный коэффициент активности
рассчитывается по следующим уравнениям:
· 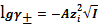
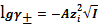 -
предельное уравнение Дебая-Хюккеля,
-
предельное уравнение Дебая-Хюккеля, 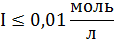
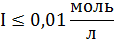
· 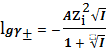
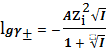 -
расширенное уравнение Дебая-Хюккеля,
-
расширенное уравнение Дебая-Хюккеля, 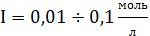
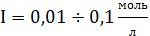
· 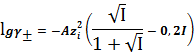
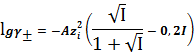 -
уравнение Дэвиса,
-
уравнение Дэвиса, 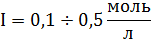
|
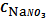 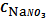 , моль/лI, моль/лlg г±г± , моль/лI, моль/лlg г±г±
|
|
|
|
|
0,0005
|
0,0005
|
-0,011
|
0,974
|
|
0,01
|
0,01
|
-0,051
|
0,889
|
|
0,12
|
0,12
|
-0,176
|
0,666
|
Полученные
значения нанесены на график зависимости 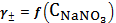
 ,
представленный ниже:
,
представленный ниже:
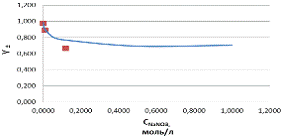
Рисунок
2 - график зависимости 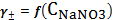
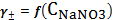 . Точки -
расчетные значения среднеионного коэффициента активности
. Точки -
расчетные значения среднеионного коэффициента активности
При
увеличении концентрации NaNO3
среднеионный коэффициент активности уменьшается. Расчетные значения
среднеионного коэффициента активности приблизительно равны справочным
значениям.
4.
CaF2тв
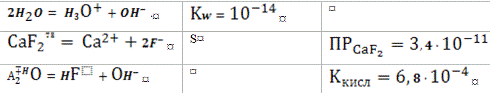
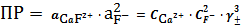
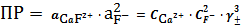 =
=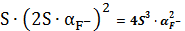
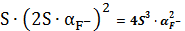
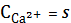
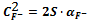
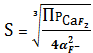
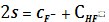
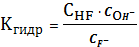
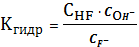 =
=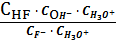
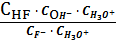 =
=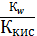
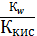
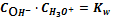
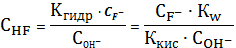
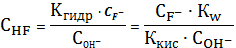 =
=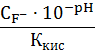
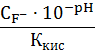
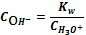
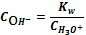 =
=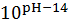
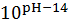
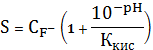
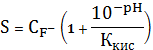 =
=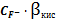
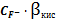
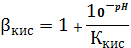
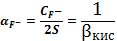
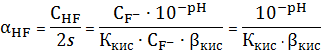
Пример
расчета (при рН=1):
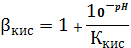
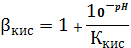 =1+
=1+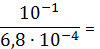
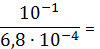 148,06
148,06
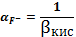
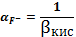 =
=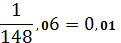
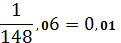
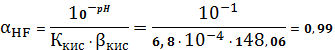
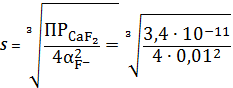
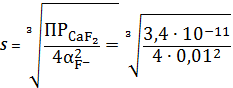 =5,71∙10-3 (моль/л)
=5,71∙10-3 (моль/л)
Таблица 2
|
pH
|
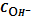
|
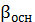
|
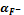
|
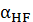
|
S
|
lg S
|
|
1
|
1∙10-13
|
148,06
|
0,01
|
0,99
|
5,71∙10-3
|
-2,24
|
|
2
|
1∙10-12
|
15,71
|
0,06
|
0,94
|
1,28∙10-3
|
-2,89
|
1∙10-11
|
2,47
|
0,40
|
0,60
|
3,73∙10-4
|
-3,43
|
|
4
|
1∙10-10
|
1,15
|
0,87
|
0,13
|
2,24∙10-4
|
-3,65
|
|
5
|
1∙10-9
|
1,01
|
0,99
|
0,01
|
2,06∙10-4
|
-3,69
|
|
6
|
1∙10-8
|
1,00
|
0,999
|
1,47∙10-3
|
2,04∙10-4
|
-3,69
|
|
7
|
1∙10-7
|
1,00
|
0,9999
|
1,47∙10-4
|
2,04∙10-4
|
-3,69
|
|
8
|
1∙10-6
|
1,00
|
0,99999
|
1,47∙10-5
|
2,04∙10-4
|
-3,69
|
|
9
|
1∙10-5
|
1,00
|
0,999999
|
1,47∙10-6
|
2,04∙10-4
|
-3,69
|
|
10
|
1∙10-4
|
1,00
|
0,9999999
|
1,47∙10-7
|
2,04∙10-4
|
-3,69
|
|
11
|
1∙10-3
|
1,00
|
0,99999999
|
1,47∙10-8
|
2,04∙10-4
|
-3,69
|
|
12
|
1∙10-2
|
1,00
|
0,999999999
|
1,47∙10-9
|
2,04∙10-4
|
-3,69
|
Построим график зависимости логарифма растворимости CaF2 от pH:
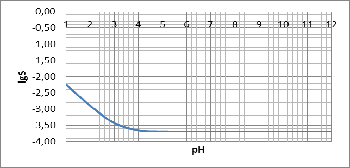
Рисунок
3 - график 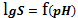
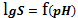
При
рН от 1 до растворимость понижается, при рН > 5 растворимость не
изменяется.
Также
построим график зависимостей долевых концентраций различных комплексов от рН:
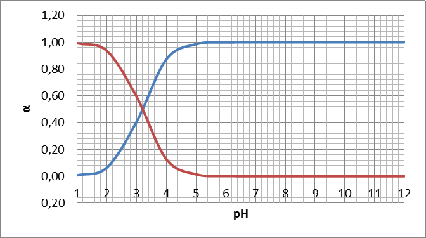
Рисунок
4 - график зависимостей б=f(pH)
При
рН=2 начинает увеличиваться доля 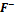
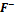 и
уменьшается доля
и
уменьшается доля 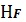
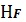 . При
рН=6 доля частиц
. При
рН=6 доля частиц 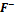
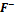 достигает
максимума. При рН=3,2 доли
достигает
максимума. При рН=3,2 доли 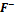
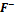 и
и 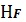
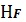 равны.
При высоких значениях рН преобладает доля
равны.
При высоких значениях рН преобладает доля 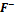
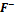 .
.
.
AgCNтв, NaCN, ПРAgCN=1,4∙10-16
1. AgCNтв= Ag++ CN- s
2. NaCN = Na+ + CN-
. Ag++ 2CN-= AgCN2- K1.2
4. Ag++ 3CN-= AgCN3
2- K1,2,3
5. Ag++ 4CN-= AgCN43- K1,…,4
C Ag+ = s∙б
Ag+
C CN-=2s + cNaCN,0
+2x2 +3x3 +4x4
ПPAgCN=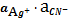
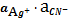 =
C Ag+ ∙ C CN-
=
C Ag+ ∙ C CN-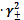
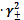 = s∙б
Ag+∙
= s∙б
Ag+∙ 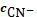
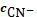 =
s∙б Ag+∙
=
s∙б Ag+∙ 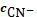
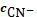
s=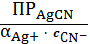
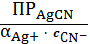 =
CAg+ + C AgCN2- +
C AgCN3 2- + C AgCN43-
=
CAg+ + C AgCN2- +
C AgCN3 2- + C AgCN43-
K1,2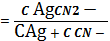
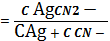
C AgCN2-=
K1,2∙
 C
Ag+ ∙ C2CN-
C
Ag+ ∙ C2CN-
K1,2,3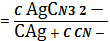
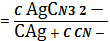
C AgCN3 2-=
K1,2,3∙
 C
Ag+ ∙ C3CN-
C
Ag+ ∙ C3CN-
K1,…,4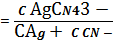
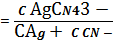
C AgCN43-=
K1,…,4∙
 C
Ag+ ∙ C4CN-=
C Ag+(1+K1,2 ∙ C2CN-+K1,2,3∙ C3CN-+K1,…,4 ∙ C4CN-)
C
Ag+ ∙ C4CN-=
C Ag+(1+K1,2 ∙ C2CN-+K1,2,3∙ C3CN-+K1,…,4 ∙ C4CN-)
вкомпл=1+K1,2
∙ C2CN-+K1,2,3∙
C3CN-+K1,…,4 ∙
C4CN-= C Ag+∙
вкомпл
б Ag+=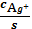
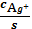 =
=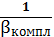
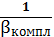
б AgCN2- = 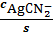
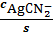 =
=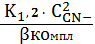
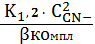
б AgCN3 2-= 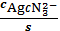
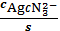 =
=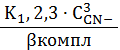
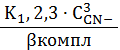
б AgCN43-
= 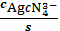
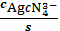 =
= 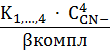
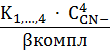
Пример расчета (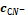
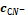 =10-15 моль/л):
=10-15 моль/л):
вкомпл =1+K1,2 ∙ C2CN-+K1,2,3∙ C3CN-+K1,…,4 ∙ C4CN-=1+1019,85∙
0,00012+ 10 20,55∙ 0,00013+ 10 19,42∙ 0,00014=1
б
Ag+=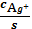
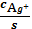 =
=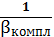
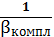 =0,9999999999
=0,9999999999
б AgCN2- = 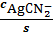
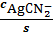 =
=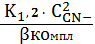
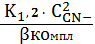 =
=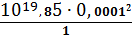
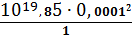 = 7,08∙10-11
= 7,08∙10-11
б AgCN3 2-= 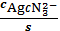
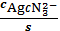 =
=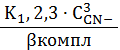
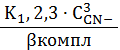 =
=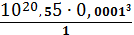
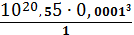 = 3,55∙10-25
= 3,55∙10-25
б AgCN43-
= 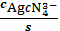
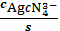 =
= 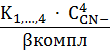
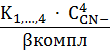 =
=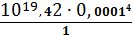
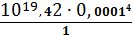 = 2,63∙10-41
= 2,63∙10-41
s=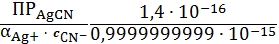
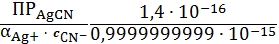 = 0,14 (моль/л)
= 0,14 (моль/л)
Таблица
3
|
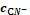 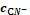 , моль/лвкомплб Ag+б AgCN2-б AgCN3 2-б AgCN43-slgslgc , моль/лвкомплб Ag+б AgCN2-б AgCN3 2-б AgCN43-slgslgc
|
|
|
|
|
|
|
|
|
|
10-15
|
1
|
0,9999999999
|
7,08∙10-11
|
3,55∙10-25
|
2,63∙10-41
|
0,14
|
-0,85
|
-15
|
|
10-14
|
1
|
0,99999999
|
7,08∙10-9
|
3,55∙10-22
|
2,63∙10-37
|
0,014
|
-1,85
|
-14
|
|
10-13
|
1
|
0,999999
|
7,08∙10-7
|
3,55∙10-19
|
2,63∙10-33
|
1,4∙10-3
|
-2,85
|
-13
|
|
10-12
|
1
|
0,9999
|
7,08∙10-5
|
3,55∙10-16
|
2,63∙10-29
|
1,4∙10-4
|
-3,85
|
-12
|
|
10-11
|
1,01
|
0,99
|
7,03∙10-3
|
3,52∙10-13
|
2,61∙10-25
|
1,41∙10-5
|
-4,85
|
-11
|
|
10-10
|
1,71
|
0,59
|
0,41
|
2,08∙10-10
|
1,54∙10-21
|
2,39∙10-6
|
-5,62
|
-10
|
|
10-9
|
71,79
|
0,01
|
0,99
|
4,94∙10-9
|
3,66∙10-19
|
1,01∙10-5
|
-5,00
|
-9
|
|
10-8
|
7080,46
|
1,41∙10-4
|
0,9999
|
5,01∙10-8
|
3,71∙10-17
|
9,91∙10-5
|
-4,00
|
-8
|
|
10-7
|
707947,14
|
1,41∙10-6
|
0,999998
|
5,01∙10-7
|
3,72∙10-15
|
9,91∙10-4
|
-3,00
|
-7
|
|
10-6
|
70794934,25
|
1,41∙10-8
|
0,99999
|
5,01∙10-6
|
3,72∙10-13
|
9,91∙10-3
|
-2,00
|
-6
|
|
10-5
|
7079812658
|
1,41∙10-10
|
0,9999
|
5,01∙10-5
|
3,72∙10-11
|
9,91∙10-2
|
-1,00
|
-5
|
Построим график зависимости логарифма растворимости AgCN от концентрации NaCN:
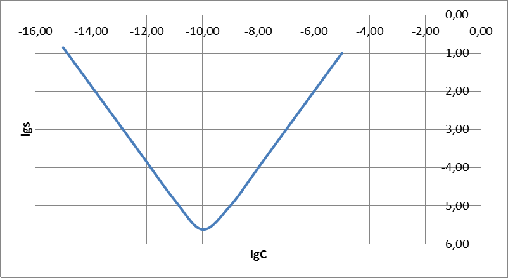
Рисунок
5 - график 
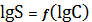
По
графику видно, что наименьшую растворимость AgCN в водных растворах NaCN
имеет при концентрации 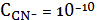
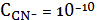 моль/л
моль/л
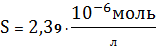
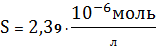 .
.
Также
построим графики зависимостей долевых концентраций различных комплексов серебра
и цианита от логарифма концентрации NaCN:
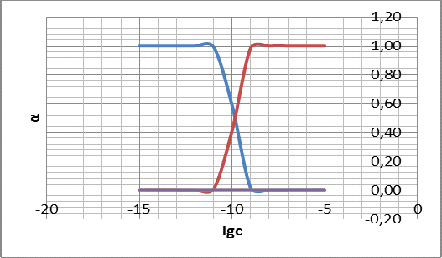
Рисунок
6 - график зависимостей 
При
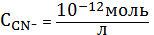
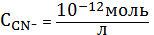 начинает
понижаться доля частиц Ag+ и
повышаться доля AgC
начинает
понижаться доля частиц Ag+ и
повышаться доля AgC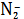
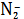 . Долевые
концентрации AgC
. Долевые
концентрации AgC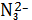
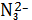 и AgC
и AgC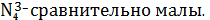
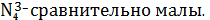 В районе
точки со значением
В районе
точки со значением 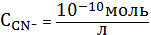
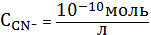 доли
частиц Ag+ и AgC
доли
частиц Ag+ и AgC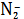
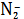 равны.
равны.
Выводы
В работе была рассчитана растворимость при различных условиях:
. растворимость осадка малорастворимого соединения AgBr в чистой воде SI
= 7,28∙10-7 (моль/л);
2.
растворимость осадка малорастворимого соединения AgBr, в водном растворе NaNO3,
содержащем в избытке ион NO-3. Растворимость достигает максимального значения
s= 1,05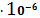
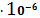 (моль/л)
при CNaNO3=0,5 моль/л, далее при повышении концентрации растворимость AgBrТВ
падает;
(моль/л)
при CNaNO3=0,5 моль/л, далее при повышении концентрации растворимость AgBrТВ
падает;
.
растворимость осадка при гидролизе катиона малорастворимой соли CaF2. Анион F-
подвергается гидролизу, что приводит к повышению растворимости осадка, в состав
которого он входит;
.
растворимость осадка малорастворимого соединения AgCN при наличии
комплексообразования с ионами СN-, входящими в состав соли NaCN. При повышении
концентрации CN- растворимость начинает расти. Мы получили минимальную
растворимость 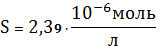
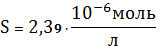 при
при 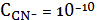
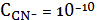 моль/л.
моль/л.
Список литературы
1. Краткий справочник физико-химических величин / Под ред.
А.А. Равделя и А.М. Пономаревой Л.; Химия. 1983. 232 с.
. Расчеты равновесий в аналитической химии. М.И. Булатов. Л.:
Химия. 1984.
. Ионные равновесия. Дж.Н. Батлер.Л.: Химия,1973.
. Химический анализ. Г.А. Лайтинен, В.Е. Харрис, М.: Химия.
1979.
. Основы аналитической химии. Том 1. Д. Скуг, Д. Уэст. М.:
Мир. 1979.