Рассмотрение синтезов соединений с пятичленными циклами
Введение
Гетероциклическими называют соединения, содержащие циклы, включающие один
или несколько гетероатомов. Это один из самых обширных и важных в практическом
отношении классов органических соединений. Наиболее устойчивыми являются пяти-
и шестичленные циклы. Они широко распространены в природе, где играют огромную
роль. Так же гетероциклические соединения производятся в больших масштабах в
промышленности. Вот некоторые из соединений, содержащие пятичленные
гетероциклы, которые мы часто используем в жизни:
) Семикарбазоном 5-нитрофурфурола является фурацилин - средство
для полоскания горла.

) Тиамин - витамин В1

) Никотин
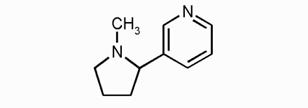
В данной курсовой работе будут рассмотрены синтезы соединений с
пятичленными циклами, поскольку их производные распространены в природе и часто
являются промышленными продуктами.
1. Классификация
гетероциклических соединений с пятичленными циклами
В зависимости от природы гетероатома различают кислород-, азот- и
серосодержащие соединения (Таб. 1). Так же гетероциклические соединения делятся
на насыщенные (Таб. 1 -А) соединения и ненасыщенные (Таб. 1-В), т.е. содержащие
кратные связи. Существуют и соединения, в составе которых есть одновременно
несколько одинаковых или различных гетероатомов (Таб. 2). В зависимости от
числа циклических фрагментов в молекуле различают моноядерные - моноциклические
соединения (Таб. 1-А, 1-В, 2-А)и полиядерные - содержащие несколько циклов(Таб.
1-С, 2-В).
Таблица 1:
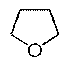 Тетрагидрофуран
Тетрагидрофуран  Фуран
Фуран  <#"822761.files/image007.gif"> <#"822761.files/image008.jpg"> Пирролидин
<#"822761.files/image007.gif"> <#"822761.files/image008.jpg"> Пирролидин  Пиррол
Пиррол  <#"822761.files/image011.gif"> <#"822761.files/image012.jpg"> Тетрагидротиофен
<#"822761.files/image011.gif"> <#"822761.files/image012.jpg"> Тетрагидротиофен 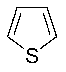 Тиофен
Тиофен  <#"822761.files/image015.gif"> <#"822761.files/image016.gif"> <#"822761.files/image017.gif"> <#"822761.files/image018.gif"> <#"822761.files/image019.gif">
<#"822761.files/image020.gif"> <#"822761.files/image021.gif"> <#"822761.files/image022.gif"> <#"822761.files/image023.gif">
<#"822761.files/image024.gif"> <#"822761.files/image025.gif">
<#"822761.files/image026.jpg">
<#"822761.files/image015.gif"> <#"822761.files/image016.gif"> <#"822761.files/image017.gif"> <#"822761.files/image018.gif"> <#"822761.files/image019.gif">
<#"822761.files/image020.gif"> <#"822761.files/image021.gif"> <#"822761.files/image022.gif"> <#"822761.files/image023.gif">
<#"822761.files/image024.gif"> <#"822761.files/image025.gif">
<#"822761.files/image026.jpg">
2. Методы синтеза моноядерных насыщенных пятичленных гетероциклов с одним
гетероатомом
Все представители этого класса (пирролидин, тетрагидрофуран,
тетрагидротиофен) получаются из своих ненасыщенных аналогов каталитическим
гидрированием.
Каталитическое гидрирование пиррола или 3-пирролина. [1]

Декарбонилирование фурфурола с последуюшим гидрированием образующегося
фурана. Катализатор первой стадии - Cu(CrO2)2 или Сu-Аl, Cu-Cr-Al, второй- Ni с
добавками Сr. Поскольку в этом методе используется возобновляемый ресурс
(растительное сырье), этот метод находит все более широкое применение. Метод
получения фурана из фурфурола будет рассмотрен ниже.

Так же как и тетрагидрофуран тетрагидротиофен можно получить
гидрированием тиофена при Т = 240-260oС, Р = 0,5-2,0 МПа, используется
катализатор дисульфид вольфрама формулы WS2. [2]
Кроме общего метода получения у каждого из соединений существуют свои
способы синтеза.
Пирролидин получают циклизацией 1-амино-4-галогенбутанов под действием
щелочи.
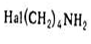
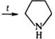
Или пирролизом гидрохлорида 1,4-тетраметилендиамина ( путресцина) [3]

Тетрогидрофуран производится промышленностью в количестве порядка
десятков тысяч тонн в год несколькими способами.
Например, синтез по Реппе реакции. Конденсация ацетилена и его
монозамещенных гомологов с альдегидами или кетонами, восстановление до
бутандиола, с дальнейшей дегидратацией спирта катализируемой кислотой.
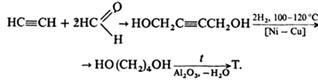
Тетрагидрофуран можно получить окислением n-бутана до малеинового
ангидрида, который в дальнейшем подвергается каталитическому гидрогенированию.
[4]

Ещё один метод синеза тетрагидротиофена основан на взаимодействие
1,4-дигалогенбутанов с сульфидом натрия при нагревании.[5]

. Методы синтеза пятичленных гетероциклов с одним гетероатомом
Общий метод синтеза таких гетероциклов основан на использовании в
качестве исходных 1,4-дикарбонильных соединений (метод Пааля-Кнорра). Пирролы
образуются по схеме:

Аналогично происходит образование фуранов (Z=O) из 1,4-дикарбонильных
соединений в кислой среде:
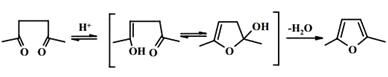
Ограничения метода связаны лишь с доступностью 1,4-дикарбонильных соединений.
Если они доступны, то циклоконденсация идет с очень высокими выходами,
например:

Очевидно, что использование 1,4-диальдегидов (или их скрытых форм,
например, ацеталей) дает возможность получать 2,5-незамещенные фураны [6]:

Аналогично по методу Пааля-Кнорра 1,4 - дикарбонильные соединения
реагируют с источниками серы с образованием тиофенов[7]:
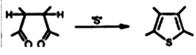
Выходы значительно растут при использовании в качестве осерняющего агента
реактива Лоуссона.

Ю.К. Юрьев открыл реакции взаимопревращений пятичленных гетероциклов,
которые также применяют с целью их получения. Реакция идет в токе сероводорода,
аммиака и воды, при высоких температурах, над окисью алюминия. Наилучшие
результаты дают превращения фурана. При превращениях пиррола и тиофена выходы
новых гетероциклических соединений очень низкие.

Перечисленные выше способы являются общими методами синтеза всех трех
пятичленных гетероциклов. Однако для каждого из них в отдельности существуют и
специфические методы получения. [8]
В лаборатории пиррол получают пиролизом аммонийной соли слизевой кислоты.
Так, слизевокислый аммоний при нагревании превращается в свободную кислоту,
которая последовательно дегидратируется, декарбоксилируется и циклизуется с
участием аммиака, давая пиррол.

Широко известен метод синтеза фурфурола (фуран-2-карбальдегида) кислотным
гидролизом пентозосодержащих полисахаридов, добываемых из доступного природного
сырья (оболочки семян, овес, кукурузные початки, капуста, сахарный тростник).
Процесс идет с количественным выходом по схеме [9]:
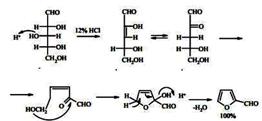
Образующийся фурфурол может быть двумя путями превращен в незамещенный
фуран:

Реакция Канниццарро позволяет с хорошим выходом превратить фурфурол в
фуран-2-карбоновую кислоту, которая термически декарбоксилируется с
образованием фурана (путь А), в результате каталитического декарбонилирования
фурфурола (в качестве катализатора используется никель) также образуется фуран
(путь В).
Основное сырье для синтеза тиофенов - углеводороды нефтяных фракций С4 и
С5. Их получают циклизацией бутана или бутилена в парах серы при 700оС.
По-видимому, на первой стадии происходит хорошо известное дегидрирование
углеводородов серой с последующим присоединением сероводорода к ненасыщенным
структурам. Способ применим для углеводородов, содержащих не более 5 атомов
углерода, для остальных в этих условиях идет крекинг. В промышленности также
используют метод получения из ацетилена с сероводородом при 400оС.
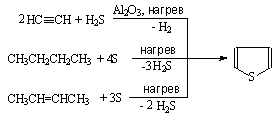
. Методы синтеза конденсированных пятичленных гетероциклов с одним
гетероатомом
Наиболее удобным и распространенным методом построения индольного бицикла
служит аннелирование пиррольного кольца к бензольному. Это определяется
доступностью, стабильностью и возможностью получения разнообразных
функциональных производных бензольного ряда (в основном производных анилина и
их синтетических предшественников). К таким методам относится прежде всего
синтез Фишера - циклизация арилгидразонов под действием кислых агентов - один
из самых известных методов получения широкого круга производных индола.
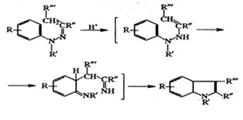
Под действием кислых агентов происходит изомеризация гидразонов в
енгидразины, протонирование енаминного атома азота, [3,3]-сигматропная
перегруппировка с разрывом связи N-N и образованием связи С-С, циклизация и
ароматизация с элиминированием молекулы аммиака.
Катализаторами реакции Фишера служат многочисленные кислотные агенты
различной природы. Так, известно применение протонных кислот (неорганических и
п-толуолсульфокислоты в толуоле), кислот Льюиса (ZnCl2, PCl3), спиртовых растворов
HCl, SOCl2 и т.п. Метод имеет один недостаток: при использовании в реакции не
симметричных кетонов образуется смесь индолов, если заместитель R2 так же имеет
а-метиленовую группу. В других случаях направление циклизации можно
контролировать выбором катализатора.
Так же индолы можно получить по реакции Бишлера. Метод основан на
взаимодействие ариламинов с a-галоген- или a-гидроксикарбонильными
соединениями. Процесс усложняется тем, что в присутствии избытка амина и
кислого катализатора ариламино кетон может изомеризоваться прежде, чем
произойдет циклизация. Это может привести к образованию смеси индолов, если
заместители R 1 и R2 не индентичны.

Существует много других доступных методов синтеза, но большинство из них ограничено
синтезом определенных групп индолов.[10]
Бензофуран встречается в каменноугольной смоле, но в
полупромышленных масштабах его получают циклизацией 2-этилфенола. Так же могут
быть получены простейшие алкилбензофураны. Все синтезы простых производных
бензофурана включают стадию замыкания фуранового цикла, происходящую по одному
из следующих трёх типов: [11]


,3-Бензофуран (I) получают в промышленных масштабах из
о-нитроэтилбензола:
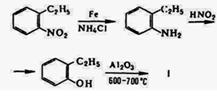
Наиболее распространенный метод синтеза бензотиофенов
состоит в циклизации орто-замещенных бензолов. Например, 2-ацетилбензотиофен
можно получить аналогично соотвествующему бензофурану, как было описано выше.
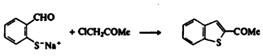
Так же можно синтезировать из монозамещенных бензолов
внутримолекулярной конденсацией по типу реакции Фриделя-Крафтса. Например,
получение 3-метилбензотиофена:

Для синтезирования производных изоиндола,
изобензотиофена и изобензофурана используют различные реакции циклизации, но ни
одна из них не подходит для получения незамещенных соединений. Нестабильные
незамещенные гетероциклы лучше всего получать с помощью техники газового
пиролиза при пониженном давлении. [12]
5. Методы синтеза пятичленных гетероциклов с двумя гетероатомомами
Не существует широко применяемого метода синтеза
имидазольного кольца. Впервые имидазол был получен в 1858 году Генрихом Дебюсом
конденсацией глиоксаля с аммиаком и формальдегидом:
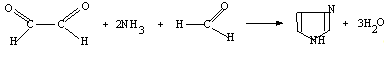
Производные имидазола так же можно получить этим
методом, действую аммиаком и формальдегидов на производные глиоксаля.

Один из методов получения 2-незамещённых имидазолов
является реакция Бредерека, в которой а-гидроксикетон или а-галогенкетон
нагревают с формальдегидом.

Взаимодействие а-аминокетонов с тиоцианатами или
изотиоцианатами приводит к образованию имидазолтиолов-2 (Синтез Марквальда).
Сера легко может быть удалена при окислении. [13]

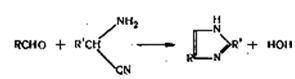
Имидадолы можно получить из аминонитрилов и
альдегидов. Реакция протекает легко, но её применяют только для синтеза
2,4-дизамещенных имидазолов. [14]
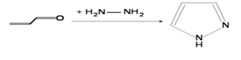
В классической методике, разработанной H. Pechmann в
1898 году, пиразол был получен из ацетилена и диазометана. Наиболее общий метод
получения пиразолов основан на реакции α, β-ненасыщенных альдегидов с гидразином
и последующего дегидрировании.
Недостаток этого метода заключается в том, что
несимметричные дикарбонильные соединения или их производные могут давать смеси
изомерных пиразолов. Хорошие выходы получаются в реакции а-галогеннокетонов с
гидразидом ХСSNHNH2 (Х=SR или NR2). В ходе реакции образуются тиадиазины,
которые либо самопроизвольно, либо при обработке кислотами элиминируют атом
серы и превращаются в пиразолы. [15]
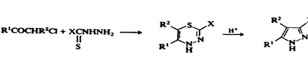
Некоторые основные методы синтеза оксазолов и тиазолов
аналогичны синтезам для фуранов и тиофенов. Таковым можно назвать метод
получения оксазолов - реакция Робинсона-Габриеля. Этот метод аналогичен синтезу
фуранов дегидратацией 1,4-дикетонов. Метод заключается в в циклодегидратации
а-ациламинокетонов. [16]

Некоторые тиазолы (включая незамещенные) получают
аналогичным способом реакцией а-ациламинокетонов с пентасульфидом фосфора:
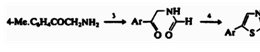
Где: 3-HCO2H; 4-Р2S5
Выше уже был описан синтез Бредерека (реакция
а-галогенокетонов с формамидом), как путь получения имидазолов, но в
присутствии кислоты интермедиаты могут циклизоваться в оксазолы.[17]
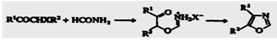
Существует два наиболее широко применяемых метода
построения циклической системы изоксазола:
1) Взаимодействие гидроксиамина с 1,3-дикарбонильными соединениями.
Причем из несимметричного карбонильного соединения образуются два изомерных
изоксазола.

) 1,3-диполярное циклоприсоединение нитрилоксида к алкенам и
алкинам. Этим способом можно получить самые разные изоксазолы варьированием
заместителей обоих реагентов.

гетероциклический синтез пятичленный
гетероатом
Общие методы получения изоксазолов не могут быть с
легкостью применены для синтеза изотиазолов. Тиогидроксиламино-S-сульфонат
калия реагирует по карбонильной группе пропаргилового альдегида, который может
циклизоваться в изотиазол в присутствии бикарбоната натрия.

Метод получения изотиазолов 1,3-диполярным
циклоприсоединением нитрилсульфидов аналогичен получению изоксазолов, но эти
реакции более ограничены числом заместителей, которые можно было бы ввести в
молекулы.
Изотиазолы также могут быть получены из
соответствующих изоксазолов восстановительным раскрытием цикла с последующим
превращением в тиоамид и окислительной циклизацией. [18]

Где: 3- H2/ Ni; 4-Р2О5; 5-хлоранил
. Методы синтеза конденсированных пятичленных
гетероциклов с двумя гетероатомомами
Почти во всех синтезах индазолов исходными соединениями являются
производные бензола. Пиразольный цикл может заключаться одним из четырёх
возможных способов:

Большинство индазолов получают замыканием кольца по типу III, поэтому
ниже будут приведены примеры этого типа:
1) Получают индазол и его замещенные из о-гидразинокоричной,
o-гидразинобензойной или о-гидразинофенилглиоксалевой кислот.
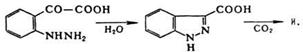
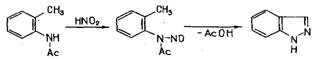
2) Циклизацией N-нитрозо-N-ацетил-о-толуидина (получают действием азотной
кислотой на N-ацетил-о-толуидина), которая протекает с выделением уксусной
кислоты.[19]
Бензимидазолы получают из о-фенилендиаминов или замещенных
о-фенилендиаминов и кислот или их производных. Ланденбург первым отметил,что
монозамещенные производные о-фенилендиамина при простом нагревании легко
переходят в соотвествующие бензимидазолы. Так как моноацильные производные
легкодоступны,этот метод является удобным для синтеза бензимидазолов.
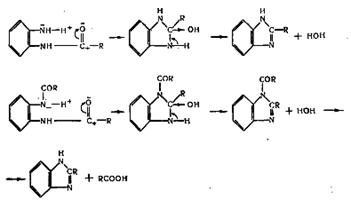
Первая стадия реакции сходна с другими реакциями аминолиза карбонильных
соединений, когда происходит присоединение группы N-H к карбонильной группе. На
этой стадии происходит образование циклического соединения
(дигидробензимидазола), которое теряет молекулу воды и переходит в нужный
бензимидазол. [20]
Бензоксазол получают взаимодействие о-аминофенола с карбоновыми кислотами
и их производными при нагревании. [21]
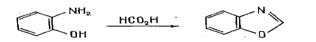
Бензотиазол получается при нагревании о-аминотиофенола (получают путём
расщепления бензотиазолин-2-тиона щелочью при высоких температурах) с
ортомуравьиным эфиром в присутствии каталитического количества серной кислоты
образуется бензотиазол.

А так же по реакции о-аминотиофенола с хлорангидридами и ангидридами
кислот. Промежуточными соединениями являются о-ациламинотиофенолы, которые
легко подвергаются циклизации.
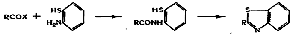
Некоторые общие методы, используемые для получения конденсированных
систем, приведены ниже:
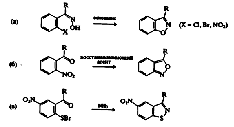

Методы синтеза бензизотиазолов родственны способам получения
моноциклическим системам, в которых связь N-S образуется при окислении. Для
метода получения бензизоксазолов, было установлено, что кольцевой атом
кислорода образуется из нитро-, а не из карбонильной группы. [22]
. Экспериментальная часть: получение индазола
Индазол получали циклизацией N-нитрозо-N-ацетил-о-толуидина (который был
получен действием азотной кислотой на N-ацетил-о-толуидина), которая протекает
с выделением уксусной кислоты.

. Получение N-ацетил-о-толуидина

В круглодонной двугорловой колбе, снабженной магнитной мешалкой и
обратным холодильником, растворяли 15 г о-толуидина в 27 мл бензола. Затем
осторожно в течение 15 мин приливали из капельной воронки 14,4 г уксусного ангидрида.
При этом реакционная смесь разогревалась до кипения. По окончании прибавления
уксусного ангидрида смеси давали охладиться. По мере охлаждения содержимое
колбы закристаллизовывалось. К смеси добавляли равный объем воды и выпавшие
кристаллы отсасывали на воронке Бюхнера, промывали холодной водой. Полученный
продукт высушивали на воздухе. Выход 15,4 г (74%)
2. Получение N-нитрозо-N-ацетил-о-толуидина.
В стакане, снабжённом мешалкой, суспендировали 15,4 г N-ацетил-о-толуидина
в 103 мл толуола и смесь охлаждали до 0-5 оС. При интенсивном перемешивании
приливали 18 мл концентрированной НCl и, следя за тем, чтобы температура
реакционной массы не поднималась выше 5 оС, порциями прибавляли 10,8 г твердого
нитрита натрия (Тяга!). После этого содержимое стакана перемешивали ещё 2 час
при температуре 5 оС и выливали в 103 мл холодной воды. Толуольный слой
отделяли, промывали 26 мл 10%-ного раствора Na2CO3. Водой (26 мл) и в течение
20 мин сушили хлоридом кальция.
. Получение индазола.

Раствор N-нитрозо-N-ацетил-о-толуидина перенесли в пол-литровую
круглодонную колбу обратным холодильником и осторожно нагревали до начала
экзотермической реакции циклизации. После прекращения самопроизвольного
кипения, смесь нагревали ещё 5 мин. Затем отгоняли с водяным паром большую
часть толуола, добавили 20,5 18%-ной HCl и продолжили отгонять остатки толуола
водяным паром. Колбу охлаждали, водный раствор гидрохлорида индазола
нейтрализовали NH4OH. Выпавший осадок индазола отфильтровывают, промывают
холодной водой (20 мл). Перекристаллизовывали из 50 частей воды[23]. Выход: 6,5
г (79%) Тпл= 151оС
Вывод
В ходе курсовой работы были рассмотрены методы синтеза некоторых
гетероциклических соединений с пятичленными циклами. Были описаны общие методы
получения группы соединений, синтезы применяемые в промышленности и в
лабораториях. Был проведен опыт по получению одного из гетероциклических
соединений с пятичленным циклом, а именно, индазола.
В данной курсовой работе было обобщено большое количество методов
получения веществ и выбраны наиболее полезные для практического применения.
Список литературы
1. Моррисон,
Бойд. "Органическая химия", (1974 г.) стр. 1022
. http://www.xumuk.ru/encyklopedia/2/4398.html
. http://www.xumuk.ru/encyklopedia/2/3368.html
. http://www.xumuk.ru/encyklopedia/2/4398.html
. Моррисон,
Бойд. "Органическая химия", (1974 г.) стр. 1022
. http://www.chem.msu.su/rus/teaching/urovskaja/getero.pdf
. Джоуль,
Миллс "Химия гетероциклических соединений" (2004 г.) стр. 368
. http://www.chem.msu.su/rus/teaching/urovskaja/getero.pdf
. Моррисон,
Бойд. "Органическая химия", (1974 г) стр. 1018
. Джоуль,
Миллс "Химия гетероциклических соединений" (2004 г.) стр. 268-271
11. Эльдерфилд
"Гетероциклические соединения", том 2, (1954 г.) стр. 6
. Джилкрист
Т. "Химия гетероциклических соединений", (1996 г.) стр. 281-283
. Джилкрист
Т. "Химия гетероциклических соединений", (1996 г.) стр. 347
. Эльдерфилд
"Гетероциклические соединения", том 5, (1961 г.) стр. 179
. Джилкрист
Т. "Химия гетероциклических соединений", (1996 г.) стр. 352
. Эльдерфилд
"Гетероциклические соединения", том 5, (1961 г) стр. 243
. Джилкрист
Т. "Химия гетероциклических соединений", (1996 г) стр. 366-367
. Джилкрист
Т. "Химия гетероциклических соединений", (1996 г) стр. 375-377
. Эльдерфилд
"Гетероциклические соединения", том 5, (1961 г.) стр. 136-138
. Эльдерфилд
"Гетероциклические соединения", том 5, (1961 г.) стр. 217
. Эльдерфилд
"Гетероциклические соединения", том 5, (1961 г.) стр. 349
. Джилкрист
Т. "Химия гетероциклических соединений", (1996 г.) стр. 377
. Пожарский
А.Ф. Анисимова В.А., "Практические работы по химии гетероциклов"
(1988 г.) стр. 77-78