Разработка технологии восстановления карбонилсодержащих соединений на многокомпонентных катализаторах
Диссертация
по теме:
Разработка
технологии восстановления карбонилсодержащих соединений на многокомпонентных
катализаторах
Реферат
Объем и структура диссертации. Диссертация
состоит из введения, литературного обзора, основной части, заключения, списка
использованных источников.
Ключевые слова: катализатор, гетерогенный
катализ, диоксид кремния, носитель катализатора, многокомпонентные
катализаторы, нанесенные катализаторы, скелетные катализаторы, карбонильные
соединения, фурфурол, фурфуриловый спирт.
Объектами исследования данной магистерской
диссертационной работы являются: катализаторы, полученные путем нанесения на
оксид кремния металлов и сплавные скелетные катализаторы на основе меди, а
также продукты гидрирования фурфурола на синтезированных катализаторах.
Цель работы - синтезировать каталитические
системы, обладающие высокой активностью и селективность, подобрать оптимальные
параметры технологического процесса гидрирования фурфурола, на основании
полученных данных разработать технологические рекомендации.
Методы исследования. Для исследования структуры
синтезированных катализаторов применяли: микроскопический,
электронномикроскопический анализы, для исследования удельной поверхности и
пористости катализаторов применяли методом тепловой десорбции аргона, для
определения состава продуктов, полученных на катализаторах применяли хромато
графический анализ.
Полученные результаты, их новизна. Новизна
полученных результатов заключается в подтверждении возможности синтеза
катализаторов путем нанесения на подложку из оксида кремния меди, никеля,
хрома, которые проявляют высокую активность в процессе гидрирования фурфурола в
фурфуриловый спирт. Разработаны сплавные катализаторы с применением в качестве
добавки ферромарганцевых сплавов, подобрано оптимальное соотношение данных
компонентов, позволяющее получать высокие выходы целевого продукта. Проведены
исследования по определению взаимосвязей выхода фурфурилового спирта и
технологических параметров процесса.
Качественная характеристика собранного
фактического материала. Результаты, представленные в работе получены с
применением современных методов исследования и являются достоверными. По теме
исследования опубликовано 5 статей и тезисов международных конференций.
Аbstract
Volume
and structure
of the
thesis. The
thesis consists of an introduction, literature review, the main part,
conclusion, list of references. The work presented in 85 pages of computer
text, includes 19 figures, 41 tables and 57 references.. Catalyst,
heterogeneous catalysis, silica, catalyst carrier multicomponent catalysts,
supported catalysts, skeletal catalysts, carbonyl compounds, furfural, furfuryl
alcohol.objects of study of this master's thesis are: catalysts prepared by
coating silica and metal alloy skeletal catalysts based on copper, as well as
products of hydrogenation of furfural on the synthesized catalysts.of work is
to synthesize catalytic systems with high activity and selectivity to find the
optimal process parameters of hydrogenation of furfural, based on the data
obtained to develop technological recommendations.methods. For investigating
the structure of synthesized catalysts used: microscopic, electron microscopic
analyzes, to study the specific surface area and porosity of the catalysts used
by thermal desorption of argon, to determine the composition of the products
obtained with the catalysts used chromatographic analysis.results, their
novelty. The novelty lies in the results obtained confirm the possibility of
synthesizing catalyst by coating a substrate of silicon oxide of copper,
nickel, chromium, which exhibit high activity in the hydrogenation of furfural
to furfuryl alcohol. Developed alloy catalysts using as an additive
ferro-manganese alloys, choose the optimal ratio of these components, which allows
obtaining high yields of the desired product. Conducted studies to determine
the relationships yield furfuryl alcohol and process parameters.description of
the factual material collected. The results presented in this work, was
obtained, with the use of modern methods of investigation and is reliable. On
the topic of research published 5 articles and abstracts of international
conferences.
Нормативные ссылки
В настоящей магистерской диссертации
использованы ссылки на следующие стандарты:
ГОСТ 8.417-2002 Государственная система
обеспечения единства измерений. Единицы величин.
ГОСТ 2.316-2008 Единая система конструкторской
документации. Правила нанесения надписей, технических требований и таблиц на
графических документах. Общие положения.
ГОСТ 7.1-2003 Система стандартов по информации,
библиотечному и издательскому делу, библиографическому и издательскому делу.
Библиографическая запись. Библиографическое описание. Общие требования и
правила составления.
ГОСТ 18995.1-73 Продукты химические жидкие.
Методы определения плотности
ГОСТ 23401-90 Порошки металлические.
Катализаторы и носители. Определение удельной поверхности.
ГОСТ 28794-90 Реактивы. Метод определения
удельной поверхности хроматографических материалов термодесорбцией.
ГОСТ 17567-81 Хроматография газовая. Термины и
определения.
ГОСТ 21006-75 Микроскопы электронные. Термины,
определения и буквенные обозначения.
ГОСТ 10437-80 Фурфурол технический. Технические
условия.
ГОСТ 28960-91 Спирт фурфуриловый. Технические
условия.
Определения
В настоящей магистерской диссертации применяются
следующие термины и определения:
Катализ - явления избирательного ускорения
химической реакции в одном из термодинамически разрешенных направлений путем
применения катализатора.
Катализатор - вещество (смесь веществ) ускоряющее
химическую реакцию, путем многократных химических взаимодействий с участниками
реакции и направления ее по более энергетически выгодному пути, при этом
катализатор не расходуется в процессе реакции.
Носитель катализатора (подложка) - инертный или
малоактивный материал, на который наносятся активные компоненты в
рассредоточенном состоянии (без агломерации).
Активный компонент катализатора - вещество в
каталитической системе, которое ускоряет химическую реакцию.
Адсорбция - увеличение концентрации растворенного
вещества у поверхности раздела двух фаз вследствие нескомпенсированности сил
межмолекулярного взаимодействия на разделе фаз.
Диффузия - массообменный процесс
взаимопроникновения атомов (молекул) одного вещества в межатомное
(межмолекулярное) пространство другого вещества, который приводит к
концентрационному выравниванию.
Изотермический режим - режим проведения
процесса, характеризующийся постоянством температуры во всем реакционном
объеме.
Кинетическая область - область протекания
процесса, когда массопередача протекает намного быстрее химической реакции,
между концентрациями веществ в каждой фазе устанавливается равновесие и общая
скорость процесса лимитируется наиболее медленной стадией - самой химической
реакцией.
Диффузионная область - область протекания
процесса, когда массопередача протекает медленнее химической реакции и между
концентрациями веществ в каждой фазе отсутствует равновесие.
Сплавной катализатор - катализатор, полученный
методом сплавления чистых металлов и сплавов друг с другом, проявляющих себя в
качестве веществ ускоряющих химическую реакцию.
Нанесенный катализатор - катализатор, полученный
методом пропитывания носителя солями различных металлов, с последующим
термическим и термохимическим воздействием для перевода осевших солей на
носителе в оксидные и металлические формы, которые обладают каталитическим
свойствами.
Обозначения и сокращения
масс. % - массовая доля (массовый процент)
ГОСТ - государственный стандарт
ФС - фурфуриловый спирт
-МФ - 2-метил фуран
НПЗ - нефтеперерабатывающий завод
ФС - фурфуриловый спирт- оксид кремнияO3 - оксид
алюминия
мл - миллилитр (мера объема)
кг/см3 - мера плотности
МПа - мега Паскаль (мера давления)
м2/г - мера удельной поверхности катализатора
мин. - минута (мера времени)
С - градус по шкале Цельсия (мера температуры)
ПЭМ - просвечивающая электронная микроскопия
Введение
Актуальность работы. В настоящее время в
Казахстане сельскохозяйственные отходы, в основном, реинвестируются в почву или
сжигаются, тогда как эффективные технологии комплексной переработки отходов
сельскохозяйственного производства позволяют полнее использовать исходное сырье
с получением из отходов ценных продуктов, таких, как фурфурол.
Казахстан входит в число 25 стран мира основных
производителей аграрного сырья, и в первую десятку по общей территории площади
сельскохозяйственных угодий [1]. Зерновое хозяйство - главная отрасль
земледелия Казахстана, обеспечивающая население хлебопродуктами, а
животноводство - кормами. В Казахстане ежегодно производится в среднем 18 млн.
тонн зерна. На сегодняшний день только 25% производимого зерна перерабатывается
в муку. В связи с этим достаточно перспективным является развитие глубокой
переработки. Около 2,5 млн. тонн зерна возможно использовать для глубокой
переработки [2].
На сегодняшний день остается актуальной не
только глубокая переработка зерна, но и глубокая переработка отходов зернового
производства, таких, как солома, лузга и т.д., так как они по своему
химическому составу представляют перспективное значение для химической, фармакологической
и пищевой промышленности. Из отходов сельскохозяйственного производства
получают полисахариды, целлюлозы, красители и пищевые добавки, фурфурол,
лекарственные препараты и другие продукты с высокой добавленной стоимостью, тем
самым способствуя развитию безотходного производства. Отходы сельского
хозяйства сегодня - почти невостребованный ресурс. Например, используется лишь
10% всего объема соломы (в основном, в животноводстве, в качестве подстилки
скоту, как добавка в корма). Между тем, в Казахстане средний объем отходов в
2011-2013 г. составил 35 245 тыс. тонн [3].
В настоящее время на химическая отрасль поделена
между несколькими крупными компаниями, которые владеют более, чем 80% лицензий
на современные технологии, таким образом, диктуют условия на их использование.
Создание отечественных катализаторов и технологий является актуальной
проблемой, стоящей перед научным сообществом республики в лице
исследовательских институтов, инжиниринговых компаний, научно-исследовательских
институтов проектирования и машиностроительной промышленностью, которая
позволит оформить идеи, ученных в металле.
Казахстану необходимо развивать нефтехимическую
отрасль для расширения номенклатуры выпускаемой продукции с высокой добавленной
стоимостью - полимеры, волокна, присадки к топливам, пестициды и др.
Учитывая реализуемые планы по реконструкции и
новому строительству на территории ШНПЗ, возможно строительство установки
гидрирования фурфурилового спирта с привязкой к энергетическим и
технологическим потокам, позволяющим за счет рекуперации и утилизации тепла
получать большее количество продуктов.
Учитываю промышленную историю
Южно-Казахстанского региона, на территории которого располагался гидролизный
завод, который в качестве сырья использовал биомассу, которая также активно
производится и сегодня, разработка катализаторов гидрирования фурфурола,
становится весьма актуальной, т.к. потребность в технологиях замкнутого цикла
не иссякнет, и возможно в новых программах индустриально-инновационного
развития Республики Казахстан появится задача строительства подобного завода.
Цель и задачи исследования. Цель данной
исследовательской работы - разработать катализаторы для гидрирования
карбонилсодержащих соединений. Исследование процесса гидрирования
карбонилсодержащих соединений проводилось на фурфуроле, который гидрируется до
фурфурилового спирта, являющегося ценным химическим продуктом.
Задачи исследования:
разработать рецептуры и методики приготовления
нанесенных и сплавных катализаторов.
определить оптимальные параметры приготовления
катализаторов.
изучить влияние температуры, давления, времени
контакта сырья с катализатором, рецептуры и структурных особенностей
катализаторов на выход целевого продукта.
Объект и предмет исследования. Объектами
исследования в данной работе являются нанесенные катализаторы, полученные путем
пропитывания носителя - диоксида кремния нитратами меди, никеля и хрома, и
сплавные катализаторы, полученные путем сплавления меди, алюминия и
железомарганцевого сплава с последующим выщелачиванием.
Предметом исследования являются показатели
селективности и активности катализатора, которые определяются температурой,
давлением, рецептурой катализатора, структурными особенностями поверхности
носителя и катализатора.
Научная новизна работы. Новизна полученных
результатов заключается в подтверждении возможности использования нанесенных и
сплавных катализаторов для промышленного производства фурфурилового спирта.
Результаты эксперимента позволили подобрать оптимальные параметры температуры,
давления и времени контакта для проведения технологического процесса.
Научная идея. Применение в качестве активных
компонентов катализаторов d-элементов, способствующих интенсификации процесса
восстановления ввиду специфического воздействия на молекулу фурфурола.
Применить в качестве носителя оксид кремния,
обладающий значительной площадью поверхности для приготовления катализаторов
гидрирования фурфурола, достичь за счет значительной внутренней поверхности
катализатора высокую степень дисперсности активного компонента и как следствие
получить высокий выход продукта, но при меньших капитальных затратах на
производство катализатора.
Практическая ценность работы. Результаты
исследования, рецептуры катализаторов могут быть использованы при разработке
технологического проекта по производству фурфурилового спирта.
Публикации и апробация работы. По материалам
магистерской диссертации опубликовано 5 научных статей: в научном журнале
«Аспект» (2013), в сборнике трудов V Международной студенческой конференции
«Нефтегазовые горизонты» (Москва, РГУ нефти и газа, 2013), в сборнике трудов XI
Международного нефтегазового студенческого форума (Алматы, КазНТУ, 2014), в
сборнике трудов 69 Международной конференции «Нефть и газ-2014» (Москва, РГУ
нефти и газа, 2014), в научном журнале «Молодой ученый» (2014).
1. Литературный обзор
.1 Производство фурфурола
Фурфурол - одни из важных исходных продуктов
органического синтеза. Единственный способ его получения в промышленности -
кислотный гидролиз богатых пентозанами сельскохозяйственных отходов и отходов
переработки древесины [4]. При производстве фурфурола технологические параметры
процесса должны обеспечивать гидролиз гемицеллюлоз и дегидратацию образующихся
пентоз. Фурфурол получают из пентозансодержащего сырья либо на специализированных
предприятиях, либо в качестве побочного продукта на предприятиях дрожжевого или
спиртодрожжевого профиля [5]. Теоретически возможный выход фурфурола из
пентозанов составляет 73%, а из пентоз - 64%. На практике выход фурфурола
существенно ниже из-за превращений его в другие соединения, выход фурфурола из
разных видов сырья представлен в таблице 1.1.
Таблица 1.1 - Выход фурфурола из
пентозансодержащего сырья
|
Сырье
|
Содержание,
масс. %
|
Средний
выход фурфурола, масс. %
|
|
пентозанов
|
урановых
кислот
|
теоретический
|
практический
|
|
Стержни
кукурузных початков
|
30-35
|
7,42
|
24
|
11
|
|
Шелуха:
|
|
|
|
|
|
овес
|
32-35
|
|
25
|
11
|
|
семя
хлопчатника
|
21-27
|
7,73
|
18
|
9
|
|
Лузга:
|
|
|
|
|
|
семя
подсолнечника
|
18-25
|
11,3
|
16
|
9
|
|
рис
|
17-20
|
4,39
|
15
|
8
|
|
Багасса
|
23-25
|
|
18
|
9
|
|
Древесина:
|
|
|
|
|
|
береза
|
22-25
|
5,71
|
17
|
8
|
|
осина
|
16-20
|
7,96
|
13
|
7
|
|
дуб
(одубина)
|
19-20
|
5,08
|
14
|
6
|
При производстве фурфурола процессы гидролиза
пентозанов и дегидратации пентоз осуществляют одновременно, без выделения
пентозного гидролизата, что связано с возможностью получения в совмещенном процессе
более высокого выхода целевого продукта [6].
Вследствие высокой реакционной способности
фурфурола достаточно высокий выход продукта может быть достигнут при соблюдении
определенных условий:
процесс должен осуществляться при условиях,
обеспечивающих максимально возможное уравнивание скоростей образования
фурфурола из пентоз и его выведения из сферы реакции;
процесс необходимо проводить при минимально
возможном количестве свободной влаги в реакторе, при небольшом слое сырья и его
интенсивном перемешивании для эффективного контакта с паром;
с повышением температуры выше 190-200°С условия
для получения фурфурола ухудшаются - снижается выход из-за возрастания потерь,
поскольку возможная скорость выведения фурфурола отстает по величине от
скорости его образования.
По типу используемого кислотного катализатора
различают следующие варианты технологии:
сернокислотный процесс - катализатором служит
серная кислота;
солевой процесс - в качестве катализаторов
используют кислые соли;
автокаталитический - катализатором являются
органические кислоты, образующиеся при гидролитических превращениях компонентов
растительной ткани [7].
Технологический процесс может проводиться в одну
(остаток от гидролиза, целлолигнин, служит топливом) или в две стадии
(целлолигнин используется для получения гексозного гидролизата). Технология
получения фурфурола включает следующие этапы:
подготовка сырья;
введение в сырье катализатора (кроме 3-го
варианта);
загрузка сырья в гидролизаппарат;
нагрев сырья до температуры реакции и отгонка
фурфурола водяным паром;
конденсация фурфуролсодержащих паров;
ректификация фурфуролсодержащих конденсатов.
Широкое практического применения фурфурола
связана с его очень высокой реакционной способностью и возможностью синтеза
соединений различных классов. На основе использования каталитических процессов
синтезируют мономеры, физиологически активные вещества и другие продукты. Чаще
всего фурфурол и его производные используются в качестве органических
растворителей [8].
Основное количество от мирового производства
фурфурола (около 50%) используется для синтеза фурфурилового спирта. На прочие
фурановые смолы идет примерно 15% фурфурола, такое же количество - для
селективной очистки смазочных масел. Остальное количество фурфурола применяется
при синтезе его многочисленных производных, различных препаратов для
сельскохозяйственного производства, медицины и других целей [9].
Наиболее важные в практическом отношении
производные получают путем гидрирования и декарбонилирования фурфурола. К
продуктам, производимым в промышленном масштабе, относятся: фурфуриловый и
тетрагидрофурфуриловые спирты, сильван, фуран, тетрагидрафуран [8].
Фурфуриловый спиртпредставляет собой ядовитую
горючую жидкость, бесцветную или светло-желтого оттенка. Смешивается с водой,
образуя нестабильные соединения, способен растворяться в целом ряде
органических растворителей. При длительном контакте с воздухом приобретает
красный цвет. Образует смолы при реакциях с кислотами. Основной способ
производства этого вида спирта- каталитическое восстановление фурфурола[8].
Тетрагидрофурфуриловый спирт- это бесцветная или
желтоватая жидкость. Молекулярная масса C6H10O2 - 102,135, температура кипения
1780С. Смешивается с водой в любых отношениях. В отличие от фурановых
соединений производные тетрагидрофуранового ряда отличаются высокой
стабильностью. В частности, срок хранения тетрагидрофурфурилового спирта 5 лет.
Тетрагидрофурфуриловый спирт находит широкое практическое применение в качестве
растворителя, добавки в моторное топливо, компонентов антифризов, как реагент
при получении пластификаторов и в других областях [8].
Сильван (2-метил фуран)- получают путем
парофазного каталитического гидрирования фурфурола. Сильван служит сырьем для
получения γ-ацетопропилового
спирта (CH3COCH2CH2CH2OH), который применяют при синтезе В1 и различных
лекарственных препаратов (акрихина, аминоакрихина). На основе сильвана также
синтезируют метилциклопропилкетон, из которого получают циклопропановые
соединения. Сильван используют также в качестве растворителя лаков, клеев, смол
[9].
Фуран и тетрагидрафуран - из фурфурола
тетрагидрафуран получают двухстадийным методом, включающим каталитическое
декарбонилирование в фуран и его гидрирование до тетрагидрафурана. Степень
конверсии фурфурола составляет 99%. Часть полученного фурана направляется на
гидрирование другую же часть применяют в синтезе производных пиррола, тиофена,
лекарственных препаратов и инсектицидов. Тетрагидрафуран является универсальным
растворителем, который находит практическое применение в различных отраслях
народного хозяйства. На основе тетрагидрафурана освоено производство
синтетического гомополимера полифурита и сополимера лапрола [10,11].
1.2 Общие понятия о процессах
гидрирования органических соединений
.2.1 Классификация реакций
гидрирования
Гидрирование (или гидрогенизация) заключается в
превращениях органических соединений под воздействием молекулярного водорода. В
ряде случаев гидрирование приводит к восстановлению кислородсодержащих веществ
[12].
Важнейшие области промышленного применения
гидрирования (гидрогенизации):
синтез аммиака;
синтез метанола из СО и Н2;
получение циклогексана и его производных;
гидрогенизация жиров;
деструктивная гидрогенизация угля с целью
получения моторных топлив;
гидрокрекинг и гидрориформинг углеводородного
сырья для получения высококачественных моторных топлив [13].
Реакции гидрирования (или гидрогенизации) можно
условно разделить на следующие группы:
Реакции первой группы противоположны реакциям
дегидрирования. При этом сохраняется первоначальное расположение атомов в цепи
и кольце. Присоединение водорода может происходить к двойной, тройной и
ароматической углерод углеродной связи или к ароматическому кольцу в целом, а
также по связи 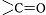 в альдегидах,
кетонах, сложных эфирах и кислотах, по связям
в альдегидах,
кетонах, сложных эфирах и кислотах, по связям  и
и
 в
азотистых соединениях и другим кратным связям.
в
азотистых соединениях и другим кратным связям.
Во вторую группу входят реакции, в которых
восстановление органических соединений сопровождается выделением веществ,
содержащих атомы кислорода, азота, серы, хлора и т. д. В реакциях третьей
группы могут принимать участие алифатические, нафтеновые и алкилароматические
углеводороды. При реакциях сопряженного гидрирования дегидрирования или при
гидрировании связанным водородом происходит перераспределение водорода между
двумя молекулами (одна из них отщепляет водород, а другая присоединяет его).
Эти реакции имеют большое значение при каталитическом крекинге, когда
непредельные углеводороды гидрируются за счет глубокого обезводороживания и
превращения части сырья в «кокс», и при каталитическом риформинге [14].
1.2.2 Факторы, влияющие на скорость
гидрирования
Для получения достаточно высокой фактической
конверсии реагентов в процессах гидрирования необходимо выбрать условия, при
которых достигается возможно более выгодное положение равновесия, зависящее от
термодинамических факторов.
По способности к гидрированию разные классы
соединений располагаются в следующие ряды: олефины> ацетиленовые
углеводороды> ароматические
углеводороды>альдегиды>кетоны>нитрилы> карбоновые кислоты [13].
Температура (термодинамика реакций гидрирования)
В расчете на одну молекулу прореагировавшего
водорода наибольший тепловой эффект наблюдается при гидрировании соединений с
тройной связью, затем соединений с двойной связью в непредельных углеводородах
приведенной в таблице 1.2. В случае двойной связи в ароматическом кольце
тепловой эффект значительно ниже.
При гидрировании двойной связи между углеродом и
кислородом в карбонильных соединениях тепловой эффект ниже, чем для двойной
углерод углеродной связи. Гидрирование альдегидов более экзотермично, чем
кетонов. Близкое значение имеет тепловой эффект при гидрировании кратных связей
между углеродом и азотом. Наименьший тепловой эффект наблюдается при
гидрировании кислот и деструктивном гидрировании углерод углеродной связи.
Равновесная глубина гидрирования увеличивается при понижении температуры.
Термодинамически наиболее благоприятно протекает гидрирование ацетиленовых
производных и в наименьшей степени гидрирование кислот. Температура оказывает
сравнительно умеренное влияние на скорость гидрирования. Обычно энергия
активации не превышает 40-65 кДж/моль. Это означает, что для увеличения
скорости реакции вдвое необходимо поднять температуру на 30-500С, что
соответствует энергии активации 21-42 кДж/моль [14].
Таблица 1.2 - Термодинамика реакций гидрирования
|
Реакции
гидрирования
|
Тепловой
эффект,-∆Н0298
|
|
ккал/моль
кДж/моль
|
|
RCOOH
+ 2Н2→ RCH2ОH + Н2О
|
9-10
|
38-42
|
|
-CH2-CH2-+
H2 → 2(-СН3)
|
10-15
|
42-63
|
|
R2CO
+ H2→ R2CHOH
|
~14
|
~58
|
|
RCHO
+ H2→ RCH2ОH
|
16-20
|
67-83
|
|
RCH=CH2+H2
→ RСН2СН3
|
27-32
|
113-134
|
|
RCN
+ 2H2→RCH2NH2
|
32-38
|
134-159
|
|
С6Н6
+ 3Н2→ С6Н12
|
49,3
|
206
|
|
СН≡СН
+ 2H2→ СН3-СН3
|
74,4
|
311
|
|
RNО2
+ 3H2→ RNH2 + 2Н2О
|
105-113
|
439-472
|
Процессы гидрирования из термодинамических
соображений следует проводить при возможно более низкой температуре,
позволяющей, однако, достичь приемлемой скорости реакции. В промышленной
практике температура колеблется от 100 до 350-4000С (в зависимости от
активности катализаторов и реакционной способности исходного вещества).
Давление
В области относительно низких температур
равновесие практически полностью смещено в сторону гидрирования, и поэтому
реакцию можно провести почти полностью при атмосферном давлении. Поскольку при
гидрировании (за исключением деструктивного) всегда происходит уменьшение
объема, для увеличения равновесной степени превращения, особенно при высокой
температуре, применяют повышенное давление. В промышленной практике используют
давления от слегка превышающих атмосферное до 30,0-70,0 МПа [15].
Соотношение реагентов
Одним из методов повышения равновесной степени
конверсии является применение избытка водорода по сравнению со
стехиометрическим, что широко используется для гидрирования в газовой фазе[15].
1.2.3 Катализаторы гидрирования
Несмотря на термические превращения, протекающие
при повышенных температурах, все реакции гидрирования являются каталитическими,
представлены в таблице 1.3. Некаталитическое гидрирование практически не
осуществляется из-за высокой энергии диссоциации связи H-H (435 кДж/моль) [13].
Катализаторы гидрирования можно разделить на следующие группы:
-металлы VIII группы (Fe, Со, Ni, Pd, Pt) и 1
группы (Сu, Ag) периодической системы элементов;
-оксиды некоторых металлов (MgO, Сr2O3,
Fе2O3-ZnO, МoО3, WО3 и др.);
-сульфиды кобальта, никеля, молибдена и
вольфрама;
-сложные катализаторы, состоящие из двух и более
металлов (Ni + Сu), из оксидов разных металлов (особенно хроматы ZnO, Сr2O3 и
СuО, Сr2O3) или сульфидов (NiS, WS3, CoS,МоS3 и др.) [14].
Практически чаще всего гидрирование ведут на
металлах. Модификация катализаторов гидрирования оксидами молибдена и вольфрама
делает их более устойчивыми к действию контактных ядов (галогены, сернистые
соединения, некоторые металлы), к которым особенно чувствительны металлические
катализаторы. Большинство процессов гидрирования являются гетерогенно
каталитическими. Только в единичных случаях для гидрирования используют
гомогенный катализ с участием солей и комплексов переходных металлов (медь и
др.) [15].
Таблица 1.3 - Катализаторы гидрирования
|
Процесс
|
Катализатор
|
|
Гидрированиеацетиленовых
углеводородов
|
Нанесенные
Ni, Pd, Ni-Pd, Co-Pd, Cu-Pd
|
|
Гидрирование
ароматических углеводородов
|
Нанесенные
Ni, Pd, Rh, Ru, Co-Mo, скелетный Ni
|
|
Гидрооблагораживание
моторных топлив
|
Ni,
Ni-Mo, Co-Mo на Аl2Оз и кизельгуре
|
|
Гидрирование
карбонильных соединений
|
Скелетные
и нанесённые Ni и Со, нанесённые Pd, Rh и Pt
|
|
Гидроочистка(гидродесульфуризация)
|
W,
Co-Mo, Co-W, Ru на Аl2Оз на углероде, карбиды Мо и W
|
|
Гидрирование
нитрилов
|
Нанесенные
Ni, Pd, Pt
|
|
Гидрирование
СО и СО2 (метанирование)
|
Нанесенные
Ni, Сu, Со, Fе, Pt, Rh, сетки Pt, карбиды Мо и W
|
Катализаторы реакций гидрирования применяются на
практике в следующих основных видах:
в мелко диспергированном состоянии (коллоидная
платина, никель и другие металлы), которое достигается путем термического
разложения или восстановления солей металлов непосредственно в реакционной
массе;
измельченные до определённого размера или
таблетированные (оксиды металлов и хроматные контакты, обычно получаемые
осаждением из солей с последующими операциями промывки, сушки и прокалки);
на носителях материалах с высокоразвитой
поверхностью (активированный уголь, оксид алюминия, пемза, кизельгур и др.),
что особенно характерно для металлических катализаторов (Ni, Pt и др.).
Их получают восстановлением водородом оксидов,
осажденных на поверхности носителя.
Наибольшее практическое значение имеют два
последних вида контактов [15].
1.2.4 Гидрирование фурфурола
Фурфурол наиболее доступное соединение
фуранового ряда. Сырьем для его производства служат отходы сельского хозяйства,
лесной и целлюлозно-бумажной промышленности. Каталитическим гидрированием
фурфурола можно получить ряд ценных продуктов:
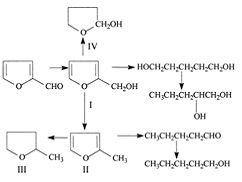
Рисунок 1.1
Гидрирование фурфурола на медных катализаторах в
парогазовой фазе является наиболее перспективным промышленным способом
получения фурфурилового спирта. Реакция протекает с высокой селективностью по
фурфуриловому спирту при температурах до 1600С в присутствии меднохромового
катализатора ВНИИНефтехим.
Контактное гидрирование фурфурола лежит в основе
процессов производства фурфурилового и тетрагидрофурилового спиртов и сильвана
(2-метилфурана). В зависимости от целевого продукта применяются катализаторы,
получаемые на основе металлов: меди, никеля, платиноидов, а также хроматов
меди. Для гидрирования фурфурола разработан ряд процессов, основные показатели
которых приведены в таблице 1.4.
Таблица 1.4 - Показатели процессов гидрирования
фурфурола
|
Показатели
|
Процессы
|
|
«Харлан»
(США)
|
СССР,
Россия
|
«Наки
Пет» (Венrрия)
|
«Квакер
Отс» (США)
|
«Шри
Рам» (Индия)
|
Польша
|
|
Давление,
МПа
|
0,2-4,2
|
30
|
25
|
0,1-0,2
|
0,1
|
0,1-1,0
|
|
Температура,
оС
|
80-130
|
60-100
|
170-320
|
170
|
140
|
140-220
|
|
Нагрузка,
кг/(лч)
|
0,04
|
0,02
|
2-5
|
-
|
0,2-0,4
|
0,2-0,6
|
|
Катализатор
|
Ni
Ренея
|
Cu-Cr
окисный
|
Cu-Cr
окисный
|
Ni
окисный
|
Cu-Cr
(Со) окисный
|
Cu-Cr
|
|
Фаза
|
Жидкая
|
Жидкая
|
Жидкая
|
Газовая
|
Газовая
|
Газовая
|
|
Степень
превращения, %
|
90-92
|
90
|
97
|
-
|
95
|
98-100
|
|
Содержание
спирта, масс. %
|
-
|
85-92
|
96-97
|
60
|
90
|
90-92
|
Процесс «НакиПет» осуществляется пропусканием
водорода через суспензию катализатора. Для получения 2-метилфурана применяется
гидрирование в паровой фазе при 210-2500С в присутствии меди Ренея. В процессе
«ШриРам» окисный катализатор СuО на пемзе регенерируют пропусканием воздуха и
активируют водородом при 2000С через 40-45 ч. Полный процесс осуществляется в
стационарном слое промотированного катализатора. Введение промотора позволяет
увеличить селективность и время работы катализатора.
В этом процессе можно регулировать соотношение
образующегося спирта и 2-метилфурана. 2-метилтетрагидрофуран наиболее
эффективно получается в результате процесса «Квакер Отс», в котором образование
нежелательных побочных продуктов подавляется введением азотистых оснований.
Высокий выход насыщенных соединений обеспечивается применением никелевых
катализаторов [15].
В настоящее время в отечественной промышленности
фурфуриловый спирт получают жидкофазным гидрированием фурфурола на оксидном
меднохромовом катализаторе. Температура 130-1500С, давление водорода 4,5-6,0
МПа, селективность 95%. При использовании медносиликатного катализатора при
температуре 1400С, давлении водорода 3,5-5,0 МПа селективность 98-99% [13].
1.3 Фурфуриловый спирт
Фурфуриловый спирт - прозрачная однородная
жидкость от бесцветного или желтоватого до темно-коричневого цвета, которая
ядовита и горюча. Температура кипения 1700С, температура вспышки 740С.
Он растворяется в воде, образуя нестабильные
соединения. Способен растворяться в целом ряде органических растворителей:
алкоголе, эфире и др., но не растворяется в парафиновом углеводороде, легко
полимеризуется с кислотой с возникновением трудноплавкой смолы. При длительном
контакте с воздухом приобретает красный цвет. Его пары с воздухом формируют
взрывную смесь.
Химическая формула: C5H6O2
Фурфуриловый спирт используется при синтезе
различных видов органических веществ: клеев, карбамидо-фурановых и
феноло-фурановых смол, в качестве растворителя нитроцеллюлозы, при изготовлении
лаков антикоррозийного назначения, защитных водоотталкивающих, антикоррозийных
покрытий, а также для повышения плотности и непроницаемости кислотоупорных
растворов. Применяется при производстве отдельных видов ракетного топлива,
синтетического волокна, резины, ядохимикатов, в литейном производстве.
Получают фурфуриловый спирт методом
каталитического гидрирования технического фурфурола в реакторе под высоким
давлением или в реакторе низкого давления в парогазовой среде с последующей
ректификацией на 2-х колонной установке, где обезвоживается и отделяется от
примесей фурфурола.
Фурфуриловый спирт - горючая жидкость.
Температура кипения 1700С, температура вспышки 740С, температура
самовоспламенения 4000С, нижний температурный предел воспламенения 610С,
верхний 117°С, нижний концентрационный предел воспламенения 1,8%, верхний
16,3%. Температура плавления -290С. При контакте с концентрированными
минеральными, сильными органическими кислотами, щелочами и кислотами Льюиса
фурфуриловый спирт способен к взрывной полимеризации. Предельно допустимая
концентрация фурфурилового спирта в воздухе рабочей зоны производственных
помещений - 0,5 мг/м2. Спирт относится к 2-му классу опасности по ГОСТ
12.1.005[16].
1.4 Катализаторы гидрирования
фурфурола в фурфуриловый спирт
.4.1 Скелетные катализаторы
Среди многочисленных катализаторов гидрирования
никель - алюминиевые сплавы (катализатор Бага) и получаемые из них путем
выщелачивания скелетные никелевые катализаторы (катализатор Ренея) находят за
последние два десятилетия весьма широкое применение и в
лабораторно-препаративной практике, и в промышленности. Это подтверждается
наличием большой патентной литературы. Широкому признанию скелетных и сплавных
никелевых катализаторов безусловно способствуют их высокая активность, низкая
стоимость (по сравнению с платиновыми и палладиевыми катализаторами),
сравнительная простота и быстрота их изготовления, хорошая теплопроводность,
легкость и скорость их активации и реактивации, высокая механическая прочность
и малая склонность к отравлению, а также возможность гидрирования многих
неустойчивых соединений, которое при употреблении других катализаторов может
сильно осложняться разнообразными побочными реакциями. Применение скелетных
катализаторов позволило во многих случаях значительно сократить
продолжительность процесса гидрирования [23].
Хотя никелевые скелетные катализаторы получили в
настоящее время наибольшее распространение и признание, естественно, не
исключено, что при последующем более глубоком изучении получат широкое
распространение и другие скелетные катализаторы (медные, железные,
кобальтовые), в том числе и в процессах гидрирования.
Как катализаторы гидрирования скелетные
никелевые катализаторы с успехом применяются для самых разнообразных целей;
кроме того, они хорошо зарекомендовали себя в качестве катализаторов
дегидрирования, окисления, дегалоидирования, обессеривания и ряда других
превращений [17].
Скелетные катализаторы используют в процессах
гидрирования сахаров, жиров, фурфурола, многоядерных хинонов и т. д. Кроме
того, они являются составной частью электродов низкотемпературных топливных
элементов, предназначенных для преобразования химической энергии в
электрическую Материалами для получения скелетных контактов служат двух - или
многокомпонентные сплавы каталитически активных металлов с такими веществами,
которые можно частично или полностью удалить при обработке растворами сильных
электролитов, отгонке в вакууме или других операциях, основанных на различии их
физико-химических свойств. По мере удаления из сплава растворимых компонентов
происходит перегруппировка атомов остающегося металла в свойственную ему кристаллическую
решетку [18].
Готовят и взвешивают основные металлы
катализатора - порошки и гранулы, а также готовят и взвешивают добавку Me.
Далее все компоненты смешивают в определенных пропорциях. Смеси металлов
отправляют в печь, где они сплавляются при температуре 1800С. Полученные сплавы
охлаждают на воздухе до комнатной температуры и отправляют на выщелачивание в
течении 2 ч. при 800С для удаления части Al из катализатора и увеличения его
внутренней поверхности.
Наиболее распространены катализаторы из сплавов
никеля с алюминием. Они отличаются высокой активностью, простотой
приготовления, хорошей теплопроводностью и высокой механической прочностью. Эти
катализаторы пирофорны, поэтому их хранят, транспортируют и работают с ними под
слоем жидкости (вода, спирт, метилциклогексан и другие) [19].
Промышленные скелетные катализаторы. В
промышленности используют два типа скелетных никелевых катализаторов -
катализатор Бага и никель Ренея (пат. США 1563787, 1628191, 1915473). Оба
получают из сплава Ni с Аl, однако, если никель Ренея представляет собой
мелкодисперсный порошок, состоящий из чистого никеля, то катализатор Бага -
кусочки никель-алюминиевого сплава (65-75% Ni и 35-25% Аl) [17].
Исходные сплавы получают чаще всего
пирометаллургическими способами- сплавлением компонентов или алюмотермией. В
последнее время используют методы порошковой металлургии- спекание
предварительно спрессованных смесей никелевых и алюминиевых порошков в
восстановительной или инертной атмосфере при 660-7000С. Реакции между двумя
твердыми телами с образованием новой твердой фазы включают процесс диффузии,
поскольку реагирующие вещества разделяются образующимся продуктом реакции.
Реагирующие вещества сохраняют постоянную активность с обеих сторон реакционной
поверхности раздела фаз, в связи с чем скорость переноса материала определяется
скоростью нарастания толщины диффузионного слоя продукта [20].
Из различных типов печей, пригодных для
получения сплава, лучшими являются высокочастотные печи с автоматическим
перемешиванием компонентов, позволяющие получать катализатор высокого качества.
Для получения активных катализаторов большое
значение имеют способ приготовления и состав сплава. При изготовлении
никелевого катализатора наиболее приемлемы сплавы, содержащие от 40 до 60%
(масс.) активного металла. Повышение содержания никеля более 60% затрудняет
разложение сплава щелочью.
Начальные стадии производства
<#"822747.files/image005.gif">
Рисунок 1.2 - Технологическая схема
получения фурфурилового спирта в паровой фазе: 1- Насадочная колонна; 2 -
циркуляционный насос; 3 - нагреватель фурфурола; 4 - пароуловитель; 5 -
паронагреватель; 6 - трубчатый реактор; 7 - насадочная колонна; 8 - насос; 9 -
водяной холодильник; 10 - компрессор; 11 - ребойлер; 12 - циркуляционный насос;
13 - паронагреватель ребойлера; 14 - вакуумная колонна; 15 - конденсатор
Фурфурол подается в испарительную часть
насадочной колонны - 1, циркуляционный насос -2 и нагреватель -3 под
напряжением пара поддерживают температуру в колонне на уровне 1200Спутем
циркуляции. Вниз насадочной колонны - 1 подается водород на смешение.
В противоточной системе, когда
водород поднимается вверх, а жидкий фурфурол стекает вниз, водород насыщается
парами фурфурола и под давлением с температурой 1200С поднимается вверх.
Полученная смесь водорода и фурфурола проходит пароуловитель - 4 и
паронагреватель - 5, после чего поступает с верху колонны в трубчатый
каталитический реактор - 6, в котором поддерживается температура 1350С при
помощи подаваемого в межтрубное пространство нагретого масла. Трубки,
заполненные медно-хромированными гранулами катализируют реакцию фурфурола с
водородом с образованием фурфурилового спирта. Реакция гидрирования фурфурола
немного экзотермична и при ее протекании выделяется 14,5 ккал/моль, поэтому
масло, текущее в межтрубном пространстве выводят избыточное тепло из системы.
Газовая смесь продуктов реакции поступает в систему конденсации, в которую
входит насадочную колонну - 7, насос - 8 и водяной холодильник -9. Насос подает
сырой фурфуриловый спирт (смесь продуктов реакции) через холодильник -9 в
насадочную колонну -7, где он встречается с противоточными продуктами в паровой
фазе. В результате тепло- и массобмена в колонне - 7 основная часть
конденсируемых веществ сжижается. Оставшаяся часть, состоящая из
непрореагировавшего водорода и некоторого количества конденсируемых веществ,
повторно сжижают компрессором-10 и вводят в трубопровод свежего водорода. Далее
сконденсированная смесь веществ подается в ребойлерную систему, включающую в
себя рибойлер-11, циркуляционный насос-12, печь ребойлера -13, работающую на
пару.
Пары продуктов поступают в вакуумную
колонну - 14. Пары уходящие с верху колонны сжижаются конденсаторе - 15. Вакуум
в колонне создается с помощью вакуумного насоса - 16. Часть конденсата
возвращается в колонну в виде флегмы, которая представляет собой смесь
2-метил-фурана, непрореагировавшего фурфурола, воды и полимерных соединений -
продуктов реакции 2-метил-фурана с водой. С куба колонны - 14 выходит товарный
фурфуриловый спирт.
На практике температура в реакторе -
6 постепенно увеличивают с 1220Сдо 1520Скомпенсируя прогрессирующее снижение
активности катализатора из-за углеродистых отложений. Типичная скорость
повышения температуры 30Св день. После 10 дней, когда температура в 1520Сбудет
достигнута, подача отключается и реактор нагревается до 2200Сдля удаления
отложений путем окисления. Затем катализатор регенерируется водородом при
1600С, после чего новый круг производства начинается с 1220С. Выход продукта
более 92%. Основной продукт-2-метил фуран. Коммерческое количество 2-метил
фурана может быть получено при более высоких температурах [45].Технологические
показатели работы реакторов парофазного гидрирования представлены в таблице
1.5.
Таблица 1.5 - Технологические
показатели работы реакторов парофазного гидрирования [13]
|
Показатели
|
Проектные
данные
|
Фактические
данные
|
|
Давление
в реакторе, МПа
|
0,12-0,13
|
0,13
|
|
Температура
в реакторе, 0С
|
165
|
150-160
|
|
Концентрация
2 этилгексеналя в сырье стадии гидрирования, %
|
91,4
|
97,0
|
|
Концентрация
в гидрогенизате, %: масляный альдегид 2-этилгексаналь
|
0,94
-
|
0,45
1,9
|
|
Степень
превращения 2-этилгексеналя, %
|
99,0
|
99,5
|
|
Выход
2этилгексанола в расчете на прореагировавший альдегид, %
|
98,0
|
99,5
|
5000
|
15000
|
Процесс получения фурфурилового спирта в жидкой
фазе
Более старый и менее элегантный процесс
получения фурфурилового спирта показан на рисунке 1.3.
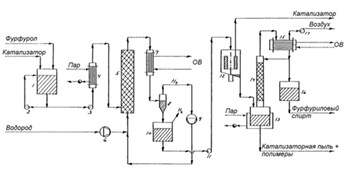
Рисунок 1.3 - Технологическая схема получения
фурфурилового спирта в жидкой фазе: 1 - резервуар; 2 - циркуляционный насос; 3
- насос; 4 - паронагреватель; 5 - реактор; 6 - компрессор; 7 - водяной
холодильник; 8 - циклон; 9 - компрессор; 10 - резервуар; 11 - насос; 12 -
центрифуга; 13 - дистиллятор; 14 - ректификационная колонна; 15 - конденсатор;
16 - резервуар; 17 - вакуумный насос
В этом процессе катализатор используется в виде
суспензии, и гидрирование проходит при давлении 20МПаи температуре 1200С[44].
Фурфурол и медно-хромированный катализатор
смешиваются в резервуаре - 1 при помощи циркуляционного насоса-2, насос-3
подает суспензию беспрерывно через паронагреватель - 4 в трубчатый реактор.
Водород, получаемый на электролизной установке из воды, впрыскивают
компрессором - 6. Смесь покидает реактор и поступает в водяной холодильник - 7
и далее уже в циклон - 8, где избыток водорода отделяется от суспензии и
закачивается в поток реактора при помощи компрессора - 9. Суспензия
сбрасывается в резервуар 10. Насосом-11 суспензия перекачивается в осадочную
центрифугу -12, где большинство частиц катализатора отделяются от жидкой фазы.
Удаление твердых частиц из чаши осуществляется вручную через определенные
промежутки времени. Жидкая фаза поступает в дистиллятор -13, а потом в
ректификационную колонну - 14. Пар с колонны сжижается в конденсаторе-15.
Продукты ректификации частично возвращаются в колонну в качестве флегмы, а
балансовое количество собирается в резервуаре -16. Этот дистиллят и есть чистый
фурфуриловый спирт. Вакуумный насос-17 поддерживает пониженное давление, чтобы
перегонка проходила при умеренных температурах. Мелкие частицы катализатора и
высококипящие полимеры, неизбежно образующиеся в реакторе и дистилляторе, сбрасываются
[45].
1.7 Применение фурфурилового спирта
.7.1 Полимеры на основе
фурфурилового спирта
Фурановые смолы на основе ФС получили очень
широкое распространение, что связано с их высокими технологическими свойствами.
В промышленных масштабах вырабатывается большое число марок смол на основе
гомо- и сополимеров ФС. Связующие на основе ФС, которые называютфурановыми,
объединяют фурфурилкарбидоформальдегидные и фурфурилфенолоформальдегидные смолы
и их различные модификации. Эти смолы имеют низкую вязкость, легко
распределяются в песке, обеспечивая хорошие технологические свойства смесей, а
стержням придают необходимую механическую прочность, достаточную термостойкость
и лёгкую выбиваемость из отливок [46].
Фурфуриловые смолы состоят в основном из ФС (85-97%)
с добавками различных компонентов: феноло- и карбамидоформальдегидов,
карбамидов, модификаторов (силанов). Фурфуриловые смолы обладают высокой
реакционной способностью, технологичностью, термостойкостью, хорошо
распределяются в песке и позволяют снизить расход связующего до 0,8- 1,2 масс.
%/100 масс. % песка. Они предназначены для изготовления стержней холодного
отверждения [47].
Отсутствие или низкое содержание азота (до 3%)
позволяет использовать их для изготовления стержней и форм при легированном
стальном и чугунном литье. Гомополимер ФС (смолу фурановую марки ПФС) получают
путем поликонденсации фурфурилового спирта в присутствии кислотного
катализатора (щавелевая, муравьиная или ортофосфорная кислоты). Продукт
представляет собой олигомер.
Путем поликонденсации ФС получают также смолу
марки ФЛ-2, которую обычно называют фуриловой смолой; смола содержит до 20-30%
несвязанного ФС. Наибольшее практическое применение из фурановых смол имеют
карбамидно-фурановые смолы, которые получаются при взаимодействии ФС с
карбамидом и формальдегидом. Смолы этого типа получают путем модифицирования
формальдегидкарбамидных смол ФС при его расходе 230-390 кг/1 т смолы (смолы
марки КФ-90, КФ-40, КФ-35). При расходе ФС 430 60 кг/т получают смолы типа
фуритол. Эти недорогие связующие используются при производстве цветного и
чугунного литья.
В промышленном масштабе вырабатываются также
фенолофурановые смолы типа ФФ, являющиеся продуктами конденсации ФС с
фенолоспиртами. Основным потребителем карбамидно-фурановых и фенолофурановых
смол является литейное производство, где они применяются в качестве связующего
для стержневых смесей. Фурановые формовочные смеси применимы в условиях
горячего и холодного отверждения, обладают высокой термостойкостью,
механической прочностью и могут применяться для всех категорий литья чугунного,
стального и цветного [48].
1.7.2 Синтезы на основе
фурфурилового спирта
ФС используется для синтеза ряда активных
медицинских препаратов. Наиболее популярным из них является противоязвенный
препарат ранитидин (торговое название «зантак») [49]. Ранитидин подавляет
базальную и стимулированную желудочную секрецию, а также секрецию соляной
кислоты и активность пепсина; его применяют при язве желудка и
двенадцатиперстной кишки, синдроме Золлингера-Эллисона и других заболеваниях,
сопровождающихся гиперсекрецией [51].
Ранитидин -
1-{2-[5-диметиламинометил-2фурфурилтио]этиламино} - 1-метиламино-2-нитроэтилен
- получают из ФС, превращенного конденсацией с диметиламином и параформом в
5-диметиламинометилфурфуриловый спирт, гидроксильная группа которого замещается
на 2-аминоэтилтиогpуппу реакцией с 2-аминоэтантиолом, после чего промежуточный
продукт конденсируется с 1-метилтио-1 (N-метиламино) -2-нитроэтиленом.
Промежуточное соединение (103) было использовано и для синтеза других
антагонистов Н2-рецепторов, например, лупитидина и Wy-45 727. Для этого его
конденсируют с соответствующими производными метилтиоурацила и 1, 1 диоксида
тиено[3,4d]изотиазола; последнее вещество в экспериментах на крысах и собаках
оказалось значительно более активным, чем ранитидин [50].
2. Объекты и методы исследования
.1 Характеристика объектов
исследования
Согласно цели работы, в качестве объектов
исследования были использованы фурфурол, вещества для приготовления нанесенных
катализаторов: диоксид кремния, нитраты меди, никеля и хрома, металлы для
приготовления сплавных катализаторов: медь, алюминий, ферромарганцевый сплав.
Физико-химические свойства фурфурола представлены в таблице 2.1.
Таблица 2.1 - Физико-химические свойства фурфурола
|
Показатель
|
Значение
|
|
агрегатное
состояние
|
жидкость
|
|
цвет
|
желтый
|
|
формула
|
C5H4O2
|
|
концентрация
фурфурола, %
|
99,5
|
|
плотность,
кг/м3
|
1156-1161
|
|
температура
кипения, 0С
|
162
|
Свойства используемого диоксида кремния
представлены в таблице 2.2.
Таблица 2.2 - Характеристики диоксида кремния
|
Показатель
|
Значение
|
|
Форма
|
таблетки,
круглая
|
|
Размер,
мм
|
диаметр
5 мм
|
|
Химическая
формула
|
SiO2
|
|
Удельная
поверхность, м2/г
|
300-500
|
|
Насыпная
плотность, кг/м3
|
753
|
Свойства нитратов меди, никеля и хрома
применяемых для приготовления растворов для пропитывания представлены в таблице
2.3.
Таблица 2.3 - Свойства нитратов
|
Показатель
|
Нитрат
меди
|
Нитрат
никеля
|
Нитрат
хрома
|
|
химическая
формула
|
Cu(NO3)2
|
Ni(NO3)2
|
Cr(NO3)3
|
|
агрегатное
состояние
|
Твердый,
крисаллический
|
Твердый,
крисаллический
|
Твердый,
крисаллический
|
|
цвет
|
Голубой
|
Светло-зелеый
|
фиолетовый
|
|
молекулярный
вес, г/моль
|
187,55
|
182,70
|
238.011
|
В качестве металлов для приготовления сплавных
катализаторов применяли гранулы меди, алюминия и стружку ферромарганцевого сплава.
Характеристика гранулированных меди и алюминия представлена в таблице 2.4.
Таблица 2.4 - Характеристика гранулированных
меди и алюминия
|
Показатель
|
Гранулы
меди
|
Гранулы
алюминия
|
|
размер,
мм
|
3-5
|
5-7
|
|
плотность,
кг/м3
|
8919-8920
|
2698-2699
|
|
температура
плавления,0С
|
1084
|
660
|
|
чистота,
%
|
99,9
|
99,9
|
|
цвет
|
золотисто-розовый
|
серебристый
|
В качестве промотирующих металлов использовался
сплав, состоящий преимущественно из железа и марганца. Характеристика
ферромарганцевого сплава представлена таблице 2.5.
Таблица 2.5 - Характеристика ферромарганцевого
сплава
|
Показатель
|
Значение
|
|
состав,
% масс.
|
Fe-30,22
Mn-69,0, остальное С,P,S
|
|
размер,
мм
|
2-5
|
|
плотность,
кг/м3
|
7250-7320
|
|
температура
плавления, 0С
|
1244-1260
|
|
цвет
|
серебристо-белый
|
2.2 Методы исследования
.2.1 Определение удельной
поверхности и пористости катализаторов методом тепловой десорбции аргона
(БЭТ-метод)
Для определения удельной поверхности дисперсных
и пористых материалов наибольшее применение получил предложенный в 1938 году
метод БЭТ, названный так по инициалам его авторов (Брунауэр, Эммет, Тейлор).
Суть метода БЭТ заключается в том, что вначале
поверхность рассматриваемых материалов освобождается от адсорбированных на них
веществ путем нагрева (проводится термотренировка образца). Затем при
температуре жидкого азота (77 К) на этих материалах адсорбируется аргон таким
образом, чтобы молекулы этих газов покрывали доступную для них поверхность
всего одним слоем (монослоем).
Зная количество газа, адсорбированного на
единице массы контролируемых материалов, а также размеры молекул газа (точнее,
их кинетические диаметры), можно рассчитать удельную поверхность по уравнению
БЭТ.
Для определения использовали удельной
поверхности и пористости использовали прибор «Сорбтометр».
Определение состава продуктов гидрирования
методом газовой хроматографии
Определения продуктов гидрирования фурфурола
осуществляли методом газовой хроматографии с детектором по теплопроводности на
хроматографе ЛХМ-80. Колонки газохроматографические, внутренний диаметр 3-4 мм,
длиной 2-2,5 мм, 2 шт., в качестве неподвижной фазы использовался полихром-1.
Проведение анализа проходило при температуре испарителя- 2250С, колонок- 1450С,
детектора- 1650С, Расход газа-носителя составлял 60см3/мин, продолжительность
анализа 20 минут.
В установившемся режиме в испаритель
хроматографа шприцем вводят пробу анализируемого продукта 3-9 мм3.
Порядок выхода компонентов смеси на хроматографе
следующий: фуран, сильван, вода, н-амиловый спирт, метилтетрагидрофурфуриловый
спирт, фурфурол, тетрагидрофурфуриловый спирт, дифурилметан, метилфурфурол,
фурфуриловый спирт, метилфурфуриловый спирт, 1,2-пентадиол.
2.2.2 Определение структуры сплавных
катализаторов методом металлографической микроскопии
Для микроскопического исследования металлов
применяются металлографические микроскопы, оптическая система которых
использует принципы отражения света. Металлографические микроскопы используются
для исследования непрозрачных объектов. Максимальное увеличение таких прибор
может составлять 1500 раз.
Принцип работы определяется тем, что структура
сплава имеет четко очерченные области зерен, агломератов, бикомпонентных
сплавов, трикомпонентных сплавов и поток света попадая на поверхность
отражается от по-разному из-за ее разнородности. В результате чего, более глубокие
участки имеют более темный цвет, выпуклые светлый. Используя данный метод можно
определять размеры однородных фаз в сплаве.
Определение размеров фаз сплавных катализаторов
осуществлялось на металлографическом микроскопе MC200(MET) с пределом
увеличения 500 раз.
2.2.3 Определение фазового состава
катализаторов методом электронной просвечивающей микроскопии
Для проведения исследований методом ПЭМ
(просвечивающей электронной микроскопией) используют электронные микроскопы,
которые представляют собой высоковольтные высоковакуумные устройства, которые
позволяют определять форму, строение вещества, размер частиц путем анализа
угловых распределений электронов, проходящих через образец.
Формирование изображения происходит в результате
прохождения пучка электронов сквозь образец, который анализируется. В методе
ПЭМ используются быстрые электроны, которые ускоряют путем прохождения пучка
через поле с напряжениям 120-250 кВ. Распространение волны электронов связано с
движением уравнением де Бройля.С помощью ПЭМ возможно получать картины
дифракции электронов - электронограммы, которые в последствии используются для
идентификации фаз при проведении фазового анализа.
Для определение фазового состава приготовленных
катализаторов методом ПЭМ использовался электронный микроскоп BS-540,
предназначенный для научных работ в современных научно-исследовательских
центрах. Микроскоп состоит из вакуумной системы (ротационный насос - 2 шт., и
диффузионный масляный насос), и электронных систем: системы освещения и системы
формирования изображения (объективная, промежуточная и проекторная линзы).
3. Экспериментальная часть
.1 Нанесенные катализаторы
гидрирования фурфурола
В настоящее время в качестве носителей
катализаторов гидрирования карбонилсодержащих соединений используются различные
носители активных компонентов. В качестве носителей активных компонентов
используется активированный уголь, обладающий высокой внутренней поверхностью,
оксид алюминия, полимеры и оксид кремния.
В настоящей магистерской диссертации в качестве
катализаторов гидрирования фурфурола в ФС использовались системы, полученные
методом пропитки оксида кремния растворами солей металлов. Оксид кремния
обладает рядом положительных свойств в отношении в качестве носителя активных
компонентов катализаторов, а именно:
высокой термической устойчивостью;
высокой механической прочностью;
распространенностью (большое количество
производств, которые выпускают SiO2 в качестве товарного продукта)
относительно низкой стоимостью
различным гранулометрическим составом, позволяющим
влиять на гидравлическое сопротивление слоя катализатора и общую поверхность.
3.2 Структура исследований по
разработке нанесенных катализаторов на диоксиде кремния
Для осуществления поставленной цели по
разработке каталитических систем для гидрирования карбонильной группы фурфурола
экспериментальное исследование делилось на 3 этапа:
Разработка каталитических систем с применением
только меди, подбор наилучших концентраций и условий проведения гидрирования (I
серия).
Модифицирование лучших образцов I серии никелем,
проведение процесса гидрирования при разных условиях (II серия).
Модифицирование лучших образцов II серии
кобальтом, проведение процесса гидрирования при разных условиях (III серия).
План проведения экспериментальных исследований
представлен в таблице 3.1.
Таблица 3.1 - Этапы проведения экспериментальных
исследований
|
Этап
|
Активный
компонент
|
Диапазон
концентрации активного компонента
|
Диапазон
температуры проведения процесса
|
Давления
водорода при проведения процесса
|
Диапазон
времени проведения процесса
|
|
I
|
Cu
|
5÷15
масс.
%
|
180÷2700С
|
2,0
МПа
|
60÷120
мин.
|
|
II
|
Сu
Ni
|
9÷13,5
масс.
% 2÷4масс.
%
|
180÷2700С
|
2,0
МПа
|
60÷120
мин.
|
|
III
|
Сu
Ni Cr
|
9÷11,5масс.
% 2 масс. % 2÷4 масс. %
|
180÷2500С
|
2,0
МПа
|
45÷75
мин.
|
|
|
|
|
|
|
|
3.3 Методика приготовление
нанесенных катализаторов
Технологический процесс приготовления
катализаторов включает в себя несколько стадий. Во-первых, готовятся растворы
солей, из которых будут получены оксиды методом прокаливания при высокой
температуре, а потом и металлы методом восстановления в среде водорода. Раствор
солей готовится различной концентрации, в нашем исследовании использовались
растворы 10% раствор Cu(NO3)2, 10% раствор Ni(NO3)2 и 10 % раствор Cr(NO3)3.
Во-вторых, готовится необходимое количество
носителя - SiO2, исходя из активного объема катализатора во всех опытах масса
SiO2 составляла 20 г. Технологический процесс приготовления катализаторов для
гидрирования фурфурола представлен на рисунке. 3.1.
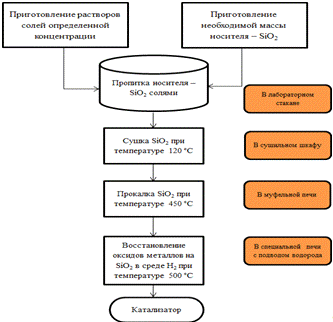
Рисунок 3.1 - Технологическая схема
приготовления катализаторов гидрирования фурфурола
Приготовление растворов солей производилось в
лабораторных условиях путем растворения навески соли в растворе
дистиллированной воды. Пропитку носителя осуществляли погружением гранул оксида
кремния в химический стакан с раствором соли. Носитель выдерживали в течении
2-3 минут и сливали раствор через фильтровальную бумагу в другой стакан. В ходе
исследования для нанесения необходимого количества соли на поверхность носителя
использовали следующие методы:
увеличение концентрации соли;
увеличение времени пропитки;
разогрев раствора соли.
Влажный носитель помещали в сушильный шкаф и
просушивали при температуре 110-1300Си выдерживали в течении 3-4 часов. Гранулы
катализатора перемешивали стеклянной палочкой во время сушки с целью более
равномерного распределения нитратов Сu, Ni, Cr по поверхности носителя.
Высушенные гранулы пересыпали в фарфоровые чашки
и отправляли в муфельную печь с целью разложение нитратов металлов до
оксидов.Время выдерживания в муфельной печи составляло 5-6 часов. Температура
прокаливания 500-5500С. Полученные гранулы катализатора представляли собой
нанесенный на поверхность оксида кремния оксид меди, никеля или хрома. С целью
перевода оксидов в металлическую форму и как следствие активации катализатора
использовалась специальная печь к которой подводился водород, и температура
нагрева составляла 5500С. Образцы помещались в эту печь, и в течении 3-4 часов
при температуре 5500С подвергались восстановлению в среде водорода.
Охлаждение образцов катализаторов осуществлялось
в печи для предотвращения взаимодействия восстановленныхметаллов с кислородом
воздуха и при достижении комнатной температуры вынимались из нее. Далее приготовленные
катализаторы взвешивались с целью определения прироста массы, который
представлял собой количество нанесенного на носитель металла. Производились
подсчеты для определения % масс. нанесенных металлов.
Для достижения необходимой рецептуры катализатора,
которая была принята на этапе разработки плана исследовательской работы,
некоторые образцы имели или большую или меньшую массу, для того чтобы получить
рецептуру необходимого состава образцы с меньшей массой подвергались вторичной
пропитке солями, но со значительно меньшими концентрациями растворов нитратов.
Полученные образцы с большей концентрацией становились образцами следующего
номера, т.к. уменьшить концентрацию на носителе с высокой точностью невозможно.
3.4 Определение удельной поверхности
катализаторов I серии
Активность катализаторов обуславливается
различными факторами, один из которых удельная поверхность, чем выше удельная
поверхность катализатора, тем более высокой степени диспергирования активных
компонентов можно достичь. Удельная поверхность приготовленных катализаторов
определялась сорбцией азота. Результаты определения удельной поверхности
представлены в таблице 3.2.
Таблица 3.2 - Удельная площадь поверхности
катализаторов I серии
|
Образец
|
Масс.
% Cu
|
Удельная
площадь поверхности катализатора, м2/г
|
|
SiO2
|
-
|
241,44
|
|
1
|
3
|
246,32
|
|
2
|
3,5
|
251,12
|
|
3
|
4
|
255,94
|
|
4
|
4,5
|
260,86
|
|
5
|
5
|
265,84
|
|
6
|
5,5
|
271,1
|
|
7
|
6
|
276,46
|
|
8
|
6,5
|
282,55
|
|
9
|
7
|
289,38
|
|
10
|
7,5
|
296,41
|
|
11
|
8
|
303,42
|
|
12
|
8,5
|
310,31
|
|
13
|
9
|
317,12
|
|
14
|
9,5
|
323,86
|
|
15
|
10
|
330,58
|
|
16
|
10,5
|
336,66
|
|
17
|
11
|
342,31
|
|
18
|
11,5
|
346,8
|
|
19
|
12
|
349,88
|
|
20
|
12,5
|
352,84
|
|
21
|
13
|
354,82
|
|
22
|
13,5
|
356,14
|
|
23
|
14
|
357,18
|
|
24
|
14,5
|
355,12
|
|
25
|
15
|
349,94
|
Для определения характера влияния концентрации
осаждаемого компонента на изменение удельной поверхности был построен график, представленный
на рисунке 3.2.

Рисунок 3.2 - Изменение удельной поверхности
носителя при нанесении меди
В диапазоне концентрации меди на носителе от 3
до 6 % масс. наблюдается постоянный прирост удельной поверхности, который может
быть объяснен образованием моно слоя меди на поверхности носителя. Скачок
прироста в диапазоне концентраций меди 6-7% масс. объясняется началом
формирование второго слоя меди на слое уже осажденной меди. В диапазоне
концентраций 10-14 % масс. меди происходит снижение прироста удельной
поверхности из-за насыщения поверхности медью. Дальнейшее увеличение
концентрации меди на носителе приведет к уменьшению общей удельной поверхности
вследствие агломерации металла, которая в свою очередь, приведет к снижению
каталитической активности.
3.5 Определение характера кластеров
меди на поверхности носителя
Образец с содержанием меди 8% масс был
проанализирован методом ПЭМ с целью определения характера распределения меди на
подложке. Микрография образца катализатора изображающая расположение кластеров
меди на поверхности диоксида кремния представлена на рисунке 3.2.

Рисунок 3.3 - Микрография образца с содержанием
Cu8 % масс
Кластеры металлической меди высокодиспергированы
на поверхности носителя, средний размер составляет 3 нм.
3.6 Исследование активности I-ой
серии катализаторов в реакции гидрирования фурфурола
Перед началом исследования необходимо был
проведен холостой опыт, для определения возможности гидрирования фурфурола без
катализатора, а также определения степени инертности носителя без
каталитических компонентов.
Раствор фурфурола 20 % об. в дистиллированной
воде заливался в реактор, реактор закрывался, в него подавался водород из
баллона, запускался нагрев реактора. Эксперимент проводился при температуре
2700С и начальное давление водорода 2,0 МПа. Было проделано 3 опыта с временем
контакта - 60, 90, 120 мин. Полученный продукт анализировался методом ВЭЖХ для
определение компонентного и количественного состава.
Результаты по выходу фурфурилового спирта при
гидрировании фурфурола без применения катализатора представлены в таблице
3.3.1. Полученные данные свидетельствуют о том, что процесс гидрирования
фурфурола в ФС идет, но высокие выходы целевого продукта, которые необходимы
для промышленного производства не достигаются.
Для установления качественного влияния носителя
на фурфурол в процессе исследований, был проделан опыт только на носителе, при
аналогичных условиях. Выход фурфурилового спирта практически повторил выход без
использования носителя, что говорит о его инертности поотношению к фурфуролу в
реакции гидрирования.
Таблица 3.3 - Выход ФС без применения
катализатора
|
Показатель/время
|
60
минут
|
90
минут
|
120
минут
|
|
Выход
ФС, % масс. (без катализатора)
|
2,41
|
4,66
|
5,14
|
|
Выход
ФС, % масс. (на носителе)
|
2,43
|
4,59
|
5,12
|
Эксперименты I серии были проведены при
температуре 1800С, давлении 2,0 МПа., времени контакта 60 минут. Результаты
гидрирования фурфурола представлены в таблице 3.4.
Таблица 3.4 - Результаты гидрирования фурфурола
при температуре 1800С и времени контакта 60 минут
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
|
1
|
3
|
1,2
|
14
|
9,5
|
7,4
|
|
2
|
3,5
|
1,9
|
15
|
10
|
7,9
|
|
3
|
4
|
2,6
|
16
|
10,5
|
8,4
|
|
4
|
4,5
|
3,1
|
17
|
11
|
9,1
|
|
5
|
5
|
3,3
|
18
|
11,5
|
9,8
|
|
6
|
5,5
|
3,7
|
19
|
12
|
10,4
|
|
7
|
6
|
4,2
|
20
|
12,5
|
11,6
|
|
8
|
6,5
|
4,6
|
21
|
13
|
12,9
|
|
9
|
7
|
5,1
|
22
|
13,5
|
13,2
|
7,5
|
5,5
|
23
|
14
|
14,6
|
|
11
|
8
|
5,9
|
24
|
14,5
|
15,9
|
|
12
|
8,5
|
6,5
|
25
|
15
|
16,7
|
|
13
|
9
|
7,1
|
|
|
|
С увеличением количества активного компонента на
поверхности носителя увеличивается выход ФС, что связано интенсификацией
процесса гидрирования. При этом, анализируя худший и лучший результат можно
отметить, что при увеличении концентрации в 5 раз, выход увеличивается в 13,91
раза, что свидетельствует о значительном влиянии количества каталитического
компонента на активность катализатора и выход целевого продукта. При времени
контакта сырья с катализатором 60 минут не удается достичь значительных выходов
ФС. Приготовленные катализаторы были испытаны при 90 минут, с целью увеличения
времени пребывания сырья на активных центрах катализатора. Результаты
эксперимента при времени контакта 90 минут представлены в таблице 3.5.
Таблица 3.5 - Результаты гидрирования фурфурола
при 180°С и времени контакта 60 минут
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
|
1
|
3
|
2,1
|
14
|
9,5
|
8,3
|
|
2
|
3,5
|
2,4
|
15
|
10
|
13,5
|
|
3
|
4
|
2,9
|
16
|
10,5
|
16,7
|
|
4
|
4,5
|
3,3
|
17
|
11
|
17,4
|
|
5
|
5
|
3,5
|
18
|
11,5
|
18,1
|
|
6
|
5,5
|
3,9
|
19
|
12
|
18,8
|
|
7
|
6
|
4,4
|
20
|
12,5
|
19,4
|
|
8
|
6,5
|
4,9
|
21
|
13
|
20,6
|
|
9
|
7
|
5,3
|
22
|
13,5
|
21,1
|
|
10
|
7,5
|
5,9
|
23
|
14
|
21,6
|
|
11
|
8
|
6,5
|
24
|
14,5
|
22,3
|
|
12
|
8,5
|
7,3
|
25
|
15
|
23,3
|
|
13
|
9
|
7,7
|
|
|
|
Анализирую полученные данные можно сделать
следующий вывод:
при увеличении времени контакта сырья с
катализатором, выход целевого продукта увеличивается;
увеличение выхода происходит планомерно с
увеличением концентрации активного компонента;
не наблюдается пиков и перегибов по выходу, что
свидетельствует возможности увеличение выхода, путем интенсификации процесса
другими технологическим параметрами.
Таким образом, для увеличения выхода ФС на
приготовленных катализаторах считаем возможным увеличение времени контакта до
120 минут, которое будет максимальным т.к. увеличение времени контакта сырья с
катализатором в промышленных условиях приведет к высоким эксплуатационным
затратам. Результаты выхода ФС при температуре 1800С и времени контакта 120
минут приведены в таблице 3.6.
Таблица 3.6 - Результаты гидрирования фурфурола
при 180°С и времени контакта 120 минут
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
|
1
|
3
|
3
|
14
|
9,5
|
20,7
|
|
2
|
3,5
|
3,3
|
15
|
10
|
20,9
|
|
3
|
4
|
3,7
|
16
|
10,5
|
21,2
|
|
4
|
4,5
|
3,9
|
17
|
11
|
21,5
|
|
5
|
5
|
4,1
|
18
|
11,5
|
22,1
|
|
6
|
5,5
|
4,7
|
19
|
12
|
22,4
|
|
7
|
6
|
10
|
20
|
12,5
|
23,2
|
|
8
|
6,5
|
12,3
|
21
|
13
|
24,4
|
|
9
|
7
|
14,5
|
22
|
13,5
|
25,3
|
|
10
|
7,5
|
14,9
|
23
|
14
|
25,4
|
|
11
|
8
|
15
|
24
|
14,5
|
26,1
|
|
12
|
8,5
|
16,4
|
25
|
15
|
27,3
|
|
13
|
9
|
20,1
|
|
|
|
Наблюдается аналогичная тенденция по увеличению
выхода целевого продукта с увеличением концентрации активного компонента и
времени контакта.
Отсутствуют пики и перегибы выходов продукта,
что дополнительно доказывает возможность увеличения выхода путем варьирования
другими технологическими параметрами. График взаимозависимости «Выход продукта
- время контакта - рецептура катализатора» представлены на рисунке 3.4.

Рисунок 3.4 - Взаимозависимость выхода ФС от
времени контакта и концентрации активного компонента
По результатам графического сравнения 3 кривых
можно сделать следующие выводы:
наблюдается рост выхода ФС с увеличением
концентрации активного компонента катализатора в рецептуре. Увеличение выхода
ФС происходит ввиду увеличения количества активных компонентов и степени
диспергирования их на поверхности на носителя;
выход ФС возрастает с увеличением времени
контакта с катализатором, что обусловлено увеличением временем пребывания сырья
в на каталитических центрах.
катализатор с одним составом дает разные выходы
ФС за разное время реакции, что указывает на возможность увеличения выхода
путем варьирования другими технологическими параметрами.
Для интенсификации процесса гидрирования было
принято увеличить температуру процесса на 500С, при этом оставить время реакции
60, 90 и 120 минут. Так как образцы №1-8 не позволили получить высокие выходы
целевого продукта, было решено прекратить использование данных каталитических
систем в исследовании и сконцентрировать внимание на образцах № 9 - 25.
Результаты гидрирования фурфурола при
температуре 2300С и времени контакта 60 мин. представлены в таблице 3.7.
Таблица 3.7 - Результаты гидрирования фурфурола
при 230°С и времени контакта 60 минут
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
|
9
|
7
|
6,9
|
18
|
11,5
|
19,3
|
|
10
|
7,5
|
8,2
|
19
|
12
|
20,8
|
|
11
|
8
|
9,7
|
20
|
12,5
|
22,2
|
|
12
|
8,5
|
11,1
|
21
|
13
|
23,6
|
|
13
|
9
|
12,7
|
22
|
13,5
|
25,8
|
|
14
|
9,5
|
13,2
|
23
|
14
|
27,8
|
|
15
|
10
|
14,8
|
24
|
14,5
|
28,3
|
|
16
|
10,5
|
16,2
|
25
|
15
|
29,1
|
|
17
|
11
|
17,8
|
|
|
|
Полученные данные эксперимента
продемонстрировали схожие закономерности в протекания процесса при повышенной
температуре. Таким образом: за счет увеличения температуры протекания процесса
увеличивается выход ФС, что обусловлено увеличением скорости реакции,
увеличение концентрации активного компонента на носителе также способствует
увеличению выхода, что обусловлено количеством активных центров на поверхности
носителя, при этом выход ФС увеличивается планомерно, без скачков. На данных
катализаторах были проведены исследования при времени контакта 90 мин.
Результаты представлены в таблице 3.8.
Таблица 3.8 - Результаты гидрирования фурфурола
при 2300С и времени контакта 90 минут
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
|
9
|
7
|
8,1
|
18
|
11,5
|
31,1
|
|
10
|
7,5
|
9,8
|
19
|
12
|
33,8
|
|
11
|
8
|
13,6
|
20
|
12,5
|
34,9
|
|
12
|
8,5
|
16,1
|
21
|
13
|
36,6
|
|
13
|
9
|
18,9
|
22
|
13,5
|
36,9
|
|
14
|
9,5
|
21,1
|
23
|
14
|
37,3
|
|
15
|
10
|
23,6
|
24
|
14,5
|
37,3
|
|
16
|
10,5
|
26,4
|
25
|
15
|
37,2
|
|
17
|
11
|
27,9
|
|
|
|
Данные представленные в таблице указывают на
немаловажное значение времени контакта сырья и катализатора на выход продукта.
При концентрации активного компонента - меди, более 12% масс. выход продукта
практически выходит на плато, что может свидетельствовать о изменении
лимитирующей стадии в процессе, а именно о переходе главенствующей роли в
процессе от кинетической стадии к диффузионной. Результаты по выходу
фурфурилового спирта при времени контакта 120 минут представлены в таблице 3.9.
Таблица 3.9 - Результаты гидрирования фурфурола
при 2300С и времени контакта 120 минут
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
|
9
|
7
|
17,5
|
18
|
11,5
|
40,1
|
|
10
|
7,5
|
20,2
|
19
|
12
|
41,4
|
|
11
|
8
|
23,1
|
20
|
12,5
|
43,5
|
|
12
|
8,5
|
26,3
|
21
|
13
|
44,7
|
|
13
|
29,5
|
22
|
13,5
|
42,4
|
|
14
|
9,5
|
31,9
|
23
|
14
|
42,1
|
|
15
|
10
|
34,1
|
24
|
14,5
|
41,8
|
|
16
|
10,5
|
36,4
|
25
|
15
|
41,3
|
|
17
|
11
|
38,8
|
|
|
|
Максимальный выход ФС был достигнут на
катализаторе с концентраций меди 13% масс. В диапазоне концентрация 11,5-15%
масс. выход целевого продукта практически не изменяется и кривая выхода
продукта выходит на плато, при этом увеличение концентрации активного компонента
более 13 % масс, приводит к незначительному снижению выхода, что может быть
связано с протеканием реакции гидрирования ФС до 2-метил-фурана и других
побочных продуктов, которые снижает его концентрацию.
По результатам, полученным на катализаторах при
температуре 2300С была построена сравнительная диаграмма «Выход продукта -
время контакта - рецептура катализатора» представленная на рисунке 3.4.
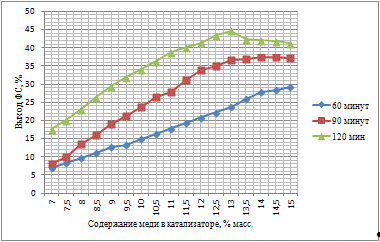
Рисунок 3.4 - Взаимозависимость выхода ФС от
времени контакта и концентрации активного компонента
По результатам графического сравнения 3 кривых
можно сделать следующий вывод:
выхода фурфурилового спирта увеличивается с
увеличением концентрации активного компонента на носителе;
выход фурфурилового спирта с увеличением времени
контакта увеличивается, но с увеличением концентрации активного компонента
скорость увеличения концентрации становится нелинейной;
с увеличением концентрации активного компонента
выше 13% масс. приводит к интенсификации процессов гидрирования ФС в 2-метил-фуран
и другие продукты.
Для увеличения выхода ФС температура проведения
процесса была увеличена на 200С до 2500С. Результаты гидрирования фурфурола при
температуре при 2500С и времени контакта 60 минут представлены в таблице 3.10.
Таблица 3.10 - Результаты гидрирования фурфурола
при 2500С и времени контакта 60 минут
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
|
9
|
7
|
10,3
|
18
|
11,5
|
26,9
|
|
10
|
7,5
|
11,4
|
19
|
12
|
29,1
|
|
11
|
8
|
12,4
|
20
|
12,5
|
31,3
|
|
12
|
8,5
|
15,6
|
21
|
13
|
33,2
|
|
13
|
9
|
17,7
|
22
|
13,5
|
34,5
|
|
14
|
9,5
|
19,8
|
23
|
14
|
33,6
|
|
15
|
10
|
21,9
|
24
|
14,5
|
33,3
|
|
16
|
10,5
|
23,1
|
25
|
15
|
33,1
|
|
17
|
11
|
25,4
|
|
|
|
Анализирую полученные данные можно сделать
следующий вывод:
при увеличении температуры процесса при
одинаковом времени выходы целевого продукта увеличиваются, максимальный выход
целевого продукта составил 34,5%;
наблюдается пик по выходу продукта, получаемый
на катализаторе с содержанием меди 13,5% масс.
снижение выхода целевого продукта на
катализаторе с содержанием меди более 13,5% масс. незначительно;
наблюдаемый пик свидетельствует о значительном
влиянии концентрации активного компонента, и как следствие структуры
поверхности на протекание процесса гидрирования.
Для катализаторов увеличили время контакта с ФС
до 90 минут и получили результаты, представленные в таблице 3.11.
Таблица 3.11 - Результаты гидрирования фурфурола
при 2500С и времени контакта 90 минут
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
|
9
|
7
|
12,3
|
18
|
11,5
|
42,5
|
|
10
|
7,5
|
15,4
|
19
|
12
|
44,7
|
|
11
|
8
|
18,3
|
20
|
12,5
|
42,4
|
|
12
|
8,5
|
20,7
|
21
|
13
|
40,1
|
|
13
|
9
|
23,1
|
22
|
13,5
|
37,7
|
|
14
|
9,5
|
25,3
|
23
|
14
|
35,4
|
|
15
|
10
|
30,1
|
24
|
14,5
|
33,3
|
|
16
|
10,5
|
33,8
|
25
|
15
|
33,1
|
|
17
|
11
|
38,2
|
|
|
|
Анализирую полученные данные можно сделать
следующий вывод:
увеличение температуры (сравнительно с
результатами выхода ФС, полученными при температуре 2300С), при одинаковом
времени контакта приводит к увеличению выхода целевого продукта в диапазоне
концентраций 7-13,5% масс. меди;
при концентрациях активного компонента более
13,5% масс. температура процесса имеет отрицательное влияние, т.к.
увеличивается выход 2-метил-фурана, который образуется из ФС, таким образом,
снижая общую концентрацию спирта в конечном анализируемом образце продукта.
пик по выходу целевого продукта более выражен и
составляет 44,7% и достигается при концентрации меди на носителе 13,5% масс.
С целью достижения максимально возможного выхода
ФС время контакта с сырьем было увеличено до 120 минут и были получены
следующие результаты, представленные в таблице 3.12.
Таблица 3.12 - Результаты гидрирования фурфурола
при 2500С и времени контакта 120 минут
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
|
9
|
7
|
17,2
|
18
|
11,5
|
38,6
|
|
10
|
7,5
|
19,7
|
19
|
12
|
37,7
|
|
11
|
8
|
22,3
|
20
|
12,5
|
36,9
|
|
12
|
8,5
|
25,1
|
21
|
13
|
35,5
|
|
13
|
9
|
27,6
|
22
|
13,5
|
33,1
|
|
14
|
9,5
|
30,1
|
23
|
14
|
31,5
|
|
15
|
10
|
33,8
|
24
|
14,5
|
30,6
|
|
16
|
10,5
|
37,2
|
25
|
15
|
29,5
|
|
17
|
11
|
39,4
|
|
|
|
Анализирую полученные данные можно сделать
следующий вывод:
увеличение выхода фурфурилового спирта
происходит с увеличением концентрации до 11% масс.
при концентрации активного компонента более 11%
масс. выход ФС снижается;
По результатам полученным на катализаторах при
температуре 2500С была построена сравнительная диаграмма «Выход продукта -
время контакта - рецептура катализатора» представленная на рисунке 3.5.
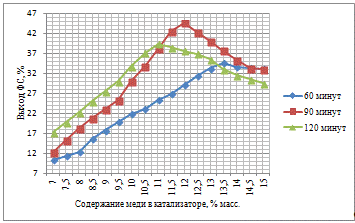
Рисунок 3.5 - Взаимозависимость выхода ФС от
времени контакта и концентрации активного компонента
По результатам графического сравнения 3 кривых
можно сделать следующий вывод:
при повышенной температуре (2500С) во всех
катализаторах наблюдается пик по выходу целевого продукта;
с увеличением времени пребывания сырья в зоне
реакции пик выхода ФС смещается в сторону меньших концентраций активного
компонента;
наибольший выход ФС достигается при времени
контакта 90 минут на катализаторе с содержанием меди 12% масс.
увеличение времени контакта сырья при высокой
температуре (2500С) приводит к снижению выхода, за счет интенсификации процесса
гидрирования ФС в 2-метил-фуран;
Для достижения максимально возможных выходов
путем ускорения процесса было решено повысить температуру процесса еще на 200С
до 2700С с неизменяемыми параметрами времени контакта, начального давления
водорода и рецептур катализаторов. Результаты гидрирования фурфурола
представлены при температуре 2700С и времени контакта 60 мин. представлены в
таблице 3.13.
Таблица 3.13 - Результаты гидрирования фурфурола
при 2700С и времени контакта 60 минут
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
|
9
|
7
|
12,8
|
18
|
11,5
|
56
|
|
10
|
7,5
|
17,4
|
19
|
12
|
58,2
|
|
11
|
8
|
22,1
|
20
|
12,5
|
55,5
|
|
12
|
8,5
|
26,3
|
21
|
13
|
51,7
|
|
13
|
9
|
30,8
|
22
|
13,5
|
49,9
|
|
14
|
9,5
|
35,3
|
23
|
14
|
47,2
|
|
15
|
10
|
40,4
|
24
|
14,5
|
45,1
|
|
16
|
10,5
|
46,7
|
25
|
15
|
44,3
|
|
17
|
11
|
51,2
|
|
|
|
Анализирую полученные данные можно сделать
следующий вывод:
при увеличении концентрации активного компонента
выход целевого продукта возрастает до определенного предела (58,2% на
катализаторе, содержащем 12% масс.), а с дальнейшим увеличением количества меди
на катализаторе падает;
повышение температуры на 20°С практически в 1,5
раза увеличивает выход ФС;
Результаты гидрирования фурфурола представлены
при 2700С и времени контакта 90 мин. представлены в таблице 3.3.12.
Таблица 3.14 - Результаты гидрирования фурфурола
при 2700С и времени контакта 90 минут
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
|
9
|
7
|
13,1
|
18
|
11,5
|
47,1
|
|
10
|
7,5
|
18,1
|
19
|
12
|
45,2
|
|
11
|
8
|
22,1
|
20
|
12,5
|
42,4
|
|
12
|
8,5
|
27,4
|
21
|
13
|
40,1
|
|
13
|
9
|
33,1
|
22
|
13,5
|
36,9
|
|
14
|
9,5
|
39,5
|
23
|
14
|
33,7
|
|
15
|
10
|
44,6
|
24
|
14,5
|
30,3
|
|
16
|
10,5
|
52,2
|
25
|
15
|
28,4
|
|
17
|
11
|
|
|
|
Анализирую полученные данные можно сделать
следующий вывод:
при увеличении концентрации активного компонента
выход целевого продукта возрастает до определенного предела (52,2% на
катализаторе, содержащем 10,5% масс.), дальнейшее снижение выхода обусловлено
образованием вторичных продуктов из ФС;
повышение температуры значительно увеличивает
выход целевого продукта;
Результаты гидрирования фурфурола представлены
при 2700С и времени контакта 120 мин. представлены в таблице 3.15.
Таблица 3.15 - Результаты гидрирования фурфурола
при 270°С и времени контакта 120 минут
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. %
|
|
9
|
7
|
13,5
|
18
|
11,5
|
35,1
|
|
10
|
7,5
|
23,8
|
19
|
12
|
33,5
|
|
11
|
8
|
29,1
|
20
|
12,5
|
31,8
|
|
12
|
8,5
|
34,7
|
21
|
13
|
30,1
|
|
13
|
9
|
43,6
|
22
|
13,5
|
28,4
|
|
14
|
9,5
|
41,1
|
23
|
14
|
26,8
|
|
15
|
10
|
39,6
|
24
|
14,5
|
25,7
|
|
16
|
10,5
|
38,3
|
25
|
15
|
25,1
|
|
17
|
11
|
36,8
|
|
|
|
Анализирую полученные данные можно сделать
следующий вывод: - при увеличении концентрации активного компонента выход
целевого продукта возрастает до определенного предела, а потом падает; -
повышение температуры значительно увеличивает выход целевого продукта (по
сравнению с результатами, полученными при 1800С).
По результатам, полученным на катализаторах была
построена сравнительная диаграмма «Выход продукта - время контакта - рецептура
катализатора», которая представлена на рисунке 3.6.
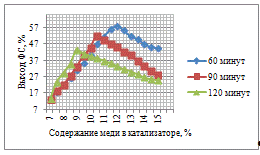
Рисунок 3.6 - Взаимозависимость выхода ФС от
времени контакта и концентрации активного компонента
По результатам графического сравнения 3 кривых
можно сделать следующий вывод:
при повышенной температуре (2700С) во всех
катализаторах наблюдается пик по выходу целевого продукта;
с увеличением времени пребывания сырья в зоне
реакции пик смещается в сторону меньших концентраций активного компонента;
наибольшие выход ФС достигается при времени
контакта 60 минут на катализаторе с содержанием меди 12% масс.
увеличение времени контакта сырья при высокой
температуре (2700С) приводит к снижению выхода, за счет интенсификации процесса
гидрирования ФС в 2-метил-фуран;
Общий вывод по серии экспериментов
Продемонстрирована возможность гидрирования
фурфурола в фурфуриловый спирт на катализаторах полученных методом пропитки
носителя - SiO2 нитратом меди.
Наибольший выход фурфурилового спирта составил
58,2%, от исходного сырья, что говорит о возможности применения данного
катализатора в промышленных целях.
При применении данного катализатора в
промышленных целях, технологическая схема должна предусматривать фракционное
разделение продуктовой смеси с отделением - ФС, как целевого продукта и
2-метил-фурана, как побочного, и возвращение непрореагировавшего фурфурола в
реактор по системе рецикла.
Варьирование технологическими параметрами:
температурой и временем контакта, а также активностью катализатора, которые
влияют на выход ФС, позволяют сделать следующие выводы:
увеличение температуры проведения процесса
приводит в увеличению выхода целевого продукта на катализаторах одного состава;
увеличение времени контакта сырья с
катализатором приводит к увеличению выхода ФС при температурах процесса до
2300С. При одновременном увеличении и температуры, и времени контакта выход ФС
достигает максимума, а потом падает, что объясняется преобладанием реакций
гидрирования ФС;
увеличение концентрации активного компонента
влияет на выход целевого продукта зависимости от технологических параметров при
которых проводился процесс, поэтому возможно привести рецептуры на которых
удалось получить сравнительно высокие выходы продуктов:
) 1800С, 120 минут, содержание Cu - 15% масс.,
выход - 27,3% масс.
) 2300С, 120 минут, содержание Cu - 13% масс.,
выход - 44,7% масс.
) 2500С, 90 минут, содержание Cu - 12% масс.,
выход - 44,7% масс.
) 2700С, 60 минут, содержание Cu - 12% масс.,
выход - 58,2% масс.
3.7 Исследование активности II-ой
серии катализаторов в реакции гидрирования фурфурола
Для увеличения выхода ФС в каталитическую
систему дополнительно был введен никель, который обладает каталитической
активностью в отношении реакций гидрирования. Технология приготовления
катализаторов не отличалась от ранее принятой. Были приготовлены рецептуры
катализаторов, которые в первой серии продемонстрировали наивысшие выходы
целевого продукта. Концентрация никеля во всех приготовленных катализаторах
составляла 2 и 4% масс. Температура варьировалась в пределах 230-2700С, время
контакта 60-120 минут. Для нанесения никеля были отобраны рецептуры I серии с
концентрацией меди 9-13,5% масс.
Для образцов I серии удельная поверхность
приготовленных катализаторов определялась сорбцией азота. Результаты
определению удельной поверхности представлены в таблице 3.16
Таблица 3.16 - Удельная площадь поверхности
катализаторов II серии
|
Образец
|
Масс.
% Cu
|
Площадь
поверхности катализатора, м2/г При концентрации Ni - 2%
|
Площадь
поверхности катализатора, м2/г При концентрации Ni - 4%
|
|
13
|
9
|
298,89
|
319,83
|
|
14
|
9,5
|
294,75
|
325,33
|
|
15
|
10
|
297,85
|
331,66
|
|
16
|
10,5
|
304,16
|
336,02
|
|
17
|
11
|
308,87
|
339,47
|
|
18
|
11,5
|
310,9
|
340,56
|
|
19
|
12
|
312,56
|
338,16
|
|
20
|
12,5
|
313,87
|
333,76
|
|
21
|
13
|
315,38
|
328,34
|
|
22
|
13,5
|
316,78
|
323,37
|
|
23
|
14
|
316,89
|
317,16
|
|
24
|
14,5
|
317,76
|
312,4
|
|
25
|
15
|
318,32
|
310,4
|
Результаты определения удельной поверхности
приготовленных катализаторов указывают на то, что никель способствует
диспергированию меди и вероятно образуются. При нанесении дополнительно 2-%
никеля на поверхность в диапазоне концентраций меди 9-15% масс. на всех
образцах наблюдается увеличение удельной площади поверхности. При нанесении
дополнительно 4-% никеля на поверхность в диапазоне концентраций 9-11% масс.
удельная поверхность возрастает, что связано с перестройкой структуры
поверхности в процессе прокаливания и восстановления в среде водорода.
Дальнейшее увеличение концентрации активных компонентов приводит к
перенасыщению поверхности, в результате чего металлы агломерируются.
На приготовленных образцах был проведен процесс
гидрирования фурфурола, результаты гидрирования фурфурола при 1800С и времени
контакта 60, 90 и 120 минут соответственно представлены в таблице 3.17
Таблица 3.17 - Результаты гидрирования фурфурола
при 1800С и времени контакта 60,90 и 120 минут
|
T
= 60 минут
|
T
= 90 минут
|
T
= 120 минут
|
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. % при концентрации Ni
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. % при концентрации Ni
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. % при концентрации Ni
|
|
|
2
%
|
4
%
|
|
|
2
%
|
4
%
|
|
|
2
%
|
4
%
|
|
13
|
9
|
11,2
|
13,9
|
13
|
9
|
19,9
|
24,5
|
13
|
9
|
23,3
|
28,7
|
|
14
|
9,5
|
13,4
|
16,1
|
14
|
9,5
|
21,8
|
26,2
|
14
|
9,5
|
25,1
|
30,3
|
|
15
|
10
|
15,7
|
17,9
|
15
|
10
|
23,7
|
24,6
|
15
|
10
|
26,9
|
32,2
|
|
16
|
10,5
|
18,1
|
20,1
|
16
|
10,5
|
25,7
|
26,5
|
16
|
10,5
|
29,2
|
33,9
|
|
17
|
11
|
20,1
|
22,2
|
17
|
11
|
27,9
|
28,6
|
17
|
11
|
31,5
|
36,1
|
|
18
|
11,5
|
22,1
|
24,5
|
18
|
11,5
|
30,1
|
30,8
|
18
|
11,5
|
33,4
|
38,6
|
|
19
|
12
|
24,6
|
26,6
|
19
|
12
|
32,6
|
33,2
|
19
|
12
|
35,7
|
40,7
|
|
20
|
12,5
|
27,1
|
29,1
|
20
|
12,5
|
35,1
|
35,8
|
20
|
12,5
|
37,9
|
42,8
|
|
21
|
13
|
28,7
|
30,6
|
21
|
13
|
37,7
|
38,7
|
21
|
13
|
40,1
|
45,1
|
|
22
|
13,5
|
29,9
|
31,3
|
22
|
13,5
|
38,1
|
42,4
|
22
|
13,5
|
41,8
|
46,7
|
Анализирую полученные данные можно сделать
следующий вывод:
при увеличении концентрации активного компонента
выход целевого продукта возрастает во всем диапазоне концентраций активного
компонента - Cu, вне зависимости от концентрации Ni;
катализаторы содержащие большее количество Ni-
4% масс. дают больший выход целевого продукта что может быть обусловлено
наличием большего количества активных центров на поверхности катализатора;
подобные закономерности наблюдаются на всех
образцах при температуре процесса 1800С вне зависимости от времени проведения
процесса;
увеличение времени проведения процесса приводит
к увеличению выхода целевого продукта, за счет более длительного контакта сырья
с катализатором;
Результаты гидрирования фурфурола при 2300С и
времени контакта 60, 90 и 120 минут соответственно представлены в таблице 3.18.
Таблица 3.18 - Результаты гидрирования фурфурола
при 2300С и времени контакта 60,90 и 120 минут
|
T
= 60 минут
|
T
= 90 минут
|
T
= 120 минут
|
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. % при концентрации Ni
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. % при концентрации Ni
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. % при концентрации Ni
|
|
|
2
%
|
4
%
|
|
|
2
%
|
4
%
|
|
|
2
%
|
4
%
|
|
13
|
9
|
21,4
|
28,3
|
13
|
9
|
29,3
|
39,4
|
13
|
9
|
33,5
|
44,8
|
|
14
|
9,5
|
23,2
|
30,1
|
14
|
9,5
|
36,4
|
47,6
|
14
|
9,5
|
38,3
|
48,9
|
|
15
|
10
|
25,1
|
32,3
|
15
|
10
|
43,2
|
54,9
|
15
|
10
|
42,8
|
52,8
|
|
16
|
10,5
|
26,8
|
34,7
|
16
|
49,1
|
61,7
|
16
|
10,5
|
47,1
|
56,6
|
|
17
|
11
|
28,7
|
36,9
|
17
|
11
|
53,9
|
64,8
|
17
|
11
|
52,6
|
60,1
|
|
18
|
11,5
|
30,8
|
39,4
|
18
|
11,5
|
57,8
|
67,4
|
18
|
11,5
|
58,8
|
63,5
|
|
19
|
12
|
32,6
|
41,8
|
19
|
12
|
61,4
|
62,5
|
19
|
12
|
62,7
|
59,3
|
|
20
|
12,5
|
34,5
|
43,2
|
20
|
12,5
|
64,9
|
59,6
|
20
|
12,5
|
60,3
|
55,2
|
|
21
|
13
|
36,6
|
43,1
|
21
|
13
|
61,2
|
55,7
|
21
|
13
|
57,7
|
51,4
|
|
22
|
13,5
|
37,4
|
42,9
|
22
|
13,5
|
58,5
|
52,3
|
22
|
13,5
|
55,5
|
48,3
|
Анализирую полученные данные можно сделать
следующий вывод:
Для времени проведения процесса 60 минут:
при увеличении концентрации активного компонента
выход целевого продукта возрастает во всем диапазоне концентраций активного
компонента - Cu, вне зависимости от концентрации Ni;
катализаторы, содержащие большее количество Ni-
4% масс. дают больший выход целевого продукта, однако на катализаторах с
концентрацией Cuболее 12,5% масс. наблюдается пик по выходу с переходом на
плато (см. выход на образцах катализаторов с концентрациейCu 12,5 - 13,5%);
выходы фурфурилового спирта на катализаторах с
большей концентрацией Ni выше;
Для времени проведения процесса 90 минут:
при концентрации Ni - 2% увеличение выхода
продукта наблюдается на катализаторах с содержанием Cu9-12,5%, при увеличении
концентрации выход начинает снижаться, что может быть обусловлено
интенсификацией процессов гидрирования фурфурилового спирта в 2-метил-фуран;
при концентрации Ni - 4% наблюдается аналогичная
закономерность, однако пик по выходу достигается при концентрации 11,5% масс.
Cu, а далее выход начинает снижаться по той же причине.
Для времени проведения процесса 120 минут:
аналогичные закономерности что и в предыдущих
2-х случаях, только пик по выходу достигается при более низких значениях
концентрации Cu в катализаторе: при 12 и 11,5% соответственно.
Результаты гидрирования фурфурола при 2500С и
времени контакта 60, 90 и 120 минут соответственно представлены в таблице 3.19.
Таблица 3.19 - Результаты гидрирования фурфурола
при 2500С и времени контакта 60,90 и 120 минут
|
T
= 60 минут
|
T
= 90 минут
|
T
= 120 минут
|
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. % при концентрации Ni
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. % при концентрации Ni
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. % при концентрации Ni
|
|
|
2
%
|
4
%
|
|
|
2
%
|
4
%
|
|
|
2
%
|
4
%
|
|
13
|
9
|
26,3
|
34,8
|
13
|
9
|
30,2
|
35,1
|
13
|
9
|
37,8
|
40,6
|
|
14
|
9,5
|
32,5
|
41,1
|
14
|
9,5
|
38,4
|
42,4
|
14
|
9,5
|
42,9
|
47,2
|
|
15
|
10
|
38,6
|
47,2
|
15
|
10
|
45,9
|
49,3
|
15
|
10
|
47,8
|
53,4
|
|
16
|
10,5
|
44,4
|
53,4
|
16
|
10,5
|
52,1
|
55,8
|
16
|
10,5
|
52,5
|
59,1
|
|
17
|
11
|
50,3
|
59,5
|
17
|
11
|
57,6
|
62,4
|
17
|
11
|
57,7
|
54,8
|
|
18
|
11,5
|
55,9
|
64,5
|
18
|
11,5
|
62,3
|
54,6
|
18
|
11,5
|
61,4
|
50,1
|
|
19
|
12
|
61,5
|
69,3
|
19
|
12
|
66,8
|
47,1
|
19
|
12
|
58,9
|
42,1
|
|
20
|
12,5
|
67,3
|
61,7
|
20
|
12,5
|
62,9
|
43,2
|
20
|
12,5
|
56,5
|
31,4
|
|
21
|
13
|
71,4
|
54,6
|
21
|
13
|
59,6
|
37,2
|
21
|
13
|
54,5
|
30,8
|
|
22
|
13,5
|
68,4
|
48,3
|
22
|
13,5
|
56,5
|
34,3
|
22
|
13,5
|
52,4
|
30,1
|
Анализирую полученные данные можно сделать
следующий вывод:
Для времени проведения процесса 60 минут:
при увеличении концентрации активного компонента
выход целевого продукта возрастает в определенном диапазоне, достигает пика, и
уменьшается;
Для концентрации Ni-2%, увеличение наблюдается
вплоть до концентрации Cu -13%, а потом происходит спад;
Для концентрации Ni -4%, увеличение наблюдается
до концентрации Cu - 12%, а потом происходит спад;
Для времени проведения процесса 90 минут:
аналогично;
Для концентрации Ni-2%, увеличение наблюдается
вплоть до концентрации Cu -12%, а потом происходит спад;
Для концентрации Ni- 4%, увеличение наблюдается
до концентрации Cu - 11%, а потом происходит спад;
Для времени проведения процесса 120 минут:
аналогично;
Для концентрации Ni-2%, увеличение наблюдается
вплоть до концентрации Cu - 11,5%, а потом происходит спад;
Для концентрации Ni-4 %, увеличение наблюдается
до концентрации Cu - 10,5%, а потом происходит спад;
При увеличении времени процесса от 60 до 120
минут при температуре 2500С максимальные выходы целевого продукта падают, что
говорит, о негативном влияние продолжительности проведения процесса при
повышенной температуре, из-за вторичных реакций гидрирования. Пики по выходам
целевого продукта свидетельствуют о взаимном влиянии концентрации активных
компонентов, времени проведения процесса и температуре.
Результаты гидрирования фурфурола при 2700С и
времени контакта 60, 90 и 120 минут соответственно представлены в таблице 3.20.
Таблица 3.20 - Результаты гидрирования фурфурола
при 2700С и времени контакта 60,90 и 120 минут
|
T
= 60 минут
|
T
= 90 минут
|
T
= 120 минут
|
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс.% при концентрации Ni
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. % при концентрации Ni
|
№
образца
|
Масс.
% Cu
|
Выход
фурфурилового спирта масс. % при концентрации Ni
|
|
|
2
%
|
4
%
|
|
|
2
%
|
4
%
|
|
|
2
%
|
4
%
|
|
13
|
9
|
31,4
|
28,1
|
13
|
9
|
35,2
|
31,6
|
13
|
9
|
34,8
|
29,1
|
|
14
|
9,5
|
36,2
|
37,3
|
14
|
9,5
|
39,4
|
39,8
|
14
|
9,5
|
33,1
|
25,5
|
|
15
|
10
|
40,7
|
44,1
|
15
|
10
|
43,5
|
37,2
|
15
|
10
|
31,1
|
22,1
|
|
16
|
10,5
|
45,1
|
41,2
|
16
|
10,5
|
41,7
|
34,7
|
16
|
10,5
|
29,4
|
18,9
|
|
17
|
11
|
49,1
|
38,5
|
17
|
11
|
39,8
|
32,4
|
17
|
11
|
27,6
|
18,4
|
|
18
|
11,5
|
45,3
|
35,4
|
18
|
11,5
|
37,6
|
23,4
|
18
|
11,5
|
26,3
|
17,8
|
|
19
|
12
|
41,4
|
32,2
|
19
|
12
|
35,6
|
22,9
|
19
|
12
|
25,4
|
17,1
|
|
20
|
12,5
|
37,2
|
25,6
|
12,5
|
34,9
|
22,1
|
20
|
12,5
|
24,3
|
16,5
|
|
21
|
13
|
32,6
|
24,5
|
21
|
13
|
34,2
|
21,3
|
21
|
13
|
23,2
|
15,9
|
|
22
|
13,5
|
29,1
|
23,8
|
22
|
13,5
|
33,4
|
20,2
|
22
|
13,5
|
22,1
|
15,2
|
Анализирую полученные данные можно сделать
следующий вывод:
Для времени проведения процесса 60 минут:
при концентрации Ni-2% масс. наблюдается пик при
концентрации Cu - 11% масс. в дальнейшем выход фурфурилового спирта снижается
за счет образования побочных нежелательных продуктов. Аналогичная картина
наблюдается при концентрации Ni-4% масс, пик по выходу приходится на концентрацию
Cu-10% и составляет 44,1% мол.
Для времени проведения процесса 90 минут:
при концентрации Ni-2% масс. наблюдается пик при
концентрации Cu - 10% масс. в дальнейшем выход фурфурилового спирта снижается
за счет образования побочных нежелательных продуктов. Аналогичная картина
наблюдается при концентрации Ni-4% масс, пик по выходу приходится на
концентрацию Cu-9,5%. На катализаторе с меньшим содержанием никеля выходу выше,
чем на катализаторах с большим содержанием никеля (4% масс.), что может указывать
на усиливающее влияние процессов гидрирования фурфурилового спирта в 2-метил
фуран при более высоких температурах проведения процесса.
Для времени проведения процесса 120 минут:
2 каталитические системы с разным содержанием
никеля при увеличении времени процесса до 120 минут при температуре процесса
2700С интенсифицируют процессы, приводящие к увеличению выхода нежелательных
продуктов реакции.
Общие выводы по серии:
На разработанных каталитических системах с
увеличением времени проведения процесса при высоких температурах протекают
побочные реакции, что приводит к снижению селективности. Увеличение
концентрации активного компонента влияет на выход целевого продукта в
зависимости от технологических параметров, поэтому приведены рецептуры на
которых удалось получить сравнительно высокие выходы продуктов:
) 1800С, 120 минут, содержание Cu -13,5% масс.,
выход при 2% масс.Ni - 41,8% мол., при 4% масс. Ni - 46,7% масс.
) 2300С, 90 минут
система 12,5% Cu + 2% Ni, выход 64,9% масс.
система 13% Cu + 4% Ni, выход 67,4% масс.
) 2500С, 60 минут
система 13% Cu + 2 % Ni, выход 71,4% масс.
система 12% Cu + 4 % Ni, выход 69,3% масс.
) 2700С, 60 минут
система 11% Cu + 2% Ni, выход 49,1% масс.
система 10% Cu + 4% Ni, выход 44,1% масс.
3.8 Исследование активности III-ей серии
катализаторов в реакции гидрирования фурфурола
Для усиления гидрирующей способности
синтезированных катализаторов в рецептуры содержащие 9÷13,5%
масс.
меди и 2% масс. никеля были введены дополнительно 2 и 4% масс. хрома.
Технология нанесения хрома аналогична ранее применяемой.
Результаты определения удельной поверхности
синтезированных катализаторов представлены в таблице 3.21.
Таблица 3.21 - Удельная площадь поверхности
катализаторов III серии
|
Образец
|
Масс.
% Cu + % Ni
|
Удельная
поверхность, м2/г при концентрации Cr - 2% масс.
|
Удельная
поверхность, м2/г при концентрации Cr - 4 % масс.
|
|
13
|
9
- 2
|
314,75
|
329,15
|
|
14
|
9,5
- 2
|
322,21
|
325,67
|
|
15
|
10
- 2
|
337,64
|
324,80
|
|
16
|
10,5
- 2
|
348,94
|
321,43
|
|
17
|
11
- 2
|
339,74
|
323,36
|
|
18
|
11,5
- 2
|
332,45
|
320,32
|
При осаждении дополнительно 2% масс. хрома
увеличение удельной поверхности наблюдается при концентрации меди 10,5% масс,
что обуславливается образованием 3 и 2 - компонентных сплавов меди, никеля и
хрома в процессе прокаливания и восстановления. При осаждении 4% масс. хрома,
на всех образцах происходит снижение удельной поверхности, что указывает
пресыщение поверхности металлами.
Полученные образцы катализаторов испытывались
при температуре 2000С и времени контакта 45-75 минут. Результаты гидрирования
фурфурола при 2000С и времени контакта 45, 60 и 75 минут соответственно
представлены в таблице 3.22.
Таблица 3.22 - Результаты гидрирования фурфурола
при 2000С и времени контакта 45,60 и 75 минут
|
T
= 45 минут
|
T
= 60 минут
|
T
= 75 минут
|
|
№
образца
|
Масс.
% Cu - % Ni
|
Выход
фурфурилового спирта масс. % при концентрации Cr
|
№
образца
|
Масс.
% Cu - % Ni
|
Выход
фурфурилового спирта масс. % при концентрации Cr
|
№
образца
|
Масс.
% Cu - % Ni
|
Выход
фурфурилового спирта масс. % при концентрации Cr
|
|
|
2
%
|
4
%
|
|
|
2
%
|
4
%
|
|
|
2
%
|
4
%
|
|
13
|
9
- 2
|
31,5
|
36,8
|
13
|
9
- 2
|
40,7
|
44,9
|
13
|
9
- 2
|
47,1
|
49,8
|
|
14
|
9,5
- 2
|
37,4
|
42,7
|
14
|
9,5
- 2
|
48,5
|
51
|
14
|
9,5
- 2
|
54,9
|
57,9
|
|
15
|
10-
2
|
43,2
|
48,6
|
15
|
10-
2
|
55,9
|
56,7
|
15
|
10-
2
|
62,5
|
75,7
|
|
16
|
10,5-
2
|
48,9
|
54,3
|
16
|
10,5-
2
|
63,3
|
69,3
|
16
|
10,5-
2
|
70,1
|
88,3
|
|
17
|
11-
2
|
54,1
|
60,2
|
17
|
11-
2
|
70,9
|
78,2
|
17
|
11-
2
|
77,2
|
79,2
|
|
18
|
11,5-
2
|
56,3
|
60,7
|
18
|
11,5-
2
|
72,1
|
76,6
|
18
|
11,5-
2
|
83,5
|
68,3
|
При времени контакта 45 минут на образцах с
содержанием Cr - 2% масс. наблюдается плавное увеличение выхода продукта, на
образцах с содержанием Cr - 4% масс. наблюдается достижением пика, и
незначительное снижение. При времени контакта 60 минут, наблюдаются аналогичные
закономерности, но из-за более длительного времени контакта сырья с
катализатором выходы ФС выше. При времени контакта 75 минут, достигнуты максимальные
выходы ФС на системах с 11,5% масс. - Cu, 2% масс. - Ni, 2% масс. - Cr, выход
на которой составил 83,5% ина системе 10,5% масс. - Cu, 2% масс. - Ni, 2% масс.
- Cr, выход на которой составил 88,3%.
3.9 Исследование влияния давления
водорода на процесс гидрирования
Давление водорода играет важную роль в процессе
гидрирования. Практически во всех промышленных процессах гидрирования
органических веществ и в процессах гидроочистки на НПЗ [52-57] количество
подводимого водорода во много раз превышает стехиометрически необходимое, это
обуславливается тем, что увеличивая давление достигается сдвиг равновесия в
сторону образования продуктов. Увеличение давления водорода способствует
снижению процессов коксообразования, происходящих на поверхности катализатора.
Исследование влияния давления водорода на выход
ФС осуществлялось на образце со следующей рецептурой 10,5% масс. -Cu, 2% масс.
-Ni, 4% масс. -Cr. Давление варьировалось в пределах 1,5-3 МПа, температура во
всех опытах составляла2200С, время проведения процесса 75 минут, результаты
определения состава продуктов представлены в таблице 3.23.
Таблица 3.23 - Влияние давления водорода на
выход ФС и 2-МФ
|
Давление,
МПа
|
Давление
на режиме, МПа
|
Выход
ФС, % масс.
|
Выход
2-МФ, % масс.
|
|
1,5
|
2,42
|
75,6
|
1,1
|
|
1,6
|
2,58
|
76,8
|
2,3
|
|
1,7
|
2,74
|
79,1
|
2,9
|
|
1,8
|
2,91
|
82,6
|
3,7
|
|
1,9
|
3,07
|
85,2
|
4,2
|
|
2,0
|
3,23
|
88,3
|
4,0
|
|
2,1
|
3,39
|
88,5
|
5,1
|
|
2,2
|
3,55
|
89,0
|
6,1
|
|
2,3
|
3,71
|
89,1
|
6,9
|
|
2,4
|
3,87
|
89,1
|
7,1
|
|
2,5
|
4,04
|
84,6
|
8,6
|
|
2,6
|
4,2
|
81,2
|
9,4
|
|
2,7
|
4,36
|
78,3
|
10,8
|
|
2,8
|
4,52
|
76,3
|
12,6
|
|
2,9
|
4,68
|
72,3
|
14,8
|
|
3,0
|
4,84
|
69,2
|
17,9
|
Как видно из результатов экспериментов при
увеличении давления до 3,7-3,9 МПа на данном технологическом режиме достигается
максимальный выход продукта, что может быть объяснено оптимальными условиями,
при которых скорость и соответственно выход продукта зависит от преимущественно
от кинетических факторов. При давлениях ниже, вероятно имеют место быть
незначительные внешнедиффузионные затруднения, которые заключаются в
недостаточном подводе молекул фурфурола к активным центрам катализатора. При
давлении выше 3,9 МПа наблюдается снижение выхода за счет задерживания молекул
ФС на каталитических центрах из-за повещенного давления с дальнейшей конверсией
в 2-метил-фуран.
Серия проведенных опытов позволила сделать
выводы, что выход ФС при гидрировании фурфурола зависит от нескольких
технологических факторов: температуры процессы, времени контакта с
катализатором и рецептуры применяемого катализатора.
Определяющими параметрами для проведения
гидрирования фурфурола с образованием ФС являются температура и свойства
применяемого катализатора. При увеличении температуры наблюдается рост выхода
ФС, что связано с интенсификацией процесса гидрирования, но подобное увеличение
напрямую зависит от активности катализатора, которая определяется его составом.
3.10 Сплавные катализаторы
гидрирования фурфурола
В настоящее время одним из перспективных
направления развития катализаторов гидрирования фурфурола являются сплавные
катализаторы, которые обладают высокими активностью, селективность, стабильностью
и достаточно простой технологией изготовления. Учитываю тот факт, что все
необходимые металлы для изготовления подобных катализаторов добываются в
Казахстане разработка сплавных катализаторов и как следствие отечественных
технология становится актуальной.
В данной части магистерской диссертации в
качестве катализаторов гидрирования фурфурола в ФС использовались системы,
полученные методом сплавления Al, Cu, Fe-Mn сплава с последующим выщелачиванием
для развития внутренней поверхности катализатора. Было приготовлено 6 образцов
катализаторов с концентрацией Fe-Mn сплава 1÷10% масс.
3.11 Структура исследований по
разработке сплавных катализаторов гидрирования фурфурола
Для осуществления поставленной цели по
разработке каталитических систем для гидрирования карбонильной группы фурфурола
экспериментальное исследование делилось на 4 этапа:
Приготовление 6 образцов катализатора, испытание
при температуре 600С и давлении 6,0 МПа.
Испытание образцов при температуре 700С и
давлении 6,0 МПа.
Испытание образцов при температуре 800С и
давлении 6,0 МПа.
Испытание образцов при температуре 900С и
давлении 6,0 МПа.
План проведения экспериментальных исследований
представлен в таблице 3.24.
Таблица 3.24 - Этапы проведения
экспериментальных исследований
|
Этап
|
Активный
компонент
|
Диапазон
концентрации
активного компонента
|
Температура
проведения процесса
|
Давления
водорода при проведения процесса
|
Диапазон
времени
проведения процесса
|
|
I
|
Cu/Al,
Fe-Mn
|
50/50%
масс. % 1÷10 масс. %
|
600С
|
6,0
МПа
|
10÷60
мин.
|
|
II
|
Cu/Al,
Fe-Mn
|
50/50
% масс. % 1÷10 масс. %
|
700С
|
6,0
МПа
|
10÷60
мин.
|
|
III
|
Cu/Al,
Fe-Mn
|
50/50
% масс. % 1÷10 масс. %
|
800С
|
6,0
МПа
|
10÷60
мин.
|
|
IV
|
Cu/Al,
Fe-Mn
|
50/50
% масс. % 1÷10 масс. %
|
900С
|
6,0
МПа
|
10÷60
мин.
|
3.12 Методика приготовление сплавных
медных катализаторов
Технологический процесс приготовления сплавных
медных катализаторов состоит из нескольких стадий.
Взвешивают необходимое количество гранул меди,
алюминия, стружек Fe-Mn сплава. Концентрация Cu в рецептуре постоянна, путем
уменьшения содержания Al увеличивают содержание Fe-Mn сплава. Рецептуры
приготовленных катализаторов представлены в таблице 3.25.
Таблица 3.25 - Рецептуры приготовленных
катализаторов
|
Содержание
Cu, % масс.
|
Содержание
Al, % масс.
|
Содержание
Fe-Mn, % масс.
|
|
50
|
50
|
-
|
|
50
|
49
|
1
|
|
50
|
47
|
3
|
|
50
|
45
|
5
|
|
50
|
43
|
7
|
|
50
|
42
|
8
|
|
50
|
40
|
10
|
После приготовления смесей металлов производят
их сплавку в индукционной печи при температуре 1500-18000С. Сплавление металлов
в данной работе проводилось на установке индукционного нагрева разработанной
ООО «Амбит» IHM -30-8-50. Масса приготовленного образца катализатора составляла
2 г.
После сплавления металлов образцы охлаждают. Для
усиления каталитической активности приготовленных катализаторов производят
модифицирование их поверхности путем выщелачивание в растворе гидроксида натрия
при различных температурах, концентрациях и продолжительности. В результате
выщелачивания происходит химическое вымывание из структуры катализатора
алюминия, что в свою очередь приводит к образованию пор и каналов в структуре
катализатора, которые увеличивают удельную поверхность и как следствие
каталитическую активность. Подбор оптимальной температуры и концентрации
раствора для выщелачивания является важной частью активации катализатора, так
как от параметров его проведения зависят структурные характеристики получаемых
образцов.
3.13 Определение оптимальных условий
для активации сплавных катализаторов
На каталитическую активность сплавных
катализаторов существенное влияние оказывают температура и концентрация щелочи.
Установлено, что повышение температуры и уменьшение длительности выщелачивания
приводят к увеличению количества алюминия в катализаторе, что в свою очередь
положительно сказывается на силе адсорбционного взаимодействия поверхности с
водородом, который необходим для гидрирования карбонильной группы, которая
также адсорбируется поверхностью катализатора.
В настоящей магистерской диссертации было
проведено исследование по подбору оптимальных параметров процесса выщелачивания
приготовленных катализаторов. В таблице 3.26 приведены данные по изменению
свойств скелетного катализатора в зависимости от концентрации щелочи,
температуры и длительности выщелачивания исходного сплава. В качестве образца,
на котором проводилось исследование влияния параметров выщелачивания был выбран
катализатор с содержанием Fe-Mn сплава - 10% масс.
Таблица 3.26 - Влияние условий выщелачивания на
удельную поверхность, дисперсность и активность скелетного катализатора
|
Условия
выщелачивания сплавов
|
Доля
фракций частиц (%) с ɳмакс.(мкм)
|
Удельная
поверхность, м2/г
|
|
1
|
3
|
5
|
7
|
|
|
Концентрация
NaOH, %
|
|
|
|
|
|
|
10
|
39
|
18
|
28
|
16
|
23,5
|
|
15
|
45
|
9
|
22
|
24
|
24,6
|
|
25
|
54
|
13
|
18
|
25,7
|
|
35
|
63
|
17
|
8
|
12
|
26,9
|
|
Температура,
0С
|
|
|
|
|
|
|
50
|
42
|
25
|
18
|
15
|
22,4
|
|
70
|
56
|
17
|
25
|
2
|
24,8
|
|
90
|
59
|
19
|
16
|
6
|
25,7
|
|
Время,
мин.
|
|
|
|
|
|
|
30
|
42
|
19
|
21
|
18
|
21,8
|
|
45
|
46
|
14
|
15
|
25
|
22,7
|
|
60
|
51
|
11
|
14
|
24
|
23,7
|
|
75
|
54
|
18
|
17
|
11
|
23,9
|
Как видно из таблицы 3.26 основные структурные
параметры катализаторов: дисперсность, удельная поверхность и активность,
достигают максимальных значений при концентрации щелочи 35-% масс., температуре
70-900С и продолжительности выщелачивания 60-75 минут. Таким образом, свойства
скелетного катализатора напрямую зависят от условий его активации. На основании
полученных результатов все приготовленные катализаторы выщелачивались при
вышеуказанных условиях.
3.14 Исследование активности
сплавных катализаторов в реакции гидрирования фурфурола
Процесс гидрирования фурфурола в фурфуриловый
спирт является гетерогенной каталитической реакцией, протекающей в жидкой фазе.
Так как реакционная система состоит из 3 фаз: твердая - катализатор, жидкая -
продуктово-сырьевой раствор, газовая - водород, то лимитирующей стадией
процесса в зависимости от технологических параметров может быть
внешнедиффузионная область (диффузия водорода в раствор фурфурола), кинетическая
(химическое взаимодействие фурфурола с водородом) или внутри диффузионная
(десорбция продукта из пор катализатора).
Протекание гетерогенных реакций в кинетической
области зависит от количества катализатора. Обобщая литературные источники
можно прийти к выводу о том, что скорость химической реакции увеличивается
пропорционально количеству активных компонентов, и это свидетельствует о
протекании реакции в кинетической области. В случае, когда скорость
гидрирования растет медленнее, чем количество катализатора - процесс протекает
в диффузионной области. При малых количествах катализатора реакция в
большинстве случаев протекает в кинетической области, постепенное снижение
скорости реакции с ростом количества катализатора свидетельствует об ее
переходе в диффузионную область. Учитывая тот факт, что одним из реагирующих
веществ является газ, то в присутствии больших количеств катализатора наиболее
медленной стадией может быть растворение газа в жидкости.
Для установления области протекания реакции
гидрирования были изучены зависимости скорости реакции гидрирования фурфурола
от количества, введенного Fe-Mn сплава в катализатор. Приготовленные
каталитические системы испытывались при давлении 6,0 МПа и температуре 600С.
Результаты гидрирования фурфурола с определением выхода ФС на различных стадиях
процесса представлены в таблице 3.27.
Таблица 3.27 - Результаты гидрирования фурфурола
при температуре 600С, давлении 6,0 МПа в различные промежутки времени
|
Количество
Fe-Mn, % масс.
|
Выход
ФС (%) во времени (мин.)
|
|
10
|
20
|
30
|
40
|
50
|
60
|
|
1
|
2,9
|
7,6
|
16,8
|
23,8
|
29,5
|
39,5
|
|
3
|
3,7
|
10,4
|
19,7
|
26,8
|
32,7
|
43,1
|
|
5
|
4,6
|
17,4
|
32,7
|
41,5
|
48,9
|
54,8
|
|
7
|
10,4
|
24,6
|
35,6
|
53,8
|
61,4
|
66,4
|
|
8
|
12,7
|
29,8
|
43,7
|
59,7
|
67,3
|
75,9
|
|
10
|
17,8
|
34,6
|
51,8
|
67,3
|
74,8
|
81,3
|
Как видно из таблицы, наибольший выход ФС
получен на катализаторе с введением 10% масс. Fe-Mn сплава, который составил
81,3%, что более чем в 2 раза выше, чем на катализаторе с добавкой 1% Fe-Mn
сплава, что указывает на значительное влияние Fe и Mn на процесс гидрирования.
Основываясь на данных эксперимента, были построены кривые изображающие
зависимость скорости химической реакции от времени протекания процесса,
представленные на рисунке 3.7
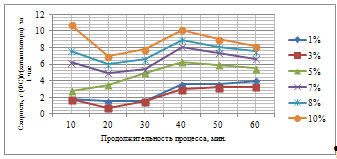
Рисунок 3.7 - Скорость гидрирования фурфурола в
фурфуриловый спирт при разном времени проведения процесса.
Как видно из графика наибольшая скорость реакции
наблюдается на образце катализатора с содержанием 10% масс. Fe-Mn сплава. Для
образцов с содержанием сплава 7-10% масс. в первые 10 минут скорость химической
реакции максимальна, что обуславливается большим количеством активных центров,
на которых в начальный период протекания процесса адсорбируется значительное
количество фурфурола, который подвергается гидрированию. Однако за последующие
10 минут скорость гидрирования падает в 2 раза из-за диффузионных затруднений,
которые вызваны блокированием активных центров ФС, реакция на данном этапе
лимитируется в диффузионной области. В течение последующих 20 минут, скорость
реакции возрастает, так как происходит диффузия ФС в среду, за счет чего
освобождаются активные центры катализатора, в этот промежуток времени реакция
лимитируется и в диффузионной, и в кинетической области. В промежутке времени
40-60 минут, скорость реакции после достижения максимума падает, что объясняется
накоплением в среде молекул ФС, и реакция снова лимитируется в диффузионной
области, потому что молекул сырья в общем растворе остается незначительное
количество.
Для образца с содержанием сплава 5% масс.
скорость химической реакции до 40 минут возрастает, после выходит на плато, что
обусловлено лимитированием реакции в кинетической области диапазоне 0-40 минут,
и в диффузионно-кинетической в области 40-60 минут.
Для образцов катализатора с содержание сплава
1-3% масс. скорость химической реакции с увеличением времени контакта
возрастает, что указывает на протекание процесса в кинетической области.
Скорости реакции сравнительно меньше чем, на других катализаторах ввиду
незначительного содержания сплава в составе.
Для определения влияния температуры на процесс
гидрирования фурфурола температура проведения процесса была увеличена до 700С.
Результаты гидрирования фурфурола с определением выхода ФС на различных стадиях
процесса представлены в таблице 3.28.
Таблица 3.28 - Результаты гидрирования фурфурола
при температуре 70°С, давлении 6,0 МПа в различные промежутки времени
|
Количество
Fe-Mn, % масс.
|
Выход
ФС (%) во времени (мин.)
|
|
10
|
20
|
30
|
40
|
50
|
60
|
|
1
|
3,2
|
8,4
|
18,5
|
26,1
|
32,3
|
43,2
|
|
3
|
4,5
|
12,6
|
21,8
|
29,8
|
35,9
|
47,4
|
|
5
|
5,9
|
21,8
|
40,9
|
51,4
|
61,6
|
68,5
|
|
7
|
13
|
30,4
|
44,7
|
53,8
|
61,4
|
66,4
|
|
8
|
16,3
|
38,3
|
56
|
76,4
|
86,3
|
97,2
|
|
10
|
20,5
|
39,9
|
59,6
|
77,4
|
86,2
|
93,5
|
На катализаторе с содержанием 8% масс. удалось
достичь 97,2% выход ФС, что свидетельствует о высокой селективности
катализатора в отношении целевого продукта. На катализаторе с содержанием 10%
масс. Fe-Mn сплава выход продукта меньше, что связано с гидрирование ФС в
побочные продукты.
Основываясь на данных эксперимента, были
построены кривые изображающие зависимость скорости химической реакции при 700С
от времени протекания процесса, представленные на рисунке 3.8.
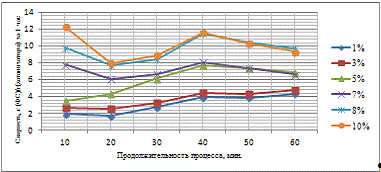
Рисунок 3.8 - Скорость гидрирования фурфурола в
фурфуриловый спирт при разном времени проведения процесса
Скорости реакций при концентрации Fe-Mn сплава в
рецептуре 8 и 10% масс. практически одинаковы. За первые 10 минут процесса
скорости реакций снижаются, что вызвано причинами, описанными ранее для
скоростей при 60 °C на этих образцах. На образце катализатора с содержанием 7%
масс. Fe-Mn сплава скорость реакции одинакова для разных участков времени, что
указывает на постоянную скоростью диффундирования ФС в реакционную массу, без
блокирования активных центров катализатора. Для образца с содержанием 5% масс.
Fe-Mn сплава скорость реакции увеличивается до 40 минут, а потом становится
постоянной, такое поведение скорости реакции обусловлено концентрациями
образующегося раствора окружающего катализатор в указанные промежутки времени.
Для образцов с содержанием 1 и 3% масс. Fe-Mn сплава кривые скоростей
практически одинаковы, отличие составляет абсолютная величина скорости реакции.
На всем промежутке времени проведения процесса скорость реакции на образцах (1
и 3% Fe-Mn сплава) возрастает, несмотря на уменьшение количества фурфурола в
реакционной массе.
Температура проведения процесса была увеличена
до 800С. Результаты гидрирования фурфурола с определением выхода ФС на
различных стадиях процесса представлены в таблице 3.29.
Таблица 3.28 - Результаты гидрирования фурфурола
при температуре 800С, давлении 6,0 МПа в различные промежутки времени
|
Количество
Fe-Mn, % масс.
|
Выход
ФС (%) во времени (мин.)
|
|
10
|
20
|
30
|
40
|
50
|
60
|
|
1
|
3,8
|
10,1
|
21,9
|
31,2
|
38,6
|
51,6
|
|
3
|
5,6
|
15,6
|
29,7
|
37,5
|
45,9
|
60,6
|
|
5
|
7,6
|
27,8
|
52,6
|
64,3
|
75,9
|
84,9
|
|
7
|
17,7
|
41,8
|
57,5
|
78,3
|
82,9
|
89,7
|
|
8
|
20,4
|
47,7
|
69,9
|
89,7
|
97,7
|
97,9
|
|
10
|
26,7
|
51,9
|
77,7
|
94,6
|
96,8
|
95,4
|
При увеличении температуры процесса еще на 100С,
на образцах с концентрацией 1-7% Fe-Mn сплава общий выход ФС увеличился и
достигает максимума за 60 минут, на образцах с содержанием 8 и 10% масс. Fe-Mn
сплава максимальные выход достигается за 50 минут. Дальнейшее незначительное
снижение ФС связано с гидрированием ФС до побочных продуктов.
Зависимость скорости химической реакции при 800С
от времени протекания процесса, представлена на рисунке 3.9.
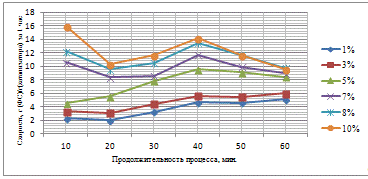
Рисунок 3.9 - Скорость гидрирования фурфурола в
фурфуриловый спирт при разном времени проведения процесса
Повышение температуры процесса положительно
сказывается для образцов с меньшей концентрацией активных компонентов. Так для
образцов с содержанием Fe-Mn сплава 1-3% масс. увеличение температуры процесса
на 100С привело увеличению скорости в 1,5 раза. Результаты гидрирования
фурфурола при 900С с определением выхода ФС на различных стадиях процесса
представлены в таблице 3.29.
катализатор микроскопия фурфурол
спирт
Таблица 3.29 - Результаты гидрирования фурфурола
при температуре 800С, давлении 6,0 МПа в различные промежутки времени
|
Количество
Fe-Mn, % масс.
|
Выход
ФС (%) во времени (мин.)
|
|
10
|
20
|
30
|
40
|
50
|
60
|
|
1
|
4,6
|
12,2
|
28,7
|
40,3
|
50,6
|
63,2
|
|
3
|
5,9
|
16,9
|
33,8
|
45,5
|
58,9
|
77,6
|
|
5
|
7,8
|
29,8
|
58,9
|
74,7
|
83,3
|
93,2
|
|
7
|
18,7
|
44,3
|
67,6
|
91,5
|
94,6
|
97,8
|
|
8
|
20,3
|
47,7
|
69,9
|
95,5
|
87,5
|
78,2
|
|
10
|
30,3
|
65,8
|
93,3
|
87,5
|
83,8
|
82,9
|
Максимальные выходы ФС, были получены при
времени контакта 40 минут на образце с содержанием 8% масс. Fe-Mn сплава,
60-минут на образце с содержанием 7% масс. Fe-Mn сплава.
Анализ скоростей реакции представленный на
рисунке 3.8.4, указывает на снижение скорости по ФС для катализаторов с
содержанием большего количества Fe-Mn сплава.
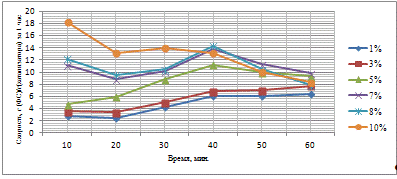
Рисунок 3.10 - Скорость гидрирования фурфурола в
фурфуриловый спирт при разном времени проведения процесса
Для катализаторов содержащих меньшее количество
Fe-Mnсплава (1-5% масс.) тенденция увеличения скорости сохранилась.
Таким образом, анализируя полученные данные
можно сделать вывод о том, что на выход ФС в значительной степени влияет
температура проведения процесса, время и состав катализатора. Путем
варьирования данными параметрами, возможно найти оптимальную температуру и
время, а также рецептуру катализатора, которая будет удовлетворять требованиям
энергоэффективности при работе в промышленных условиях.
3.15 Исследование селективности
сплавных катализаторов в реакции гидрирования фурфурола от температуры и
времени проведения процесса
Селективность является важной характеристикой
катализаторов, так как она позволяет проводить технологические процессы при
меньших капитальных затратах на оборудование для разделения целевых и побочных
продуктов процесса. Определение зависимостей селективности от времени и
температуры рассматривается на примере двух приготовленных образцов с
содержанием 3 и 10% масс. Fe-Mn сплава.
На рисунке 3.11 представлена зависимость выхода
ФС от времени и температуры процесса на катализаторе с содержанием Fe-Mn 3% масс.
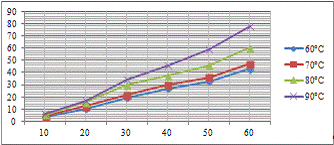
Рисунок 3.11 - Зависимость выхода ФС от времени
проведения процесса на образце, содержащем 3% масс. Fe-Mn сплава
Как видно из графика на образце с относительно
небольшим содержанием Fe-Mn сплава селективность процесса с увеличением времени
контакта возрастает, что объясняется «недостатком» каталитически активных
центров и как следствие отсутствием побочных реакций.
На рисунке 3.12 представлена аналогичная
зависимость для образца с содержанием Fe-Mn сплава 10% масс.
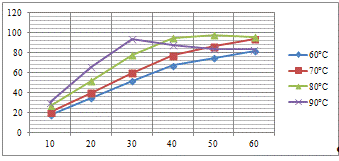
Рисунок 3.12 - Зависимость выхода ФС от времени
проведения процесса на образце, содержащем 10% масс. Fe-Mn сплава
При температуре 60 и 700С селективность процесса
возрастает с увеличением времени контакта катализатора с сырьем. При дальнейшем
увеличении температуры процесса на 100С при 40 минутах выход достигает пика, и
прямая выходит на плато, что указывает на равенство скоростей образования ФС из
фурфурола и 2-метил фурана из ФС, селективность процесса снижается.
При температуре процесса максимальный выход ФС
получен при времени контакта 30 минут, после роль вторичных процессов
становится преобладающей и выход начинает снижаться. Таким образом, можно
сделать вывод о том, что селективность по выходу ФС есть функция температуры,
времени проведения и активности катализатора.
Для удобства определения тенденций изменения
селективности процесса от времени, контакта и количества активных компонентов
катализатора были построены трехмерные диаграммы, представленные на рисунках
3.13, 3.14 для 600С и 900С.
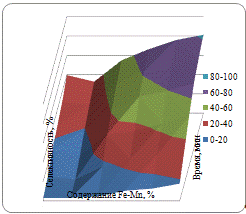
Рисунок 3.13 - Зависимость селективности
процесса гидрирования от времени контакта и концентрации активных компонентов
при 600С
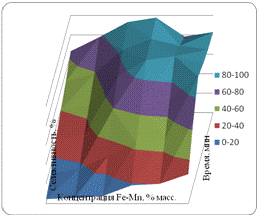
Рисунок 3.14 - Зависимость селективности
процесса гидрирования от времени контакта и концентрации активных компонентов
при 900С
При времени температуре процесса 600С процесс
гидрирования фурфурола протекает с высокой степенью селективности на образцах
катализатора с большим содержанием Fe-Mnсплава. При температуре 900С происходит
сдвиг селективности в область меньших концентраций (5-7% масс. Fe-Mn), при этом
наблюдается незначительный провал в области 8-10% масс. Fe-Mn. В целом при
увеличении температуры процесс протекает более селективно на всех образцах,
однако эффект времени играет отрицательную роль, а именно при увеличении
контакта сырья с катализатором более 40-50 минут, наблюдается спад, который
объясняется интенсификацией побочных реакций.
Таким образом, проанализировав полученные данные
эксперимента считаем целесообразным использование в промышленных условиях
образец с содержанием Fe-Mn 8% масс. при температуре 900С и давлении 6,0 МПа.
3.16 Исследование пористой структуры
катализаторов
Каталитические процессы, проходящие на твердых
катализаторах зависят от адсорбционных сил, которые возникают между
поверхностью катализатора и реагентами. При этом решающую роль играет доля
поверхности, которая доступна для образования адсорбционного взаимодействия.
Процесс выщелачивания необходим для увеличения поверхности, которое происходит
в результате химического взаимодействия алюминия и гидроксида натрия.
Для расчета величины удельной поверхности по
формуле БЭТ использовали экспериментальные точки изотерм адсорбции аргона при -
2000С, в области относительных давлений 0,05-0,35, положение прямой определяли
методом наименьших квадратов. При расчетах использовали десорбционные ветви
изотерм. Результаты анализа пористой структуры скелетных медных катализаторов
представлены в таблице 3.30.
Таблица 3.30 - Характеристика пористой структуры
катализаторов
|
Катализатор
|
SБЭТ,
м2/г
|
Sкум
м2/г
|
SБЭТ-
Sкум
/
SБЭТ, %
|
V
пор, см3/г
|
R эфф.
Å
|
|
50% - Al/50-% Cu
|
14,3
|
6,26
|
56,2
|
0,011
|
19
|
|
Fe-Mn -1%
|
17,2
|
13,86
|
19,4
|
0,049
|
25
|
|
Fe-Mn - 3%
|
19,4
|
14,8
|
23,7
|
0,052
|
27
|
|
Fe-Mn 5%
|
21,4
|
16,1
|
24,8
|
0,054
|
28
|
|
Fe-Mn
- 7%
|
23,5
|
17,45
|
25,8
|
0,059
|
31
|
|
Fe-Mn
- 8%
|
25
|
18,43
|
26,3
|
0,068
|
32
|
|
Fe-Mn
- 10%
|
17,47
|
27,5
|
0,061
|
30
|
Из приведенной выше таблицы следует, что параметры
пористой структуры протестированных катализаторов существенно отличаются от
образца без добавления Fe-Mncплава. Добавление сплава способствует увеличению
удельной поверхности до 23-25 м2/г, активного объема пор до 0,047 - 0,055
см3/г, эффективный радиус - до 28-32 Å.
Добавление Fe-Mn сплава в состав медных
катализаторов приводит к практически одинаковому воздействию на структуру
катализаторов, а именно происходит одновременное увеличение удельной
поверхности, объема пор и величины эффективных радиусов, но при этом
уменьшается доля микропор.
Заключение
Рассмотрены современные тенденции в создании
катализаторов для гидрирования фурфурола в фурфуриловый спирт. Анализ
литературного обзора позволил обосновать постановку задач исследования.
Приготовлены катализаторы гидрирования фурфурола
путем нанесения меди, никеля и хрома на диоксид кремния. Определенна их
удельная поверхность.
Нанесенные катализаторы протестированы при
различных параметрах процесса: температуре, давлении, времени контакта с
сырьем. Полученные зависимости представляют ценный материал, который может быть
использован при моделировании технологического процесса гидрирования фурфурола.
Предложены рецептуры пропиточных катализаторов,
позволяющие получать фурфуриловый спирт с более чем 95% выходом.
Приготовлены сплавные скелетные катализаторы на
основе меди с добавлением в качестве промотора ферромарганцевого сплава.
Определены удельная поверхность, объем активных
и эффективный радиус сплавных медных катализаторов.
Сплавные катализаторы протестированы при
различной температуре и времени контакта с сырьем. Определенны скорости
реакций, на основе которых определены лимитирующие стадии процесса в разное
время протекания реакции.
Предложены рецептуры сплавных катализаторов,
позволяющие получать фурфуриловый спирт с выходом 97%.
Список использованных источников
1. Морозов
Е.Ф. Производство фурфурола. М.: Лесн. пром-сть, 1988, - 200 с.
2. Холькин
Ю.И. - Технология гидролизных производств. М.: Лесн. пром-сть, 1989, - 496 с.
. Шарков
В.И., Сапотницкий С.А., Дмитриева О.А., Туманов И.Ф. Технология гидролизных
производств М.: Лесн. пром-сть, 197,3 - 408 с.
. Дудкин
М.С., Громов В.С., Ведерников Н.А., Каткевич Р.Г., Черно Н.К. Гемицеллюлозы -
Рига: Зинатне, 1991,-488 с.
5. Anastassiadis
S., Aivasidis А., Wandrey С.
Continuous gluconic acid production bу
isolated yeast-like mould strains of Aureobasidium pullulans .Аррl.
Microbiol. Biotechnol. 2003, V. 61 p. 110-117.
. Bigelis
R., Tsai S.P. Microorganisms for organic acid production. Food biotechnology microorganisms.
VСН
Publishers, Inc., 1994, p. 239-280.
7. Новый
справочник химика и технолога. Сырье и продукты промышленности органических и
неорганических веществ. ч. 1. С.Пб.: АН О НПО «Мир и Семья», АНО НПО
«Профессионал», 2002, -988 с.
. Новый
справочник химика и технолога. Сырье и продукты промышленности органических и
неорганических веществ. ч. 1. С.Пб.:
АНО
НПО
«Профессионал»,
2005,2007,-1142 с.
. Elderfield
Robert C. Heterocyclic compounds, New York, 1950.
10. Л.С.
Глебов, В.И. Келорев, В.Н. Кошелев. Промышленная органическая химия. Учебное
пособие. Часть 1. Гидрирование альдегидов и кетонов и дегидрирование спиртов,
-М.: РГУ нефти и газа, 2001.
. ГОСТ
28960-91 Фурфуриловый спирт.
. Богословский
Б.М., Казакова З.С. Скелетные катализаторы, их свойства и применение в
органической химии. М.: Госхимиздат,1967,- 133 с.
13. <http://msd.com.ua/texnologiya-katalizatorov/skeletnye-katalizatory/>
. Сеттерфилд
Ч. Практический курс гетерогенного катализа, 1984.
. Боресков
Г.К. Гетерогенный катализ. - М.: Наука,1986, -304 с.
. А.П.
Ильина. Научные основы приготовления катализаторов. Творческое наследие и
дальнейшее развитие работ профессора И.П. Кириллова, 2008
. Ч.
Томас. Промышленные каталитические процессы и эффективные катализаторы, 1973 г.
18. Keenan Lee Deutsch. Copper
catalysts in the C-O hydrogenolysis of biorenewable compounds. Iowa 2012,
p16-21.
. H. E. Hoydonckx, W. M. Van
Rhijn, W. Van Rhijn, D. E. De Vos and P. A. Jacobs, Furfural and Derivatives,
Ullmann's Encyclopedia of Industrial Chemistry, 2007.
. J. G. M. Bremner and R. K.
F. Keeys,The hydrogenation
<http://dolka-extensions.ru/SKADclick.php?url=http%3A%2F%2Fmarketgid.com%2Fghits%2F3162812%2Fi%2F5150%2F0%2Fpp%2F1%2F2%2F%23k565684%3Fh%3DXIH-WLRPnMNejYtXxgl0EpqgroB0QsrS32qBIGW0RYY*>
of furfuraldehyde to furfuryl alcohol and sylvan (2- methylfuran), J Chem Soc,
1947, 1068-1080.
. J. Wu, Y. M. Shen, C. H.
Liu, H. B. Wang, C. Geng and Z. X. Zhang, Direct catalytic conversion of
furfural to 1,5-pentanediol by hydrogenolysis of the furan ring under mild conditions
over Pt/Co2AlO4catalyst, Catal Commun, 2005, 6, 633-637.
. P.D. Vaidya and V.V.
Mahajani, Kinetics of aqueous phase catalytic hydrogenation of maleic acid to
succinic acid over a Ru/Al2O3 catalyst, Ind Eng Chem Res, 2003, 42, 3881-3885.
. T.B.L. W. Marinelli, L.
Ponec, C.G. Raab and J.A. Lercher, Furfural - hydrogen reactions, manipulation
of activity and selectivity of the catalyst
<http://casc.lic.leidenuniv.nl/publications/2250>, heterogeneous
catalysis and fine chemicals, 1993, 78, 195-202.
. X.F. Chen, H.X. Li, H.S.
Luo and M. H. Qiao, Liquid phase hydrogenation of furfural to furfuryl alcohol
over Mo-doped Co-B amorphous alloy catalysts, Appl Catal a-Gen, 2002, 233,
13-20.
. M.S. Borts, N.D. Gilchenok,
V.M. Ignatev and G.S. Gurevich, Kinetics of vapor-phase hydrogenation of
furfural on a copper-chromium catalyst J Appl Chem-Ussr+,1986, 59, 114-117.
. G. Seo and H. Chon,
Hydrogenation of furfural over copper-containing catalysts
<http://www.sciencedirect.com/science/article/pii/002195178190302X>, J
Catal, 1981, 67, 424-429.
. R. Rao, A. Dandekar, R. T.
K. Baker and M. A. Vannice, Properties of Copper Chromite Catalysts in
Hydrogenation Reactions
<http://www.sciencedirect.com/science/article/pii/S0021951797918327> J
Catal, 1997, 171, 406-419.
. Daobao Chu. Nano TiO2 film
electrode for electrocatalytic reduction of furfural in ionic liquids. Springer
Science Business Media B.V. 2009
. Beck F, Gabriel W
Heterogeneous redox catalysis on Ti/TiO2 cathodes-reduction of nitrobenzene.
Angew Chem Int Ed Engl.1985
. Chen XB, Mao SS Titanium
dioxide nanomaterial’s: synthesis, properties, modifications, and applications.
Chem Rev 107:2891-2959. 2007
. Tony Gutierrez, Marian. L.
Buszko, Lonnie O. Ingram and James F. Preston. Reduction of furfural to
furfuryl alcohol by Ethanologenic strains of bacteria and its effect on ethanol
production from xylose. Applied biochemistry and biotechnology vols 98-100,
2002
. Zeitsch Karl J. the
chemistry and technology of furfural and its many by-products - 2000
. Rodgers D. G., Comparison
of calsicat modified X-407 TU, X-407 TU, and harshaw Cu-1132 for vapor phase
hydrogenation of furfural, Publication of the Mallinckrod specialty chemicals
company, 1990.
. Sodergard O.A. Properties
of Peroxide Melt Modified Poly (L-lactide). Аbо:
Аbо
Academy University, 1996. Р 28.
. Seebach D., Brunner А.
Bachmann В.М.
Zurich: Biopolymers and oligomers of (R) 3-hydroxyalkanoic acids contribution
of synthetic organic chemists. Ernst Schering Research Foundation, 1995. р
105.
36. Т.Ф.
Костенко, В.В. Васильева, С.Л. Маслова. Использование отходов масложировых
комбинатов в питательных средах для выращивания продуцента витамина В2
кopмoвoгo. Вопросы
биотехнологии.
ч.
2. М.:
вниисэнти,
1989.
. Deppenmeier U., Hoffmeister
М.PrustС.
Biochemistry and biotechnological applications of Gluconobacter strains. Appl.
Microbiol. Biotechnol. 2002. V. 60. P.233-242.
38. М.А.
Аскаров, Б.Л. Гафуров. Синтез и полимеризация. Ташкент: ФАН, 1979. -192с.
. Каминский
Э.Ф. Хавкин В.А. Глубокая переработка нефти: технологический и экологический
аспекты. - М: Техника, 2001. -384с.
. Ахметов
С.А. Технология глубокой переработки нефти и газа. - Уфа: Гилем, 2002. -С. 672.
. Магарил
Р.З. Теоретические основы процессов переработки нефти. - М.: Химия, 1976.
-167с.
. Смидович
Е.В. Технология переработки нефти и газа. М.: Химия, 1980, -135-140 с.