|
Координаты атомов
|
K
|
La
|
Ti(1)
|
Ti(2)
|
O(1)
|
O(2)
|
O(3)
|
O(4)
|
|
x
|
0,0
|
0,0
|
0,0
|
0,0
|
0,0
|
0,0
|
0,0
|
0,0
|
|
y
|
0,0
|
0,0
|
0,0
|
0,0
|
0,5
|
0,0
|
0,5
|
0,0
|
|
z
|
0,29
|
0,43
|
0,0
|
0,14
|
0,0
|
0,06
|
0,13
|
0,20
|
.2
Процессы интеркаляции в слоистом оксиде K2La2Ti3O10
Интеркаляция - это обратимое внедрение молекулы в межслоевое пространство
другого вещества. На рисунке 5 представлен этот процесс на примере интеркаляции
воды в межслоевое пространство K2La2Ti3O10. Внедрение молекул воды
сопровождается смещением перовскитных слоёв относительно изначального положения
[4] и увеличением параметра кристаллической решётки с [5]. На одну
формульную единицу K2La2Ti3O10 при этом по разным данным приходится
1 [6,9,10] или 2 [3,5] молекулы воды.

Рис. 5 Схема интеркаляции молекул воды в межслоевое пространство K2La2Ti3O10.
Если предварительно заместить ионы калия в K2La2Ti3O10 на ионы водорода, то такой слоистый оксид способен
интеркалировать органические основания. В работе [6] проводилось внедрение
ионов 5,10,15,20-тетракис(N-метилпиридин-4-ил)-21Н, 23Н-порфина (TMPyP4+)
в межслоевое пространство K2La2Ti3O10. Исходное соединение было
синтезировано по керамической методике и обработано соляной кислотой (3 раза
вымачивалось по 24 ч в 2 М HCl) с
целью получения H2La2Ti3O10. С помощью кислотно-основной реакции
с пропиламином сначала в межслоевое пространство были введены ионы n-PrNH3+
(вещество выдерживалось в 50% водном растворе пропиламина в течение 3 недель).
Полученный в итоге (PrNH3+)xH2-xLa2Ti3O10
промывался спиртом и помещался в водный раствор TMPyP4+,
концентрацией 3 ммоль/л, на две недели при 50 °С. Затем продукт реакции промывался
водой до тех пор, пока в фильтрате не перестал обнаруживаться TMPyP4+,
который адсорбировался на поверхности слоистого оксида. После этого (TMPyP4+)xH2-4xLa2Ti3O10
был диспергирован в воде ультразвуком и нанесён на кварцевую подложку с целью
получения оптически прозрачной тонкой плёнки для изучения структуры соединения.
Элементный анализ показал, что ионный обмен между H2La2Ti3O10 и TMPyP4+ прошёл на 14%, таким образом, формула
полученного слоистого оксида: (TMPyP4+)0,07H1,72La2Ti3O10*1,3H2O.
Было рассчитано расстояние между ближайшими интеркалированными молекулами
порфирина, оно составило 2,08 нм и показано, что катионы TMPyP4+,
находясь между перовскитными слоями [La2Ti3O10]2-,
наклонены под углом 58°.
Однако существуют данные, опровергающие возможность интеркаляции
органических оснований в межслоевое пространство HxK2-xLa2Ti3O10 [8,9]. Это может быть вызвано
следующими причинами. Хотя интеркаляция проводится в соединение с
предполагаемой формулой H2La2Ti3O10, в работе [6] из дифрактограммы
полученного соединения можно сделать вывод, что замещение K+ на H+ прошло частично, то есть формула
вещества в действительности HxK2-xLa2Ti3O10. Данные, полученные в нашей лаборатории, свидетельствуют о
том, что существует обратная зависимость между количеством интеркалированной
воды и степенью замещения x.
Таким образом, вероятно, что в работах [8,9] было получено полностью замещённое
соединение x=2, благодаря чему снизилась
интеркаляционная способность вещества, а в другом исследовании [6], вещество
осталось способным к интеркаляции, так как замещение ионов калия на протоны
прошло частично (x<2).

Рис. 6 Схема ионного обмена в K2La2Ti3O10.
Ионный обмен используется для синтеза водородзамещённых
перовскитоподобных слоистых оксидов. В работе [8] авторы получили H2La2Ti3O10 из K2La2Ti3O10 путём ионного обмена и исследовали его способность к
интеркаляции органических оснований в сравнении с HCa2Nb3O10. Второй образец интеркалировал
широкий ряд органических оснований, включая анилин и пиридин, в то время как H2La2Ti3O10 не показал способности к
интеркаляции даже сильных оснований. Авторы связали это с различием в структуре
этих соединений, которое заключается в том, что для H2La2Ti3O10 наблюдается смещение перовскитных слоёв на (а+b)/2, а в соединении HCa2Nb3O10 они располагаются строго друг под
другом, благодаря чему ионы водорода, находящиеся между перовскитными слоями,
обладают большей кислотностью по Бренстеду.
Авторы [9] работы также показали, что H2La2Ti3O10 не обладает кислотными свойствами в реакциях с органическими
основаниями. Для получения полностью замещённого слоистого оксида они
выдерживали K2La2Ti3O10 в растворе 2 М HNO3 в течение 5 дней. Кроме того, ими были синтезированы
фазы H2-xLa2Ti3-xNbxO10, где 0˂x≤0,75 и x=1. На основании опытов по
интеркаляции аминов в межслоевое пространство замещённых слоистых оксидов,
авторы сделали вывод, что соединения с 0≤x≤0,75, изоструктурные с K2La2Ti3O10, не проявляют кислотных свойств из-за особенностей структуры
межслоевого пространства: сдвига перовскитных слоёв на ½
в направлении (110) и
маленького расстояния между ними. Образец с x=1, изоструктурный с HCa2Nb3O10, является слабо кислотным и
интеркалирует сильные органические основания с pKa>11,0.
В [10] подтверждается, что полное замещение ионов калия на протоны в K2La2Ti3O10 происходит при выдерживании его в 2
М азотной кислоте в течение 5 дней при 30°С (уже при 60°С структура
разрушается). Кроме того, авторы указывают на возможность обмена ионов K+ на Na+ и Li+: для этого исходное соединение обрабатывалось расплавленными
нитратами: NaNO3 в течение 2 дней и LiNO3 в течение 2 недель. Изучение H2La2Ti3O10 показало, что водородзамещённый слоистый оксид является
термически неустойчивым и разлагается при 400 °С. Разложение происходит по
реакции (1).
H2La2Ti3O10 → 3La2/3TiO3 + H2О (1)
Этот факт позволяет использовать термогравиметрический метод анализа для
характеризации частично и полностью водородзамещённых оксидов и расчёта степени
замещения x в HxK2-xLa2Ti3O10.
.4
Фотокаталитическая активность слоистых оксидов
.4.1
Фотокаталитический процесс
Согласно
определению, данному В. Н. Пармоном, «Фотокатализ - это изменение скорости или
возбуждение химических реакций под действием света в присутствии веществ
(фотокатализаторов), которые поглощают кванты света и участвуют в химических
превращениях участников реакции, многократно вступая с ними в промежуточные
взаимодействия и регенерируя свой химический состав после каждого цикла таких
взаимодействий» [11,12].
Распространёнными
фотокатализаторами для гетерогенного фотокатализа являются полупроводниковые
соединения, электронная структура которых, согласно зонной теории, состоит из
энергетических зон, содержащих доступные для электронов состояния, которые
разделены промежутками, в которых доступные состояния отсутствуют. Под термином
«запрещенная зона», в данном случае, понимают область энергий, которые не могут
иметь электроны, лежащую между высшей заполненной зоной (валентной) и низшей
свободной (зоной проводимости). Для полупроводников ширина запрещенной зоны (Eg)
составляет величину от десятых до единиц электрон-вольт.
Если
энергия квантов света, которым облучают полупроводник равна или превышает
ширину запрещённой зоны, то в полупроводнике генерируются неравновесные
носители заряда - электроны в зоне проводимости и дырки в валентной зоне. У
образовавшихся носителей есть два основных пути превращения: рекомбинация или
участие в окислительно-восстановительных процессах, если их протекание возможно
в данной системе (рис. 7).
1.4.2
Факторы, влияющие на процесс фотокатализа
Из вышесказанного видно, что ширина запрещенной зоны полупроводникового
фотокатализатора является одной из важнейших его характеристик, поскольку эта
величина соответствует минимальной энергии поглощаемого кванта света,
необходимой для генерации электрон-дырочной пары. Иными словами, ширина
запрещенной зоны определяет спектральную область действия фотокатализатора. Для
поглощения видимого света (400-700 нм) требуется значение Eg < 3
эВ. Если ширина запрещенной зоны больше, как в случае K2La2Ti3O10 (Eg =
3,5 эВ) [26,27], то такой фотокатализатор может проявлять фотокаталитическую
активность только под действием УФ излучения [13].
С другой стороны, положение верхнего заполненного и нижнего свободного
уровней определяет реакционную способность электронов и дырок. В большинстве
оксидных полупроводниковых фотокатализаторов валентная зона формируется в
основном за счет 2p-орбиталей атомов кислорода, следовательно, мало зависит от
состава катализатора, а зона проводимости - за счет вакантных d-орбиталей
металла, поэтому положение дна зоны проводимости можно изменять, варьируя
катионный состав оксида.
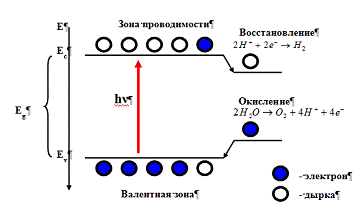
Рис. 7 Схема фотокаталитического процесса.
Таким образом, фотокатализатор должен обладать шириной запрещенной зоны,
подходящей для работы в нужной спектральной области и, при этом, границы
запрещенной зоны должны соответствовать потенциалам целевых
окислительно-восстановительных полуреакций.
Ещё одной важной характеристикой, определяющей каталитическую активность
любого гетерогенного катализатора, является его удельная поверхность. Это
справедливо и при рассмотрении фотокатализа, поскольку многие
окислительно-восстановительные стадии фотокаталитической реакции происходят
именно на поверхности твердого тела. Поэтому большое внимание в исследованиях
уделяют методам [14] и условиям [15] синтеза фотокатализаторов. Так, в работе
[16] было проведено сравнение фотокаталитических свойств образцов слоистого
титаната K2La2Ti3O10, полученного
по керамической технологии и гидротермальным методом. Авторы определили
оптимальные условия гидротермального синтеза (4 M KOH, 200°C, 24 ч.) и
показали, что образец полученный таким образом имеет частицы меньшего размера,
а значит большую удельную поверхность. Опыты по изучению фотокаталитической
активности показали, что полученный гидротермальным методом K2La2Ti3O10,
имеет активность практически в 2 раза выше, чем титанат, полученный по
стандартной керамической методике. Ещё одним распространённым методом синтеза K2La2Ti3O10
является метод полимерного комплекса [17,18]. Он основан на поликонденсации этиленгликоля
и лимонной кислоты в присутствии растворимого комплекса металл-лимонная кислота
и является вариантом золь-гель синтеза. Комплекс иммобилизуется на жесткой цепи
полиэфира, что ингибирует гидроксилирование отдельных катионов металла,
существующее при обычном проведении синтеза по золь-гель технологии.
Получившийся в итоге гель в работах [17,18] подвергался пиролизу с получением
прекурсора, который затем прокаливался при различных температурах. Авторы
сравнили фотокаталитическую активность порошков K2La2Ti3O10,
полученных по методу полимерного комплекса и керамическим методом при различных
температурах и при различном избытке добавляемого при синтезе карбоната. Они
пришли к выводу, что избыток карбоната является необходимым условием получения
чистого вещества (без примеси La2/3TiO3), однако при
слишком большом избытке (пятикратном) получается новая фаза: K2Ti2O5.
Также они показали, что в зависимости от температуры прокаливания изменяется
удельная поверхность вещества, причём с её увеличением возрастает
фотокаталитическая активность. Но даже если площади поверхностей приблизительно
одинаковы, образец, полученный по методу ПК, является более активным, так как
его частицы имеют более однородную морфологию и высокую кристалличность, по
сравнению с полученными по керамической методике.
Помимо сдвига краёв запрещённой зоны, существуют и другие методы
изменения электронной структуры полупроводников [19]. К ним относятся:
допирование полупроводников донорными или акцепторными компонентами; создание
примесных уровней внутри запрещенной зоны, для сдвига полосы поглощения в
видимую область [20,21]; создание композитных катализаторов [22,23]. Последние
обладают тем преимуществом, что центры окисления и восстановления оказываются
пространственно разделенными, что препятствует протеканию обратной реакции или
рекомбинации [24].
Реакции, протекающие в ходе фотокаталитического процесса, определяются, в
первую очередь, составом раствора, контактирующего с фотокатализатором, так как
любой его компонент может рассматриваться как потенциальный реагент
окислительно-восстановительной реакции. Какая именно из реакций будет протекать
определяется термодинамической и кинетической выгодностью процесса. Так,
например, процесс фотокаталитического разложения воды в кислой среде включает в
себя две полуреакции (2) и (3),
H+ + 2e- → H2 E=0
В (pH=0) (2)
H2O + 4h+ → O2 + 4H+ Е=1.23
В (3)
в одной из которых выделяется водород, а в другой - кислород. Поскольку
расход электронов и дырок должен происходить с одинаковой скоростью, то скорость
суммарного процесса будет определяться лимитирующей стадией. Однако создание
благоприятных условий для одновременного выделения водорода и кислорода
является сложной задачей, поэтому в некоторых случаях к воде добавляют так
называемые «жертвенные» реагенты, повышающие скорость необходимого процесса.
Стандартными жертвенными реагентами являются нитрат серебра (окислитель,
заменяет реакцию (2)) и метанол (восстановитель, заменяет реакцию (3)).
Ag+ + e- → Ag0 (4)
CH3OH + 2h+ → CH2O + 2H+ (5)
.4.3
Фотокаталитическая активность K2La2Ti3O10
По литературным данным, K2La2Ti3O10
имеет ширину запрещенной зоны 3.5 эВ [26,27] и способен разлагать воду на
водород и кислород под действием УФ-излучения.
Впервые фотокаталитическая активность K2La2Ti3O10 была изучена и результаты опубликованы в 1997 году [25].
Авторы статьи также описали оптимальные условия при которых скорость выделения
водорода из воды под действием света с использование катализатора K2La2Ti3O10 была максимальной: концентрация
водного раствора КОН, в котором проводился фотокаталитический опыт, 0,1 моль/л,
рН среды = 12,8. Кроме того, авторы показали, что активность увеличивается при
нанесении на поверхность слоистого оксида частиц Ni. Оптимальное количество никеля 3%.
В работе [27] исследовали зависимость фотокаталитической активности K2La2Ti3O10
от количества сокатализатора NiO и от концентрации раствора KOH, в котором
проводили реакцию. Максимальная активность наблюдалась при содержании NiO 3%, в
то время как оптимальная концентрация щелочи равна 0.1М. Слоистый оксид был
получен керамическим методом и затем пропитан раствором Ni(NO3)2,
восстановлен водородом (при 773 К в течение 2 часов) и окислен O2 при 473 К в течении 1 часа. Авторы
предложили следующий механизм реакции фотокаталитического разложения воды на
кислород и водород: восстановление водорода происходит на частицах NiO,
находящихся на поверхности слоистого оксида, в то время как выделение кислорода
происходит в межслоевом пространстве путём расщепления интеркалированной воды.
В работе [26] фотокаталитическую активность трёхслойных
перовскитопободных оксидов связывают с их гидратацией на основании сравнения
активности K2La2Ti3O10 с
соединением KLa2Ti2NbO10, в котором треть
атомов титана замещена на ниобий. При этом количество щелочного металла
уменьшается, что является необходимым условием для сохранения
электронейтральности. У данного соединения пропадает способность к интеркаляции
воды в межслоевое пространство и наблюдается снижение фотокаталитической
активности на порядок. Был сделан вывод о том, что гидратация слоистых оксидов
напрямую связана с количеством катионов щелочного металла.
В работе [28] были синтезированы композитные катализаторы Pt/K2La2Ti3O10 с различным содержанием платины. Была изучена их
фотокаталитическая активность в реакциях выделения водорода из водного раствора
метанола под действием УФ света. Слоистый оксид K2La2Ti3O10 был приготовлен твердофазным методом и промыт
дистиллированной водой. Композит Pt/K2La2Ti3O10 был получен из него с использованием
различных восстановителей. Для этого, порошок K2La2Ti3O10 пропитывали раствором H2PtCl6, сушили
инфракрасной лампой и восстанавливали различными способами: 1) избытком
раствора гидразина; 2) избытком формальдегида; 3) облучением УФ светом в
течение 4 часов; 4) водородом в U-образной
кварцевой трубке, в течение 2 часов при 673 К. Также, для сравнения, был
синтезирован композит Ni/K2La2Ti3O10,
фотокаталитическая активность которого была изучена ранее. Все образцы были
охарактеризованы с помощью рентгенофазового анализа и методом спектроскопии
диффузного отражения в УФ и видимой областях. Результаты работы показали, что
активность композита с платиной в несколько раз выше активности исходного K2La2Ti3O10 и образца с никелем. Причём
наибольшую эффективность показал образец, полученный с помощью восстановления
водородом и с содержанием платины 2%, далее наблюдался спад активности.
Те же авторы, в работе [29] нанесли на поверхность K2La2Ti3O10 частицы CdS и исследовали фотокаталитическую активность
полученного соединения в реакции выделения водорода из воды под действием
видимого света, в присутствии Na2S. Образец CdS/K2La2Ti3O10
был получен двумя способами: путём механического смешения порошков CdS и K2La2Ti3O10,
а также проведением реакции синтеза CdS из Cd(NO3)2 и
SC(NH2)2 в растворе, содержащем слоистый оксид K2La2Ti3O10.
CdS/K2La2Ti3O10 в сравнении с
CdS/TiO2 показал вдвое большую активность. Причём наибольшую
фотокаталитическую активность показал образец с содержанием CdS 5%. В работе
также было изучено влияние концентрации Na2S в растворе на скорость
выделения водорода. Наибольшей скорости соответствует концентрация 0,15 моль/л.
Такая добавка производилась авторами для того, чтобы увеличить время жизни
сокатализатора CdS, так как анионы S2− могут замедлить
фото-коррозионный процесс, кроме того, Na2S использовался как донор
электронов, захватывающий фотогенерированные дырки, которые в дальнейшем могут
участвовать в процессе окисления S2- до S, что снижает вероятность их рекомбинации с
фотогенерированными электронами и таким образом увеличивает разделение
фотоиндуцированных носителей зарядов.
В работе [30] изучалось влияние частиц золота на фотокаталитическую
активность K2La2Ti3O10 в реакции
разложения воды под действием УФ и видимого света. K2La2Ti3O10
был синтезирован с помощью метода полимерного комплекса. Композиты Au/K2La2Ti3O10
получены методами влажной пропитки, с использованием HAuCl4*3H2O,
и осаждением из раствора тетрахлороаурата(III) водорода. Сравнение образцов, полученных разными
методами, а также с разным содержанием золота, показало, что наиболее
эффективным фотокатализатором является композит, полученный первым методом, с
содержанием Au 1,1%. Для него было также рассмотрено влияние предварительной
обработки на фотокаталитическую активность в реакции разложения воды. Авторы
изучили образцы Au/K2La2Ti3O10,
восстановленные водородом в течение 2 часов при 200, 500 и 600 ᵒС (такой
диапазон температур был выбран исходя из того, что в нём происходит
восстановление ионов золота), прокалённый при 400 ᵒС, без предварительной
обработки, а также образцы, полученные комбинированием нескольких методов
обработки. Наиболее эффективным оказался образец полученный восстановлением
водородом при 200 ᵒС. При большей температуре происходит агрегация частиц
золота, что уменьшает активность. Другие методы увеличивают фотокаталитическую
активность за счёт очистки поверхности от хлорида, но не включают стадию
восстановления золота, поэтому не являются настолько же эффективными. Кроме
того, если сначала провести обработку водородом, а затем прокалить порошок на
воздухе, то наблюдается снижение активности, которое авторы объясняют наличием
кислорода или азота на поверхности наночастиц золота, увеличивающим
сопротивление переходу электронов и дырок, сгенерированных в K2La2Ti3O10.
Также авторы сравнили наиболее эффективный полученный ими фотокатализатор с
композитом Ni/K2La2Ti3O10 и
показали, что K2La2Ti3O10,
допированный золотом, менее активен под действием УФ излучения, но более
активен в случае видимого излучения.
Таким образом, обзор литературы показал, что K2La2Ti3O10
является перспективным материалом для создания фотокатализаторов с высокой
активностью. Однако на данный момент мало изучено влияние среды, в которой
протекает фотокаталитическая реакция, на состав и структуру слоистого оксида.
Поэтому целью данной работы стало исследование ионного обмена в слоистом оксиде
K2La2Ti3O10 в зависимости от рН
среды.
2.
Экспериментальная часть
.1 Синтез
слоистого оксида K2La2Ti3O10
Синтез K2La2Ti3O10
осуществлялся по керамической методике, согласно уравнению реакции:
La2O3 + 3TiO2 + K2CO3
= K2La2Ti3O10 + CO2
Реагенты La2O3 и TiO2 взвешивались в стехиометрических
количествах, в то время как K2CO3 брали с 30% мольным избытком, что связано с тем, что
при температуре синтеза часть карбоната улетучивается. После взвешивания
реактивы смешивали и перетирали в агатовой ступке из расчёта 30 мин/г. Затем
шихту прессовали в таблетки и прокаливали при 1100 ᵒС. Следующим шагом
была очистка полученного вещества от избытка карбоната калия, для этого
таблетки измельчали и порошок промывали 1М водным раствором аммиака три раза,
каждый раз центрифугируя раствор в течение 8 минут со скоростью 3500
оборотов/мин. Далее полученное вещество сушили.
.2
Определение диапазона pH, при котором в слоистом оксиде K2La2Ti3O10
происходит ионный обмен
.2.1 Схема
установки
Опыты по определению диапазона рН, при котором происходит ионный обмен,
проводились методом непрерывного потенциометрического титрования. Для этого
была сконструирована установка (рис. 8), состоящая из 3 основных частей:
резервуара с кислотой (1), стакана с изучаемой суспензией слоистого оксида (2)
и рН-метра(3).
Кислота из ёмкости (1) поступала через стеклянный капилляр (4) в стакан с
изучаемой суспензией. В неё также опускались электроды: стеклянный электрод (6)
и хлор-серебряный электрод (7), в качестве электрода сравнения. Разность
потенциалов между ними регистрировалась с помощью рН-метра (Иономер Мультитест
ИПЛ-103) (3) и на компьютере автоматически записывалась зависимость Е, мВ от
времени.

Рис. 8 Схема установки.
.2.2
Калибровка стеклянного электрода
Согласно уравнению Никольского, потенциал стеклянного электрода линейно
зависит от pH раствора:
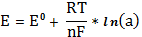
Градуировка проводилась с использованием стандартных буферных растворов
со значениями рН 1,65, 3,56, 6,86 и 9,18. В области рН, необходимой для
проведения экспериментов по определению диапазона ионного обмена (1-10),
наблюдалась линейная зависимость между ΔE и логарифмом активности ионов
водорода (рис. 9).
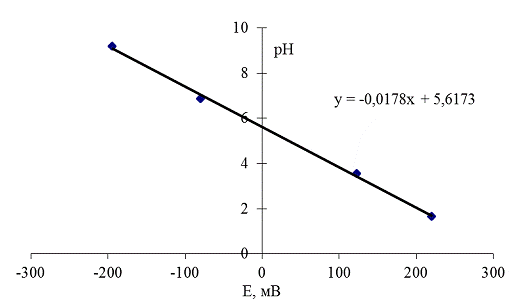
Рис. 9 Градуировочный график.
То есть уравнение Никольского выполняется на интересующем нас участке,
причём угловой коэффициент линейной зависимости E от pH
составил 55,99.
.2.3 Выбор
оптимальной скорости добавления кислоты
Изменяя диаметр капилляра мы могли изменять скорость подачи кислоты в
реакционную суспензию. На рисунке 10 представлены кривые титрования, полученные
при различных скоростях добавления кислоты. Видно, что все кривые, полученные в
присутствии слоистого оксида, отличаются от кривых титрования чистой щелочи,
записанных в тех же условиях. При этом, чем меньше скорость титрования, тем
более отчетливо проявляется перегиб в области рН 7-8. Это естественно,
поскольку для появления четкого перегиба необходимо, чтобы скорость ионного
обмена лимитировалась скоростью подачи кислоты, что и наблюдается при
минимальной скорости 3,2 мл в час.
Именно эту скорость мы использовали в дальнейших опытах.
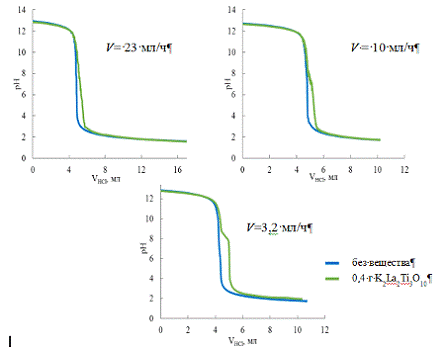
Рис. 10 Кривые титрования суспензий K2La2Ti3O10
и чистого раствора КОН с разной скоростью.
.2.4
Методика проведения эксперимента
Непосредственно опыт по изучению ионного обмена проводился следующим
образом. В стакан (2) заливали суспензию 0,4 г K2La2Ti3O10
в 100 мл 0,05 М КОН. Электроды промывали дистиллированной водой и опускали в
перемешиваемую с помощью магнитной мешалки (5) суспензию. Через минуту после
запуска программы регистрации потенциала, начиналось добавление HCl,
концентрацией 1,098 М. До и после опыта контролировалась скорость истечения
кислоты из капилляра (4) весовым методом. После окончания эксперимента,
вещество центрифугировали (8 мин. 3500 об/мин) и оставляли сушиться в
эксикаторе над CaO. Зависимость потенциала от времени перестраивалась в
координатах рН - VHCl с помощью полученной ранее градуировочной
зависимости.
2.3
Определение фотокаталитической активности HxK2-xLa2Ti3O10
.3.1
Получение образцов
Для изучения фотокаталитической активности необходимо получить вещество,
устойчивое в растворе, в котором будет проводиться фотокаталитический
эксперимент. Наиболее часто подобной средой является вода или раствор КОН.
Поэтому, для получения устойчивого в данных условиях соединения, равное
количество исходного вещества выдерживалось в воде и растворе КОН до тех пор,
пока не произойдет максимально возможное замещение ионов калия на ионы
водорода. Этот эксперимент проводился следующим образом: 0,4 г K2La2Ti3O10
помещалось в 50 мл воды или 0,05 М раствора КОН и выдерживалось определённое
время (от часа, в первый раз, до 4 дней, в конце эксперимента), затем суспензию
центрифугировали (20 минут 3500 об/мин), декантировали и к осадку добавляли
новую порцию воды/щелочи. Всего было проведено 10 циклов замачивания, для
каждого образца, которые в общей сложности заняли 21 день.
.3.2
Определение фотокаталитической активности
Реакционную суспензию приготавливали за сутки до эксперимента, чтобы
успело установиться сорбционное равновесие. Исследования проводились в двух
средах: воде, для изучения фотокаталитической активности образцов в реакции
разложения воды на кислород и водород под действием света, и изопропиловом
спирте (ИПС), для изучения активности оксидов в фотореакции разложения ИПС,
которое также сопровождается выделением водорода. Всего было приготовлено и
изучено 5 суспензий, которые состояли из 60 мг частично замещённого слоистого
оксида, полученного по описанной выше методике, и 60 мл раствора. Из каждого
образца получена суспензия в растворе, в котором он вымачивался (воде или 0,05
М КОН), кроме того, образец, вымачиваемый в воде, был диспергирован в растворе
0,05 М КОН и 0,1 % ИПС, для сравнения фотокаталитических активностей слоистых
оксидов с разной степенью замещения. Это стало возможным так как, по полученным
нами данным, обратное замещение Н+ на К+ проходит лишь
частично. Для измельчения частиц оксида непосредственно перед опытом
проводилась обработка ультразвуком (УЗ ванна Elmasonic S10H). Определение
фотокаталитической активности проводилось на установке, схема которой
изображена на рисунке 11. Она предназначена для исследования кинетики выделения
водорода в ходе фотокаталитических реакций.

Рис. 11 Схема фотокаталитической установки.
мл исследуемой суспензии заливались в реакционную ячейку (рис. 12),
которая состояла из 2 частей: ячейки для суспензии, под которой находилась
магнитная мешалка, необходимая для эффективного перемешивания облучаемой
жидкости, и ячейки с раствором светофильтра, находящейся ближе к лампе. В
качестве светофильтра использовался раствор смеси KCl/NaBr по 6 г/л каждого,
который отсекает жёсткое ультрафиолетовое излучение с длиной волны меньше 220
нм (рис. 13). Это необходимо, так как ИПС способен самостоятельно разлагаться
под действием коротковолнового УФ-излучения с выделением водорода, кроме того,
раствор светофильтра служил для охлаждения фотореактора, посредством того, что
он термостатировался при 15 ᵒС.

Рис. 12 Реакционная ячейка.
Перед началом эксперимента проводилась продувка системы аргоном, чтобы
удалить воздух. Для постоянного циркулирования газа в ходе опыта в системе
использовался насос, до и после которого находились накопительные ёмкости
необходимые для того, чтобы исключить возможность попадания инородных частиц
(например, капелек воды) в насос и кран.
Затем включали лампу, спектр излучения которой представлен на рисунке 13.
В экспериментах использовалась ртутная лампа ДРТ 125, максимум излучения
которой приходится на λ = 365 нм.
Каждый опыт длился 4 часа. Через 2 часа после начала проводилась вторая
продувка аргоном, необходимая для удаления оставшегося после первой продувки
воздуха и устранения накопившегося в системе водорода, способного влиять на
скорость фотокаталитической реакции, вызывая обратные процессы. Для проведения продувки
необходимо было переключить кран-переключатель в положение показанное
пунктирными линиями (рис. 11), она длилась в среднем 15-20 минут.
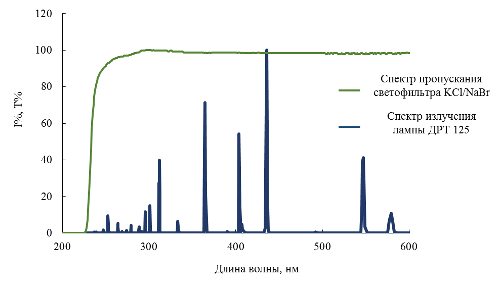
Рис. 13 Спектр испускания лампы и спектр пропускания светофильтра.
Пробы для измерения скорости выделения водорода отбирались каждые 15
минут следующим образом: при переключении крана-дозатора (на рис. 11 он
изображён уже в положении отбора пробы), газ-носитель (Ar) переносил пробу к
газовому хроматографу, где происходит разделение газовой смеси в колонке с
молекулярными ситами и анализ с помощью детектора по теплопроводности.
Количество выделившегося водорода рассчитывалось исходя из площади
хроматографического пика. Для этих исследований использовался газовый
хроматограф Shimadzu GC-2014.
.4
Характеризация полученных образцов
.4.1
Рентгенофазовый анализ (РФА)
Фазовый состав полученных образцов контролировался с помощью порошкового
рентгенофазового анализа на дифрактометре Rigaku Miniflex II (излучение CuKα)
в РЦ СПБГУ «Рентгенодифракционные
методы исследования». В основе этого метода лежит регистрация углов дифракции
рентгеновских лучей на кристаллической решётке и их интенсивности, определяемых
индивидуальными характеристиками решётки. Дифрактограммы записывались в интервале
углов 2Ѳ от 3° до 60°. Положения пиков сравнивались с теоретически
рассчитанными значениями и имеющимися в литературе дифрактограммами.
.4.2
Сканирующая электронная микроскопия (СЭМ)
Морфология образцов слоистых оксидов была исследована путем сканирующей
электронной микроскопии на микроскопе Zeiss Merlin с полевым эмиссионным
катодом, колонной электронной оптики GEMINI-II и безмаслянной вакуумной
системой в междисциплинарном ресурсном центре по направлению
"Нанотехнологии". Сущность метода заключается в том, что поверхность
образца облучается пучком электронов - электронным зондом. В результате такого
взаимодействия генерируются вторичные электроны, которые собираются детектором.
Интенсивность сигнала на детекторе зависит от топографии образца в области взаимодействия.
Кроме того, были получены данные рентгеновского микроанализа состава
соединений. Эти исследования проводились с помощью приставки к электронному
микроскопу, а именно системы энергодисперсионного рентгеновского микроанализа
Oxford Instruments INCAx-act. На основании количества калия в образце
рассчитывалась степень замещения на протоны.
.4.3
Термогравиметрический анализ (ТГА)
Количество интеркалированной воды, а также степень замещения ионов калия
на протоны в образцах определялась посредством термогравиметрического анализа,
проводимого на термомикровесах Netzsch TG 209 F1 Libra. Съёмка проводилась в
атмосфере аргона со скоростью 10 K/мин
в диапазоне от комнатной температуры до 900 ᵒС. На термогравиметрической
кривой (рис. 14) наблюдались два участка массопотери, первый из которых
соответствует выходу интеркалированной воды:
HxK2-xLa2Ti3O10*yH2O → HxK2-xLa2Ti3O10 + yH2О,
а второй - разложению водородзамещенного слоистого оксида:
HxK2-xLa2Ti3O10
→ (K2O)(2-x)/2La2Ti3O9 +
x/2H2О.
Исходя из этих уравнений степень замещения и количество интеркалированной
вода можно рассчитать по следующим формулам:
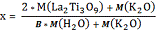
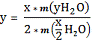
Здесь М - молекулярная масса, m - масса вещества, В - отношение массы оставшегося после выделения всей
воды вещества, к массе воды, выделившейся в ходе разложения замещённого
соединения, А - (K2O)(2-x)/2La2Ti3O9.
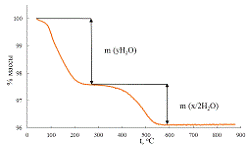
Рис. 14 Термогравиметрическая кривая.
Анализ проводился в ресурсном центре СПБГУ «Термогравиметрические и
калориметрические методы исследования»
.4.4
Атомно-эмиссионная спектроскопия с индуктивно связанной плазмой (ИСП)
Степень замещения K+ на H+ в слоистом оксиде K2La2Ti3O10
контролировалась также атомно-эмиссионным спектральным анализом. Количественный
элементный состав определялся по интенсивности характеристичных спектральных
линий атомов, возбуждаемых индуктивно связанной плазмой. Исследования
проводились на оптическом эмиссионном спектрометре ICPE-9000, Shimadzu.
Пробоподготовка проводилась следующим образом: 6 мг образца растворяли в 1,6 мл
70% HNO3 (осч) при температуре 90-100 ᵒС и разбавляли водой
так, что общий объём раствора составлял 25 мл.
Этот анализ был проведён в РЦ «Методы анализа состава вещества».
3.
Обсуждение результатов
.1
Диапазон рН, при котором происходит ионный обмен в K2La2Ti3O10
.1.1
Кривые титрования
Сравнение кривых
титрования суспензии K2La2Ti3O10 в
0,05 М растворе КОН и чистого раствора КОН соляной кислотой (рис. 15),
полученных методом непрерывного потенциометрического титрования, показало, что
при титровании K2La2Ti3O10 на
кривой появляется перегиб в области рН=7-8. Если предположить, что именно в
этой области происходит замещение К+ на Н+ в K2La2Ti3O10
и всё соответствующее этому перегибу количество кислоты идет на ионный
обмен, то можно рассчитать оценочную степень замещения калия на протон в
слоистом оксиде. Она составит приблизительно 70%.
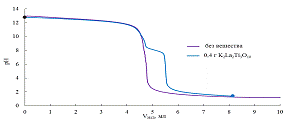
Рис. 15 Кривые титрования суспензии K2La2Ti3O10
и чистого раствора КОН.
Чтобы подтвердить предположение о том, что ионообменный процесс протекает
именно на этом перегибе, было дополнительно проведено два аналогичных опыта,
которые останавливались при рН равном 10 и 5, то есть до и после перегиба на
кривой титрования (красная и зелёная точки на рисунке 16).
Таким образом в результате этих экспериментов было получено 4 образца
слоистых оксидов: исходный (промытый раствором аммиака) и три соединения,
полученные титрованием суспензии K2La2Ti3O10
соляной кислотой, остановленным при рН=10 (до перегиба на кривой титрования),
при рН=5 (после перегиба) и при рН<2 (в кислой области).
В следующих четырёх параграфах подробно рассматриваются эти образцы и
формулируются основные закономерности ионного обмена в слоистом оксиде K2La2Ti3O10.
Для сокращения в дальнейшем образцы будут обозначены цифрами: 1 - исходный, 2 -
при рН=10, 3 - при рН=5, 4 - при рН<2.
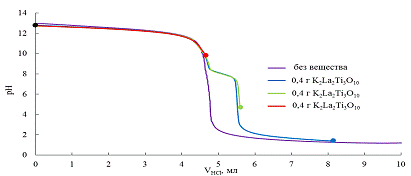
Рис. 16 Кривые титрования суспензий K2La2Ti3O10
и чистого раствора КОН.
3.1.2
Исходный образец
Исходный образец, полученный по керамической методике и промытый
раствором аммиака, с предполагаемой формулой K2La2Ti3O10,
был охарактеризован 4 методами: РФА, ТГА, СЭМ и АЭС с ИСП. Эти же методы
использовались для изучения других образцов.
Из дифрактограммы (рис. 17) видно, что полученный образец состоит из
одной фазы, положения всех рефлексов практически совпадают с теоретически
рассчитанной дифрактограммой K2La2Ti3O10
(изображена маркерами). То есть процесс синтеза можно считать завершённым,
вещество - рентгенографически чистым. На основе этой дифрактограммы был
рассчитан параметр кристаллической решётки с исходного соединения,
который составил 3,30 нм, что также соответствует литературным данным.
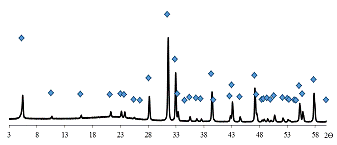
Рис. 17 Дифрактограмма образца 1.
Морфология частиц была изучена с помощью СЭМ, которая показала, что
вещество состоит из пластинчатых частиц микронного размера 100-200 нм в толщину
(рис 18)


Рис. 18 Микрофотографии образца 1.
На термогравиметрической кривой (рис. 19) образца 1 наблюдаются два
участка массопотери, первый из которых соответствует выходу интеркалированной
воды (~3,0%), а второй - разложению водородзамещенного слоистого оксида
(~0,61%), что свидетельствует о том, что уже при промывке раствором аммиака
произошло частичное замещение ионов калия на ионы водорода в K2La2Ti3O10.
Таким образом, в действительности, в результате синтеза был получен частично
водородзамещённый слоистый перовскитоподобный оксид HxK2-xLa2Ti3O10*yH2O.
Причём степень замещения x/2, согласно ТГА, равна 0,21, y = 1,07
Факт образования водородзамещённого соединения подтверждается также
данными атомно-эмиссионной спектроскопии и микрозондовым анализом. Однако
степень замещения, рассчитанная с помощью разных методов анализа, отличается.
По результатам АЭС х/2 = 0,15, согласно рентгеновскому микроанализу х/2 = 0,14.
Данные АЭС хорошо соотносятся с данными микрозондового анализа, в то время как
ТГА показывает другое количество водорода в исходном соединении. Это связано с
тем, что при малых степенях замещения на термогравиметрической кривой не
наблюдается чёткого разделения между двумя участками массопотери, поэтому
сложно разделить вклады от выхода интеркалированной воды и разложения
водородзамещённого соединения. Исходя из этого мы считали данные, полученные по
методу АЭС с ИСП более объективными.
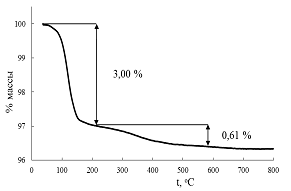
Рис. 19 Термогравиметрическая кривая образца 1.
.1.3
Образец, полученный при рН=10
Согласно РФА (рис. 20), образец 2 состоит из двух фаз, одна из которых
совпадает с исходной (с = 3,30 нм), а вторая имеет меньший параметр
ячейки (с = 3,12 нм), т.е. является частично водородзамещённой.
Маркерами отмечены пики, относящиеся к теоретической дифрактограмме K2La2Ti3O10.
На микрофотографии (рис. 21) этого вещества наблюдаются небольшие
выпуклости, которые, вероятно, представляют собой частицы, осевшие на
поверхность образца в результате его сушки. При длительном облучении
электронным пучком эти неоднородности исчезали. В целом морфология частиц
совпадает с образцом 1.
Степень замещения в этом случае в два раза превышает степень замещения в
исходном веществе и составляет приблизительно 0,35, по данным АЭС и 0,34, по
данным рентгеновского микроанализа. Как и в случае исходного соединения, x/2,
рассчитанная из термогравиметрической кривой (рис. 22) отличается из-за
трудности в разделении участков массопотери (x/2ТГА=0,56, y=0,81 для
HxK2-xLa2Ti3O10*yH2O).
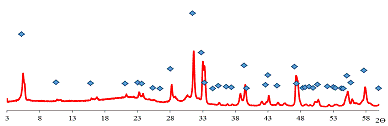
Рис. 20 Дифрактограмма образца 2.


Рис. 21 Микрофотографии образца 2.
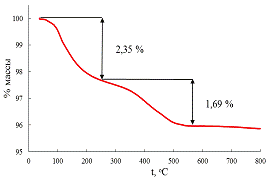
Рис. 22 Термогравиметрическая кривая образца 2.
На основании этих данных можно сделать вывод, что ионный обмен К+
на Н+ в слоистом оксиде K2La2Ti3O10
начинается уже в щелочной области.
3.1.4 Образец, полученный при рН=5
Слоистый оксид, полученный при рН приблизительно равном 5, то есть после
перегиба на кривой титрования, в отличие от предыдущего, является однофазным.
Параметр кристаллической ячейки с, рассчитанный из дифрактограммы (рис.
23), ещё меньше параметра, соответствующего водородзамещённой фазе слоистого
оксида, полученного при рН=10 и равен 3,00 нм, что может свидетельствовать об
увеличении степени замещения.
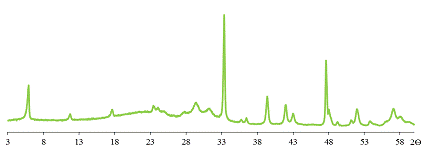
Рис. 23 Дифрактограмма образца 3.
СЭМ показала, что форма и размер частиц в результате титрования не
изменились (рис.24).


Рис. 24 Микрофотографии образца 3.
Форма термогравиметрической кривой (рис. 25), соответствующей образцу 3,
позволяет разделить вклады в изменение массы образца, соответствующие двум
процессам (1,87% - интеркалированная вода, 2,23% - разложение водородзамещённой
формы), поэтому для этого образца были рассчитаны степень замещение и
количество интеркалированной воды на одну формульную единицу оксида из данных
ТГА. Согласно этим данным, перовскитоподобный оксид имеет формулу H1,5K0,5La2Ti3O10*0,6H2O
(х/2=0,75, y=0,60).
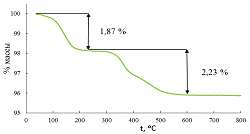
Рис. 25 Термогравиметрическая кривая образца 3.
АЭС и микрозондовый анализ показали близкие значения: x/2АЭС=0,76,
x/2микрозонд=0,78. Такая степень замещения подтверждает
предположение о том, что в области рН=7-8, при которой на кривой титрования
наблюдается перегиб, происходит замещение большей части ионов калия на ионы
водорода в K2La2Ti3O10.
.1.5
Образец, полученный в кислой среде
Образец 4, полученный в результате титрования суспензии K2La2Ti3O10
соляной кислотой, остановленного в сильнокислой области (рН<2), согласно
результатам РФА (рис. 26) - однофазный с параметром кристаллической решётки с
= 2,98 нм.
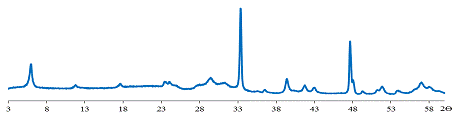
Рис. 26 Дифрактограмма образца 4.
Этот слоистый оксид состоит из пластинчатых частиц шириной 100-200 нм. На
микрофотографиях отчётливо видна слоистая структура таких частиц (рис.27).


Рис. 27 Микрофотографии образца 4.
Степень замещения K+ на Н+ в образце составила 85%,
причём это значение одинаково для всех используемых методов анализа (АЭС, ТГА,
рентгеновский микроанализ). Если также учесть количество интеркалированной
воды, рассчитанное из термогравиметрических данных (рис. 28), то формулу
соединения, получаемого в кислой области рН можно записать как H1,69K0,31La2Ti3O10*0,47H2O.
На основании этих данных можно сделать вывод, что в кислой области
замещение в слоистом оксиде K2La2Ti3O10
продолжается, но с меньшей скоростью.
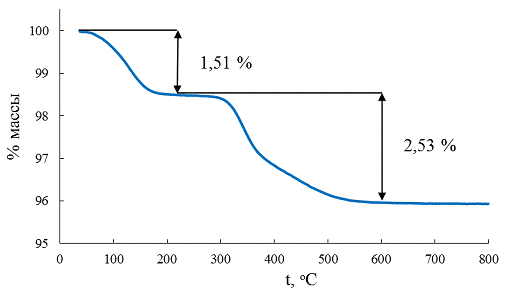
Рис. 28 Термогравиметрическая кривая образца 4.
Данные, полученные из термогравиметрических кривых для образцов 1-4
показывают, что существует обратная зависимость между количеством
интеркалированной воды и степенью замещения калия на протон в K2La2Ti3O10
(рис. 29). Общее падение массы для образцов, полученных при различных рН,
приблизительно постоянно, в то время как участок разложения водородзамещённого
оксида увеличивается с уменьшением рН, следовательно, уменьшается доля массы,
приходящаяся на интеркалированную воду.
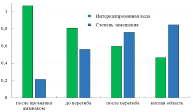
Рис. 29 Сравнение количества молекул воды на формульную единицу слоистого
оксида и степени замещения К+ на Н+, рассчитанных из
данных ТГА для разных образцов.
Таким образом, были сформулированы основные закономерности ионного обмена
в K2La2Ti3O10. В таблице 2
представлены данные, обобщающие результаты титрования суспензий слоистого
оксида до определённого рН.
Таблица 2. Сравнение степеней замещения и параметров кристаллической
решётки для образцов 1, 2, 3, 4.
|
Степень замещения
|
1
|
2
|
3
|
4
|
|
Микрозондовый анализ
|
0,14
|
0,78
|
0,85
|
|
АЭС с ИСП
|
0,15
|
0,34
|
0,76
|
0,85
|
|
ТГА
|
0,21
|
0,56
|
0,75
|
0,85
|
|
Параметр решётки с, нм
|
3,30
|
3,30 3,12
|
3,00
|
2,98
|
.1.6
Обратное замещение Н+ на К+
После определения основных закономерностей ионного обмена дополнительно
был проведён опыт с целью установления возможности обратного замещения протонов
на ионы калия. Для этого в такую же реакционную суспензию, содержащую 0,4 г K2La2Ti3O10,
сначала добавляли соляную кислоту, а затем, после достижения рН среды меньше 2,
добавляли 0,92 М КОН с такой же скоростью.
Первая половина кривой титрования, соответствующая добавлению кислоты,
совпадает с ранее полученными, а вторая половина, в ходе которой в раствор
попадала щелочь, показала, что обратное замещение также имеет место, однако,
проходит лишь на 19%, если проводить расчёт из перегиба на кривой титрования,
(рис. 30).

Рис. 30 Кривая прямого и обратного титрования K2La2Ti3O10.
Полученный в конце этого эксперимента образец является однофазным (рис.
31), причём положение пиков на дифрактограмме близко к положению,
соответствующему образцу, полученному при рН=5. Параметр кристаллической
решётки данного слоистого оксида с = 3,02 нм.
СЭМ показала, что в целом морфология частиц не изменилась (рис. 32)
Степень замещения калия на протон в K2La2Ti3O10,
полученная путём последовательного титрования соляной кислотой и раствором
гидроксида калия, составила по данным ТГА 66% (рис. 33). Количество молекул H2O
на формульную единицу водородзамещенного слоистого оксида - 0,49.
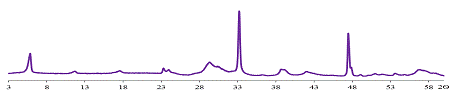
Рис. 31 Дифрактограмма образца, полученного обратным замещением.


Рис. 32 Микрофотографии образца, полученного обратным замещением.
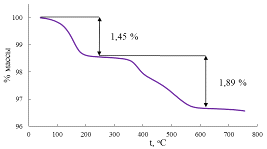
Рис. 33 Термогравиметрическая кривая образца, полученного обратным
замещением.
Микрозондовый анализ и АЭС дают схожие значения степени замещения: 0,68 и
0,66, соответственно.
Таким образом, опыт с обратным титрованием водородзамещенного слоистого
оксида раствором щелочи показал, что обратное замещение Н+ на К+
в HxK2-xLa2Ti3O10
возможно, но проходит со значительно меньшей скоростью и в условиях данного
эксперимента останавливается на степени замещения ≈ 70%.
3.2
Фотокаталитическая активность
.2.1
Образцы для изучения фотокаталитической активности
Для изучения фотокаталитических свойств слоистых оксидов HxK2-xLa2Ti3O10
с разной степенью замещения ионов калия на ионы водорода были получены образцы
по методике, описанной в разделе 2.3.1. Они были охарактеризованы РФА и ТГА.
РФА показал, что оба соединения (K2La2Ti3O10
выдержанный в воде, (обазначим его - Ф1) и в растворе КОН (Ф2)) получились
однофазными, чистыми, частично водородзамещёнными, с разной величиной параметра
кристаллической решётки с (рис. 34, 35).
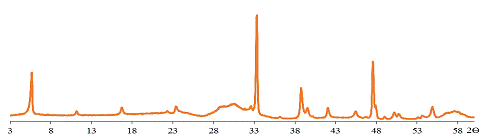
Рис. 34 Дифрактограмма образца Ф1.
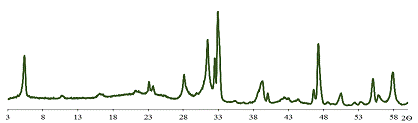
Рис. 35 Дифрактограмма образца Ф2.
Для образца Ф1 с = 3,16 нм, для слоистого оксида Ф2 с =
3,28 нм.
Степень замещения, а также количество молекул воды на формульную единицу
в этих слоистых оксидах определялись ТГ анализом.
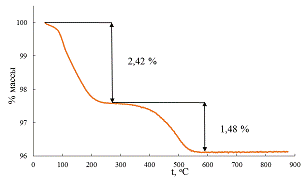
Рис. 36 Термогравиметрическая кривая образца Ф1.
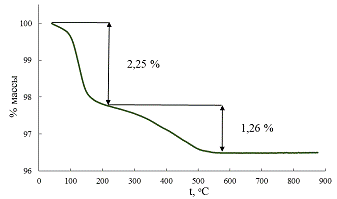
Рис. 37 Термогравиметрическая кривая образца Ф2.
х/2 для первого образца составила 52% (рис. 36), для второго - 43%
(рис.37). Однако, как уже говорилось ранее, для образцов с малой степенью
замещения рассчёт по термогравиметрическим кривым неточен. Более того, ситуация
осложняется тем, что данный образец, будучи полученым в растворе щелочи, и
отделенным от него центрифугированием, не может быть полностью очищен от
щелочи. Остаточный KOH, являясь гигроскопичным веществом, может вносить
существенный вклад в массопотерю на ТГ-кривой, что дополнительно затрудняет интерпретацию
данных. Вместе с тем, дифрактограмма образца Ф2 близка к дифрактограмме
исходного K2La2Ti3O10*H2O.
Таким образом, основываясь на данных ТГА можно записать формулу для соединения
Ф1, получаемого вымачиванием K2La2Ti3O10
в воде: H1,04K0,96La2Ti3O10*0,85H2O,
а соединение Ф2 можно считать замещённым в малой степени.
Следовательно, были получены два частично водородзамещённых слоистых
оксида с разной степенью замещения ионов калия на ионы водорода.
3.2.2
Фотокаталитическая активность слоистых оксидов HxK2-xLa2Ti3O10*yH2O
Сравнение фотокаталитической активности образцов проводилось на основе
сравнения скоростей выделения водорода из разных суспензий под действием
УФ-излучения.
В случае изучения реакции разложения воды на кислород и водород под действием
света протекают следующие две полуреакции:
H+ + 2e- → H2
H2O → O2 + 4H+ + 4e-
В присутствии изопропилового спирта вместо второй реакции (окисление
воды) протекает окисление спирта:
ИПС → Ацетон + 2H+ + 2e-
Это происходит из-за большей выгодности процесса окисления ИПС по
сравнению с окислением воды, которое необходимо для восстановления водорода по
условию электронейтральности.
Изучение фотокаталитической активности образца Ф1 в разных средах
показало, что скорость выделения водорода, как и ожидалось, наибольшая в случае
использования изопропилового спирта (рис. 38).
В щелочной среде скорость выделения водорода минимальна (табл. 3). Однако
именно в ней были проведены опыты с целью сравнения активностей образцов с
разной степенью замещения. Это связано с тем, что при помещении образца Ф2 в
воду степень замещения в нём увеличивается, при этом контролировать это
увеличение невозможно. В то же время, обратное замещение, которое могло бы
протекать при помещении образца Ф1 в щелочной раствор, возможно, но проходит в
малой степени, как показано в разделе 3.1.6. Таким образом, проведение опыта по
изучению фотокаталитической активности в щелочной среде гарантирует сохранение
разости степеней замещения в Ф1 и Ф2.
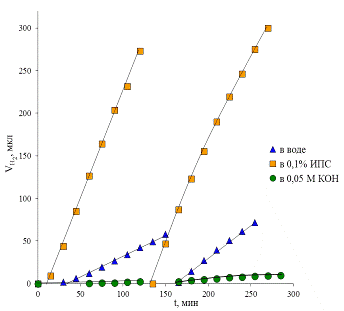
Рис. 38 Сравнение фотокаталитической активности образца Ф1 в реакциях
выделения водорода в разных средах.
Результаты этого эксперимента представлены на рисунке 39. Они показывают,
что образец с большей степенью замещения К+ на Н+ в K2La2Ti3O10
обладают большей фотокаталитеческой активностью в реакции разложения воды с
выделением водорода под действием УФ-излучения (табл. 3).
Таблица 3. Скорости выделения водорода в ходе фотокаталитических
экспериментов для образцов Ф1 и Ф2.
|
Скорость выделения Н2
|
0,05 М КОН
|
H2O
|
0,1 % ИПС
|
|
VФ1, мкл/ч
|
4,8
|
46,8
|
142,2
|
|
VФ2, мкл/ч
|
1,5
|
-
|
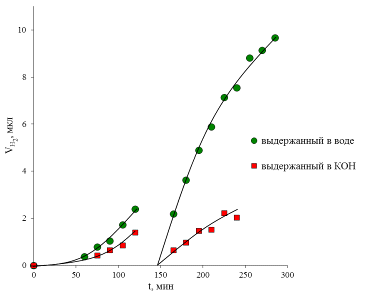
Рис. 39 Сравнение фотокаталитических активностей слоистых оксидов HxK2-xLa2Ti3O10*yH2O
с разной степенью замещения х/2 в реакции выделения водорода из 0.05М раствора KOH.
Скорости выделения водорода, представленные в таблице 3, рассчитаны по
кинетическим кривым, построенным после продувки, так как в первой половине
эксперимента наблюдается индукционный период.
Основные
результаты
1. Установлено, что слоистый перовскитоподобный оксид K2La2Ti3O10
неустойчив в водной среде по отношению к замещению межслоевых катионов калия на
протоны. Показано, что ионный обмен начинается уже при рН=10.
. Показано, что при рН=7-8 в слоистом оксиде K2La2Ti3O10
достигается степень замещения ≈75%, при этом ионный обмен происходит
крайне быстро (менее, чем за 10 мин). При рН<5 происходит дальнейшее
замещение К+ на Н+.
. Установлено, что обратное замещение Н+ на К+
в щелочной среде происходит лишь частично и приводит к степени замещения ≈70%.
Таким образом, процесс замещения К+ на Н+ в слоистом
оксиде K2La2Ti3O10 можно считать
практически необратимым.
. Показано, что замещение 50% катионов калия на протоны приводит к
увеличению фотокаталитической активности K2La2Ti3O10
в реакции выделения водорода из раствора KOH под действием УФ-излучения.
Автор благодарит своего научного руководителя Родионова Ивана Алексеевича
и коллектив кафедры химической термодинамики и кинетики за помощь в работе.
Работа была выполнена с использованием оборудования Научного Парка СПБГУ:
- РЦ «Рентгенодифракционные методы исследования»
МРЦ по направлению «Нанотехнологии»
РЦ «Термогравиметрические и калориметрические методы исследования»
РЦ «Методы анализа состава вещества».
Список литературы
1. Galasso F.S. Structure, Properties and Preparation of
Perovskite-type Compounds // Pergamon Press: Oxford. 1969.
2. Dion M., Ganne M., and Tournoux M. Nouvelles familles de
phases MIMII2Nb3O10 a
feullets ‘perovskites’ // Materials Research Bulletin. 1981. V. 16. P.
1429-1435.
3. K. Toda, J. Watanabe, M. Sato, Crystal structure
determination of ion-exchangeable layered perovskite compounds, K2La2Ti3O10
and Li2La2Ti3O10 // Materials Research Bulletin.
1996. V. 31. P. 1427-1435.
4. R. Nozaki, J. N. Kondo, C. Hirose et al. Vibrational
Study of Layered Perovskites M2La2Ti3O10
(M = Li, Na, K, Rb): Raman Spectra and Normal Mode Analysis // 2001. V. 105. P.
7950-7953.
5. Song-Ho Byeon, Hyo-Jin Nam. Neutron Diffraction and
FT-Raman Study of Ion-Exchangeable Layered Titanates and Niobates // Chem.
Mater. 2000. V.
12. P. 1771-1778.
6. Z. Tong, G. Zhang, S. Takagi, T. Shimada, H.
Tachibana, H Inoue. Preparation and Characterization of a Transparent Thin Film
of the Layered Perovskite, K2La2Ti3O10,
Intercalated with an Ionic Porphyrin // Chemistry Letters. 2005. V. 34. P.
632-633.
7. L. Zhang, J. Yang, W. Zhang, et al. Preparation of
ultrafine K2La2Ti3O10 by Stearic
Acid Method and Study on its Acid-exchanging Property // Chinese Journal of
Inorganic Chemistry. 2003. V. 19. P. 1217-1221.
8. J. Gopalakrishnan. Chimie Douce Approaches to the
Synthesis of Metastable Oxide Materials // American Chemical Society. 1995. V.
7. P. 1265-1275.
9. S. Uma, A. Raju, J. Gopalakrishnan. Bridging the
Ruddlesden-Popper and the Dion-Jacobson Series of Layered Perovskites:
Synthesis of Layered Oxides, A2-xLa2Ti3-xNbxO10
(A = K, Rb), exhibiting Ion Exchange // J. Mater. Chem. 1993. V. 3. P. 709-713.
10. J. Gopalakrishnan, V. Bhat. A2Ln2Ti3O10
(A = K or Rb; Ln = La or Rare Earth): A New Series of Layered Perovskites
Exhibiting Ion Exchange // Inorganic Chemistry. 1987. V. 26. P. 4299-4301.
11. Parmon V.N. Photocatalysis as a phenomenon: aspects of
terminology // Catalysis Today. 1997. V. 39. P. 137-144.
12. Пармон В.Н. Фотокатализ: вопросы терминологии // Фотокаталитическое
преобразование солнечной энергии. Гетерогенные, гомогенные и молекулярные
структурно-организованные системы. Отв. ред. К.И. Замараев и В.Н. Пармон. Н.:
Наука. 1991.
13. Takata T., Tanaka A., Hara M., Kondo J.N., Domen K.
Photocatalytic water decomposition by layered perovskites // Studies in Surface
Science and Catalysis. 2000. V. 130. P. 1943-1948.
14. W. Cui, Y. Qi,J. Hu, Y. Liang. The synthesis,
characterization and photocatalytic property of K2La2Ti3O10
// Advanced Materials Research. 2012. V. 415-417. P. 1992-1995.
15. Y. Ya-Hui, Q. Guan-zhou, C. Qi-yua et al. Influence of
calcination atmosphere on photocatalytic reactivity of K2La2Ti3O10
for water splitting // Trans. of Nonferrous Met. Soc. of China. 2007. V. 17. P.
836-840.
16. Huang Y., Wu J., Wei Y., Lin J., Huang M. Hydrothermal
synthesis of K2La2Ti3O10 and
photocatalytic splitting of water // Journal of Alloys and Compounds. 2008. V.
456. P. 364-367.
17. S. Ikeda, M. Hara, J. Kondo, K. Domen. Preparation of
K2La2Ti3O10 by Polymerized Complex
Method and Photocatalytic Decomposition of Water // Chem. Mater. 1998. V. 10. P.
72-77.
18. S. Ikeda, M. Hara, J. Kondo, K. Domen. Preparation of
a high active photocatalyst, K2La2Ti3O10,
by polymerized complex method and its photocatalytic activity of water
splitting // Journal of Materials Research. 1998. V. 13. P. 852-855.
19. K. Maeda and K. Domen. Photocatalytic Water Splitting:
Recent Progress and Future Challenges // The Journal of Physical Chemistry
Letters. 2010. V. 1. P 2655-2661.
20. V. Kumar, Govind, S. Uma. Investigation of cation (Sn2+)
and anion (N3-) substitution in favor of visible light
photocatalytic activity in the layered perovskite K2La2Ti3O10
// Journal of Hazardous Materials. 2011. V. 189. P. 502-508.
21. L. Liu, W. Cui, Y. Liang, F. Qiu. Efficiently
Photocatalytic Hydrogen Evolution over Ce-doped K2La2Ti3O10
under Visible Light Irradiation // Journal of chemistry. 2010. V. 68. P.
211-216.
22. Y. Ya-Hui, C. Qi-Yuan, Y. Zhou-Lan et al. Study on the
photocatalytic activity of K2La2Ti3O10
doped with zinc(Zn) // Applied Surface Science. 2009. V. 255. P. 8419-8424.
23. W. Cui, Y. Qi, L. Liu et al. Synthesis of PbS-K2La2Ti3O10
composite and its photocatalytic activity for hydrogen production // Progress
in Natural Science: Materials International. 2012. V. 22. P. 120-125.
24. Electronic Structure Analysis of Interface between
Support Surface and Cocatalyst for Water Splitting Layer Photocatalyst by DFT
Method // Chemistry Letters. 2007. V. 36. P. 170-171.
25. T. Takata, Y. Furumi, K. Shinohara et al.
Photocatalytic Decomposition of Water on Perovskites // Chem. Mater. 1997. V.
9. P. 1063-1064.
26. Takata T., Tanaka A., Hara M., Kondo J. N., Domen K. Recent
progress of photocatalysts for overall water splitting // Catalysis Today.
1998. Vol. 44. P. 17-26.
27. Takata T., Shinohara K., Tanaka A., Hara M., Kondo J.
N., Domen K. A highly active photocatalyst for overall water splitting with a
hydrated layered perovskite structure // Journal of Photochemistry and
Photobiology A: Chemistry. 1997. V. 106. P. 45-49.
28. W. Cui, L. Liu, L. Feng et al. Preparation of Pt/K2La2Ti3O10
and its photo-catalytic activity for hydrogen evolution from methanol water
solution // Science in China Series B Chemistry. 2006. V. 49. P. 162-168.
29. W. Cui, L. Liu, S. Ma et al. CdS-sensitized K2La2Ti3O10
composite: A new photocatalyst for hydrogen evolution under visible light
irradiation // Catalysis Today. 2013. V. 207. P. 44-49.
30. Y. Tai, J. Chen, C. Yang, B. Wan. Preparation of nano-gold on
K2La2Ti3O10 for producing hydrogen
from photo-catalytic water splitting // Catalysis Today. 2004. V. 97. P.
95-101.