|
Mr, г/моль
|
p, г/см3
|
Tплав., оС
|
Ткип.,
оС
|
Крит.
точка
|
Смол.,
Дж/моль*К
|
ДНо,
кДж/моль
|
рКа
|
n
|
|
60,05
|
1,0492
|
16,75
|
118,1
|
321,6
оС 5,79 МПа
|
123,4
|
-487
|
4,76
|
1,372
|
Уксусная кислота амбидентна в отношении
растворителей, т.к. имеет в своем составе полярную группу (-COOH)
и неполярную (-CH3).
Таким образом, она прекрасно растворима в воде и в некоторых органических
растворителях. Также она образует двойные и тройные азеотропы типа «уксусная
кислота-вода-органический растворитель».
Уксусная кислота является слабой органической
кислотой. Она способна реагировать с активными металлами с выделением водорода:
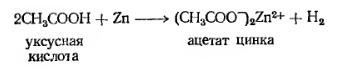
Превращаться в производные кислот под действием
соответствующих реагентов (важные реакции в орг. синтезе):
а) в галогенангидриды
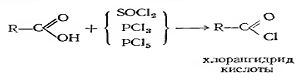
б) в сложные эфиры

в) в амиды

Восстанавливаться в этиловый спирт:
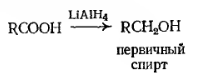
А также вступать в реакции замещения по
метильной группе, из которых наиболее важной является реакция
Геля-Фольгарда-Зелинского, использующаяся для получения важной аминокислоты -
глицина:
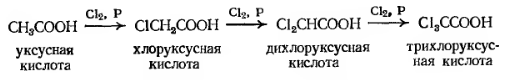
Причем с каждым последующим замещением, за счет
индуктивного эффекта галогена, увеличивается сила кислоты. Так, например,
трифторуксусная кислота по своей силе близка к минеральным кислотам [2][3].
. Способы получения
Наиболее выгодный и очевидный химический
способ получения уксусной кислоты заключается в окислении соответствующего
альдегида (ацетальдегида или же этаналя), который,
в свою очередь, получается одним из двух способов: гидратацией ацетилена
в присутствии солей ртути (II)
(реакция Чугаева), или окислением (дегидрированием) этилового спирта
над раскалённой медью: [2]
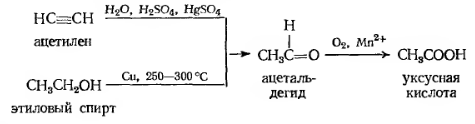
Ацетальдегид сам по себе легко окисляется
кислородом воздуха и медленно превращается в уксусную кислоту.
Первый способ получения этаналя по реакции
Чугаева не выгоден по многим причинам, среди которых работа с взрывоопасным
ацетиленом, загрязнение продукта ядовитыми солями ртути, большие объемы
реакторов и проч. Наиболее распространен второй способ получения из этилового
спирта (который производится в огромных количествах и сравнительно дешев).
Полученный ацетальдегид окисляется кислородом в
присутствии катализатора - солей марганца (II).
Именно этот метод и будет рассматриваться в дальнейшем.
Более современным является метод каталитического
карбонилирования метанола (метод Кольбе) [1] по реакции:
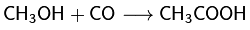
Этот метод позволяет достигать выходов порядка
99% по метанолу и 90% по СО. Он заключается в барботаже монооксида углерода при
температуре 180°С и давлениях 200-700 атм через смесь реагентов. Катализаторами
являются иодиды кобальта или родия, а так же, реже, соединения иридия. На
данный момент по этому методу получают около 50% всей уксусной кислоты,
производимой в мире.
Существуют так же и биохимические методы (т.е.
посредством брожения сахаров), однако, они редко применяются, в основном из-за
их малой производительности и сложности разделения полученной смеси продуктов.
. Обоснование выбора
технологического процесса методом окисления этаналя
Данный метод обладает рядом положительных
качеств, таких как:
) Дешёвые исходные реагенты
) Высокая производительность
) Относительно невысокие энергетические
затраты (50-60 оС)
) Высокие выходы по исходным реагентам
) Высокая степень превращения и
селективность процесса
) Относительно простое разделение смеси
Реакция проводится в колонне барботажного типа.
Повышенная температура необходима для предотвращения побочной реакции
образования перекисей (из-за которых может образовываться взрывоопасная смесь).
Верхний предел температуры определяется летучестью ацетальдегида. Уксусная
кислота является не только продуктом реакции, но и растворителем, что
значительно упрощает процесс. [3]
Основные технологические показатели процесса
сведены в таблицу ниже:

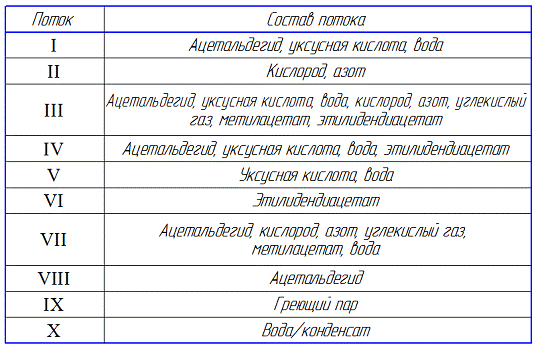
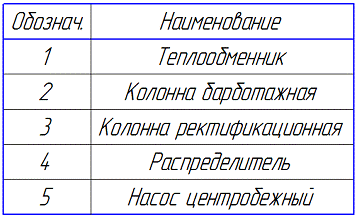
. Технологическая схема процесса
Ниже представлена упрощенная
технологическая схема получения уксусной кислоты окислением ацетальдегида.
Обозначения, приведенные на схеме, сведены в таблицы.
Исходная смесь (I) поступает
в теплообменник (1), где подогревается до температуры реакции (50-80 оС).
Обогрев производится греющим паром (IX), который
затем в виде конденсата (X) отводится из межтрубного
пространства. Подача альдегида производится центробежными насосами (5) и
регулируется вентилями.
Нагретый альдегид поступает в
барботажную колонну (2), снабженную змеевиковыми холодильниками (реакция -
экзотермическая). В колонну продувается технический кислород (II),
начинается окисление альдегида.
Полученные продукты в виде
паро-жидкостной смеси выводятся через верх колонны и поступают в распределитель
(4), после чего, часть реакционной массы поступает в первую ректификационную
колонну (3), предназначенную для очистки от легколетучих примесей (выхлопные
газы - VII). Далее,
остаток реакционной массы (IV) поступает во вторую
колонну, где полученная уксусная кислота (V) отводится
к потребителю или на склад. Кубовый остаток (VI),
содержащий этилидендиацетат также удаляется из колонны. Непрореагировавший
ацетальдегид (VIII)
возвращается в барботажную колонну, тем самым уменьшая количество изначально
необходимого альдегида, для обеспечения заданной производительности (повышается
конверсия сырья). [4].
Таблицы основных потоков и
обозначений:
Расчётная часть
. Составление материального баланса
Составление материального баланса
является одним из главных пунктов расчета технологических процессов. Его суть
заключается в законе сохранения массы (Приход-Уход=0). Благодаря составлению
уравнений мат. баланса можно оперировать различными показателями процесса
(концентрациями, массовыми потоками и т.д.) для оптимизации процесса.
Начать составлять баланс следует с
упрощенной схемы в виде блоков. Каждый из блоков будет включать в себя основную
функцию - смешение, окисление или распределение. Для данного процесса
блок-схема будет выглядеть следующим образом (состав потоков указан выше в
таблице):

Таким образом, видно, что
технологическая схема разбивается на четыре основных блока:
1) Блок смешения.
) Блок окисления (непосредственно сама
барботажная колонна).
) Блок разделения (первая
ректификационная колонна, из которой отводятся легколетучие вещества, выхлопные
газы).
) Блок разделения и возвращения
непрореагировавшего сырья в первый блок.
Во втором блоке происходит перераспределение
масс за счет химических превращений по основной реакции:
СН3СНО + 0,5О2 = СН3СООН
И по двум побочным реакциям образования
метилацетата и этилидендиацетата соответственно:
СН3СНО + 1,5О2 = СН3СООСН3
+ СО2 + Н2О
СН3СНО + О2 = СН3СН(ООССН3)2
+ Н2О
Исходя из заданной производительности по
продукту и селективности и степени превращения по ацетальдегиду можно рассчитать
необходимое количество этаналя по базисному уравнению:
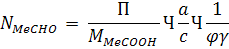
где N
- количество молей исходного ацетальдегида, необходимое для поступления в
первый реактор; M - молярная
масса продукта (уксусной кислоты); а и с - стехиометрические коэффициенты
реагента и продукта, 

Следовательно, в блок 1 должно поступать 31,6265
кмоль ацетальдегида. Следует учесть, что ацетальдегид поступает как чистый
(исходный), так и обратный (после четвёртого блока) по рециркуляции. Массовый
расход составляет:
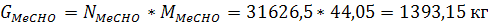
Рассчитаем также количества образующихся
побочных продуктов:
а) метилацетата:
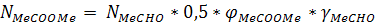
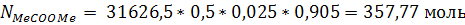

б) этилидендиацетата:
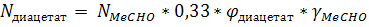
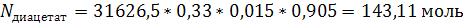
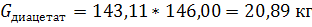
Где 0,5 и 0,33 переводные коэффициенты (с учетом
стехиометрии реакции). Рассчитаем количество кислорода, необходимое для реакции
(с учетом его конверсии, т.е. не полного превращения):

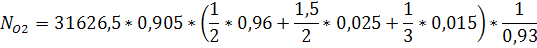
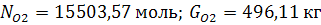
Технический кислород содержит небольшое
количество азота (2,5%), которое следует учитывать:


Непрореагировавший альдегид:
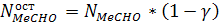


Количество образующегося углекислого газа:
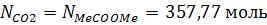
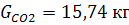
Вода, образовавшаяся по реакциям:

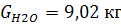
Следует учитывать, что вода так же поступает с
исходным сырьем.
Далее смесь поступает в разделительный блок 3,
откуда отводятся выхлопные газы, вода и частично ацетальдегид. Остальная смесь
протекает дальше в блок 4.
Альдегид (в атмосферу):
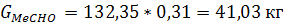

Альдегид (в 4-ый блок):


Так как весь альдегид, переходящий в блок 4,
затем поступает обратно в блок 1, то теперь можно рассчитать количество свежего
альдегида, поступающего в 1-ый блок на смешение:
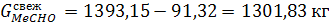

А так же количества примесей (уксусной кислоты и
воды) в свежем альдегиде:

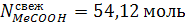
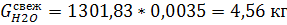
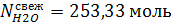
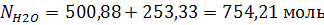
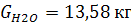
Уксусная кислота образуется в результате реакции
и при поступлении с свежим альдегидом:


Часть воды удаляется вместе с уксусной кислотой
(0,2% по массе):

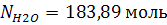
Баланс по воде составляется следующим образом:
образованная по реакции + с свежим альдегидом - с кислотой - в атмосферу = 0.
Тогда:

Все расчетные значения для удобства сводятся в
таблицу потоков и таблицу материального баланса.
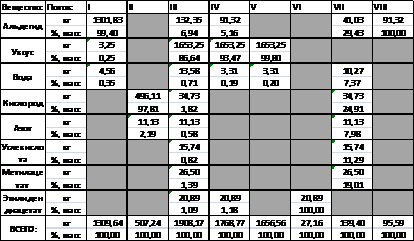
*Примечание №1: метилацетат имеет
температуру кипения 57 оС и является легколетучим веществом, поэтому
он удаляется с выхлопными газами т.е. в третьем блоке (первой ректификационной
колонне).

*Примечание №2: следует также учитывать, что в
колонне находится постоянное количество уксусной кислоты (в качестве растворителя),
и рециркулирующий ацетальдегид.
Заключение
кислота альдегид этаналь
В заключение следует отметить, что данный метод
является практически основным в получении уксусной кислоты. В последнее время
он все чаще замещается методом Кольбе (карбоксилированием метилового спирта),
который даёт более высокие выходы по исходным реагентам.
Данный метод обладает и недостатками, такими
как, например, выброс в атмосферу непрореагировавшего ацетальдегида и
метилацетата, применение повышенного давления, образование побочных продуктов и
пр.
Тем не менее, около 50% всей уксусной кислоты,
производимой в мире, получают именно таким способом, используя в качестве
катализатора ацетаты марганца (II).
В целом, подобный метод является одним из наиболее удобных и выгодных для
технологии.
Уксусная кислота является одним из наиболее
ходовых и используемых продуктов сырья, а так же крайне востребована в пищевой
и химической промышленности.
Список использованной литературы
1) «Экологический фактор или
окружающая среда как стимул эволюции промышленной химии». Роджер А. Шелдон
) «Органическая химия». Моррисон Р.,
Бойд Р., 1974 г.
) «Механизмы реакций в органической
химии». Сайкс П., 1991 г.
) «Сборник заданий и методических
указаний по расчету материального баланса химико-технологических производств».
МИТХТ, 2008 г.
Дополнительная литература:
5) «Общий курс процессов и аппаратов
химической технологии». Айнштейн В.Г., Захаров М.К., 1999 г.
) «Краткий справочник
физико-химических величин». Равдель А.А., 1999 г.
) «Схемы химико-технологических
процессов». Носов Г.А., Вышнепольский В.И., Лапшенков Г.И., 2011 г.