Потенциометрический анализ лекарственного препарата: фенибут
Тольяттинский
государственный университет
Институт
Химии и Инженерной Экологии
Кафедра
«Химия и химические технологии и процессы»
Лабораторная работа
Потенциометрический анализ
лекарственного препарата: фенибут
Студент:
Щеголева А.И
Группа: ХИМб-1202
Преподаватель:
к.х.н., доцент
Писарева В.С
Тольятти,
2014 г.
Теоретическая часть
Электрохимические методы основаны на измерении электрических параметров
электрохимических явлений, возникающих в исследуемом растворе. Такое измерение
осуществляют с помощью электрохимической ячейки, представляющей собой сосуд с
исследуемым раствором, в который помещены электроды. Электрохимические процессы
в растворе сопровождаются появлением или изменением разности потенциалов между
электродами или изменением величины тока, проходящего через раствор.
Одной из разновидностей электрохимических методов является
потенциометрия, основанная на использовании зависимости электродвижущей силы
(ЭДС) от активности (концентрации) анализируемого иона. Таким образом, аналитический
сигнал, используемый в данном методе ЭДС.
Электродвижущая сила (ЭДС) - физическая величина,
характеризующая способность вещества проводить электрический ток под
воздействием электрического поля. [1]
Зависимость ЭДС электрохимической цепи от активности
анализируемого иона описывают уравнением Нернста:
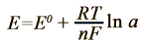
где E0 -
стандартная ЭДС цепи; n -
заряд анализируемого иона с соответствующим знаком; R - универсальная газовая постоянная, равная 8,314 Дж/(моль • K); T - абсолютная температура раствора; F - число Фарадея, равное 96 500 Кл/моль; a - активность анализируемого иона.
Соотношение активности анализируемого иона с его
концентрацией выражается следующей формулой:
a = f • C
где С - концентрация анализируемого иона; f - коэффициент активности.
Для потенциометрических измерений применяют
электрохимические цепи, содержащие два электрода: индикаторный и электрод
сравнения. Если оба электрода погружены в анализируемый раствор, то такая цепь
называется цепью без переноса. Если электрод сравнения соединяют с
анализируемым раствором через жидкостный контакт (солевой мостик), то цепь
называется цепью с переносом.
Индикаторным является электрод, потенциал которого
определяет активность анализируемого иона в соответствии с уравнением Нернста.
Электродом сравнения является электрод с постоянным потенциалом, не зависящим
от концентрации ионов в растворе.
Электродвижущую силу электрохимической цепи определяют
разностью потенциалов двух электродов:
= Eср - Eин
где Eср -
потенциал электрода сравнения; Eин -
потенциал индикаторного электрода.
Потенциометрические методы анализа подразделяются на
два вида:
· прямая потенциометрия (ионометрия);
· потенциометрическое титрование.
Прямая потенциометрия основана на определении
концентрации анализируемого иона непосредственно по измеренной ЭДС цепи,
содержащей соответствующий ионоселективный электрод. Расчет выполняется по
указанному выше уравнению Нернста, если известны все параметры, входящие данное
уравнение. Однако величина f
неизвестна, поэтому используют приемы, позволяющие обойти эти трудности.
Метод градуировочного графика заключается в построении
графика в координатах ЭДС - lg C с использованием стандартных
растворов анализируемого иона, имеющих одинаковую ионную силу растворов. В этом
случае f остается постоянной и график
становится линейным (рис. 1).
Затем при той же ионной силе измеряют ЭДС цепи с
анализируемым раствором и по графику определяют концентрацию раствора.
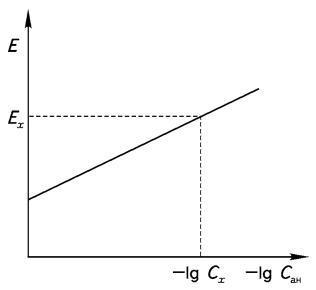
Рисунок 1 - Градуировочный график для определения
концентрации методом прямой потенциометрии
Метод добавок. Это группа методов, основанная на
введении в анализируемый раствор добавки анализируемого иона с известной
концентрацией.
Потенциометрическое титрование - второй вид
потенциометрического метода анализа. Основан на определении точки
эквивалентности по резкому изменению в ней ЭДС цепи. Как следует из уравнения
Нернста, при резком изменении концентрации иона в точке эквивалентности
происходит и резкое изменение ЭДС.
Точку эквивалентности при потенциометрических
титрованиях определяют графическим методом на кривой титрования. Обычно
используют одну из следующих видов кривых титрования: интегральную,
дифференциальную или кривую Грана (рис. 2).
Интегральная кривая титрования (рис. 2, а) строится в
координатах E - Vт. Точка эквивалентности находится в середине скачка
титрования.
Дифференциальная кривая титрования (рис. 2, б)
строится в координатах  - Vт.
Точка эквивалентности находится в вершине кривой титрования. Дифференциальная
кривая титрования дает более точное определение точки эквивалентности, чем
интегральная.
- Vт.
Точка эквивалентности находится в вершине кривой титрования. Дифференциальная
кривая титрования дает более точное определение точки эквивалентности, чем
интегральная.

Рисунок 2 - Кривые потенциометрического титрования: а
- интегральная кривая; б - дифференциальная кривая; в - кривая титрования Грана
Кривая титрования в методе Грана (рис. 2, в) строится
в координатах
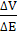 - Vт. Точка эквивалентности находится на пересечении двух прямых
линий. Этой кривой удобно пользоваться для определения точки эквивалентности
при титровании разбавленных растворов.
- Vт. Точка эквивалентности находится на пересечении двух прямых
линий. Этой кривой удобно пользоваться для определения точки эквивалентности
при титровании разбавленных растворов.
В потенциометрическом титровании можно использовать
все виды титрования: кислотно-основное, осадительное, комплексиметрическое и
окислительно-восстановительное.
Цели и задачи работы
Цель работы: определение содержания активного вещества в лекарственном
препарате методами потенциометрического титрования и прямой потенциометрии.
Задачи:
1. Подготовить лекарственный препарат к анализу.
. Рассчитать теоретический объем титранта, требуемый для
титрования данного препарата.
. Провести потенциометрическое титрование
. Построить прямые потенциометрического титрования и определить
точки эквивалентности.
. Провести анализ препарата методом прямой потенциометрии.
. Методом градуировочного графика определить содержание активного
вещества в анализируемом растворе.
. Определить относительную погрешность и сделать выводы о
проделанной работе.
Расчетная часть
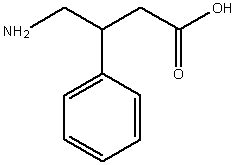
Препарат: фенибут (активное вещество: аминофенилмасляная кислота).
Масса
активного вещества: 250 мг
Состав
на 1 таблетку: действующее вещество - фенибут; вспомогательные вещества -
лактоза, крахмал картофельный, кальция стеарат.
ИЮПАК: (±)-4-амино-3-фенилбутановая кислота
Брутто-формула: C10H13NO2
Молярная масса: 179,216 г/моль.
Молекула препарата имеет две функциональные группы: аминогруппу,
проявляющую основные свойства, и карбоксильную группу, обладающую кислотными
свойствами.
Титровать препарат будем по карбоксильной группе, т.е. как слабую
кислоту. Титрант - сильное основание NaOH.
· Расчеты для потенциометрического титрования
Стандартизация раствора щелочи по стандартному раствору хлороводородной
кислоты:
. Предварительно вымытую бюретку ополаскивают 2-3 раза малыми порциями
(3.00-5.00 мл) приготовленного раствора NaOH. Заполняют бюретку раствором щелочи выше деления «0»,
удаляют пузырьки воздуха из носика бюретки, уровень раствора выставляют на
нулевое деление по нижнему мениску.
2. Отбирают аликвоту (20.00 мл) стандартного раствора хлороводородной
кислоты в коническую колбу для титрования вместимостью 250.00 мл и добавляют
2-3 капли фенолфталеина.
. Титруют раствором щелочи сначала быстро, а под конец по каплям до
перехода бесцветной окраски в розовую, одновременно содержимое колбы
перемешивают плавным вращательным движением руки. Операцию повторяют до
получения не менее трех значений, расходящихся не более чем на 0.30 %.
. Результаты измерений сводят в таблицу 1.
Таблица 1. Стандартизация раствора щелочи
V(0,1 н HCl), мл
|
V(NaOH), мл
|
Vсреднее(NaOH), мл
|
|
1
|
20,0
|
22,0
|
22,0
|
|
2
|
20,0
|
22,0
|
22,0
|
|
3
|
20,0
|
22,0
|
22,0
|
. Молярную концентрацию раствора щелочи рассчитывают по формуле:
(NaOH) = C (HCl) * V (HCl) / V (NaOH)
где V(HCl) - объем хлороводородной кислоты в конической колбе,
мл; V(NaOH) - объем щелочи, израсходованной на титрование
кислоты, мл; c(HCl) - молярная концентрация хлороводородной кислоты,
моль/л
Если значения молярной концентрации щелочи по результатам трех титрований
различаются не более чем на 0.30%, берут среднее арифметическое.
В итоге, концентрация стандартизированного раствора щелочи:
(NaOH) = 0,1 * 20 / 22 = 0,0909 моль/л
Расчет расхода титранта:
Одна таблетка препарата содержит 250 мг активного вещества. Готовим
раствор 100 мл и берем на анализ пробу 50 мл. Рассчитаем, какой теоретический
объем 0,0909 М титранта потребуется для титрования 50 мл пробы раствора.
Молярная масса аминофенилмасляной кислоты М=179,216 г/моль.
Количество молей активного вещества в 100 мл:
(к-ты)= m/M = 0,25 г / 179,216 г/моль = 1,395*10-3 моль.
Количество молей активного вещества в 50 мл:
(к-ты) = ½ * 1,395*10-3 моль = 0,6975*10-3 моль.
эквивалент аминофенилмасляной кислоты вступает во взаимодействие с 1
эквивалентом щелочи. Объем 0,0909 М щелочи, необходимый на титрование 0,7*10-3
моль вещества:
(NaOH) = (0,7*10-3 моль / 0,0909
моль/л)*1000 мл = 7,67 мл.
Таким образом, на титрование препарата должно затратиться 7,67 мл 0,0909
М раствора NaOH.
· Расчеты для прямой потенциометрии
Для проведения анализа методом прямой потенциометрии необходимо
приготовить стандартные растворы кислоты 0,1 М и 0,05 М объемом 50 мл.
Рассчитаем массу навески, необходимой для приготовления растворов данной
концентрации.
Количество молей активного вещества в 50 мл 0,1 М раствора:
= (0,1 M * 50 мл) / 1000 мл = 0,005 моль.
Масса активного вещества для 0,1 М раствора:
= 0,005 моль * 179,216 г/моль = 0,8961 г
По данным фармацевтической компании в 1 таблетке содержится 0,25 г
активного вещества. Взяли навеску 4 таблеток препарата, в которой содержится 1
г активного вещества. Масса навески составила 2,057 г.
Таким образом, чтобы содержание активного вещества в навеске составило
0,8961 г необходимо взять навеску препарата массой:
= (2,057 г * 0,8961 г) / 1 г = 1,8433 г.
Для приготовления стандартного раствора 0,05 М, нужно взять навеску в 2
раза меньше, так как концентрация требуемого раствора в 2 раза меньше. Таким
образом, масса навески препарата для стандартного раствора 0,05 М:
= 1,8433 г / 2 = 0,9216 г.
Экспериментальная часть
Прямая потенциометрия
Взяли две навески препарата, предварительно растерев его в порошок в
ступке. Первая навеска m1 =
1,843 г используется для приготовления 50 мл раствора с концентрацией 0,1 М.
Для этого растворили препарат в малом количестве воды в конической колбе, затем
перелили содержимое в мерную колбу объемом 50мл и долили воды до отметки.
Анализируемый раствор с концентрацией 0,1 М готов (К=1). То же самое повторили
и со второй навеской m2 =
0,922 г, получили анализируемый раствор с концентрацией 0,05 М (К=1). Далее, от
раствора 1 отобрали 5 мл пипеткой Мора и переместили в другую мерную колбу
объемом 50 мл, долили воды до отметки - получили раствор 3 с концентрацией 0,01
М. Затем отобрали 5мл раствора 3 и еще разбавили водой до отметки 50 мл -
получили раствор 5 с концентрацией 0,001 М. Проделав то же самое с раствором 5,
получили раствор 7 с концентрацией 0,0001 М. Повторив манипуляции с раствором 2
(0,05 М) получили: раствор 4 (0,005 М), раствор 6 (0,0005 М), раствор 8
(0,00005 М). Все растворы проанализировали с помощью потенциометра, полученные
данные записали в таблицу 1.
Таблица 1. Данные по прямой потенциометрии
|
№ раствора
|
С, M
|
pH
|
E, mV
|
-lgC
|
|
1
|
0,1
|
2,71
|
224,1
|
1,0
|
|
2
|
0,05
|
2,931
|
215,8
|
1,3
|
|
3
|
0,01
|
3,325
|
192,5
|
2,0
|
|
4
|
0,005
|
3,461
|
183,4
|
|
5
|
0,001
|
3,867
|
160,5
|
3,0
|
|
6
|
0,0005
|
4,068
|
145,2
|
3,3
|
|
№ раствора
|
С, M
|
pH
|
E, mV
|
-lgC
|
|
7
|
0,0001
|
4,634
|
115,0
|
4,0
|
|
8
|
0,00005
|
5,049
|
92,7
|
4,3
|
На основании этих данных построен графики зависимости ЭДС от -lgC (рис. 3) и рН от -lgC (рис. 4)
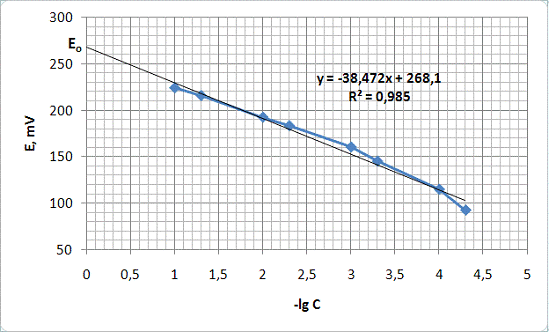
Рисунок 3 - График зависимости ЭДС от -lgC

Рисунок 4 - График зависимости рН от -lgC.
Потенциометрическое титрование
Производим титрование 50 мл приготовленного раствора фенибута. Измеряем
ЭДС и рН раствора каждый раз, когда добавляем 1мл титранта. Полученные данные
заносим в таблицу 2.
Таблица 2. Данные по потенциометрическому титрованию
|
V NaOH
|
pH
|
E, mV
|
∆Е
|
∆ V
|
∆Е/∆V
|
∆V/∆Е
|
|
0
|
3,234
|
201,6
|
|
|
|
|
|
1
|
2,277
|
198,3
|
13,3
|
1
|
13,3
|
0,075
|
|
2
|
3,387
|
182,7
|
15,6
|
1
|
15,6
|
0,064
|
|
3
|
3,538
|
165,2
|
17,5
|
1
|
17,5
|
0,057
|
|
4
|
3,878
|
145,7
|
19,5
|
1
|
19,5
|
|
5
|
4,183
|
121,3
|
24,4
|
1
|
24,4
|
0,041
|
|
6
|
4,530
|
90,3
|
31
|
1
|
31
|
0,032
|
|
7
|
5,153
|
48,7
|
41,6
|
1
|
41,6
|
0,024
|
|
8
|
8,705
|
-116,0
|
164,7
|
1
|
164,7
|
0,006
|
|
9
|
9,629
|
-156,7
|
40,7
|
1
|
40,7
|
0,025
|
|
10
|
10,013
|
-185,3
|
28,6
|
1
|
28,6
|
0,035
|
|
11
|
10,308
|
-206,8
|
21,5
|
1
|
21,5
|
0,047
|
На основе этих данных построены кривые потенциометрического титрования. А
именно графики зависимости: рН от объема титранта (Рис.5.), ЭДС от объема
титранта (Рис.6.), ∆E/∆V от объема титранта(Рис.7.), ∆V/∆E от объема титранта (Рис.8.).

Рисунок 5 - Интегральная кривая. График зависимости рН от объема титранта

Рисунок 6 - Интегральная кривая. График зависимости ЭДС от объема
титранта

Рисунок 7 - Дифференциальная кривая. График зависимости ∆Е/∆V от объема титранта

Рисунок 8 - Кривая титрования Грана. График зависимости -∆V/∆E от объема титранта.
Расчет содержания активного вещества по экспериментальным данным
Прямая потенциометрия.
Была измерена ЭДС 100 мл раствора 1 таблетки препарата, которая составила
201,6 мВ. По графику зависимости E от -lgC кислоты можно определить
концентрацию активного вещества (Рис. 9)
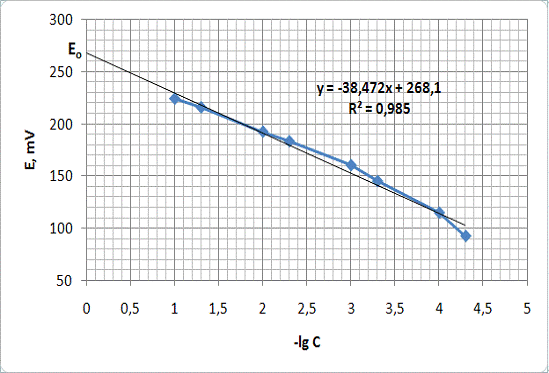
Рисунок 9 - Определение концентрации вещества методом прямой
потенциометрии
Из уравнения прямой:
=-38,473x+268,1
x =
(268,1-201,6)/38,473 = 1,73
отсюда концентрация активного вещества:
С = 10-1,47 = 0,018 М
Был также измерен pH 100
мл раствора 1 таблетки препарата, который составил 3,234. По графику
зависимости pH от -lgC кислоты (Рис.10):
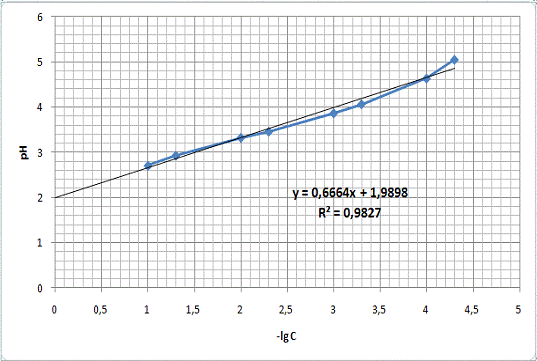
Из уравнения прямой:
=0,6664x+1,9898
x =
(3,234-1,9898)/0,6664 = 1,868
отсюда концентрация активного вещества:
С = 10-1,868 = 0,013 М
Средняя концентрация по данным pH и E для прямой потенциометрии:
Сср = (0,018+0,013)/2 = 0,015 М
Масса активного вещества в 100 мл:
= [(0,015 М * 100 мл) / 1000 мл]*179,216 г/моль = 0,26 г
Потенциометрическое титрование
Найдем концентрацию активного вещества исходя из количества затраченного
титранта.
Данные, полученные из графиков:
э интегр E = 7,6 мл
Vэ
интегр pH = 7,5 мл
Vэ
дифф = 8,0 мл
Vэ
гран = 8,0 мл
Vэ ср
= (7,6 + 7,5 + 8,0 + 8,0)/4 = 7,775 мл
В 7,775 мл 0,0909 М раствора щелочи содержится:
n =
(0,0909 М *7,775 мл) /1000 мл = 0,706*10-3 моль
Отсюда масса оттитрованного вещества:
m =
0,706*10-3 моль * 179,216 г/моль = 0,1265 г
Тогда масса вещества в 100 мл этого раствора:
m =
0,1265*2 = 0,253 г
Расчет относительной погрешности
Относительная погрешность определяется по следующей формуле:
δ = 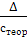 · 100%,
· 100%,
где стеор - теоретическое (расчетное) значение величины; Δ - абсолютная погрешность,
рассчитываемая по формуле:
Δ = |спрак - стеор|
· для прямой потенциометрии
Δ (фенибут) = |0,26 г - 0,25 г| = 0,01
г
δ (фенибут) = 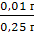 · 100% =
4%
· 100% =
4%
· для потенциометрического титрования
Δ (фенибут) = |0,253 г - 0,25 г| =
0,003 г
δ (фенибут) =  · 100% = 1,2%
· 100% = 1,2%
Заключение
В ходе данной работы были освоены методы потенциометрического титрования
и прямой потенциометрии, был проведен анализ лекарственного препарата -
фенибута.
На нейтрализацию 100 мл раствора 1 таблетки, содержащей по данным
фармацевтической компании 0,25 г активного вещества, был затрачено 7,775 мл
0,0909 М раствора щелочи. По экспериментальным данным были построены
интегральная, дифференциальная кривые титрования, а также кривая титрования
Грана. Были построены прямые потенциометрии.
По графикам были определены точки эквивалентности и на основании
полученных данных рассчитано содержание активного вещества в 1 таблетке.
Полученные результаты:
Потенциометрическое титрование:
m =
0,253±0,003 г
Относительная погрешность δ = 1,2%
Прямая потенциометрия:
m =
0,26±0,01 г
Относительная погрешность δ = 4%
раствор
хлороводородный фенибут кислота
Литература
1. Большая
советская энциклопедия: в 30 т. - М. : Советская энциклопедия, 1969-1978
2. Евстратова,
К.И. Физическая и коллоидная химия: Учеб. для фарм. вузов и
факультетов/К.И.Евстратова, Н.А, Купина, Е.Е. Малахова; под ред. К. И.
Евстратовой. М. : Высш. шк., 1990. 487 с.
. Конспект
лекций по аналитической химии. Количественный анализ: Учеб. пособие для студ.
вузов /В.В. Болотов, Е.Н. Свечникова, Т.А. Костина и др.; под ред. В.В.
Болотова. Харьков : Изд-во НФаУ; Оригинал, 2005. 200 с.
. Лопатин,
Б.А. Теоретические основы электрохимических методов анализа. Учеб. пособие для
ун-тов. М. : Высш. школа, 1975. 295 с.
. Физическая
химия [Электронный ресурс]: учебное пособие / В.И. Грызунов, И.Р. Кузеев, Е.В.
Пояркова и др. М. : ФЛИНТА, 2014. 251 с.