Особливості змін біохімічних показників ферокінетики, системи ПОЛ-АОЗ та маркерів ендогенної інтоксикації у хворих на хронічні захворювання кишечнику
ЗМІСТ
ПЕРЕЛІК
СКОРОЧЕНЬ
ВСТУП
Розділ
I. ОГЛЯД ЛІТЕРАТУРИ
.1
Хронічні запальні захворювання кишечнику, етіологія, патогенез, статистика
.2
Анемічний синдром. Механізм та патогенез анемічного явища
.3
Система ПОЛ-АОЗ, явище ендотоксемії та показники ферокінетики
Розділ
ІІ. МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕНЬ
.1
Матеріали та об’єкти дослідження
.2
Роль оксидативного стресу та ендотоксикозу у хворих на хронічні запальні
захворювання кишечнику з анемією
.3
Статистична обробка результатів
Розділ
ІІІ. РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
.1
Зміни показників ферокінетики, які приймають участь у еритропоезі хворих на
хронічні запальні захворювання кишечнику з анемією
.2
Рівень оксидативного стресу та ендотоксикозу у хворих на хронічні запальні
захворювання кишечнику з анемією
Розділ
IV. ОХОРОНА ПРАЦІ
ВИСНОВКИ
СПИСОК
ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
захворювання кишечник анемія
ендотоксикоз
ПЕРЕЛІК СКОРОЧЕНЬ
АОА - антиокислювальна активність сироватки
АОЗ - антиоксидантний захист
АОС - антиоксидантна система
АХЗ - анемія хронічного захворювання
ВРО - вільно радикальне окислення
ЗДА - залізодефіцитна анемія
ЗЗЗС - загальна залізозв’язуюча здатність
сироватки крові
КТ- каталаза
МДА - малоновий діальдегід
МСМ - молекули середньої маси
НВК - неспецифічний виразковий коліт
НЗЗС - ненасичена залізозв’язуюча здатність
сироватки крові
НТ Fe - насичення трансферину залізом-
NO-синтази
ПОЛ - перекисне окислення ліпідів
СОД - супероксиддисмутаза
ТДК - тіолдисульфідний коефіцієнт
ТДС - тіолдисульфідна система
ФНП - фактор некрозу пухлини
ХЗЗК - хронічні запальні захворювання кишечнику
ХК - хвороба Крона
ЦП
- церулоплазмін
ШКТ
- шлунково-кишковий тракт
ЕІ
- ендогенна інтоксикація
Вступ
Ріст захворюваності на запальні захворювання
кишечнику - одна з актуальних проблем сучасної гастроентерології, важливість
якої для практичної охорони здоров'я визначається її медико-біологічним і
соціальним аспектами [2]. Труднощі лікування запальних захворювань кишечнику
зумовлені двома основними аспектами: з одного боку, це резистентниіі до терапії
коліт, а з іншого побічні ефекти препаратів і їх непереносимість [1].
Анемія - це загальна проблема при запальних
захворюваннях кишечнику [5]. Через гіпоксію відбувасться перероз поділ крові з
мезентеріальних судин, що призводить до погіршання кровопостачання кишечнику, що
додатково погіршує процеси всмоктування і репарації слизової оболонки самого
кишечнику. Анемічниіі синдром, впливаючи на всі органи і системи, значно знижує
якість життя пацієнтів. У пацієнтів виявляється як залізодефіцитна анемія
(ЗДА), так і анемія хронічного захворювання (ЛХЗ) [6].
АКТУАЛЬНІСТЬ
Запальні захворювання кишечника (ЗЗК) є складною
проблемою сучасної гастроентерології, оскільки етіологія цих захворювань
залишається невідомою, а патогенез - недостатньо вивченим. Обидва захворювання
- неспецифічний виразковий коліт (НВК) та хвороба Крона (ХК), більше
розповсюджені серед людей працездатного віку, супроводжуються великою кількістю
ускладнень і значною інвалідизацією та летальністю [14]. НВК найчастіше
зустрічається у віці 15-35 років і чим молодшим є пацієнт у момент встановлення
діагнозу, тим гірший його прогноз в порівнянні з хворими, у яких захворювання
виявлене в зрілому віці [26]. У всьому світі, особливо в розвинених країнах,
ЗЗК продовжують бути однією з важливих медико-соціальних проблем у зв’язку з
тенденцією до агресивного перебігу[32]. Блискавичний перебіг НВК в 15-20%
випадків вимагає хірургічного лікування і супроводжується летальністю більше
25%. При цьому частота розвитку абдомінальних ускладнень (кишкова кровотеча,
токсична дилятація товстої кишки, перфорація, перитоніт) складає 12-44,9% і не
має тенденції до зниження [1]. В даний час поширеність НВК в різних країнах
світу коливається, за різними даними, від 85 до 120 випадків на 100 000
населення, а поширеність ХК складає 58-150 випадків на 100 000 населення. [18].
При ЗЗК визначена висока ймовірність
малігнізації диспластично зміненої слизової оболонки товстої кишки [20],
розвитку колоректального раку, який характеризується тенденцією до поширення як
в Україні, так і в інших країнах Європи [19]. У патогенезі НВК та ХК важлива
роль відводиться загибелі клітин внаслідок апоптозу, викликаного
імунокомпетентними клітинами [33].
Одна третина хворих на ЗЗК страждають від
рецидивуючої анемії [43]. При середній та важкій формах НВК завжди присутній
анемічний синдром. Анемія має істотний вплив на якість життя хворих [11],
оскільки лежить в основі таких клінічних проявів, як постійна втома,
запаморочення, слабкість, тощо [10].
Патогенез анемії при ЗЗК на сьогодні до кінця не
з’ясований. Механізми її розвитку різноманітні та включають як дефіцит заліза
та недостатність вітамінів причетних до гемопоезу (В12 та фолієвої кислоти),
так і аутоімунний гемоліз еритроцитів [42]. Також розвиток анемії при ХК і НВК
пов'язують з надмірним утворенням цитокінів - фактора некрозу пухлин (ФНП-α),
інтерферону-g,
інтерлейкіну-1, трансформуючого фактора росту [59].
Усе це свідчить, що анемія при ЗЗК має
неоднорідний характер і може бути сукупністю залізодефіцитної (ЗДА), В12-
фолієводефіцитної, анемії хронічного захворювання (АХЗ) та аутоімунної
гемолітичної анемії. Складність і неоднозначність даних, що стосуються
механізмів розвитку анемії при ЗЗК, привертають увагу багатьох дослідників і
клініцистів. Однак, на сьогодні в доступній літературі нами не виявлено даних,
які б відображали наскільки часто зустрічається кожен вид анемії, не розроблено
підходів до диференціальної діагностики та лікування анемії з урахуванням
патогенетичних механізмів формування. Наявні літературні дані недостатні для
розробки методів профілактики, індивідуалізованого підходу до комплексного
лікування ЗЗК, крім того, ці відомості іноді суперечливі. Все це свідчить про
необхідність більш детального вивчення даної проблеми.
Тому, метою роботи було дослідити особливості
змін біохімічних показників ферокінетики, системи перекисного окислення ліпідів
- антиоксидантного захисту та маркерів ендогенної інтоксикації у хворих на
хронічні захворювання кишечнику.
Для досягнення поставленої мети були поставлені
наступні завдання:
Визначити зміни біохімічних показників,
ферокінетики крові хворих на неспецифічний виразковий коліт за різними
ступенями анемії;
Визначити зміни біохімічних показників,
ферокінетики крові хворих на хворобу Крона;
Встановити рівень оксидативного стресу та
ендотоксикозу у хворих на хронічні запальні захворювання кишечнику з анемією.
Для виконання поставлених завдань
використовували методи: спектроскопії та статичної обробки даних.
1. ОГЛЯД ЛІТЕРАТУРИ
.1 Хронічні запальні захворювання кишечнику,
етіологія, патогенез, статистика
Хронічні запальні захворювання кишечнику (ХЗЗК)
- одна з актуальних проблем сучасної гастроентерології, важливість якої для
практичної охорони здоров’я визначається її медико-біологічним і соціальним
аспектами. ХЗЗК починаються у молодому та середньому віці і відносяться до
найбільш тяжких хвороб травного каналу. Діагностичні помилки, невчасне й
неадекватне лікування призводять до збільшення числа хворих із тяжким
перебігом, протяжними формами, системними проявами, що обумовлює тривалу
непрацездатність, інвалідізацію, і навіть смерть хворих. Запальні захворювання
кишечника - загальний термін, яким позначають групу хронічних запальних
захворювань невідомої етіології. Хронічні захворювання можна розділити на дві
великі групи: виразковий коліт і хвороба Крона [1].
Неспецифічний виразковий коліт (НВК) - це
поширене у всьому світі хронічне, ідіопатичне запальне захворювання слизової
оболонки товстої кишки, що вирізняється прогресуючим перебігом, можливим
розвитком низки ускладнень, тому є важливою соціальною проблемою. Крім того,
найчастіше НВК первинно виникає у молодому віці [2].
Як і НВК, хвороба Крона (ХК) - хронічне
рецидивуюче захворювання, яке характеризується неспецифічним, імунним,
трансмуральним, гранулематозним запаленням з сегментарним ураженням травного
тракту [3].
Хвороба Крона була виділене як відокремлена
нозологічна одиниця в 1932 році Баррилом Бернардом Кроном і його колегами.
Хронічне запалення і виразкування при даному захворюванні найчастіше
виявляється в термінальному відділі тонкої кишки, однак можуть пошкоджуватися
всі частини травного тракту: від ротової порожнини до прямої кишки. Також може
уражатися шкіра, найчастіше - в перианальній зоні.
Захворюваність на ідіопатичні запальні
захворювання кишки значно варіює в різних географічних областях. Недуга
набагато частіше зустрічається в розвинених країнах: в північній Європі, США,
Японії. В цих країнах захворюваність складає від 4 до 65 на 100000 населення.
Виявляється і генетична схильність. Так, в ізраїльских євреїв захворюваність
набагато вища, ніж в арабських бедуїнів, які мешкають на тій же території.
Разом з тим захворюваність ізраїльских євреїв набагато менша, ніж у мешканців в
США. Ці дані показують, що більше значення у розвитку захворювання мають
чинники навколишнього середовища, ніж генетичні чинники. Таким чином, на основі
епідеміологічних досліджень ХК і НВК на сьогодні являють собою захворювання,
які розвиваються в результаті генетичної сприйнятливості до ще не встановленого
агента навколишнього середовища.
Вважається, що при ХК спостерігається дефект в
одному з рецесивних генів, чкий контролюює ефективну імунну відповідь проти
етіологічного агента. Цей висновок був зроблений на підставі епідеміологічного
дослідження поширення ХК в близнюків у Швеції: вона розвивається в обох індивідуумів
у 44% гомозиготних і 4% гетерозиготних близнюків. Також доведено, що у хворих з
даною патологією найчастіше зустрічаються гени HLA-DR1 і DQw5. Доведений вплив
паління. ХК у людей, які палять, зустрічається частіше, ніж у тих, хто не
палить, але при виразковому коліті спостерігається зворотне співвідношення.
Виявлено, що у схильних людей компоненти тютюнового диму впливають на тип
запальних змін у кишці.
Припускається, що найбільш ймовірним
етіологічним чинником є інфекційний. Досліджувалася роль Mycobacterium
paratuberculosis, яку часто знаходять в осіб з ХК і НВК, однак чітких доказів
її ролі в патогенезі виявлено не було. Також доведена відсутність ефективності
протимікробного і протитуберкульозного лікування. Іншою лінією в дослідженні
етіології ХК є з’ясування ролі мікросудинних інфарктів. Оклюзія дрібних судин
спостерігається в уражених сегментах кишки в результаті гранульоматозного
запалення в стінці інтрамуральних і брижових артерій. Припускається, що велику
роль в даному процесі відіграє паління, прийом пероральних контрацептивів та
інші зміни, які призводять до підвищення зсідання крові. При цьому, пусковим
механізмом є інфекція кору, при якій в генетично схильних індивідуумів
розвивається широке ураження ендотелію, внутрішньосудинне нагромадження
моноцитів і агрегація тромбоцитів, що і призводить до оклюзії дрібних судин. Ці
два протилежних припущення широко обговорюються в літературі, але точних
підтверджень тієї або іншої точки зору досі немає. Незалежно від етіології, у
пацієнтів з ХК спостерігається персистуюча і неадекватна активація Т-клітин і
макрофагів, що супроводжується збільшеною продукцією прозапальних цитокінів,
особливо інтерлейкінів 1, 2, 6 і 8, інтерферону і фактору некрозу пухлини
(ФНП). ХК характеризується хронічним запаленням, яке супроводжується фіброзом.
Проліферація фібробластів і нагромадження колагену відбувається під впливом
чинника, який трансформує ріст і має невелику протизапальну дію, привертає
фібробласти і знижує активність запальних клітин [4].
Незважаючи на те що пік захворювань припадає на
15-35 років, захворіти можуть особи будь-якого віку. Сімейні випадки ХЗЗК
реєструються в 2-5% випадків, коли хворіють один або більше членів сім'ї.
Однак специфічності захворювання у членів однієї
сім'ї не зазначено. Результати групового епідеміологічного аналізу свідчать про
існування як генетичних, так і набутих форм хвороби. Ймовірно, у розвитку ХЗЗК
беруть участь і генетичні, і негативні зовнішні фактори [5].
.2 Анемічний синдром. Механізм та патогенез
анемічного явища
ХЗЗК часто супроводжуються прихованої чи явної
гастроінтестинальною крововтратою. Результатом хронічної крововтрати та інших
факторів є розвиток гемоглобіндифіцитних станів. Анемія виявляється у 85% осіб
з ХК і у 68% - з НВК, при цьому в 30% випадків вона носить важкий характер [6].
Залежно від зниження рівня гемоглобіну,
виділяють три ступені тяжкості анемії:
І ст. (легка анемія) - рівень гемоглобіну вищий
за 90 г/л;
ІІ ст. (середня анемія) - гемоглобін в межах
90-70 г/л;
ІІІ ст. (важка анемія) - рівень гемоглобіну
нижчий за 70 г/л.
Анемія - це загальна проблема при запальних
захворюваннях кишечнику. Анемічний синдром, впливаючи на всі органи і системи,
значно знижує якість життя пацієнтів. Патогенез анемії при ХЗЗК на сьогодні до
кінця не з’ясований. Механізми її розвитку різноманітні та включають як дефіцит
заліза та недостатність вітамінів причетних до гемопоезу (В12 та фолієвої
кислоти), так і аутоімунний гемоліз еритроцитів [7]. Також розвиток анемії при
ХК і НВК пов'язують з надмірним утворенням цитокінів - ФНП-α,
інтерферону,
інтерлейкіну-1, трансформуючого фактора росту [8].
Усе це свідчить, що анемія при ХЗЗК має
неоднорідний характер і може бути сукупністю залізодефіцитної (ЗДА), В12 -
дефіцитної, анемії хронічного захворювання (АХЗ) та аутоімунної гемолітичної
анемії. Складність і неоднозначність даних, що стосуються механізмів розвитку
анемії при ХЗЗК, привертають увагу багатьох дослідників і клініцистів. Однак,
на сьогодні в доступній літературі не виявлено даних, які б відображали
наскільки часто зустрічається кожен вид анемії, не розроблено підходів до
диференціальної діагностики та лікування анемії з урахуванням патогенетичних
механізмів формування.
Анемія є важливою проблемою сучасної медицини.
За даними ВООЗ, на анемію страждають біля 2 мільярдів населення усього світу,
що складає майже третину від 7 мільярдів мешканців планети [15]. Під анемією
розуміють зниження гемоглобіну (Нв) та еритроцитів нижче встановленої норми:
для невагітних жінок це рівень Нв менше 120 г/л та для чоловіків - менше 130
г/л [23].
Причини анемічних станів різноманітні і часто
вони доповнюють одна одну, проте найбільшу вагу серед анемій різного походження
має залізодефіцитна анемія (ЗДА), яка спостерігається у 75-80 % випадків [22].
Залізо (Fe) є необхідним елементом для всіх
живих організмів, оскільки воно є частиною функціональних груп білків, які
транспортують кисень, та ферментів, які каталізують реакції генерації енергії і
метаболічні процеси. Fe відповідає за окислювально-відновні процеси та
біоенергетику в організмі. Дослідження останніх років показали участь Fe у
забезпеченні таких важливих процесів, як проліферація та диференціювання
клітин, клітинний і гуморальний імунітет, біосинтетичні процеси, метаболізм
фізіологічно активних сполук [4, 18].
Гомеостаз заліза в організмі є
високоорганізованим процесом і ретельно підтримується. Залізодефіцит може
розвинутися, коли втрати перевищують надходження цього елемента в організм.
Чоловіки в середньому щодня виділяють близько 0,6 мг заліза. Жінки додатково
втрачають при менструаціях в середньому до 1,3 мг на добу. Час, необхідний для
розвитку залізодефіциту, залежить від початкових запасів Fe, частоти
крововтрат, кишкової абсорбції. Зазвичай залізодефіцит виникає при втраті
більше 5 мл крові в день. Причому, анемія може бути пізнім проявом
залізодефіцитного стану.
Наслідком дефіциту Fe в організмі є не тільки
гематологічна симптоматика, а й розлад функцій усіх клітин, особливо у
високоаеробних тканинах. Прояви залізодефіциту не обмежуються специфічними для
анемії симптомами, такими, як слабкість, задишка та ін. Нестача Fe погіршує
ріст нігтів, стан шкіри, репарацію слизових оболонок (уповільнення загоєння
виразкових дефектів слизової оболонки при неспецифічному виразковому коліті
(НВК) та хворобі Крона (ХК)). У хворих з анемією спостерігаються головний біль,
порушення сну, зниження лібідо, еректильна дисфункція та ін., що в цілому
визначається як сидеропенічний синдром, та значно знижує якість життя [4, 7].
Тканинний дефіцит заліза призводить до порушення нормального функціонування
різних органів та систем через зниження активності внутриклітинних
залізовміщуючих ферментів - цитохромів.
В клітинах залізо депонується в комплексі з
білками - феритином (Ф) і гемосидерином, головним чином у паренхімі печінки,
м’язах і клітинах ретикулоендотеліальної системи селезінки та кісткового мозку.
Феритин є одним з високоінформативних маркерів, які характеризують метаболізм
заліза. У невеликій концентрації Ф виявляється у сироватці крові, де виконує
важливу функцію транспорта заліза від ретикулоендотеліальних до паренхіматозних
клітин печінки. І хоча сироватковий Ф вміщує лише 15-20 % загального заліза,
його рівень у крові завжди пропорційний запасам заліза в організмі. При
низькому внутрішньоклітинному рівні заліза Fе-залежний білок ініціює синтез
трансферинового рецептору та пригнічує синтез феритину. Таким чином, при ЗДА
низький рівень заліза пов'язаний з підвищеною залізозвязувальною здатністю
сироватки та низьким рівнем феритину крові. Поряд з тим вміст феритину у
сироватці крові зростає при запальних процесах [5].
В плазмі залізо переноситься трансферином у депо
або до органів і тканин, які мають в ньому потребу. Проникнення заліза в
клітини здійснюється при взаємодії комплексу трансферин-залізо зі специфічним
до трансферину рецептором на плазматичній мембрані. На поверхні мембрани
молекула трансферину зв’язується з трансфериновим рецептором (TfR), після чого
створений комплекс поглинається клітиною шляхом ендоцитозу. У везикулі, яка
виникла, залізо міняє ступінь окислення (з +3 до +2) та використовується для
синтезу гемоглобіну або депонується. Білкова частина трансферину разом з
рецептором мігрує на поверхню клітини, потім весь цикл інтерналізації рецептора
повторюється. При збільшенні потреби організму в залізі цикл рециркуляції TfR
прискорюється, і на поверхні клітини з’являється більша кількість рецепторів.
Під дією позаклітинних протеаз на зовнішню частину рецепторів від них
відщеплюється й надходить до кровотоку пептид з молекулярною масою 95 кДа. Цей
пептид отримав назву розчинний рецептор трансферину (sTfR) [17].
При дефіциті заліза збільшується експресія TfR
на клітинних мембранах і, відповідно, рівень sTfR в крові. Цей процес залежить
від проліферативної активності клітин. Якщо при ЗДА синтез TfR збільшується, то
при апластичній анемії він зменшується. Приблизно 80 % TfR локалізовано на
плазматичній мембрані еритропоетичних клітин. Щільність TfR на поверхні
клітин-попередників еритроцитів збільшується по мірі їх розвитку до
ретикулоцитів. На поверхні зрілих еритроцитів ці рецептори не виявляються. При
стимуляції еритропоезу кількість TfR збільшується, що дозволяє здійснювати
контроль за ефективністю терапії [9, 19].
Діагностика класичної ЗДА, в першу чергу
базується на результатах загального аналізу крові. Однак звичайні гематологічні
показники змінюються на пізніх стадіях ЗДА. Спочатку зменшується середній об’єм
еритроциту (MCV) - ознака мікроцитарної анемії, пізніше - вміст гемоглобіну
(Нв) в еритроцитах (МСН), середня концентрація Нв в еритроцитах (MCHC),
гематокрит та збільшується RDW - показник анізоцитозу. Гіпохромна мікроцитарна
анемія характерна для ЗДА, однак не є специфічною.
Діагностика залізодефіциту на фоні запального
процесу викликає певні труднощі. При так званій анемії хронічного захворювання
(АХЗ), яка виникає на фоні активації імунної системи і продукції прозапальних
цитокінів, відбувається накопичення заліза в макрофагах, внаслідок чого воно
стає недоступним для еритропоезу, формується «функціональний залізодефіцит».
Під дією цитокінів не тільки порушується обмін заліза, а й можливе порушення
еритропоезу внаслідок пригнічення синтезу еритропоетину (ЕПО), апоптозу
еритроїдних клітин-попередників [1].
Концепція функціонального дефіциту заліза
базується на припущенні, що ані потреба в залізі, ані кількість депонованого
заліза не є інформативними окремо. Діагностичної значущості в умовах
залізодефіциту на фоні хронічного запалення набуває визначення sTfR та індексу
sTfR/log Ф, який зменшується при АХЗ. Значення індексу <1 свідчить про
наявність АХЗ, а >2 або >3 - про виснаження запасів заліза в депо. На
фоні активної запальної відповіді дискримінаційним значенням цього індексу
вважається 2, оскільки вміст феритину, як білка гострої фази, підвищується при
запаленні, незалежно від запасів заліза в організмі [14].
Значним науковим досягненням останнього
десятиліття стало відкриття гепсидину - гормону, якому належить провідна роль в
регуляції гомеостазу заліза [2, 6, 11, 16]. Гепсидин - антимікробний пептид, до
складу якого входить 25 амінокислот, продукується, головним чином, в печінці у
відповідь на перевантаження Fe або прозапальні стимули, такі як
ліпополісахариди або інтерлейкін-6. Гепсидин проявляє свою біологічну функцію
через зв’язування клітинного експортеру Fe - ферропортину (SLC40A1) шляхом
інтерналізації або деградації. Це блокує переніс (трансфер) абсорбованого Fe
через дуоденоцити в циркуляторне русло - ефект, який може посилюватися фактором
некрозу пухлини-α (TNF-a),
та паралельно викликає затримку (ретенцію) заліза в макрофагах та моноцитах.
Останній ефект більш вагомий, тому що макрофаги залучені в реутилізацію заліза
з старих червоних кров’яних клітин через механізм еритрофагоцитоза. Отже,
гепсидин є центральним регулятором гомеостазу Fe завдяки здатності модулювати
феропортин-залежний вихід заліза у циркуляторне русло у відповідь на системний
рівень Fe та потребу в ньому, а також інші сигнали. В нормі при підвищенні
рівня циркулюючого Fe в крові виникає збільшення експресії гепсидину, та,
навпроти, рівень гепсидину зменшується при залізодефіциті [8, 10].
Анемія є одним із частих системних проявів
хронічних запальних захворювань кишечнику (ХЗЗК), який має мультифакторну
природу, обтяжує перебіг захворювання, знижує не тільки працездатність, а й
життєву активність пацієнтів, часто призводить до госпіталізації, подовжує
термін перебування хворих в стаціонарі, потребує спеціального діагностичного та
лікувального підходу [12, 13].
Наявні літературні дані недостатні для розробки
методів профілактики, індивідуалізованого підходу до комплексного лікування
ХЗЗК, крім того, ці відомості іноді суперечливі. Все це свідчить про
необхідність більш детального вивчення даної проблеми [9].
.3 Система ПОЛ-АОЗ, ендотоксемії та показники
ферокінетики
Процеси ПОЛ-АОЗ займають ведуче місце в
патогенезі багатьох станів, включаючи захворювання ШКТ. На сьогоднішній день
поширене визначення рівня молекул середньої маси (МСМ), що є загальновизнаним
біохімічним маркером ЕІ при різних патологічних станах. ЕІ підтримується
дисбалансом в системі ПОЛ-АОЗ. Процеси ПОЛ носять загальнобіологічний характер
і є необхідною ланкою у метаболізмі низки гормонів, медіаторів, нуклеїнових
кислот, окислювальним фосфорилюванням. Оскільки при будь-якій патології
відбувається порушення процесів ВРО, що проявляється активацією ПОЛ та
послабленням АОС організму, перспективним є вивчення та застосування лікарських
засобів з антиоксидантними властивостями, які б сприяли покращенню метаболічних
та зменшенню запальних процесів [10].
Особливе місце в АОС організму займають
ферментативні антиоксиданти. Основним внутрішньоклітинними антиоксидантами є
супероксиддисмутаза (СОД) та каталаза (КТ). У плазмі крові основну
антиоксидантну функцію виконує церулоплазмін. Було показано, що антиоксидантні
властивості ЦП обумовлені його електронноакцепторними властивостями. Завдяки
високій ферооксидазній активності ЦП запобігає неферментативним реакціям, що
дають початок вільним радикалам і подальшому розвитку ПОЛ. Серед різноманітних
функцій ЦП в даний час можуть бути виділені наступні основні:
) транспорт і регулювання обміну міді в крові і
органах;
) ферооксидазна дія та іммобілізація
сироваткового заліза;
) антиоксидантна дія;
) участь в острофазних реакціях;
) регуляція рівня біогенних амінів в організмі
[11].
Відомо, що при різних патологічних станах у
сироватці крові з’являються у збільшених концентраціях МСМ, діапазон
молекулярної маси яких становить від 300 до 5000 Да. Хімічний склад МСМ досить
неоднорідний та об’єднує гетерогенну групу речовин. Він представлений
пептидами, глікопептидами, нуклеопптидами, ендорфінами, аміноцукрами,
поліамінами, багатоатомними спиртами, деякими гуморальними регуляторами -
інсуліном, глюкагоном, деякими вітамінами, похідними глюкуронових кислот та ін.
[18]. Подібного роду молекули являють собою продукти розпаду білків та їх
комплексів і відіграють роль ендотоксинів. Завдяки наявності в структурі
середніх молекул пептидних зв'язків і циклічних амінокислот, вміст МСМ може
бути встановлений за реєстрацією викликаного ними ефекту поглинання
монохроматичного ультрафіолетового світлового потоку. Найчастіше виділяють дві
фракції МСМ: МСМ, до складу яких входять ароматичні амінокислоти (реєструються
при спектрофотометрії за довжиною хвилі 280 нм) та МСМ, які не містять
ароматичних амінокислот (вимірюються за довжиною хвилі 254 нм) [19].
Встановлено, що МСМ обумовлюють не тільки
синдром ендогенної інтоксикації (ЕІ), вони також залучені у порушення
мікроциркуляції, імунної відповіді організму, зменшення активності ізоферментів
ЛДГ, аденілатциклази, піруваткінази, транскетолази та інших, транспорту іонів
натрію та калію через мембрани, пригнічення фагоцитозу, тощо. МСМ порушують
фізико-хімічні властивості клітинних мембран, у тому числі і мембран
еритроцитів, впливають на процеси синтезу гемоглобіну [20].
Руйнування еритроцитів відбувається в
ретикулоендотеліальній системі кісткового мозку, селезінки і печінки. В цих
органах руйнується мембрана еритроцитів. Вивільнений гемоглобін розщеплюється
на свої складові частини - гем і глобін. Гемовое залізо використовується
кістковим мозком для відтворення нових еритроцитів, решта гема перетворюється в
білірубін, який метаболізується печінкою, а глобінові ланцюги руйнуються до
амінокислот, які надходять до загального пулу амінокислот організму, поповнюючи
коло метаболітів, що володіють ендотоксичною дією [21]. Однією з вивільнених
амінокислот є гістидин - α-аміно-β-[4(5)-імідазоліл]
пропіонова кислота, що входить до складу багатьох білків та у значній кількості
міститься у глобіні. За рахунок піридинового атома азота імідазольного
фрагмента цієї кислоти білок глобін зв’язується з атомом заліза гема у
гемоглобіні [22]. Максимум поглинання світла гістидином припадає на 210 нм,
тому при вимірюванні МСМ за такої довжини хвилі дана амінокислота робить свій
внесок у їх загальний вміст. Таким чином вміст МСМ при 210 нм вказує на кількість
вивільненого або невикористаного гістидину у крові, характеризує ступінь
ендогенної інтоксикації, яка обумовлена анемічним станом хворих, та свідчить
про інтенсифікацію процесів руйнування еритроцитів та порушення синтезу
гемоглобіну внаслідок дефіциту заліза або цитокін-опосередкованої анемії (АХЗ).
В літературі також відсутні дані про роль МСМ в
патогенезі ХЗЗК, взаємозв’язок між процесом ПОЛ, МСМ при цих захворюваннях.
Вивчення вищезгаданих біохімічних показників у хворих на ХЗЗК є досить актуальним
і перспективим і дасть можливість позитивного лікувального впливу на перебіг
даної патології [6].
Особлива увага приділена вивченню основних
ферокінетичних параметрів у хворих на ХЗЗК в умовах анемічного стану та без
нього: вміст заліза у сироватці крові, насичення трансферину залізом, загальна
залізозв’язуюча здатність сироватки, ненасичена залізозв’язуюча здатність
сироватки крові.
Залізо - есенціальний макроелемент, що надходить
з їжею. Вважається, що його загальний вміст в організмі людини становить 4-5 г.
Феритин утворюється в різних клітинах організму, де він і зв’язується із
залізом. Атом заліза знаходиться в двох формах - окисленої (Fe3+) і відновленої
(Fe2+). Залізо всмоктується у дванадцятипалій кишці у формі двовалентного
заліза. Входить до складу гемоглобіну еритроцитів, а також до складу м'язового
білка міоглобіну та деяких ферментів. Залізо в складі гема гемоглобіну (гемове
залізо) в еритроцитах має здатність зворотно зв'язувати кисень, що дозволяє
переносити його і насичувати киснем органи і тканини. Кількість заліза в
сироватці крові становить лише 0,2-0,5% від усього вмісту в організмі людини.
Вважається, що добовий прийом заліза з їжею становить 20 мг. Однак всмоктується
лише 1-2 мг, що закриває його фізіологічні втрати. При розпаді гемоглобіну в
печінці і селезінці близько 24 мг заліза знову всмоктується в тонкому кишечнику
і в дванадцятипалій кишці, закриваючи на 97% його добову потребу. Дефіцит
заліза може розвинутися, якщо надходження цього елемента в організм буде менш 1
мг/добу. Чоловіки в середньому щодня виділяють близько 0,6 мг заліза. Жінки
додатково втрачають при менструаціях в середньому до 1,3 мг на добу. Більша
частина заліза (70%) міститься в еритроцитах. Близько 20% запасається в
феритині.
Менша частина (0,1%) зв'язана з білком
трансферином, що переносить залізо, циркулює в плазмі крові. Вільне залізо
вкрай токсичне для органів і тканин. У вільному вигляді токсичність заліза
визначається також його здатністю каталізувати перетворення перекису водню у
вільні радикали. В організмі людини залізо не виявляється у вільному стані, а
лише у зв'язаному вигляді з білками. При аналізі сироваткового заліза
визначають концентрацію саме трансферинзв’язаного заліза. Таким чином,
сироваткове залізо або залізо плазми крові - це концентрація заліза в
сироватці, що не включає залізо еритроцитів і залізо феритину. Останнє залізо,
пов'язане з білками феритином і гемосидерином міститься у вигляді запасів,
головним чином, у печінці, селезінці, кістковому мозку [23].
Ненасичена залізозв’язуюча здатність сироватки
(НЗЗЗС) - показник, що використовується для виявлення дефіциту заліза в
організмі. У нормі трансферин насичується залізом приблизно на 30%, а додаткова
кількість заліза, яке може зв'язатися з трансферином називається латентної
(ненасиченої) залізозв’язуючою здатністю сироватки. ЛЗЗЗС або НЗЗЗС -
представляє собою різницю між загальною залізозв'язувальної здатністю (ЗЗЗС) і
реальним насиченням трансферину.
Загальна залізозв’язуюча здатність сироватки
(ЗЗЗС) - максимальна кількість заліза, яке трансферин може приєднати до повного
насичення. Встановлюється як сума показників - Сироваткове залізо + НЗЗЗС.
Зважаючи на точне молярне співвідношення зв'язування заліза трансферином
визначення ЗЗЗС може бути замінене на пряме кількісне вимірювання трансферину
[24].
ЗЗЗС - відображає зміст білка-трасферина, що
переносить залізо в плазмі крові. НЗЗЗС відображає резервну «незаповнену»
залізом ємність транспортного білка - трансферину. Показник НЗЗЗС відображає ту
кількість заліза, яке може приєднати трансферин, щоб досягти максимального
насичення. Підвищення ЗЗЗС спостерігається при залізодефіцитній анемії на
відміну інших типів гіпохромних анемій. Таке збільшення вмісту трансферину при
залізодефіцитній анемії пов'язано з посиленням його синтезу, що є компенсаторною
реакцією у відповідь на тканинний дефіцит заліза [25].
У лабораторній діагностиці також проводять
визначення коефіцієнта насичення трансферину залізом. Даний параметр відображає
кількість заліза циркулюючого в крові, використовується як показник прихованого
дефіциту заліза і є маркером доступності заліза для еритропоезу.
Вимірювання цих показників дає змогу оцінити
анемічний стан пацієнтів, вказує на інтенсивність та ускладнення основної
патології.
Мета роботи - оцінити стан біохімічних
показників системи ПОЛ-АОЗ, показників ферокінетики та ендотоксемії у хворих на
ХЗЗК.
В зв’язку з поставленою метою завданнями
дослідження були:
визначити вміст вторинного продукту МДА в
плазмі;
визначити активність ферментів АОЗ - СОД,
каталази, ЦП;
визначити загальну антиоксидантну активність
(АОА) плазми крові;
визначити ферокінетичні показники крові: вміст
заліза, насичення трансферина залізом, загальну залізозв’язуючу здатність
сироватки, ненасичену залізозв’язуючу здатність сироватки.
2. МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕНЬ
.1 Матеріали дослідження
Для виконання поставлених завдань
використовували кров хворих чоловіків і жінок, які були поділені на ХК та НВК,
без анемії з різними ступенями розвитку анемії, які були поділені на дослідні
групи:
І - Контроль (n=20)
ІІ - НВК (n=15)
ІІІ - НВКа (n=76)- ХК (n=11)- ХКа (n=23)
Порівняльний аналіз проведений з показниками в
контрольній групі, яку склали 20 практично здорових осіб. Оцінку вивчених
показників давали відповідно до їх змін у крові:
МДА у плазмі - (2,03±0,13) нмоль/мл;
Активність СОД - (32,72±1,06)
ум.од.;
Каталаза - (1149,6±49,3)
мкМ/хвмгНв;
АОА - (43,7±1,75) % ;
Церулоплазмін - (308,08±8,79) мг/мл;
МСМ по білку - (445,6±18,2) мг/л;
МСМ210 - (0,22±0,05) у.о;: чоловіки -
(19,00±1,67) мкмоль/л;
жінки - (15,51±1,39) мкмоль/л;Fe: чоловіки -
(35,00±5,00) %;
жінки - (32,50±5,83) %;
ЗЗЗС - (74,35±3,25) мкмоль/л;
НЗЗЗС - (55,11±5,83) мкмоль/л;у сироватці крові
- (72,58±4,75) ммоль/л;у сироватці крові - (37,11±3,48) ммоль/л;
ТДК у сироватці крові - (2,06±0,16);у еритроцитах
- (79,54±0,76) ммоль/л;у еритроцитах - (13,00±0,56) ммоль/л;
ТДК у еритроцитах - (6,18±0,25);- (41,65±5,55)
мкмоль/л.
Стан системи ПОЛ оцінювали за концентрацією
малонового діальдегіду (МДА) в плазмі крові [6]. Стан системи АОЗ оцінювали за
активністю СОД та КТ. Активність СОД вимірювали за Сиротою Т.В. [26], К
визначали в гемолізаті еритроцитів за Овсянніковим Л.М. [27].
Активність ЦП визначали за модифікованим методом
Ревіна [6]. Для характеристики загального стану хворих використовували
визначення загальної АОА плазми крові за Спектор Е.Б. зі співавт. [28]. Процеси
ендотоксемії оцінювали за вмістом молекул середньої маси за білком (МСМ) [6] та
при довжині хвилі 210 нм (МСМ210), за Ніколайчуком В.В. [6, 29].
Визначення концентрації заліза в сироватці крові,
загальну залізозв’язуючу здатність сироватки крові, ненасичену залізозв’язуючу
здатність сироватки крові, насичення трансферину визначали за допомогою набору
реактивів «Філісіт-Діагностика». Показники тіолдисульфідної системи: SH-, -SS-
групп, ТДК, визначали у сироватці крові та у еритроцитах за Верьовкіною І.В.
[30], рівень метаболітів оксиду азоту проводили за Метельською В.А. [31].
Для статистичного аналізу даних використовували
дескриптивну статистику; порівняння середніх значень змінних здійснювали за
допомогою параметричних методів (t-критерію Стьюдента) за нормального розподілу
даних ознак, що виражені в інтервальній шкалі. Всі розрахунки виконували у
програмі Microsoft Excel.
Всі засоби вимірювальної техніки, які
використовувались при виконанні роботи, пройшли метрологічну повірку в
установленому порядку.
Методи досліджень
В даній роботі ми використовували наступні
методи роботи:
Метод отримання плазми крові і еритроцитів
Методика визначення концентрації МДА
Методика визначення активності СОД
Методика визначення активності каталази
Методика визначення концентрації ЦП
Методика визначення загальної АОА
Методика визначення вмісту молекул середньої
маси
Методика визначення концентрації заліза
Методика визначення ТДК
Методика визначення рівня метаболітів оксиду
азота
Статистична обробка результатів
Метод отримання плазми крові і еритроцитів
Для стабілізації донорської крові використовують
наступні консерванти: глюгицир, цитроглюкофосфат, циглюфад та інші. В окремих
випадках, при необхідності приготування препаратів крові та використання їх в
перші 3 години і проведення реінфузії, кров стабілізують розчином гепарину (2,5
- 5 тис. ОД на 50 мл. ізотонічного розчину натрію хлориду для забору 200
мл.крові).
Донор лежить або сидить. Йому накладають жгут в
ділянці нижньої третини плеча. Обробляють ділянку ліктєвого згину розчином
антисептика. Товстою голкою від системи для взяття крові проколюють попередньо
простерилізовану пробку флакона з консервантом, сюди ж вводять голку для
випускання повітря з флакона. Тоншою голкою цієї ж системи проводять
венепункцію і забирають кров у флакон з консервантом до його заповнення. Після
зняття жгута виводять голку з вени. Накладають стерильну тиснучу пов'язку на
проколоту судину. Кров, що залишилась у системі, виливають у пробірку для
подальшого лабораторного дослідження.
Заповнений кров'ю флакон маркують етикеткою у
відповідності до групової приналежності і герметично закривають.
Обов'язковою умовою для отримання плазми
являється поділ цільної крові на плазму та клітинну масу. Це досягається або
шляхом центрифугування, або відстоюванням протягом 3 - 4 днів при температурі +
4 - 6 градусів по Цельсію. Після обробки пробок флаконів вогнем та 5% настоєм
йоду, голку одноразової системи для отримання плазми, вводять на достатню
глибину шару плазми. Другу голку цієї системи проводять в порожній флакон, до
якого підключають пристрій для створення вакууму. Плазма вільно поступає у
флакон із створеним від'мним тиском.
Простіше отримати плазму при допомозі зпарених
пластикових мішків. Після фракціонування крові, зібраної в мішок, плазму
"витискають" з нього при допомозі простого пристрою, і вона вільно
переміщається в мішок для плазми. Методика визначення концентрації МДА
Принцип методу: При взаємодії МДА із двома
молекулами
тіобарбітурової
кислоти (ТБК) при температурі 90-100°С, утворюється
пофарбований
триметиновий комплекс із максимумом поглинання при 532 їм
(зелений
світлофільтр).
Реактиви:
. Розчин гемолітику: 0,15 М калію хлорид в 1 мм
ЕДТА, рн=7,4
. Трихлоруксусна кислота (ТХУ): 30% розчин
. Тіобарбітурова кислота (ТБК): 0,75% розчин
. Натрію хлорид: 0,85%) розчин
. Антикоагулянт (цитрат натрію: 3,8% розчин)
.Зваж відмитих еритроцитів: цільну кров збирають
у центрифужну
пробірку,
куди попередньо вносять 1-1,5 мол антикоагулянту й центрифугують 10 хв при 1500
про/хв. Надосадову рідину зливають, а еритроцити двічі відмивають потрійним
обсягом 0,85% розчину натрію
хлориду,
щораз центрифугуючи при зазначених вище умовах і зливаючи
надосадову
рідину.
Хід визначення:
У центрифужну пробірку вносять 0,1 мол суспензії
еритроцитів, 1,9 мол. розчину гемолітику й ретельно перемішують; потім
доливають 2 мол 30% трихлоруксусної кислоти (ТХУ) і 2мол 0,75% ТБК, знову
перемішують.
Пробірку поміщають на киплячу водяну лазню (15
хв). Після охолодження до кімнатної температури центрифугують (10 хв, 3000
про/хв.).
Центрифугат колориметрирують у кюветі з робочою
довжиною 10 мм при зеленому світлофільтрі (530-540 їм) проти контролю.
Розрахунки концентрації МДА (З) проводять по
формулі:
З= D-50 / 1,56 нмоль/мол еритроцитів,
де D - оптична щільність,
- розведення,
,56 - молярний коефіцієнт экстипції МДА.
Методика визначення активності СОД
Принцип методу засновано на здатності
конкурувати з нітросинім тетразолієм (НСТ) за супероксидні аніони, що
утворюються в результаті аеробної взаємодії відновленої форми НАДН і
феназинметасульфата (ФМС). У результаті цієї реакції НСТ відновлюється з
утвором гідразинтетразолію. У присутності СОД відсоток відновлення НСТ
зменшується.
Прилади: спектрофотометр, термостат, центрифуга.
Реактиви:
. Фосфатний буфер, 0,15 М, рн 7,8.
. ТРИС-ЭДТА буфер, рн 8,0.
. Реагент 1.62 мг ЭДТА, 500 мг НСТ, 92 мг
феназинметасульфату розчиняють в 1000 мол фосфатного буфера, рн 7,8.
. Реагент 11.76,3 мг НАДН розчиняють в 100 мол
ТРИС-ЭДТА буфера, рн 8,0.
Проведення аналізу.
У дві пробірки вносять наступні реагенти:
|
Реагент
|
Нульова
проба, мол
|
Досліджувана
проба, мол
|
|
Трис-нтiбуфер, рн=7,4
|
0,05
|
-
|
|
Плазма
крові
|
-
|
0,05
|
|
Реагент
1
|
2,0
|
2,0
|
|
Реагент
11
|
0,1
|
0,1
|
Реакцію проводять при температурі 25 0С. Вимір
ведуть у кюветі з довжиною оптичного шляху 1 див на спектрофотометрі СФ-46 при
довжині хвилі 540 нм. Після перемішування компонентів проби в кюветі
встановлюють початкову екстинкцію. Через 10 хв вимірюють наростання оптичної
щільності розчину.
Розрахунки ведуть по формулі/блокування, де Ео -
екстинкція реакційної суміші у відсутності СОД ( нульової проби) у стані
рівноваги,
Епр - екстинкція досліджуваної проби в стані
рівноваги.
За одиницю активності ухвалюють 50% гальмування
реакції відновлення НСТ, активність ферменту виражають в наст. од. на 1 г
білка.
Методика визначення активності каталази
Метод заснований на вимірі кількості перекису
водню, розчепленого каталазою. Каталаза каталізує розкладання перекису водню на
молекулярний кисень і воду. За хімічною природою каталаза є гемоферментом, тому
що до складу простетичної групи цього ферменту входить гем:
О2 + 2Н2О 2Н2О2
Кількісне визначення активності каталази - це
визначення “каталазного числа” і “показника активності каталази”. Каталазним
числом називається кількість міліграмів Н2О2, що розкладається 1 мікролітром
(1мм3) досліджуваної крові. Принцип визначення каталазного числа ґрунтується за
наступною реакцією:
2KMnO4
+ 5Н2О2 + 4H2SO4
2KHSO4 + 2MnSO4
+ 8H2O
+ 5О2
т.ч. про кількість зруйнованого перекису водню
судять по різниці кількостей марганцевокислого калію, витраченного на
титрування до і після дії каталази.
Показником каталази називають дріб, у якій
чисельником є каталазн число, а знаменник - число мільйонів еритроцитів в
одному мм3 досліджуваної крові.
Хід роботи. 1.Вносять піпеткою 0,1 мл
досліджуваної крові, попередньо протерши кінчик капіляра від крові.
. Піпетку промивають шляхом утягування і
випускання назад рідини з мірної колби на 100 мл, куди попередньо наливають 10
мл дистильованої води.
. Доливають мірну колбу водою до мітки і
помічають час, коли кров була розведена. Цей розчин називають основним розчином
крові (1:1000), що використовують для визначення каталазного числа.
. У дві конічні колби наливають 7-8 мл
дистильованої води і відмірюють у них по 1 мл основного розчину крові.
. Вміст першої колби (контроль) зараз же
кип'ятять протягом двох хвилин для руйнування каталази, обидві колби залишають
на 10 хвилин.
. У кожну колбу вносять по 2 мл розчиниу
перекису водню (1%) і залишають на 30 хвилин.
. Доливають у кожну колбу по 5 мл 10% розчину
сірчаної кислоти й відтітровують вміст 0,1 н розчином марганцевокислого калію
до появи рожевого кольору.
Каталаза розкладає перекис водню, тому на
титрування другої колби піде менше розчину марганцевокислого калію, чим на
титрування вмісту першої колби, де каталаза була зруйнована. Цю різницю множать
на 1,7 і одержують каталазне число досліджуваної крові. Принцип обчислення
заснований на наступному. Грам-еквівалент перекису водню дорівнює 17. Отже, у 1
мл 0,1 н розчину міститься 1,7 мг перекису водню. 1 мл 0,1 н розчину
марганцевокислого калію відповідає 1 мл перекису водню. Таким чином, помноживши
1,7 на різницю між кількістю міллілітрів 0,1 н розчину марганцевокислого калію,
одержують кількість мл перекису водню, що розкладається в 1 мм3 досліджуваній
крові (каталазне число). Показник активності каталази тоді буде дорівнювати
каталазному числу поділеному на кількість еритроцитів в 1 мм3 досліджуваної
крові.
Методика визначення концентрації ЦП
Метод Равина заснований на тому, що
церулоплазмін (ЦП,
КФ 1.16.3.1) окиснює діаміни, з'єднуючись із
диметилпарафенілендиаміном,дає рожеве фарбування, інтенсивність якого
пропорційна каталітичної активності ЦП.
Реактиви. 1.0, розчин солянокислого
диметилпарафенілендиаміну
(ПФД)
в ацетатному буфері рн 5,2 готується перед уживанням.
Навішення робиться на аналітичних вагах. Розчин
повинен бути безбарвним, темно-сірий колір реактиву не допускається. ПФД
повинен бути перекристалізований, реактив гідрофілен і світлочутливий, навіть у
перекристалізованому стані тривалому зберіганню не підлягає. (Зберігати в
холодильнику в ексикаторі.).
Ацетатний буфер рН 5,2 готується в такий спосіб:
20 мол крижаний оцтової кислоти й 163 г ацетату натрію трьохводного розливають
в 1 л дистильованої води. По класичному пропису методики визначення ЦП в
якості
інгібітору реакції застосовується 0,1% азид натрію. Через токсичність
і
дефіциту цього реактиву можна використовувати 0,25% розчин роданистого
калію.
Хід визначення. У піддослідну пробірку налити
1,0мол свіжоприготовленого розчину ПФД і додати 0,1 мол сироватки. Схований
гемоліз, як правило, не заважає визначенню. Інкубація триває 30 хв при З˚С.
Кінетика реакції така, що максимальна активність її падає на початкову
швидкість (перші 15 хв), так що час інкубації можна міняти емпірично залежно
від активності ПФД із відповідним наступним перерахуванням. Реакція інгібується
5 мол 0,25% роданистого калію і приміщенням пробірок у лід. Оптичну щільність
вимірюють на ФЕК або спектрофотометрі при довжині хвилі 525 нм проти «сліпого»
контрольного досвіду. У контролі, який відбиває фонову диамінооксидазну
активність сироватки й повинен бути індивідуальним для кожного хворого,
змінюють порядок додатка реактивів, тобто спочатку додають інгібітор, а потім
проводять інкубацію. Визначення ЦП у плазмі проводити не можна, тому що
утворюється каламуть, яку усунути не вдається. При відсутності чистого ЦП для
стандарту можна калібрувати реакцію побічно, за допомогою паралельного
визначення в сироватках здоровіших людей змісту міді й ЦП. Знаючи зміст міді в
крові, можна розрахувати кількість ЦП, враховуючи, що практично основна маса
міді (95%) пов'язана з ЦП і становить 0,32%).
Си (мкг%) X 100x0,95
ЦП у мг% = 1000x0,32
Визначення міді краще проводити з
диэтилтиокарбаматом, а калібровану криву для міді будувати по сірчанокислій
міді. Помилка визначення ЦП методом Равина менш 3%. Зміст ЦП у практично
здоровіших людей у сироватці становить (24-50) мг%.
Методика визначення загальної АОА
Хід виконання. На льоду готується 5% гомогенат
головного мозку щура (у дослідах використовували тварин масою 180±15 г) на
трис-НСl-буфері, рН 7,4 (500 мг мозку гомогенізували у 9,5 мл буфера),
центрифугували 10 хв при 3000 об/хв. Одержаний центрифугат (2 мл) вносили в
центрифужні пробірки об’ємом 10 мл. У дослідні проби добавляли 0,1 мл сироватки
(плазми) крові, а в контрольні - 0,1 мл буфера. Проби інкубували 60 хв у
водяному термостаті при 37˚С, після чого реакцію зупиняли, вносячи в проби
по 2 мл охолодженої 10% трихлороцтової кислоти. Проби центрифугували (10 хв при
3000 об/хв) і в одержаному центрифугаті визначали вміст МА. Для цього в хімічні
пробірки вносили 3 мл центрифугату, 1 мл 0,8% тіобарбітурової кислоти і ставили
в кип’ячу водяну баню на 15 хв. Після охолодження вимірювали оптичну густину
контрольних і дослідних проб на спектрофотометрі СФ-46 при 532 нм в 10 мм
кварцових кюветах.Загальну антиоксидантну активність (ЗАОА) виражали у
відсотках і розраховували за формулою:
ЗАОА (в %) = ((Дк - Д∂) /Дк) * 100
де Дк - оптична густина контрольної проби;
Д∂ - оптична густина дослідної проби
Методика визначення вмісту молекул середньої
маси
Принцип методу: базується на депротеїнізації
сироватки крові, нейтралізації білкового супернатанту і подальшому визначенні
пептидних компонентів за допомогою методу Лоурі.
Реактиви:
,6 н HClO4
M K2CO3
Хід визначення:
До 0,5 мл сироватки крові додають 0,5 мл 0,6 н
HClO4, і центрифугують15 - 20 хв. при 3000 об/хв. Безбілковий супернатант
нейтралізуємо 3 М К2СО3, витримуємо 15 - 20 хв. на холоді для відділення осаду
КСlO-4 (в морозилці). Центрифугуємо 15 хв. при 3000 об/хв. і використовуємо
надосад для визначення білка за Лоурі і прямої спектрофотометриї. Для
визначення білка за Лоурі надосад розводимо в 5 разів і далі проводять
вимірювання за методикою. Для прямої спектрометрії, надосад розводять в 5 разів
і спектрофотометрують при довжині хвилі 210 нм на СФ-46.
Методика визначення концентрації заліза
Залізо звільняється ззалізозв'язуючих пептидів
сироватки крові та відновлюється завдяки діїгуанідину та гідроксил аміну.
Натрієва сіль 3-(2-піріділ)-5,6-біс (4-сульфофеніл)-1,2,4-триазину (феррозину)
дає з іонами Fe+2комплекс фіолетового кольору. Оптична щільність дослідного
розчину пропорційна концентрації заліза в пробі.
Склад реакційного розчину впробі
Феррозин > 1,10 ммоль/л; тіосечовина - 11,90
ммоль/л; гуанідину гідро хлорид -3,75 моль/л; гідроксил амінугідро хлорид
>60 ммоль/л; гліцин, НС 1 - 0,2 моль/л.
Приготування робочих розчинів
Розчини готові та придатні до використання після
відкупорювання флаконів протягом місяця при зберіганні від+2 до +8°С.
Витримують 5-10 хв. при кімнатній температурі,
виміряють оптичну щільність дослідної (Едосл) і калібрувальної (ЕКдл) проб
проти холостої. Фотометрування - див. Розділ " Обладнання".
Перемішують, витримують 15-20хв., виміряють
оптичну щільність дослідної (Едосл') і калібрувальної (ЕКдл') проб проти
холостої з колірореагентом.
Методика визначення ТДК
Для визначення співвідношення тиольних та
дисульфідних зв`язків у еритроцитах використано колориметричний метод,
оснований на реакції взаємодії 5,5/-дитиобис(2-нитробензойной)кислоти з
сульфгідрильними та дисульфідними групами.
За рН=8,0 5,5/-дитиобіс-(2-нітробензойна)кислота
(ДТНБК) взаємодіє з вільними SH-групами білків (стадія 1 рис.2.2). В ході цієї
реакції відбувається вивільнення тионітрофенільного аніону (ТНФА). Кількість
утвореного ТНФА прямо пропорційна кількості вільних SH-груп білків, що
прореагували з ДТНБК.
При рН 10,5 реакція може продовжуватися при
умові, що у білках, окрім SH-груп, присутні -S-S- групи (стадії 2 та 3
рис.2.2.9.).
Кількість дисульфідних груп в білках
розраховують, порівнюючи вміст вільних ТНФА визначений при рН=8,0 та після
доведення рН до 10,5.
Для отримання білкового розчину еритроцитів
крові спочатку еритроцити гемолізували витримуючи їх на протязі 25 хвилин при
кімнатній
температурі
після розведення дистильованою водою (1:10). Потім відділяли гемоглобін: у
центрифужні пробірки з гемолізатом (по 0,5 мл) послідовно додавали 0,25 мл
хлороформу, 0,5 мл 96% етилового спирту, не перемішували і додавали 300 мг солі
КН2РО4. Обережно “притоптували” гемоглобін разом з сіллю до дна пробірки, доки
не утвориться дві фази: знизу - тіні еритроцитів та гемоглобін, зверху -
білковий розчин еритроцитів. Далі проби центрифугували при 2000 об/хв на
протязі 20 хвилин та відбирали супернатант, який вносили до пробірок
Флоринського по 0,4 мл. Після додавання до нього 1,2 мл фізіологічного розчину
отримували так званий розчин білка еритроцитів об`ємом 1,6 мл.


Рис. 2.2.9. Взаємодія ДТНБК з сульфгідрильними
та дисульфідними групами
У роботі використовували реактив Елмана
(2ммоль/л), який готували наступним чином: 31,72 мг 5,5/-дитиобіс-(2-нітробензойна)кислоти
розчиняли у 40 мл 0,01 моль/л фосфатного буфера і доводили рН до 8,1.
Робота по визначенню кількості SH- та -S-S- груп
у білковому розчині еритроцитів проводилася за протоколом, що подано у таблиці
2.1.
Таблиця 2.1. Протокол процедури визначення
концентрації вільних жирних кислот.
|
Реактиви
|
Контроль
|
Експериментальний
зразок
|
|
визначення
кількості SH-
|
|
розчин
білку, мл
|
________
|
1,6
|
|
Фізіологічний
розчин, мл
|
1,6
|
________
|
|
трис-фосфатний
буфер рН=8,1, мл
|
________
|
0,08
|
|
реактив
Елмана 2ммоль/л, мл
|
0,4
|
0,4
|
|
вміст
пробірок перемішати та через 2 хвилини почати вимірювання ОD при λ=412нм ( у
кюветах l = 5 мм ) у режимі через кожні 5 хвилин доки значення ОD досягне
сталого значення.
|
|
визначення
наявності -S-S-
|
|
0,1
н NaOH, мл (для доведення рН=10,5)
|
0,48
|
0,48
|
|
0,1
н НСl, мл (для доведення рН=8,1)
|
0,90
|
0,90
|
|
вміст
пробірок перемішати та виміряти ОD при λ=412нм ( у
кюветах l = 5 мм )
|
Загальний вміст тиольних груп (вільні SН-групи +
SН-групи, що утворилися з -S-S- зв'язків) розраховували за формулою:
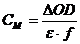 ,
,
де СМ - концентрація тиольних груп,
моль/л
∆OD - приріст оптичної густини
за час, достатній для завершення реакції,
e
- коефіцієнт молярної екстинкції ТНФА (e
=11400),
f - фактор розведення.
Вміст дисульфідних зв’язків
розраховуємо за формулою:
СМ (-S-S-)
де СМ (-S-S-)- концентрація
дисульфідних груп, моль/л
СМ (ТНФА)1 - концентрація
тионітрофенильного аніону, моль/л за рН=10,5
СМ (ТНФА)2 - концентрація
тионітрофенильного аніону, моль/л за рН=8,1
Величину тиол/дисульфідного
коефіцієнту розраховували за формулою:
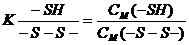
де 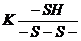 - тиол/дисульфідний коефіцієнт.
- тиол/дисульфідний коефіцієнт.
Принцип методу. Полягає в
одночасному відновленні нітратів у нітрити в присутності VCl3 і реакції
діазотування утворившимся нітритом сульфаніламіду, з подальшим розвитком
рожевого забарвлення, інтенсивність якого визначається спектрофотометрично.
Реактиви:
,05% водний розчин
N-нафтілетилендіаміна (І частина реактиву Грісса).
% розчин сульфаніламіду в 30%
оцтовій кислоті (ІІ частина реактиву Грісса).
N розчин соляної кислоти.
Ванадій хлорид (ІІІ).
% етиловий спирт.
Хід визначення:
Сироватку крові депротеінізують 96%
етиловим спиртом в співвідношенні сироватки до спирту 1:2 і центрифугують при
2500 об/хв. протягом 20 хв. Для приготування розчину ванадію хлориду (ІІІ)
400мг ванадію хлориду (ІІІ) розчиняли в 50 мл 1N соляної кислоти з подальшим
фільтруванням через паперовий фільтр. Після депротоінізації сироватки до супернатанту
додають розчин ванадію хлориду (ІІІ) і реактив Грісса у співвідношенні 1:1:1.
Суміш інкубують 30 хв. при 37 °С. Для приготування холостої проби замість І
частини реактиву Грісса додають таку ж кількість ІІ частини реактиву Грісса.
Оптичну щільність дослідної проби проти холостої вимірюють Спектрофотометрично
при 540 нм, товщина кювети 5 мм. Вміст метаболітів азоту розраховується за
калібрувальною кривою.
Побудова калібрувальної кривої:
Для побудови калібрувального графіку
необхідно приготувати стандартний розчин 1М водного розчину нітриту натрію.
Перед використанням стандартний розчин розводять в 1000 разів і готують серію
розведень. Лінійность кривої зберігається в діапазоні концентрацій нітрит-іону
від 5 до 320 мкМ. До кожної проби стандартного розчину додають по 1 мл реактиву
Грісса; до кожної холостої проби додають по 1 мл ІІ частини реактиву Грісса.
Оптичну щільність дослідної проби проти холостої вимірюють Спектрофотометрично
при 540 нм, товщина кювети 5 мм. За цифрами екстинції стандартних розчинів
будують калібрувальний графік.
Методи статистичної обробки
результатів
Статистичну обробку результатів
проводили за допомогою програми Excel, використовуючи t-критерій Ст’юдента.
Вірогідними вважали результати, якщо р < 0,05 [Лакин Г.Ф. 1990].
Розрахунок похибки вимірювання
проводили за формулою:
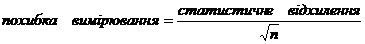 , (2.1)
, (2.1)
де n - число випробувань.
3. РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ
.1 Зміни показників ферокінетики,
які приймають участь у еритропоезі хворих на хронічні запальні захворювання кишечнику
з анемією
В ході дослідження було встановлено
зміни показників ферокінетики у хворих на хронічні запальні зазварювання
кишечнику до яких відносяться: НВК наведено в таблиці (3.1. 3.2.)ХК
табл.(3.3,3.4)
Таблиця 3.1 - Показники ферокінетики
хворих на НВК
|
Показник, од. виміру
|
Контроль (n=20)
|
НВК (n=15)
|
НВКa (n=76)
|
|
M
± m
|
M
± m
|
M
± m
|
|
Fe,
мкмоль/л:
|
|
чоловіки
|
19,00
± 1,67
|
17,61
± 3,43
|
8,04
± 0,87**,°
|
|
жінки
|
15,51
± 1,39
|
15,06
± 1,76
|
9,16
± 0,95**,°
|
|
НТ
Fe, %:
|
35,00
± 5,00
|
27,00
± 5,21
|
12,68
± 1,64**,°
|
|
жінки
|
32,50
± 5,83
|
26,55
± 2,83
|
16,09
± 2,08*,°
|
|
ЗЗЗС,
мкмоль/л
|
74,35
± 3,25
|
60,22
± 2,56**
|
63,75
± 2,07*
|
|
НЗЗС,
мкмоль/л
|
55,11
± 5,83
|
42,27
± 3,14
|
55,05
± 2,22°°
|
Примітки:
. * - р<0,01; ** - р<0,001 - вірогідність
змін у порівнянні з групою контролю;
. ° - р<0,01; °° - р<0,001 - вірогідність
змін у порівнянні з групою без анемії.
Як видно з наведених даних, в порівнянні з
хворими без анемічного синдрому у хворих на НВКа вміст сироваткового заліза був
зниженим у чоловіків на 54,3 % (р<0,01), у жінок на 39,2 % (р<0,01), що
супроводжувалось зменшеною насиченістю трансферину залізом у 2,1 рази у
чоловіків (р<0,01) і у 1,7 рази у жінок (р<0,01). Що стосується ЗЗЗС, то
недостатність її спостерігалася як у хворих без анемії на 19,0 % (р<0,01),
так і з анемічним синдромом на 14,3 % (р<0,01), що свідчить про вплив
запального процесу на метаболізм заліза у цих хворих.
З підвищенням ступеня анемії спостерігалась
тенденція до поступового зниження рівня сироваткового заліза, особливо у жінок
(табл. 3.2).
Таблиця 3.2 - Особливості ферокінетики в
залежності від ступеня анемії у хворих на НВКа
|
Показник,
од. Виміру
|
Контроль
(n=20)
|
НВКа
(n=76)
|
Ступінь
анемії у хворих на НВК
|
|
|
|
І
(n=46)
|
ІІ
(n=21)
|
ІІІ
(n=9)
|
|
|
М±m
|
|
Fe,
мкмоль/л
|
|
Чоловіки
|
19,00±1,67
|
8,65±0,8***
|
7,82±0,87***
|
6,9±0,61***
|
11,24±5,92
|
|
Жінки
|
15,51±1,39
|
7,87±1,36***
|
8,84±0,91***
|
8,3±1,98***
|
6,49±1,21***
|
|
|
НТ
Fe, %
|
|
Чоловіки
|
35,00±5,00
|
15,11±4,46**
|
12,21±1,56***
|
11,55±1,57***
|
21,46±10,26
|
|
Жінки
|
32,50±5,83
|
14,37±3,00**
|
15,49±1,53**
|
16,57±5,08*
|
11,05±2,41***
|
|
ЗЗЗС,
мкмоль/л
|
74,35±3,25
|
62,31±2,44**
|
61,97±2,25**
|
64,79±2,9*
|
61,25±5,79*
|
|
НЗЗС,
мкмоль/л
|
55,11±5,83
|
54,16±2,50
|
53,52±2,27
|
56,27±3,4
|
53,12±6,48
|
Примітки:
. *- р<0,05; ** - р<0,01; *** - р<0,001
- вірогідність змін показників у порівнянні з групою контролю;
Незважаючи на те, що серед жінок кількість
хворих з залізодефіцитом зростала по мірі підвищення ступеня анемії,
залізодефіцит був притаманний практично 100,0 % чоловіків з анемією, незалежно
від її ступеня. Важливо, що у 1/3 чоловіків та 16,7 % жінок групи порівняння
(без анемії) виявлено прихований залізодефіцит. Недостатність ЗЗЗС та резервної
ємності трансферину спостерігалися лише при ІІІ ступені анемії.
Результати дослідження показників ферокінетики у
хворих на ХК представлені в таблиці 3.3.
Таблиця 3.3 - Показники ферокінетики хворих на
ХК
|
Показник,
од. Виміру
|
Контроль
(n=20)
|
ХК (n=11)
|
ХКа (n=23)
|
|
|
М±m
|
|
Fe,
мкмоль/л
|
|
Чоловіки
|
19,0±1,67
|
20,23±2,52
|
7,99±1,62***
°°
|
|
жінки
|
15,51±1,39
|
22,82±1,89**
|
6,96±0,50***
°°
|
|
НТ
Fe, %
|
|
Чоловіки
|
35,00±5,00
|
35,15±4,91
|
15,11±5,02**
°
|
|
жінки
|
32,50±5,83
|
40,13±5,97
|
15,02±1,06**
°°
|
|
ЗЗЗС,
мкмоль/л
|
74,35±3,25
|
58,44±2,64***
|
60,32±3,26*
|
|
НЗЗС,
мкмоль/л
|
55,11±5,83
|
37,05±2,3,29*
|
55,92±3,32°°
|
Примітки:
. *- р<0,05; ** - р<0,01; *** - р<0,001
- вірогідність змін показників у порівнянні з групою контролю;
. °-- р<0,01; °° - р<0,001 - вірогідність
змін показників у порівнянні з групою без анемії.
З наведених даних видно, що у хворих на ХКа
вміст сироваткового заліза був зниженим у чоловіків на 60,5 %, у жінок на 69,5
% (р<0,001) в порівнянні з хворими без анемічного синдрому, що
супроводжувалось зменшенням ступеня насиченості ним трансферину у 2,3 рази у
чоловіків і у 2,7 рази у жінок (р<0,01). Такі зміни призводять до зниження
транспорту заліза в кістковий мозок і, як наслідок, до патологічних змін
еритропоезу, анемічного стану хворих. Недостатність ЗЗЗС спостерігалася як у
хворих без анемії на 21,3 % (р<0,05), що свідчить про прихований
залізодефіцит, який може бути предиктором розвитку анемії, так і з анемічним
синдромом на 19,0 % (р<0,05), що є наслідком порушення метаболізму заліза у
цих хворих. При цьому НЗЗС у хворих на ХКа була вище в 1,5 рази, ніж при ХК без
анемії.
Подібно до змін у групі НВКа, у хворих на ХКа,
із підвищенням ступеня анемії спостерігалась тенденція до поступового зниження
рівня сироваткового заліза (табл. 3.4). При ХКа недостатність ЗЗЗС та резервної
ємності трансферину спостерігалися при І та ІІ ступені анемії і лише у
чоловіків.
Таблиця 3.4 - Особливості ферокінетики в
залежності від ступеня анемії у хворих на ХКа
|
Показник,
од. Виміру
|
Контроль
(n=20)
|
ХКа (n=23)
|
Ступінь
анемії у хворих на ХК
|
|
|
|
І
(n=20)
|
ІІ
(n=2)
|
ІІІ
(n=1)
|
|
|
М±m
|
|
Fe,
мкмоль/л
|
|
Чоловіки
|
19,00±1,67
|
7,99±1,62***
|
9,06±1,9***
|
6,92±1,34***
|
-
|
|
Жінки
|
15,51±1,39
|
6,96±0,50***
|
7,93±0,62***
|
-
|
6,00±0,00
|
|
|
НТ
Fe, %
|
|
Чоловіки
|
35,00±5,00
|
15,11±5,02**
|
16,92±4,15**
|
13,3±5,89*
|
-
|
|
Жінки
|
32,50±5,83
|
15,12±1,06**
|
13,01±1,12**
|
-
|
17,24±0,00
|
|
ЗЗЗС,
мкмоль/л
|
74,35±3,25
|
63,32±3,26*
|
59,8±2,81***
|
59,2±16,16
|
34,80±0,00
|
|
НЗЗС,
мкмоль/л
|
55,11±5,83
|
55,92±3,32
|
51,25±2,81
|
52,28±17,5
|
28,80±0,00
|
Примітка. 1. *- р<0,05; ** - р<0,01; *** -
р<0,001 - вірогідність змін між показниками у порівнянні з групою контролю;
Така картина змін ферокінетичних показників, а
саме нормальні або знижені показники Fe, НТ Fe, ЗЗЗС та НЗЗС, характерна для
АХЗ, проте не виключає розвиток ЗДА та В12-(фолієво)-дефіцитної анемії у
пацієнтів з ХКа.
.2 Рівень оксидативного стресу та ендотоксикозу
у хворих на хронічні запальні захворювання кишечнику з анемією
Стан показників окиснювального гомеостазу у
хворих наХЗЗК НВК наведено в таблиці 3.5.
Таблиця 3.5. Показники системи ПОЛ-АОЗ у хворих
на НВК
|
Показник,
од. виміру
|
Характеристика
стану
|
Контроль
(n=20)
|
НВК (n=15)
|
НВКа (n=75)
|
|
|
|
|
|
|
|
|
|
|
|
|
М±m
|
М±m
|
%
|
М±m
|
%
|
|
МДА,
нмоль/л 1,64-2,42
|
зниження
|
2,03±0,13
|
1,62±0,00
|
6,67
|
1,43±0,03**
|
37,33
|
|
норма
|
|
2,07±0,08
|
33,33
|
2,00±0,04
|
46,67
|
|
підвищення
|
|
3,23±0,23***
|
60,00
|
3,26±0,29**
|
16,00
|
|
АОА,
% 35,5-58,1
|
зниження
|
43,7±1,8
|
26,46±2,08***
|
54,14
|
23,83±0,90***
|
60,00
|
|
норма
|
|
46,96±3,80
|
42,86
|
45,43±1,06
|
40,00
|
|
підвищення
|
|
-
|
-
|
-
|
-
|
|
ЦП,
мг/л 281,7-334,5
|
зниження
|
308,1±8,79
|
157,5±0,00
|
7,14
|
220,77±17,01***
|
17,33
|
|
норма
|
|
325,21±3,86
|
21,43
|
312,98±3,25
|
17,34
|
|
підвищення
|
|
437,33±24,02**
|
71,43
|
428,91±8,91**
|
65,33
|
|
СОД,
у.о. 24,54-36,06
|
зниження
|
32,75±1,06
|
13,60±2,74***
|
35,71
|
14,43±1,91***
|
5,56
|
|
норма
|
|
28,53±2,34
|
28,57
|
30,52±1,04
|
18,06
|
|
підвищення
|
|
54,90±6,78**
|
35,72
|
56,71±1,98***
|
76,38
|
|
К,
мкМ/мин•мгНb 1001,70-1297,50
|
зниження
|
1149±49,3
|
903,90±29,81
|
46,67
|
867,92±19,11
|
25,33
|
|
норма
|
|
1146,24±43,72
|
46,67
|
1162,42±14,91
|
41,33
|
|
підвищення
|
|
1333,30±0,00
|
6,66
|
1548,80±43,59
|
33,34
|
Примітки:
. ** - р<0,01; *** - р<0,001 -
вірогідність змін між показниками у порівнянні з групою контролю;
Як свідчать представлені дані, вміст вторинного
продукту ПОЛ - МДА у хворих на НВК при наявності анемічного синдрому мав певні
особливості: якщо за відсутністю анемії більше ніж у половини хворих він був
підвищеним у 1,6 рази (р<0,001), то при НВКа майже у половини пацієнтів
надлишкової продукції МДА не виявлено, а у 37,33 % хворих, концентрація його
знижувалась в 1,4 рази (р<0,001) (табл.3.6). Це можна розглядати як
виснаження оксидантного статусу при значному та довготривалому посиленні
процесів ПОЛ на фоні хронічного перебігу хвороби, особливо у пацієнтів з ІІІ
ступенем анемії (табл.2.6).
Таблиця 3.6. Особливості показників
окислювального гомеостазу у хворих на НВКа з різним ступенем анемії
|
Показник,
од. Виміру
|
Контроль
(n=20)
|
НВКа (n=75)
|
Ступінь
анемії у хворих на НВК
|
|
|
|
І
(n=45)
|
ІІ
(n=21)
|
ІІІ
(n=9)
|
|
М±m
|
|
МДА,
нмоль/л 1,64-2,42
|
2,03±0,13
|
2,02±0,11
|
2,01±0,10
|
1,99±0,23
|
1,61±0,07**°
|
|
АОА,
% 35,5-58,1
|
43,7±1,8
|
32,34±1,82***
|
31,92±1,82***
|
34,63±2,75**
|
30,17±3,86**
|
|
ЦП,
мг/л 281,7-334,5
|
308,1±8,79
|
381,29±14,26***
|
373,14±15,6***
|
382,21±20,2***
|
348,64±31,08
|
|
СОД,
у.о. 24,54-36,06
|
32,75±1,06
|
47,66±2,38***
|
49,69±2,67***
|
49,94±5,23***
|
48,72±3,9***
|
|
К,
мкМ/мин•мгНb 1001,70-1297,50
|
1149,6±49,3
|
1253,7±47,89
|
1185,26±46,27
|
1324,03±63,90*
|
1122,67±65,8
|
|
|
|
|
|
|
|
Примітки:
. *- р<0,05; ** - р<0,01; *** - р<0,001
- вірогідність змін між показниками у порівнянні з групою контролю;
. ° - р<0,01- вірогідність змін між
показниками у порівнянні з групою без анемії.
Причому кількість хворих із зниженим рівнем МДА
зростала зі ступенем анемічного синдрому (рис. 2.1).
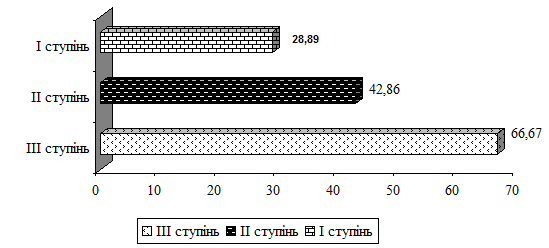
Рис. 3.1. Динаміка зниження МДА у
хворих на НВКа з урахуванням ступеня анемії
Це підтверджується зниженням
сумарного потенціалу АОС більше, ніж у половини хворих на НВК, в 1,6 рази
(р<0,001) та НВКа в 1,4 рази (р<0,001) та відсутністю у жодного пацієнта
зростання АОА (табл. 3.5-3.6).
Аналіз стану антиоксидантних
ферментів проводився з урахуванням їх ензиматичної активності відносно
еритропоезу.
Активність ЦП була в 1,4 рази
підвищеною більше ніж у половини хворих на НВК як при наявності анемії
(р<0,001), так і за її відсутністю (р<0,001), (табл. 3.5-3.6). Поряд з
цим майже у чверті хворих на НВКа активність цього ферменту була зниженою на
13,0 % (р<0,001), що частіше спостерігалося при ІІІ ступені анемії, для
якого гіперактивність ЦП не була характерною (табл. 3.6). Враховуючи активність
ЦП, що реалізується через стимуляцію еритропоезу посиленням проліферації та
диференціювання еритроїдних елементів у кістковому мозку, даний факт може
свідчити про поступове виснаження резерву цього ферменту в умовах гіпоксії.
Зміни активності ферменту
внутрішньоклітинної ланки системи АОЗ - СОД у хворих на НВК мали
різноспрямований характер. Якщо при НВК без анемічного синдрому в спектрі змін
майже однаково часто спостерігались зниження активності СОД у 2,4 рази
(р<0,001), то НВКа супроводжувався переважно гіперактивністю цього ферменту
в 1,7 рази (р<0,001), (табл. 3.5), рівень якої суттєво не залежав від
ступеня анемії (табл. 3.6).
Відомо, що СОД, яка у великій
кількості експресується в еритроцитах людини і в нормі приймає участь у захисті
тканин від токсичної дії реактивних форм кисню, пригнічує клітинний цикл
бурст-утворюючої еритроїдної одиниці, тобто є інгібітором еритропоезу. Існує
припущення, що у фізіологічних умовах ефект СОД, яка пригнічує еритропоез,
врівноважується стимуляторами останнього. Порушення даної рівноваги у бік
збільшення концентрації СОД може сприяти розвитку анемії.
Активність К була змінена більше,
ніж у половини хворих на НВК, однак при відсутності анемічного синдрому у
спектрі змін переважала її недостатність на 21,4 % (р<0,001), тоді як при
НВКа рівень її активності зростав на 26,5 % (р<0,001) (табл. 3.6). Таке
зростання слід вважати компенсаторним, оскільки воно зберігалося лише при І та
ІІ ступенях анемії, а з прогресуванням недостатності заліза активність К
знижувалась (табл. 3.7).
Одержані дані свідчать про фазні
зміни ферментативної ланки АОС, які обумовлюють вираженість анемічного синдрому
у хворих на НВК.
Таблиця 3.7 - Показники системи
ПОЛ-АОЗ у хворих на ХК
|
Показник,
од. виміру
|
Характеристика
стану
|
Контроль
(n=20)
|
ХК
|
Хка
|
|
|
М±m
|
М±m
|
%
|
М±m
|
%
|
|
МДА,
нмоль/л 1,64-2,42
|
зниження
|
2,03±0,13
|
1,44±0,00
|
9,10
|
1,53±0,05
|
12,50
|
|
норма
|
|
2,05±0,10
|
45,45
|
2,00±0,06
|
66,67
|
|
підвищення
|
|
3,37±0,31*
|
45,45
|
2,83±0,22
|
20,83
|
|
АОА,
% 35,5-58,1
|
зниження
|
43,7±1,8
|
26,60±2,78*
|
60,00
|
27,63±1,42*
|
66,67
|
|
44,71±2,11
|
40,00
|
45,28±2,49
|
33,33
|
|
підвищення
|
|
-
|
-
|
-
|
-
|
|
ЦП,
мг/л 281,7-334,5
|
зниження
|
308,1±8,79
|
223,57±9,19
|
20,00
|
257,24±2,64
|
8,33
|
|
норма
|
|
-
|
-
|
308,00±7,78
|
12,50
|
|
підвищення
|
|
416,72±20,76
|
80,00
|
478,68±16,05*
|
66,67
|
|
СОД,
у.о. 24,54-36,06
|
зниження
|
32,75±1,06
|
14,60±3,82
|
44,44
|
15,13±2,91
|
17,39
|
|
норма
|
|
29,74±1,95
|
55,56
|
31,03±1,75
|
17,39
|
|
підвищення
|
|
-
|
-
|
54,08±4,33*
|
65,22
|
|
К,
мкМ/мин•мгНb 1001,70-1297,50
|
зниження
|
1149,6±49,
|
901,87±21,43
|
63,64
|
899,61±59,10*
|
25,00
|
|
норма
|
|
1126,37±43,68
|
27,27
|
1130,03±17,25
|
62,50
|
|
підвищення
|
|
1300,00±0,00
|
9,09
|
1484,57±97,39
|
12,50
|
Примітки:
. *- р<0,05;- вірогідність змін між
показниками хворих у порівнянні з групою контролю;
Як видно з представлених даних, якщо вміст МДА у
62,5 % хворих на ХК без анемії був підвищеним у 1,7 рази (р<0,001), то при
ХКа він був значно меньше, але підвищеним в порівнянні з нормою.
При цьому тенденція до більш виражених змін
спостерігалась при ІІІ ступені анемії, де вміст МДА був знижений у 1,3 рази в
порівнянні з ХК без анемії (табл. 3.8.).
Таблиця 3.8. - Характеристика показники системи
ПОЛ-АОЗ у хворих на ХК
|
Показник,
од. Виміру
|
Контроль
(n=20)
|
ХКа (n=24)
|
Ступінь
анемії у хворих на ХК
|
|
|
|
І
(n=21)
|
ІІ
(n=2)
|
ІІІ
(n=1)
|
|
М±m
|
|
МДА,
нмоль/л 1,64-2,42
|
2,03±0,13
|
2,13±0,14
|
2,14±0,11
|
2,11±0,04
|
1,53±0,00
|
|
АОА,
% 35,5-58,1
|
43,7±1,8
|
33,17±2,81**
|
32,94±2,36***
|
40,47±4,98
|
31,58±0,00
|
|
ЦП,
мг/л 281,7-334,5
|
308,1±8,79
|
432,04±25,00***
|
421,13±25,45***
|
365,32±68,69
|
403,38±0,00
|
|
СОД,
у.о. 24,54-36,06
|
32,75±1,06
|
42,62±5,01
|
44,14±4,97*
|
37,10±6,90
|
38,9±0,00
|
|
К,
мкМ/мин•мгНb 1001,70-1297,50
|
1149,6±49,3
|
1136,64±50,89
|
1099,36±49,5
|
1188,95±29,8
|
1133,3±0,00
|
|
|
|
|
|
|
|
Примітки:1. *- р<0,05; ** - р<0,01; *** -
р<0,001 - вірогідність змін між показниками хворих у порівнянні з групою
контролю;
Загальна АОА була зниженою у половини хворих
обох груп, як з анемією, та і без, з тенденцією до виснаження АОЗ по мірі
зростання ступеня анемії. Відсутність хворих зі збільшенням АОА підтверджувала
недостатню потужність АОС у цих пацієнтів.
Рівень ЦП був підвищений у більшості хворих на
ХК та ХКа у 1,4 та 1,3 рази, відповідно, в порівнянні з контролем (р<0,001).
ЦП оцінюється як головний циркулюючий фермент
АОЗ плазми. Підвищення його активності при запальних процесах трактується як
інтерлейкін-6-залежний прояв “гострофазової” відповіді .
Зміни активності СОД у хворих на ХК мали
різноспрямований характер. При ХКа активність СОД була підвищена у 62,22 % 1,3
рази порівняно з контролем, тоді як у хворих без анемії активації ферменту не
спостерігалось (табл. 3.11.). Висока активність СОД при ХКа не залежала від
ступеня анемічного синдрому.
Отже, отримані дані свідчать про дисбаланс в
системі ПОЛ-АОЗ при ХК, вираженість якого зростає у хворих з анемічним
синдромом.
У порушеннях фізико-хімічних властивостей
мембран еритроцитів значну роль відіграють МСМ, які не тільки є маркерами
ендотоксикозу, а й впливають і на процеси синтезу гемоглобіну.
Визначення МСМ у хворих на ХЗЗК без анемії
показало їх зростання на 46,3 % (р<0,05) при НВК та на 29,0 % - при ХК
(табл.3.9.).
Наявність анемічного синдрому посилювала
ендотоксикоз, що підтверджується зростанням рівня МСМ при НВКа на 21,3 %, при
ХКа - на 40,0 % (р<0,001) в порівнянні з хворими без анемії.
Причому зростання тяжкості анемії при НВК
супроводжувалось посиленням ендотоксикозу: рівень МСМ при ІІ ступені анемії
зроств на 9,6 % в порівнянні з І ступенем (р<0,05), а при 3ступені - на 12,6
% (р<0,05) (табл. 3.10).
Таблиця 3.9. - Характеристика показників
ендотоксикозу у обстежених хворих
|
Показник,
од. Виміру
|
Контроль
(n=20)
|
НВК
(n=15)
|
НВКа
(n=76)
|
ХК
(n=11)
|
ХКа
(n=23)
|
|
|
|
|
|
|
|
М±m
|
|
МСМ,
мг/л 312,50-550,00
|
445,6±18,2
|
679,17±81,38**
|
862,81±76,71***
|
638,75±55,73**
|
1049,18±54,56***°°
|
|
МСМ210,
у.о 0,076-0,37
|
0,22±0,05
|
0,37±0,03*
|
0,45±0,04***
|
0,34±0,03*
|
0,46±0,02***°
|
Примітки:
. *- р<0,05; ** - р<0,01; *** - р<0,001
- статистично значуща відмінність між показниками хворих та осіб контрольної
групи
. ° - р<0,01; °° - р<0,001 - вірогідність
змін між показниками хворих у порівнянні з групою без анемії.
Таблиця 3.10 - Особливості показників
ендотоксикозу у хворих на НВК з різним ступенем анемії
|
Показник,
од. виміру
|
Контроль
(n=20)
|
НВКа
(n=76)
|
Ступінь
анемії у хворих на НВК
|
|
|
|
І
(n=46)
|
ІІ
(n=21)
|
ІІІ
(n=9)
|
|
М±m
|
|
МСМ,
мг/л
|
445,6±18,2
|
679,17±81,38**
|
852,21±36,35***
|
910,13±58,86***
|
920,83±53,36***°
|
|
МСМ210,
у.о
|
0,22±0,05
|
0,37±0,03*
|
0,44±0,02***
|
0,47±0,03***
|
0,47±0,02***°
|
Примітки:
. *- р<0,05; ** - р<0,01 *** - р<0,001
- статистично значуща відмінність між показниками хворих та осіб контрольної
групи;
. °- р<0,05- статистично значуща відмінність
між показниками хворих з анемічним синдромом та без нього.
Аналогічна закономірність мала місце і у хворих
на ХКа: якщо у хворих з І ступенем анемії вміст МСМ був у 1,6 рази вищим, ніж
при ХК без анемії (р<0,001), то при ІІ-ІІІ ступенях він зростав в 1,5 рази
(р<0,001), (табл.2.11).
Таблиця 3.11 - Особливості показників
ендотоксикозу у хворих на ХК з різним ступенем анемії
|
Показник,
од. Виміру
|
Контроль
(n=20)
|
ХКа
(n=23)
|
Ступінь
анемії у хворих на ХК
|
|
|
|
І
(n=20)
|
ІІ
(n=2)
|
ІІІ
(n=1)
|
|
М±m
|
|
МСМ,
мг/л 312,50-550,00
|
445,6±18,2
|
638,75±55,73**
|
1006,42±43,56***
|
1068,75±18,75***
|
750±0,00
|
|
МСМ210,
у.о 0,076-0,37
|
0,22±0,05
|
0,34±0,03*
|
0,47±0,02***
|
0,48±0,05***
|
0,43±0,00
|
Примітки: 1. *- р<0,05; ** - р<0,01 *** -
р<0,001 - статистично значуща відмінність між показниками хворих та осіб
контрольної групи;
Серед МСМ важлива роль у метаболізмі еритроциту
належить амінокислоті гістидин, максимум поглинання світла яким припадає на
довжину хвилі, що складає 210 нм, тобто вміст МСМ210 вказує на кількість
вивільненого або невикористаного гістидину у крові.
Визначення концентрації МСМ210 дозволило
встановити, що кількість вивільненого гістидину підвищується в 1,6 рази при НВК
(р<0,05) та в 1,5 рази - при ХК (р<0,001), (табл. 2.12). При наявності
анемії цей показник зростав вдвічі як у хворих на НВК (р<0,001), так і ХК
(р<0,001). Слід підкреслити, що з посиленням тяжкості анемії кількість
хворих з високим рівнем МСМ210 збільшується (рис. 2.2). Отже вміст МСМ210
дозволяє характеризувати ступінь анемічного синдрому, обумовленого порушенням
метаболізму гістидину.

Рис. 3.2 - Динаміка частоти
зростання МСМ210 (%) у хворих на ХЗЗК з урахуванням ступеня анемії
Високий рівень ендотоксемії
(вірогідне підвищення МСМ у 92,6 % при НВК та 100,0 % при ХК) на фоні
дисбалансу в системі ПОЛ-АОЗ підтримував замкнуте порочне коло «запалення -
анемія - гіпоксія - запалення» та сприяв хронічному перебігу захворювання.
Розділ 4. ОХОРОНА ПРАЦІ
Аналіз робочого місця
Експериментальна частина дипломної
роботи проходила в лабораторії дитячої міської клінічної лікарні № 3 ім.
професора М.Ф. Руднева, у віділенні реанімації новонароджених.
Приміщення лабораторії має прямокутну
форму, площею 32 м2 , має два вікна загальною площею 16 м2, що виходять в
південному напрямку. Лабораторія вміщує 6 столів, 6 стільців, шафа з
реактивами, шафа з лабораторним посудом, 1 холодильник, раковина, лабораторне
обладнання та посуд: мікроскоп, фотокалориметр, дистилятор, центрифуги,
пробірки, колби, піпетки, циліндри, памфлети, дозатори. Загалом в лабораторії
знаходиться 5 робочих місць.
У процессі виконання роботи я
піддавалася впливу потенційно-небезпечних факторів, а саме: електричному струму,
мікроклімату, освітленню, пожежній безпеці та шуму.
Мікроклімат
Мікроклімат виробничих приміщень -
це умови внутрішнього середовища у виробничому приміщенні, що впливають на
тепловий обмін працюючих з середовищем шляхом конвекції, кондукції, теплового випромінювання
та випаровування вологи і діють на людину в процесі праці на його робочому
місці, у робочій зоні. Параметри мікроклімату: 1) температура повітря Т, °С; 2)
відносна вологість, %; 3) швидкість руху повітря V, м/с; 4) інтенсивність
теплового (інфрачервоного) опромінення; 5) температура поверхонь устаткування.
Значні коливання параметрів
мікроклімату можуть призвести до порушення терморегуляції організму (здатності
утримувати постійну температуру), загальної слабкості та інших негативних
проявів. За ступенем впливу на тепловий стан людини мікрокліматичні умови
поділяють на оптимальні та допустимі. Нормування параметрів мікроклімату
здійснюють відповідно до вимог «Санітарних норм мікроклімату виробничих
приміщень» (ДСН 3.3.6.042-99).
Оптимальні - найбільш сприятливі,
комфортні - це такі параметри мікроклімату, які в разі тривалого,
систематичного впливу на людину забезпечують нормальний тепловий стан організму
без напруження і порушення системи терморегуляції. Такі умови створюють
відчуття теплового комфорту і забезпечують умови для високого рівня
працездатності.
Допустимі - це такі параметри
мікроклімату, які у разі тривалого, систематичного впливу на людину можуть
викликали зміни теплового стану організму, що швидко минають і нормалізуються
та супроводжуються напруженням механізмів терморегуляції в межах біологічної
адаптації. При цьому не виникають ушкодження або порушення стану здоров'я, але
можуть спостерігатися відчуття дискомфорту та зниження працездатності.
Існують оптимальні умови мікроклімату
для постійних робочих місць
Таблиця 4.1.
Оптимальні величини параметрів
мікроклімату в робочій зоні
|
Період
року
|
Категорія
робіт
|
Температура
повітря, °С
|
Відносна
вологість, %
|
Швидкість
руху повітря, м/с
|
|
Теплий
період року
|
Легка
1-а
|
23-25
|
40-60
|
0,1
|
|
Легка
І-б
|
22-24
|
40-60
|
0,2
|
Я працювала над експериментальною частиною
диплому в теплий період року, виконувала роботу, згідно за категорією I-б. У
лабораторії були дотримані усі оптимальні параметри мікроклімату, а саме:
температура повітря +22 °С, відносна вологість 50%, швидкість руху повітря 0,2
м/c.
Вентиляція виробничих приміщень
Одним із ефективних засобів нормалізації повітря
в приміщенні є вентиляція. Вентиляція - це повітрообмін, за допомогою якого
забруднене шкідливими речовинами або перегріте повітря виводиться з приміщення,
а замість нього вводиться свіже зовнішнє або очищене повітря. Функція
вентиляції - забезпечення чистоти повітря та заданих мікрокліматичних умов.
За способом переміщення повітря розрізняють
системи природної, штучної (механічної) та змішаної вентиляції. За напрямом
руху повітря системи розподіляються на припливну (повітря подається у
приміщення), витяжну (забруднене повітря видаляється з приміщення) та
припливно-витяжну.
Залежно від місця дії вентиляція може бути
загальнообмінною, місцевою (шкідливі речовини надходять у повітря робочої зони
від технологічного устаткування на декількох робочих місцях), локалізованою
(шкідливі речовини надходять у повітря робочої зони від технологічного
устаткування на робочих місцях, розташованих одне біля одного) та комбінованою.
Вентиляція не повинна спричиняти перегрівання
або охолодження робатників.
У виробничих приміщеннях необхідно передбачати
природну вентиляцію, а якщо в цьому є необхідність, то і механічну. При цьому
необхідно враховувати, що природна вентиляція дешевше в процесі експлуатації,
але вона менш ефективна, тому не дозволяє «обробити» надходить у приміщення
повітря.
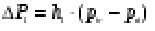 , Па.
, Па.
На рівні витяжних вікон різниця
тисків обумовлює рух повітря з приміщення в атмосферу.
 , Па.
, Па.
Загальнообмінну вентиляцію
влаштовують у випадках, коли шкідливі виділення утворюються у всьому об'ємі
приміщення. Загальнообмінна вентиляція буває природною і механічною. При
природній вентиляції повітрообмін відбувається під дією теплового або вітрового
напору без повітроводів і вентиляторів, а також без попередньої обробки
вхідного в приміщення повітря (тобто без очищення, охолодження, підігріву
повітря і т.п.). На рівні осі нижніх припливних вікон виникає різниця тисків,
обумовлених різною щільністю зовнішнього та внутрішнього стовпів повітря, через
яку повітря надходить у приміщення.
Лабораторія, у якій виконувалася
експериментальна частина дипломної роботи, відноситься до типу змішаної
вентиляції, за напрямом руху повітря є припливно-витяжною, залежно від місця
дії є комбінованою.
Шум
Шум - один із найпоширеніших
виробничих шкідливих факторів. У разі його тривалого впливу не тільки
знижується гострота слуху, але й погіршується робота центральної нервової і
серцево-судинної систем, шлунково-кишкового тракту, органів дихання, виникають
запаморочення та функціональні зміни нервової системи, втома, ослаблення
пам'яті та уваги. Шум може стати причиною виробничого травматизму та зниження
продуктивності праці.
Шумом називають звук, що порушує
тишу, постійно заважає слуховому сприйняттю і може спричинити шкоду для
здоров'я.
Захист від шуму повинен досягатися
шляхом створення шумобезпечної техніки (ГОСТ 12.1.003-83, ДСН 3.3.6.037-99),
застосування методів і засобів колективного захисту (ГОСТ 12.1.029-80),
індивідуального захисту, застосування архітектурно-планувальних методів.
Відповідно до ДСН 3.3.6.037-99 ГДР шуму в експериментальній лабораторії складає
73Дб. У таблиці 3 представлені норми шуму в разі виконання розумової праці.
Таблиця 4.2.
Гранично допустимі норми шуму
|
Характер
роботи
|
Середньо
геометрична частота в октавній смузі, Гц
|
ДБА
|
|
31,5
|
63
|
125
|
250
|
500
|
1000
|
2000
|
4000
|
8000
|
|
|
Вимірювальні
та аналітичні роботи в лабораторії
|
93
|
79
|
70
|
63
|
58
|
55
|
52
|
50
|
49
|
60
|
У лабораторії, де виконувалася експериментальна
частина роботи, рівень шуму складав 46-53дБ(А).
Пожежна безбека
Пожежа - неконтрольований процес горіння, який
супроводжується знищенням матеріальних цінностей і створює небезпеку для життя
людей.
Відповідно до ОНТП 24-86 приміщення за
вибухопожежною та пожежною небезпекою залежно від характеристик речовин, які
використовують чи отримують під час виробництва та їх кількості, поділяють на 5
категорій: А, Б, В, Г та Д.
Категорія А (пожежовибухонебезпечні приміщення)
- виробництва, пов'язані з використанням паливних газів та легкозаймистих рідин
із температурою спалаху to,, до 28 °С у кількостях, що можуть утворювати
вибухонебезпечні парогазоповітряні суміші, у разі спалахування яких
розрахунковий надлишковий тиск вибуху в приміщенні перевищує 5 кПа, а також
речовини й матеріали, здатні вибухати та горіти у разі взаємодії з водою,
киснем повітря або одне з одним, в такій кількості, що розрахунковий
надлишковий тиск вибуху в приміщенні перевищує 5 кПа.
Категорія Б (пожежовибухонебезпечні приміщення)
- виробництва, пов'язані з використанням горючого пилу або волокон
легкозаймистих рідин із температурою спалаху tc > 28 °С з тією ж межею
надлишкового тиску, що й у категорії А.
Категорія В (пожежонебезпечні) - виробництва, де
використовують рідини, що горять та важко горять, пил і тверді матеріали й
речовини, здатні горіти тільки у разі взаємодії з водою, киснем повітря або між
собою за умови, що приміщення, в яких вони знаходяться або використовуються, не
належать до категорій А та Б.
Категорія Г - виробництва, пов'язані з обробкою
негорючих речовин та матеріалів у гарячому, розжареному або розплавленому
стані, спалимих рідин, твердих речовин, які спалюють або утилізують як паливо.
Категорія Д - виробництва, пов'язані з обробкою
негорючих речовин у холодному стані.
Лабораторія, у якій виконувалася
експериментальна частина дипломної роботи, відноситься до категорії Д, за
наявності горючих матеріалів площею менше 10 кв.м, питома пожежна навантага
складала менше 180 МДж/м2.
Освітлення
Організація освітлення робочих місць має велике
значення. Недостатнє чи нераціональне освітлення призводить до стомлення очей,
розладу центральної нервової системи, зниження розумової та фізичної
працездатності, а в ряді випадків може бути причиною травматизму (близько 5%
травм приходиться виникають внаслідок нераціонального чи недостатнього
освітлення).
Виробниче освітлення може бути: природним,
штучним та суміщеним. Державних будівельних норм (ДБН) В.2.5-28-2006 «Природне
та штучне освітлення» у приміщеннях із постійним перебуванням людей повинно
бути передбачене природне освітлення. Основною нормованою величиною природного
освітлення є КПО, (є) - коефіцієнт природної освітленості. Одиниця виміру
освітленості - люкс (лк) - освітленість поверхні площею 5 = 1 м2 за умов
світлового потоку Ф = 1 лм, який падає на неї.
Згідно ДБН В.2.5-28-2006 «Природне та штучне
освітлення» для роботи в біохімічній лабораторії норми освітлення повинні бути
100-300лк при штучному освітленні, а при природному - 0,5-1,0% (бокове
освітлення). Щоб забезпечити оптимальне освітлення стабілізують напругу
живлення, жорстко кріплять світильники, застосовують спеціальні пристрої для
включення світильників.
Таблиця 4.3.
Нормативні значення мінімально допустимих рівнів
освітленості
|
Характеристика
зорової роботи
|
Найменший
розмір об'єкта розрізнення, мм
|
Розряд
зорової роботи
|
Тривалість
зорової роботи,%
|
Штучне
освітлення
|
Природне
освітлення
|
|
|
|
|
Освітлення
робочої поверхні, лк
|
Кп,
%
|
КПО,
% при бічному
|
|
Дуже
високої точності
|
0,15-
0,3
|
ІІ
|
70
|
500/400
|
10
|
1,5
1,2
|
|
Високої
точності
|
0,3-0,5
|
ІІІ
|
70
|
300/200
|
15-20
|
1,0
0,7
|
|
Середньої
точності
|
більше
0,5
|
ІV
|
70
|
150/100
|
20
|
0,5
0.5
|
У лабораторії, в якій здійснювалася
експериментальна частина дипломної роботи, було природне та штучне освітлення.
Природне освітлення було обумовлене прямими сонячними променями через вікна.
Електробезпека
Електроустановками називають сукупність машин,
ліній, допоміжного обладнання, призначених для виробництва, перетворення,
трансформації, передачі, розподілу електроенергії та перетворення її на інші
види енергії. Недотримання вимог електробезпеки під час роботи на
електроустановках, як правило, призводить до електротравм.
Електротравма - це порушення цілісності
організму в разі дії на нього електричного струму або електричної дуги.
Відповідно до «Правил улаштування
електроустановок» (ПУЕ) приміщення за небезпекою електротравм поділяють на три
категорії:
без підвищеної небезпеки;
із підвищеною небезпекою;
особливо небезпечні.
Відповідно до ГОСТ 12.1.038-82 установлені норми
гранично допустимих напруги дотику та струму залежно від тривалості впливу,
умов виконання робіт і режиму роботи електричних мереж. У таблиці 4 наведені ці
рівні під час проходження струму від однієї руки до другої та від руки до ніг у
разі нормального режиму роботи електроустановки для мережі до 1000 В із
будь-яким режимом нейтралі і вище 1000 В з ізольованою нейтраллю.
Таблиця 4.4.
Норми струму та напруги дотику
|
Вид
току
|
Нормоване
значення
|
Граничнодопустимі
рівні за тривалості пилу, г.
|
|
|
0,1
|
0,5
|
0,7
|
1,0
|
Понад
1,0
|
|
Перемінний
з частотою 50 Гц
|
Струм,
мА
|
500
|
100
|
70
|
50
|
6
|
|
Напруга
дотику, В
|
500
|
100
|
70
|
50
|
36
|
Під час виконання експериментальної частини
дипломної роботи, я працювала у лабораторії, що відноситься до першої категорії
приміщень по електронебезпеці, тому що у ній не були наявні умови, що створюють
підвищену небезпеку: відсутність струмопровідної підлоги, температура повітря
протягом доби (25-28°С).
ВИСНОВКИ
. Особливу значущість у верифікації гіпохромної
анемії при ХЗЗК, поряд з еритроцитарними індексами, набуває виснаження
загальних резервів заліза у 42,0 % хворих, при недостатності феритину, яке має
місце у 2 рази частіше при НВКа, ніж при ХКа (46,3 % проти 26,7 %), і вказує на
перевагу ЗДА у цих хворих. Наявність нормального та підвищеного феритину як при
НВКа, так і при ХКа поряд із зниженням ЗЗЗС у 53,7 % хворих на НВКа та 71,4 % -
на ХКа, свідчить про комбінацію у них ЗДА з АХЗ.
. У формуванні метаболічної складової порушення
еритропоезу суттєву роль відіграють поступове виснаження резерву ЦП та
залізовмісної каталази у хворих на НВКа, а також порушення тіолового обміну,
яке проявляється зростанням відновлених тіолів у еритроцитах і відображує
напругу у тіол-дисульфідній ланці, сприяючи розвитку адаптаційного дисбалансу у
системі еритропоезу, який посилюєтьсяся зі зростанням ступеня анемії.
. Анемічний синдром при ХЗЗК супроводжується
недостатністю кисень-залежних процесів в еритроцитарній ланці, на що вказує
зниження рівня кінцевих стабільних метаболітів оксиду азоту NOx (р<0,01).
. Високий рівень ендотоксемії, за підвищенням
МСМ у 92,6 % при НВКа та 100,0 % при ХКа, на фоні дисбалансу в системі ПОЛ-АОЗ
підтримує замкнуте порочне коло «запалення - анемія - гіпоксія - запалення» та
сприяє хронічному перебігу захворювання. Серед МСМ доведена значущість
гістидину, що визначає ступінь ендогенної інтоксикації при розвитку анемічного
синдрому.
. Лікування сприяло корекції виявлених порушень
в системі ферокінетики у хворих всіх груп. Відбувалося зниження явища
ендотоксикозу у хворих з анемією хронічного захворювання та зі змішаним типом
анемії, спостерігалася активація АОС у хворих на хронічні запальні захворювання
кишечнику з залізодефіцитною анемією, що проявлялося в підвищенні вмісту АОА,
(р<0,05) та тенденції до підвищення активності ферментів антиоксидантного
захисту СОД.
СПИСОК ЛІТЕРАТУРИ
Дорофеев
А.Э. Клинико-эндоскопическая характеристика больных неспецифическим язвенным
колитом, проживающих в Донецком промышленном регионе/ А.Э. Дорофеев//
Гастроентерологія. - 2006. - № 37. - С. 14-24.
Міщук
В. Г. Ефективність різних схем терапії при неспецифічному виразковому коліті /
В. Г. Міщук, Т. І. Маковецька, Е.Й. Лапковський // Сучасна гастроентерологія. -
2008. - № 2. - С. 11-13.
Пасієшвілі
Л.М. Хронічний коліт як чинник розвитку та прогресування вторинного остеопорозу
у хворих з остеохондрозом хребта / Л.М. Пасієшвілі, А.Б. Андруша // Сучасна
гастроентерологія. - № 2. - 2008. - С. 30-33.
Лекціїї
по патологічній анатомії. Захворювання кишечника <http://ukrmedserv.com/content/view/7955/327/lang,ru/>.
Носова
І.А. Труднощі діагностики та обґрунтування принципів базисного лікування хворих
на неспецифічні запальні хвороби кишечнику / І.А. Носова // Сучасна
гастроентерологія. - 2008. - № 2. -- С. 51-55.
Камышников
В.С. Справочник по клинико-биохимической лабораторной диагностике в 2-х т. т.2
/ В.С. Камышников //Минск: Беларусь. -2000. - 465 с.
Gasche C. Iron, anaemia, and
inflammatory bowel diseases/ C.Gasche, M.C.E.Lomer, I.Cavill et. al.// Gut. - 2004.
- Vol.53, № 8. - P. 1190-1197.
Півторак
К.В. Патогенетичні механізми розвитку анемічного синдрому при неспецифічному
виразковому коліті та хворобі Крона (огляд літератури)/ К.В. Півторак // Вісник
Вінницького національного медичного університету. - 2008. - № 12 (2). - С.
481-485.
Гунько
И.Н. Роль процессов свободнорадильного окисления в развитии эндотелиальной
дисфункции и гемореологических нарушений у больных с острым коронарным
синдромом / И.Н. Гунько // - Український мед. часопис. - 2002 - № 5. -
С.138-141.
Ващенко
В.И. Церулоплазмин: от метаболита до лекарственного средства/ В.И. Ващенко,
Т.Н. Ващенко// Психофармакол. биол. наркол. - 2006. - Т. 6, № 3. - С.
1254-1269.
Гончарова
Л.Л. Тиолдисульфидная система в клинической практике/ Л.Л. Гончарова // Terra
Medica. - 2002. - №3.
Нагоев
Б.С. Состояние тиол-дисульфидного звена антиоксидантной системы у больных
герпес-вирусными инфекциями/ Б.С. Нагоев, З.А. Камбачокова// Эпидемиол. и
инфекц. болезни. - 2011. - № 1. - С. 38 - 40.
Степовая
Е.А. Участие тиолдисульфидной системы в регуляции окислительной модификации
белков в нейтрофилах при окислительном стрессе / Е.А. Степовая, Т.В. Жаворонок,
Г.В. Петина, Н.В. Рязанцева, В.В. Иванов, Ф.Ф. Тетенев, Т.С. Агеева, В.В.
Новицкий // Бюллетень СО РАМН. - 2010. - т. 30. - №5. - С. 64-69.
Калинкина
Н.В. Особенности метаболизма оксида азота под влиянием различных кумулятивных
доз антрациклиновых препаратов / Н.В. Калинкина // Донецкий надиональный
медицинский университет. Автореферат. - 2010. - 6 с.
Костогрыз
В.Б. Особенности метаболизма оксида азота у пациентов с хронической сердечной
недостаточностью ишемической этиологии с имплантированным
электрокариостимулятором: возможности медикаментозной коррекции блокаторами
бета-адренорецепторов/ В.Б. Костогрыз, Т.В. Туровская// Укр.мед.час.опис. -
2010. - № 5 (79). - С. 81-84.
Моисеева
М.О. Роль оксида азота и его метаболитов в регуляции сосудистого тонуса при
гипертонической болезни / О.М. Моисеева, Л.А. Александрова, И.В. Емельянов,
Е.А. Лясникова, Н.К. Меркулова, Т.Г. Иванова, А.А. Жлоба // Артериальная
гипертензия. - 2003. - т.9. - №6. - С. 17-23.
Аксенова
В.М. Диагностическая ценность определения уровня веществ средней молекулярной
массы в плазме новорожденных детей, перенесших внутриутробную гипоксию /В.М.
Аксенова, А.В.Старкова//Перм. мед. журнал. - 1998. - Т. 15. - № 1. - С. 25-28.
Камышников
В.С. Справочник по клинико-биохимической лабораторной диагностике: В 2 т. - Т.
1. - 2-е изд. - Мн.: Беларусь, 2002. - С. 344-351.
Матвеев
С.Б. Оценка эндогенной интоксикации по показателям среднемолекулярных пептидов
при неотложных состояниях / С.Б. Матвеев, Н.В. Федорова, М.А. Годков // Клин.
лаб. диагностика. - 2009. - № 5. - С. 16 - 18.
Кишкун
А.А. Клиническая лабораторная диагностика: учебное пособие. - М.: ГЭОТАР-Медия.
- 2010. - С.137-139.
Тюкавкина
Н.А., Бауков Ю.И. Биоорганическая химия: Учебник. - 2-е изд., перераб. и доп. -
М.: Медицина. - 1991. - С. 287.
Звягинцева
Т.Д. Неспецифический язвенный колит: современное состояние проблемы./Т.Д.
Звягинцева, Гриднева С.В.// Здоров’я України - 2006. - № 21/1. - С.3-4.
Серов
В.Н. Железодефицитные состояния у беременных./ В.Н. Серов, В.А. Бурлев, Е.Н.
Коноводова, М.Б. Охапкин, М.В. Хитров, И.Н. Ильяшенко, В.О. Лопухин //
Российский клинический олпыт для акушеров-гинекологов. - 2005.
Станіславчук
М.А. Характеристика анемічного синдрому при неспецифічному виразковому коліті/
М.А. Станіславчук, К.В. Півторак// Буковинський медичний вісник. - 2008. -
т.12. - № 3. - С. 47-51.
Сирота
Т.В. Новый подход в исследовании процесса аутоокисления адреналина и
использование его для измерения активности супероксиддисмутазы/ Т.В. Сирота
//Вопросы медицинской химии. -1999.
- т. 45. - №3. -С. 263-272.
Біохімічні
та біофізичні методи оцінки порушень окислювального гомеостазу в осіб, що
зазнали радіоційного впливу внаслідок аварії на ЧАЕС: Метод.рекомендації / Під
ред. М.М.Овсяннікова, С.М.Альохіна, О.В.Дробінської та ін. К., 1999. 6 с.
Спектор
Е. Б. Определение общей антиокислительной активности плазмы крови и ликвора/ Е.
Б. Спектор, А.А. Ананенко, Л.И. Политова //Лаб. дело. - 1984 - № 1. - C. 26-28.
Николайчук
В.В. Способ определения «средних молекул» / В.В. Николайчук, В.М. Моин, В.В.
Кирковский // Лабор. дело. - 1991. - №10. - С. 13-16.
Современные
методы в биохимии/ под. ред.. В.Н. Ореховича. - М.: Медицина. - 1977. - С.
223-231.
Метельская
В.А. Скрининг-метод определения уровня метаболитов оксида азота в сыворотке
крови./ В.А. Метельская, Н.Г. Гуманова// Лабораторная диагностика. - 2005. - №
6. - С. 15-18.
Ільченко
Ф. Н. Особливості патогенезу і профілактики ендогенної інтоксикації як чинника
риску біліарного сепсису у хворих з ускладненою жовчнокам'яною хворобою
/Ільченко Ф. Н., Сербул М. М., Гордієнко А. І //Сучаснi медичнi технології. -
2010. - № 1.
Бойко
Т.И. Анемія та хронічні запальні захворювання кишечника// Новости медицины и
фармации.Гастроэнтерология (407) 2012 (тематический номер) / В помощь
практикующему врачу.- 2012. - № 407. - С. 49-53.
Меньшикова
Е.Б., Зенков Н.К., Реутов В.П. Оксид азота и NO-синтазы в организме
млекопитающих при различных физиологичесих состояниях // Биохимия - 2000 - т.
65, вып.4 - С. 485 - 503.
Грищенко
В.А., Тимчук В.А., Литвиненко О.М. Діагностика порушень коагуляційних процесів
при медикаментозному гепатиті та їх корекція //Лаб. диагностика. - 2010,
№3(53). - С. 20-23.
Дрогемецкая
Н.В., Заболотная И.Б., Ижа А.Н. Эффективность применения препарата нейровитан в
комплексном лечении больных с заболеваниями органов пищеварения // Новости
медицины и фармации ( гастроэнтерол.). - 2008. - № 239. - С. 2 - 4.
Виговська
Я. І. Анемія хронічних хвороб: патогенез, діагностика, лікування (лекція) //
Укр. Мед. Часопис. - 2012, № 6 (92). - С. 76-79.
Видиборець
С.В. Гепсидин - як центральний регулятор метаболізму заліза / С.В. Видиборець,
А.В. Сергієнко, Ю.Ю. Попович // Укр. журнал гематол. та трансфузіол. - 2011. -
№ 2. - С. 5-9.
Гусєва
С. А., Гончаров Я. П., Курищук К. В. та ін. Рекомбінантний еритропоетин:
застосування в клінічній практиці. - К.: Логос, 2007 - 131 с.
Залізодефіцитні
стани: посібник для лікарів / за ред. С.А. Гусєвої та ін. - К.: Логос, 2005. -
76 с.
Колочева
Т. И. Ферритин в лабораторной диагностике различных заболеваний человека / Т.
И. Колочева, С. С. Решетников. // Новости "Вектор-Бест". - 2007. - N1(43). - Режим доступа к журн.:
<http://www.vector-best.ru/nvb/n43>/st43_4.htm.
Левина
А. А. Гепсидин как регулятор гомеостаза железа / А.А. Левина, Т.В. Казюкова,
Н.В. Цветаева и др. // Педиатрия. - 2008. - Т. 87, № 1. - С. 67- 74.
Свінціцький
А. С., Гусєва С. А., Скрипниченко С. В та ін. Діагностика та лікування
захворювань системи крові Посібник для студентів та лікарів-інтернів. - К. :
Медкнига, 2010. - 148 с.
Brasse-Lagnel C, Rarim Z., Letteron
P. et al. Intestinal DMT1 cotransporter is down regulated by hepcidin via
proteasome internalization and degradation // Gastroenterol. - 2011. - Vol. 140
(4). - P. 1261-1271.W. C., Tsai T. J., Chen Y. M. et al. Serum soluble
transferrin receptor reflects erythropoiesis but not iron availability in
erythropoietin-treated chronic hemodialysis patients // Clin. Nephrol. 2002. -
Vol. 58. - P. 363-369.G., Fleury T., Means R. T. Serum hepcidin in clinical
specimens // Br. J. Haematol. - 2003. - Vol. 122. - P:996 - 1000.T: Hepcidin, a
key regulator of iron metabolism and mediator of anemia of inflammation / T.
Ganz // Blood. - .2003. - Vol. 102. - P. 783- 788.C., Lomer M. C., Cavill I. et
al. Iron, anaemia, and inflammatory bowel diseases / // Gut. - 2004. - V. 53, N
8. - P. 1190-1197.F., Gisbert J. Anemia and inflammatory bowel diseases //
World J. Gastroenterol. - 2009. - Vol. 15 (37). - P. 4659-4665.B. I., MacPhail
A. P., Alberts M. et al. The ratio of serum transferring receptor and serum
ferritin in the diagnosis of iron status / A. P. // Br. J. Haematol. - 2001 -
Vol.115. - P. 84-89. N. Anemia - still a major health problem in many parts of
the world! // Ann. Hematol. - 2011. - Vol. 90. - P. 369-377E., Ganz T. The role
of hepcidin in iron metabolism // Acta Hematol. - 2009. - Vol 122 (2-3). - P.
78 - 86. B. S. Serum transferring receptor // Am. J. Hematol. - 2008. - Vol. 83
(11). - P. 872 - 875.J. Diagnosis and management of iron deficiency anemia in
patients with IBD / J. Stin, F. Hartmann, A.U. Dignas // Nature Revue
Gastroent. Hepatol. - 2010. - V. 7, N 11. - P. 599-610.D. C., Huang T. P:
Determinants of circulating soluble transferrin receptor level in chronic
haemodialysis patients / Nephrol. Dial. Transplant. - 2002. - Vol. 17. - P.
1063- 1069.C., Montosi G., Zhang K et al. ER stress controls iron metabolism
through induction of hepcidin // Science. - 2009. - Vol. 325. - P. 877-880.J.
B. Assessing Iron Status: Beyond Serum Ferritin and Tanserrin Saturation // Clin.
J. of the American Cociety of Nephrology. - 2006.- Vol. 1, Suppl. 1. -
S4-S8.Health Organization. Assessing the iron status of populations. Geneva, WHO
2007. - Режим доступа к журн.:
<http://www.who.int/entity/nutrition/>
World Health Organization. Worldwide
prevalence of anaemia 1993- 2005. WHO Global Database on Anaemia. Geneva, WHO
2008.