Определение константы диссоциации уксусной кислоты
Введение
электрохимический буферный диссоциация электрод
Выбирая тему своей курсовой работы,
я прежде всего хотел найти такую тему, которая бы совмещала в себе несколько
качеств: она должна быть непременно с практической частью, где необходимо было
бы работать «своими руками», а не просто изучать теоретический материал, она
должна поставить передо мной ряд задач, которые бы действительно заставили меня
думать, как ученого, и, конечно же, она должна быть интересной для меня.
И я нашел такую тему: «Определение
константы диссоциации уксусной кислоты».
В первом семестре в курсе общей
химии мы подробно рассматривали эти константы - что это такое, откуда они
берутся, решили бесчисленное количество задач, и почти в каждой было необходимо
было использовать значение какой-либо константы. Нам всё про эти константы
рассказали. Всё, кроме одного. Как они высчитываются учеными? Все те цифры,
напечатанные в книге, воспринимаются как данное, как будто они были всегда
известны человеку. И мало кто из студентов задумывается, как получаются эти
значения.
И я решил взять эту тему. В начале
работы у меня не было ни единой мысли, как это можно было бы осуществить и
посчитать. Узнав поподробнее про потенциометрию, я пришел к первым зацепкам. В
итоге мне пришлось прочитать много литературы, «поломать голову», отсеять все
лишнее, чтобы прийти к решению этой задачи. Я намеренно избегал помощи
преподавателей для большего понимания процесса научного поиска, ведь в
«большой» науке просить помощи будет не у кого. Мне удалось даже в какой-то
мере прочувствовать этот процесс научного поиска, что, безусловно, дарит
радость от результата, от проделанной работы.
Выполняя эту курсовую работу, я
приобрел много нового опыта, много полезных навыков как в лабораторной
практике, так и в поиске и отборе научной и методической литературы. Я уверен,
что приобретенные знания мне помогут в будущем для решения более масштабных
задач.
Цели и задачи:
) Ознакомиться с потенциометрией и
ее различными видами, с приборами, используемыми потенциометрией и их устройством
) Практически вычислить константу
диссоциации уксусной кислоты через рН раствора и сравнить полученное значение
со значением в справочнике
) Построить график зависимости рН от
концентрации кислоты
1. Потенциометрия
.1 Электрохимические
методы анализа
Химические методы анализа основаны
на химических реакциях, протекающих в растворах, расплавах, твердых телах и
газах - реакциях нейтрализации, осаждения, комплексообразовния, окисления -
восстановления или газообразования.
Под термином физические методы,
анализа объединяются все методы, в которых не применяются химические (или
электрохимические) реакции. При проведении анализа многими из физических
методов анализируемое вещество не изменяет свой состав.
В физико-химических методах анализа
используются химические или электрохимические реакции и анализ ведется на
основе исследования зависимости между химическим составом и каким-либо
физическим свойством равновесной или неравновесной химической системы.
Соответственно различают методы анализа: фотометрические (или фотометрия),
хроматографические (или хроматография), кинетические и электрохимические.
Среди физико-химических методов
анализа большое место занимают электрохимические методы вследствие их
многообразия, высокой чувствительности и точности результатов,
безынерционности, быстроте проведения анализа и возможности автоматизации.
Электрохимические методы
анализа - это методы качественного и
количественного анализа веществ, находящихся в газообразном, жидком (в
растворах и расплавах) или твердом состояниях, основанные на электрохимических
явлениях в исследуемой среде или на границах соприкасающихся фаз и связанных с
изменением структуры, химического состава или концентрации [1].
1.2 Классификация
электрохимических методов анализа
Электрохимические методы основаны на
измерении электрических параметров электрохимических явлений, возникающих в
исследуемом растворе. Такое измерение осуществляют с помощью электрохимической
ячейки, представляющей собой сосуд с исследуемым раствором, в который помещены
электроды. Электрохимические процессы в растворе сопровождаются появлением или
изменением разности потенциалов между электродами или изменение величины тока,
проходящего через раствор.
Электрохимические методы
классифицируют в зависимости от типа явлений, замеряемых в процессе анализа. В
общем случае различают две группы электрохимических методов:
. Методы без наложения постороннего
потенциала, основанные на измерении разности потенциалов, который возникает в
электрохимической ячейке, состоящей из электрода и сосуда с исследуемым
раствором. Эту группу методов называют потенциометрическими. В
потенциометрических методах используют зависимость равновесного потенциала
электродов от концентрации ионов, участвующих в электрохимической реакции на
электродах.
. Методы с наложением постороннего
потенциала, основанные на измерении:
а) электрической проводимости
растворов - кондуктометрия;
б) количества электричества,
прошедшего через раствор - кулонометрия;
в) зависимости величины тока от
приложенного потенциала - вольт-амперометрия;
г) времени, необходимого для
прохождения электрохимической реакции - хроноэлектрохимические методы
(хроновольтамперометрия, хронокондуктометрия).
В методах этой группы на электроды
электрохимической ячейки налагают посторонний потенциал.
В данной курсовой работе нас
интересует только первый тип методов, т.е. потенциометрические методы.
Потенциометрия объединяет методы
определения различных физико-химических величин и концентраций веществ,
основанные на измерении электродвижущих сил (э.д.с.) обратимых
электрохимических цепей, когда рабочий электрод имеет потенциал, близкий к
равновесному значению.
Основы потенциометрии заложены В.
Нернстом, который в 1889 г. получил известное уравнение для равновесных
электродных потенциалов. Вскоре потенциометрия начала применяться в
аналитической химии и в 1893 г. Р. Беренд провел первое потенциометрическое
титрование. В настоящее время потенциометрия широко применяется в аналитической
и физической химии.
.3 Классификация методов
потенциометрии
В настоящее время потенциометрия
широко используется для определения различных физико-химических величин, в
аналитической химии - для определения концентрации веществ в растворах, в
автоматических непрерывных методах контроля различных технологических процессов
(потенциометрические датчики-преобразователи) и развивается в нескольких
направлениях (рис. 1) [1, стр. 7]
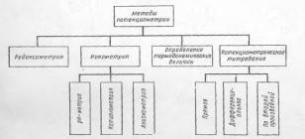
Рис. 1. Классификация методов
потенциометрии
1) Редоксометрия
Редоксометрия объединяет ряд
методов, основанных на измерении окислительно-восстановительных потенциалов в
растворах.
В настоящее время широко применяется
для изучения протолитических процессов и комплексообразовния (в химии), для
контроля технологических процессов в фармацевтической, текстильной,
целлюлозно-бумажной, гидрометаллургической, винодельческой промышленности, в
санитарно-гигиенических исследованиях и в ряде других областей науки и
производства.
2) Определение
термодинамических величин
Широко используется в физической
химии. С помощью потенциометрии определяются изменения величины свободной
энергии, энтропии, энтальпии при химических процессах, определяются активности
(концентрации) в водных и неводник растворах и расплавах.
Потенциометрическое титрование -
использование потенциометрических методов для наблюдения за ходом реакции
титрования и особенно для нахождения точки эквивалентности.
По сравнению с индикаторным
титрованием этот метод позволяет достичь большей точности, а также позволяет
титровать вещества, для которых отсутствуют цветные индикаторы или их
применение невозможно. Часто за один прием можно определить несколько веществ,
присутствующих в растворе.
3) Потенциометрическое
титрование
При потенциометрическом титровании
используются реакции нейтрализации, осаждения, комплексообразовния, окисления -
восстановления.
Различают три способа
потенциометрического титрования: прямое, дифференциальное и по второй
производной. Последние два способа применяются для увеличения точности
определения конечной точки.
) Ионометрия
Ионометрия - область прямой потенциометрии,
которая объединяет методы прямого определения концентрации или активности ионов
в различных фазах с использованием ионоселективных электродов.
К области ионометрии относятся давно
известная рН-метрия и новые методы - катионометрия и анионометрия.
Катионометрия и анионометрия
объединяют методы прямого определения концентрации или активности ионов (Na+,
К+, Са2+, Mg2+, Zn2+, Pb2+,
La3+ и др.; F-, Cl-, Br-, S2-,
ClO4-, NO3- и др.).
рН-метрия включает методы, применяющиеся для измерения концентрации ионов
водорода в растворах. Понятие рН введено в науку Зеренсеном в 1909 г. Он же
разработал экспериментальный метод определения рН. Большой вклад в теорию и
методы измерения величины рН внесли советские ученые под руководством акад.
Б.П. Никольского: М.М. Шульц, П.А. Крюков и др.
В настоящее время известна очень
большая роль ионов водорода во всех химических и биологических процессах.
Поэтому измерение величины рН имеет большое значение в биологии, медицине,
химии, в сельском хозяйстве, в химической, нефтяной, бумажной, пищевой
промышленности, в гальванотехнике и т.д.
Потенциометрический метод намного
точнее, чем колориметрический, но требует оборудования лабораторий специальными
приборами - pH-метрами.
Именно этот метод я использовал на
практике для определения pH исследуемого раствора.
.4 Приборы
потенциометрических методов
Основным элементом приборов для
электрохимического анализа является электрохимическая ячейка. В методах без
наложения постороннего потенциала (потенциометрических) она представляет собой
гальванический элемент, в котором вследствие протекания химических
окислительно-восстановительных реакций возникает электрический ток. В ячейке
типа гальванического элемента в контакте с анализируемым раствором находятся
два электрода - индикаторный электрод, потенциал которого зависит от
концентрации вещества, и электрод с постоянным потенциалом - электрод
сравнения, относительно которого измеряют потенциал индикаторного электрода.
Измерение разности потенциалов производят специальными приборами - потенциометрами.
Приборы для электрохимических
определений кроме электрохимической ячейки, мешалки, нагрузочного сопротивления
включают устройства для измерения разности потенциалов, тока, сопротивление
раствора, количества электричества. Эти измерения могут осуществляться
стрелочными приборами (вольтметр или микроамперметр), осциллографами,
автоматическими самопишущими потенциометрами. Если электрический сигнал от
ячейки очень слабый, то его усиливают с помощью радиотехнических усилителей.

Рис. 2 Схема ячейки для
потенциометрических измерений
Прибор, который я использовал в
своей работе, называется pH-метр - прибор для измерения водородного
показателя (показателя pH), характеризующего активность ионов водорода в
растворах, воде, пищевой продукции и сырье, объектах окружающей среды и пр.
Действие pH-метра основано на
измерении величины ЭДС электродной системы, которая пропорциональна активности
ионов водорода в растворе водородному показателю. Измерительная схема по сути
представляет собой вольтметр, проградуированный непосредственно в единицах pH
для конкретной электродной системы.
Две главные настройки выполняются
при калибровке по буферным растворам с точно известным значением pH -
устанавливается крутизна усиления и смещение нуля. Так же настраивается так
называемая изопотенциальная точка (pHи, Eи) - значение pH
и соответствующая ему ЭДС, при которых ЭДС системы не зависит от температуры.
.5 Электроды
В потенциометрии обычно применяют
гальванический элемент, включающий два электрода, которые могут быть погружены
в один и тот же раствор (элемент без переноса) или в два различных по составу
раствора, имеющих между собой жидкостной контакт (цепь с переносом).
Первый электрод - это электрод,
потенциал которого зависит от активности (концентрации) определяемых ионов в
растворе, называется индикаторным.
Для измерения потенциала
индикаторного электрода в раствор погружают второй электрод, потенциал которого
не зависит от концентрации определяемых ионов. Такой электрод называется
электродом сравнения. Величину ЭДС можно рассчитать по разности потенциалов
этих электродов.
Зависимость величины электродного
потенциала (ЭП) от активности ионов в растворе выражается уравнением Нернста:
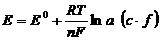
где Е0 - стандартный
электродный потенциал; R - универсальная газовая постоянная (R = 8.314 Дж/моль∙К);
Т - абсолютная температура; n - число электронов (з), участвующих в реакции; c
- концентрация, моль/дм3; f - коэффициент активности.
Так как в потенциометрии используются
разбавленные растворы, где f стремятся к единице, то активность (а) заменяют на
концентрацию (с).
Если перейти от ln к lg, то при T =
298K (25°С) уравнение запишется в виде
Индикаторные электроды
В потенциометрическом
методе анализа используют обратимые электроды. Токи обмена для обратимых
электродов достигают несколько десятков и сотен мА/см2. Потенциал у
таких электродов зависит от активности компонентов электродной реакции в
соответствии с термодинамическими уравнениями. На обратимых электродах быстро
устанавливается равновесие, и скачки потенциалов остаются неизменными во
времени. При прохождении электрического тока скачки потенциалов не должны
значительно изменяться; а после выключения тока быстро должно устанавливаться
равновесие. Электроды, не удовлетворяющие этим требованиям, называются
необратимыми.
В потенциометрии
применяют два основных класса индикаторных электродов:
А) Электроды, на
межфазных границах которых протекают реакции с участием электронов, так
называемые электронообменные (окислительно-восстановительные, электроды первого
и второго рода);
Б) Электроды, на
межфазных границах которых протекают ионообменные реакции. Такие электроды
называют мембранными, или ионообменными, их называют также ионоселективными.
Рассмотрим их подробнее.
А) Электронообменные
электроды
1) Окислительно-восстановительные
электроды состоят из электрохимически инертного проводника (платины,
графита и т.д.), погруженного в раствор, в котором находятся окисленная и
восстановленная формы потенциалопределяющего вещества. Такой инертный проводник
способствует передаче электронов от восстановителя к окислителю через внешнюю
цепь. Примерами таких электродов могут служить редокс-электроды с ионами в
различных степенях окисления: (Pt) Sn4+, Sn2+, (Pt) Fe3+,
Fe2+.
Уравнение Нернста при
298 К:
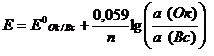
) Электроды первого
рода - электроды, находящиеся в равновесии с катионами, одноименными с
металлом, и обратимые по отношению к ним. Простейший электронообменный электрод
- металлическая пластинка, погруженная в раствор или расплав электролита Zn/Zn2+;
Cu/Cu2+ и т.д.
Уравнение Нернста для
электрода первого рода при 298 К
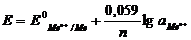
) Электроды второго
рода представляют собой металлические электроды, покрытые слоем
труднорастворимой соли того же металла. При погружении в раствор соли
одноименного аниона его потенциал будет определяться активностью иона в
растворе.
.1.) Хлорсеребряный
электрод (ХСЭ) Ag0, AgCl|Cl - представляет собой
серебряный проводник, покрытый твердым AgCl, который погружен в насыщенный
раствор KCl.
Серебро электрохимически
взаимодействует со своим ионом:
+
+ e- = Ag.
Уравнение Нернста для
этого процесса:
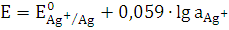 (1)
(1)
Однако в присутствии
труднорастворимого AgCl активность ионов серебра очень мала и ее трудно
определить. Но активность ионов Ag+ связана с легко задаваемой в
данной системе активностью ионов Cl - произведением растворимости
хлорида серебра ПРAgCl:
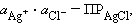
Откуда:
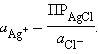
Подставляя это выражение в (1)
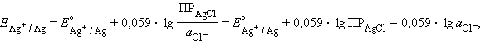
и обозначив
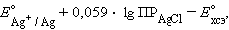
получим уравнение Нернста для
хлорсеребряного электрода:
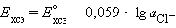
где Е0ХСЭ =
+1,37425 В
Потенциалопределяющими являются ионы
хлора, а электродный процесс может быть представлен уравнением
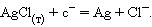
Именно ХСЭ получили очень широкое
распространение в потенциометрии, они обладают многими достоинствами: высокая
воспроизводимость, возможность изготовления в малых размерах, применимость в
различных средах, водных и неводных растворах. Они используются в цепях без
жидкостных соединений. [1, стр. 14]
.2.) Каломельный
электрод (КЭ) Hg|Hg2Cl2|Cl- - это ртуть,
находящаяся в контакте с пастой из смеси ртути и каломели Hg2Cl2,
которая, в свою очередь, соприкасается с насыщенным раствором KCl.
Принцип действия каломельного
электрода тот же, что и хлорсеребряного.
Электроды второго рода обеспечивают
стабильное поддержание электродных потенциалов за счет постоянно большой и
неизменной концентрации анионов. Поэтому они применяются как электроды
сравнения в потенциометрической ячейке.
Б) Ионоселективные
электроды
Ионоселективным электродом (ИСЭ)
называется индикаторный или измерительный электрод с относительно высокой
специфичностью к отдельному иону или типу ионов.
Мембрана - основной компонент любого
ИСЭ. Она разделяет внутренний раствор с постоянной концентрацией определяемого
иона и исследуемый раствор. Одновременно мембрана служит средством
электролитического контакта между ними. Мембрана обладает ионообменными
свойствами, причем проницаемость ее к ионам разного типа различна. Таким
образом, ИСЭ - это аналитические устройства, позволяющие с помощью
ионочувствительной мембраны узнавать конкретный тип ионов и давать информацию
об их количестве в виде электрического сигнала - потенциала, который связан с
активностью (концентрацией) определяемого иона в анализируемом растворе.
Ионоселективные электроды имеют
следующие достоинства: они не оказывают воздействия на исследуемый раствор;
портативны; пригодны как для прямых определений, так и в качестве индикаторов в
титриметрии.
В зависимости от типа мембраны
ионоселективные электроды можно разделить на следующие группы:
. Твердые электроды -
гомогенные, гетерогенные, на основе ионообменных смол, стекол, осадков, моно- и
поликристаллов;
. Жидкостные электроды на
основе жидких ионитов хелатов - нейтральные переносчики, биологически активных
веществ;
. Газовые и энзимные
электроды.
1) Электроды с твердыми
мембранами
В таких электродах мембрана
изготовлена из малорастворимого кристаллического вещества с ионным типом
электрической проводимости. Конструктивно электрод представляет собой трубку
диаметром около 1 см из инертного полимера (обычно поливинилхлорида), к торцу
которой приклеена тонкая (~0,5 мм) мембрана. В трубку заливают внутренний раствор
сравнения, в который погружают электрод сравнения.
К электродам с твердой мембраной
относятся: лантанфторидный электрод (мембрана на основе монокристалла LаF3),
сульфидсеребряные электроды, галогенсеребряные электроды, электроды на основе
сульфидов (халькогенидов) некоторых двузарядных ионов металлов, стеклянные
электроды.
Наибольшее распространение получил
стеклянный электрод, который я так же использовал в своей практической работе в
качестве электрода - индикатора.
Стеклянный электрод
С помощью данного вида электродов
определяют рН растворов. Их изготавливают из специального электродного стекла,
в состав которого входят оксиды алюминия, натрия, калия, бора и др. Мембрана
таких электродов представляет собой тонкостенный шарик (~0,1 мм) диаметром 5 -
8 мм.
Существуют стеклянные электроды,
которые позволяют определить концентрацию ионов Na+, K+.
В основе теории стеклянного электрода лежит представление о том, что стекло -
это ионообменник, который может вступать в ионообменное взаимодействие с
раствором. Стекло при этом рассматривается как твердый электролит. Стекло,
состоящее из окислов натрия, кальция, кремния, обладает резко выраженным
специфическим сродством к ионам Н+. Вследствие этого при
соприкосновении с водными растворами в поверхностном слое стекол образуется
слой, в котором ионы Na+ оказываются почти полностью замещенными на
ионы Н+. Поэтому мембранный электрод, изготовленный из такого
стекла, обладает Н+-функцией.
Введение в состав стекла окислов
бария, цезия, лантана и замена натрия на литий значительно расширяет диапазон Н+-функции
стеклянного электрода. Введение же окислов алюминия и бора значительно снижают
Н+-функции стеклянного электрода. Таким путем удалось создать
ионоселективные стеклянные электроды для ионов Na+, K+,
Li+, Ag+.
Продолжительность функционирования
стеклянного электрода определяется рядом факторов - состав стекла, толщина
рН-чувствительного поверхностного слоя мембраны, температура и состав раствора,
в котором электрод используется. Разрушение стекла водными растворами происходит
в результате сорбции воды стеклом и глубокое ее проникновение в толщу.
Коррозионному действию щелочных растворов, образующихся при экстракции щелочных
компонентов стекла, подвергается и горловое стекло. Кремнекислородная сетка
испытывает воздействие с обеих сторон мембраны. В конце концов развиваются
трещины, приводящие к нарушению функции электрода. Для защиты электрода от
разрушения необходимо хранить его в воде, так как в воде происходит
выщелачивание связанных ионными силами основных компонентов стекла и замена их
ионами водорода, в результате чего на поверхности стекла образуется слой
гидролизованного кремнезема, предохраняющий стекло от дальнейшего разрушения.
Факторы, влияющие на
работу твердых мембранных электродов
Для достижения теоретических функций
в электродах с твердыми мембранами необходимо, что бы все твердые соединения,
входящие в фазу мембраны, находились в равновесии с анализируемом раствором.
Этого не произойдет, если ионы, присутствующие в анализируемом растворе,
реагируют с отдельными компонентами мембраны. Наиболее типичной реакцией,
характерной для мембран, содержащих галогениды серебра, является образование
менее растворимой серебряной соли. Для электрода с мембраной из смеси сульфидов
серебра и меди обнаружен более сложный характер влияния, связанный с
образованием новой твердой фазы. Если электрод оказался в растворе, ионы
которого приводят к образованию новой твердой фазы, то вернуть электрод в
прежнее состояние можно выдержав его в растворе с высокой концентрацией
соответствующих ионов.
2) Электроды с
жидкостными мембранами
В таких электродах жидкие мембраны,
представляющие собой растворенные в органических растворителях ионообменные
вещества, отделяют от анализируемого раствора гидрофобными мелкопористыми
пленками, пористыми дисками или гидрофобизированными керамическими диафрагмами.
Устойчивость мембраны повышается,
если органическая жидкость обладает высокой вязкостью. Низкая диэлектрическая
проницаемость жидкого органического вещества способствует ассоциации ионов в
фазе мембраны. Высокая селективность к определяемому иону требует большой
стабильности ионного комплекса, на которую влияет растворитель. Для создания
электродов с жидкими мембранами используют многие органические вещества, либо
чистые, либо в соответствующем растворителе. Общее свойство всех этих
соединений - способность селективно связывать некоторые небольшого размера
ионы, образуя нейтральные ионогенные группы с ионами противоположного знака
заряда (в жидком ионообменнике) или заряженные комплексы с нейтральными
группами органической природы. Жидкие мембраны разделяют две водные фазы. На
границе между мембраной и раствором происходит быстрый обмен между свободными
ионами в растворе и ионами, связанными органическими группами в фазе мембраны.
Селективность электрода зависит от избирательности этого ионного процесса.
В электродах с жидкими мембранами к
мембранному веществу предъявляется одно требование, так как если какой-либо ион
способен вообще существовать в фазе мембраны, то он в ней будет двигаться по
закону диффузии, и поэтому проблема обеспечения подвижности интересующего иона
в мембране сама собой разрешается. Селективность жидких мембран будет
определяться ограничением внедрения посторонних ионов в поверхность мембраны.
Так как жидкая фаза находится в контакте с водными растворами, она должна быть
нерастворимой в воде и иметь низкое давление паров, чтобы избежать интенсивного
ее испарения. Эти требованиям могут отвечать жидкие органические вещества,
обладающие сравнительно большим молекулярным весом и низкими диэлектрическими
проницаемостями.
Их основным недостатком является
постепенное вымывание анализируемым раствором ионообменника, что сокращает срок
работы электрода.
Этих трудностей удалось избежать
после разработки электродов с пленочными мембранами. В таких электродах в
тонкую мембрану из гидрофобного полимера (поливинилхлорида) вводят
пластификатор и растворенное в нем электродоактивное вещество, вступающее в
ионообменную реакцию с анализируемым ионом в растворе. В настоящее время
промышленность выпускает пленочные ионоселективные электроды на катионы Na+,
К+, NH4+, Са2+, Mg2+;
электроды для определения общей жесткости воды; на анионы галогенидов, NCS-,
NО3- Существуют электроды и на другие ионы.
3) Газовые электроды
Газовый электрод включает
ионоселективный электрод и сравнительный электрод, контактирующие с небольшим
объемом вспомогательного раствора, который отделен от исследуемого раствора
газовой прослойкой или гидрофобной газопроницаемой мембраной.
Существует два вида газовых
электродов:
) Первый тип - ионоселективный и
сравнительный электрод погружены в небольшой объем раствора определенного
состава, отделенного от исследуемого раствора гидрофобной газопроницаемой
мембраной. Для этого вида электродов используют два вида мембран - гомогенные,
представляющие собой пленку полимера, в которой растворяется диффузионный газ,
и гетерогенные, микропористые, в которых газ диффундирует фактически через
воздух, заполняющий поры. В качестве мембран используют - силиконовый каучук,
тефлон, полипропилен.
) Второй тип - в нем газопроницаемая
мембрана заменена газовой прослойкой. В этом электроде для удержания
электролита на поверхности индикаторного электрода и создания стандартной по
толщине пленки в электролит вводят ПАВ или весь раствор впитывается слоем геля.
В электроде с гидрофобной мембраной
не требуется обновлять слой электролита на мембране индикаторного электрода
после каждого измерения; электрод можно использовать в условиях протока; на
показания электрода практически не влияют механические помехи (например,
сотрясение); полимерная пленка защищает электрод от воздействия воздуха.
В электроде с газовым зазором можно
изменять толщину слоя электролита, изменяя давление головки электрода на
полимерную мембрану; слой электролита на индикаторном электроде очень тонок,
это значительно сокращает время отклика электрода; диффузия газа в воздушной
прослойке происходит гораздо быстрее, чем в мембране из полимера; из-за
отсутствия прямого контакта электрода с образцом значительно возрастает срок
жизни электрода.
Одним из наиболее распространенных
электродов, является электрод с чувствительным элементом на аммиак. Эта
электродная система включает катионоселективный электрод и гидрофобную
мембрану, проницаемую для аммиака, но непроницаемую для таких ионов, как Na+,
K+, NH4+. Мембрана отделяет исследуемый
щелочной раствор от внутреннего раствора 0,1М NH4Cl, в
который погружен стеклянный рН-электрод и хлорсеребряный электрод
сравнения. Диффузия аммиака через мембрану вызывает изменение рН
раствора, находящегося между мембраной и стеклянным электродом, который
регистрирует это изменение рН. Электроды для определения кислорода и углекислого
газа используют преимущественно в медицине.
Электроды сравнения
В качестве электрода сравнения
используют стандартный водородный электрод (СВЭ) - электрод I рода - Pt(H2)/2H+.
Его потенциал определяется величиной pH и при комнатной температуре равен:
0 + 0,059 * lg[H+] = −0,059pH.
Стандартный водородный электрод
(СВЭ) неудобен в работе, его заменяют электродами II рода - насыщенным
каломельным электродом (НКЭ) и хлорсеребряным (ХСЭ), который я и использовал в
своей работе, как электрод сравнения.
2 Диссоциация. Закон
действующих масс. Константа диссоциации
.1 Электролитическая
диссоциация
Электролитическая
диссоциация - это полный или
частичный распад молекул растворенного вещества на катионы и анионы.
Электролитической диссоциацией называют также распад на катионы и анионы ионных
кристаллов при растворении или расплавлении. Электролитическая диссоциация, как
правило, происходит в полярных растворителях. При электролитической диссоциации
разрываются обычно лишь наиболее полярные связи молекул, напр. карбоновые к-ты
RCOOH диссоциируют на RCOO- и Н+.
Электролитической диссоциацией могут подвергаться молекулы некоторых
растворителей, например, воды. Основными причинами электролитической
диссоциации являются, с одной стороны, взаимодействие растворенного вещества с
растворителем, которое приводит к сольватации ионов, а с другой стороны -
значительное ослабление электростатического взаимодействия между
сольватированными ионами в среде, обусловленное ее электростатическим полем
(диэлектрической проницаемостью растворителя). При этом работа, необходимая для
разрушения молекул (кристаллической решетки), обеспечивается за счет энергии
сольватации. Электролитическая диссоциация лежит в основе деления растворов на
два класса - растворы неэлектролитов и растворы электролитов. Наблюдаемое
различие в коллигативных свойствах разбавленных растворов электролитов и
неэлектролитов объясняется тем, что из-за электролитической диссоциации
увеличивается общее число частиц в растворе. Это, в частности, приводит к
увеличению осмотического давления раствора сравнительно с растворами
неэлектролитов, понижению давления пара растворителя над раствором, увеличению
изменения температуры кипения и замерзания раствора относительно чистого
растворителя. Электролитическая диссоциация объясняется также ионная
электропроводность электролитов. Мерой электролитической диссоциации является
степень диссоциации - б отношение количества диссоциированных на ионы молекул
электролита к их исходному количеству в растворе. Согласно этому определению, б
изменяется от 0 (отсутствие диссоциации) до 1 (полная диссоциация) и зависит от
природы растворенного вещества и растворителя, а также от концентрации раствора
и температуры. Как правило, с увеличением диэлектрической проницаемости
растворителя е его б увеличивается, хотя заметная диссоциация наблюдается в
некоторых растворителях с низкой электрической проницаемостью. [2]
.2 Закон действующих
масс. Константа химической реакции
Закон действующих масс устанавливает
соотношение между массами реагирующих веществ в химических реакциях при
равновесии, а также зависимость скорости химической реакции от концентрации
исходных веществ.
Он гласит, что что скорость
элементарной химической реакции пропорциональна произведению концентраций
реагентов в степенях, равных стехиометрическим коэффициентам в уравнении
реакции.
Скорость реакции пропорциональна
произведению концентрации реагирующих веществ, взведенных в степени их
стехиометрических коэффициентов. Запишем уравнение реакции в общем виде:
+nB ó pC+qD
Обозначив концентрации реагирующих
веществ (в молях на литр) соответственно cA, cB, cC, cD и выразив скорости
прямой и обратной химической реакции через V1 и V2, получим:
V1=k1cAm
·cBn
V2=k2cCp
·cDq
Где k1 и k2 - константы скоростей
реакции.
При установлении химического
равновесия (Химическое равновесие - это состояние системы, при которых скорости
прямой и обратной реакций равны) получим:
V1=V21cAm
·cBn = k2cCp ·cDq
Т. к. при постоянной температуре
величины k1 и k2 -постоянные, следовательно, их отношение 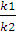 можно заменить постоянной величиной К:
можно заменить постоянной величиной К:
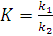 или
или 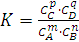
где К - константа химического
равновесия. Она зависит от температуры (так как k1 и k2 зависят от температуры) и природы реагирующих
веществ, но не зависит от их концентрации.
Действительно, если, например,
увеличить сс, то должна уменьшиться cD и увеличиться сА
и св, т.е. это поведет к смещению равновесия влево.
Установится новое равновесие. Новые равновесные концентрации будут иметь другие
числовые значения, однако отношение произведений их, возведенных в
соответствующие степени, будет, величиной постоянной. Так как константа
равновесия равна отношению констант прямой и обратной реакции, то она
показывает, во сколько раз скорость прямой реакции больше скорости обратной
реакции, если концентрации каждого из реагирующих веществ равны 1 моль/л. В
этом физический смысл этой константы К.
Если реакции протекают в растворах,
то при точных расчетах К следует выражать в активностях, а именно:

Применение концентраций допустимо
только лишь в случае реакций в очень разбавленных растворах. Если в реакции
участвуют твердые вещества, к ним понятие концентрации неприменимо. [3, стр.
71-72]
.3 Диссоциация уксусной
кислоты. Константа диссоциации уксусной кислоты
Рассмотрим уксусную кислоту. Это
довольно слабая органическая кислота с формулой CH3COOH, является слабым
электролитом. В воде обратимо диссоциирует на ионы:
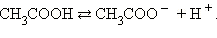
Так как это обратимая химическая
реакция, то соответственно должна быть у нее и константа диссоциации, которую
мне необходимо посчитать.
Обратимся к закону действующих масс,
тогда константа реакции равна:
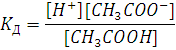
Где [H+], [CH3COO-], [CH3COOH] - равновесные
концентрации для данной температуры.
Преобразуем эту формулу, используя
уравнения:
А) Электронейтральности раствора:
[H+] = [CH3COO-]
Б) Материального баланса:
СН = ССН3СООН =
[H+] +[CH3COO-]
Тогда получим новую формулу для
расчета константы уксусной кислоты:
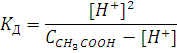
Где есть всего две неизвестных
величины (вместо трех):
) Равновесная концентрация [H+], которая может быть вычислена из рН раствора (по определению
рН):
рН= - lg[H+]
отсюда:
[H+] = 10 -рН
2) Исходная концентрация уксусной
кислоты, которая нам будет дана для каждого раствора.
Итак, вот мы и подошли к
практической части - суть процесса нам известна, прибор и его компоненты
рассмотрены, формулы для расчетов выведены.
3. РН-метр, измерение РН
буферных растворов и постройка калибровочного графика
В своей работе я использовал Рн-метр
«рН-150М» производства РУП «Гомельский завод измерительных приборов» с
электродами:
) Электрод сравнения -
хлорсеребряный,
) Индикаторный электрод -
стеклянный.
Прибор имеет вывод данных на экран,
прибор самостоятельно (!) делает поправку на температуру, показывая данные для
стандартной температуры (25оС). Как уже было сказано ранее,
константа диссоциации не зависит от концентрации вещества, но зависит от
температуры. В день измерений температура в помещении, где были проведены
измерения 7 марта 2014 года на кафедре Электрохимии СПбГТИ(ТУ), составляла
около 19оС выше ноля, т.е. довольно существенно отличавшееся от
стандартного значение, которое могло привести к большой погрешности в расчетах.
В моем распоряжении были 5 буферных
растворов с точно известным рН. Я измерил их на приборе и получил следующие
данные:
|
рН теоретический
|
1,68
|
4,10
|
6,86
|
7,05
|
9,18
|
|
рН измеренный
|
1,73
|
4,09
|
6,73
|
6, 74
|
8,69
|
Теперь можно строить калибровочный
график - график прямой линии, с помощью которого все измеренные значения рН
можно перевести в теоретические, с помощью которых и будут производится расчеты
константы. График будем строить в программе Exel методом наименьших
квадратов. На горизонтальной оси будем откладывать рН измеренный, а
на вертикальной - рН теоретический
Теперь можно перевести значения
измеренного рН в теоретические значения. В моем распоряжении были 5 растворов уксусной
кислоты различной концентрации. Я провел измерения уровня рН с помощью рН-метра
и перевел значения в теоретические. Результаты отражены в таблице:
|
С уксусной
кислоты, моль/литр
|
рН измеренный
|
рН теоретический
|
3,44
|
3,45
|
|
0,031
|
3,15
|
3,16
|
|
0,0625
|
2,97
|
2,98
|
|
0,184
|
2,75
|
2,76
|
|
0,5
|
2,53
|
2,54
|
Теперь можно построить график
зависимости рН от концентрации кислоты (на вертикальной оси - значение рН, на
горизонтальной - концентрация кислоты):
Приходим к выводу, что это -
убывающая логарифмическая функция, что соответствует истине, ведь:
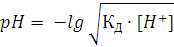
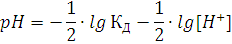
Теперь можно приступать к
непосредственным расчетам константы:
1) 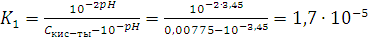
2) 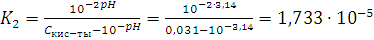
3) 
4) 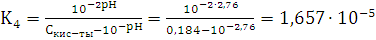
5) 
6) 
Сравним вычисленную константу с
константой, данную в справочнике:
Ka = 1,74 · 10-5
Сравнивая эти значения, находим, что
порядок этих величин одинаков и первые две значащие цифры совпали, т.е. с
погрешностью эти величины равны. Это говорит о том, что расчеты верны.
Заключение
В курсовой работе я достиг
поставленных целей и задач. Мой вывод таков, что потенциометрия играет огромную
роль в электрохимических методах анализа. Она позволяет не только узнать рН
раствора, но и вычислить важнейшие константы и параметры химических систем. Так
же она способна частично дать ответы о качественном составе растворов, а также
их количественную характеристику. Так же огромным плюсом является высокая
скорость проводимых измерений.
Константа диссоциации уксусной
кислоты вычислена и с погрешностью она совпала со справочным значением.
График зависимости рН от
концентрации кислоты построен, он соответствует убывающей логарифмической
функции.
В целом, работать над курсовой мне
понравилось. Я узнал много нового, что несомненно пригодится в моей будущей
специальности. И лично мне кажется, что курсовая работа выполнена успешно.
Список литературы
1) Лопатин Б.А. Теоретические
основы электрохимических методов анализа - М.: Высшая школа, 1975.
2)
http://www.xumuk.ru/encyklopedia/2/5305.html
3) Хомченко Г.П.,
Севастьянова К.И. Окислительно-восстановительные реакции. 3-е-издание,
переработанное. - М.: Издательство «Просвещение», 1989.
4) Лебедева М.И.
Аналитическая химия и физико-химические методы анализа - Тамбов: Изд-во Тамб.
гос. техн. ун-та, 2005.
) Агасян П.К., Николаева
Е.Р., Основы электрохимических методов анализа (потенциометрический метод), М.,
1986.